Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 161-165
Распределение D2-подобных дофаминовых рецепторов в головном мозге у крыс с разными формами генетической эпилепсии
Е. Т. Цыба 1, *, Л. М. Бирюкова 2, И. С. Мидзяновская 2, Н. М. Сурина 1, К. Р. Аббасова 1
1 Московский государственный университет
имени М.В. Ломоносова, биологический факультет
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки институт высшей нервной деятельности
и нейрофизиологии Российской академии наук
Москва, Россия
* E-mail: evgeniya.tsyba@mail.ru
Поступила в редакцию 25.11.2022
После доработки 14.12.2022
Принята к публикации 17.12.2022
- EDN: NBICLX
- DOI: 10.31857/S2686738922700147
Аннотация
Исследовали распределение D2-подобных дофаминовых рецепторов (D2DR) методом авторадиографии в стриатуме и коре у крыс с абсансной, аудиогенной и смешанной формами генетической эпилепсии, по сравнению с нормальными крысами Wistar. Плотность связывания лиганда с D2DR была значимо ниже в дорсальной и вентролатеральной частях прилежащего ядра у крыс с эпилепсией. У крыс с аудиогенной эпилепсией плотность рецепторов была значимо выше в дорсальной части стриатума, в моторной и соматосенсорной коре и ниже в вентролатеральной части прилежащего ядра. Полученные данные предполагают общее звено нейрональных цепей, вовлеченных в патогенез генерализованной эпилепсии как конвульсивных, так и неконвульсивных форм.
Абсансная эпилепсия – генерализованная неконвульсивная форма эпилепсии, развитие которой определяется дисфункцией таламокортикальных сетей. Инбредная линия крыс WAG/Rij c генетической предрасположенностью к абсансной эпилепсии является валидной ее моделью [1]. Другая инбредная линия крыс Крушинского-Молодкиной (КМ) с аудиогенной эпилепсией в ответ на звуковую стимуляцию демонстрируют генерализованные моторные судороги максимальной интенсивности [2]. Часть популяции крыс линии WAG/Rij демонстрируют аудиогенные судороги (WAG/Rij-AGS). Эта субпопуляция является моделью смешанных, конвульсивно-неконвульсивных форм эпилепсии. Известна функциональная недостаточность дофаминергической системы при абсансной эпилепсии [3]. У крыс с генетической аудиогенной эпилепсией также снижена активность дофаминергической системы. Ранее методом авторадиографии сравнили распределение дофаминовых рецепторов в головном мозге крыс линий WAG/Rij и ACI (крысы резистентные к эпилептическим расстройствам). У крыс линии WAG/Rij плотность D2DR была выше в париетальной и фронтальной коре, и ниже в дорсальном стриатуме и гиппокампе [4]. Данные о распределении дофаминовых рецепторов у крыс с конвульсивной или смешанной формой эпилепсии отсутствуют. Целью исследования стало сравнение плотности распределения D2DR у крыс Wistar и трех линий крыс с генетической эпилепсией.
МАТЕРИАЛЫ И МЕТОДЫ
Использовали самцов крыс Wistar (WS, n = 5), WAG/Rij (WR, n = 5), WAG/Rij-AGS (WRA, n = 5), KM (n = 5). На криотоме при температуре –18°С делали коронарные срезы мозга (18 мкм, на четырех анатомических уровнях: +2.52; +1.92; –0.24; –3.24 от брегмы). Срезы инкубировали в 1 мл 50 mM Трис-буфера (pH = 7.5) с 0.4 nM [3H]спипероном (час при 24°С). Для связывания использовали галоперидол 10–5 M и кетансерин. После инкубации срезы дважды погружали в трис-буфер при 4°С и в дистиллированную воду на 2 сек, высушивали в потоке холодного воздуха. Стандарты для авторадиографии Amersham3H Microscale Autoradiography Standards® помещали рядом со срезами на тритий-чувствительную пленку, экспонировали 8 нед. Оцифрованные изображения срезов обрабатывали в программе ImageJ. Для идентификации структур использовали атлас [5]. Все зоны коры для анализа объединялись в соответствующие области: моторную, соматосенсорную и цингулярную, без разделения на первичную и вторичную кору. В группу по фактору “эпилепсия” включены: крысы линии КМ с аудиогенной эпилепсией, крысы линии WAG/Rij с абсансной эпилепсией и крысы линии WAG/Rij-AGS со смешанной формой эпилепсии: абсансной и аудиогенной.
Статистическую обработку проводили в программе TIBCO Software Inc. Statistica, 14.0.0.15. Плотность связывания с D2DR анализировали методом ANOVA GLM, аналогично опубликованным ранее результатам на этой же когорте животных [6]. Измерения проводили два раза и усредняли. Пропущенные значения заменяли на контралатеральные. Для пост-хок анализа использовали тест Фишера. Значения представлены в формате Среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Специфическое связывание с D2-подобными дофаминовыми рецепторами
1.1. Общее распределение D2DR. Наибольшая плотность связывания с D2DR обнаружена в дорсальном стриатуме, ядре и оболочке прилежащего ядра. Также D2DR локализуются в коре, клауструме, эндопириформном ядре, что согласуется с литературными данными [4].
1.2. Фактор “эпилепсия”. Специфическое связывание селективного лиганда с D2DR у линий крыс с генетической эпилепсией (КM, WR, WRA, n = 15) значимо ниже по сравнению с крысами Wistar (n = 5) в дорсальной части оболочки (dShell) на первом анатомическом уровне (–21.3%; p = = 0.045) и в вентролатеральной части оболочки прилежащего ядра (vlShell) на втором анатомическом уровне (–35.9%; p = 0.01). Наблюдается тенденция в дорсальной части стриатума (Cpu) на втором (+19%; p = 0.083) и третьем (+21.9%; p = = 0.93) анатомических уровнях, в медиальной части оболочки прилежащего ядра (mShell; –29%; p = 0.058) (рис. 1а, 2). рис. 2
Рис. 1.
Специфическое связывание [3H]spiperone с D2DR в стриатуме (а) и коре (б), pmol/g tissue. Cpu – caudate putamen, Core –сердцевина прилежащего ядра, Shell – оболочка прилежащего ядра: d – дорсальная, dl – дорсолатеральная, m – медиальная, vl – вентролатеральная; M – моторная кора; S – соматосенсорная кора. *p < 0.05, **p ≤ 0.01. Epi – фактор “эпилепсия”. AGS – фактор аудиогенной эпилепсии. AbS – фактор абсансной эпилепсии.
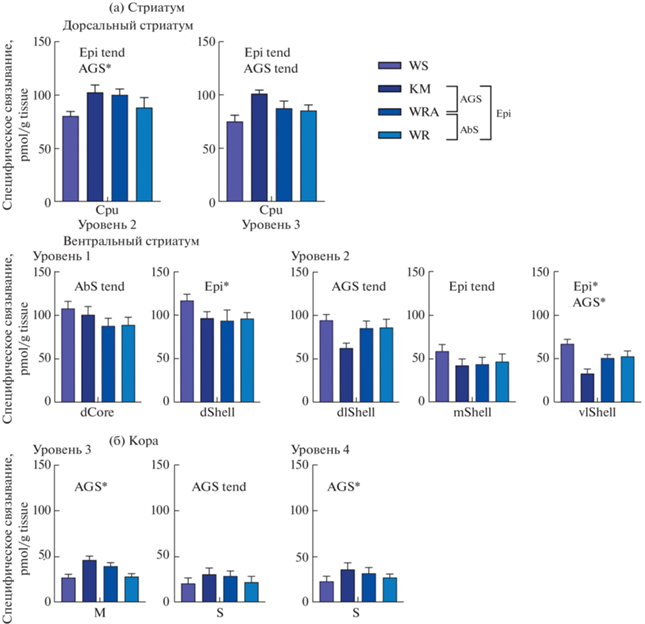
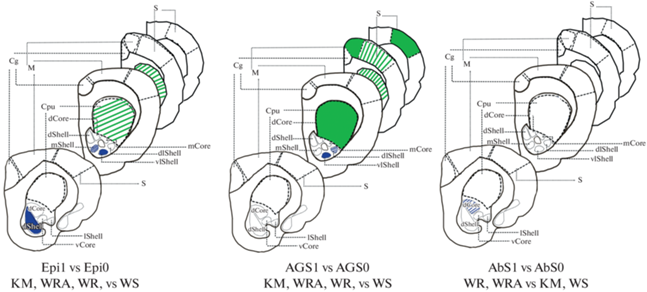
Рис. 2.
Схематичное изображение исследуемых структур мозга. Цветом обозначены регионы со статистически достоверными отличиями (p < 0.05) в сторону снижения (синий) и в сторону повышения (зеленый), штрихом обозначены тенденции (p < 0.1) по факторам “эпилепсия” (Epi), “аудиогенность” (AGS), “абсансность” (AbS), 1 и 0 обозначают наличие или отсутствие фактора соответственно. Cpu – каудатус, Core – сердцевина прилежащего ядра, Shell – оболочка прилежащего ядра, d – дорсальная, l – латеральная, dl – дорсолатеральная, m – медиальная, v – вентральная, vl – вентролатеральная; Cg – цингулярная кора, M – моторная кора; S – соматосенсорная кора.
1.3. Фактор “аудиогенность”. Специфическое связывание селективного лиганда [3Н]спиперона с D2DR на срезах мозга между крысами с признаками аудиогенной эпилепсии (KM + WRA, n = 10) и без (WR + WS, n = 10) было значимо выше у аудиогенных крыс в Cpu на втором уровне (+19.2%; p = 0.039), в области моторной коры на третьем анатомическом уровне (+50.8%; p = = 0.0087), на четвертом уровне SmI (+39.5%; p = = 0.01) и ниже в vlShell (–28.5%; p = 0.01). На третьем анатомическом уровне обнаружили тенденции в Cpu (+17.5%; p = 0.086) и SmI (+39.5%; p = = 0.06); на втором уровне – в дорсолатеральной части прилежащего ядра (–25.4%; p = 0.067). (рис. 1б, 2).
1.4. Фактор “абсансность”. У группы крыс с абсансной эпилепсией (WR, WRA, n = 10) специфическое связывание с D2DR было ниже на уровне тенденции в дорсальной части сердцевины прилежащего ядра (–21.4%; p = 0.066), по сравнению с крысами без абсансных проявлений (KM, WS, n = 10) (рис. 1а, 2).
Общее распределение D2DR. Экспериментальные исследования показывают, что фармакологическое воздействие на крыс с дисбалансом мезокортикальной и мезолимбической дофаминергических систем увеличивает число и продолжительность ПВР. Ранее сравнивали плотность связывания лиганда с D2DR между крысами WAG/Rij и ACI. Сравнение плотности связывания дофаминовых рецепторов между нормотипичными животными (крысами Wistar) и животными с набором кардинально различающихся эпилептических патологий проводится впервые. Наибольшая плотность связывания у всех линий крыс наблюдается в дорсальной и вентральной частях стриатума, в гиппокампе и коре, что согласуется с данными предыдущих исследований [4]. Проводили анализ трех факторов, с которыми могут быть связаны особенности распределения D2DR у линий крыс с генетически обусловленной генерализованной эпилепсией: неспецифический фактор “эпилепсия”, специфический “абсансность” для неконвульсивной формы эпилепсии, и фактор “аудиогенность” для конвульсивной формы эпилепсии.
Эффект фактора “эпилепсия”. У крыс с генетически обусловленной эпилепсией в дорсальной и вентролатеральной частях оболочки прилежащего ядра плотность D2DR ниже по сравнению с не эпилептическими. В ряде исследованиях показана модулирующая роль прилежащего ядра [7, 8], и, в частности, проекций дофаминергических нейронов в мезолимбической системе при эпилепсии [7]. Выявлено модулирующее влияние на эпилептогенез нейронов как сердцевины, так и оболочки прилежащего ядра, причем оболочка имела более тесную связь с лимбической системой [9]. При эпилепсии изменения в прилежащем ядре могут быть связаны с дегенерацией нейронов, которая в основном происходит в оболочке прилежащего ядра [10].
Эффект фактора “аудиогенность”. Согласно полученным данным, плотность D2DR у аудиогенных крыс значимо выше по сравнению с не аудиогенными в хвостатом ядре и области моторной коры. Ранее на пилокарпиновой модели височной эпилепсии продемонстрировали противосудорожное действие агониста D2DR в хвостатом ядре [11]. Результаты могут свидетельствовать о компенсаторной роли дофаминергической системы моторной коры при аудиогенных судорогах. Вероятно, выраженное моторное возбуждение, сопровождающее первую фазу аудиогенных припадков (бег с потерей зрительного контроля), приводит к последующему повышению плотности связывания с D2DR моторной коры, как этап активации противосудорожных систем мозга. Известно, что основную роль в патогенезе аудиогенной эпилепсии играют ствол мозга и двухолмие [12]. К сожалению, на срезах, включенных в исследование, не было найдено необходимых анатомических уровней, затрагивающих интересующие области этих структур. На уровне –5.52 от брегмы было обнаружено самое начало поверхностного серого слоя верхнего двухолмия (SuG). Однако даже на этом небольшом участке структуры можно увидеть тенденцию (–28.3%; p = 0.073).
Эффект фактора “абсансность”. Низкая плотность распределения D2DR у абсансных крыс по сравнению с не-абсансными подтверждает мнение о дисфункции не только таламокортикальной сети, но и дофаминергической дисфункции мезолимбического пути. Ранее предположили, что сердцевина прилежащего ядра оказывает модулирующее влияние на кортикоталамическую сеть, поскольку введение фармакологических агентов в эту область влияет на количество и продолжительность ПВР [7]. Также у крыс с генетически обусловленной абсансной эпилепсией обнаружен повышенный уровень экспрессии мРНК D3 рецепторов в сердцевине прилежащего ядра [13]. Снижение плотности D2DR в этой области может указывать на недостаточность мезолимбической дофаминергической системы мозга у крыс с абсансами. Подобные изменения могут лежать в основе патогенеза расстройств мотивации и поведения, характерных для некоторых видов эпилепсий.
ЗАКЛЮЧЕНИЕ
Показано распределение плотности D2DR в дорсальном и вентральном стриатуме, цингулярной, моторной и соматосенсорной коре. В сердцевине и оболочке прилежащего ядра по факторам “эпилепсия” и “абсансность” показана более низкая плотность рецепторов относительно группы сравнения. В моторной и соматосенсорной коре по фактору “аудиогенность” выявлена более высокая плотность рецепторов. Полученные данные о неспецифическом понижении D2DR в вентролатеральной и дорсальной оболочке прилежащего ядра предполагают общее звено нейрональных цепей, вовлеченных в патогенез генерализованной эпилепсии как конвульсивных, так и неконвульсивных форм.
Список литературы
Russo E., Citraro R., Constanti A., et al. Upholding WAG/Rij rats as a model of absence epileptogenesis: Hidden mechanisms and a new theory on seizure development // Neuroscience & Biobehavioral Reviews. 2016. V. 71. P. 388–408.
Poletaeva I., Surina N., Kostina Z., et al. The Krushinsky-Molodkina rat strain: The study of audiogenic epilepsy for 65years // Epilepsy Behav. 2017. V. 71. Pt. B. P. 130–141.
Kuznetsova G., Petrova E., Coenen A., et al. Generalized absence epilepsy and catalepsy in rats // Physiol. Behav. 1996. V. 60. P. 1165–1169.
Birioukova L., Midzyanovskaya I., Lensu S., et al. Distribution of D1-like and D2-like dopamine receptors in the brain of genetic epileptic WAG/Rij rats // Epilepsy Res. 2005. V. 63. № 2–3. P. 89–96.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates // Academic Press, Sixth Edition, 2007.
Midzyanovskaya et al. The prefrontal cortex shows widespread decrease in H3 histamine receptor binding densities in rats with genetic generalized epilepsies // Epilepsy Res. 2022. V. 182. 106921.
Deransart C., Riban V., Lê B., et al. Dopamine in the striatum modulates seizures in a genetic model of absence epilepsy in the rat // Neuroscience. 2000. V. 100. № 2. P. 335–44.
Fu J., Liu Y., Yang K., Long H., Wang K., Qi S. Effect of accumbens nucleus shell lesioning on bitemporal lobe epilepsy in rat model // Folia Neuropathologica. 2018. V. 56. № 4. P. 346–353.
Wang J., Zhang Y., Zhang H., et al. Nucleus accumbens shell: A potential target for drug-resistant epilepsy with neuropsychiatric disorders // Epilepsy Res. 2020. V. 164. 106365.
Zhao X., Yang R., Wang K., et al. Connectivity-based parcellation of the nucleus accumbens into core and shell portions for stereotactic target localization and alterations in each NAc subdivision in mTLE patients // Hum. Brain Mapp. 2018. V. 39. P. 1232–1245.
al-Tajir G., Starr M.S. Anticonvulsant effect of striatal dopamine D2 receptor stimulation: dependence on cortical circuits? // Neuroscience. 1991. V. 43. № 1. P. 51–7.
Fedotova I., Surina N., Nikolaev G., et al. Rodent Brain Pathology, Audiogenic Epilepsy // Biomedicines. 2021. V. 9. № 11. P. 1641.
Deransart C., et al. Up-regulation of D3 dopaminergic receptor mRNA in the core of the nucleus accumbens accompanies the development of seizures in a genetic model of absence-epilepsy in the rat // Molecular Brain Research. 2001. V. 94. P. 166–177.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


