Экология, 2019, № 1, стр. 47-54
Факторы динамики сообществ планктонных ракообразных в эвтрофных условиях
И. Ю. Фенева a, *, В. И. Разлуцкий b, М. И. Гладышев c, d, И. Костшевска-Шлаковска e, Н. Н. Майсак b, М. Жапецкий f, Н. Н. Сущик c, d, Н. С. Зилитинкевич g
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071, Москва, Ленинский просп., 33, Россия,
b ГНПО НПЦ НАН Беларуси по биоресурсам
220072 Минск, ул. Академическая, 27, Белорусь
c Федеральный исследовательский центр Красноярский научный центр СО РАН
660036 Красноярск, Академгородок, 50, Россия
d Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
e Варшавский университет
02-096 Варшава, ул. Мечникова, 1, Польша
f Институт экспериментальной биологии им. М. Ненцкего
02-093 Варшава, ул. Луи Пастера, 3, Польша
g Институт физики атмосферы им. А.М. Обухова РАН
119017 Москва, Пыжевский пер., 3, Россия
* E-mail: feniova@mail.ru
Поступила в редакцию 05.05.2018
После доработки 07.06.2018
Принята к публикации 30.05.2018
Аннотация
Показано, что основным драйвером динамики обилия ветвистоусых и веслоногих ракообразных в эвтрофных условиях являются хищничество (рыбы), количество или качество пищи, выражаемое в содержании эйкозапентаеновой кислоты, фосфора и азота в сестоне. В результате исследований по динамике обилия веслоногих и ветвистоусых ракообразных в присутствии и отсутствии рыбы в экспериментальных мезокосмах с эвтрофными условиями установлено, что рыбы в эвтрофных условиях не влияют на количество и качество пищевых ресурсов для ракообразных. Однако во второй половине наших экспериментов наблюдался переход доминирования от веслоногих к ветвистоусым ракообразным. Это было связано не с влиянием рыбы, а с улучшением качества пищи для ветвистоусых ракообразных, определяемое соотношением углерода к фосфору в сестоне. Рыбы в эвтрофных условиях понижали биомассу как ветвистоусых, так и веслоногих ракообразных, не меняя соотношение между ними.
Зоопланктон занимает промежуточное положение в трофической цепи пресноводных сообществ. Через это звено происходит передача вещества и энергии от первичных продуцентов к рыбам. Ракообразные – доминирующая группа в составе зоопланктона. Они являются основным пищевым ресурсом для планктоноядных рыб. Согласно теории каскадных эффектов [1–3], хищничество со стороны рыб может приводить к сокращению обилия зоопланктона, повышению доли мелких видов, уменьшению индивидуальных размеров особей в популяциях и как результат этого к снижению давления зоопланктона на фитопланктон. Поэтому хищничество со стороны рыб может привести через каскадные эффекты к повышению обилия фитопланктона. Согласно теории каскадных эффектов, процессы, происходящие на одном трофическом уровне, обязательно отразятся на других трофических уровнях. Однако механизмы всего разнообразия функционирования пищевых цепей изучены недостаточно. Проявление каскадных эффектов с появлением хищника может зависеть от обилия и видовой структуры как планктонных ракообразных, так и фитопланктона.
Планктонные ракообразные пресноводных экосистем представлены ветвистоусыми и веслоногими ракообразными. Планктоноядные рыбы потребляют их с разной интенсивностью. В экспериментальной работе по оценке способности ракообразных избегать рыб [4] было показано, что веслоногие ракообразные способны уйти от нападения хищника примерно в 90% случаев, дафнии – в 15%, мелкая босмина – в 2%. Это связано с более высокой двигательной активностью веслоногих ракообразных, которая позволяет им лучше избегать атаки хищника [5–7]. В природных условиях более предпочтительное потребление рыбами ветвистоусых ракообразных, чем веслоногих, несмотря на более высокую плотность последних, было продемонстрировано в работе [8]. Поэтому можно предположить, что планктоноядные рыбы будут способствовать увеличению доли веслоногих ракообразных в зоопланктонных сообществах.
Кроме того, на относительную долю веслоногих и ветвистоусых ракообразных в зоопланктоне может влиять соотношение N : P (азот : фосфор) в составе пищевых ресурсов. Показано [9], что соотношение N : P в тканях веслоногих ракообразных равно примерно 30–50, а у ветвистоусых ракообразных – около 14 [10]. Поэтому веслоногие более чувствительны к недостатоку азота, а ветвистоусые ракообразные – к недостатку фосфора в пищевых ресурсах. Ветвистоусые и веслоногие ракообразные по-разному реагируют и на содержание полиненасыщенных жирных кислот в пищевых ресурсах: первые более чувствительны к дефициту эйкозапентаеновой кислоты (ЭПК), чем вторые [11]. В связи с этим качество пищи, выражаемое в соотношении азота и фосфора, а также в содержании полиненасыщенных жирных кислот, в частности ЭПК, может быть еще одним драйвером, определяющим обилие ветвистоусых и веслоногих ракообразных.
Рыбы могут влиять на ракообразных не только в результате хищничества, но и меняя качество пищевых ресурсов для ракообразных. Установлено [12], что прохождение водорослей через кишечник серебряного карася Carassius auratus gibelio Bloch. может стимулировать или ингибировать их развитие. Влиять на состав фитопланктона рыбы могут и в результате изменения ими циркуляции железа: их мукус способен образовывать комплексы с железом, которые усваиваются только цианобактериями [13]. Питаясь в литорали бентосными организмами и потребляя отложенные на дне формы железа, которые выводятся из кишечника уже в зоне эпилимниона, рыбы возвращают железо в пелагиаль, где летом часто возникает его дефицит для фитопланктона [14, 15]. В результате наиболее чувствительные к недостатку железа водоросли получают возможность интенсифицировать свой рост. Таким образом, меняя состав пищевых ресурсов, рыбы могут оказывать на ракообразных влияние “снизу” (“bottom-up effect”).
Нами были проведены исследования по динамике веслоногих и ветвистоусых ракообразных в присутствии и отсутствии рыб в экспериментальных мезокосмах с эвтрофными условиями (июнь–август 2014 г.). Мы предполагали, что в эвтрофных условиях обилие пищи не будет лимитировать развитие веслоногих и ветвистоусых ракообразных в экспериментах. Основными факторами регуляции развития ракообразных в таких условиях могут быть хищничество и качество пищи: хищничество со стороны рыб может привести к преобладанию веслоногих ракообразных в присутствии рыбы, повышенное содержание азота в пищевых ресурсах – к доминированию веслоногих ракообразных, а фосфора – к доминированию ветвистоусых ракообразных. Дефицит ЭПК, если таковой имеет место, также может сдвигать видовую структуру в пользу веслоногих ракообразных.
Основная цель настоящей работы – показать, что является основным драйвером динамики обилия ветвистоусых и веслоногих ракообразных в эвтрофных условиях: хищничество (рыбы), количество или качество пищи, выражаемое в содержании эйкозапентаеновой кислоты, фосфора и азота в сестоне.
МАТЕРИАЛ И МЕТОДЫ
Опыты проводили в 300-литровых пластиковых аквариумах (0.94 × 0.64 × 0.50 м), которые заполняли водой с содержащимся в ней естественным фито- и зоопланктоном из эвтрофного оз. Миколайское (северо-восточная Польша, Мазурские озера). Площадь озера 4.98 км2, максимальная и средняя глубины равны соответственно 26 и 11 м. Продолжительность опытов составляла 54 сут. Опыты состояли из двух вариантов (с рыбами и без рыб), каждый в трех повторностях. В контроле аквариумы наполняли водой с содержащимися в ней фито- и зоопланктоном. В варианте с рыбами в каждый мезокосм добавляли по одной особи молоди ерша Gymnocephalus cernuus (Linnaeus) размером 7.5−11 см. Рыб содержали в контейнерах объемом 5 л, подвешенных в аквариумах. В контейнерах имелись крупные поперечные отверстия, через которые планктонные организмы свободно проходили, однако рыбы не могли из них выйти. Мезокосмы находились в открытом состоянии, но в случае дождя их закрывали полиэтиленовой многослойной пленкой во избежание загрязнения извне.
Пробы ветвистоусых и веслоногих ракообразных брали батометром объемом 2.6 л с 10-суточным интервалом и фиксировали 4%-ным формалином. В конце эксперимента объем проб составлял 60 л из каждого аквариума для повышения точности оценки обилия ракообразных. Среди ветвистоусых ракообразных доминировали мелкие виды Chydorus sphaericus (O.F. Müller, 1776), Bosmina longirostris (O.F. Müller, 1776) и Ceriodaphnia pulchella Sars, 1862 со средним размером карапакса половозрелых особей 0.307 ± 0.026, 0.322 ± ± 0.022 и 0.517 ± 0.048 мм соответственно. Доминирующими видами веслоногих ракообразных были Eudiaptomus graciloides (Lilljeborg, 1888), Mesocyclops leuckarti (Claus, 1857), Thermocyclops oithonoides (Sars G.O., 1863), Macrocyclops albidus (Jurine, 1820) со средним размером половозрелых особей от края головы до фуркальнях щетинок 1.233±0.072, 1.069 ± 0.059, 0.75 ± 0.012 и 1.671 ± ± 0.213 мм соответственно. Таким образом, размеры веслоногих были больше, чем ветвистоусых ракообразных. При расчете биомассы ракообразных использовали линейные зависимости веса тела ракообразных от их размеров [16].
Количество фитопланктона оценивали по концентрации хлорофилла с использованием флуориметра PHYTOPAM (WALZ, Германия), который раздельно определяет концентрацию хлорофилла зеленых, цианобактерий и диатомовых водорослей. Концентрации N-NO3, N-NO2, N-NH4 и P-PO4 измеряли стандартными методами [17] в 1, 4, 24 и 54-й дни. Интервалы определения концентрации биогенных веществ выбирали исходя из того, что наиболее резко их концентрации меняются в начале эксперимента. Один раз в течение 3−4 сут измеряли температуру воды и содержание кислорода многофункциональным датчиком 3410 с оптическим сенсором FDO925. Концентрация растворенного кислорода в воде варьировала от 8 до 10 мг/л, т.е. его дефицита для ракообразных не наблюдалось. Электропроводность воды, которая изменялась в пределах 271–354 мкСм/cм, измеряли датчиком Vario Cond TETRA Con V.
Пробы на содержание ЭПК, углерода, фосфора и азота в сестоне брали в начале и конце эксперимента, так как для такого анализа требуются большие объемы воды (до 50 л из каждого мезокосма), и взятие таких проб во время эксперимента могло бы нарушить ход динамики планктонных сообществ. Воду из мезокосмов предварительно пропускали через газ 110 мкм для удаления крупных организмов зоопланктона и других частиц, а затем фильтровали через стекловолоконные фильтры GF/F (Whatman) до интенсивного окрашивания фильтра. После подсушивания фильтры на ЭПК помещали в раствор хлороформа с метанолом (2 : 1) и затем хранили при температуре –20°С. Содержание углерода, азота и фосфора определяли на элементном анализаторе Flash EA 1112 [18], содержание фосфора в сестоне –фотоколориметрическим методом [19].
Для обработки данных использованы методы двухфакторного дисперсионного анализа с повторными измерениями (RM-ANOVA). Факторами были присутствие/отсутствие рыб и дата отбора проб. Также оценивалось влияние взаимодействия этих двух факторов. Зависимыми переменными были концентрация неорганического фосфора (P-PO4) и неорганического азота, определяемого по сумме N-NO3, N-NO2, N-NH4, концентрация хлорофилла цианобактерий и общего хлорофилла, биомасса ветвистоусых и веслоногих ракообразных и отношение биомассы ветвистоусых к биомассе веслоногих ракообразных.
Для оценки гомогенности дисперсий использовали тест Левене. При проведении статистического анализа не учитывали значения в первый день эксперимента, так как они соответствовали значениям исследуемых параметров в озере и не отражали результат влияния экспериментальных факторов на исследуемые параметры. Для оценки связи биомассы ракообразных с концентрацией общего хлорофилла использовали коэффициент корреляции Пирсона. Статистический анализ экспериментальных данных выполнен с использованием статистического пакета Sigma Stat v. 3.5.
Для сравнения таких индикаторов качества сестона, как C:N:P и ЭПК, использовали однофакторный дисперсионный анализ (ANOVA). При отсутствии нормального распределения данных (тест Колмогорова-Смирнова) для сравнения данных использовали непараметрический тест Крускала-Уоллиса. Количество вариантов составляло 12 (3 повторности × 4 съемки). Сравнение проводили по всему набору данных (n = 246).
РЕЗУЛЬТАТЫ
Уже на 4-й день опытов концентрации фосфора и азота в воде повысились. В дальнейшем, как показал статистический анализ (табл. 1), концентрации биогенных веществ значимо не изменялись во времени. Концентрация неорганического фосфора в виде P-PO4 значимо не различалась между контролем и вариантом с рыбой, тогда как концентрация неорганического азота в присутствии рыб была значимо больше (табл. 1 и 2, рис. 1).
Таблица 1.
Влияние рыб и времени на концентрации биогенных веществ, хлорофилла и биомассу ракообразных по результатам двухфакторного дисперсионного анализа с повторными измерениями
| Факторы | SS | Df | MS | F | P |
|---|---|---|---|---|---|
| Концентрация неорганического азота, мг/л | |||||
| Рыба | 0.137 | 1 | 0.137 | 8.73 | 0.012 |
| Дата | 0.064 | 2 | 0.032 | 2.04 | 0.172 |
| Дата × Рыба | 0.013 | 2 | 0.007 | 0.42 | 0.666 |
| Концентрация неорганического фосфора, мг/л | |||||
| Рыба | 0.0010 | 1 | 0.0010 | 3.95 | 0.070 |
| Дата | 0.0010 | 2 | 0.0005 | 2.18 | 0.156 |
| Дата × Рыба | 0.0009 | 2 | 0.0005 | 1.96 | 0.183 |
| Концентрация хлорофилла, µг/л | |||||
| Цианобактерии | |||||
| Рыба | 894.44 | 1 | 894.44 | 6.45 | 0.018 |
| Дата | 4262.35 | 5 | 852.47 | 6.15 | 0.001 |
| Дата × Рыба | 778.89 | 5 | 155.78 | 1.12 | 0.375 |
| Общий хлорофилл | |||||
| Рыба | 111.83 | 1 | 111.83 | 0.7794 | 0.386 |
| Дата | 8138.45 | 5 | 1627.69 | 11.3443 | ⪡0.001 |
| Дата × Рыба | 426.74 | 5 | 85.35 | 0.5948 | 0.704 |
| Биомасса ракообразных, мг/л | |||||
| Ветвистоусые | |||||
| Рыба | 1.63 | 1 | 1.63 | 27.80 | ⪡0.001 |
| Дата | 1.64 | 5 | 0.33 | 5.60 | 0.001 |
| Дата × Рыба | 0.14 | 5 | 0.03 | 0.48 | 0.785 |
| Веслоногие | |||||
| Рыба | 1.52 | 1 | 1.52 | 13.26 | 0.001 |
| Дата | 3.59 | 5 | 0.72 | 6.28 | 0.001 |
| Дата × Рыба | 0.61 | 5 | 0.12 | 1.06 | 0.406 |
| Соотношение ветвистоусые/веслоногие | |||||
| Рыба | 0.87 | 1 | 0.87 | 1.25 | 0.275 |
| Дата | 33.95 | 5 | 6.79 | 9.73 | ⪡0.001 |
| Дата × Рыба | 2.90 | 5 | 0.58 | 0.83 | 0.540 |
Таблица 2.
Средние величины концентраций биогенных веществ, общего хлорофилла и цианобактерий, а также биомассы ветвистоусых и веслоногих ракообразных в контроле (над чертой) и варианте с рыбами (под чертой) за весь период эксперимента
| Параметры | Средняя | Ошибка | N (кол-во повторностей) |
|---|---|---|---|
| Фосфор, мг/л | $\frac{{0.02}}{{0.03}}$ | $\frac{{0.001}}{{0.008}}$ | $\frac{9}{9}$ |
| Азот, мг/л | $\frac{{0.09}}{{{\mathbf{0}}.{\mathbf{14}}}}$ | $\frac{{0.008}}{{0.011}}$ | $\frac{9}{9}$ |
| Общий хлорофилл, µг/л | $\frac{{52.06}}{{48.53}}$ | $\frac{{2.827}}{{2.820}}$ | $\frac{{18}}{{18}}$ |
| Цианобактерии, µг/л | $\frac{{23.34}}{{{\mathbf{13}}.{\mathbf{38}}}}$ | $\frac{{3.94}}{{1.48}}$ | $\frac{{18}}{{18}}$ |
| Ветвистоусые, мг/л | $\frac{{0.67}}{{{\mathbf{0}}.{\mathbf{44}}}}$ | $\frac{{0.169}}{{0.082}}$ | $\frac{{18}}{{18}}$ |
| Веслоногие, мг/л | $\frac{{0.88}}{{{\mathbf{0}}.{\mathbf{45}}}}$ | $\frac{{0.090}}{{0.056}}$ | $\frac{{18}}{{18}}$ |
Примечание. Средние параметры, которые статистически различаются между контролем и вариантом с рыбами, обозначены жирным шрифтом. Достоверность различий приведена в табл. 1.
Рис. 1.
Динамика концентрации неорганического фосфора и азота в контроле (а) и в присутствии рыб (б).
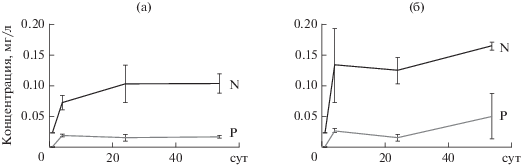
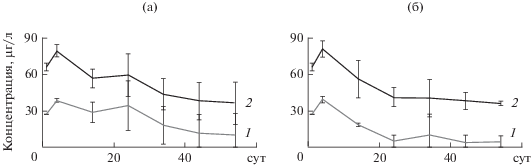
Концентрации как общего хлорофилла, так и хлорофилла цианобактерий статистически значимо снижались на протяжении эксперимента (табл. 1, рис. 2). Концентрации общего хлорофилла в контроле и варианте с рыбой не различались, тогда как концентрация хлорофилла цианобактерий была значимо меньше в присутствии рыб (табл. 2). Эффекта взаимодействия двух факторов (рыбы и время) не наблюдалось (табл. 1, рис. 2).
Рис. 2.
Динамика концентрации хлорофилла цианобактерий (1) и общего хлорофилла (2) в контроле (а) и в присутствии рыб (б).
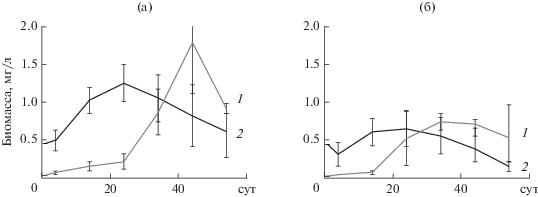
Биомасса ветвистоусых и веслоногих ракообразных статистически значимо менялась со временем таким образом, что веслоногие доминировали в начале эксперимента, а ветвистоусые – во второй половине эксперимента (табл. 1, рис. 3). Биомасса ветвистоусых ракообразных в контроле была статистически значимо выше, чем в варианте с рыбой (см. табл. 2). Биомасса веслоногих, вопреки ожиданиям, также снижалась в присутствии рыб (табл. 1, 2). Достоверных корреляций между биомассой как ветвистоусых, так и веслоногих ракообразных с концентрацией хлорофилла не найдено. Соотношение биомассы ветвистоусых к биомассе веслоногих ракообразных достоверно не различалось между контролем и вариантом с рыбами (см. табл. 1).
Рис. 3.
Динамика биомассы ветвистоусых (1) и веслоногих (2) ракообразных в контроле (а) и в присутствии рыб (б).
Концентрация эйкозапентаеновой кислоты (ЭПК) как показателя качества пищи снизилась в обоих вариантах опытов (табл. 3). Однако соотношение ЭПК : C не изменилось, а соотношение C : N снизилось к концу эксперимента и не различалось между контролем и вариантом с рыбой. Соотношение C : P к концу опыта снизилось сильнее, чем изменились другие показатели качества пищи, т.е. более чем в 15 раз. Величина этого соотношения статистически значимо различалась между началом и концом опытов, но не различалась между вариантами с рыбой и без рыбы. Соотношение N : P снижалось к концу опыта более чем в 12 раз в обоих вариантах опытов. Между вариантами опытов это соотношение также не различалось.
Таблица 3.
Средние значения (± ошибка средней) концентрации ЭПК и соотношений индикаторов качества сестона в мезокосмах в начале и конце эксперимента
| Индикаторы качества сестона | Начало опыта | Рыба | Контроль |
|---|---|---|---|
| ЭПК, μг/л | 4.04 ± 0.16a | 0.82 ± 0.05c | 0.72 ± 0.18c |
| C : N, мг/мг | 6.5 ± 0.1ab | 5.4 ± 0.2a | 5.2 ± 0.3a |
| C : P, мг/мг | 635.3 ± 129.3a | 41.8 ± 7.9b | 40.5 ± 8.8b |
| N : P, мг/мг | 97.6 ± 19.7a | 7.7 ± 1.3b | 8.0 ± 2.0b |
| ЭПК : C, μг/мг | 2.4 ± 0.2 | 2.6 ± 0.2 | 2.0 ± 0.7 |
Таким образом, анализ показателей качества пищи не выявил значимого влияния рыб на качество пищи. Однако качество пищи, выраженное в содержании фосфора в сестоне, резко изменялось к концу эксперимента независимо от присутствия рыб. Поскольку менялся показатель качества пищи, связанный с содержанием фосфора в сестоне, то улучшение качества пищи происходило в основном для ветвистоусых ракообразных, которые более чувствительные к недостатку фосфора, чем веслоногие.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Вселение рыб может сопровождаться каскадными эффектами [20]. Согласно теории каскадных эффектов в классическом понимании [1, 2], пресс рыб должен приводить к снижению зоопланктонных организмов и потере ими контроля за концентрацией пищи. Предполагается, что в присутствии рыб концентрация фитопланктона будет выше, чем в условиях без рыб. Однако в наших экспериментах, хотя мы и наблюдали понижение биомассы планктонных ракообразных, как того и следовало ожидать, повышение концентрации общего хлорофилла в варианте с рыбой относительно контроля не наблюдалось. Следует обратить внимание на то, что концентрация фитопланктона регулируется не только “сверху”, но и “снизу” концентрациями биогенных веществ. В присутствии рыб концентрация неорганического фосфора в виде P-PO4 не изменилась, тогда как концентрация неорганического азота в виде суммы N-NO3, N-NO2, N-NH4 возрастала. Поэтому присутствие рыб могло стимулировать развитие водорослей, чувствительных к недостатку азота. В наших экспериментах произошло снижение количества цианобактерий, что, возможно, могло быть обусловлено конкуренцией за биогенные вещества с усилившими свой рост водорослями из других таксонов в присутствии рыб. В результате изменения структуры фитопланктона ожидаемого изменения концентрации общего хлорофилла при вселении рыб не произошло. Таким образом, каскадные эффекты могут проявляться не только в изменении количества пищевых ресурсов зоопланктона, но и в изменении структуры фитопланктона.
Статистический анализ по оценке влияния рыб на структуру сообществ ракообразных в мезокосмах с эвтрофными условиями показал, что рыбы снижали биомассу как ветвистоусых, так и веслоногих ракообразных. Известно, что рыбы предпочитают более крупных особей [3, 21], представителями которых в нашем эксперименте были веслоногие ракообразные, которые лучше, чем ветвистоусые, способны избегать хищника за счет своей более высокой скорости передвижения [5–7]. Таким образом, у каждой группы ракообразных есть свое преимущество. Видимо, по этой причине рыбы не влияли на соотношение биомассы веслоногих и ветвистоусых ракообразных.
Однако сдвиг в соотношении между веслоногими и ветвистоусыми ракообразными происходил во времени. В начале эксперимента в зоопланктоне преобладали веслоногие, а во второй половине начали преобладать ветвистоусые ракообразные, причем как в присутствии, так и отсутствии рыб. Мы не рассматривали конкуренцию за пищу в качестве причины изменения структуры сообществ ракообразных. Во-первых, в наших экспериментах концентрация пищи всегда превышала пороговые уровни (0.5–2.0 μg L–1), при которых начинается конкурентное исключение [22]. Во-вторых, не было найдено корреляций между концентрацией общего хлорофилла и биомассой каких-либо таксонов ракообразных в эвтрофных условиях наших экспериментов, что подтверждено и результатами другого исследования в наших мезокосмах [23]. Поэтому мы полагаем, что драйвером изменений в соотношении веслоногих и ветвистоусых ракообразных в эвтрофных условиях было качество пищи. В пользу этого предположения свидетельствуют также результаты полевых исследований, согласно которым биомасса зоопланктона в природе часто бывает связана не с количеством пищи, а с ее качеством [24, 25].
Сравнение содержания ЭПК и стехиометрических соотношений между контролем и вариантом с рыбами показало, что рыбы не меняли качество пищевых ресурсов. Изменение качества пищевых ресурсов произошло за счет изменения содержания фосфора в сестоне, которое значительно увеличилось к концу эксперимента. В начале эксперимента соотношение С : P более чем в 5 раз превышало пороговый уровень по этому показателю для ветвистоусых ракообразных [26–28]. Поскольку к содержанию фосфора в сестоне чувствительны ветвистоусые (а в начале эксперимента наблюдался его недостаток), то в первой половине опытов преобладали веслоногие ракообразные. Однако в процессе регенерации органического фосфора в неорганический его содержание в сестоне возрастало. Скорости регенерации органического фосфора планктонными коловратками и ракообразными в наших мезокосмах, которые могут приводить к увеличению содержания фосфора в фитопланктоне, были оценены в работе [29]. Мы полагаем, что по мере возрастания содержания фосфора в сестоне менялось соотношение веслоногих и ветвистоусых ракообразных. В конце эксперимента в обоих вариантах опытов доминировали ветвистоусые ракообразные, так как соотношение С : P в сестоне снизилось более чем в 15 раз по сравнению с началом опытов. Следовательно, основным драйвером динамики структуры сообществ планктонных ракообразных было содержание фосфора в сестоне.
Таким образом, в мезокосмах обилие ракообразных одновременно регулировалось “сверху” рыбами и “снизу” качеством пищи. Рыбы снижали количество ракообразных, в то время как качество пищи приводило к изменению в соотношении веслоногих и ветвистоусых ракообразных. Количество пищи не влияло на обилие ракообразных в эвтрофных условиях. Поэтому при анализе каскадных эффектов при вселении рыб следует учитывать и роль качества пищевых ресурсов. Сторонники гипотезы размерной эффективности предполагают, что влияние рыб нивелирует контроль “снизу”, так как ослабляет конкурентные отношения [3, 21, 30, 31]. Однако нивелировать контроль “снизу”, связанный с качеством пищи, рыбы не могут. Наши эксперименты показали, что качество пищи способно приводить к изменению соотношения между ветвистоусыми и веслоногими ракообразными. В пользу данного заключения свидетельствуют и полевые наблюдения, которые показали, что ветвистоусые ракообразные, у которых N : P ниже, чем у веслоногих ракообразных [32], встречаются преимущественно в озерах с низким соотношением N : P в сестоне [33]. В то же время веслоногие ракообразные, у которых N : P выше, чем у ветвистоусых [32, 34, 35], преимущественно встречаются в озерах с высоким соотношением N : P в сестоне [33].
Итак, наши эксперименты показали, что рыбы в эвтрофных условиях не влияли на количество и качество пищевых ресурсов для ракообразных. Однако во второй половине экспериментов наблюдался переход доминирования от веслоногих к ветвистоусым ракообразным. Это было связано не с влиянием рыбы, а с улучшением качества пищи для ветвистоусых ракообразных, определяемое соотношением углерода к фосфору в сестоне. Рыбы в эвтрофных условиях понижали биомассу как ветвистоусых, так и веслоногих ракообразных, не меняя соотношение между ними.
Проведение экспериментов и сбор биологического материала выполнены при поддержке Национального центра науки Польши (UMO-506 2016/21/B/NZ8/00434). Обработка проб фитопланктона осуществлялась за счет гранта РФФИ 18-54-00002 Бел_а, обработка проб зоопланктона и их анализ – за счет Белорусского республиканского фонда фундаментальных исследований (гранты Б18СРБГ-007; Б18КИ-007), а статистическая обработка, интерпретация полученных результатов, обзор литературы и подготовка материалов для публикации – за счет Российского научного фонда (проект № 16-14-10323).
Список литературы
Hairston N.G., Smith F.E., Slobodkin L.B. Community structure, population control, and competition // Am. Nat. 1960. V. 94. P. 421–425.
Hrbacek J., Dvorakova M., Korinek V., Prochazkova L. Demonstration of the effect of the fish stock on the species composition of zooplankton and the intensity of metabolism of the whole plankton association // Verh. Internat. Verein. Limnol. 1961. V. 14. P. 192–195.
Brooks J.L., Dodson S.I. Predation. body size and composition of plankton // Science. 1965. V. 150. P. 28−35.
Bohl E. Food supply and prey selection in planktivorous Cyprinidae // Oecologia. 1982. V. 35. P. 134–138.
Maia-Barbosa P.M., Matsumura-Tundisi T.M. Consumption of zooplanktonic organisms by Astyanax fasciatus Cuvier, 1819 (Osteichthyes, Characidae) in Lobo (Broa) reservoir, São Carlos, SP, Brazil // Hydrobiologia. 1984. V. 113. P. 171–181.
Sommer U., Stibor H. Copepoda–Cladocera–Tunicata: the role of three major mesozooplankton groups in pelagic food webs // Ecol. Res. 2002. V. 17. P. 161–174.
Güntzel A.M., Morita Melo I.K., Roche K.F. et al. Cladocerans from gut contents of fishes associated to macrophytes from Taquari River Basin, MS, Brazil // Acta Limnologica Brasiliensia. 2012. V. 24. P. 97–102.
Okun N., Mehner T. Distribution and feeding of juvenile fish on invertebrates in littoral reed (Phragmites) stands // Ecology of Freshwater Fish. 2005. V. 14. P. 139–149.
Elser J.J., Urabe J. The stoichiometry of consumer-driven nutrient recycling: theory, observations, and consequences // Ecology. 1999. V. 80. P. 735–751.
Sterner R.W., Elser J.J. Ecological stoichiometry: The biology of elements from molecules to the biosphere. Princeton: Princeton University Press, 2002. 464 p.
Ravet J.L., Persson J., Brett M.T. Threshold dietary polyunsaturated fatty acid concentrations for Daphnia pulex growth and reproduction // Inland Waters. 2012. V. 2. P. 199–209.
Kolmakov V.I., Gladyshev M.I. Growth and potential photosynthesis of cyanobacteria are stimulated by viable gut passage in crucian carp // Aquatic Ecol. 2003. V. 37. P. 237–242.
Brabrand A., Bjorn F., Torsten K., Nilssen P.J. Can iron defecation from fish influence phytoplankton production and biomass in eutrophic lakes? // Limnol. Oceanogr. 1984. V. 29. P. 1330−1334.
Happey-Wood C.M., Pentecost A. Algal bioassay of the water from two linked but contrasting Welsh lakes // Freshwater Biol. 1981. V. 11. P. 473–491.
Lin C.K., Schelske C.L. Seasonal variation of potential nutrient limitation to chlorophyll production in southern Lake Huron // Can. J. Fish. Aquat. Sci. 1981. V. 38. P. 1–9.
Балушкина Е.В., Винберг Г.Г. Зависимость между длиной и массой тела планктонных ракообразных // Экспериментальные и полевые исследования биологических основ продуктивности озер. Л.: Наука, 1979. С. 58–72.
APHA. Standard Methods. Standard methods for the examination of water and wastewater / 21st edn. American Public Health Association, Washington, DC. 2005.
Gladyshev M.I., Sushchik N.N., Kolmakova A.A. et al. Seasonal correlations of elemental and v-3 PUFA composition of seston and dominant phytoplankton species in a eutrophic Siberian Reservoir // Aquatic Ecology. 2007. V. 41. P. 9–23.
Murphy J., Riley J.P. A modified single solution method for the determination of phosphate in natural waters // Analytica Chimica Acta. 1962. V. 27. P. 31–36.
Hessen D.O., Kaartvedt S. Top-down cascades in lakes and oceans: different perspectives but same story? // J. Plankton Res. 2014. V. 36. P. 914–924.
Gliwicz Z.M. Between hazards of starvation and risk of predation: the ecology of off-shore animals // Excellence in Ecology. Book 12. Oldendorf/Luhe: International Ecology Institute, Germany, 2003. 379 p.
Semenchenko V.P., Razlutskij V.I., Feniova I.Yu., Aibulatov D.N. Biotic relations affecting species structure in zooplankton communities // Hydrobiologia. 2007. V. 579. P. 219–231.
Feniova I., Dawidowicz P., Ejsmont-Karabin J. et al. Effects of zebra mussels on cladoceran communities under eutrophic conditions // Hydrobiologia. 2018. https://doi.org/10.1007/s10750-018-3699-4.
McCauley E., Murdoch W.W., Nisbet R. Growth, reproduction, and mortality of Daphnia pulex Leyding: Life at low food // Functional Ecology. 1990. V. 4. P. 505–514.
Müller-Navarra D., Lampert W. Seasonal patterns of food limitation in Daphnia galeata: Separating food quantity and food quality effects // J. of Plankton Research. 1996. V. 18. P. 1137–1157.
DeMott W.R., Gulati R.D., Siewertsen K. Effects of phosphorus-deficient diets on the carbon and phosphorus balance of Daphnia magna // Limnology and Oceanography. 1998. V. 43. P. 1147–1161.
Brett M.T., Muller-Navarra D.C., Park S.-K. Empirical analysis of the effect of phosphorus limitation on algal food quality for freshwater zooplankton // Limnology and Oceanography. 2000. V. 45. P. 1564–1575.
Hall S.R., Leibold M.A., Lytle D.A., Smith V.H. Stoichiometry and planktonic grazer composition over gradients of light, nutrients, and predation risk // Ecology. 2004. V. 85. P. 2291–2301.
Ejsmont-Karabina J., Feniova I., Kostrzewska-Szlakowska I. et al. Factors influencing phosphorus regeneration by lake zooplankton – An experimental approach // Limnologica. 2018. V. 70. P. 58–64.
Sommer U., Gliwicz Z.M., Lampert W., Duncan A. The PEG-model of seasonal succession of planktonic events in fresh waters // Archiv für Hydrobiologie. 1986. V. 106. P. 433–471.
Sommer U. Plankton Ecology. Succession in Plankton Communities. Berlin: Springer-Verlag, 1989. 369 p.
Andersen T., Hessen D.O. Carbon, nitrogen and phosphorus content of freshwater zooplankton // Limnology and Oceanography. 1991. V. 36. P. 807–814.
Hassett R.P., Cardinale B., Stabler L.B., Elser J.J. Ecological stoichiometry of N and P in pelagic ecosystems: Comparison of lakes and oceans with emphasis on the zooplankton-phytoplankton interaction // Limnology and Oceanography. 1997. V. 42. P. 648–662.
Carrillo P., Reche I., Cruz-Pizarro L. Intraspecific stoichiometric variability and the ratio of nitrogen to phosphorus resupplied by zooplankton // Freshwater Biology. 1996. V. 36. P. 363–374.
Villar-Argaiz M., Medina-Sánchez J. M., Cruz-Pizarro L., Carrillo P. Life history implications of calanoid Mixodiaptomus laciniatus in C : N : P stoichiometry // Verhandlungen der Internationale Vereinigung für Theoretische und Angewandte Limnologie. 2000. V. 27. P. 527–531.
Дополнительные материалы отсутствуют.


