Экология, 2019, № 1, стр. 62-71
Анализ закономерностей организации комплексов видов макрозообентоса понто-каспийского и понто-азовского происхождения в водохранилищах Средней и Нижней Волги
Е. М. Курина a, *, Д. Г. Селезнев b
a Институт экологии Волжского бассейна РАН
445003 Самарская обл, Тольятти, ул. Комзина, 10, Россия
b Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Некоузский р-н, п. Борок, Россия
* E-mail: ekaterina_kurina@mail.ru
Поступила в редакцию 12.02.2018
После доработки 15.05.2018
Принята к публикации 27.04.2018
Аннотация
В результате исследований макрозообентоса в водохранилищах Средней и Нижней Волги выявлены устойчивые ценотические комплексы понто-каспийских и понто-азовских видов, характеризующихся консорционными взаимодействиями. Установлено, что ведущая средообразующая роль в донных сообществах принадлежит массовым видам моллюсков Dreissena polymorpha (Pallas, 1771) и D. bugensis (Andrusov, 1897). Представлен анализ закономерностей образования взаимно согласованных пар видов понто-каспийского и понто-азовского комплексов в разнотипных водоемах.
До зарегулирования р. Волги состав донных организмов был типичным для равнинной реки, однако в отличие от рек других бассейнов представители понто-каспийской фауны, проникая в речную систему, образовывали местами специфические биоценозы [1]. С созданием системы водохранилищ произошла перестройка речных сообществ в связи с заилением биотопов. Прежде всего широко расселились моллюски рода Dreissena, которые изменяют и впоследствии определяют структуру гидробиоценозов [2]. Резкий рост числа чужеродных видов понто-каспийского и понто-азовского происхождения начался с 1980−1990 гг. в связи как с естественными процессами расселения видов, так и хозяйственной деятельностью человека: развитием судоходства и акклиматизацией каспийских ракообразных и полихет в целях повышения продуктивности водоемов [3].
Под названием “понто-каспийского” и “понто-азовского” комплексов подразумеваются специфические комплексы видов, характерные для понто-каспийского и понто-азовского бассейнов, которые по своему систематическому положению резко отличаются как от морской, так и от пресноводной фауны и образующие особые группы видов, роды и даже семейства, что объясняется длительностью развития фаунистических групп этих бассейнов в условиях изоляции от океана [4]. Действительно, при анализе экологических и биологических характеристик понто-азовской и особенно понто-каспийской фауны возникает представление об определенной обособленности этих видов. К таким характеристикам относят относительную эврибионтность, эвригалинность, высокую генетическую вариабельность, эврифагию, высокую устойчивость к загрязнению среды [5−7 и др.]. Вместе с этим среди причин, обусловивших натурализацию чужеродных видов, рядом авторов указывается наличие успешной стратегии размножения [8, 9]. Дискуссионным остается вопрос о происхождении этих комплексов в водоемах Волги и Камы и возможном расселении видов в результате одной из трансгрессий Каспия [4].
Цель настоящей работы − оценка таксономического состава, структурных характеристик и ассоциативности видов бентоса понто-каспийского и понто-азовского комплексов с использованием статистических методов в водохранилищах Средней и Нижней Волги. Были поставлены следующие задачи: проанализировать состав и количественные характеристики чужеродных видов; оценить роль редких и единичных видов в структуре ценоза вселенцев; выявить пары взаимно приуроченных видов; проанализировать закономерности образования ценотических комплексов и консорций понто-каспийских и понто-азовских видов в разнотипных водоемах.
МАТЕРИАЛ И МЕТОДЫ
Исследовали пробы зообентоса из глубоководных и прибрежных (h < 3.0 м) участков Волгоградского, Саратовского, Куйбышевского, Чебоксарского и Горьковского водохранилищ (рис. 1). Отбор проб в Волгоградском водохранилище проведен в ходе экспедиционных исследований в 2005, 2011 и 2016 гг. на 24 станциях (число проб N = 40), в Саратовском – в 2009−2011, 2014, 2016 гг. на 45 станциях (N = 108), в Куйбышевском – в 2009−2011, 2014−2016 гг. на 40 станциях (N = 113), в Чебоксарском – в 2016 г. на 14 станциях (N =20), в Горьковском в 2016 г. – на 18 станциях (N = 35). Всего за период исследований 2005−2016 гг. в водохранилищах Волжского каскада собрано и обработано 316 количественных и качественных проб зообентоса. При построении дендрограммы сходства видового состава чужеродных видов бентоса водохранилищ Средней Волги и Камы также использовались данные о видовой структуре донных сообществ Нижнекамского, Воткинского и Камского водохранилищ, полученные в ходе экспедиционных исследований 2016 г. (45 проб бентоса).
Количественные пробы отбирали дночерпателем Экмана-Берджи с площадью захвата 250 и 400 см2 по 2 подъема на станции и дночерпателем ДАК-100 (100 см2 × 8). Качественные пробы отбирали гидробиологическим скребком с длиной ножа 20 см и драгой с длиной ножа 40 см (размер ячеи 0.23 мм). Сбор и обработка материала проведены с использованием стандартных гидробиологических методов [10, 11].
Для анализа структуры сообществ бентоса определяли число видов, частоту встречаемости, соотношение численности и биомассы отдельных таксонов. При оценке частоты встречаемости условно выделены пять категорий видов: М – массовый (>51%); О – обычный (31–50%); В – часто встречающийся (16–30%); Р – редкий (5–15%); Е – единичный (<5%).
Для определения пар взаимно приуроченных видов использовали индекс C-заполнения (Checkerboard score) [12]. Нуль-модели для проверки статистической значимости индекса С-заполнения строили методом Монте-Карло с 1000 перестановками по алгоритму FE (Fixed-Equiprobable) [13, 14] и доверительными границами [0.01−0.99]. Если наблюдаемое значение индекса выходило за нижнюю границу доверительного интервала плотности распределения смоделированного значения, индекс признавался значимо отличающимся от случайного, а виды – приуроченными, если индекс превышал верхнюю границу – значимо несовместимыми. Вторично значимость оценивали Z-тестом Фишера [15] с уровнем значимости p < < 0.05. Дополнительно взаимную приуроченность видов оценивали по значению индекса Шлюттера V [0 : 2] (значения, стремящиеся к 0, говорят несовместимости видов, около 1 – о случайном совпадении местообитаний, стремящиеся к 2 – о приуроченности видов), а также по показателю нормированного совместного обнаружения видов (при N1N2.scaled = 1 приуроченность максимальна).
При построении дендрограммы сходства видового состава чужеродных видов бентоса водохранилищ Средней Волги и Камы использовали бинарную меру расстояния и алгоритм Варда. Граф ценотических комплексов понто-каспийских и понто-азовских видов строили алгоритмом Kamada-Kawai [16], группировку вершин осуществляли алгоритмом многоуровневой оптимизации модулярности (multi-level optimization of modularity) [17]. Данные подготовлены в программе MS Excel, вычисления выполнены в программе статистического анализа R3.3 с использованием пакетов EcoSimR, igraph и vegan. Исходные данные и код вычислений в R могут быть загружены с сайта ИБВВ РАН: ibiw.ru/upload/staff/267/coobs.zip.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Водохранилища Средней и Нижней Волги характеризуются значительным распространением видов понто-каспийского и понто-азовского комплексов, в основном ракообразных (табл. 1). Среди чужеродных видов также отметим байкальских амфипод Gmelinoides fasciatus (Stebbing, 1899), которые в 1960−1970-х гг. были интродуцированы в ряд водоемов России для повышения их рыбопродуктивности [18], а также двустворчатых моллюсков Corbicula fluminea Muller, 1774, нативным ареалом которых являются реки Юго-Восточной Азии. Во всех водохранилищах Средней и Нижней Волги отмечены моллюски рода Dreissena – D. bugensis (Andrusov, 1897) и D. polymorpha (Pallas, 1771), которые образуют консорции с двумя видами полихет – Hypania invalida (Grube, 1860) и Hypaniola kowalewskii (Grimm, 1877), а также с пиявками Archaeobdella esmonti Grimm, 1876. Общее число чужеродных видов в водохранилищах Средней и Нижней Волги составляет 6−20% от таксономического состава бентоса, при этом их доля превышает 90% от общей средней биомассы донных сообществ.
Таблица 1.
Состав и частота встречаемости чужеродных видов макрозообентоса водохранилищ Средней и Нижней Волги
| Таксоны | Код | Происхож-дение | Водохранилище | ||||
|---|---|---|---|---|---|---|---|
| Г.В. | Ч.В. | К.В. | С.В. | В.В. | |||
| Oligochaeta | |||||||
| Potamothrix vejdovskyi Hrabĕ, 1941 | PtmV | ПК | 0 | 5 (Р) | 11(Р) | 21(В) | 8(Р) |
| Polychaeta | |||||||
| Hypania invalida (Grube, 1860) | HypI | ПК | 34(О) | 50(О) | 64(М) | 35(О) | 50(О) |
| Manayunkia caspica (Annenkova, 1929) | ManC | ПК | 0 | 0 | 1(Е) | 0 | 0 |
| Hypaniola kowalewskii (Grimm, 1877) | HypK | ПК | 6(Р) | 5(Р) | 3(Е) | 1(Е) | 3(Е) |
| Hirudinea | |||||||
| Archaeobdella esmonti Grimm, 1876 | ArcE | ПК | 15(Р) | 15(Р) | 20(В) | 15(Р) | 20(В) |
| Caspiobdela fadejewi (Epstein, 1961) | CspF | ПА | 0 | 0 | 1(Е) | 1(Е) | 0 |
| Crustacea | |||||||
| Paramysis ullskyi Czerniavsky, 1882 | PrmU | ПК | 0 | 0 | 3(Е) | 10(Р) | 3(Е) |
| P. lacustris (Czerniavsky, 1882) | PrmL | ПК | 0 | 0 | 6(Р) | 12(Р) | 3(Е) |
| P. intermedia (Czerniavsky, 1882) | PrmI | ПК | 0 | 0 | 1(Е) | 1(Е) | 1(Е) |
| Katamysis warpachowskyi Sars, 1893 | KtmW | ПК | 0 | 0 | 3(Е) | 13(Р) | 3(Е) |
| Limnomysis benedeni Czerniavsky, 1882 | LmnB | ПК | 0 | 0 | 0 | 3(Е) | 1(Е) |
| Pterocuma rostrata (Sars, 1894) | PtrR | ПК | 0 | 0 | 0 | 14(Р) | 25(В) |
| P. sowinskyi (Sars, 1894) | PtrS | ПК | 0 | 0 | 14(Р) | 17(В) | 13(Р) |
| P. pectinata Sowinsky, 1893 | PtrP | ПК | 0 | 0 | 0 | 0 | 3(Е) |
| Pseudocuma cercaroides Sars, 1894 | PsdC | ПК | 0 | 0 | 8(Р) | 10(Р) | 3(Е) |
| Caspiocuma campylaspoides (Sars, 1897) | CasC | ПК | 0 | 0 | 1(Е) | 1(Е) | 0 |
| Dikerogammarus haemobaphes (Eichwald, 1841) | DkrH | ПК | 0 | 30(В) | 20(В) | 20(В) | 13(Р) |
| D. villosus (Sowinsky, 1894) | DkrV | ПА | 0 | 15(Р) | 3(Е) | 3(Е) | 3(Е) |
| D. сaspius (Pallas, 1771) | DkrC | ПК | 0 | 0 | 1(Е) | 8(Р) | 10(Р) |
| Pontogammarus robustoides (Sars, 1894) | PntR | ПК | 0 | 10(Р) | 11(Р) | 15(Р) | 20(В) |
| P. maeoticus (Sowinsky, 1894) | PntM | ПК | 0 | 5(Р) | 4(Е) | 16(В) | 3(Е) |
| Obesogammarus obesus (Sars, 1896) | ObsO | ПК | 0 | 10(Р) | 4(Е) | 17(В) | 15(Р) |
| Stenogammarus dzjubani Mordukhay-Boltovskoy et Ljakhov, 1972 | StnD | ПК | 0 | 0 | 8(Р) | 24(В) | 15(Р) |
| S. similis (Sars, 1894) | StnS | ПК | 0 | 0 | 0 | 1(Е) | 10(Р) |
| S. deminutus (Stebbing, 1906) | StnD | ПК | 0 | 0 | 0 | 0 | 3(Е) |
| Pandorites platycheir (Sars, 1896) | PndP | ПК | 0 | 0 | 1(Е) | 0 | 25(В) |
| Shablogammarus chablensis (Carausu, 1943) | ShbC | ПА | 0 | 0 | 13(Р) | 8(Р) | 3(Е) |
| Chaetogammarus warpachowskyi (Sars, 1894) | ChtW | ПК | 0 | 0 | 1(Е) | 24(В) | 15(Р) |
| C. ischnus (Stebbing, 1898) | ChtI | ПК | 0 | 0 | 0 | 2(Е) | 0 |
| Gmelinoides fasciatus (Stebbing, 1899) | GmlF | Б | 31(О) | 10(Р) | 3(Е) | 0 | 3(Е) |
| Chelicorophium curvispinum Sars, 1895 | ChlC | ПК | 0 | 40(О) | 17(В) | 11(Р) | 8(Р) |
| Ch. sowinskyi Martynov, 1924 | ChlS | ПА | 0 | 35(О) | 9(Р) | 7(Р) | 5(Р) |
| Jaera sarsi Valkanov, 1936 | JrSr | ПК | 0 | 0 | 0 | 7(Р) | 5(Р) |
| Mollusca | |||||||
| Dreissena bugensis (Andrusov, 1897) | DrsB | ПК | 31(О) | 50(О) | 58(М) | 36(О) | 55(М) |
| D. polymorpha (Pallas, 1771) | DrsP | ПК | 50(О) | 40(О) | 33(О) | 25(В) | 23(В) |
| Monodacna colorata (Eichwald, 1829) | MndC | ПА | 0 | 0 | 4(Е) | 0 | 0 |
| Corbicula fluminea Muller, 1774 | CrbF | ЮВ | 3(Е) | 0 | 0 | 0 | 0 |
| Theodoxus astrachanicus (Starobogatov in Starobogatov, Filchakov, Antonova et Pirogov, 1994) | ThdA | ПК | 0 | 0 | 0 | 15(Р) | 13(Р) |
| Lithoglyphus naticoides (Preiffer, 1828) | LthN | ПА | 19(В) | 60(М) | 31(О) | 32(О) | 28(В) |
| Всего видов: 39 | 8 | 15 | 30 | 32 | 33 | ||
Примечание. Водохранилище: Г.В. – Горьковское, Ч.В. – Чебоксарское, К.В. – Куйбышевское, С.В. – Саратовское, В.В. – Волгоградское. Происхождение: ПК – понто-каспийское, ПА − понто-азовское, Б – байкальское, ЮВ – Юго-Восточная Азия. Ранжирование видов по частоте встречаемости: М − массовый; О − обычный; В − встречающийся; Р − редкий; Е − единичный.
Анализ количественных показателей чужеродных видов в водохранилищах Средней и Нижней Волги (табл. 2) выявил следующие общие черты: пелофильный (профундальный) ценоз вселенцев по биомассе представлен одним доминантом – моллюском Dreissena bugensis (до 98% биомассы на данном типе биотопа); доминантами псаммофильного (прибрежного) ценоза являются в основном два вида – моллюски Lithoglyphus naticoides (66−90% биомассы) и Dreissena polymorpha (12−22%). Исключение составляет Саратовское водохранилище, где на галечно-песчаных грунтах прибрежья, как и на русле, значительно преобладают моллюски Dreissena bugensis (58%, см. табл. 2). Эти виды зачастую являются средообразующими в водохранилищах и создают ценотические комплексы с полихетами, амфиподами и кумовыми ракообразными.
Таблица 2.
Доминанты профундального и прибрежного ценозов чужеродных видов макрозообентоса в водохранилищах Средней и Нижней Волги
| Водохранилище | Доминанты пелофильного (профундального) ценоза вселенцев (% биомассы) | Доминанты псаммофильного (прибрежного) ценоза вселенцев (% биомассы) |
|---|---|---|
| Горьковское | Dreissena bugensis (71%) Dreissena polymorpha (28%) |
Lithoglyphus naticoides (71%) Gmelinoides fasciatus (28%) Dreissena polymorpha (22%) |
| Чебоксарское | Dreissena bugensis (95%) | Lithoglyphus naticoides (66%) Dreissena polymorpha (17%) Dikerogammarus villosus (10% ) |
| Куйбышевское | Dreissena bugensis (98% биомассы) | Lithoglyphus naticoides (73%) Dreissena polymorpha (19%) Dreissena bugensis (6%) |
| Саратовское | Dreissena bugensis (98%) | Dreissena bugensis (58%) Lithoglyphus naticoides (18%) Dreissena polymorpha (12%) |
| Волгоградское | Dreissena bugensis (98%) | Lithoglyphus naticoides (90%) |
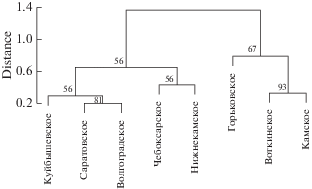
Число чужеродных видов последовательно увеличивается от северных водохранилищ волжского каскада к южным (см. табл. 1). Дендрограмма сходства видового состава вселенцев волжских и камских водохранилищ образует три кластера (рис. 2). Первый кластер характеризует сообщества нижневолжских водохранилищ (Волгоградского и Саратовского), а также в значительной степени Куйбышевского, в которых большую роль играют многочисленные каспийские ракообразные (мизиды, амфиподы и кумовые) (см. табл. 1). Второй кластер (Чебоксарское и Нижнекамское водохранилища) характеризуется преобладанием в сообществах макрозообентоса моллюсков рода Dreissena, массовым развитием корофиид, а в прибрежье – амфипод Pontogammarus robustoides и Dikerogammarus villosus. Отдельный кластер образуют сообщества “северных” водохранилищ − Воткинского, Камского и Горьковского, где число понто-каспийских и понто-азовских вселенцев значительно сокращается (до 8−9 видов). Вместе с тем особенностью верхнекамских водохранилищ является массовое обитание понто-каспийских амфипод Dikerogammarus haemobaphes, а Горьковского – возрастание доли байкальских амфипод Gmelinoides fasciatus в донных сообществах прибрежных биотопов водоема.
Рис. 2.
Дендрограмма сходства видового состава чужеродных видов бентоса водохранилищ Средней Волги и Камы.
Количественная оценка межвидовых взаимодействий, используемых для выделения пар потенциально сопряженных видов в водохранилищах, представлена в табл. 3. Высокая вероятность совместного обнаружения видов определяется их биологическими и экологическими особенностями, специфичностью занимаемых ими биотопов, а также средообразующей ролью ключевых видов бентоса (моллюски рода Dreissena в водохранилищах). Так, практически для всех изученных водоемов наблюдается закономерная положительная связь пелофильных моллюсков Dreissena bugensis и полихет Hypania invalida, а также D. bugensis и амфипод Dikerogammarus haemobaphes на глубоководных участках водоема. Эти виды связывают не только топические, но и трофические взаимодействия, так как продукты жизнедеятельности моллюсков (агглютинаты, фекальные пеллеты) служат источником пищи для отмеченных детритофагов [19]. Вместе с тем Dreissena polymorpha образует консорционные связи не с пелофильным, а псаммопелофильным комплексом видов: корофиидами Chelicorophium sowinskyi, C. curvispinum, кумовыми раками Pseudocuma cercaroides и моллюсками Lithoglyphus naticoides в прибрежной зоне водоемов (см. табл. 3). Отметим также примеры высокой вероятности совместного обнаружения видов одного рода или семейства среди амфипод (Pontogammarus robustoides и Obesogammarus obesus), кумовых раков (Pterocuma rostrata и P. sowinskyi), мизид (Paramysis lacustris и Katamysis warpachowskyi), моллюсков (Dreissena bugensis и D. polymorpha). Это свидетельствует о том, что большинство инвазий протекает относительно одновременно и поставляет в систему-реципиент устойчивые комплексы новых видов.
Таблица 3.
Парные комбинации видов-вселенцев бентоса, встретившиеся в N1 и N2 пробах, из которых N1N2 − совместно
| Вид 1 | Вид 2 | N1 | N2 | N1N2 | N1N2.scaled | Сobs | Сsim | Z | p | V |
|---|---|---|---|---|---|---|---|---|---|---|
| Горьковское водохранилище (n = 35) | ||||||||||
| Hypania invalida | Dreissena bugensis | 11 | 9 | 8 | 0.80 | 3 | 47.727 | –2.693 | 0.007 | 1.717 |
| Dreissena bugensis | Dreissena polymorpha | 9 | 16 | 9 | 0.72 | 0 | 54.108 | –2.620 | 0.009 | 1.622 |
| Чебоксарское водохранилище (n = 20) | ||||||||||
| Chelicorophium curvispinum | Chelicorophium sowinskyi | 8 | 7 | 7 | 0.93 | 0 | 22.284 | –2.231 | 0.026 | 1.898 |
| Ch. sowinskyi | Dreissena polymorpha | 7 | 8 | 6 | 0.80 | 2 | 23.004 | –2.062 | 0.039 | 1.684 |
| Hypania invalida | Dikerogammarus haemobaphes | 10 | 6 | 6 | 0.75 | 0 | 22.158 | –2.140 | 0.032 | 1.652 |
| Dikerogammarus haemobaphes | Dreissena bugensis | 6 | 10 | 6 | 0.75 | 0 | 22.049 | –2.108 | 0.035 | 1.652 |
| Chelicorophium curvispinum | D. polymorpha | 8 | 8 | 6 | 0.75 | 4 | 24.697 | –1.884 | 0.060 | 1.583 |
| Куйбышевское водохранилище (n = 113) | ||||||||||
| Hypania invalida | Dreissena bugensis | 72 | 66 | 56 | 0.81 | 160 | 718.216 | –4.109 | 0 | 1.521 |
| Dreissena polymorpha | Lithoglyphus naticoides | 37 | 33 | 26 | 0.74 | 77 | 582.511 | –4.490 | 0 | 1.630 |
| Cheliorophium curvispinum | Chelicorophium sowinskyi | 19 | 10 | 10 | 0.69 | 0 | 144.636 | –5.283 | 0 | 1.668 |
| Dikerogammarus haemobaphes | Shablogammarus chablensis | 23 | 15 | 11 | 0.58 | 48 | 240.047 | –4.188 | 0 | 1.507 |
| Shablogammarus chablensis | Cheliorophium curvispinum | 15 | 19 | 9 | 0.53 | 60 | 205.645 | –3.736 | 0 | 1.450 |
| Pterocuma sowinskyi | Pseudocuma cercaroides | 16 | 9 | 6 | 0.48 | 30 | 114.420 | –3.980 | 0 | 1.429 |
| Dikerogammarus haemobaphes | Dreissena bugensis | 23 | 66 | 21 | 0.47 | 90 | 497.322 | –3.183 | 0.001 | 1.331 |
| Pseudocuma cercaroides | Lithoglyphus naticoides | 9 | 33 | 8 | 0.38 | 25 | 194.548 | –3.520 | 0 | 1.339 |
| P. cercaroides | Dreissena polymorpha | 9 | 37 | 8 | 0.35 | 29 | 210.690 | –3.326 | 0.001 | 1.305 |
| Саратовское водохранилище (n = 108) | ||||||||||
| Paramysis lacustris | Katamysis warpachowskyi | 13 | 14 | 10 | 0.74 | 12 | 141.062 | –4.917 | 0 | 1.704 |
| Dreissena bugensis | Theodoxus astrachanicus | 39 | 16 | 16 | 0.58 | 0 | 341.794 | –4.412 | 0 | 1.530 |
| D. bugensis | Dreissena polymorpha | 39 | 27 | 19 | 0.58 | 160 | 510.972 | –3.369 | 0.001 | 1.410 |
| Hypania invalida | Dreissena bugensis | 38 | 39 | 22 | 0.57 | 272 | 621.220 | –2.989 | 0.003 | 1.334 |
| Dikerogammarus haemobaphes | D. bugensis | 22 | 39 | 17 | 0.56 | 110 | 438.800 | –3.624 | 0 | 1.427 |
| Katamysis warpachowskyi | Chaetogammarus warpachowskyi | 14 | 26 | 11 | 0.55 | 45 | 241.547 | –3.946 | 0 | 1.478 |
| Dikerogammarus haemobaphes | Jaera sarsi | 22 | 8 | 8 | 0.53 | 0 | 131.641 | –4.637 | 0 | 1.511 |
| Paramysis lacustris | Chaetogammarus warpachowskyi | 13 | 26 | 10 | 0.51 | 48 | 227.552 | –3.893 | 0 | 1.441 |
| Волгоградское водохранилище (n = 40) | ||||||||||
| Hypania invalida | Dreissena bugensis | 20 | 22 | 17 | 0.81 | 15 | 101.448 | –2.711 | 0.007 | 1.603 |
| Pontogammarus robustoides | Obesogammarus obesus | 8 | 6 | 4 | 0.57 | 8 | 33.572 | –2.503 | 0.012 | 1.487 |
| Pterocuma rostrata | Pterocuma sowinskyi | 10 | 5 | 4 | 0.53 | 6 | 33.700 | -2.494 | 0.013 | 1.463 |
Примечание. n – количество проб. N1 и N2 – число обнаружений первого и второго видов соответственно; N1N2 – совместное обнаружение, N1N2.scaled – нормированное совместное обнаружение (N1N2.scaled = 2*N1N2/(N1 + N2); Сobs – расчетный индекс С-заполения; Сsim – смоделированный индекс С-заполнения; Z и p – значение Z-статистики и ее уровень значимости, V – индекс Шлюттера.
Водохранилища волжского каскада являются важнейшими звеньями Волго-Балтийского инвазионного коридора. В каждом из водоемов сформировались собственные экосистемы, в развитии которых присутствуют как уникальные, так и общие для всего каскада черты. В нижневолжских водохранилищах (Волгоградском, Саратовском и Куйбышевском) основу видового состава вселенцев составляют редко и единично встречающиеся виды (см. табл. 1), доля которых достигает 26% от общей численности чужеродных видов. Известно, что редкие виды обеспечивают высокий уровень видового разнообразия и являются показателями состояния сообщества в целом [13]. Вместе с тем из небольшого числа понто-каспийских и понто-азовских видов, проникших в средневолжские водохранилища (Горьковское и Чебоксарское), большинство успешно интегрируется в донные сообщества водоемов, имеет высокую частоту встречаемости и осваивает значительное количество биотопов (см. табл. 1).
Наибольшее число чужеродных видов (33, см. табл. 1) зарегистрировано в Волгоградском водохранилище, что объясняется как географической близостью водоема-донора, так и особыми морфометрическими и гидрологическими характеристиками: относительно низкими скоростями течения на русле и высокой степенью зарастаемости (40%) пойм верхнего и среднего участков [20], что создает предпосылки для развития фитофильной фауны. Амфиподы, мизиды и кумовые раки играют важную роль в сообществах бентоса водохранилища, что выражается в их высоком разнообразии и частоте встречаемости (см. табл. 1). В отличие от других водоемов волжского каскада особое значение в прибрежных сообществах Волгоградского водохранилища имеют псаммофильные амфиподы Pandorites platycheir и фитофильные амфиподы Dikerogammarus caspius, которые не образуют ценотических связей с другими видами (см. табл. 3) и на определенных типах биотопов (песчаные открытые мелководья – для Pandorites platycheir и заросли высшей водной растительности – для Dikerogammarus caspius) достигают 97% биомассы бентоса.
Распространение чужеродных видов в Саратовском водохранилище также имеет ряд существенных особенностей: высокое разнообразие редких каспийских видов, относительно низкие по сравнению с другими водохранилищами частота встречаемости, численность и биомасса моллюсков рода Dreissena, образование устойчивых комплексов видов мизид и амфипод. Эти отличия в структуре ценоза вселенцев могут быть объяснены характерными особенностями самого водохранилища: в первую очередь разнообразием биотопов верхнего, среднего и нижнего участков, высокой проточностью и значительными площадями мелководий (более 21% от площади водоема) [21]. Комплекс каспийских ракообразных Paramysis lacustris, Katamysis warpachowskyi и Chaetogammarus warpachowskyi (виды составляют менее 1% биомассы вселенцев), отмеченный на затопленной пойме Саратовского водохранилища (см. табл. 3), формируется за счет схожести характера питания видов (детрит и микроскопические водоросли [22, 23]) и их биотопической приуроченности к заиленным грунтам, т.е. эти виды связывают непрямые межвидовые взаимодействия [24].
Куйбышевское водохранилище, самое крупное из всех водохранилищ волжского каскада, представляет собой цепь озеровидных расширений – плесов, при этом доля мелководной зоны относительно низка и составляет 10.5% от общей площади водоема [21]. Вследствие этого на обширных русловых и пойменных участках нижних плесов водохранилища сформировался однообразный тип сообществ, включающий вид-эдификатор Dreissena bugensis (97.8% биомассы вселенцев) и консортов (см. табл. 3): каспийских полихет Hypania invalida (0.05%), амфипод Dikerogammarus haemobaphes (0.09%), а также некоторых аборигенных видов – олигохет Potamothrix moldaviensis Vejdovsky et Mrazek, 1902, Limnodrilus claparedeanus Ratzel, 1868 и хирономид Procladius ferrugineus Kieffer, 1919. Вместе с тем в верхних плесах (наиболее проточных и вследствие этого менее заиленных) происходит перестройка бентосных сообществ из-за уменьшения в сообществе дрейссен доли полихет и массового развития корофиид Cheliorophium curvispinum и C. sowinskyi (0.09% биомассы вселенцев) и понто-азовских гаммарид Shablogammarus chablensis (0.01%).
В прибрежье водохранилища образовался специфичный псаммопелофильный комплекс, состоящий из двух ключевых видов – моллюсков Dreissena polymorpha (19.2% биомассы вселенцев на данном типе биотопа) и Lithoglyphus naticoides (73.0%), образующих ценотические связи с кумовыми ракообразными Pterocuma sowinskyi и Pseudocuma cercaroides (0.8% биомассы) (см. табл. 3). На песчаных грунтах Приплотинного плеса водохранилища отмечена “зона островного распространения” (глубина 5−9 м) понто-каспийской солоноватоводной полихеты Manayunkia caspica Annenkova, 1929. Известно о находках полихеты в бассейне Днестра, р. Турунчук [25] и низовьях Днепра [26], что подтверждает возможность ее расселения в реках.
В Чебоксарском водохранилище, образованном по времени последним в системе волжско-камских водохранилищ, значительно сокращается число каспийских видов (см. табл. 1) вследствие удаленности водоема-донора. Донные отложения водохранилища представлены в основном песчаными грунтами (84% от общей площади дна [21]), в результате чего наблюдается массовое развитие псаммофильных видов: брюхоногого моллюска Lithoglyphus naticoides (65.8% биомассы вселенцев), амфипод Pontogammarus maeoticus (2.5%) и Obesogammarus obesus (1.8%) в пойменной и прибрежной зонах водохранилища, а также в устьевых участках рек. Особенностью водоема является образование специфического комплекса видов Dreissena polymorpha (14.3% биомассы вселенцев) и корофиид Cheliorophium curvispinum и C. sowinskyi (3.2%) (см. табл. 3) на песчаных и каменистых биотопах. Этот тип сообществ сформировался еще до сооружения каскада водохранилищ. Так, известно, что на Средней Волге корофииды развивались в огромном количестве и образовывали так называемый “корофиидный” грунт [1]. В настоящее время представители сем. Corophiidae в водохранилищах Нижней Волги встречаются единично.
Горьковское водохранилище характеризуется наименьшим количеством чужеродных видов (см. табл. 1) из-за географической отдаленности Каспийского моря, климатических условий, высокой скорости течения на русловых участках. Особенностью ценоза моллюсков Dreissena bugensis (71.6% биомассы вселенцев) и D. polymorpha (28.1%) и связанных с ними трофическими и топическими взаимодействиями полихет Hypania invalida (0.2% биомассы) (см. табл. 3) является присутствие аборигенных видов – ручейников Hydropsyche ornatula McLachlan, 1878, которые формировали реофильный ценоз еще до сооружения водохранилища. В прибрежной зоне водоема в зарослях высших водных растений из ракообразных обитает только байкальский бокоплав Gmelinoides fasciatus (27.9% биомассы вселенцев на мелководье), способный переходить к хищному питанию и активному саморасселению [27]. В подогретых водах вблизи водосбросного канала Костромской ГРЭС обнаружены двустворчатые моллюски Corbicula fluminea (0.5% биомассы вселенцев), нативным ареалом которых являются реки Юго-Восточной Азии. В настоящее время инвазионный моллюск встречается в водоемах Южной и Северной Америки, Африки, широко расселился в реках Европы, в том числе в России – на супралиторали Каспийского моря и в р. Шура-Озень (Дагестан), а также в канале Новочеркасской ГРЭС (нижнее течение р. Дон) [28, 29]. Основным путем распространения вида считается речное судоходство, интродукция азиатских видов рыб, аквариумистика.
При анализе графа ценотических комплексов чужеродных видов (рис. 3) выявлено, что в волжских водохранилищах образуются два типа сообществ – псаммопелофильный (прибрежный) и пелофильный (профундальный). Первый тип сообществ сформировался еще до сооружения каскада водохранилищ при расселении моллюска Dreissena polymorpha вверх по течению р. Волга, что сопровождалось рядом сопряженных инвазий каспийских ракообразных. В настоящее время ценоз представлен комплексом прибрежных видов, включающим вид-эдификатор D. polymorpha, кумовых раков (Pseudocuma cercaroides, Pterocuma rostrata), мизид Katamysis warpachowskyi и амфипод Chaetogammarus warpachowskyi. В последнее десятилетие особую роль на песчаных мелководьях водоемов играют также моллюски понто-азовского комплекса Lithoglyphus naticoides, связанные общностью занимаемых биотопов с каспийскими ракообразными.
Рис. 3.
Граф ценотических комплексов каспийских и азовских видов в водохранилищах Средней и Нижней Волги (коды видов приведены в табл. 1). Учитывались виды с частотой встречаемости >3%. Квадратный маркер – азовский вид, круглый – каспийский; толщина ребра логарифмически пропорциональна силе связи по нормированному совместному обнаружению.
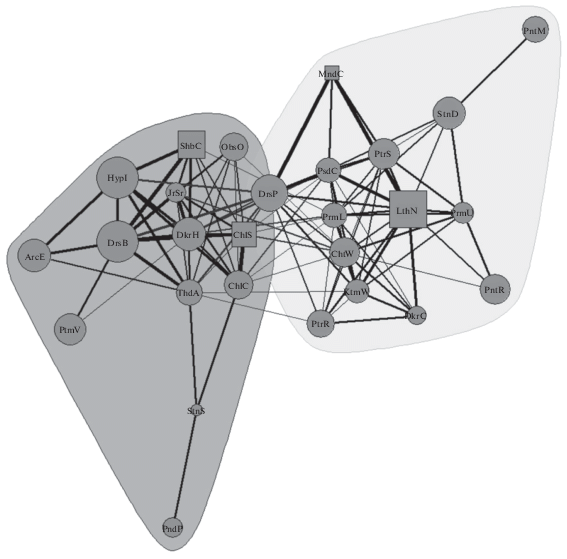
После сооружения каскада водохранилищ и заиления биотопов произошли вселение и натурализация моллюска Dreissena bugensis, изменившие абиотические и биотические условия в системе-реципиент так, что они стали благоприятными для массового развития других видов, связанных с ним консорционными отношениями, в первую очередь полихет Hypania invalida, а также пиявок Archaeobdella esmonti, амфипод Dikerogammarus haemobaphes, Shablogammarus chablensis, олигохет Potamothrix vejdovsky и изопод Jaera sarsi (см. рис. 3). Несмотря на возможную конкуренцию за пищевые ресурсы, их сосуществование обусловлено не только трофическими, но и топическими условиями [2, 4]. Раковины живых моллюсков, а также пустые раковины D. bugensis используются ракообразными в качестве убежища. Вместе с тем отмечены прочные ценотические связи между каспийскими амфиподами (Pandorites platycheir – Stenogammarus similis – Chelicorophium curvispinum), что, вероятно, подтверждает сопряженность инвазий некоторых видов в изученных водохранилищах.
Среди всех понто-каспийских и понто-азовских видов особое значение имеет моллюск Dreissena polymorpha, который играет важную роль в обоих типах сообществ и создает между ними ценотические связи. Это свидетельствует о высокой средообразующей роли моллюска для гидробионтов, что связано с экологической пластичностью вида и давностью его присутствия в волжских водохранилищах.
ЗАКЛЮЧЕНИЕ
В водохранилищах Средней и Нижней Волги выявлено 39 чужеродных видов, большинство из них (31) – понто-каспийского происхождения, 6 видов – представители понто-азовской фауны, также отмечены амфиподы байкальского комплекса Gmelinoides fasciatus и ориентальный двустворчатый моллюск Corbicula fluminea. Высокая вероятность совместного обнаружения видов одного рода или семейства среди ракообразных и моллюсков, а также прочные ценотические связи между понто-каспийскими амфиподами свидетельствуют о том, что большинство инвазий поставляет в систему-реципиент устойчивые комплексы новых видов, связанных трофическими и топическими взаимодействиями.
В водохранилищах Средней и Нижней Волги сформировалось два типа ценотических комплексов понто-каспийских и понто-азовских видов: псаммопелофильный (прибрежный) и пелофильный (профундальный). Первый тип представлен ценозом прибрежных видов (преимущественно ракообразных), связанных с каспийскими двустворчатыми моллюсками Dreissena polymorpha и понто-азовскими брюхоногими моллюсками Lithoglyphus naticoides. Таким образом, виды разных фаунистических групп могут становиться доминантами и образовывать ценотические комплексы, основанные на непрямых межвидовых отношениях (общности биотопических условий, характере питания, способах защиты от хищников). Второй тип ценотических комплексов образован в основном консорционными взаимодействиями моллюска-эдификатора Dreissena bugensis, обеспечивающего жизнедеятельность представителей разных трофических групп, c каспийскими видами полихет, пиявок, олигохет и некоторых ракообразных на глубоководных участках водоемов.
Авторы выражают искреннюю благодарность сотрудникам ИБВВ РАН д.б.н. В.И. Лазаревой и А.И. Цветкову за организацию и проведение экспедиций на волжские и камские водохранилища, к.б.н. Д.П. Карабанову– за помощь в сборе материала, к.б.н. А.А. Прокину – за ценные советы и рекомендации при написании статьи.
Работа выполнена в рамках государственного задания ФАНО России (темы № АААА-А18-118012690106-7 и АААА-А17-117112040040-3).
Список литературы
Волга и ее жизнь. Л.: Наука, 1978. 348 с.
Дрейссена Dreissena polymorpha (Pall.) (Bivalvia, Dreissenidae). Систематика, экология и практическое значение. М.: Наука, 1994. 240 с.
Зинченко Т.Д., Головатюк Л.В., Загорская Е.П., Антонов П.И. Распределение инвазионных видов в составе донных сообществ Куйбышевского водохранилища: анализ многолетних исследований // Изв. СНЦ РАН. 2007. Т. 10. № 2. С. 547−558.
Мордухай-Болтовской Ф.Д. Каспийская фауна в Азово-Черноморском бассейне. М.; Л.: Изд-во АН СССР, 1960. 288 с.
Dennert H.G. Tolerance differences and interspecific competition in three members of the amphipod genus Gammarus // Bijdragen tot de Dierkund. 1974. Bd 44. Ht 1. P. 83−99.
Van den Brink F.W.B., Paffen B.G.P., Oosterbroek F.M.J., Van der Velde G. Immigration of Echinogammarus ischnus (Stebbing, 1899) (Crustacea: Amphipoda) into the Netherlands via the Lower Rhine // Bulleten Zoölogisch Museum Universiteit van Amsterdam. 1993. V. 13. P. 167−170.
Holdich D.M., Pöckl M. Invasive crustaceans in European inland waters // Biol. invaders in inland waters: Profiles, distribution and threats. Springer, 2007. P. 29−75.
Grabowskyi M., Bącela K., Konopacka A. How to be an invasive gammarid (Amphipoda: Gammaroidea) – comparison of life history traits // Hydrobiologia. 2007. V. 590. P. 75−84.
Курина Е.М. Чужеродные виды амфипод (Amphipoda, Gammaridea) в составе донных сообществ Куйбышевского и Саратовского водохранилищ: особенности распространения и стратегий жизненных циклов // Росс. журн. биол. инвазий. 2017. № 2. С. 69−80.
Руководство по гидробиологическому мониторингу пресноводных экосистем. СПб.: Гидрометеоиздат, 1992. 318 с.
Баканов А.И. Использование зообентоса для мониторинга пресноводных водоемов // Биол. внутр. вод. 2000. № 1. С. 68−83.
Stone L., Roberts A. The checkerboard score and species destributions // Oeciologia. 1990. V. 85. P. 74−79.
Шитиков В.К., Зинченко Т.Д., Розенберг Г.С. Макроэкология речных сообществ: концепции, методы, модели. Тольятти: Кассандра, 2012. 100 с.
Gotelli N.J. Null model analysis of species co-occurrence patterns // Ecology. 2000. V. 81. P. 2606−2621.
Шитиков В.К., Розенберг Г.С., Крамаренко С.С., Якимов В.Н. Современные подходы к статистическому анализу экспериментальных данных // Проблемы экологического эксперимента (Планирование и анализ наблюдений). Тольятти: СамНЦ РАН; Кассандра, 2008. С. 212−250.
Kamada T., Kawai S. An algorithm for drawing general undirected graphs // Information Processing Letters, Elsevier. 1989. V. 31 (1). P. 7−15.
Blondel V.D., Guillaume J.-L., Lambiotte R., Lefebvre E. Fast unfolding of communities in large networks // J. Stat. Mech. 2008. № 10. P.1−12.
Березина Н.А., Панов В.Е. Вселение байкальской амфиподы Gmelinoides fasciatus (Amphipoda, Crustacea) в Онежское озеро // Зоол. журн. 2003. Т. 82. № 6. С. 731−734.
Львова А.А., Извекова Э.И., Соколова Н.Ю. Роль донных организмов в трансформации органического вещества и в процессах самоочищения водоемов // Бентос Учинского водохранилища. М.: Наука, 1980. С. 171−177.
Шашуловский В.А., Мосияш С.С. Формирование биологических ресурсов Волгоградского водохранилища в ходе сукцессии его экосистемы. М.: Тов. науч. изд. КМК, 2010. 250 с.
Буторин Н.В., Успенский С.М. Значение мелководий в биологической продуктивности в водохранилищах // Биологические ресурсы водохранилищ. М.: Наука, 1984. С. 23−41.
Hanselmann A.J. Katamysis warpachowskyi Sars, 1877 (Crustacea, Mysida) invaded Lake Constance // Aquatic invasions. 2010. V. 5. № 1. P. 31−34.
Монаков А.В. Питание пресноводных беспозвоночных. М.: Ин-т проблем экологии и эволюции РАН им. А.Н. Северцова, 1998. 319 с.
Беклемишев В.Н. О классификации биоценологических (симфизиологических) связей // Бюлл. МОИП. Отд. биол. 1951. Т. 56. № 5. С. 3−30.
Анненкова Н.П. Определители организмов пресных вод СССР. Пресноводная фауна. Вып. 2. Пресноводные и солоноватоводные полихеты СССР. Л.: Наука, 1930. 48 с.
Плигин Ю.В., Емельянова Л.В. Итоги акклиматизации беспозвоночных Каспийской фауны в Днепре и его водохранилищах // Гидробиол. журн. 1989. Т. 25. № 1. С. 3−11.
Kurashov E.A., Telesh I.V., Panov V.E. et al. Invertebrate communities associated with macrophytes in Lake Ladoga: effects of environmental factors // Hydrobiologia. 1996. V. 322. P. 49−55.
Набоженко М.В., Набоженко С.В. Corbicula fluminalis (O.F. Muller, 1774) – новый для российского сектора каспийского бассейна вид двустворчатых моллюсков // Вестн. Южного научного центра. 2016. Т. 12. № 1. С. 61−64.
Об обнаружении нового для бассейна Нижнего Дона двустворчатого моллюска // [Электронный ресурс]. URL: http://azniirkh.ru/novosti/ob-obnaruzhenii-novogo-dlya-basseyna-nizhnego-dona-dvustvorchatogo-mollyuska/ (дата обращения: 29.01.2017).
Дополнительные материалы отсутствуют.