Экология, 2019, № 1, стр. 15-21
Генетическое разнообразие однолетних ксеро-галофитов сем. Chenopodiaceae по градиентам влажности и засоления
Е. В. Шуйская a, *, З. Ф. Рахманкулова a, Я. Т. Суюндуков b
a Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35,
Россия,
b Сибайский филиал Государственного автономного научного учреждения
Институт стратегических исследований Республики Башкортостан
453830 Сибай, ул. К. Цеткин, 2, Россия,
* E-mail: evshuya@mail.ru
Поступила в редакцию 26.02.2018
После доработки 03.05.2018
Принята к публикации 30.04.2018
Аннотация
Изучен генетический полиморфизм в популяциях двух однолетних ксеро-галофитов сем. Chenopodiaceae – Atriplex tatarica и Sedobassia sedoides, произрастающих на почвах с разным уровнем влажности и содержания ионов натрия и калия. Обнаружена тенденция снижения процента полиморфных локусов у A. tatarica по мере увеличения засоления почвы и повышение уровня наблюдаемой гетерозиготности в популяциях S. sedoides с ростом содержания калия в почве. Связи между параметрами генетической изменчивости и влажностью почвы у изученных видов не наблюдалось. Дефицит калия является стрессовым фактором как на физиологическом, так и на популяционно-генетическом уровнях для S. sedoides. Механизмы контроля поглощения натрия и стабильности ионного гомеостаза, а также высокий уровень гомозиготности указывают на усиление черт стрессустойчивости у данного однолетника.
Генетическое разнообразие популяции определяет ее устойчивость, способность к адаптации и возможность выживания в изменяющихся условиях среды. Существует немало примеров влияния изменчивости окружающей среды на генетическое разнообразие и генетическую дифференциацию популяций [1–4]. В различных условиях окружающей среды локальные стрессовые факторы могут “корректировать” основную геномную структуру, тем самым способствуя местной адаптации. Степень локальной адаптации во многом определяется взаимодействием между отбором и потоком генов между популяциями по экологическим градиентам [5, 6]. Как известно, уровень доступной воды в почве и ее содержание в тканях растений зависят от количества ионов натрия и калия в почве и их аккумуляции растениями. Высокие концентрации солей в почве нарушают гомеостаз водного потенциала и распределения ионов как на клеточном уровне, так и на уровне целого растения [7].
Разные виды ксеро-галофитов и галофитов отличаются по способности и динамике накопления соли в надземной части растений [8, 9]. В результате проведенных нами ранее исследований ксеро-галофитов сем. Chenopodiaceae в естественных условиях обитания выявлены различные биохимические протекторные стратегии солеустойчивости. К первой группе можно отнести галофиты с зависимым от содержания натрия в почве соленакоплением в побегах (Atriplex tatarica). Для данной группы характерно значительное накопление пролина, особенно у интенсивно растущих растений, т.е. обитающих в относительно благоприятных условиях. Ко второй группе относятся растения с независимым от почвенного засоления накоплением соли в побегах (Sedobassia sedoides), т.е. способных аккумулировать ионы Na+ даже при небольшом засолении и поддерживать их стабильную концентрацию в растениях. У данного вида наблюдалось сравнительно высокое общее содержание флавоноидов в побегах, которое положительно коррелировало с количеством ионов калия в тканях [7]. Оба однолетние виды произрастают на умеренно засоленной и сухой почве и характеризуются наибольшими различиями в накоплении биомассы (до 10 раз) в оптимальных и пессимальных местах обитания, что свидетельствует о рудеральной стратегии адаптации данных видов. Влияние таких локальных экологических стрессов, как дефицит воды и засоление почвы, на разнообразие и структуру популяции ксеро-галофитов до сих пор изучено недостаточно.
Цель данной работы – изучение влияния почвенных свойств (влажности почвы, содержания ионов натрия и калия) на популяционно-генетические характеристики (внутри- и межпопуляционный полиморфизм) двух однолетних ксеро-галофитов – Atriplex tatarica и Sedobassia sedoides (Chenopodiaceae) с разными стратегиями соленакопления (солеустойчивости).
МАТЕРИАЛ И МЕТОДЫ
Для исследования были выбраны два типичных однолетних ксеро-галофита сем. Chenopodiaceae: лебеда татарская Atriplex tatarica L. (синонимы A. laciniata L., A. sinuata Hoffmn, A. veneta Wild.), однолетний факультативный галофит, ксерофит [10], рудерал, космополит с С4 НАД-МЭ типом фотосинтеза [11], перекрестно-ветроопыляемое растение, число хромосом 2n = 18, 36 [12]; бассия очитковидная Sedobassia sedoides (Pall.) Aschers. (синоним Bassia sedoides, Echinopsilon sedoides), однолетний факультативный галофит, ксерофит, кормовое растение, тип фотосинтеза промежуточный – С3-С4 НАДФ-МЭ [13], перекрестно-ветроопыляемое растение, число хромосом 2n = 18 [14].
Растительный материал был собран в 8 популяциях Atriplex tatarica и Sedobassia sedoides (Chenopodiaceae) на участках с разным уровнем содержания ионов натрия, калия и влажности почвы на территории Южного Урала (табл. 1).
Таблица 1.
Координаты, характеристика растительных сообществ и водно-солевой режим почвы в местах произрастания Atriplex tatarica и Sedobassia sedoides
| № попу-ляции | Координаты популяций | Классы растительных сообществ | Доля вида в сообществе, % | Влажность почвы, % | Содержание Na+ в почве, ммоль/г | Содержание K+ в почве, ммоль/г |
|---|---|---|---|---|---|---|
| Atriplex tatarica | ||||||
| 1 | N 52°09.897′ E 58°32.522′ |
Рolygono-Artemisietea austriacae | 50 (доминант) | 4.5 ± 0.5 | 0.023 ± 0.001 | 0.0011 ± 0.0001 |
| 2 | N 52°09.897′ E 58°32.522′ |
Рolygono-Artemisietea austriacae | 40 (доминант) | 1.2 ± 0.4 | 0.035 ± 0.014 | 0.0011 ± 0.0001 |
| 3 | N 51°51.218′ E 58°13.646′ |
Рolygono-Artemisietea austriacae | 40 (доминант) | 10.3 ± 0.4 | 0.006 ± 0.001 | 0.0062 ± 0.0014 |
| Sedobassia sedoides | ||||||
| 4 | N 52°00.891′ E 58°26.690′ |
Halimiono verruciferae-Puccinellietum tenuissimae | ед. | 7.1 ± 1.4 | 0.019 ± 0.005 | 0.0014 ± 0.0002 |
| 5 | N 52°00.891′ E 58°26.690′ |
Festuco-Puccinellietea | <10 | 11.7 ± 3.0 | 0.071 ± 0.023 | 0.0025 ± 0.0003 |
| 6 | N 52°01.186′ E 58°28.179′ |
Festuco-Puccinellietea | 30 (доминант) | 6.4 ± 0.7 | 0.134 ± 0.044 | 0.0047 ± 0.0010 |
| 7 | N 52°09.897′ E 58°32.522′ |
Рolygono-Artemisietea austriacae | 10 | 4.5 ± 0.5 | 0.023 ± 0.001 | 0.0011 ± 0.0001 |
| 8 | N 51°56.848′ E 58°23.344′ |
Festuco-Puccinellietea | <10 | 3.0 ± 1.3 | 0.090 ± 0.077 | 0.0101 ± 0.0045 |
Семена и надземные части растений A. tatarica были собраны в трех популяциях из растительных сообществ № 1, 2 и 3, в которых изученный вид доминировал (см. табл. 1). Данные сообщества, возможно, представляют одну из последних стадий деградации степных пастбищ, так как в их сложении большую роль играют виды класса Рolygono-Artemisietea austriacae. Доля A. tatarica в составе сообществ соответствовала 40–50%, количество растений в популяциях >100.
Семена и надземные части растений S. sedoides были собраны в пяти популяциях из растительных сообществ № 4–8. Вид доминировал (доля в составе сообщества 30%, количество растений в популяции >100) только в одном растительном сообществе (№ 6), которое относится к присельным территориям и подвергается выпасу. В его сложении также участвуют виды соленых почв класса Festuco-Puccinellietea. В составе двух других растительных сообществ (№ 5, 8) класса Festuco-Puccinellietea доля S. sedoides была <10%. В растительном сообществе с доминированием A. tatarica (класс Рolygono-Artemisietea austriacae) доля S. sedoides была равна 10%. Размеры популяций S. sedoides в данных растительных сообществах составили 50–100 особей. В растительном сообществе с доминированием Halimione verrucifera (№ 4) на влажных солончаках встречались только единичные растения S. sedoides (15 растений в популяции).
Уровень содержания ионов натрия (Na+) и калия (K+) в верхнем горизонте (0–20 см) почвы и надземной биомассе растений (листья, зеленые побеги) определяли в водной вытяжке пробы (100 мг) на атомно-абсорбционном спектрометре (Hitachi 207, Japan), для измерения влажности почвы пробы высушивали сутки при 105°C.
Материалом для исследований послужили семена, собранные с 10–25 отдельных растений каждой популяции. Для анализа семена замачивали в воде в течение 12 ч до набухания, затем для экстракции ферментов зародыши гомогенизировали в 80 мкл буфера: EDTA, KCl, MgCl2, TRITON, PVP, Трис-HCl. Разделение энзимов проводили в 10%-ном крахмальном геле с использованием двух буферных систем [15]: 1) электродный буфер – Трис, лимонная кислота, pH 8.0; гелевый буфер – 10 мл электродного буфера, 90 мл Н2О, pH 8.0; 2) электродный буфер – борная кислота, NaOH, pH 8.2; гелевый буфер – Трис, лимонная кислота, pH 8.7. Электрофорез проводили в течение 4–6 ч при следующих условиях: 1) буферная система – 90 В, 40–50 мА; 2) буферная система – 210 В, 70–80 мА при температуре 5°С. Анализировали 8 ферментов: глутамат-оксалоацетаттрансаминаза (GOT, E.C. 2.6.1.1), диафораза (DIA, E.C. 1.6.99), глутаматдегидрогеназа (GDH, E.C. 1.4.1.2), супероксиддисмутаза (SOD, 1.15.1.1), глюкозо-6-фосфатдегидрогеназа (G6PD, E.C. 1.1.1.49), 6-фосфогюконатдегидрогеназа (6PGD, 1.1.1.44), малатдегидрогеназа (MDH, 1.1.1.37), малик энзим (Me, 1.1.1.40). Гистохимическое окрашивание ферментов и генетическую интерпретацию осуществляли по методу Гончаренко с соавт. [16] с некоторыми модификациями. На гелях с образцами A. tatarica не было замечено зимограмм (по димерным белкам), характерных для тетраплоидных организмов, поэтому генетическую интерпретацию проводили как для диплоидных растений. Для оценки уровня генетической изменчивости рассчитывали следующие показатели: долю полиморфных локусов (Р), среднее число аллелей на локус (А), среднюю наблюдаемую (Но) и ожидаемую (Не) гетерозиготности. Для анализа структуры популяций и потока генов использовали коэффициенты F-статистики Райта (Fis, Fit, Fst) и Nm [17] в программе POPGENE 1.32 [18].
РЕЗУЛЬТАТЫ
Нами был изучен генетический полиморфизм в популяциях двух однолетних ксеро-галофитов сем. Chenopodiaceae (Atriplex tatarica и Sedobassia sedoides), произрастающих на почвах с разным уровнем влажности и содержания ионов натрия и калия (см. табл. 1). На исследуемой территории влажность почвы была очень низкой и не превышала 12%. Содержание натрия в почве колебалось в больших пределах – от 0.01 до 0.13 ммоль/г, калия было в 10 раз меньше (0.001–0.010 ммоль/г).
В данных условиях A. tatarica характеризуется наибольшим генетическим полиморфизмом (Р = = 64.1%, He = 24.7%, Ho = 7.8%) среди изученных видов (табл. 2). Однако уровень наблюдаемой гетерозиготности почти в 3 раза ниже уровня ожидаемой гетерозиготности, что указывает на значительный дефицит гетерозигот в популяциях (Fit = 0.703). При этом наибольший полиморфизм обнаружен внутри популяций, и только 7.8% (Fst) генетической изменчивости приходится на изменчивость между популяциями. Для популяций S. sedoides характерны меньший генетический полиморфизм (Р = 10%, He = 2.7%, Ho = 0.3%) и больший (94%) дефицит гетерозигот. При этом наблюдается значительная дифференциация популяций – почти 50% общей изменчивости приходится на изменчивость между популяциями – при слабом потоке генов (Nm < 1).
Таблица 2.
Генетические параметры видов Atriplex tatarica и Sedobassia sedoides
| Параметры | A. tatarica | S. sedoides |
|---|---|---|
| Процент полиморфных локусов (P, %) | 64.10 ± 11.72 | 10.00 ± 10.82 |
| Среднее число аллелей на локус (A) | 1.85 ± 0.08 | 1.16 ± 0.16 |
| Наблюдаемая гетерозиготность (Ho, %) | 7.80 ± 2.72 | 0.30 ± 0.41 |
| Ожидаемая гетерозиготность (He, %) | 24.70 ± 4.11 | 2.70 ± 3.15 |
| Коэффициент инбридинга особи относительно субпопуляции (Fis) | 0.678 | 0.882 |
| Коэффициент инбридинга особи относительно целой популяции (Fit) | 0.703 | 0.939 |
| Показатель локальной подразделенности (Fst) | 0.078 | 0.488 |
| Поток генов (Nm) | 2.944 | 0.263 |
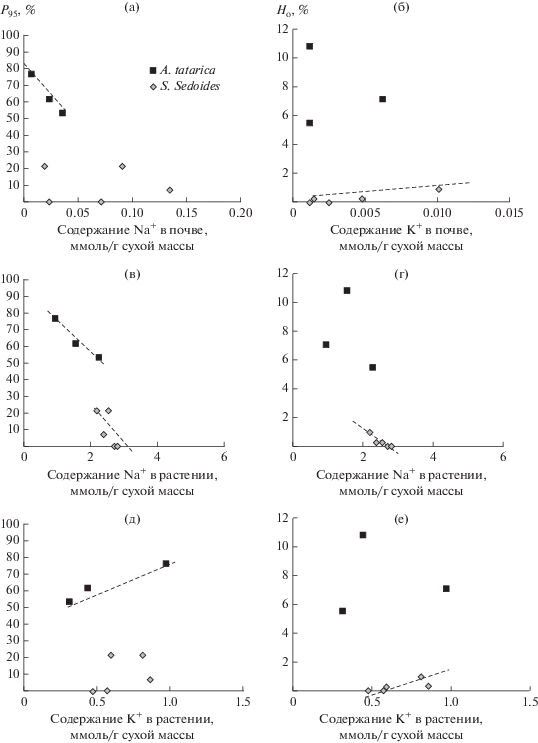
Анализ генетического разнообразия изученных видов по эдафическим градиентам – влажность почвы, содержание натрия и калия в почве – показал снижение процента полиморфных локусов у A. tatarica по мере увеличения засоления почвы (см. рис. 1а) и рост уровня наблюдаемой гетерозиготности в популяциях S. sedoides с повышением содержания калия в почве (см. рис. 1б). Связь между параметрами генетической изменчивости и влажностью почвы у изученных видов не наблюдалась.
Так как основным механизмом солеустойчивости (поддержание осмотического потенциала) изученных видов является накопление ионов натрия в тканях, мы проанализировали взаимосвязь уровня генетической изменчивости семян и содержания ионов натрия (как основного осмолита и, если в избытке, токсического иона) и калия (как жизненно важного иона) в материнских растениях. Оказалось, что оба однолетних вида – A. tatarica и S. sedoides – при избытке натрия в тканях формируют семена с меньшим процентом полиморфных локусов (см. рис. 1в) и меньшим уровнем наблюдаемой гетерозиготности в случае S. sedoides (см. рис. 1г). Также у обоих однолетников наблюдается рост генетической изменчивости семян (Р – у A. tatarica и Ho – у S. sedoides) с увеличением аккумуляции калия материнскими растениями (см. рис. 1д, 1е).
ОБСУЖДЕНИЕ
Популяционно-генетический анализ двух однолетних ксеро-галофитов сем. Chenopodiaceae показал, что популяции Atriplex tatarica высоко полиморфны, но слабо дифференцированы, что не характерно для однолетних видов [19], и в то же время имеют сходство с европейскими популяциями A. tatarica [20]. Значительный поток генов (Nm > 1.0) между популяциями уравновешивает дрейф генов [17]. Популяции второго однолетника S. sedoides, произрастающего в схожих условиях, наоборот, слабо полиморфны, но сильно дифференцированы, что более характерно для однолетних видов. В популяциях обоих видов наблюдается значительное отклонение от равновесия Харди-Вайнберга в сторону дефицита гетерозигот (70–94%), что не свойственно для перекрестно-ветроопыляемых видов и может свидетельствовать о давлении сильного стресса и, следовательно, действии отбора в пользу гомозигот, лучше адаптированных к экстремальным условиям [21].
Для всех галофитов необходим определенный уровень засоления почвы для оптимального роста. Изученные виды встречаются при различном диапазоне засоления: A. tatarica менее солеустойчивый вид и выдерживает небольшие концентрации натрия (0.01–0.04 ммоль/г почвы) в почве, тогда как S. sedoides встречается при большем диапазоне содержания натрия (0.02–0.13 ммоль/г почвы) (табл. 3). Разные виды галофитов отличаются по способности и динамике накопления соли в надземной части растений [8, 9]. Ранее нами [7] было показано, что A. tatarica характеризуется зависимым от содержания натрия в почве соленакоплением. С этим согласуется выявленное снижение доли полиморфных локусов как при увеличении засоления почвы, так и при усилении аккумуляции натрия в тканях растений (см. рис. 1а, 1в).
Таблица 3.
Эдафические, популяционно-генетические, физиологические и экологические характеристики видов Atriplex tatarica и Sedobassia sedoides
| Условия и параметры | A. tatarica | S. sedoides |
|---|---|---|
| Почвенные условия: | ||
| влажность, % | 1.2–10.4 | 3.0–11.7 |
| содержание* Na+ | 0.01–0.04 | 0.02–0.13 |
| содержание K+ | 0.001–0.006 | 0.001–0.010 |
| Физиологические параметры: | ||
| содержание Na+ в побегах, в скобках CV (%)** | 0.93–2.27 (43) | 2.20–2.82 (10) |
| содержание K+ в побегах, в скобках CV (%) |
0.31–0.97 (61) | 0.47–0.86 (25) |
| Na+/K+, в скобках CV (%) | 0.96–7.3 (82) | 2.7–6.0 (34) |
| K+ + Na+, в скобках CV (%) | 1.9–2.6 (17) | 3.01–3.29 (4) |
| Механизм соленакопления***: | Зависимый | Независимый |
| диапазон аккумуляции ионов | Широкий | Узкий |
| сумма поглощенных ионов | Непостоянная | Постоянная |
| отношение Na+/K+ | Нестабильное | Стабильное |
| чувствительность | К количеству Na+ | К количеству K+ |
| Популяционно-генетические параметры: | ||
| уровень полиморфизма | Высокий | Низкий |
| уровень изоляции популяций | Низкий | Высокий |
| поток генов | Высокий | Низкий |
| Эдафический фактор, влияющий на полиморфизм | Избыток Na+ на уровень Р95 | Дефицит К+ на гетерозиготность |
| Экологические характеристики: | ||
| адаптивный потенциал | Высокий | Низкий |
| стрессовый фактор | — | Дефицит К+ |
| стратегия адаптации | Рудерал, космополит | Рудерал, стресстолерант |
Как известно, ионы натрия не только играют роль основного осмолита, но в больших количествах оказывают токсическое действие на растение в целом, что может отражаться на репродуктивной сфере и формировании семян [22]. В целом для A. tatarica характерен широкий диапазон аккумуляции ионов натрия и калия (коэффициент вариации (CV) = 43–61%) и нестабильное отношение Nа+/K+ (CV = 82%) (см. табл. 3), что свидетельствует о слабой солеустойчивости. Уменьшение доли полиморфных локусов у A. tatarica по градиенту засоления, возможно, также связано с функциональной ролью некоторых изоферментов при токсическом действии натрия на растение. Данное уменьшение наблюдается за счет локусов, кодирующих ферменты глутаматдегидрогеназу (GDH) и глюкозо-6-фосфатдегидрогеназу (G6PD), занимающих ключевые позиции в функционировании и регуляции дыхательного метаболизма в норме и при адаптации к стрессу [23]. Эти ферменты связаны с регуляторными точками двух основных дыхательных путей: дихотомического (гликолиз, цикл трикарбоновых кислот (ЦТК)) и апотомического – окислительного пентозофосфатного пути (ОПФП). Ключевым ферментом ОПФП является G-6-PD, катализирующий первый окислительный, необратимый этап этого цикла, на котором поток метаболитов перераспределяется и может быть направлен по гликолитическому окислительному пути [24]. GDH катализирует реакцию восстановления α-кетоглутарата до L-глутамата (в ЦТК), из которого может образоваться целый спектр аминокислот, в том числе пролин, который играет важную роль при засухе и засолении [25]. У A. tatarica пролин накапливается в значительном количестве и выполняет антиоксидантную функцию [7].
У S. sedoides имеются специфические механизмы, обеспечивающие накопление соли в растениях независимо от уровня засоления почвы [7]. Возможно, поэтому не обнаружено связи между уровнем засоления почвы и уровнем генетического полиморфизма. Для этого вида найдены корреляции только между уровнем генетического полиморфизма и содержанием ионов натрия в тканях растений (см. рис. 1в, 1г). Очень низкий уровень гетерозиготности свидетельствует о том, что у S. sedoides преобладают определенные гомозиготные генотипы, адаптированные к специфичным условиям обитания, в частности по натриево-калиевому балансу, и, вероятно, связанные с механизмом поддержания ионного гомеостаза в тканях растений. Растения S. sedoides способны поддерживать относительно постоянное отношение Na+/K+ и сумму ионов Na+ + K+ при узком диапазоне накопления данных ионов (см. табл. 3.) независимо от уровня засоления почвы. При этом наблюдается ограничение аккумуляции ионов калия, а его дефицит в почве может приводить к снижению роста (продуктивности) [7]. О стрессовости дефицита калия для S. sedoides свидетельствует и снижение уровня гетерозиготности в его популяциях (см. рис. 1б, 1е).
Таким образом, в результате изучения генетического полиморфизма в популяциях двух однолетних ксеро-галофитов сем. Chenopodiaceae – Atriplex tatarica и Sedobassia sedoides, произрастающих на почвах с разным уровнем влажности и содержания ионов натрия и калия и характеризующихся разными стратегиями соленакопления, обнаружено снижение процента полиморфных локусов у A. tatarica по мере увеличения засоления почвы и увеличение уровня наблюдаемой гетерозиготности в популяциях S. sedoides с повышением содержания калия в почве. Связь между параметрами генетической изменчивости и влажностью почвы у изученных видов не наблюдалась. Оба однолетних вида при увеличении содержания натрия и уменьшении количества калия в тканях формируют семена с меньшим процентом полиморфных локусов и меньшим уровнем наблюдаемой гетерозиготности в случае S. sedoides. Причиной низкого уровня генетической изменчивости S. sedoides в популяциях может быть возможность (преобладание) самоопыления, однако отсутствие связи между параметрами генетической изменчивости и плотностью популяций это не подтверждает.
Мы предполагаем, что больший уровень гетерозиготности и слабая дифференциация популяций A. tatarica могут свидетельствовать о большем адаптивном потенциале данного вида по сравнению с S. sedoides, а отсутствие связи с изученными эдафическими факторами указывает на то, что данные условия обитания не являются стрессовыми для A. tatarica. Отсутствие каких-либо связей популяционно-генетических параметров S. sedoides с уровнем засоления почвы, возможно, является результатом эффективной защиты от токсичного действия ионов натрия благодаря механизму, поддерживающему относительно постоянное содержание ионов натрия в тканях растений. В то же время дефицит калия является стрессовым фактором как на физиологическом, так и на популяционно-генетическом уровнях для данного вида. Механизмы контроля поглощения натрия и стабильности ионного гомеостаза, а также высокий уровень гомозиготности указывают на усиление черт стрессустойчивости у данного однолетника.
Рис. 1.
Генетическое разнообразие двух однолетних ксеро-галофитов сем. Chenopodiaceae по градиентам содержания ионов натрия (а) и калия (б) в почве, натрия (в, г) и калия (д, е) в тканях растений.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 17-04-00853-а).
Список литературы
Prentice H.C., Lonn M., Lefkovitch L.P., Runyeon H. Associations between allele frequencies in Festuca ovina and habitat variation in the alvar grass-lands on the Baltic island of Oland // J. of Ecology. 1995. V. 83. P. 391–401.
Prentice H.C., Lonn M., Lager H. et al. Changes in allozyme frequencies in Festuca ovina populations after a 9‑year nutrient/water experiment // J. of Ecology. 2000. V. 88. P. 331–347.
Linhart Y.B., Grant M.C. Evolutionary significance of local genetic differentiation in plants // Annual review of Ecology and Systematics. 1996. V. 27. P. 237–277.
Odat N., Jetschke G., Hellwig F.H. Genetic diversity of Ranunculus acris L. (Ranunculaceae) populations in relation to species diversity and habitat type in grassland communities // Molecular Ecology. 2004. V. 13. P. 1251–1257.
Lenormand T. Gene flow and the limits to natural Selection // TRENDS in Ecology & Evolution. 2002. V. 17. № 4 April.
Forester B.R., Jones M.R., Joost S. et al. Detecting spatial genetic signatures of local adaptation in heterogeneous landscapes // Molecular Ecology. 2016. V. 25. P. 104–120.
Рахманкулова З.Ф., Шуйская Е.В., Щербаков А.В. и др. Содержание пролина и флавоноидов в побегах галофитов, произрастающих на территории Южного Урала // Физиология растений. 2015. Т. 62. № 1. С. 79–88.
Flowers T., Colmer T. Salinity tolerance in halophytes // New Phytol. 2008. V. 179. P. 945–963.
Aslam R., Bostan N., Nabgha-e-Amen Maria M., Safdar W. A critical review on halophytes: salt tolerant plants // J. Med. Plants Res. 2011. V. 5. P. 7108–7118.
Fan Y., Li P.F., Hou Z.A. et al. Water adaptive traits of deep-rooted C3 halophyte (Karelinia caspica (Pall.) Less.) and shallow-rooted C4 halophyte (Atriplex tatarica L.) in an arid region, Northwest China // J. of Arid Land. 2012. V. 4. P. 469−478.
Osmond C.B., Björkman O., Anderson D.J. Physiological processes in plant ecology: toward a synthesis with Atriplex. Berlin; New York: Springer-Verlag, 1980. 463 p.
Ломоносова М.Н., Красников А.А. Числа хромосом представителей рода Atriplex (Chenopodiaceae) // Ботан. журн. 1992. Т. 77. № 6. С. 99.
Kadereit G., Freitag H. Molecular phylogeny of Camphorosmeae (Camphorosmioideae, Chenopodiaceae): Implications for biogeography, evolution of C4-photosynthesis and taxonomy // Taxon. 2011. V. 60. № 1. P. 51–78.
Хромосомные числа цветковых растений / Под ред. Федорова Ан.А. Л.: Наука, 1969. 926 с.
Muona O., Szmidt A. A multilocus study of natural populations of Pinus sylvestris // Population genetics in forestry. Lecture Notes in Biomathematics. 1985. V. 60. P. 226–240.
Гончаренко Г.Г., Падутов В.Е., Потенко В.В. Руководство по исследованию хвойных видов методом электрофоретического анализа изоферментов. Гомель, 1989. 150 с.
Wright S. Evolution and the genetics of populations. Chicago: Univ. Chicago Press, 1984. 511 p.
Yeh F.C., Yang R.C., Boyle T. POPGEN, version 1.32. Microsoft Windows-based freeware for population genetic analysis. Edmonton: University of Alberta/CIFOR, 1999.
Hamrick J.L., Godt M.J.W. Allozyme diversity in plant species // Plant Population Genetics, Breeding and Genetic Resources. Brown A.H.D., Clegg M.T., Kahler A.L., Weir B.S. Eds. Sinauer, Sunderland, MA, 1989. P. 43–63.
Mandak B., Bimova K., Plackova I. et al. Loss of Genetic Variation in Geographically Marginal Populations of Atriplex tatarica (Chenopodiaceae) // Annals of Botany. 2005. V. 96. P. 901–912.
Алтухов Ю.П. Генетические процессы в популяциях. М.: ИКЦ “Академкнига”, 2003. 431 с.
Шамров И.И. Семязачаток цветковых растений: строение, функции, происхождение. М.: Тов. науч. изд. КМК, 2008. 348 с.
Рахманкулова З.Ф., Шуйская Е.В., Рогожникова Е.С. Влияние дефицита воды на функции митохондрий и полиморфизм ферментов дыхания у растений // Журн. общ. биол. 2013. № 3. С. 167–179.
Esposito S., Guerrieo G., Vona V. et al. Glucose-6P dehydrogenase in chlorella sorokiniana (211/8k): an enzyme with unusual characteristics // Planta. 2006. V. 223. P. 796–804.
Kavi Kishor P.B., Sangam S., Amrutha R.N. et al. Regulation of proline biosynthesis, degradation, uptake and transport in higher plants: Its implications in plant growth and abiotic stress tolerance // Curr. Sci. 2005. V. 88. P. 424–438.
Дополнительные материалы отсутствуют.


