Экология, 2019, № 2, стр. 133-148
Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода
Е. Л. Воробейчик a, *, А. И. Ермаков a, М. Е. Гребенников a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: ev@ipae.uran.ru
Поступила в редакцию 16.08.2018
После доработки 23.08.2018
Принята к публикации 20.08.2018
Аннотация
Анализ естественного восстановления сообществ, инициированного прекращением промышленных выбросов, важен для понимания их устойчивости. Однако очевиден дефицит прямых наблюдений за ходом такого восстановления, в частности для крупных почвенных беспозвоночных отсутствуют прямые сравнения состояния сообществ до и после сокращения выбросов. Нами изучена структура сообществ почвенной мезофауны (на уровне надвидовых таксонов) елово-пихтовых лесов (южная тайга) в районе воздействия атмосферных выбросов Среднеуральского медеплавильного завода (г. Ревда, Свердловская обл.). Сравнивали три периода – высоких (1990–1991 гг.), сниженных (2004 г.) и почти прекратившихся (2014–2016 гг.) выбросов. Проверяли гипотезу об отсутствии быстрого восстановления сообществ, которая частично подтвердилась. С одной стороны, за прошедшие 25 лет на качественном уровне реакция педобионтов на загрязнение не претерпела принципиальных изменений: в каждый из трех периодов при приближении к заводу резко уменьшается общее обилие (за счет большинства групп), доминирование сапрофагов сменяется преобладанием фито- и зоофагов. С другой стороны, в последний период заметны признаки восстановления: увеличилось обилие педобионтов на загрязненных участках, ближе к заводу продвинулись чувствительные к загрязнению группы – дождевые черви, энхитреиды, моллюски. Восстановление, скорее всего, вызвано уменьшением токсичности металлов из-за нормализации кислотности почвы. Быстрая реколонизация ранее дефаунированной территории может быть связана с существованием на ней микросайтов с более благоприятными условиями по сравнению с окружающими пространствами, которые позволяют малоподвижным формам выживать за границами основной области их распространения.
В лесных экосистемах крупные почвенные беспозвоночные определяют скорость биологического круговорота и обеспеченность растений биогенами, формируют структуру почвы, тем самым влияют на ее водный режим и плодородие, модифицируют состав почвенных микроорганизмов [1]. Учитывая столь значительную роль этой группы, оправданы предложения о включении показателей ее состояния в системы экологического мониторинга [2] и контроля загрязнения среды [3].
Различные поллютанты отрицательно действуют на крупных почвенных беспозвоночных [4]. Особенно губительно загрязнение почвы тяжелыми металлами в результате деятельности предприятий цветной металлургии: некоторые группы либо исчезают, либо сильно уменьшается их численность, что кардинально трансформирует структуру сообществ [5–11]. Такие перестройки ведут к торможению деструкции органического вещества и замедлению биологического круговорота [12], разрушению почвенных агрегатов [12, 13], элиминации млекопитающих, трофически связанных с крупными беспозвоночными [14], дисбалансу элементов минерального питания у растений [15] и птиц [16].
Сокращение промышленных выбросов из-за закрытия или реконструкции металлургических предприятий, происходящее в последнее время во многих странах [17], теоретически должно положительно сказываться на почвенной фауне. Однако крайне мало работ, в которых исследовано восстановление сообществ педобионтов после такого сокращения [10, 18, 19]. Более того, заключения о динамике сообществ в них сделаны не на основе прямых наблюдений, а либо с привлечением материалов других авторов [10], либо путем замены анализа временных рядов пространственными [19]. В ряде случаев почвенных беспозвоночных исследовали возле давно закрытых заводов, но вне связи с восстановительной динамикой [8, 20, 21]. Более подробно изучены изменения при естественном зарастании или рекультивации промышленных отвалов и заброшенных шахт [22–25]. Однако эти материалы характеризуют закономерности протекания первичных сукцессий и поэтому имеют лишь косвенное отношение к обсуждаемой теме, причем только для крайних стадий деградации экосистем – техногенных пустошей. Скудность информации о закономерностях восстановления почвенной фауны при сокращении промышленных выбросов определяет актуальность работ в этом направлении.
Рассматриваемый нами район, подверженный воздействию атмосферных выбросов медеплавильного завода, удобен для изучения восстановления сообществ педобионтов по нескольким причинам. Во-первых, многолетнее (более 75 лет) загрязнение сформировало здесь мощную геохимическую аномалию, в центре которой концентрации металлов превышают фоновые уровни на несколько порядков [26]. Это привело к катастрофическим последствиям для биоты [27], а контрастность реакций на загрязнение упрощает их изучение. Во-вторых, в течение последних десятилетий поступление поллютантов постепенно уменьшалось и к настоящему времени почти прекратилось [26], что должно инициировать восстановление экосистем. В-третьих, 25 лет назад было зафиксировано состояние почвенной мезофауны до начала сокращения промышленных выбросов [27–29], которое можно принять за “точку отсчета”.
Кроме того, для интерпретации результатов немаловажно наличие для рассматриваемого района информации о закономерностях реакции на загрязнение многих компонентов экосистем: растительности [30], почвы [12, 13, 31], почвенного микробоценоза [32–34], почвенных микроартропод [35], герпето- [36, 37], хорто- [38], некро- [39] и дендробионтов [40]. Еще более важны результаты по динамике концентраций тяжелых металлов в почве [26] и растениях [41, 42], а также восстановлению ряда групп – растительности [30], европейского крота [14], филлофагов [42], эпифитных лишайников [43].
Заметим, что анализ почвенной фауны может быть выполнен с разной детализацией: можно рассматривать как интегральные параметры сообществ (общая численность, соотношение надвидовых таксонов), так и обилие и видовое разнообразие отдельных групп. Эти подходы не исключают, а дополняют друг друга. В настоящей работе был реализован первый из них, рисующий картину динамики “крупными мазками”.
Цель нашей работы – анализ 25-летней динамики общего обилия и соотношения надвидовых таксонов (ранга семейства и выше) почвенной мезофауны в период сокращения выбросов медеплавильного завода. Нам не известны работы, в которых для условий промышленного загрязнения напрямую сопоставляли бы параметры сообществ крупных почвенных беспозвоночных до и после сокращения выбросов. Мы тестируем гипотезу об отсутствии положительных сдвигов в сообществах на наиболее загрязненных участках за 25-летний период. Гипотеза основана на следующих фактах: 1) низкой скорости выноса тяжелых металлов из верхних почвенных горизонтов [44], что документировано и для рассматриваемого района [26]; 2) продолжении угнетенного состояния растительности вблизи завода [30], а следовательно, отсутствии положительных сдвигов в ценотическом окружении; 3) низкого обилия почвенной мезофауны возле давно закрытых предприятий [8, 19–21].
МАТЕРИАЛ И МЕТОДЫ
Район исследований. Среднеуральский медеплавильный завод (СУМЗ), расположенный на окраине г. Ревды (в 50 км к западу от г. Екатеринбурга), функционирует с 1940 г. и до недавнего времени был крупнейшим источником промышленного загрязнения в России. Основные ингредиенты его выбросов – газообразные соединения серы, фтора и азота, а также пылевые частицы с сорбированными тяжелыми металлами (Cu, Pb, Zn, Cd, Fe, Hg и др.) и металлоидами (As). В 1980 г. выбросы завода составляли 225 тыс. т поллютантов в год, в 1990 г. – 148 тыс. т, в 1991 г. – 106 тыс. т. После 1991 г. выбросы снижались еще сильнее: в 1994 г. они составили 96 тыс. т, в 2000 г. – 63 тыс. т, в 2004 г. – 28 тыс. т, а после кардинальной реконструкции предприятия в 2010 г. – всего около 3–5 тыс. т/год [30]. Выбросы основного компонента – сернистого ангидрида – к 2012 г. упали в 116 раз по сравнению с 1980 г., пыли – в 44 раза. Из металлов наиболее сильно сократились выбросы меди – более чем в 3000 раз к 2012 г. по сравнению с 1989 г. [26]. Современное содержание кислоторастворимых форм металлов в лесной подстилке вблизи завода очень высокое (мкг/г): Cu – 3500–5500, Pb – 1400–2500, Cd – 17–20, Zn – 600–900, что превышает фоновые значения в 100, 40, 7 и 3 раза соответственно [13, 45].
Район расположен в южной тайге. Работы проведены в елово-пихтовых разновозрастных лесах с элементами неморального флористического комплекса, произрастающих на пологих склонах увалов. В фоновой зоне в напочвенном покрове доминируют Oxalis acetosella, Aegopodium podagraria, Gymnocarpium dryopteris, Dryopteris carthusiana, Asarum europaeum, Maianthemum bifolium, Cerastium pauciflorum, Stellaria holostea, в буферной – Oxalis acetosella, Cerastium pauciflorum, Maianthemum bifolium, Carex montana, Calamagrostis obtusata, Rubus saxatilis, Linnaea borealis. Загрязнение вызвало угнетение древостоя (уменьшение высоты, диаметра и запаса деревьев, увеличение доли сухостоя) и живого напочвенного покрова (снижение видового разнообразия и продуктивности). Вблизи завода сохранились фрагменты елово-пихтового леса с маловидовыми сообществами (Equisetum sylvaticum, Deschampsia caespitosa, Tussilago farfara, Agrostis capillaris и др.) и моховым покровом из Pohlia nutans. Несмотря на снижение выбросов в последние годы, на наиболее загрязненных участках растительность пока не восстанавливается, но в буферной зоне заметны позитивные изменения [30].
Почвенный покров представлен в разной степени преобразованными горно-лесными бурыми, дерново-подзолистыми и серыми лесными почвами. Трансформация почв, помимо накопления тяжелых металлов и увеличения кислотности, проявилась в усилении элювиально-глеевого процесса, разрушении агрегатов, уменьшении содержания обменных кальция и магния, формировании мощной оторфованной подстилки [12, 13, 31, 45].
Учеты почвенной мезофауны выполнены в июле–августе 2014–2016 гг. Пробные площади размером 10 × 10 м были заложены в четырех выделенных ранее по уровню загрязнения и состоянию растительности зонах нагрузки: фоновой (20–30 км к западу от завода, 5 площадей в 2014 г., по 2 – в 2015 и 2016 гг.), буферной-1 (7 км, 5 площадей в 2014 г., по 2 – в 2015 и 2016 гг.), буферной-2 (3–6 км, 6 площадей в 2014 г., по 3 – в 2015 и 2016 гг.) и импактной (0–2 км, 7 площадей в 2014 г., по 2 – в 2015 и 2016 гг.), всего 41 учет.
Беспозвоночных (размером более 2 мм) учитывали ручной выборкой из почвенных монолитов 20 × 20 см и глубиной 20–30 см (в зависимости от встречаемости животных). На каждой пробной площади было отобрано по 10 монолитов, размещенных случайно, исключая места видимых педотурбаций и участки радиусом 0.5 м от ствола крупных деревьев. Для повышения точности при отборе проб и выборке беспозвоночных монолиты делили на два слоя – лесную подстилку и минеральные горизонты; в дальнейшем анализе данные по слоям были объединены. Разбор проб осуществляли в лабораторных условиях, куда почвенные монолиты доставляли в пластиковых пакетах сразу после отбора. До выборки беспозвоночных пробы хранили при температуре 12°С, как правило, 1–2 дня (не более 5 сут). Беспозвоночных фиксировали в 70%-ном спирте. Не учитывали муравьев, пустые коконы дождевых червей, а также относительно крупных микроартропод (коллемболы, орибатиды и др.).
Для сравнения с другими годами использовали наши ранее опубликованные материалы, собранные в июне–июле 1990–1991 гг. [27–29] и июле–августе 2004 г. [11]. Пробные площади в 2014–2016 и 2004 гг. строго совпадали, а между этими периодами и 1990–1991 гг. совпадали только участки размещения площадей в пределах 300–500 м. В 2004 г. число и распределение пробных площадей по зонам совпадало с 2014 г. (за исключением не 5, а 2 площадей в 7 км и 3 дополнительных площадей в импактной зоне в 2014 г.). В 1990–1991 гг. в фоновой и буферной-1 зонах было по 3 площади, в буферной-2 – 9, в импактной – 3. За все годы в анализ включено 76 учетов.
Методика отбора и разбора проб во все годы была одинаковой, за исключением того, что в 1991 г. размер пробы составлял 25 × 25 см, а в 1990 г. было по 20–40 проб на пробную площадь. Общий объем материала в 2016 г. составил 90 проб (4.8 тыс. экз. беспозвоночных), в 2015 г. – 92 (9.2 тыс.), в 2014 г. – 230 (15.8 тыс.), в 2004 г. – 169 (6.3 тыс.), в 1990–1991 гг. – 306 (5.6 тыс.); за все годы – 887 проб (41.7 тыс. экз.).
Анализ данных. Для характеристики погодных условий использовали данные ближайшей метеостанции (г. Ревда). Помимо средней температуры воздуха, суммы осадков и числа дней с осадками, рассчитали гидротермический коэффициент Селянинова (умноженное на 10 отношение суммы осадков в дни, когда температура воздуха была выше 10°C, к сумме разниц между среднесуточной температурой и 10°C за этот период).
Во всех случаях учетной единицей считали пробную площадь. Различия между зонами загрязнения и периодами оценили двухфакторным дисперсионным анализом (отдельно для первого–второго и второго–третьего периодов) с поправкой на неоднородность дисперсии по методу Хьюбера–Уайта (алгоритм hc3, пакет car v.3.0-0); обилие предварительно логарифмировали (y = ln(x + 1)). Контроль над ожидаемой частотой ложных отклонений (false discovery rate, FDR) при множественных проверках статистических гипотез осуществляли с помощью поправки Беньямини–Йекутили (везде приведены FDR-скорректированные значения уровня значимости P). Для множественных сравнений использовали критерий Тьюки. Величину эффекта относительно фоновой территории рассчитали как отношение откликов (Response Ratio, натуральный логарифм); использовали несмещенную оценку, предложенную для малых выборок и близких к нулю значений в опыте (RRΔ) [46]. Ординацию выполнили методом главных координат по относительному обилию таксономических групп с использованием коэффициента Жаккара (пакет vegan v.2.4-5). Все расчеты проведены в среде R v.3.4.3.
РЕЗУЛЬТАТЫ
Погода сильно различалась между годами учетов: 2016 г. был существенно суше и теплее по сравнению с многолетними средними условиями, 1990 и 2015 гг. – влажнее и холоднее, а 1991, 2004 и 2014 гг. – близки к средним многолетним (табл. 1).
Таблица 1.
Характеристика погодных условий за период с мая по сентябрь в годы проведения исследований
| Показатель | Год | Среднее (1981–2015 гг.) |
|||||
|---|---|---|---|---|---|---|---|
| 1990 | 1991 | 2004 | 2014 | 2015 | 2016 | ||
| Средняя температура, oC | 13.0 | 14.7 | 14.8 | 13.4 | 13.7 | 15.8 | 13.7 |
| Сумма осадков, мм | 445.1 | 376.3 | 341.6 | 299.3 | 528.0 | 152.2 | 343.0 |
| Число дней с осадками | 94 | 74 | 68 | 65 | 90 | 50 | 75 |
| Гидротермический коэффициент | 5.1 | 3.8 | 3.1 | 3.7 | 5.3 | 1.1 | 3.6 |
Общее обилие и обилие практически всех таксонов (за исключением личинок пилильщиков и щелкунов) значимо различалось между зонами загрязнения либо для обоих вариантов сравнения (первый–второй, второй–третий периоды), либо в какой-то один из них (табл. 2, 3). Различия между периодами не столь однозначны: между первым и вторым значимо различается обилие пауков, литобиид, пилильщиков, длинноусых двукрылых, щелкунов, стафилинид, между вторым и третьим – большего числа групп (энхитреиды, геофилиды, червецы, чешуекрылые, пилильщики, щелкуны, двукрылые, стафилиниды, моллюски). Общее обилие педобионтов значимо различается между периодами в обоих случаях. Почти всегда взаимодействие “зона загрязнения × период” незначимо, что свидетельствует, по крайней мере, об отсутствии сильно выраженной разнонаправленности изменений в разных зонах.
Таблица 2.
Обилие (±стандартная ошибка, экз/м2) таксономических групп почвенной мезофауны в разных зонах загрязнения в разные периоды
| Группа | Зона загрязнения (удаление от источника выбросов, км), период | |||||
| фоновая (20–30) | буферная-1 (7) | |||||
| I, n = 3 | II, n = 5 | III, n = 9 | I, n = 3 | II, n = 2 | III, n = 9 | |
| Lumbricidae, черви | 285.8 ± 114.8a | 261.5 ± 50.1a | 238.0 ± 25.5a | 153.5 ± 60.2a | 212.5 ± 19.4a | 330.8 ± 28.2a |
| Lumbricidae, коконы | 178.6 ± 84.3a | 47.0 ± 7.1a | 139.6 ± 20.2a | 32.1 ± 15.0a | 27.5 ± 5.3a | 165.6 ± 27.8a |
| Enchytraeidae | 299.5 ± 112.9ab | 168.0 ± 25.8a | 1005.3 ± 137.7b | 34.5 ± 22.6a | 125.0 ± 40.7ab | 884.4 ± 207.6b |
| Aranei | 12.8 ± 4.0a | 232.0 ± 30.3b | 280.7 ± 31.6b | 9.2 ± 3.6a | 190 ± 102.5b | 172.8 ± 13.1b |
| Opiliones | 4.8 ± 2.3a | 7.0 ± 2.2a | 9.7 ± 1.7a | 1.3 ± 0.8a | 7.5 ± 3.5a | 11.1 ± 3.6a |
| Lithobiidae | 80.9 ± 27.4a | 180.5 ± 19.9a | 250.1 ± 33.4a | 41.7 ± 15.1a | 75.0 ± 7.1a | 111.9 ± 4.2a |
| Geophilidae | 35.8 ± 12.2ab | 37.5 ± 4.9a | 123.9 ± 15.7b | 14.8 ± 5.6a | 47.5 ± 10.6a | 81.9 ± 4.4a |
| Diplopoda | 5.9 ± 4.2a | 23.5 ± 5.5a | 11.3 ± 5.3a | 2.8 ± 0.3a | 5.0 ± 3.5a | 35.3 ± 26.6a |
| Heteroptera (im + l) | 32.7 ± 13.8a | 22 ± 6.3a | 6.9 ± 1.5a | 17.1 ± 9.1a | 18.8 ± 8.0a | 17.8 ± 3.5a |
| Coccodea (im + l) | 3.2 ± 2.6a | 6.5 ± 2.2a | 42.2 ± 9.3b | 1.0 ± 0.4a | 3.8 ± 0.9a | 28.9 ± 6.2b |
| Lepidoptera (l + p) | 15.4 ± 5.8a | 10.5 ± 2.8a | 9.1 ± 1.9a | 2.9 ± 1.3a | 23.8 ± 0.9b | 4.2 ± 1.1a |
| Hymenoptera, Symphyta (l + p) | 2.8 ± 0.8a | 22.0± 6.3a | 12.4 ± 2.9a | 3.4 ± 2.5a | 23.8 ± 8.0a | 6.9 ± 1.0a |
| Diptera, Nematocera (l + p) | 19.1 ± 12.5a | 100.5 ± 61.8a | 103.8 ± 26.9a | 4.8 ± 2.7a | 5.0 ± 0.0a | 50.0 ± 9.8b |
| Diptera, Brachycera (l + p) | 111.2 ± 43.4a | 53.0 ± 13.5a | 188.4 ± 16.3a | 31.1 ± 15.8a | 56.3 ± 18.6a | 101.9 ± 15.0a |
| Carabidae (im + l) | 42.1 ± 15.4a | 10.0 ± 2.8a | 22.7 ± 7.4a | 25.2 ± 16.6a | 13.8 ± 0.9a | 17.8 ± 5.0a |
| Staphylinidae (im + l) | 108.6 ± 38.4a | 144.0 ± 21.7a | 185.3 ± 16.5a | 54.3 ± 22.8a | 136.3 ± 30.9ab | 209.7 ± 22. b |
| Cantharidae (l) | 13.9 ± 5.5a | 37.5 ± 10.5a | 35.4 ± 7.5a | 2.2 ± 1.2a | 8.8 ± 2.7ab | 26.7 ± 3.4b |
| Elateridae (im + l + p) | 24.3 ± 3.2a | 46.0 ± 9.7a | 58.3 ± 7.9a | 12.9 ± 4.7a | 85.0 ± 10.6b | 75.3 ± 17.7b |
| Curculionidae (im+l+p) | 19.0 ± 10.1a | 8.5 ± 3.6a | 6.4 ± 1.7a | 8.9 ± 5.6a | 16.3 ± 0.9a | 9.4 ± 3.2a |
| Прочие Coleoptera (im + l + p) | 4.2 ± 1.2a | 19.0 ± 2.8ab | 65.4 ± 10.4b | 7.5 ± 5.9a | 12.5 ± 5.3a | 76.4 ± 7.6b |
| Mollusca, Gastropoda | 73.6 ± 27.5a | 293.5 ± 97.4a | 337.4 ± 18.7a | 44.7 ± 19a | 172.5 ± 91.9ab | 348.9 ± 55.3b |
| Прочие беспозвоночные | 1.3 ± 0.3a | 13.0 ± 5.3ab | 23.4 ± 4.4b | 0.4 ± 0.2a | 2.5 ± 1.8ab | 16.1 ± 3.5b |
| Всего | 1375.1 ± 497.7 ab | 1743.0 ± 224.3a | 3155.6 ± 214.0b | 506.2 ± 209.2a | 1268.8 ± 335.0ab | 2783.9 ± 298.2b |
| Группа | Зона загрязнения (удаление от источника выбросов, км), период | |||||
| буферная-2 (3–6) | импактная (0–2) | |||||
| I, n = 9 | II, n = 6 | III, n = 12 | I, n = 3 | II, n = 4 | III, n = 11 | |
| Lumbricidae, черви | 8.2 ± 3.4a | 32.9 ± 21.3ab | 93.3 ± 32.4b | 0.0a | 0.0a | 1.0 ± 1.0a |
| Lumbricidae, коконы | 7.9 ± 3.5ab | 4.2 ± 3.4a | 50.8 ± 23.9b | 0.0a | 0.0a | 0.0a |
| Enchytraeidae | 19.1 ± 9.4a | 25.0 ± 15.3a | 300.6 ± 124.4a | 0.5 ± 0.4a | 0.0a | 4.1 ± 2.3a |
| Aranei | 6.6 ± 2.9a | 165.8 ± 40.8b | 179.8 ± 18.9b | 3.7 ± 1.2a | 24.6 ± 5.9ab | 51.1 ± 10.3b |
| Opiliones | 0.7 ± 0.4a | 1.7 ± 0.8ab | 4.0 ± 0.7b | 0.5 ± 0.4a | 0.6 ± 0.5a | 1.1 ± 0.7a |
| Lithobiidae | 17.2 ± 5.3a | 32.5 ± 10.6a | 40.8 ± 10.1a | 1.1 ± 0.4a | 16.6 ± 1.9b | 41.1 ± 14.1b |
| Geophilidae | 8.3 ± 1.9a | 16.7 ± 5.5a | 43.3 ± 9.1a | 1.1 ± 0.4a | 0.6 ± 0.5a | 3.6 ± 1.1a |
| Diplopoda | 3.6 ± 1.1a | 13.3 ± 8.1a | 8.5 ± 6.7a | 1.6 ± 0.8a | 3.8 ± 3.2a | 3.4 ± 1.9a |
| Heteroptera (im + l) | 5.7 ± 2.3a | 6.7 ± 1.5a | 6.5 ± 1.9a | 0.0a | 1.9 ± 0.6ab | 3.6 ± 0.9b |
| Coccodea (im + l) | 0.5 ± 0.4a | 7.5 ± 4.3ab | 20.0 ± 6.3b | 1.1 ± 0.9a | 1.3 ± 1.1a | 14.0 ± 7.2a |
| Lepidoptera (l + p) | 3.6 ± 1.7a | 9.6 ± 5.2a | 7.1 ± 2.1a | 1.1 ± 0.4a | 3.8 ± 1.9a | 3.4 ± 1.2 a |
| Hymenoptera, Symphyta (l + p) | 1.3 ± 0.5a | 13.8 ± 4.5ab | 6.5 ± 1.2b | 1.6 ± 1.3a | 23.2 ± 8.8a | 7.0 ± 2.9a |
| Diptera, Nematocera (l + p) | 1.9 ± 1.3a | 4.6 ± 1.6a | 98.8 ± 26.6b | 1.1 ± 0.4a | 5.2 ± 1.6ab | 34.2 ± 9.8b |
| Diptera, Brachycera (l + p) | 28.6 ± 13.2a | 50.4 ± 21.4a | 129.6 ± 56.1a | 19.7 ± 7.9ab | 1.9 ± 0.5b | 53.7 ± 26.3a |
| Carabidae (im + l) | 6.4 ± 2.0a | 8.8 ± 1.8a | 9.6 ± 1.7a | 2.7 ± 1.6a | 4.5 ± 1.1a | 5.4 ± 1.3a |
| Staphylinidae (im + l) | 17.9 ± 4.2a | 74.2 ± 9.2b | 137.9 ± 16.8b | 11.2 ± 5.4a | 61.4 ± 5.7b | 53.8 ± 9.4b |
| Cantharidae (l) | 12.0 ± 3.8a | 28.3 ± 9.3a | 22.3 ± 4.0a | 6.9 ± 1.6a | 9.7 ± 3.4 a | 9.3 ± 3.0a |
| Elateridae (im + l + p) | 26.3 ± 7.7a | 48.8 ± 5.3ab | 71.3 ± 6.0b | 24.5 ± 12.4ab | 17.8 ± 5.0a | 71.7 ± 14.9b |
| Curculionidae (im + l + p) | 4.5 ± 1.3a | 8.3 ± 2.0a | 3.8 ± 1.0a | 2.7 ± 1.2a | 0.0a | 2.0 ± 0.7a |
| Прочие Coleoptera (im + l + p) | 0.7 ± 0.5a | 41.7 ± 6.4b | 61.5 ± 8.4b | 0.5 ± 0.4a | 13.3 ± 4.3b | 24.7 ± 4.6b |
| Mollusca, Gastropoda | 3.4 ± 2.2a | 7.5 ± 4.5a | 74.8 ± 27.4b | 0.0a | 0.0a | 0.4 ± 0.3a |
| Прочие беспозвоночные | 0.7 ± 0.5a | 11.3 ± 4.4b | 4.4 ± 1.3ab | 0.0a | 0.0a | 3.4 ± 1.8a |
| Всего | 185.0 ± 49.9a | 613.3 ± 63.3b | 1375.0 ± 256.6b | 81.6 ± 12.1 | 190.2 ± 15.9a | 392.1 ± 43.2b |
Примечание. Здесь, в табл. 3 и на рис. 1, 2 периоды: I – 1990–1991 гг., II – 2004 г., III – 2014–2016 гг.; стадии развития: im – имаго, l – личинка, p – куколка или пупарий; учетная единица – пробная площадь (среднее из 10 проб), n – число учетов. Одинаковые буквы обозначают отсутствие значимых различий по критерию Тьюки между периодами в пределах зоны нагрузки для каждой группы.
Таблица 3.
Результаты дисперсионного анализа различий обилия почвенной мезофауны между зонами загрязнения и периодами
| Группа | Источник изменчивости | |||||
|---|---|---|---|---|---|---|
| I и II периоды | II и III периоды | |||||
| Зона, df = 3 | Период, df = 1 | Зона × период, df = 3 | Зона, df = 3 | Период, df = 1 | Зона × период, df = 3 | |
| Lumbricidae, черви | 522.2 (<0.001) | 0.0 (1.000) | 0.6 (0.761) | 619.4 (<0.001) | 4.5 (0.079) | 0.7 (0.718) |
| Lumbricidae, коконы | 224.7 (<0.001) | 2.0 (0.276) | 0.4 (0.84) | 728.4 (<0.001) | 0.0 (1.000) | 11.4 (<0.001) |
| Enchytraeidae | 256.5 (<0.001) | 0.1 (0.843) | 0.9 (0.624) | 306.6 (<0.001) | 48.8 (<0.001) | 0.5 (0.792) |
| Aranei | 8.6 (0.001) | 66.5 (<0.001) | 1.9 (0.263) | 20.6 (<0.001) | 1.7 (0.311) | 0.1 (0.992) |
| Opiliones | 2.1 (0.212) | 1.1 (0.448) | 0.4 (0.843) | 13.8 (<0.001) | 2.8 (0.185) | 0.4 (0.843) |
| Lithobiidae | 51.2 (<0.001) | 17.4 (0.001) | 1.7 (0.311) | 60.1 (<0.001) | 4.7 (0.073) | 0.8 (0.654) |
| Geophilidae | 21.9 (<0.001) | 0.7 (0.542) | 0.9 (0.576) | 48.3 (<0.001) | 30.1 (<0.001) | 0.4 (0.840) |
| Diplopoda | 1.1 (0.501) | 0.1 (0.840) | 0.4 (0.855) | 3.5 (0.048) | 0.4 (0.654) | 0.4 (0.855) |
| Heteroptera | 12.5 (<0.001) | 5.5 (0.056) | 0.7 (0.718) | 7.4 (0.001) | 1.1 (0.448) | 0.8 (0.654) |
| Coccodea | 1.2 (0.468) | 4.5 (0.086) | 0.4 (0.843) | 6.4 (0.003) | 22.4 (<0.001) | 0.3 (0.906) |
| Lepidoptera | 6.9 (0.004) | 4.7 (0.079) | 1.1 (0.503) | 4.8 (0.013) | 24.8 (<0.001) | 3.9 (0.036) |
| Hymenoptera, Symphyta | 1.2 (0.464) | 13.8 (0.003) | 0.5 (0.837) | 1.2 (0.468) | 6.2 (0.038) | 1.3 (0.42) |
| Diptera, Nematocera | 3.7 (0.05) | 5.9 (0.048) | 0.1 (1.000) | 4.2 (0.025) | 125.5 (<0.001) | 2.1 (0.198) |
| Diptera, Brachycera | 6.4 (0.006) | 0.0 (0.926) | 2.0 (0.246) | 19.2 (<0.001) | 21.3 (<0.001) | 2.0 (0.222) |
| Carabidae | 5.8 (0.009) | 1.1 (0.448) | 1.2 (0.468) | 7.8 (0.001) | 0.0 (1.000) | 0.3 (0.86) |
| Staphylinidae | 5.8 (0.009) | 34.1 (<0.001) | 0.5 (0.792) | 11.7 (<0.001) | 5.8 (0.044) | 2.3 (0.161) |
| Cantharidae | 2.7 (0.124) | 4.4 (0.09) | 0.6 (0.761) | 5.3 (0.008) | 0.1 (0.840) | 1.2 (0.459) |
| Elateridae | 3.3 (0.074) | 11.2 (0.007) | 1.2 (0.464) | 1.9 (0.248) | 6.1 (0.040) | 2.8 (0.093) |
| Curculionidae | 411.7 (<0.001) | 1.0 (0.464) | 2.2 (0.194) | 408.9 (<0.001) | 0.2 (0.792) | 7.3 (0.001) |
| Прочие Coleoptera | 1.7 (0.311) | 125.6 (<0.001) | 5.0 (0.018) | 11.6 (<0.001) | 21.4 (<0.001) | 2.1 (0.194) |
| Mollusca, Gastropoda | 65.7 (<0.001) | 0.0 (1.000) | 0.9 (0.624) | 301.0 (<0.001) | 5.9 (0.044) | 2.9 (0.090) |
| Все группы | 47.1 (<0.001) | 30.5 (<0.001) | 0.8 (0.654) | 109.6 (<0.001) | 34.6 (<0.001) | 0.0 (1.000) |
В период высоких выбросов (1990–1991 гг.) реакция почвенной мезофауны на загрязнение была очень контрастной (см. табл. 2). По мере приближения к заводу обилие дождевых червей, энхитреид, моллюсков, полужесткокрылых снижалось вплоть до исчезновения; обилие многоножек, паукообразных, большинства жесткокрылых, личинок двукрылых и чешуекрылых также уменьшалось (в 5–100 раз), но они не исчезали полностью. Обилие некоторых групп увеличивалось при переходе от промежуточного к максимальному уровню загрязнения: личинки щелкунов – в 2.2–2.5 раза, мягкотелок – в 7–8 раз. Поскольку на загрязнение негативно реагировали наиболее многочисленные на фоновой территории группы (прежде всего сапрофаги), общее обилие педобионтов вблизи завода сильно снизилось (в 14 раз), а доминирование сапрофагов (дождевые черви, энхитреиды, диплоподы, личинки большинства длинноусых двукрылых) и сапрофитофагов (моллюски) сменилось преобладанием зоофагов (пауки, литобииды, геофилиды, сенокосцы, личинки и имаго жужелиц, мягкотелок, стафилинид, личинки части короткоусых двукрылых), фитофагов (личинки долгоносиков, пилильщиков, чешуекрылых, червецы) и миксофагов (личинки щелкунов).
В период сниженных выбросов (2004 г.) на качественном уровне картина трансформации сообществ под действием загрязнения не изменилась, но обилие ряда групп в буферной (энхитреиды, пауки, личинки чешуекрылых, стафилиниды, моллюски) и импактной (пауки, литобииды, стафилиниды) зонах стало выше (в 1.5–19 раз) по сравнению с предыдущим периодом (см. табл. 2).
В период почти полного прекращения выбросов (2014–2016 гг.) на качественном уровне картина также не изменилась. В то же время в этот период по сравнению с 2004 г. на буферных участках не только увеличилось обилие дождевых червей (в 3 раза), их коконов (в 12 раз), энхитреид (в 13 раз) и моллюсков (в 10 раз), но эти группы появились на импактных территориях, хотя ранее там отсутствовали. Обилие дождевых червей, лишь единично встречавшихся в 2004 г. на удалении 4 км от завода, в 2014 и 2015 гг. увеличилось на этом участке, а в 2015 г. они были обнаружены уже в 2 км; в 2014 и 2015 гг. энхитреиды были встречены на удалении 1 км, а моллюски – 2 км, тогда как в 2004 г. ближайшие места их находок были расположены в 4 км (табл. 4).
Таблица 4.
Встречаемость в почвенных пробах (%) индикаторных групп мезофауны в разные годы на разном удалении от завода
| Год | Удаление от завода, км | |||||||
|---|---|---|---|---|---|---|---|---|
| 20–30 | 7 | 5–6 | 4 | 3 | 2 | 1 | 0–0.5 | |
| Lumbricidae (черви и коконы) | ||||||||
| 1990–1991 | 80 | 66 | 41 | 25 | 0 | 0 | – | 0 |
| 2004 | 98 | 100 | 70 | 27 | 0 | 0 | 0 | – |
| 2014 | 100 | 100 | 75 | 77 | 0 | 0 | 0 | 0 |
| 2015 | 100 | 100 | 100 | 100 | 60 | 45 | 0 | – |
| 2016 | 100 | 95 | 100 | 10 | 20 | 0 | 0 | 0 |
| Enchytraeidae | ||||||||
| 1990–1991 | 55 | 22 | 34.8 | 15 | 40 | 10 | – | 0 |
| 2004 | 90 | 70 | 40 | 16.7 | 0 | 0 | 0 | – |
| 2014 | 100 | 92 | 60 | 83.3 | 0 | 10 | 10 | 0 |
| 2015 | 100 | 100 | 100 | 100 | 40 | 45 | 0 | – |
| 2016 | 100 | 90 | 80 | 60 | 0 | 20 | 0 | 0 |
| Mollusca | ||||||||
| 1990–1991 | 48 | 45 | 21 | 2 | 0 | 0 | – | 0 |
| 2004 | 92 | 75 | 20 | 17 | 0 | 0 | 0 | – |
| 2014 | 100 | 98 | 50 | 60 | 30 | 3 | 0 | 0 |
| 2015 | 100 | 100 | 100 | 90 | 70 | 9 | 0 | – |
| 2016 | 100 | 100 | 100 | 60 | 40 | 0 | 0 | 0 |
| Число проб | ||||||||
| 1990–1991 | 60 | 100 | 66 | 40 | 10 | 10 | 0 | 20 |
| 2004 | 50 | 20 | 20 | 30 | 10 | 29 | 10 | 0 |
| 2014 | 50 | 50 | 20 | 30 | 10 | 30 | 10 | 30 |
| 2015 | 21 | 20 | 10 | 10 | 10 | 11 | 10 | 0 |
| 2016 | 20 | 20 | 10 | 10 | 10 | 10 | 10 | 10* |
Примечание. Прочерк означает отсутствие данных; * – дополнительные пробы, отобранные рядом с постоянными пробными площадями для сравнения с крупными древесными остатками [66].
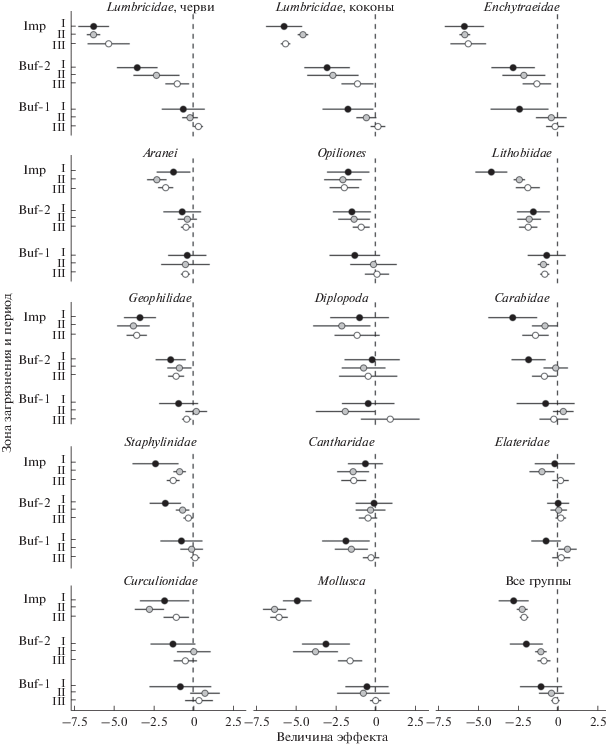
Разницу в реакции разных групп и восстановительные тренды красноречиво характеризует динамика величин эффекта RRΔ: в импактной зоне он стабилен во времени для общего обилия педобионтов и обилия большинства групп, тогда как в буферной-1 и буферной-2 зонах при переходе от первого периода к третьему сдвигается к нулю (рис. 1). Для ряда групп (дождевые черви, энхитреиды, жужелицы, стафилиниды, мягкотелки) ко второму–третьему периодам на буферных участках обилие перестает значимо отличаться от фонового уровня, тогда как в первый период такие отличия были значимы. Другими словами, сила влияния загрязнения на педобионтов на импактных участках не меняется, а на буферных – уменьшается.
Рис. 1.
Величины эффекта (и 95%-ный доверительный интервал) в импактной (Imp), буферной-1 (Buf-1) и буферной-2 (Buf-2) зонах загрязнения по отношению к фоновой территории. Периоды: I – черный маркер, II – серый, III – белый. Стадии развития беспозвоночных указаны в табл. 2.
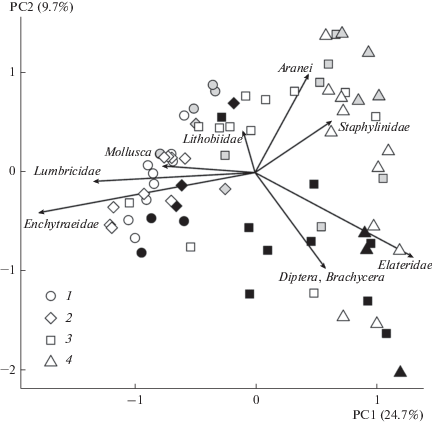
Ординация показывает, что в каждый из периодов сообщества импактных участков сильно дистанцированы от сообществ фоновой зоны, а буферных занимают промежуточное положение (рис. 2). Основной вклад в различия структуры сообществ разных зон вносят дождевые черви, энхитреиды, моллюски, пауки, стафилиниды, личинки короткоусых двукрылых и щелкунов. Различия между периодами менее выражены для сообществ фоновой зоны по сравнению с импактными и буферными участками. Показательно приближение в третий период части площадок зоны буферная-2 (но не импактной) к фоновой.
Рис. 2.
Ординация пробных площадей в пространстве первой (PC1) и второй (PC2) главных координат (в скобках приведена доля объясняемой дисперсии, %). Зоны загрязнения: 1 – фоновая, 2 – буферная-1, 3 – буферная-2, 4 – импактная. Периоды: I – черный маркер, II – серый, III – белый. Стадии развития беспозвоночных указаны в табл. 2. Для Lumbricidae суммировано обилие червей и коконов. Векторы показаны для тех групп, у которых модуль значений главных координат превышает 0.4 ед.
ОБСУЖДЕНИЕ
Реакция на загрязнение. Подробное рассмотрение характера, причин и последствий вызванных загрязнением изменений сообществ почвенной мезофауны не входит в наши задачи; частично это было сделано ранее [11, 28, 29]. В целом закономерности реакции мезофауны на загрязнение в исследованном импактном регионе совпадают с описанными для районов воздействия выбросов других меде(никеле)плавильных заводов, в частности на Южном Урале [7], Кольском полуострове [6, 10], Дальнем Востоке [47], в Финляндии [48] и Франции [8]. По степени выраженности изменений (уменьшение численности на один–два порядка) почвенная мезофауна отличается от беспозвоночных других ярусов, обилие которых возле СУМЗа снижено лишь в 2–3 раза – герпето- [36, 37], некро- [39], дендробионтов [40].
Анализ изменений на уровне крупных таксонов позволяет объяснять разнообразие реакций на загрязнение разных групп различиями в образе жизни. Для ряда таксонов (дождевые черви, энхитреиды, диплоподы, моллюски, сенокосцы) основной причиной снижения численности и последующей элиминации можно считать прямое токсическое действие тяжелых металлов из-за большого поступления с пищей и/или прямого контакта покровов с почвенным раствором. В районе СУМЗа содержание металлов в почве намного превосходит безопасные уровни для почвенных животных [5, 49], тем более в сочетании с подкислением естественно кислых почв. Для других таксонов (литобииды, геофилиды, пауки, клопы, жужелицы, стафилиниды), вероятно, бóльшую роль играют опосредованные эффекты загрязнения – пессимизация микроклимата и/или снижение обеспеченности трофическими ресурсами из-за деградации растительности. Индифферентные к загрязнению группы или положительно на него реагирующие (личинки щелкунов), скорее всего, обладают механизмами, которые либо успешно препятствуют поступлению токсикантов в организм, либо эффективно их выводят. Разными для этих групп будут и драйверы восстановления.
Динамика сообществ. Анализ многолетней динамики затруднен мешающим влиянием нескольких факторов, особенно важных в случае почвенной мезофауны, – разномасштабной пространственной изменчивости, межгодовых флуктуаций и различий в точности учетов. Использование постоянных пробных площадей, как это сделано в нашей работе, позволяет снизить риск подмены изучения временнóй динамики анализом пространственной мозаичности в масштабе сотен метров. Но, к сожалению, и при таком подходе нельзя полностью устранить мешающее влияние микромасштабной вариабельности (в масштабе единиц метров).
Сложнее нивелировать влияние межгодовой изменчивости. Возможным решением было бы в каждый из временных срезов оценивать параметры в течение нескольких контрастных по погодным условиям лет. Этот путь реализован в нашей работе лишь частично. Тем не менее использование в каждый из трех периодов нескольких зон загрязнения позволило использовать обилие в фоновой зоне в качестве “внутреннего стандарта” и для загрязненных участков анализировать динамику не только абсолютных, но и нормированных относительно него значений. Тем самым величины эффекта RRΔ (см. рис.1) нивелируют влияние не только межгодовой изменчивости, но и возможных методических погрешностей, сказывающихся на полноте учета беспозвоночных.
Сравнение материалов, характеризующих период высоких (1990–1991 гг.), сниженных (2004 г.) и почти прекратившихся (2014–2016 гг.) выбросов показывает стабильность характера реакции почвенной мезофауны на загрязнение, которая за прошедшие 25 лет на качественном уровне не претерпела каких-либо принципиальных изменений. В каждый из трех периодов при приближении к заводу воспроизводилось резкое снижение общего обилия, исчезновение ряда таксонов, в том числе ключевых для функционирования лесных экосистем (дождевые черви), смещение соотношения трофических групп от доминирования сапро- и сапрофитофагов к преобладанию фито-, зоо- и миксофагов. В этом отношении проверяемая нами гипотеза о медленном восстановлении сообществ подтвердилась.
На Кольском полуострове также было отмечено отсутствие сколько-нибудь выраженной восстановительной динамики почвенной мезофауны через 14 лет после сокращения выбросов никелеплавильного комбината [10]. Косвенно о стабильности угнетенного состояния сообществ гео- и герпетобионтов вблизи предприятий свидетельствует сохраняющаяся значительная разница в обилии и разнообразии между импактными и фоновыми участками через много лет после закрытия плавильных заводов: через 40 лет – в Канаде [18, 19], 50 лет – во Франции [8, 20], 15 лет – в Бразилии [21].
В то же время некоторые наблюдаемые нами изменения можно интерпретировать как признаки восстановления сообществ, что противоречит нашей гипотезе. Происходит развертывание во времени двух взаимосвязанных процессов: во-первых, увеличивается обилие беспозвоночных в буферной и импактной зонах (см. табл. 2), во-вторых, ближе к заводу сдвигаются границы распространения тех групп, которые ранее отсутствовали на наиболее загрязненных участках (дождевые черви, энхитреиды и моллюски) (см. табл. 4). Первый из них менее надежен для выводов о восстановлении, поскольку может отражать межгодовые флуктуации численности, второй более показателен для характеристики восстановления, так как свидетельствует о начале качественных сдвигов, хотя частично также может быть связан с удачным “стечением обстоятельств” в виде благоприятных погодных условий. В результате несколько нивелируется разница между загрязненными и фоновыми участками как по структуре сообществ (см. рис. 2), так и по обилию ряда групп (см. рис.1).
В отношении динамики тех групп, для которых более важно опосредованное действие загрязнения, следует отметить, что на наиболее загрязненных участках пока не произошло восстановления лесной растительности [30] и соответствующего ей микроклимата. Впрочем, для обсуждения этого аспекта необходим более подробный уровень таксономического разрешения.
Возможные драйверы динамики. Хорошо известно, что обилие педобионтов зависит от температуры и влажности местообитаний. Поэтому теоретически наблюдаемые временны́е тренды могут быть следствием исключительно различий в тепло- и влагообеспеченности между периодами. Однако в нашем случае динамику сообществ нельзя объяснить этим: одни из годов периода высоких (1990 г.) и низких (2015 г.) выбросов были очень сходны по температуре и сумме осадков (см. табл. 1), хотя сильно различались по обилию и структуре сообществ. Аналогичный вывод можно сделать и при сравнении 1991, 2004 и 2014 гг. Признаки восстановления сообществ очевидны даже в наиболее засушливый 2016 г., хотя они менее выражены, чем в 2014 и 2015 гг. (см. табл. 4). Все это дает основание связывать обсуждаемые тренды изменений сообществ с сокращением выбросов, а не с динамикой погодных условий.
Анализ возможных причин восстановительной динамики в первую очередь логично основывать на изменении во времени токсической нагрузки на педобионтов. Сокращение выбросов СУМЗа пока не привело к значительному уменьшению концентраций металлов в почве [26]. Так, содержание Cd, Pb и Zn в лесной подстилке и гумусовом горизонте было постоянным в 1989–2012 гг. или даже увеличилось к 2012 г. (из-за pH-зависимого снижения их миграционной подвижности и ряда других механизмов). В то же время за прошедшие 25 лет во всех зонах загрязнения в 1.5–3.0 раза снизилось содержание Cu в подстилке, а непосредственно вблизи завода – также и в гумусовом горизонте (в 1.5 раза) [26]. Однако уменьшение содержания лишь одного из компонентов “токсического коктейля”, при неизменно высоких концентрациях других, вряд ли может играть большую роль, поскольку губительное действие на почвенных животных оказывают все рассмотренные металлы [50]. Сохранение высокого уровня загрязнения территории подтверждает отсутствие снижения за эти же 25 лет содержания металлов в рационе грызунов (в основном травянистые растения) [41]. Снижение концентраций металлов в последние годы отмечено в листьях березы [42], но это связано с прекращением осаждения пыли на листовых пластинках, что документировано и для других районов [15].
В контексте нашего обсуждения особое значение имеет то обстоятельство, что сокращение выбросов (прежде всего сернистого ангидрида), а также связанное с этим развитие дернового процесса и лесовозобновления лиственными видами на загрязненных участках привели к нормализации кислотности лесной подстилки и гумусового горизонта [26]. Хорошо известно, что кислотность – это основной фактор, влияющий на подвижность и соответственно токсичность металлов в почве [51, 52], причем подвижность резко снижается при рН > 5. Именно к этому диапазону приблизился рН подстилки в буферной и импактной зонах: увеличился с 3.5–3.8 ед. в 1989 г. до 4.8–5.0 ед. в 2012 г. [26]. Следствием этого может быть уменьшение токсичности при сохранении высокого валового содержания металлов; в частности, это было продемонстрировано для фитотоксичности подстилки в районе СУМЗа [53].
Подчеркнем, что причиной элиминации дождевых червей (возможно, и других сапрофагов) под действием выбросов следует считать именно сочетанное действие металлов и кислотности, а не каждого из агентов по отдельности [29]. Дождевые черви могут выживать при высоких концентрациях металлов в почве, но только если реакция среды исходно близка к нейтральной и не происходит ее смещения в кислую сторону [54]; это же касается и энхитреид [55]. Поэтому ожидаемое снижение токсичности из-за нормализации кислотности теоретически может привести к восстановлению обилия сапрофагов.
Реколонизация загрязненной территории. Отдельно обсудим феномен быстрого продвижения к заводу дождевых червей и моллюсков. Сравнение материалов первого и второго периодов (черви и моллюски отсутствовали ближе 4 км от завода) с третьим (встречены уже в 2 км) позволяет оценить скорость их продвижения в 2 км за 10 лет, что неправдоподобно много. Близкие оценки дал анализ смещения границ распространения в рассматриваемом районе европейского крота, который почти облигатно связан с дождевыми червями [14].
Такая скорость не вызывала бы удивления, например, для активно летающих жесткокрылых [56]. Объяснима быстрая реколонизация эпифитными лишайниками территории “лишайниковой пустыни” [43], происходящая за счет ветрового переноса пропагул с менее загрязненных участков. Однако хорошо известно, что обсуждаемые группы – одни из наименее подвижных [57]. В большинстве случаев скорость колонизации дождевыми червями ранее незаселенной территории (например, при инвазии европейских видов в лесах Северной Америки) составляет 4–6 м/год [58, 59], а максимальные величины не превышают 14 [58] – 28 [60] м/год. Аналогичные величины для наземных моллюсков равны 2–5 м/год [61], максимально (для крупных форм) – 20 м/год [62]. Другими словами, исходя из таких скоростей, наблюдаемое в нашем случае продвижение на 2 км ближе к заводу можно было бы ожидать за 100 лет, а не за 10 лет.
Безусловно, нельзя полностью исключить альтернативное объяснение: эти группы и ранее обитали на загрязненной территории, но не были обнаружены из-за очень низкой численности и недостаточных объемов выборки. В этом случае находки в 2015 г. свидетельствуют не собственно о реколонизации, а об увеличении численности выше порога обнаружения. Впрочем, такую ситуацию мы считаем маловероятной, поскольку отсутствие червей и моллюсков на сильно загрязненных участках не только было зарегистрировано за четыре учета (1990, 1991, 2004 и 2014 гг., суммарно 170 проб), но и неоднократно подтверждалось дополнительными обследованиями.
Более правдоподобно другое объяснение: черви и моллюски не только продвигались к заводу “сплошным фронтом” с более чистых территорий, помимо этого, имело место их “сетевое распространение” из определенных микросайтов, которые обычно не включают в стандартные почвенно-зоологические учеты. В качестве таких микросайтов можно рассматривать, в частности, увлажненные места возле малых водотоков, валежные стволы и пни на поздних стадиях разложения. В них следует ожидать не только более благоприятные условия увлажнения по сравнению с окружающими пространствами, но и меньшую токсичность металлов из-за высокого содержания органического вещества. Известно, что для червей переносимые концентрации металлов намного выше в богатых органикой субстратах, чем в бедных [49]. Исходя из этого можно предположить длительное обитание в таких микросайтах червей и моллюсков далеко за границами их распространения, проведенных по наличию их в стандартных почвенных пробах.
Немаловажно, что на загрязненных территориях обычно высока пятнистость валового содержания тяжелых металлов в почве [45], а пространственное варьирование кислотности усиливает неравномерность распределения их токсичности [53]. Такая пятнистость токсичности может формировать пространственные паттерны почвенной микрофлоры [32, 33] и фауны [63, 64]. Последнее частично связано с активным избеганием беспозвоночными пятен с высоким содержанием поллютантов [65]. Поэтому обсуждаемые микросайты правомерно рассматривать в качестве “островков безопасности” не только из-за повышенной смертности педобионтов на окружающих пространствах, но и в силу их аттрактивности для беспозвоночных.
Если справедливо наше предположение о существовании микросайтов, то снижение токсичности почвы на окружающих их пространствах (особенно в сочетании с благоприятной погодой) может приводить к быстрой реколонизации загрязненной территории. Нельзя полностью исключить и другие механизмы, ускоряющие расселение: форезию птицами и пассивное перемещение (например, при переносе растительного материала ветром или водными потоками).
Предпринятое в 2016 г. специальное обследование крупных древесных остатков подтвердило наше предположение: дождевые черви и моллюски были обнаружены внутри разлагающихся стволов на тех участках, которые ранее всегда относили к территории “люмбрицидной пустыни” [66]. Это можно считать прямым доказательством существования обсуждаемых микросайтов.
Помимо этого, в пользу предложенного объяснения свидетельствуют и другие наблюдения. В гнездовом материале мухоловки-пеструшки в 1 км от СУМЗа были найдены моллюски [16], хотя в стандартных почвенных пробах здесь они отсутствовали [11, 27]. Вряд ли птицы были более “удачливыми охотниками” за почвенной мезофауной, чем разборщики проб. Скорее всего, птицы собирали моллюсков из мест с высокой численностью, например в переувлажненных местообитаниях. Поскольку для сбора корма мухоловка использует ближайшие окрестности гнезда, редко удаляясь от него более чем на 50 м [67], это также косвенно подтверждает существование микросайтов вблизи завода.
ЗАКЛЮЧЕНИЕ
Насколько нам известно, данная работа – это первое прямое сравнение состояния сообществ крупных почвенных беспозвоночных до и после сокращения промышленных выбросов. Учитывая очень медленное очищение почвы от тяжелых металлов, мы не ожидали, что сокращение (а в последние годы почти полное прекращение) поступления поллютантов сразу же приведет к восстановлению сообществ педобионтов. Действительно, за прошедшие 25 лет на качественном уровне характер реакции рассматриваемой группы на загрязнение не претерпел каких-либо принципиальных изменений: как и в период высокой эмиссии (1990–1991 гг.), при сниженных (2004 г.) и почти прекратившихся (2014–2016 гг.) выбросах общее обилие мезофауны катастрофически (на два порядка) уменьшалось по мере приближения к заводу (за счет большинства таксонов), кардинально менялось соотношение трофических групп (преобладание сапрофагов сменялось доминированием зоо- и фитофагов). В то же время можно констатировать и определенные признаки восстановления: увеличилось обилие педобионтов на загрязненных участках, ближе к заводу продвинулись те группы, которые ранее отсутствовали на сильно загрязненной территории (дождевые черви, энхитреиды, моллюски).
Наблюдаемые начальные этапы восстановления сообществ, скорее всего, связаны с нормализацией кислотности и обусловленного этим снижения подвижности (соответственно токсичности) металлов в почве. Не исключено, что важную роль в динамике играет констелляция снижения токсичности и благоприятных погодных условий.
Обнаруженный феномен очень быстрого (2 км за 10 лет) продвижения к заводу дождевых червей и моллюсков может быть связан с пространственной неоднородностью сильно загрязненной территории. В ее пределах вероятно существование микросайтов с менее пессимальными условиями по сравнению с окружающими пространствами, которые позволяют малоподвижным формам выживать за границами основной области их распространения, а затем, при снижении токсичности и благоприятных погодных условиях, быстро реколонизировать загрязненные участки. Для проверки этой гипотезы необходимо продолжение мониторинга, а также специальный анализ микростациального распределения педобионтов.
Мы рассмотрели только начальные этапы восстановления сообществ педобионтов, которое явно будет длиться еще очень долго. Продолжение прямых наблюдений за динамикой в сочетании с изучением восстановления других компонентов экосистем позволит понять механизмы, лежащие в основе восстановительных сукцессий, что важно для развития теории устойчивости. Раскрытию механизмов будет способствовать анализ сообществ на видовом уровне, который мы предполагаем выполнить в дальнейшем.
Авторы признательны М.П. Золотареву за участие в полевых работах, В.С. Микрюкову – за помощь в анализе данных, Е.А. Бельской и О.В. Дуле – за комментарии к тексту рукописи. Сбор материала в 2014–2016 гг. выполнен при поддержке РФФИ (проект № 14-05-00686). Анализ данных и подготовка рукописи выполнены в рамках государственного задания Института экологии растений и животных УрО РАН и при поддержке РФФИ (проект № 18-04-00160). Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Brussaard L., Pulleman M.M., Ouédraogo E. et al. Soil fauna and soil function in the fabric of the food web // Pedobiologia. 2007. V. 50. № 6. P. 447–462.
Paoletti M.G., Bressan M. Soil invertebrates as bioindicators of human disturbance // Crit. Rev. Plant Sci. 1996. V. 15. № 1. P. 21–62.
Cortet J., Gomot-De Vauflery A., Poinsot-Balaguer N. et al. The use of invertebrate soil fauna in monitoring pollutant effects // Eur. J. Soil Biol. 1999. V. 35. № 3. P. 115–134.
Rusek J., Marshall V.G. Impacts of airborne pollutants on soil fauna // Annu. Rev. Ecol. Syst. 2000. V. 31. № 1. P. 395–423.
Bengtsson G., Tranvik L. Critical metal concentrations for forest soil invertebrates. A review of the limitations // Water, Air, Soil Pollut. 1989. V. 47. № 3–4. P. 381–417.
Степанов А.М., Черненькова Т.М., Верещагина Т.Н., Безукладова Ю.О. Оценка влияния техногенных выбросов на почвенных беспозвоночных и растительный покров // Журн. общ. биол. 1991. V. 52. № 5. С. 699–707.
Некрасова Л.С. Влияние медеплавильного производства на почвенную мезофауну // Экология. 1993. № 5. С. 83–85.
Nahmani J., Lavelle P. Effects of heavy metal pollution on soil macrofauna in a grassland of Northern France // Eur. J. Soil Biol. 2002. V. 38. № 3–4. P. 297–300.
Гонгальский К.Б., Филимонова Ж.В., Покаржевский А.Д., Бутовский Р.О. Различия реакции герпетобионтов и геобионтов на воздействие Косогорского металлургического комбината (Тульская область) // Экология. 2007. № 1. С. 55–60. [Gongalsky K.B., Filimonova Z.V., Pokarzhevskii A.D., Butovskii R.O. Differences in responses of herpetobionts and geobionts to impact from the Kosogorsky Metallurgical Plant (Tula region, Russia) // Rus. J. Ecol. 2007. V. 38. № 1. P. 52–57.]
Танасевич А.В., Рыбалов Л.Б., Камаев И.О. Динамика почвенной мезофауны в зоне техногенного воздействия // Лесоведение. 2009. № 6. С. 63–72.
Воробейчик Е.Л., Ермаков А.И., Золотарев М.П., Тунева Т.К. Изменение разнообразия почвенной мезофауны в градиенте промышленного загрязнения // Rus. Entomol. J. 2012. V. 21. № 2. С. 203–218.
Коркина И.Н., Воробейчик Е.Л. Индекс форм гумуса – перспективный инструмент для экологического мониторинга // Экология. 2016. № 6. С. 434–440. [Korkina I.N., Vorobeichik E.L. The humus index: A promising tool for environmental monitoring // Rus. J. Ecol. 2016. V. 47. № 6. P. 526–531.]
Korkina I.N., Vorobeichik E.L. Humus Index as an indicator of the topsoil response to the impacts of industrial pollution // Appl. Soil Ecol. 2018. V. 123. P. 455–463.
Воробейчик Е.Л., Нестеркова Д.В. Техногенная граница распространения крота в районе воздействия медеплавильного завода: смещение в период сокращения выбросов // Экология. 2015. № 4. С. 308–312. [Vorobeichik E.L., Nesterkova D.V. Technogenic boundary of the mole distribution in the region of copper smelter impacts: Shift after reduction of emissions // Rus. J. Ecol. 2015. V. 46. № 4. P. 377–380.]
Сухарева Т.А., Лукина Н.В. Минеральный состав ассимилирующих органов хвойных деревьев после снижения уровня атмосферного загрязнения на Кольском полуострове // Экология. 2014. № 2. С. 97–104. [Sukhareva T.A., Lukina N.V. Mineral composition of assimilative organs of conifers after reduction of atmospheric pollution in the Kola Peninsula // Rus. J. Ecol. 2014. V. 45. № 2. P. 95–102.]
Belskii E., Grebennikov M. Snail consumption and breeding performance of pied flycatchers (Ficedula hypoleuca) along a pollution gradient in the Middle Urals, Russia // Sci. Total Environ. 2014. V. 490. P. 114–120.
Pacyna J.M., Pacyna E.G., Aas W. Changes of emissions and atmospheric deposition of mercury, lead, and cadmium // Atmos. Environ. 2009. V. 43. № 1. P. 117–127.
Babin-Fenske J., Anand M. Terrestrial insect communities and the restoration of an industrially perturbed landscape: assessing success and surrogacy // Restor. Ecol. 2010. V. 18. № S. 1. P. 73–84.
Babin-Fenske J., Anand M. Patterns of insect communities along a stress gradient following decommissioning of a Cu-Ni smelter // Environ. Pollut. 2011. V. 159. № 10. P. 3036–3043.
Nahmani J., Rossi J.-P. Soil macroinvertebrates as indicators of pollution by heavy metals // Comptes Rendus - Biologies. 2003. V. 326. № 3. P. 295–303.
Niemeyer J.C., Nogueira M.A., Carvalho G.M. et al. Functional and structural parameters to assess the ecological status of a metal contaminated area in the tropics // Ecotoxicol. Environ. Saf. 2012. V. 86. P. 188–197.
Ma W.-C., Eijsackers H. The influence of substrate toxicity on soil macrofauna return in reclaimed land // Animals in primary succession. The role of fauna in land reclamation. Cambridge, 1989. P. 223–244.
Curry J.P., Good J.A. Soil faunal degradation and restoration // Soil Restoration / Eds. Lal R., Stewart B.A. N.Y., 1992. P. 171–215.
Dunger W., Wanner M., Hauser H. et al. Development of soil fauna at mine sites during 46 years after afforestation // Pedobiologia. 2001. V. 45. № 3. P. 243–271.
Cristescu R.H., Frere C., Banks P.B. A review of fauna in mine rehabilitation in Australia: Current state and future directions // Biol. Conserv. 2012. V. 149. № 1. P. 60–72.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. [Vorobeichik E.L., Kaigorodova S.Y. Long-term dynamics of heavy metals in the upper horizons of soils in the region of a copper smelter impacts during the period of reduced emission // Eurasian Soil Science. 2017. V. 50. № 8. P. 977–990.]
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: Наука, 1994. 280 с.
Воробейчик Е.Л. Реакция почвенной биоты лесных экосистем Среднего Урала на выбросы медеплавильных комбинатов: Автореф. дис. … канд. биол. наук. Екатеринбург, 1995. 24 с.
Воробейчик Е.Л. Население дождевых червей (Lumbricidae) лесов Среднего Урала в условиях загрязнения выбросами медеплавильных комбинатов // Экология. 1998. № 2. С. 102–108. [Vorobeichik E.L. Populations of earthworms (Lumbricidae) in forests of the Middle Urals in conditions of pollution by discharge from copper works // Rus. J. Ecol. 1998. V. 29. № 2. P. 85–91.]
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V., Bergman I.E. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Rus. J. Ecol. 2014. V. 45. № 6. P. 498–507.]
Кайгородова С.Ю., Воробейчик Е.Л. Трансформация некоторых свойств серых лесных почв под действием выбросов медеплавильного комбината // Экология. 1996. № 3. С. 187–193. [Kaigorodova S.Y., Vorobeichik E.L. Changes in certain properties of grey forest soil polluted with emissions from a copper-smelting plant // Rus. J. Ecol. 1996. V. 27. № 3. P. 177–183.]
Воробейчик Е.Л. Сезонная динамика пространственного распределения целлюлозолитической активности почвенной микрофлоры в условиях атмосферного загрязнения // Экология. 2007. № 6. С. 427–437. [Vorobeichik E.L. Seasonal changes in the spatial distribution of cellulolytic activity of soil microflora under conditions of atmospheric pollution // Rus. J. Ecol. 2007. V. 38. № 6. P. 398–407.]
Mikryukov V.S., Dulya O.V., Vorobeichik E.L. Diversity and spatial structure of soil fungi and arbuscular mycorrhizal fungi in forest litter contaminated with copper smelter emissions // Water, Air, Soil Pollut. 2015. V. 226. № 4. Article 114. P. 1–14.
Сморкалов И.А., Воробейчик Е.Л. Механизм стабильности эмиссии СО2 из лесной подстилки в условиях промышленного загрязнения // Лесоведение. 2016. № 1. С. 34–43.
Кузнецова Н.А. Население почвообитающих коллембол в градиенте загрязнения хвойных лесов выбросами Среднеуральского медеплавильного завода // Экология. 2009. № 6. С. 439–448. [Kuznetsova N.A. Soil-dwelling Collembola in coniferous forests along the gradient of pollution with emissions from the Middle Ural Copper Smelter // Rus. J. Ecol. 2009. V. 40. № 6. P. 415–423.]
Ермаков А.И. Изменение структуры населения жужелиц лесных экосистем под действием токсической нагрузки // Экология. 2004. № 6. С. 450–455. [Ermakov A.I. Structural changes in the Carabid fauna of forest ecosystems under a toxic impact // Rus. J. Ecol. 2004. V. 35. № 6. P. 403–408.]
Бельская Е.А., Зиновьев Е.В. Структура комплексов жужелиц (Coleoptera, Carabidae) в природных и техногенно-нарушенных лесных экосистемах на юго-западе Свердловской области // Сибирский эколог. журн. 2007. № 4. С. 533–543.
Золотарев М.П., Нестерков А.В. Паукообразные (Aranei, Opiliones) лугов: реакция на загрязнение выбросами Среднеуральского медеплавильного завода // Экология. 2015. № 1. С. 48–56. [Zolotarev M.P., Nesterkov A.V. Arachnids (Aranei, Opiliones) in meadows: Response to pollution with emissions from the Middle Ural Copper Smelter // Rus. J. Ecol. 2015. V. 46. № 1. P. 81–88.]
Ермаков А.И. Изменение комплекса некрофильных беспозвоночных под действием загрязнения выбросами Среднеуральского медеплавильного завода // Экология. 2013. № 6. С. 463–470. [Ermakov A.I. Changes in the assemblage of necrophilous invertebrates under the effect of pollution with emissions from the Middle Ural Copper Smelter // Rus. J. Ecol. 2013. V. 44. № 6. P. 515–522.]
Бельская Е.А., Воробейчик Е.Л. Реакция филлофагов осины на выбросы Среднеуральского медеплавильного завода // Экология. 2013. № 2. С. 99–109. [Belskaya E.A., Vorobeichik E.L. Responses of leaf-eating insects feeding on aspen to emissions from the Middle Ural copper smelter // Rus. J. Ecol. 2013. V. 44. № 2. P. 108–117.]
Мухачева С.В. Многолетняя динамика концентрации тяжелых металлов в корме и организме рыжей полевки (Myodes glareolus) в период снижения выбросов медеплавильного завода // Экология. 2017. № 6. С. 461–471. [Mukhacheva S.V. Long-term dynamics of heavy metal concentrations in the food and liver of bank voles (Myodes glareolus) in the period of reduction of emissions from a copper smelter // Rus. J. Ecol. 2017. V. 48. № 6. P. 559–568.]
Бельская Е.А. Динамика трофической активности филлофагов березы в период снижения атмосферных выбросов медеплавильного завода // Экология. 2018. № 1. С. 74–80. [Belskaya E.A. Dynamics of trophic activity of leaf-eating insects on birch during reduction of emissions from the Middle Ural Copper Smelter // Rus. J. Ecol. 2018. V. 49. № 1. P. 87–92.]
Михайлова И.Н. Начальные этапы восстановления сообществ эпифитных лишайников после снижения выбросов медеплавильного завода // Экология. 2017. № 4. С. 277–281. [Mikhailova I.N. Initial stages of recovery of epiphytic lichen communities after reduction of emissions from a copper smelter // Rus. J. Ecol. 2017. V. 48. № 4. P. 335–339.]
Tyler G. Leaching rates of heavy metal ions in forest soil // Water, Air, Soil Pollut. 1978. V. 9. № 2. P. 137–148.
Воробейчик Е.Л., Пищулин П.Г. Промышленное загрязнение снижает роль деревьев в формировании структуры полей концентраций тяжелых металлов в лесной подстилке // Экология. 2016. № 5. С. 323–334. [Vorobeichik E.L., Pishchulin P.G. Industrial pollution reduces the effect of trees on forming the patterns of heavy metal concentration fields in forest litter // Rus. J. Ecol. 2016. V. 47. № 5. P. 431–441.]
Lajeunesse M.J. Bias and correction for the log response ratio in ecological meta-analysis // Ecology. 2015. V. 96. № 8. P. 2056–2063.
Елпатьевский П.В., Филатова Л.Д. Почвенная мезофауна в анoмальных эколого-геохимических условиях // География и природные ресурсы. 1988. № 1. С. 92–97.
Haimi J., Mätäsniemi L. Soil decomposer animal community in heavy-metal contaminated coniferous forest with and without liming // Eur. J. Soil Biol. 2002. V. 38. № 2. P. 131–136.
De Vries W., Römkens P.F.A.M., Schütze G. Critical soil concentrations of cadmium, lead, and mercury in view of health effects on humans and animals // Rev. Environ. Contam. Toxicol. 2007. V. 191. P. 91–130.
Sivakumar S. Effects of metals on earthworm life cycles: a review // Environ. Monit. Assess. 2015. V. 187. № 8. Article 530. P. 1–16.
McBride M., Sauvé S., Hendershot W. Solubility control of Cu, Zn, Cd and Pb in contaminated soils // Eur. J. Soil Sci. 1997. V. 48. № 2. P. 337–346.
Dube A., Zbytniewski R., Kowalkowski T. et al. Adsorption and migration of heavy metals in soil // Pol. J. Environ. Stud. 2001. V. 10. № 1. P. 1–10.
Воробейчик Е.Л., Позолотина В.Н. Микромасштабное пространственное варьирование фитотоксичности лесной подстилки // Экология. 2003. № 6. С. 420–427. [Vorobeichik E.L., Pozolotina V.N. Microscale spatial variation in forest litter phytotoxicity // Rus. J. Ecol. 2003. V. 34. № 6. P. 381–388.]
Grumiaux F., Demuynck S., Pernin C., Leprêtre A. Earthworm populations of highly metal-contaminated soils restored by fly ash-aided phytostabilisation // Ecotoxicol. Environ. Saf. 2015. V. 113. P. 183–190.
Kapusta P., Sobczyk L. Effects of heavy metal pollution from mining and smelting on enchytraeid communities under different land management and soil conditions // Sci. Total Environ. 2015. V. 536. P. 517–526.
Schellhorn N.A., Bianchi F., Hsu C.L. Movement of entomophagous arthropods in agricultural landscapes: Links to pest suppression // Annu. Rev. Entomol. 2014. V. 59. P. 559–581.
Wellings P.W. How variable are rates of colonization? // Eur. J. Entomol. 1994. V. 91 №1. P. 121–125.
Eijsackers H. Earthworms as colonisers: Primary colonisation of contaminated land, and sediment and soil waste deposits // Sci. Total Environ. 2010. V. 408. № 8. P. 1759–1769.
Eijsackers H. Earthworms as colonizers of natural and cultivated soil environments // Appl. Soil Ecol. 2011. V. 50. № 1. P. 1–13.
Cameron E.K., Bayne E.M. Spatial patterns and spread of exotic earthworms at local scales // Can. J. Zool. 2015. V. 93. № 9. P. 721–726.
Крамаренко С.С. Активная и пассивная миграция наземных моллюсков: обзор // Ruthenica. 2014. V. 24. № 1. P. 1–14.
Ozgo M., Bogucki Z. Colonization, stability, and adaptation in a transplant experiment of the polymorphic land snail Cepaea nemoralis (Gastropoda: Pulmonata) at the edge of its geographical range // Biol. J. Linn. Soc. 2011. V. 104. № 2. P. 462–470.
Gongalsky K.B., Belorustseva S.A., Kuznetsova D.M., et al. Spatial avoidance of patches of polluted chernozem soils by soil invertebrates // Insect Sci. 2009. V. 16. № 1. P. 99–105.
Гонгальский К.Б., Филимонова Ж.Б., Зайцев А.С. Связь пространственного распределения численности почвенных беспозвоночных и содержания тяжелых металлов в почве в окрестностях Косогорского металлургического комбината (Тульская обл.) // Экология. 2010. № 1. С. 70–73. [Gongalsky K.B., Filimonova Z.V., Zaitsev A.S. Relationship between soil invertebrate abundance and soil heavy metal contents in the environs of the Kosogorsky Metallurgical Plant, Tula oblast // Rus. J. Ecol. 2010. V. 41. № 1. P. 67–70.]
Lukkari T., Haimi J. Avoidance of Cu- and Zn-contaminated soil by three ecologically different earthworm species // Ecotoxicol. Environ. Saf. 2005. V. 62. № 1. P. 35–41.
Воробейчик Е.Л., Ермаков А.И., Нестеркова Д.В., Гребенников М.Е. Крупные древесные остатки как микростации обитания почвенной мезофауны на загрязненных территориях // Изв. РАН. Сер. биол. 2019. В печати.
Артемьев А.В. Популяционная экология мухоловки-пеструшки в северной зоне ареала. М.: Наука, 2008. 267 с.
Дополнительные материалы отсутствуют.


