Экология, 2019, № 2, стр. 125-132
Зависимость продолжительности покатной миграции личинок налима (Lota lota) от гепатосоматического индекса производителей
А. Р. Копориков a, *, В. Д. Богданов a, **
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: Koporikov@mail.ru
** E-mail: Bogdanov@ipae.uran.ru
Поступила в редакцию 28.08.2018
После доработки 10.09.2018
Принята к публикации 05.09.2018
Аннотация
Оценили зависимость продолжительности покатной миграции личинок налима за 20 лет наблюдений (с 1999 г. по 2018 г.) на р. Войкар (бассейн нижней Оби) от относительной упитанности полупроходных производителей, поднимающихся осенью в нерестовый приток. Для оценки относительной упитанности производителей использовали наблюдаемые (11 лет) и расчетные (9 лет) показатели гепатосоматического индекса. Использовали расчет показателей гепатосоматического индекса с помощью медианной квантильной регрессии на основе оценок максимального уровня затопления поймы и суммы среднесуточных температур воды в период открытого русла в местах летнего нагула производителей. Установили сильную высокозначимую отрицательную корреляционную зависимость продолжительности покатной миграции молоди, а также числа пиков численности от показателей гепатосоматического индекса производителей. Сделано предположение о связи относительной упитанности производителей со сроками их подъема на нерестилища. В свою очередь время подъема детерминирует доступность для производителей нерестовых участков реки, что в дальнейшем определяет сроки вылупления личинок налима.
Время наступления массового выхода личинок рыб из икры – один из первых значимых моментов в онтогенезе, во многом определяющий будущую численность поколения [1]. Если вылупившиеся личинки большей частью попадают в условия, неблагоприятные для перехода на экзогенное питание, то численность поколения может быть снижена из-за высокой элиминации [2–7]. Наоборот, если массово вылупившиеся личинки рыб достигают мест нагула во время экологического оптимума, то это способствует их повышенной выживаемости, что благоприятно сказывается на общей динамике численности популяции [8–13]. Как правило, в природе второй вариант развития событий доминирует из-за эволюционно обусловленной синхронизации этапов онтогенеза с сезонными изменениями окружающей среды [14].
Иногда изучение формирования конкретных механизмов приспособления организмов к условиям среды вынужденно остается за пределами интересов или возможностей исследователей. В первую очередь это связано с тем, что при выявлении закономерностей, происходящих в природе, исследователь сталкивается с большим количеством побочных факторов, искажающих общую картину [15, 16]. Эксперимент позволяет отсечь большую часть таких факторов, не относящихся непосредственно к исследованию, но полученные в ходе эксперимента данные обычно имеют рафинированный вид и могут слабо соотноситься с реальностью [17]. Для того чтобы выполнить исследование в естественных условиях и вычленить побочное влияние сторонних факторов, требуется многолетний мониторинг изучаемого явления.
Цель настоящей работы – на основе 20-летнего мониторинга воспроизводства полупроходного налима (Lota lota L., 1758) выявить закономерности наступления пика и продолжительности ската его личинок.
За 20-летний период наших наблюдений сроки наступления весенних явлений и ледохода изменялись в широком диапазоне (дата ледохода изменялась от 5 мая до 12 июня). Такие фенологические колебания затрудняли анализ имеющихся данных.
В наших предыдущих работах [18, 19; и др.] мы рассматривали некоторые вопросы, посвященные физиологическому состоянию производителей полупроходного налима. Была показана связь между гепатосоматическим индексом и индивидуальной абсолютной плодовитостью, выживаемостью рыб и т.д., а также зависимость гепатосоматического индекса от условий среды в период открытого русла.
Традиционно сроки весеннего вылупления и ската личинок рыб с мест инкубации икры связывают с изменением температуры воды, инсоляции, скорости потока и расходов воды [20–24]. Нам не известны работы, в которых анализируется зависимость сроков ската ранней молоди с мест инкубации икры от физиологического состояния производителей перед нерестом. Отсутствие таких исследований может быть обосновано тем, что, за исключением редких случаев у рыб, когда родители заботятся о своем потомстве, икра во время инкубации и личинки после вылупления уже не связаны с родителями. Может наблюдаться некоторая положительная зависимость, опосредованная общей численностью покатников, которая зависит от общего фонда отложенной икры и успешности выживания икры на местах ее инкубации [25].
Таким образом, мы проверяли следующую рабочую гипотезу: сроки пика ската личинок налима на нерестовом притоке не зависят от физиологического состояния производителей.
МАТЕРИАЛ И МЕТОДЫ
Район исследования
Исследование проводили с 1999 по 2018 г. в р. Войкар – четвертом по величине бассейна (8.1 тыс. км2) уральском нерестовом притоке нижней Оби (рис. 1). За исток Войкара принимают р. Большая Лагорта, берущую начало на юго-восточном склоне Полярного Урала на высоте около 550 м над ур. м. Ее общая длина от истока до устья равна 166 км, из которых примерно 80 км приходится на горную часть бассейна [26, 27]. Если считать длину реки от истоков ручья Лёк-Хойла (бассейн р. Танью), то длина р. Войкар составляет около 225 км. В предгорной части на высоте 43 м над ур. м. находится мелководное оз. Варчато площадью 55 км2. В северо-восточную часть озера впадает нерестовый приток Танью, из юго-западной части вытекает протока Варча-Ты-Вис. С юга бассейн р. Войкар граничит с бассейном р. Сыня, с северо-востока – с бассейном р. Собь, с северо-запада водораздельный хребет ограничивает от бассейна р. Юньяха (бассейн р. Усы).
Рис. 1.
Карта-схема района работ: 1, 2 и 3 – соответственно районы нижних, средних и верхних нерестилищ; учетный створ на р. Войкар отмечен поперечной линией, пересекающей течение реки на нижнем участке нерестилищ.
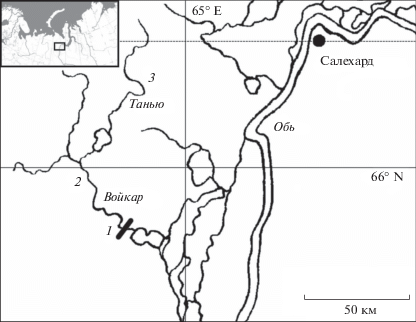
На р. Войкар учетный створ оборудован в 36 км от устья (14 км выше от пос. Вершина Войкар), в конце спрямленного плесового участка русла протяженностью около 1 км. Ширина реки в месте створа изменяется от 185 м в зимнюю межень до 236 м во время паводка. Русло реки сдвинуто ближе к правому берегу. Максимальная глубина на стрежне реки меняется от 2.1 м в межень и до 5.4 м во время паводка. В 2 км выше створа по правому берегу находится приток Нанкъеган. В половодье вода р. Нанкъеган течет вдоль правого берега р. Войкар, что учтено при расчете численности покатной молоди.
Лов и анализ производителей
Сбор материала по физиологическому состоянию производителей полупроходного налима проводили в 2000, 2004–2007, 2010–2014 и 2016 гг. (11 лет) во время осеннего нагульно-преднерестового подъема в р. Войкар с использованием различных орудий лова: неводов, ставных и плавных сетей, крючковой снасти. Всего обработано 355 экз. налима.
Взвешивание рыб и их органов проводили на электронных весах Kern (модели CH15K20 и 442-51). Для оценки относительной упитанности производителей применяли показатели гепатосоматического индекса (HSI) [28], которые рассчитывали как процентное отношение массы печени к массе тела без внутренностей [29]. Использование при расчетах HSI показателя массы тела без внутренностей позволяет избежать ошибок, связанных с наполненностью желудка (по нашим данным, до 30% от массы тела без внутренностей) и состоянием гонад (до 40% от массы тела без внутренностей у самцов перед началом нереста).
Расчет показателей гепатосоматического индекса
Для того чтобы полностью сравнить ряд наблюдений по покатной миграции ранней молоди налима с мест инкубации икры с данными по физиологическому состоянию производителей (величина HSI), было решено дополнить годы, по которым отсутствуют наблюдаемые данные по HSI, расчетными значениями.
Ранее в нашей работе [19] указывалось, что HSI производителей полупроходного налима имеет статистически высокозначимую зависимость от условий летнего нагула в пойме. Для р. Войкар с помощью медианной квантильной регрессии [30] было построено уравнение (1), позволяющее с высокой степенью детерминации (r1 = 0.90) предсказывать величину HSI налима во время осенней преднерестовой миграции на основании данных инструментально измеряемых параметров среды (максимального уровня затопления поймы и суммы среднесуточных температур воды за период открытого русла):
где HEP – расчетное значение HSI производителей; Hmax% – показатель максимального уровня затопления поймы; SumT% – показатель суммы среднесуточных температур воды в период открытого русла; 0.179 и –0.112 – рассчитанные для р. Войкар регрессионные коэффициенты (уровень статистической значимости p ≤ 0.001) показателей максимального уровня затопления поймы и суммы среднесуточных температур воды.Сбор данных и анализ продолжительности и интенсивности покатной миграции личинок налима
Наблюдения за покатной миграцией ранней молоди налима начинали проводить с началом весенних явлений (конец апреля–первая декада мая) и заканчивали после прекращения ската в последней декаде мая – первой декаде июня. В отдельные годы сроки начала и конца наблюдений могли изменяться в соответствии с фенологическими особенностями года. Сбор материала по дрифту икры и скату личинок осуществляли с использованием метода учета стока [31, 33]. Всего за годы исследований собрана 721 проба.
Абсолютную численность личинок, прошедших через учeтный створ, определяли по формуле
где N – общее число личинок; Sр – площадь поперечного сечения створа речного русла без льда (м2); Vр – средняя cкорость течения в реке (м/с); m – среднее число личинок налима в пробах, попадаемое в ловушку за единицу времени (экз./с); T – расчетный период времени (секунды), составляющий обычно 6, 12 или 24 ч; Sлов – площадь входного отверстия конусной ловушки (м2); Vлов – средняя cкорость течения в конусной ловушке (м/с). Общая погрешность применяемого метода не превышала 40%, чаще была близка к 30% [32].Эффективность фильтрации ловушки изменялась в зависимости от продолжительности лова, скорости течения и количества выносимых взвесей от 1.0 до 0.7. Эта величина установлена эмпирически по соотношению скоростей течения в ловушке и потоке (в месте установки ловушки) и использовалась при расчете расхода воды в ловушке в тех случаях, когда мы располагали только значениями скоростей течения в потоке [31, 32].
Сбор материала проводили на льду (до ледохода) или по открытой воде (после ледохода). Отбор проб дрифта на льду осуществляли с помощью ряда майн, прорубленных через равное расстояние во льду перпендикулярно течению реки. Пробы дрифта по открытой воде отбирали с лодки, поставленной на якорь в стандартных точках. Применяемые для сбора конусные ловушки были изготовлены из капронового мельничного газа № 21 и имели стандартную площадь входного отверстия 0.25 м2. Глубину отбора проб регулировали с помощью шестов (подо льдом) или с помощью системы груз–поплавок, прикрепляемой к ловушке (по открытой воде).
Статистический анализ
Статистический анализ выполнен с использованием программ Matrixer 5.1 [34] и SPSS Statistics 17.0. Расчет показателей HSI в годы, когда отсутствовали эмпирические значения, проводили с помощью медианной квантильной регрессии. Наличие связи между показателями HSI производителей и данными по скату покатных личинок на учетном створе оценивали с помощью коэффициента ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ
В дополнение к эмпирическим значениям HSI производителей налима, поднимающихся осенью в нерестовый приток р. Войкар, использовали расчетные значения HSI (табл.1), полученные с помощью уравнения (1) для 9 лет (1998–1999, 2001–2003, 2008–2009 и 2015, 2017 гг.). Для отдельных лет расчетный показатель не совпадал с реально наблюдаемым. Например, в начале осени 2016 г. (скат молоди весной 2017 г.) среднее значение HSI у производителей реально было равно 3.9 (см. табл. 1), в то время как расчетный показатель должен был быть равен 2.9. Вероятно, низкое среднее по выборке значение расчетного HSI физиологически мало достижимо, так как формально HSI может быть равен 0 (полное отсутствие печени), но на практике это невозможно.
Таблица 1.
Зависимость продолжительности покатной миграции и числа пиков ската личинок налима от значений HSI производителей
| Значения HSI | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| экстремально низкие | средние | высокие | |||||||||
| I | II | III | IV | I | II | III | IV | I | II | III | IV |
| 2013 | 4.9 | 4 | 1 | 2001 | 6.3 | 20 | 3 | 1999 | 8.2 | 0 | 1 |
| 2014 | 4.4 | 10 | 2 | 2004 | 6.4 | 4 | 2 | 2000 | 11.0 | 1 | 1 |
| 2017 | 3.9 | 3 | 2 | 2006 | 5.7 | 9 | 3 | 2002 | 7.4 | 1 | 1 |
| 2009 | 6.7 | 11 | 2 | 2003 | 8.9 | 2 | 1 | ||||
| 2010 | 6.8 | 11 | 2 | 2005 | 7.7 | 3 | 1 | ||||
| 2011 | 6.4 | 12 | 2 | 2007 | 7.4 | 3 | 1 | ||||
| 2012 | 6.0 | 9 | 2 | 2008 | 7.5 | 1 | 1 | ||||
| 2018 | 6.9 | 12 | 3 | 2015 | 9.9 | 1 | 1 | ||||
| 2016 | 7.6 | 1 | 1 | ||||||||
| Мин | 3.9 | 3 | 1 | Мин | 5.7 | 4 | 2 | Мин | 7.4 | 0 | 1 |
| Макс | 4.9 | 10 | 2 | Макс | 6.9 | 20 | 3 | Макс | 11.0 | 3 | 1 |
| Среднее | 4.4 | 5.7 | 1.7 | Среднее | 6.4 | 11.0 | 2.4 | Среднее | 8.4 | 1.4 | 1.0 |
Примечание. I – год наблюдения покатной миграции ранней молоди налима с мест инкубации икры; II – HSI производителей в конце лета–начале осени года, предыдущего скату ранней молоди; III – количество суток с даты ледохода на учетном створе и до последнего пика ската; IV – количество пиков ската; полужирным выделены расчетные показатели HSI.
Начало покатной миграции личинок налима совпадает с началом весенних явлений на реке (апрельские оттепели) и освежением воды. Скорость течения при этом близка к скорости во время зимней межени. Время массового вылупления личинок налима совпадает с началом ледохода, так как в это время в наибольшей степени проявляются факторы среды (механическое раздражение, температурные колебания, повышенная соляризация, увеличение содержания кислорода в воде и т.д.), активирующие физиологические механизмы вылупления [35–38].
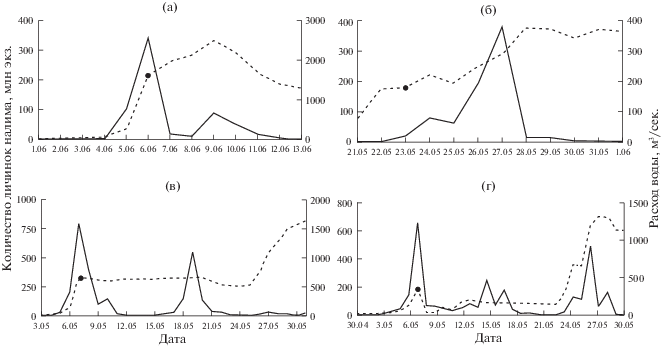
Пик ската в районе учетного створа зависит от удаленности мест инкубации икры. Ранее нами [38] указывалось, что места инкубации икры у налима в водотоках могут не совпадать с местами нереста производителей, что обусловлено высокой степенью плавучести икры при повышении скорости течения выше 0.04 м/с [39]. Если основные места инкубации икры находятся в зоне учетного створа, то пик ската происходит несколько раньше или совпадает по срокам с ледоходом (рис. 2а). Если большая часть икры инкубируется значительно выше района учетного створа, то пик ската происходит спустя несколько суток после ледохода на учетном створе (рис. 2б). В отдельные годы на р. Войкар были отмечены два (рис. 2в) и даже три и более пиков (рис. 2г) численности покатных личинок налима, что объясняется несколькими крупными участками инкубации икры.
Рис. 2.
Варианты покатной миграции личинок налима (сплошная линия) на р. Войкар: а – 2017 г., б – 2013 г., в – 2011 г., г – 2001 г.; черная точка на графике расхода воды (пунктирная линия) обозначает день ледохода.
Подобная ситуация возможна в условиях, когда разные группы производителей налима используют значительно удаленные друг от друга нерестилища. Река Войкар отличается от других уральских нерестовых притоков наличием крупного мелководного предгорного оз. Варчато, которое разделяет верхние нерестилища (150 км и выше от устья – нерестилища на р. Танью) от средних (70 км от устья – район ур. Антенны) и нижних (35 км и выше от устья – район учетного створа). Уникальное расположение нерестилищ на р. Войкар позволяет производителям более полно использовать нерестовые участки реки. При этом снижаются численность производителей и количество инкубируемой икры на единицу площади, повышается выживаемость как взрослых рыб, так и самой икры.
Завершение ската личинок налима, как правило, происходит на фоне роста расходов воды. Вынос незначительного количества покатной молоди может продолжаться еще какое-то время после пика из-за постепенного вскрытия отдельных удаленных участков верхних нерестилищ. Для р. Войкар, например, из-за буферного эффекта оз. Варчато характерна некоторая задержка поступления личинок налима с нерестилищ р. Танью в пойменную систему р. Войкар. Всего за время наблюдений на р. Войкар (20 лет) отмечено 10 однопиковых скатов и 10 скатов, где зафиксировано 2 и более пика численности личинок (см. табл. 1).
Для определения продолжительности покатной миграции имеет значение время наступления последнего пика численности личинок, зафиксированного на учетном створе. Условия конкретного года могут сильно отличаться от среднемноголетних значений, и наступление весенних явлений может быть как бурным, так и затяжным (что накладывает отпечаток на общую продолжительность ската). Исходя из этого в качестве одного из критериев, описывающих продолжительность покатной миграции, решено взять количество суток с момента ледохода до последнего пика численности. Другой критерий, который описывает крупные участки инкубации икры в р. Войкар, – число пиков численности покатной молоди, наблюдаемых в конкретный год.
Между показателями HSI производителей налима, поднимающихся в начале осени по р. Войкар, и длительностью ската личинок после ледохода весной следующего года (rS = –0.650 при n = 20, p ≤ 0.01), а также количеством пиков численности ската (rS = –0.676 при n = 20, p ≤ 0.01) существует отрицательная высокозначимая средняя корреляция.
При анализе условий среды и данных HSI обращает на себя внимание ряд экстремальных лет (2012, 2016 – годы с экстремально высоким прогревом воды и 2012, 2013 – годы с экстремально низким уровнем затопления поймы). Именно в эти годы наблюдается предельно низкий показатель HSI у производителей, поднимающихся осенью к нерестовым участкам (см. табл. 1). При исключении из расчетов экстремальных лет показатель коэффициента ранговой корреляции Спирмена становится отрицательным сильным и высокозначимым: без 2012 и 2016 гг. корреляция между показателями HSI за предыдущий год наблюдений и временем в сутках между ледоходом и последним пиком численности покатных личинок на учетном створе – rs = –0.740 (n = 18, p ≤ 0.01), количеством пиков покатной миграции – rs = –0.823 (n = 18, p ≤ 0.01): без 2012, 2013 и 2016 гг. корреляция между показателями HSI за предыдущий год наблюдений и временем в сутках между ледоходом и последним пиком численности покатных личинок на учетном створе равна rS = –0.760 (n = 17, p ≤ 0.01), количеством пиков покатной миграции rS = –0.843 (n = 17, p ≤ 0.01).
Таким образом, рабочая гипотеза не подтвердилась. Сроки пика ската личинок налима на нерестовом притоке Войкар зависят от физиологического состояния производителей во время осенней нагульно-преднерестовой миграции.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По данным многолетних наблюдений, вскрытие льда в уральских нерестовых притоках происходит не одновременно на всем протяжении их течения, а от нижних участков к верхним. Такая особенность объясняется вертикальной зональностью – чем выше в горы (т.е. к истокам реки), тем вскрытие реки происходит позднее. Самое раннее вскрытие льда в бассейне уральских рек наблюдается на пойменном участке, куда поступают относительно теплые воды р. Обь, наиболее поздно вскрываются горные участки реки.
Время разрыва в сутках между ледоходом и первым пиком численности покатных личинок показывает, как далеко от учетного створа находится ближайший (в отдельные годы единственный) участок инкубации икры. Если пик ската совпадает с ледоходом, то место инкубации икры расположено непосредственно в районе учетного створа. Чем дальше от учетного створа находятся места инкубации икры (ближе к горным участкам), тем позднее на учетном створе будет зафиксирован пик численности.
На основании наличия статистически высокозначимой отрицательной корреляции между величиной энергетических запасов в организме производителей (HSI), заходящих осенью в нерестовые притоки на нагульно-нерестовую миграцию, и сроками весенней покатной миграции ранней молоди появляется возможность выявить картину использования налимом нерестовых участков в осенне-зимний период.
В табл. 1 показано, что если у производителей налима в конце периода открытого русла HSI имеет средние значения (5.7–6.9), то весной следующего года наблюдается несколько пиков ската личинок, а время между ледоходом на учетном створе и датой последнего пика численности покатников составляет от 4 до 20 сут (в среднем 11.0). Из этого следует, что производители массово откладывают икру не только в районе нижних нерестилищ (район учетного створа) – первый пик ската после ледохода, но и выше по течению – в районе средних и верхних нерестилищ.
Механизм распределения производителей по нерестилищам может быть следующим. Если гидрологическая ситуация в период открытого русла близка к многолетней норме, то происходит умеренное снижение запасов жира в организме [18]. К концу лета из-за падения уровня воды и повышения температуры в придонном слое производители налима покидают Обскую пойменную систему и заходят в русло уральских нерестовых притоков, так как последние имеют более низкую температуру воды. Подъемная миграция растянута по времени и занимает до 3–4 мес. (конец августа–начало декабря). За это время производители продолжают питаться, у них наблюдается увеличение гепато- и гонадосоматических индексов [18]. Продолжительная по времени анадромная миграция позволяет освоить верхние участки нерестилищ.
Напротив, если условия летнего нагула в пойме благоприятны (высокий уровень затопления и низкая температура прогрева воды), а производители имеют достаточные запасы жира (высокие значения HSI), то заход в нерестовые притоки откладывается на длительное время. Это объясняется тем, что в Обской пойме больше доступных объектов питания, чем в нерестовых притоках. Заход в русло притоков осуществляется ближе к времени нереста (конец осени). Созревание гонад у большей части производителей происходит еще в пойменной системе, и до начала нереста (декабрь) производители массово успевают подняться только до нижних участков нерестилищ.
При наличии экстремально негативных условий среды в летний период в пойменной системе Оби (2012, 2013, 2016 гг.), скорее всего, миграционная активность производителей снижается, подъем в нерестовые притоки откладывается до осеннего понижения температуры. Заход в русло нерестовых притоков происходит позже, чем в годы со средними показателями HSI, но значительно раньше, чем в годы с благоприятными условиями летнего нагула. При этом у производителей может быть недостаточно энергетических запасов для подъема против течения горных рек к верхним нерестилищам. По времени наступления последнего пика ската личинок и общему количеству пиков численности годы с экстремально низкими значениями HSI у производителей налима занимают промежуточное значение между годами со средними и высокими показателями.
Важное место в сохранении ихтиоценозов имеет охрана нерестилищ и мест инкубации икры. Полученные нами результаты на основе инструментально измеряемых параметров среды (максимального уровня затопления поймы и суммы среднесуточных температур воды за период открытого русла) и эмпирически наблюдаемых данных о физиологическом состоянии производителей дают возможность указывать вероятные места нерестилищ и инкубации икры, предсказывать сроки покатной миграции ранней молоди.
ВЫВОДЫ
1. Начало ската определяется началом весенних явлений на реке, завершение ската личинок налима происходит вскоре после последнего пика численности.
2. Выдвинутая рабочая гипотеза не подтвердилась. Сроки пика ската личинок налима на нерестовом притоке р. Войкар зависят от физиологического состояния производителей во время осенней нагульно-преднерестовой миграции.
3. Если условия летнего нагула близки к многолетней норме и снижение запасов жира в организме умеренное, то производители относительно рано покидают Обскую пойменную систему и заходят в русло нерестовых притоков, имеющих более низкую температуру воды. В ходе миграции происходят дальнейшее увеличение запасов жира и подъем на более высокие участки нерестилищ. В этом случае весенняя покатная миграция ранней молоди налима имеет протяженный характер и 2–3 пика численности.
4. Если условия летнего нагула в пойме близки к оптимальным (низкая температура прогрева воды) и производители имеют достаточные запасы жира (высокие значения HSI), то их подъем в нерестовые притоки откладывается на достаточно длительное время. Массовый заход в русло притоков осуществляется ближе к времени нереста (конец осени). При этом производители успевают подняться только до ближайших доступных участков нерестилищ. При таких условиях наблюдается единственный пик ската, совпадающий с ледоходом или происходящий сразу после него.
5. При наличии экстремально негативных условий среды в период открытого русла в пойменной системе Оби (высокий прогрев воды) миграционная активность производителей снижается. Подъем в нерестовые притоки происходит после осеннего понижения температуры. Заход в русло нерестовых притоков происходит позже, чем в годы со средними показателями HSI, но значительно раньше, чем в годы с благоприятными условиями летнего нагула. В этом случае скат имеет один или два пика численности, продолжительность ската ниже, чем в годы, когда производители имеют средние значения HSI.
Работа выполнена при поддержке Программы УрО РАН № 18-4-24 и РФФИ (проект № 16-44-890 070). Авторы признательны к.б.н. О.А. Госьковой (Институт экологии растений и животных УрО РАН) за предоставленные материалы по водности поймы Оби, д.б.н. Д.В. Веселкину (Институт экологии растений и животных УрО РАН) – за помощь при обсуждении результатов.
Список литературы
Hjort J. Fluctuations in the great fisheries of northern Europe viewed in the light of biological research // ICES J. Marine Science. 1914. V. 20. 228 p.
Богданов В.Д. Состояние и перспективы воспроизводства сиговых рыб нижней Оби // Биология, биотехника разведения и состояние запасов сиговых рыб. Тюмень: ФГУП Госрыбцентр, 2013. С. 16–20.
Госькова О.А. Современное состояние воспроизводства сиговых рыб в р. Сыня (нижняя Обь) // Биология, биотехника разведения и состояние запасов сиговых рыб. Тюмень: ФГУП Госрыбцентр, 2013. С. 62–66.
Robert D., Murphy H.M., Jenkins G.P. et al. Poor taxonomical knowledge of larval fish prey preference is impeding our ability to assess the existence of a “critical period” driving year-class strength // ICES J. Marine Science. 2013. V. 71. Is. 8. P. 2042–2052.
China V., Holzman R. Hydrodynamic starvation in first-feeding larval fishes // Proceedings of the National Academy of Sciences. 2014. V. 111. Is. 22. P. 8083–8088.
Garrido S., Ben-Hamadou R., Santos A.M.P. et al. Born small, die young: Intrinsic, size-selective mortality in marine larval fish // Scientific reports. 2015. V. 5. P. 17065.
Berrut S., Pouillard V., Richmond P. et al. Deciphering infant mortality // Physica A: Statistical Mechanics and its Applications. 2016. Is. 463. P. 400–426.
Копориков А.Р., Богданов В.Д. Особенности пространственно-биотопического распределения ранних личинок полупроходного налима (Lotidae) в пойме нижней Оби // Экология. 2011. № 4. С. 309–313. [Koporikov A.R., Bogdanov V.D. Spatial and Biotopic Distribution Patterns of Semianadromous Burbot, Lota lota L. (Lotidae), Early Larvae in the Lower Ob Floodplain // Rus. J. Ecol. 2011. V. 42. №. 4. P. 339–343. doi 10.1134/S1067413611040084]
Swalethorp R., Kjellerup S., Malanski E. et al. Feeding opportunities of larval and juvenile cod (Gadus morhua) in a Greenlandic fjord: temporal and spatial linkages between cod and their preferred prey // Marine biology. 2014. V. 161. Is. 12. P. 2831–2846.
Sabatés A., Zaragoza N., Raya V. Distribution and feeding dynamics of larval red mullet (Mullus barbatus) in the NW Mediterranean: the important role of cladocera // J. plankton research. 2015. V. 37. Is. 4. P. 820–833.
Abdelouahab H., Berraho A., Ramzi A. et al. Mortality of early life stages of European pilchard Sardina pilchardus along the Atlantic Coast of Northwest Africa (22°30′ N–26° N) // Revista de biología marina y oceanografía. 2016. V. 51. Is. 3. P. 483–492.
Swalethorp R., Nielsen T.G., Thompson A.R. et al. Early life of an inshore population of West Greenlandic cod Gadus morhua: spatial and temporal aspects of growth and survival // Marine Ecol. Progress Series. 2016. V. 555. P. 185–202.
Teodósio M.A., Garrido S., Peters J. et al. Assessing the impact of environmental forcing on the condition of anchovy larvae in the Cadiz Gulf using nucleic acid and fatty acid-derived indices // Estuarine, Coastal and Shelf Science. 2017. V. 185. P. 94–106.
Gollin E.S. The comparative development of adaptive skills: Evolutionary implications. Routledge, 2018. 292 p.
Флейшман Б.С., Брусиловский П.М., Розенберг Г.С. О методах математического моделирования сложных систем // Системные исследования. Методологические проблемы. Ежегодник. М., 1982. С. 65–79.
DeAngelis D.L. Individual-based models and approaches in ecology: populations, communities and ecosystems. CRC Press, 2018. 545 p.
Кеннеди К.Р. Популяционная биология паразитов: современное состояние и перспективы // Паразитология. 1985. Т. 19. №. 5. С. 347–355.
Копориков А.Р., Богданов В.Д. Изменение относительной упитанности полупроходного налима (Lotidae) Оби в зависимости от физиологического состояния и условий нагула // Экология. 2013. № 3. С. 210–215. doi 10.7868/S0367059713030074[Koporikov A.R., Bogdanov V.D. Changes in the hepatosomatic index of semianadromous burbot, Lota lota L. (Lotidae), in the Ob River depending on fish physiological state and foraging conditions // Rus. J. Ecol. 2013. V. 44. № 3. P. 233–238. doi 10.1134/S1067413613030077]
Копориков А.Р., Богданов В.Д. Влияние условий среды в период открытого русла на изменение относительной упитанности полупроходного налима (Lotidae) реки Обь // Экология. 2014. № 6. С. 417–421. doi 10.7868/S0367059714060079 [Koporikov A.R., Bogdanov V.D. The effect of environmental conditions of the open channel period on the relative body condition of semianadromous burbot, Lota lota L. (Lotidae), in the Ob River// Rus. J. Ecology. 2014. V. 45. № 6. P. 463–466. doi 10.1134/S1067413614060071]
Næsje T., Jonssons B., Skurdal J. Spring flood: a primary cue for hatching of river spawning Coregoninae // Can. J. Fisheries and Aquatic Sciences. 1995. V. 52. Is. 10. P. 2190–2196.
Jude D.J., Tesar F.J., Tin H.T. Spring distribution and abundance of larval fishes in the St. Marys River, with a note on potential effects of freighter traffic on survival of eggs and larvae // J. Great Lakes Research. 1998. V. 24. Is. 3. P. 569–581.
Palińska-Żarska K., Żarski D., Krejszeff S. et al. Dynamics of yolk sac and oil droplet utilization and behavioural aspects of swim bladder inflation in burbot, Lota lota L., larvae during the first days of life, under laboratory conditions // Aquaculture international. 2014. V. 22. Is. 1. P. 13–27.
Tucker T.R., Roseman E.F., DeBruyne R.L. et al. Long-term assessment of ichthyoplankton in a large North American river system reveals changes in fish community dynamics // Can. J. Fisheries and Aquatic Sciences. 2018. V. 999. P. 1–16.
Богданов В.Д., Мельниченко С.М., Мельниченко И.П. Скат личинок сиговых рыб в районе нерестилищ на р. Манья (бассейн нижней Оби) // Вопр. ихтиологии. 1991. Т. 31. С. 776–782.
Богданов В.Д., Богданова Е.Н. Экологические аспекты покатной миграции личинок сиговых рыб при длительном миграционном пути // Экология. № 4. 2012. С. 1–8. [Bogdanov V.D., Bogdanova E.N. Ecological aspects of larval drift in coregonids with long migration routes // Rus. J. Ecol. 2012. V. 43. Is. 4. P. 315–322.]
Кеммерих А.О. Гидрография Северного, Приполярного и Полярного Урала. М.: Изд-во АН СССР, 1961. 139 с.
Государственный водный реестр (http://textual.ru/ gvr) (дата обращения: 17.11.2017).
Cott P.A., Amos A.L., Guzzo M.M. et al. Can traditional methods of selecting food accurately assess fish health? // Arctic Science. 2018. V. 4. Is. 2. P. 205–222.
Инструкции и методические рекомендации по сбору и обработке биологической информации в районах исследований ПИНРО. Мурманск: Изд-во ПИНРО, 2001. 291 с.
Koenker R., Bassett G. Regression quantiles // Econometrica. 1978. V. 46. Is. 1. P. 33–50.
Павлов Д.С., Нездолий В.К., Ходоревская Р.П. и др. Покатная миграция молоди рыб в реках Волга и Или. М.: Наука, 1981. 320 с.
Богданов В.Д. Изучение динамики численности и распределения личинок сиговых рыб реки Северной Сосьвы. Свердловск: УНЦ АН СССР, 1987. 60 с.
Pavlov D.S., Nazarov D.Y., Zvezdin A.O. et al. Downstream migration of early larvae of the European river lamprey Lampetra fluviatilis // Doklady Biological Sciences. Pleiades Publishing, 2014. V. 459. Is. 1. P. 344–347.
Цыплаков А. Эконометрическая программа Matrixer 5.1 (http://www.matrixer.narod.ru) (дата обращения: 09.02.2014).
Володин В.М. Влияние температуры и рН на эмбриональное развитие налима // Бюл. Ин-та биологии водохранилищ АН СССР. 1960. № 7. С. 26–30.
Vught I., Harzevilli A.S., Auwerx J. et al. Aspects of reproduction and larviculture of burbot under hatchery conditions // American Fisheries Society. 2008. V. 59. P. 167.
Lahnsteiner F., Kletzl M., Weismann T. The effect of temperature on embryonic and yolk-sac larval development in the burbot Lota lota // J. Fish Biol. 2012. V. 81. Is. 3. P. 977–986.
Богданов В.Д., Копориков А.Р. Воспроизводство налима нижней Оби. Екатеринбург: УрО РАН, 2011. 156 с.
Володин В.М. Эмбриональное развитие налима // Тр. Ин-та биологии водохранилищ АН СССР. 1960. Вып. 3(6). С. 227–230.
Дополнительные материалы отсутствуют.


