Экология, 2020, № 2, стр. 101-109
Влияние почвенных условий на уровень генетического разнообразия ксерогалофита Kochia prostrata (L.) Schrad. (Chenopodiaceae)
Е. В. Шуйская a, *, Ю. Д. Нухимовская b, М. П. Лебедева c, А. Е. Чурилина c, А. В. Колесников d
a Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
c Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, Россия
d Институт лесоведения РАН
143030 Московская обл., с. Успенское, ул. Советская, 21, Россия
* E-mail: evshuya@mail.ru
Поступила в редакцию 05.07.2019
После доработки 28.08.2019
Принята к публикации 17.09.2019
Аннотация
Изучен генетический полиморфизм в популяциях ксерогалофита Kochia prostrata, произрастающих на разных по свойствам почвах с контрастным содержанием солей в 8 вариантах растительных сообществ опустыненных степей. Во всех изученных популяциях наблюдался дефицит гетерозигот (11.1–77.5%). Обнаружены достоверные различия в уровне наблюдаемой гетерозиготности в популяциях, произрастающих на разных типах почв. Значительная генетическая дифференциация двух популяций на темногумусовых солончаках указывает на возможность влияния почвенных условий не только на уровень разнообразия, но и на генетическую структуру популяций.
Генетическое разнообразие является одним из основных источников биоразнообразия на Земле и обеспечивает сырье для эволюции. Его можно рассматривать как связь между эволюционными и экологическими процессами. Снижение разнообразия ведет к уменьшению эволюционного потенциала, необходимого для адаптации к меняющимся условиям окружающей среды, и снижению приспособленности вида в целом [1, 2]. Изменение условий окружающей среды может влиять на генетическое разнообразие и дифференциацию между локальными популяциями дикорастущих видов растений [3, 4]. Уровень локальной адаптации определяется взаимодействием между естественным отбором и потоком генов вдоль экологических градиентов [5]. Почвенные условия, отраженные в их морфологических и физико-химических свойствах – pH, влажность, содержание питательных элементов [6–8] и характер растительности [4, 9–11] – могут влиять на уровень внутрипопуляционного генетического разнообразия и степень генетической дифференциации популяций.
Выявление экологических факторов, влияющих на формирование генетического разнообразия дикорастущих видов, необходимо для понимания процессов внутривидовой микроэволюции и механизмов локальной адаптации к разным и меняющимся условиям окружающей среды. Удобными модельными объектами для изучения механизмов локальной адаптации к гетерогенным условиям являются широко распространенные виды, которые, как правило, характеризуются высокой фенотипической пластичностью и генетической изменчивостью. Успешное освоение гетерогенных условий такими видами происходит благодаря появлению множества разных генотипов, приспособленных к конкретным условиям обитания, а не наличием одного универсального генотипа [12].
Прутняк простертый Kochia prostrata (L.) Schrad. (семейство Chenopodiaceae) [Bassia prostrata (L.) A.J. Scott] – длительно вегетирующий вид, широко распространенный в сухих и опустыненных степях, предгорных пустынях юга России, Центральной Азии и Закавказья, Западной Европы. Обладая широкой эдафической пластичностью, он способен произрастать на почвах разного механического состава – от легких опесчаненных до тяжелых суглинистых, каменистых и гипсоносных, в том числе на солонцеватых и тяжелых по гранулометрическому составу солонцово-солончаковых почвах [13, 14]. Kochia prostrata характеризуется С4-типом фотосинтеза, неоднороден по морфологическим, биологическим и эколого-физиологическим свойствам, обладает значительной засухо- и солеустойчивостью и имеет значительный адаптационный потенциал [13, 15, 16]. В условиях южных глинистых и каменистых предгорных полупустынь он отличается высоким уровнем внутрипопуляционного генетического полиморфизма [17].
Цель данной работы – изучить влияние почвенных свойств (тип почвы, содержание гумуса и суммы солей) на уровень генетического разнообразия и формирование генетической структуры популяций K. prostrata, произрастающих в различных вариантах растительности опустыненных степей Северо-Западного Прикаспия.
МАТЕРИАЛ И МЕТОДЫ
Район исследований, геоморфология. Работы проведены на территории Палласовского района Волгоградской области, в северо-западной части Прикаспийской низменности на Волго-Уральском междуречье. Регион представляет собой плоскую морскую аккумулятивную равнину, сложенную с поверхности раннехвалынскими суглинками, и с почти полным отсутствием поверхностного и грунтового стока [18]. На этой территории широко распространены такие замкнутые бессточные котловины, приуроченные к депрессионным понижениям, как соленые озера Булухта и Эльтон. Крупнейшее соленое озеро Европы Эльтон и его окрестности входят в состав природного парка регионального значения “Эльтонский”. По климатическим показателям (метеостанция Джаныбек) район исследований относится к засушливым аридным территориям со среднегодовой суммой осадков 291 мм и среднегодовым коэффициентом увлажнения (отношение осадков к испаряемости) 0.32 [19]. Территории с такими гидротермическими показателями относят к полупустыням и сухим степям [20].
Почвы. Свойства почв данного региона подробно изучены многими исследователями [21–23]. В почвенном покрове Волгоградской области широко представлены каштановые почвы и их комплексы, в северной части региона распространены черноземы южные, в юго-восточной – солонцы каштановые и лугово-каштановые почвы [24]. В пределах равнинных ландшафтов Прикаспийской низменности широко распространены солонцовые комплексы, для понижений и других отрицательных элементов рельефа (западины, котловины) характерны темноцветные черноземовидные или лугово-каштановые почвы [25]. В ходе полевых работ были заложены разрезы, для которых выполняли морфогенетические описания с индексацией горизонтов по “Полевому определителю почв” [26]. Профили исследовали до глубины 50 см, зоны максимального распространения корней. Анализы водной вытяжки, а также содержания гумуса в отобранных образцах выполнены по общепринятым методикам [27]. Полученные данные усредняли для рассматриваемой части профиля (50 см).
Растительность. В ботанико-географическом отношении территория Приэльтонья расположена в подзоне южных полукустарничково-дерновиннозлаковых (опустыненных) степей Ергенинско-Заволжской подпровинции Заволжско-Казахстанской провинции Евразиатской степной области [28, 29]. Здесь, помимо типичных степных злаковых сообществ, широко распространены полукустарничковые и промежуточные между ними фитоценозы, характерна комплексность растительности, что означает быструю смену растительности на очень коротких расстояниях, измеряемых иногда метрами.
Растительные сообщества с участием прутняка подбирали с учетом максимального разнообразия мест его обитаний в плакорных, специфических экотонных условиях и озерных котловинах, на террасах соленых озер, береговых уступах, на стыке сообществ, относящихся к разным формациям. Геоботанические описания выбранных сообществ выполнены в начале июня 2018 г. по общепринятой методике [30, 31] в 13 местообитаниях (табл. 1). Размеры большинства сообществ были невелики (12–18 м2), поэтому их описывали в пределах естественных границ. Долю участия видов оценивали по степени проективного покрытия (ПП, %) в составе общего проективного покрытия (ОПП). Группировка 13 описаний выполнена с использованием публикаций о структуре растительного покрова степной зоны и трактовке границы степей и пустынь в европейской части СССР и РФ [28, 29, 32] на основе преобладающей жизненной формы (здесь это травянистые многолетники: дерновинные злаки, полукустарнички, ксерофильное разнотравье), а также экологии доминантных видов (ксерофиты, галофиты, галоксерофиты).
Таблица 1.
Почвенные и растительные условия произрастания 13 популяций Kochia prostrata в опустыненных степях Северо-Западного Прикаспия
| Место произрастания | Популяция (растения)* |
Тип почвы | Сумма солей в почве, % | Содержание гумуса, % | Варианты опустыненных степей | Растительные сообщества | Проективное покрытие прутняка, % |
|---|---|---|---|---|---|---|---|
| Береговая линия оз. Булухта | Б1 (18) | Солончак темногумусовый (I группа) | 0.94 | 4.08 | Ксерогалофитнополу- кустарничковые |
Вострецово-прутняково-лиственничносолянковое | 15–20 |
| Б2 (15) | Солончак темногумусовый (I группа) | 1.10 | 3.5 | Ксерогалофитнополу- кустарничковые |
Типчаково- сантоникополынно-халимионовое | 5–10 | |
| Равнинная часть между озерами Булухта и Эльтон | Р1 (16) | Солонец, сильно промытый от солей (III группа) | 0.11 | 1.47 | Полукустарничково-ксерофитноразнотрав-ные | Типчаково-ромашниково-волосистогрудницевое с участием прутняка, полыни Лерха и житняка пустынного | 10 |
| Р2 (5) | Солонец мелкий, слабо промытый (II группа) | 0.49 | 2.37 | Полукустарничково-плотнодерновинно-злаковые | Сантоникополынно-пустынно- житняковое с грудницей волосистой и кермеком метельчатым | 5 | |
| Р3 (15) | Каштановая солонцеватая (III группа) | 0.52 | 2.49 | Плотнодерновинно-злаковые | Пустынножитняковое | 5–10 | |
| Р4 (20) | Солонец мелкий, сильно промытый от солей (II группа) | 0.64 | 1.70 | Полукустарничковые | Мятликово-прутняковое | 30–40 | |
| Р5 (18) | Каштановая (IV группа) | 0.12 | 1.89 | Полукустарничково-ксерофитнозлаковые | Прутняково-вострецовое с житняком пустынным | 15 | |
| Р6 (10) | Каштановая (IV группа) | 0.05 | 1.91 | Плотнодерновинно-злаковые | Тырсиково-типчаковое с полынью таврической | 5 | |
| Р7 (20) | Каштановая солонцеватая (III группа) | 0.10 | 1.95 | Галоксерофитнополукустарничковые | Лиственничносолянково-чернополынно-прутняковое | 40–50 | |
| Р8 (20) | Каштановая солонцеватая (III группа) | 0.36 | 1.55 | Полукустарничковые | Прутняковое | 30–40 | |
| Р9 (20) | Солонец корковый, не промытый от солей (II группа) |
0.68 | 1.89 | Галоксерофитнополукустарничковые | Вострецово-лиственничносолянково-прутняковое с мятликом луковичным | 30 | |
| Природный парк “Эльтон” | Э1 (15) | Солонец мелкий, не промытый от солей (II группа) | 0.77 | 0.88 | Ксерогалофитнополу- кустарничковые |
Мятликово- сантоникополынно-вздутосведовое с прутняком | 10 |
| Э2 (20) | Каштановая солонцеватая (III группа) | 0.63 | 0.80 | Ксерофитнозлаково-полукустарничковые | Мятликово-вострецово-прутняковое | 25–30 |
Можно выделить сообщества прутняка с участием других полукустарничков, а также ксерофильных дерновинных злаков и фитоценозы, где прутняк встречается совместно с другими полукустарничками, дерновинными злаками, а иногда и разнотравьем. Ниже приведены доминанты сообществ с характеристикой их экобиоморф:
1. Плотнодерновинные злаки: типчак Festuca valesiaca, ковыль сарептский, или тырсик Stipa sareptana, житняк пустынный Agropyron desertorum. Корневищные злаки: вострец Leymus ramosus. Эфемероид мятлик луковичный Poa bulbosa.
2. Ксерофильное разнотравье: грудница волосистая Galatella villosa, пижма тысячелистниколистная Tanacetum achilleifolium, кермек метельчатый Limonium scoparium.
3. Ксерофильные полукустарнички: прутняк простертый Kochia prostrata, полынь таврическая Artemisia taurica, полынь Лерха Artemisia lerchiana [28].
4. Ксерогалофильные полукустарнички: халимионе бородавчатый Halimione verrucifera, сведа вздутоплодная Suaeda physophora, кароксилон лиственничный Caroxylon laricinum (солянка лиственничная Salsola laricina), полынь черная Artemisia pauciflora, полынь сантонинная Artemisia santonica.
Латинские названия приведены в основном согласно сводке С.К. Черепанова [33], представители семейства Chenopodiaceae даны по А.П. Сухорукову [34]. В скобках указаны синонимы.
Растительный материал и изоферментный анализ. Семена Kochia prostrata (L.) Schrad. были собраны в 13 популяциях из различных растительных сообществ (см. табл. 1) с 5–20 отдельных растений каждой популяции. Изоферментный анализ проводили на 30–50 проростках с каждой популяции по ранее описанной методике для пустынных видов маревых [35]. Разделение энзимов проводилось в 10%-ном крахмальном геле. Анализировали восемь ферментов: GOT (E.C. 2.6.1.1), DIA (E.C. 1.6.99), GDH (E.C. 1.4.1.2), SOD (E.C. 1.15.1.1), G6PD (E.C. 1.1.1.49), 6PGD (E.C. 1.1.1.44), MDH (Е.С. 1.1.1.37), Me (Е.С. 1.1.1.40).
Статистический анализ. Для оценки уровня генетической изменчивости рассчитывали следующие показатели: долю полиморфных локусов (Р99), среднюю наблюдаемую (Но) и ожидаемую (Не) гетерозиготности, генетические дистанции по 10 выявленным локусам. Для анализа структуры популяций и потока генов использовали коэффициенты F‑статистики Райта (Fis, Fit, Fst) и показатель потока генов Nm [36] в программе POPGEN 1.32 [37].
На рис. 2, 3 приведены средние арифметические значения полученных величин и их стандартные ошибки. Для корреляционного и факторного (ANOVA) анализов использовали программу SigmaPlot12.0. Достоверность различий между средними значениями признаков определяли при помощи теста Tukey (в программе SigmaPlot12.0). Различия считались достоверными при р < 0.05. На диаграммах достоверные различия между средними значениями признаков отмечены разными латинскими буквами над барами. Одинаковые буквы над барами означают отсутствие различий между средними значениями данных признаков.
РЕЗУЛЬТАТЫ
В условиях Северо-Западного Прикаспия исследованы 13 популяций Kochia prostrata в 8 вариантах растительности опустыненных степей (см. табл. 1). Произрастание прутняка в типичных дерновиннозлаковых степных сообществах зарегистрировано в двух местообитаниях (Р3, Р6), а в ксерофитноразнотравных — в одном (Р1). Остальные сообщества представляют собой разные варианты полукустарничковых и дерновиннозлаково-полукустарничковых опустыненных степей, в которых доминируют перечисленные выше виды в разных сочетаниях и соотношениях. Среди них собственно прутняковые сообщества (с доминированием K. prostrata) отмечены в 5 местообитаниях: Р4, Р7, Р8, Р9, Э2. Фитоценозы с участием прутняка, как правило, разреженные, их ОПП колеблется от 15–20 до 70–80%, в том числе на долю прутняка приходится 5–50% ПП: минимально (5–10%) – в дерновиннозлаковых и полукустарничково-дерновиннозлаковых степях, максимально (до 40–50%) – в полукустарничковых, в лиственничносолянково-чернополынно-прутняковом сообществе на каштановой солонцеватой почве (Р7). Такое разнообразие фитоценозов с участием K. рrostrata, вероятно, связано с разнообразием почвенных условий. В исследованном районе K. prostrata произрастает на светлых и светлогумусовых солонцах, каштановых солонцеватых и каштановых почвах, темногумусовых солончаках с различным содержанием солей (0.05–1.10% суммы солей) и гумуса (0.80–4.08%) (см. табл. 1).
Популяционно-генетический анализ K. prostrata показал, что доля полиморфных локусов в 13 популяциях варьирует от 20 до 70% и в среднем составляет 45 ± 3%. Уровень средней наблюдаемой гетерозиготности (Ho = 7.3 ± 0.6%) в популяциях в 1.7 раза ниже уровня средней ожидаемой гетерозиготности (He = 12.0 ± 0.9%) (рис. 1а), т.е. во всех изученных популяциях наблюдается дефицит гетерозигот, который в среднем составляет 38 ± 4%. При этом уровни средних He и Ho не коррелируют с размером выборки (r = 0.20–0.22, p > 0.05). В то же время обнаружена незначительная положительная корреляция (r = 0.55, p ≥ 0.05) уровня He с долей вида в растительных сообществах. Однако между уровнем Ho и долей прутняка в растительных сообществах корреляции не выявлено (r = 0.07, p > 0.05). В целом для всех популяций около 30% изменчивости приходится на межпопуляционную (табл. 2). Генетические дистанции между 13 популяциями очень различаются (D = 0.0014–0.2094) и не коррелируют с географическими расстояниями (см. рис. 1б). Наименьший внутрипопуляционный генетический полиморфизм K. prostrata наблюдается в ксерогалофитно-полукустарничковых вариантах степей: He ниже в 1.4–1.9 раза, а Ho – в 1.3–1.6 раза по сравнению с популяциями, произрастающими в других вариантах опустыненных степей (рис. 2а). Достоверных различий между генетическими параметрами и характером растительности остальных вариантов опустыненных степей не обнаружено.
Рис. 1.
Уровень генетического разнообразия в популяциях (а), взаимосвязь генетических дистанций (по Nei, 1984) и географических расстояний между популяциями Kochia prostrata в условиях естественных местообитаний Северо-Западного Прикаспия (б): P – процент полиморфных локусов, Ho – наблюдаемая гетерозиготность, He – ожидаемая гетерозиготность, треугольники – популяции Б1, Б2, круги – популяции Р1–Р9, квадраты – популяции Э1–Э2; R2 – величина аппроксимации.
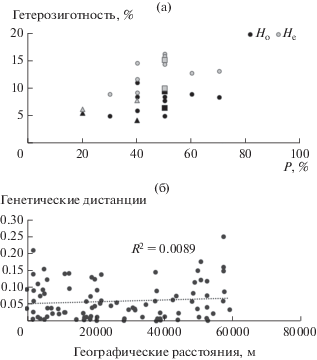
Таблица 2.
Уровень межпопуляционной изменчивости и потока генов в группах популяций Kochia prostrata, произрастающих на различных типах почв Северо-Западного Прикаспия
| Группы популяций | Fst | Nm | D |
|---|---|---|---|
| Между всеми 13 популяциями | 0.286 | 0.62 | 0.0014–0.2094 |
| Между группами I, II, III, IV | 0.104 | 2.16 | 0.0032–0.0609 |
| Между группами I и II | 0.116 | 1.90 | 0.0573 |
| Между группами I и III | 0.093 | 2.44 | 0.0439 |
| Между группами I и IV | 0.165 | 1.27 | 0.0609 |
| Между группами II и III | 0.009 | 27.02 | 0.0032 |
| Между группами II и IV | 0.018 | 13.53 | 0.0049 |
| Между группами III и IV | 0.026 | 9.42 | 0.0075 |
| Внутри группы I (между популяциями Б1 и Б2) | 0.565 | 0.19 | 0.2094 |
| Внутри группы II (Р2, Р4, Р9, Э1) | 0.112 | 1.98 | 0.0046–0.0501 |
| Внутри группы III (Р1, Р3, Р7, Р8, Э2) | 0.133 | 1.63 | 0.0024–0.0815 |
| Внутри группы IV (Р5 и Р6) | 0.156 | 1.35 | 0.0367 |
| Между 11 популяциями (без Б1 и Б2) | 0.161 | 1.13 | 0.0014–0.1765 |
Для изучения возможного влияния почвенных условий на внутри- и межпопуляционный генетический полиморфизм популяции K. prostrata были сгруппированы по морфологическому типу и уровню засоления почвы, на которых они произрастают: I группа – популяции, произрастающие на сильнозасоленных темногумусовых солончаках с суммой солей 1.02 ± 0.08% и содержанием гумуса 3.79 ± 0.29%; II группа – на мелких солонцах (сумма солей 0.65 ± 0.08%, гумус 1.71 ± 0.44%); III группа – на глубоких солонцах и каштановых солонцеватых почвах (сумма солей 0.34 ± 0.11%, гумус 1.65 ± 0.28%) и IV группа – на каштановых почвах (сумма солей 0.08 ± 0.03%, гумус 1.89 ± 0.08%) (см. табл. 1, рис. 3). Оказалось, что популяции I и IV групп характеризуются достоверно меньшим (в 1.5–2 раза) уровнем гетерозиготности по сравнению с популяциями II и III групп (см. рис. 2б, 3).
Рис. 2.
Уровень генетического разнообразия в популяциях Kochia prostrata, произрастающих в разных вариантах растительности опустыненных степей (а) и типов почв (б): Ho – наблюдаемая гетерозиготность, He – ожидаемая гетерозиготность; 1 – ксерогалофитнополукустарничковые, 2 – галоксерофитнополукустарничковые, 3 – полукустарничково-ксерофитноразнотравные, полукустарничково-ксерофитнозлаковые и полукустарничково-плотнодерновиннозлаковые, 4 – полукустарничковые, 5 – плотнодерновиннозлаковые степи; I–IV – типы почв: I – темногумусовые солончаки, II – мелкие и корковые солонцы, III – глубокие солонцы и каштановые солонцеватые почвы, IV – каштановые почвы. Разными латинскими буквами отмечены достоверные различия между всеми средними значениями Ho и He на уровне p < 0.05, одинаковые буквы над барами означают отсутствие различий между средними значениями данных признаков.
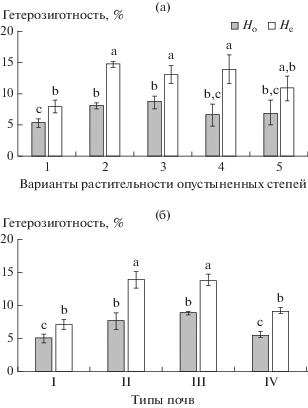
Рис. 3.
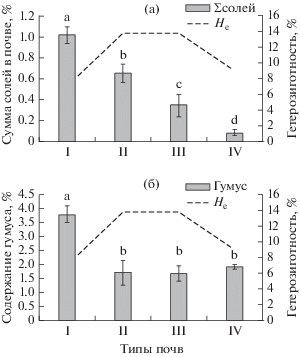
Сумма солей (а) и содержание гумуса (б) в различных типах почвы в популяциях Kochia prostrata с разным уровнем генетического разнообразия: ∑солей – сумма солей, He – ожидаемая гетерозиготность; I – темногумусовые солончаки, II – мелкие и корковые солонцы, III – глубокие солонцы и каштановые солонцеватые почвы, IV – каштановые почвы. Разными латинскими буквами отмечены достоверные различия между средними значениями параметров на уровне p < 0.05.
Анализ генетической структуры популяций и потока генов внутри четырех групп (по свойствам почв) и между группами популяций K. prostrata показал невысокий уровень генетической дифференциации групп (Fst = 0.009–0.116) и значительный поток генов (Nm > 1) между всеми группами и всеми парами групп (см. табл. 2), т.е. между группами популяций наблюдается свободный обмен генами, который уравновешивает возможное действие дрейфа генов [36] на генетическую структуру популяций. В то же время между всеми популяциями (без группировки) наблюдается больший уровень генетической дифференциации (Fst = 0.286) и меньший поток генов (Nm = 0.62). Данные отличия основаны на значительной генетической дифференциации (Fst = 0.565) и ограниченном потоке генов (Nm = 0.19) популяций I группы, произрастающих на темногумусовых солончаках у бровки первой террасы оз. Булухта (Б1 и Б2). Кроме того, генетические расстояния между данными популяциями гораздо больше, чем между популяциями внутри других групп или между группами популяций (см. табл. 2). При анализе 11 популяций (без учета популяций Б1 и Б2) также наблюдается свободный обмен генами (Nm = 1.127), который уравновешивает возможное действие дрейфа генов на генетическую структуру изученных популяций прутняка. Отсутствие корреляций генетических дистанций с географическими расстояниями между популяциями (см. рис. 1б) свидетельствует о том, что поток генов также не играет решающей роли в формировании структуры данных популяций.
ОБСУЖДЕНИЕ
Анализ растительности опустыненных степей северо-западной части Прикаспийской низменности показал большое разнообразие фитоценозов с участием Kochia prostrata на разных типах почв с разной мощностью поверхностных гумусированных горизонтов, отмытых от легкорастворимых солей: светлых и светлогумусовых солонцах, каштановых солонцеватых и каштановых почвах, темногумусовых солончаках. Возможно, вследствие такого разнообразия мест обитания сформировались значительные генетические расстояния между популяциями Б1 и Р4 (D = 0.1765) и между Б1 и Б2 (D = 0.2094), которые больше соответствуют степени генетических различий между подвидами (D = 0.17−0.22). В то же время генетические расстояния между популяцией Б1 и остальными изученными 11 популяциями (исключая Б2) находятся на уровне межпопуляционных различий (D = 0.0380−0.1544), как и в случае популяций Б2 и Р4 (D = 0.0128−0.1108 и D = = 0.0258−0.1500 соответственно). Это дает нам основание считать их разными популяциями, а не подвидами K. prostrata.
Популяционно-генетический анализ K. prostrata показал, что в целом основные параметры генетического разнообразия вида, кроме показателя наблюдаемой гетерозиготности (Но), соответствуют среднему уровню для многолетних перекрестно-ветроопыляемых видов (P = 49–66%, Ho = 26– 29%, He = 15–16%) [38]. Однако средний уровень генетической изменчивости в популяциях K. prostrata Северо-Западного Прикаспия (Р = = 46 ± 3%, Ho = 7.0 ± 0.6%, He = 12.1 ± 0.9%) оказался ниже, чем в среднеазиатских популяциях (Р = 82 ± 5%, Ho = 34 ± 2%) [17], а также в популяциях некоторых других засухоустойчивых видов (P = 54–93%, Но = 14–50%, Не = 33–42%) – Agave victoriae-reginae [39], Flourensia cernua [40] и Haloxylon aphyllum [35].
Различия в уровнях наблюдаемой и ожидаемой гетерозиготности указывают на значительный дефицит гетерозигот (11.1–77.5%) во всех изученных популяциях K. prostrata в условиях опустыненных степей Северо-Западного Прикаспия, чего не наблюдалось в среднеазиатских популяциях [17]. Подобный дефицит гетерозигот может быть вызван инбридингом (самоопылением), однако прутняк простертый – многолетнее преимущественно перекрестно-ветроопыляемое растение. Географических и ценотических препятствий для опыления и распространения семян в данных условиях произрастания нет. Кроме того, отсутствие корреляции между наблюдаемой гетерозиготностью и долей вида свидетельствует о том, что инбридинг не играет решающей роли в формировании пула гетерозигот, а следовательно, и дефицита гетерозигот. Отклонение генетической структуры популяции от равновесия в сторону инбридинга (по Харди-Вайнбергу) и снижение генетического разнообразия может быть следствием узкой экологической ниши [41], как в случае с галофитом Suaeda salsa (Но = 0.08, Не = 0.18 [42]). Кроме того, общий дефицит гетерозигот может формироваться вследствие подразделения больших пространственно-протяженных популяций на панмиктические группы (эффект Валунда) [35, 43].
В Северо-Западном Прикаспии наблюдается большое разнообразие фитоценозов с участием K. prostrata, однако для данной территории характерна быстрая смена растительности на коротких расстояниях, что не позволяет данному ветроопыляемому виду формировать пространственно-протяженные популяции с образованием нескольких панмиктических групп. Дефицит гетерозигот также может свидетельствовать о давлении сильного стресса [43]. В последнем случае наблюдается отбор против гетерозигот в пользу более приспособленных к стрессовым условиям гомозигот. При этом под действием отбора могут оказаться отдельные конкретные локусы, как, например, в случае Festuca ovina [7], или большинство исследованных локусов. В изученных популяциях K. prostrata дефицит гетерозигот (Fit = 0.133–0.961) выявлен у 8 из 9 полиморфных локусов (табл. 3), т.е. все проанализированные локусы находятся под действием отбора в разной степени.
Таблица 3.
Значения коэффициентов F-статистики Райта (Fis, Fit, Fst) по 9 выявленным локусам 13 популяций Kochia prostrata в Северо-Западном Прикаспии
| Локус | Fis | Fit | Fst | p* |
|---|---|---|---|---|
| Got | –0.0264 | –0.0060 | 0.0199 | 0.595 |
| Gdh | 0.2180 | 0.2988 | 0.1034 | <0.001 |
| Dia-A | 0.7889 | 0.9609 | 0.8149 | <0.001 |
| Dia-B | 0.6858 | 0.7355 | 0.1581 | <0.001 |
| 6pgd | 0.0809 | 0.1330 | 0.0567 | 0.008 |
| G6pd | 0.3688 | 0.4616 | 0.1470 | <0.001 |
| Me | 0.5308 | 0.6117 | 0.1725 | <0.001 |
| Mdh-A | 0.0139 | 0.4605 | 0.4529 | <0.001 |
| Mdh-B | 0.4737 | 0.4971 | 0.0445 | 0.004 |
| Среднее | 0.3762 | 0.5420 | 0.2658 |
Роль стрессовых как абиотических (почвенные условия), так и биотических (например, тип растительных сообществ, их видовой состав) факторов могут играть различия в условиях местообитания. Показано влияние варианта растительных сообществ (ксерофитных и галофитных) [11] и степени использования сельскохозяйственных земель [4] на генетическое разнообразие популяций. При изучении K. prostrata из разных растительных сообществ и вариантов опустыненных степей значимых связей между популяционно-генетическими параметрами и характером растительности не было обнаружено. В то же время достоверно меньший уровень гетерозиготности в популяциях, произрастающих на темногумусовых солончаках и каштановых почвах, указывает на возможность влияния почвенных условий на формирование внутрипопуляционной генетической изменчивости K. prostrata. Ранее на двух ксерогалофитах нами было показано [44] снижение процента полиморфных локусов (Atriplex tatarica) по мере увеличения засоления почвы и повышение уровня наблюдаемой гетерозиготности (Sedobassia sedoides) с ростом содержания калия в почве. В изученных популяциях K. prostrata наблюдается нелинейная зависимость показателей гетерозиготности и уровня засоления почвы (см. рис. 3а). Наибольшая гетерозиготность обнаружена в популяциях, произрастающих на солонцах и каштановых солонцеватых (II и III группы) почвах со средним содержанием солей (0.35–0.65%). Известно, что для галофитов необходим определенный уровень засоления почвы для оптимального роста [45]. В изученных группах популяций наибольшей биомассой (38.7 ± 7.7 г) характеризовались кусты K. prostrata, произрастающие в популяциях на мелких солонцах (II группа), а наименьшей (6.3–8.3 г) – на каштановых солонцеватых (III группа) и каштановых (IV группа) почвах.
Таким образом, оптимальный рост и наибольший уровень генетического разнообразия наблюдаются в популяциях K. prostrata, произрастающих на мелких солонцах со средним содержанием солей 0.65 ± 0.08%. Несмотря на то, что наличие гумуса в почве является необходимым условием для нормального роста растений, связь уровня гетерозиготности в популяциях K. prostrata с содержанием гумуса в почвах отсутствует (см. рис. 3б). Две популяции, произрастающие на темногумусовых солончаках береговой линии оз. Булухта (Б1, Б2), отличаются и по параметрам генетической изменчивости (см. рис. 2б), и по структуре популяций (см. табл. 2) друг от друга и остальных изученных популяций, что свидетельствует об их значительной генетической дифференциации. В то же время между популяциями незначительны географические расстояния и отсутствуют явные преграды (ландшафтные и ценотические) для перекрестного опыления и распространения семян ветром. Берег оз. Булухта характеризуется комплексностью микрорельефа, различным химизмом засоления, историей развития почв и сменой растительных формаций на очень коротких расстояниях, что формирует мозаичность условий произрастания K. prostrata и может ограничивать поток генов между изолированными популяциями, уменьшая их генетическое разнообразие [4, 9]. Известно, что локальные различия в характеристиках почв и экологической истории вида способствуют генетической дифференциации популяций, и изменчивость среды обитания коррелирует с генетической дифференциацией [4, 46].
ЗАКЛЮЧЕНИЕ
Популяционно-генетический анализ вида K. prostrata в условиях опустыненных степей Северо-Западного Прикаспия выявил невысокий уровень разнообразия по сравнению со среднеазиатскими популяциями данного вида [17]. Анализ генетической структуры популяций показал, что дрейф и поток генов не играют решающей роли в формировании структуры данных популяций. Не обнаружено значимых связей между популяционно-генетическими параметрами K. prostrata и конкретными растительными сообществами, а также вариантами опустыненных степей. Достоверные различия в уровне генетического полиморфизма показаны для групп популяций, произрастающих на разных типах почв. В 1.5–2 раза меньший уровень гетерозиготности в популяциях на темногумусовых сильно засоленных и каштановых почвах указывает на возможность влияния почвенных условий на формирование внутрипопуляционной генетической изменчивости K. prostrata. Не выявлено связи уровня гетерозиготности в популяциях K. prostrata с содержанием гумуса в почвах, однако показана нелинейная зависимость показателей гетерозиготности и уровня засоления почвы с максимумом при среднем засолении. По степени генетической дифференциации выделаются две популяции, произрастающие на темногумусовых солончаках береговой линии озера Булухта (Б1, Б2). Причинами повышенной изоляции популяций, возможно, является мозаичность почвенных условий береговой линии озера.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 18-016-00129а).
Список литературы
Ouborg N.J., Vergeer P., Mix C. The rough edges of the conservation genetics paradigm for plants // J. of Ecology. 2006. V. 94(6). P. 1233–1248. https://doi.org/10.1111/j.1365-2745.2006.01167.x
Dostalek T., Munzbergova Z., Plactova I. High genetic diversity in isolated populations of Thesium ebracteatum at the edge of its distribution range // Conservation Genetics. 2014. V. 15(1). P. 75–86. https://doi.org/10.1007/s10592-013-0522-7
Linhart Y.B., Grant M.C. Evolutionary significance of local genetic differentiation in plants // Annual review of Ecology and Systematics. 1996. V. 27(1). P. 237–277. https://doi.org/10.1146/annurev.ecolsys.27.1.237
Odat N., Jetschke G., Hellwig F.H. Genetic diversity of Ranunculus acris L. (Ranunculaceae) populations in relation to species diversity and habitat type in grassland communities // Molecular Ecology. 2004. V. 13(5). P. 1251–1257. https://doi.org/10.1111/j.1365-294x.2004.02115.x
Forester B.R., Jones M.R., Joost S. et al. Detecting spatial genetic signatures of local adaptation in heterogeneous landscapes // Molecular Ecology. 2015. V. 25(1). P. 104–120. https://doi.org/10.1111/mec.13476
Nevo E., Krugman T., Beiles A. Edaphic natural selection of allozyme polymorphisms in Aegilops peregrina at a Galilee microsite in Israel // Heredity. 1994. V. 72(2). P. 109–112. https://doi.org/10.1038/hdy.1994.16
Prentice H.C., Lonn M., Lager H. et al. Changes in allozyme frequencies in Festuca ovina populations after a 9‑year nutrient/water experiment // J. of Ecology. 2000. V. 88(2). P. 331–347. https://doi.org/10.1046/j.1365-2745.2000.00454.x
Orians C.M., Lower S., Fritz R.S. et al. The effects of plant genetic variation and soil nutrients on secondary chemistry and growth in a shrubby willow, Salix sericea: patterns and constraints on the evolution of resistance traits // Biochemical Systematics and Ecology. 2003. V. 31(3). P. 233–247. https://doi.org/10.1016/S0305-1978(02)00144-8
Leonardi S., Piovani P., Scalfi M. et al. Effect of habitat fragmentation on the genetic diversity and structure of peripheral populations of beech in Central Italy // J. of Heredity. 2009. V. 103(3). P. 408–417. https://doi.org/10.1093/jhered/ess004
Lega M., Fior S., Li M. et al. Genetic drift linked to heterogeneous landscape and ecological specialization drives diversification in the Alpine endemic columbine Aquilegia thalictrifolia // J. of Heredity. 2014. V. 105(4). P. 542–554. https://doi.org/10.1093/jhered/esu028
Shuyskaya E., Toderich K., Gismatullina L. et al. Genetic diversity of two annual Salsola species (Chenopodiaceae) among habitat types in desert plant communities // Biologia. 2017. V. 72(3). P. 267–276. https://doi.org/10.1515/biolog-2017-0032
Joshi J., Schmid B., Caldeira M.C. et al. Local adaptation enhances performance of common plant species // Ecology Letters. 2001. V. 4(6). P. 536–544. https://doi.org/10.1046/j.1461-0248.2001.00262.x
Балян Г. А. Прутняк простертый и его культура в Киргизии. Фрунзе: Кыргызстан, 1972. 263 с.
Harrison R.D., Chatterton N.J., Waldron B.L. et al. Forage Kochia. Its compatibility and potential aggressivenes on intermountation rangelands / Research report 162. Utah Agricultural Experiment Station, Utah State University. Logan, Utah, 2000. 66 p.
Orlovsky N.S., Japakova U.N., Shulgina I. et al. Comparative study of seed germination and growth of Kochia prostrata and Kochia scoparia (Chenopodiaceae) under salinity // J. of Arid Environments. 2011. V. 75(6). P. 532–537. https://doi.org/10.1016/j.jaridenv.2011.01.014
Тодерич К.Н., Бабокулов Н.А., Раббимов А.Р. и др. Kochia prostrata (L.) Schrad. – ценное кормовое растение для улучшения пустынных и полупустынных пастбищ в Центральной Азии. Tашкент: “Fan va texnologiya”, 2014. 152 с.
Шуйская Е.В., Тодерич К.Н., Войницка-Полторак А. Генетическая изменчивость кохии простертой (Kochia prostrata (L.) Schrad.) в условиях аридной зоны Узбекистана // Проблемы освоения пустынь. 2001. № 3. С. 24–31.
Доскач А.Г. Природное районирование Прикаспийской полупустыни. М.: Наука, 1979. 142 с.
Сапанов М.К., Сиземская М.Л. Изменение климата и динамика целинной растительности в северном Прикаспии // Поволж. экол. журн. 2015. № 3. С. 307–320.
Гребенщиков О.С. Климатическая характеристика ареалов зональных природных экосистем / Базилевич Н.И., Гребенщиков О.С., Тишков А.А. Географические закономерности структуры и функционирования экосистем. М.: Наука, 1986. С. 31–50.
Ковда В.А. Почвы Прикаспийской низменности (северо-западной части). М.: Изд-во АН СССР, 1950. 255 с.
Роде А.А., Польский М.Н. Почвы Джаныбекского стационара, их морфологическое строение, механический и химический состав и физические свойства // Тр. Почв. ин-та им. В.В. Докучаева. 1961. Т. 56. С. 3–214.
Лебедева М.П., Шабанова Н.П. Сравнительный анализ почвообразовательных процессов и свойств солонцов террас соленых озер Булухта и Хаки в Прикаспийской низменности. // Почвоведение. 2016. № 6. С. 647–662. https://doi.org/10.7868/S0032180X16060113
Засоленные почвы России / Отв. ред. Шишов Л.Л. и Панкова Е.И. М.: ИКЦ Академкнига, 2006. 854 с.
Конюшкова М.В., Козлов Д.Н. Автоматизированный анализ распространения темноцветных черноземовидных почв в Северном Прикаспии по данным космической съемки (на примере Джаныбекского стационара) // Аридные экосистемы. 2010. Т. 16. № 5(45). С. 46–56.
Полевой определитель почв. М.: Почвенный ин-т им. В.В. Докучаева, 2008. 182 с.
Воробьева Л.А. Химический анализ почв. М.: Изд-во МГУ, 1998. 272 с.
Лавренко Е.М., Карамышева З.В., Никулина Р.И. Степи Северной Евразии. Л.: Наука, 1991. 146 с.
Сафронова И.Н. Характеристика растительности Палласовского района Волгоградской области // Биоразнообразие и природопользоавание в Приэльтонье: Сб. науч. тр. Волгоград: Прин Терра, 2006. С. 5–9.
Полевая геоботаника. Т. 3. М.; Л.: Наука, 1964. 264 с.
Работнов Т.А. Фитоценология. М.: Изд-во МГУ, 1992. 351 с.
Сафронова И.Н. О проблемах зонального деления аридной территории европейской части России // Бот. журн. 2012. Т. 97. № 6. С. 705–711.
Черепанов С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб.: Мир и семья, 1995. 992 с.
Сухоруков А.П. Карпология семейства Chenopodiaceae в связи с проблемами филогении, систематики и диагностики его представителей. Тула: Гриф и К, 2014. 400 с.
Шуйская Е.В., Гисматуллина Л.Г., Тодерич К.Н. и др. Генетическая дифференциация Haloxylon aphyllum (Chenopodiaceae) по градиенту засоления почвы в пустыне Кызылкум // Экология. 2012. № 4. С. 284–28.
Wright S. Evolution and the genetics of populations. V. 2. The theory of gene frequencies. Chicago: Univ. of Chicago Press, 1984. 511 p.
Yeh F.C., Yang R.C., Boyle T. POPGEN, version 1.32. Microsoft Windows-based freeware for population genetic analysis. Edmonton: University of Alberta/ CIFOR, 1999.
Hamrick J.L., Godt M.J., Sherman-Broyles S.L. Factors influencing levels of genetic diversity in woody plant species // New Forests. 1992. V. 6. P. 95–124.
Martinez-Palacios A., Eguiarte L.E., Furnier G.R. Genetic diversity of the endangered endemic Agave victoriae-reginae (Agavaceae) in the Chihuahuan Desert // Amer. J. Bot. 1999. V. 86(8). P. 1093–1098. https://doi.org/10.2307/2656971
Ferrer M.M., Eguiarte L.E., Mantana C. Genetic structure and outcrossing rates in Flourensia cernua (Asteraceae) growing at different densities in the South-western Chihuahuan Desert // Annals of Botany. 2004. V. 94(3). P. 419–426. https://doi.org/10.1093/aob/mch159
Wolff S.L., Jefferies R.L. Morphological and isozyme variation in Salicornia europaea (s. l.) (Chenopodiaceae) in North America // Canadian J. of Botany. 1987. V. 65(7). P.1410–1419. https://doi.org/10.1139/b87-195
Сонг Б., Занг З. Морфологическое и генетическое разнообразие популяций Suaeda salsa в дельте реки Хуанхэ // Экология. 2007. № 4. С. 299–306.
Алтухов Ю.П. Генетические процессы в популяциях. М.: Академкнига, 2003. 431 с.
Шуйская Е.В., Рахманкулова З.Ф., Суюндуков Я.Т. Генетическое разнообразие однолетних ксеро-галофитов сем. Chenopodiaceae по градиентам влажности и засоления // Экология. 2019. № 1. С. 15–21.
Flowers T.J., Colmer T.D. Plant salt tolerance: adaptation in halophytes // Annals of Botany. 2015. V. 115(3). P. 327–331. https://doi.org/10.1093/aob/mcu267
Huff D.R., Quinn J.A., Higgins B. et al. Random amplified polymorphic DNA (RAPD) variation among native little bluestem [Schizachyrium scoparium (Michx.) Nash] populations from sites of high and low fertility in forest and grasslands biomes // Molecular Ecology. 1998. V. 7(11). P. 1591–1597. https://doi.org/10.1046/j.1365-294x.1998.00473.x
Дополнительные материалы отсутствуют.


