Экология, 2020, № 2, стр. 90-100
Уязвимость видов травяно-кустарничкового яруса к загрязнению выбросами медеплавильного завода: роль различий в способе распространения диаспор
М. Р. Трубина *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: mart@ipae.uran.ru
Поступила в редакцию 02.04.2019
После доработки 27.08.2019
Принята к публикации 02.09.2019
Аннотация
Способ распространения диаспор может существенно влиять на уязвимость травянистых растений к антропогенной трансформации экосистем, но в настоящее время нет единого мнения о связи способа распространения диаспор с процессами вымирания и колонизации. В работе проанализированы результаты описаний растительного покрова, выполненных в районе воздействия Среднеуральского медеплавильного завода в период высоких (1995–1998 гг.) и низких (2014–2016 гг.) выбросов. Проверяли две гипотезы: 1) способ распространения диаспор влияет на уязвимость: наименее уязвимы к трансформации местообитаний те виды, чьи диаспоры распространяются дальше; 2) независимо от способа распространения диаспор восстановление при высоких уровнях загрязнения менее выражено, чем при низких. Для всех групп отмечено высокое варьирование видового богатства в пространстве, его резкое снижение в области высоких токсических нагрузок, наличие локалитетов с большим видовым богатством даже при сильном загрязнении. С увеличением загрязнения разнообразие групп в мезомасштабе (сотни метров) снижалось сильнее, чем в макромасштабе (километры). Виды с разным способом распространения диаспор различались как по чувствительности к загрязнению, так и по способности к реколонизации после сокращения выбросов, но связь уязвимости с дальностью переноса диаспор неоднозначна. Высокая чувствительность к загрязнению и низкая способность к восстановлению выявлены у видов как с наименьшей (автохоры), так и с наибольшей (эпи-/эндозоохоры) дальностью распространения диаспор; наименее уязвимы анемохоры. Разнообразие большинства групп в зоне сильного загрязнения за прошедшие 20 лет осталось на низком уровне, положительные сдвиги произошли у мирмекохоров и типичных анемохоров, при этом динамика у типичных анемохоров не зависела от уровня нагрузки.
Антропогенное воздействие на экосистемы часто сопровождается существенной фрагментацией и уменьшением качества местообитаний, что приводит к резкому снижению биоразнообразия [1, 2]. Следствием этого может быть нарушение экосистемных функций, причем не только в локальном, но и глобальном масштабах [3–5], поэтому изучение последствий трансформации экосистем актуально для современной экологии. Важен анализ уязвимости биоты к внешним воздействиям, что подразумевает оценку как чувствительности к нагрузке, так и способности к восстановлению после ее снижения, а также выявление факторов, влияющих на процессы вымирания и реколонизации.
Виды травяно-кустарничкового яруса в лесах умеренной зоны составляют основу разнообразия растений, играют значительную роль в регуляции потоков биогенов и поддержании разнообразия других групп биоты [6–8]. Многие виды травянистых растений уязвимы к фрагментации и изменению качества местообитаний из-за низкой скорости расселения [9–12], которая может лимитироваться небольшим количеством генеративных диаспор [13] и невысокой дальностью их распространения [14–16]. В свою очередь дальность распространения диаспор зависит от способа их распространения [14, 15, 17, 18], что может влиять на уязвимость видов.
В настоящее время нет единого мнения о связи способа распространения с процессами вымирания и колонизации. В одних работах показано отсутствие такой связи [19, 20], в других – наличие [21–23]. Оценки чувствительности к антропогенному преобразованию среды также различаются [22, 23]. Противоречивость данных, скорее всего, обусловлена тем, что на процессы вымирания и расселения видов может влиять множество факторов [24], в частности качество местообитаний [10, 25, 26], характеристики видов [27–30], избирательность в поедании и переносе диаспор животными [31–34], изменение вклада распространителей [22]. Однако дефицит информации о динамике видов с разным способом распространения в трансформированных экосистемах не позволяет сделать какие-либо обобщения. Несмотря на существенный вклад атмосферного загрязнения в деградацию природных экосистем, уязвимость видов с разным способом распространения диаспор к этому типу воздействия ранее не сравнивали.
Цель нашей работы – сравнение уязвимости видов травяно-кустарничкового яруса с разным способом распространения генеративных диаспор к загрязнению выбросами медеплавильного завода. Проверяли несколько гипотез.
Первая – способ распространения диаспор существенно влияет на уязвимость: наименее уязвимы к трансформации местообитаний те виды, чьи диаспоры распространяются дальше. Гипотеза базируется на предположении, что такие виды с большей вероятностью могут попасть в “осколки” местообитаний с благоприятными условиями среды и сохраниться в них при длительном загрязнении, а также быстрее заселять территорию после сокращения выбросов. С другой стороны, связь между способом распространения диаспор и дальностью их распространения может быть очень слабой [19, 20] из-за возможности случайного переноса диаспор на очень большие расстояния [14, 18], нивелирующего действия других факторов [24, 35] или изменения вклада распространителей [22].
Вторая гипотеза – независимо от способа распространения диаспор восстановление при высоких уровнях загрязнения будет менее выражено, чем при низких. Гипотеза базируется на предположении, что расселение видов в пространстве может лимитироваться как отсутствием диаспор [36], так и неблагоприятными для выживания условиями среды [10, 25, 37]. Несмотря на существенное сокращение выбросов, концентрации токсикантов в почве и подстилке в окрестностях медеплавильных заводов остаются очень большими в течение десятилетий [38–40]. В сочетании с низким количеством и обилием видов на прилегающих к источнику выбросов территориях и высоким уровнем фрагментации местообитаний [41] это может существенно лимитировать процессы расселения видов после сокращения выбросов.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены в окрестностях Среднеуральского медеплавильного завода, расположенного на окраине г. Ревды, в 50 км к западу от г. Екатеринбурга. Основные ингредиенты выбросов – газообразные соединения серы, фтора и азота, а также пылевые частицы с сорбированными тяжелыми металлами (Cu, Pb, Zn, Cd, Fe, Hg и др.) и металлоидами (As). Предприятие функционирует с 1940 г., валовый выброс СУМЗ в 1980-х гг. достигал 150–225 тыс. т в год, к началу 2000-х гг. снизился до 65 тыс. т/год, к середине 2000-х гг. – до 25 тыс. т/год, а после кардинальной реконструкции предприятия в 2010 г. – до 5 тыс. т/год [49]. Согласно физико-географическому районированию, территория относится к подзоне южной тайги, к провинции низкогорий Среднего Урала, абсолютные высоты – от 100 до 450 м над ур. м. [42].
Проанализированы результаты описаний растительного покрова, выполненных в период высоких (1995–1998 гг.) и низких (2014–2016 гг.) выбросов предприятия. В каждый из периодов выполнили геоботанические описания на 110 пробных площадях (ПП) размером 25 × 25 м, заложенных в лесных фитоценозах на расстоянии не менее 1 км друг от друга в пределах территории 56 × 36 км вокруг завода. Пробные площади различались по типу ландшафтов (элювиальные, транзитные, аккумулятивные), типу почв (серые лесные, бурые горно-лесные, дерново-подзолистые) и растительности (березовые, сосново-березовые и сосновые леса разных ассоциаций). Критериями подбора ПП служили отсутствие свежих пожаров и сильных антропогенных нарушений, не связанных с загрязнением, удаленность от автомобильных дорог не менее 100 м и возраст эдификаторов древесного яруса не менее 80 лет. Местоположения ПП в первый и второй периоды могли несколько различаться, так как в первый период положение ПП фиксировали вручную на карте масштаба 1 : 100 000.
Согласно ранее предложенным классификациям [14, 17], все отмеченные виды по способу распространения диаспор были подразделены на 6 групп (табл. 1). Поскольку многие виды используют несколько способов распространения диаспор (см. Приложение в он-лайн версии), отнесение к той или иной группе выполнено на основании морфологических характеристик, главным образом признаков плодов.
Таблица 1.
Признаки, представители и дальность распространения генеративных диаспор у видов с разным способом диссеминации
| Способ распространения | Основные признаки и представители | Дальность распространения, м | ||
|---|---|---|---|---|
| 50–99% диаспор | максимум | |||
| Автохоры | Без приспособлений для расселения (БП) | Диаспоры осыпаются при полегании и раскачивании стеблей или под собственной тяжестью (Veronica sp., Campanula sp.) | 0.1–1 [14] | 1 [14] |
| Автомеханохоры (АМ) | Активное разбрасывание диаспор благодаря специфике строения плодов (Geranium sp., Vicia sp.) | 1–5 [14] | 7 [14] | |
| Анемохоры | Полуанемохоры (ПА) | Небольшие крыловидные выросты на диаспорах, легкие и ломкие соцветия, сохранение связи чешуек с зерновками, значительная высота (сем. Poaceae и Apiaceae) | 2–150 [14] | 200 [14] |
| Типичные анемохоры (ТА) | Длинные хохолки, очень мелкие и легкие диаспоры (сем. Asteraceae, Pyrolaceae, хвощи, папоротники, плауны) | 10–500 [14] | 3600 [14] | |
| Зоохоры | Мирмекохоры (М) | Наличие элайосом или активное распространение с помощью муравьев (Viola sp., Myosotis sp.) | 2–15 [14] | 70 [14, 17] |
| Эпи-, эндозохоры (ЭЭ) | Яркие и сочные плоды, приспособления для прикрепления плодов к шерсти и перьям (Vaccinium sp., Geum sp.) | 400–1500 [14] | 6000 [31] | |
Для оценки токсической нагрузки использовали индекс токсичности, характеризующий среднее превышение регионального фона для кислоторастворимых форм четырех металлов (Cu, Cd, Рb и Zn) в лесной подстилке. За региональный фон принято содержание этих металлов в лесах Сысертского района Свердловской области (23.6 мкг/г Cu, 1.1 – Cd, 17.4 – Рb, 147.8 – Zn). Использованы пробы, собранные в 1995–1998 гг. (экстракция 5%-ной HNO3, отношение субстрата к экстрагенту 1 : 10, время экстракции – сутки после однократного встряхивания). Концентрацию определяли методом атомной абсорбции на спектрометре AAS-3 (Analytik Jena, Германия). На каждой ПП отбирали по 3 усредненные пробы подстилки. Индекс токсичности менялся от 2.30 до 132.14 усл. ед. В ходе анализа градиент разделили на две зоны (по 55 ПП в каждой). В пределах зоны слабого загрязнения индексы менялись от 2.30 до 10.63 усл. ед., сильного – от 10.86 до 132.14.
Чувствительность к загрязнению и способность к реколонизации оценивали по степени изменения разнообразия групп в градиенте нагрузки до и после существенного сокращения выбросов соответственно. Для характеристики разнообразия групп использовали два показателя: видовое богатство (ВБ, число видов на площади 625 м2) и общее число видов в пределах зоны. Первый из них характеризует видовое разнообразие группы в мезомасштабе (сотни метров), второй – в макромасштабе (километры). Различия в чувствительности групп к токсической нагрузке оценивали по величине угла наклона линий регрессий (для ВБ) и доле исчезнувших видов от их общего числа (для разнообразия в макромасштабе). Различия в способности к реколонизации после сокращения выбросов оценивали по наличию/отсутствию статистически значимого увеличения ВБ групп за прошедшие 20 лет и динамике общего числа видов в группах. В качестве дополнительного параметра использовали долю незаселенных ПП на участках с очень сильным загрязнением (более 49.76 усл. ед.) до и после сокращения выбросов.
Влияние способа распространения диаспор и уровня нагрузки на динамику ВБ групп в период высоких выбросов для каждой зоны оценили с помощью ковариационного анализа (модель для определения гомогенности углов наклона линий регрессий). Реакция разных групп на увеличение токсической нагрузки различалась, поэтому для определения влияния периода наблюдений, способа распространения и уровня нагрузки на динамику ВБ использовали модель ковариационного анализа для данных с разными углами наклона. Перед проведением анализа данные по видовому богатству были преобразованы с помощью извлечения квадратного корня. Множественные сравнения выполнены с помощью критерия Тьюки. Для сравнения доли незаселенных участков видами разных групп и динамики показателя во времени использовали двусторонний t-критерий. Все расчеты проведены в Statistica v7.0 software (StatSoft, Inc.).
РЕЗУЛЬТАТЫ
Видовое богатство. Данные 1995–1998 гг. свидетельствуют о том, что в зоне слабого загрязнения ВБ с увеличением нагрузки в большинстве групп не менялось, у ЭЭ увеличивалось, у ПА снижалось (табл. 2, рис. 1а). Взаимодействие “группа × индекс нагрузки” значимо (F5,308 = 2.29, P < 0.046), а влияние нагрузки в целом незначимо (F1,308 = 0.01, P < 0.917). В зоне сильного загрязнения существенное снижение ВБ с увеличением нагрузки наблюдалось во всех группах (см. табл. 2, рис. 1б; F5,308 = 209.48, P < 0.001). В наименьшей степени негативные изменения были выражены у ТА и ПА (взаимодействие “группа × индекс нагрузки”: F = 2.785,308, P < 0.018).
Таблица 2.
Результаты регрессионных анализов по оценке влияния уровня токсической нагрузки на изменение видового богатства в группах с разным способом распространения диаспор
| Группы по способу распространения диаспор | Зона загрязнения (индекс нагрузки, усл. ед.) | |||||
|---|---|---|---|---|---|---|
| cлабого (2.3–10.6) | cильного (10.9–132.1) | |||||
| β (SE) | R2 | P | β (SE) | R2 | P | |
| 1995–1998 гг. | ||||||
| Без приспособлений (БП) | –0.026 (0.054) | 0.00 | 0.631 | –0.032 (0.004) | 0.49 | 0.000 |
| Автомеханохоры (АМ) | –0.007 (0.037) | 0.00 | 0.840 | –0.024 (0.003) | 0.51 | 0.000 |
| Мирмекохоры (М) | 0.004 (0.029) | 0.00 | 0.884 | –0.025 (0.004) | 0.42 | 0.000 |
| Эпи-, эндозоохоры (ЭЭ) | 0.076 (0.032) | 0.10 | 0.022 | –0.022 (0.003) | 0.49 | 0.000 |
| Полуанемохоры (ПА) | –0.107 (0.048) | 0.09 | 0.030 | –0.015 (0.004) | 0.24 | 0.000 |
| Типичные анемохоры (ТА) | 0.050 (0.049) | 0.02 | 0.312 | –0.015 (0.004) | 0.23 | 0.000 |
| 2014–2016 гг. | ||||||
| Без приспособлений (БП) | –0.09 (0.045) | 0.07 | 0.050 | –0.031 (0.005) | 0.42 | 0.000 |
| Автомеханохоры (АМ) | –0.023 (0.033) | 0.01 | 0.492 | –0.027 (0.004) | 0.45 | 0.000 |
| Мирмекохоры (М) | –0.055 (0.028) | 0.07 | 0.059 | –0.031 (0.004) | 0.49 | 0.000 |
| Эпи-, эндозоохоры (ЭЭ) | 0.021 (0.022) | 0.02 | 0.356 | –0.023 (0.003) | 0.53 | 0.000 |
| Полуанемохоры (ПА) | –0.125 (0.046) | 0.12 | 0.009 | –0.014 (0.003) | 0.29 | 0.000 |
| Типичные анемохоры (ТА) | 0.092 (0.031) | 0.15 | 0.004 | –0.024 (0.003) | 0.47 | 0.000 |
Рис. 1.
Изменение в градиенте нагрузки видового богатства групп растений с разным способом распространения диаспор при слабом (а) и сильном (б) загрязнении: черный круг, пунктирная линия – первый период наблюдений; белый круг, сплошная линия – второй период.
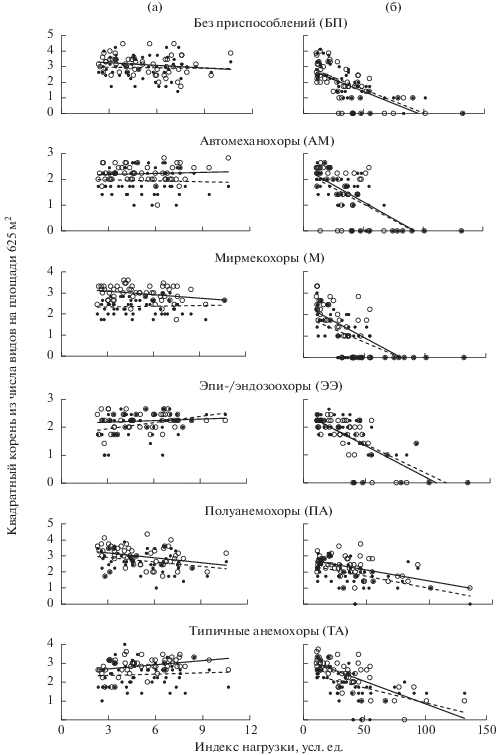
От первого ко второму периоду ВБ в зоне слабого загрязнения возросло (F1,308 = 13.75, P < 0.001), но существенные сдвиги отмечены только у М (P < < 0.001) и ТА (P < 0.001) (взаимодействие “период × × группа × индекс нагрузки”: F5,308 = 3.15, P < 0.001). Увеличение у М произошло главным образом в области низких нагрузок, у ТА – на всей части градиента. В зоне сильного загрязнения ВБ также возросло (F1,308 = 7.80, P < 0.005), однако значимое повышение отмечено только у ТА (P < 0.037) (взаимодействие “период × группа × индекс нагрузки”: F5,308 = 40.75, P < 0.001).
ВБ групп широко варьировало в пределах всей обследованной территории и даже в зоне сильного загрязнения на отдельных ПП могло быть довольно высоким (табл. 3). Средние значения ВБ групп в зоне сильного загрязнения были существенно меньше, чем в зоне слабого, как в первый, так и во второй период наблюдений.
Таблица 3.
Видовое богатство групп с разным способом распространения диаспор в зонах слабого и сильного загрязнения в разные периоды наблюдений. Приведены средние арифметические значения ± стандартная ошибка и лимиты (в скобках)
| Группа по способу распространения диаспор | Зона загрязнения (индекс нагрузки, усл. ед.) | |||
|---|---|---|---|---|
| слабого (2.3–10.6) | сильного (10.9–132.1) | |||
| 1-й период | 2-й период | 1-й период | 2-й период | |
| Без приспособлений (БП) | 9.0 ± 0.55 | 10.2 ± 0.53 | 4.9 ± 0.61 | 4.5 ± 0.59 |
| (2–18) | (3–20) | (0–17) | (0–16) | |
| Автомеханохоры (АМ) | 4.0 ± 0.25 | 4.9 ± 0.21 | 2.6 ± 0.28 | 3.0 ± 0.33 |
| (0–7) | (0–8) | (0–7) | (0–7) | |
| Мирмекохоры (М) | 5.6 ± 0.24 | 8.9 ± 0.29 | 1.9 ± 0.31 | 2.9 ± 0.42 |
| (2–9) | (3–13) | (0–9) | (0–11) | |
| Эпи-, эндозоохоры (ЭЭ) | 4.6 ± 0.23 | 5.0 ± 0.17 | 3.3 ± 0.27 | 3.3 ± 0.26 |
| (1–7) | (2–7) | (0–7) | (0–6) | |
| Полуанемохоры (ПА) | 7.6 ± 0.45 | 9.2 ± 0.51 | 4.3 ± 0.38 | 5.7 ± 0.4 |
| (1–15) | (3–19) | (0–10) | (1–14) | |
| Типичные анемохоры (ТА) | 6.1 ± 0.42 | 8.4 ± 0.31 | 4.2 ± 0.39 | 6.2 ± 0.49 |
| (1–16) | (3–13) | (0–11) | (0–14) | |
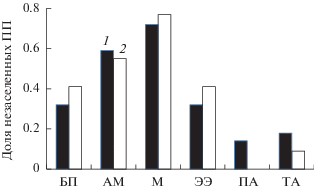
Доля незаселенных участков на территории с очень сильным загрязнением была наибольшей у М и АМ, наименьшей – среди ПА и ТА (рис. 2). От первого ко второму периоду изменение доли незаселенных участков в группах различалось: выраженное снижение наблюдалось у анемохорных видов, а у остальных групп она либо осталась на прежнем уровне (АМ, М), либо несколько возросла (БП, ЭЭ).
Рис. 2.
Доля незаселенных ПП при очень сильном загрязнении у видов с разным способом распространения диаспор в первый (1) и второй (2) периоды наблюдений. Группы: БП – без приспособлений, АМ – автомеханохоры, М – мирмекохоры, ЭЭ – эпи-, эндозоохоры, ПА – полуанемохоры, ТА – типичные анемохоры.
Общее число видов. По данным первого периода наблюдений, общее число видов в зоне сильного загрязнения по сравнению с зоной слабого у автохоров и зоохоров снизилось (БП – на 24%, АМ – на 18%, М – на 28%, ЭЭ – на 19%), а у анемохоров, наоборот, возросло (ПА – на 15%, ТА – на 3%) (табл. 4). В целом общее число видов в зоне сильного загрязнения по сравнению с зоной слабого было меньше лишь на 9%. От первого ко второму периоду общее число видов в обеих зонах загрязнения в большинстве групп изменилось незначительно: в зоне слабого загрязнения несколько увеличилось число типичных анемохоров (появились Epipactis sp., Senecio nemorensis и др.) (см. Приложение), в зоне сильного загрязнения увеличилось число мирмекохоров (появились Allium victorale, Pulmonaria obscura и др.), а полуанемохоров, наоборот, снизилось (исчезли Bupleurum aureum, Crepis sibirica и др.).
Таблица 4.
Общее число видов в группах с разным способом распространения генеративных диаспор в разных зонах токсической нагрузки в 1995–1998 гг. и 2014–2016 гг.
| Группа | Годы | Зона загрязнения (индекс нагрузки, усл. ед.) | |
|---|---|---|---|
| слабое (2.3–10.6) | сильное (10.9–132.1) | ||
| Автохоры | 1995–1998 | 57 | 44 |
| 2014–2016 | 52 | 43 | |
| В том числе: | |||
| без приспособлений (БП) | 1995–1998 | 46 | 35 |
| 2014–2016 | 43 | 35 | |
| автомеханохоры (АМ) | 1995–1998 | 11 | 9 |
| 2014–2016 | 9 | 8 | |
| Зоохоры | 1995–1998 | 33 | 25 |
| 2014–2016 | 34 | 30 | |
| В том числе: | |||
| мирмекохоры (М) | 1995–1998 | 18 | 13 |
| 2014–2016 | 19 | 19 | |
| эпи-, эндозоохоры (ЭЭ) | 1995–1998 | 16 | 13 |
| 2014–2016 | 15 | 12 | |
| Анемохоры | 1995–1998 | 72 | 78 |
| 2014–2016 | 80 | 73 | |
| В том числе: | |||
| полуанемохоры (ПА) | 1995–1998 | 34 | 39 |
| 2014–2016 | 36 | 34 | |
| типичные анемохоры (ТА) | 1995–1998 | 38 | 39 |
| 2014–2016 | 44 | 39 | |
| Всего видов | 1995–1998 | 163 | 148 |
| 2014–2016 | 166 | 147 | |
ОБСУЖДЕНИЕ
Виды с разным способом распространения диаспор различались как по чувствительности к загрязнению, так и по способности к реколонизации после сокращения выбросов. Однако полученные результаты лишь частично подтверждают нашу первою гипотезу: способ распространения влияет на уязвимость видов, но связь между уязвимостью и дальностью переноса диаспор неоднозначна.
Чувствительность к загрязнению. По данным первого периода наблюдений, снижение видового богатства при высоких уровнях загрязнения наблюдалось во всех группах, но среди анемохоров негативные изменения были выражены в наименьшей степени (см. рис. 1 и табл. 2). Анемохоры характеризовались также самой низкой долей незаселенных участков при очень сильном загрязнении (см. рис. 2). Более того, общее число видов анемохоров в зоне сильного загрязнения даже возросло (см. табл. 4).
Дифференцированный отклик групп может быть обусловлен разными причинами. В частности, меньшая чувствительность анемохоров к загрязнению может быть связана с тем, что большинство из них образует огромное количество генеративных диаспор, которые благодаря очень мелким размерам или наличию специфических приспособлений, например хохолков, способны распространяться на значительные расстояния [14, 17]. Это может увеличивать вероятность попадания диаспор в “осколки” местообитаний с более благоприятными условиями, т.е. обеспечивать меньшую чувствительность видов этой группы к усилению фрагментации местообитаний и ухудшению их качества. Отсутствие исследований по динамике видов с разным способом распространения диаспор в окрестностях других заводов не позволяет оценить степень общности полученных оценок чувствительности. Однако исследования по потерям видов в антропогенно преобразованных ландшафтах Европы также свидетельствуют о меньшей чувствительности анемохорных видов и большей – зоохоров и гидрохоров [22].
Во всех группах потери видов в мезомасштабе (видовое богатство в пределах сообществ) были выражены в большей степени, чем в макромасштабе (общее число видов в зоне загрязнения). Это соответствует нашим данным по динамике альфа- и гамма-разнообразия сообществ на этой территории [41]. Использованное нами ранее более дробное зонирование (5 зон нагрузки) показывает, что резкое снижение общего числа видов происходит только непосредственно вблизи завода (в радиусе 3 км) [41]. Однако даже в зоне сильного загрязнения видовое богатство групп в отдельных местообитаниях могло быть высоким (см. табл. 3), что свидетельствует о неравномерности элиминации видов в пространстве и наличии локалитетов с более благоприятными условиями среды. По нашим наблюдениям такими локалитетами могут быть приручьевые и припойменные участки, подветренные склоны, участки с вывалами единичных деревьев.
Разная выраженность изменений разнообразия в мезо- и макромасштабе свидетельствует о наличии значительного временнóго лага между элиминацией видов в локальных местообитаниях и их исчезновением со всей территории. Наличие временнóго лага, предшествующего полной элиминации видов с территории, показано в ряде исследований [2, 43]. Среди препятствующих исчезновению видов факторов называют высокую продолжительность жизни, существование покоящихся стадий (сохранение в почве семян и спор) и наличие нескольких локальных популяций в пределах территории [44]. При длительном поступлении загрязняющих веществ выживание отдельных видов может быть обусловлено также наличием меж- и внутривидовой дифференциации по толерантности к токсикантам и возможностью адаптации к их избытку [45, 46], высокой пространственной неравномерностью распределения токсикантов [41, 47] и условий среды.
Способность к реколонизации после сокращения выбросов. Низкая способность к реколонизации после сокращения выбросов отмечена не только у автохоров, т.е. видов с наименьшей дальностью распространения диаспор, но и у эпи-, эндозоохоров, дальность распространения диаспор которых максимальна. Очень низкая, вопреки ожиданиям, способность к реколонизации эпи-, эндозоохоров может быть обусловлена отсутствием или очень низкой численностью распространителей в загрязненных местообитаниях. Значительное снижение численности птиц и мелких млекопитающих в зоне действия этого и других медеплавильных заводов показано в ряде работ [48–52]. Существенный вклад в распространение диаспор растений вносят и крупные млекопитающие [31, 33, 53]. Хотя данные по этой группе на рассматриваемой территории отсутствуют, известно, что численность крупных млекопитающих в современном биоценотическом покрове из-за деятельности человека крайне низка [54].
Информации о восстановлении обилия потенциальных распространителей диаспор после сокращения выбросов мало. В некоторых исследованиях показано очень медленное улучшение репродуктивных и других показателей населения птиц после сокращения выбросов [55, 56]. Результаты отдельных экспериментов показывают, что через несколько десятилетий после сокращения выбросов в деградированных экосистемах наблюдается низкая скорость изъятия плодов птицами и млекопитающими [57]. Это косвенно свидетельствует о длительном сохранении низкой численности распространителей в окрестностях заводов после сокращения выбросов.
Мирмекохоры очень чувствительны к загрязнению, но после сокращения выбросов в зоне слабого загрязнения увеличилось их видовое богатство, а в зоне сильного загрязнения несколько возросло общее число видов. Более выраженная по сравнению с эпи-, эндозоохорами положительная динамика разнообразия этой группы может быть обусловлена следующим. Видовое разнообразие и обилие муравьев по мере приближения к рассматриваемому заводу не уменьшаются, а наоборот возрастают, небольшое снижение показателей зафиксировано только при очень высоких нагрузках [58]. Существенная роль муравьев в распространении диаспор растений хорошо известна [34], причем муравьи способствуют не только перемещению диаспор в пространстве: у диаспор мирмекохорных видов муравьи съедают только элайосомы, а семена при этом остаются неповрежденными и выбрасываются из гнезд. Удаление элайосом стимулирует всхожесть семян, предотвращает повреждаемость их грибами и снижает привлекательность для мелких млекопитающих [59]. Временное запасание и хранение диаспор в гнездах предохраняют их также от повреждения и поедания животными.
Видовое богатство типичных анемохоров за прошедшие 20 лет увеличилось в обеих зонах (см. рис. 1 и табл. 3). Более быстрая по сравнению с другими группами реколонизация анемохорами загрязненных местообитаний может быть обусловлена их высокой представленностью в зоне сильного загрязнения, а также тем, что ветер как агент диссеминации повсеместен и присутствует постоянно. Увеличение видового богатства анемохоров на всей исследованной территории за прошедший период может быть также следствием массовых ветровалов, произошедших на территории Свердловской области в 1995 г. [60]. Известно, что ветровалы способствуют существенному увеличению обилия видов открытых и нарушенных местообитаний, к числу которых относятся многие анемохорные виды. Хотя исследованные ПП не были подвержены массовым ветровалам, ветровальные участки на прилегающих территориях могли служить источниками значительного количества диаспор.
Различия в реколонизации между слабо и сильно загрязненными участками. Динамика видового богатства большинства групп зависела от уровня нагрузки: положительные сдвиги отмечены только при низких нагрузках, а в зоне высоких нагрузок разнообразие осталось на прежнем уровне. Однако у типичных анемохоров динамика не зависела от уровня нагрузки. Таким образом, наша вторая гипотеза также подтвердилась лишь частично.
Одной из возможных причин практически полного отсутствия положительных изменений в сильно загрязненных местообитаниях у большей части групп может быть сохранение высоких концентраций тяжелых металлов в почве и подстилке в течение десятилетий после сокращения выбросов [40]. Лимитировать процессы расселения видов в загрязненных местообитаниях может также подстилка, увеличение мощности которой в зоне действия завода хорошо документировано [61]. Негативное действие мощной подстилки на возобновление растений хорошо известно [62, 63]. Факторами, лимитирующими расселение видов после сокращения выбросов, также могут быть произошедшие в условиях загрязнения изменения травяно-кустарничкового яруса: 1) существенное снижение числа и обилия видов; 2) увеличение размеров территории, полностью непригодной для выживания видов, т.е. ухудшение качества местообитаний в сочетании с увеличением дистанции до источников диаспор (усиление фрагментации). Влияние доступности диаспор и качества местообитаний на динамику лесных видов после прекращения аграрного использования земель, как и негативное действие фрагментации местообитаний на процессы иммиграции видов, показано в ряде экспериментальных работ [10, 25, 26, 37, 64]. Оценка вклада разных факторов требует дополнительных исследований. Отсутствие положительных изменений в течение десятилетий или крайне медленное восстановление разнообразия растительных сообществ после сокращения выбросов показано в ряде работ [39, 65–67], и наши данные хорошо согласуются с выводом о длительном сохранении деградированного состояния растительных сообществ после сокращения выбросов.
ЗАКЛЮЧЕНИЕ
При длительном атмосферном загрязнении среды выбросами медеплавильного завода резкое снижение видового богатства, независимо от способа распространения диаспор, происходит главным образом при высоких токсических нагрузках. Общее число видов (разнообразие в макромасштабе) снижается в меньшей степени, чем видовое богатство (разнообразие в мезомасштабе). Более того, для всех групп в зоне высоких токсических нагрузок отмечено наличие локалитетов с относительно высоким видовым богатством. Сохранение таких локалитетов в сочетании со значительным временны́м лагом, предшествующим исчезновению вида на всей территории, может иметь большое значение для реколонизации деградированных экосистем после сокращения выбросов.
Несмотря на многократное снижение выбросов завода за прошедшие 20 лет, положительные сдвиги в видовом богатстве выявлены только у мирмекохоров (в области низких нагрузок) и типичных анемохоров (на всем градиенте загрязнения). Однако в целом видовое богатство всех групп в зоне высоких нагрузок осталось на крайне низком уровне, что свидетельствует о стабильности деградированного состояния травяно-кустарничкового яруса на наиболее загрязненной территории.
Виды с разным способом распространения диаспор различаются по степени уязвимости к изменению условий среды, вызванных длительным атмосферным загрязнением, но связь уязвимости с дальностью переноса диаспор неоднозначна. У видов с наименьшей (автохоры) и наибольшей (эпи-, эндозоохоры) дальностью распространения диаспор отмечены практически одинаково высокая чувствительность к загрязнению и крайне низкая способность к реколонизации после сокращения выбросов, т.е. очень высокая уязвимость. Высоко чувствительны к загрязнению также мирмекохоры, но способность к реколонизации у них выше, чем у автохоров и эпи-, эндозоохоров, а наименее уязвимы анемохоры.
Выявленные различия в поведении видов с разным способом распространения диаспор важны для понимания закономерностей динамики растительных сообществ при антропогенных воздействиях и оценки последствий таких воздействий. В деградированных лесных экосистемах, с крайне низким качеством местообитаний и высокой степенью их фрагментации [41], наименее уязвимы виды, чьи диаспоры распространяются внешним агентом абиотического происхождения, в частности ветром. Наиболее уязвимы виды диаспор, не имеющие приспособлений для переноса внешними агентами (автохоры), и виды, чьи диаспоры распространяются птицами и млекопитающими (эпи-, эндозоохоры). Изменение вклада распространителей в трансформированных экосистемах может быть одной из причин частичной “потери” связи дальности распространения диаспор со степенью уязвимости видов. Более того, изменение вклада распространителей может приводить к смещению состава и структуры растительных сообществ в сторону увеличения участия наименее уязвимой группы, в данном случае анемохоров (эффект самоусиления). В таком случае сама возможность возврата трансформированных сообществ к типичным лесным сообществам незагрязненных местообитаний становится маловероятной.
Выражаю признательность Е.Л. Воробейчику за предоставление данных по содержанию металлов в подстилке, И.Н. Михайловой – за организацию полевых работ, анонимному рецензенту и Е.Л. Воробейчику за ценные замечания при подготовке рукописи. Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН.
Список литературы
Haddad N.M., Brudvig L.A., Clobert J. et al. Habitat fragmentation and its lasting impact on Earth’s ecosystems // Science Advances. 2015. V. 1. № 2. P. e1500052.
Kolk J., Naaf T. Herb layer extinction debt in highly fragmented temperate forests – Completely paid after 160 years? // Biological Conservation. 2015. V. 182. P. 164–172.
Cadotte M.W., Dinnage R., Tilman D. Phylogenetic diversity promotes ecosystem stability // Ecology. 2012. V. 93. № 8. P. 223–233.
Cardinale B.J., Duffy J.E., Gonzalez A. et al. Biodiversity loss and its impact on humanity // Nature. 2012. V. 486. № 7401. P. 59–67.
Букварева Е.Н. Роль наземных экосистем в регуляции климата и место России в посткиотском процессе. М.: Litres, 2017. 100 с.
Gilliam F.S. The ecological significance of the herbaceous layer in temperate forest ecosystems // AIBS Bulletin. 2007. V. 57. № 10. P. 845–858.
Moore P.T., Van Miegroet H., Nicholas N.S. Relative role of understory and overstory in carbon and nitrogen cycling in a southern Appalachian spruce-fir forest // Canad. J. of Forest Research. 2007. V. 37. № 12. P. 2689–2700.
Milcu A., Thebault E., Scheu S., Eisenhauer N. Plant diversity enhances the reliability of belowground processes // Soil Biology and Biochemistry. 2010. V. 42. № 12. P. 2102–2110.
Михайлова Н.В., Богданова Н.Е., Михайлов А.В. Скорость освоения территории неморальными видами трав (модельный подход) // Бюл. МОИП. Сер. биол. 2006. Т. 111. № 1. С. 37–44.
Baeten L., Jacquemyn H., Van Calster H. et al. Low recruitment across life stages partly accounts for the slow colonization of forest herbs // J. of Ecology. 2009. V. 97. № 1. P. 109–117.
Brunet J., De Frenne P., Holmström E., Mayr M.L. Life-history traits explain rapid colonization of young post-agricultural forests by understory herbs // Forest Ecology and Management. 2012. V. 278. P. 55–62.
Nordén B., Dahlberg A., Brandrud T.E. et al. Effects of ecological continuity on species richness and composition in forests and woodlands: A review // Écoscience. 2014. V. 21. № 1. P. 34–45.
Myers J.A., Harms K.E. Seed arrival, ecological filters, and plant species richness: a meta-analysis // Ecology Letters. 2009. V. 12. № 11. P. 1250–1260.
Vittoz P., Engler R. Seed dispersal distances: a typology based on dispersal modes and plant traits // Botanica Helvetica. 2007. V. 117. № 2. P. 109–124.
Bullock J.M., Mallada González L., Tamme R. et al. A synthesis of empirical plant dispersal kernels // J. of Ecology. 2017. V. 105. № 1. P. 6–19.
Hemrová L., Bullock J.M., Hooftman D.A.P. et al. Drivers of plant species’ potential to spread: the importance of demography versus seed dispersal // Oikos. 2017. V. 126. № 10. P. 1493–1500.
Левина Р.Е. Морфология и экология плодов. Л.: Наука, 1987. 160 с.
Nathan R., Schurr F.M., Spiegel O. et al. Mechanisms of long-distance seed dispersal // Trends in Ecology & Evolution. 2008. V. 23. № 11. P. 638–647.
Higgins S.I., Nathan R., Cain M.L. Are long-distance dispersal events in plants usually caused by nonstandard means of dispersal? // Ecology. 2003. V. 84. № 8. P. 1945–1956.
Ash J.D., Givnish T.J., Waller D.M. Tracking lags in historical plant species’ shifts in relation to regional climate change // Global Change Biology. 2017. V. 23. № 3. P. 1305–1315.
Fröborg H., Eriksson O. Local colonization and extinction of field layer plants in a deciduous forest and their dependence upon life history features // J. of Vegetation Science. 1997. V. 8. № 3. P. 395–400.
Ozinga W.A., Römermann C., Bekker R.M. et al. Dispersal failure contributes to plant losses in NW Europe // Ecology Letters. 2009. V. 12. № 1. P. 66–74.
Marini L., Bruun H.H., Heikkinen R.K. et al. Traits related to species persistence and dispersal explain changes in plant communities subjected to habitat loss // Diversity and Distributions. 2012. V. 18. № 9. P. 898–908.
García C., Klein E.K., Jordano P. Dispersal processes driving plant movement: challenges for understanding and predicting range shifts in a changing world // J. of Ecology. 2017. V. 105. № 1. P. 1–5.
Flinn K.M. Microsite-limited recruitment controls fern colonization of post-agricultural forests // Ecology. 2007. V. 88. № 12. P. 3103–3114.
Paal T., Kütt L., Lõhmus K., Liira J. Both spatiotemporal connectivity and habitat quality limit the immigration of forest plants into wooded corridors // Plant Ecology. 2017. V. 218. № 4. P. 417–431.
Thomson F.J., Moles A.T., Auld T.D., Kingsford R.T. Seed dispersal distance is more strongly correlated with plant height than with seed mass // J. of Ecology. 2011. V. 99. № 6. P. 1299–1307.
Albert A., Auffret A.G., Cosyns E. et al. Seed dispersal by ungulates as an ecological filter: a trait-based meta-analysis // Oikos. 2015. V. 124. № 9. P. 1109–1120.
Sonkoly J., Deák B., Valkó O. et al. Do large-seeded herbs have a small range size? The seed mass–distribution range trade-off hypothesis // Ecology and Evolution. 2017. V. 7. № 24. P. 11 204–11 212.
Beckman N.G., Bullock J.M., Salguero-Gómez R. High dispersal ability is related to fast life-history strategies // J. of Ecology. 2018. V. 106. № 4. P. 1349–1362.
Evstigneev O.I., Korotkov V.N., Murashev I.A., Voevodin P.V. Zoochory and peculiarities of forest community formation: a review // Rus. J. of Ecosystem Ecology. 2017. № 1. P. 1–16.
Forey E., Barot S., Decaëns T. et al. Importance of earthworm-seed interactions for the composition and structure of plant communities: A review // Acta Oecologica. 2011. V. 37. № 6. P. 594–603.
Lepková B., Horčičková E., Vojta J. Endozoochorous seed dispersal by free-ranging herbivores in an abandoned landscape // Plant Ecology. 2018. V. 219. № 9. P. 1127–1138.
Penn H.J., Crist T.O. From dispersal to predation: A global synthesis of ant – seed interactions // Ecology and Evolution. 2018. V. 8. № 18. P. 9122–9138.
Lustenhouwer N., Moran E.V., Levine J.M. Trait correlations equalize spread velocity across plant life histories // Global Ecology and Biogeography. 2017. V. 26. № 12. P. 1398–1407.
Ehrlén J., Eriksson O. Dispersal limitation and patch occupancy in forest herbs // Ecology. 2000. V. 81. № 6. P. 1667–1674.
Verheyen K., Hermy M., Thompson K. Recruitment and growth of herb-layer species with different colonizing capacities in ancient and recent forests // J. of Vegetation Science. 2004. V. 15. № 1. P. 125–134.
Meadows M., Watmough S.A. An assessment of long-term risks of metals in Sudbury: a critical loads approach // Water, Air, & Soil Pollution. 2012. V. 223. № 7. P. 4343–4354.
Трубина М.Р., Воробейчик Е.Л., Хантемирова Е.В. и др. Динамика лесной растительности после снижения промышленных выбросов // Докл. РАН. 2014. Т. 458. № 6. С. 721–725.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период сокращения объемов его выбросов // Почвоведение. 2017. № 8. С. 1009–1024.
Трубина М.Р., Воробейчик Е.Л. Сильное промышленное загрязнение увеличивает β-разнообразие растительных сообществ // Докл. РАН. 2012. Т. 442. № 1. С. 139–141.
Прокаев В.И. Физико-географическое районирование Свердловской области. Свердловск: Свердловский педагогич. ин-т, 1976. 137 с.
Metzger J.P., Martensen A.C., Dixo M. et al. Time-lag in biological responses to landscape changes in a highly dynamic Atlantic forest region // Biological conservation. 2009. V. 142. № 6. P. 1166–1177.
Hylander K., Ehrlén J. The mechanisms causing extinction debts // Trends in Ecology & Evolution. 2013. V. 28. № 6. P. 341–346.
Ernst W.H.O. Evolution of metal tolerance in higher plants // For Snow Landsc. Res. 2006. V. 80. № 3. P. 251–274.
Дуля О.В., Микрюков В.С., Воробейчик Е.Л. Стратегии адаптации Deschampsia caespitosa и Lychnis flos-cuculi к загрязнению тяжелыми металлами: анализ на основе зависимости доза–эффект // Экология. 2013. № 4. С. 243–243.
Ginocchio R., Carvallo G., Toro I. et al. Micro-spatial variation of soil metal pollution and plant recruitment near a copper smelter in Central Chile // Environmental Pollution. 2004. V. 127. № 3. P. 343–352.
Kataev G.D., Suornela J., Palokangas P. Densities of microtime rodents along a pollution gradient from a copper-nickel smelter // Oecologia. 1994. V. 97. № 4. P. 491–498.
Бельский Е., Ляхов А. Реакции населения птиц южной тайги Среднего Урала на техногенное загрязнение среды обитания // Экология. 2003. № 3. С. 200–207.
Мухачева С.В. Особенности пространственно-временной структуры населения рыжей полевки в градиенте техногенного загрязнения среды // Экология. 2007. № 3. С. 178–184.
Мухачева С.В., Давыдова Ю.А., Кшнясев И.А. Реакция населения мелких млекопитающих на загрязнение среды выбросами медеплавильного производства // Экология. 2010. № 6. С. 452–458.
Eeva T., Belskii E., Gilyazov A.S., Kozlov M.V. Pollution impacts on bird population density and species diversity at four non-ferrous smelter sites // Biological Conservation. 2012. V. 150. № 1. P. 33–41.
Boch S., Berlinger M., Prati D., Fischer M. Is fern endozoochory widespread among fern-eating herbivores? // Plant Ecology. 2016. V. 217. № 1. P. 13–20.
Евстигнеев О.И., Воеводин П.В., Коротков В.Н., Мурашев И.А. Зоохория и дальность переноса семян в хвойно-широколиственных лесах Восточной Европы // Успехи современной биологии. 2013. Т. 133. № 4. С. 392–400.
Berglund Å.M.M., Nyholm N.E.I. Slow improvements of metal exposure, health- and breeding conditions of pied flycatchers (Ficedula hypoleuca) after decreased industrial heavy metal emissions // Science of The Total Environment. 2011. V. 409. № 20. P. 4326–4334.
Eeva T., Lehikoinen E. Long-term recovery of clutch size and egg shell quality of the pied flycatcher (Ficedula hypoleuca) in a metal polluted area // Environmental Pollution. 2015. V. 201. P. 26–33.
Chillo V., Anand M. Effects of past pollution on zoochory in a recovering mixed temperate—boreal forest // Ecoscience. 2012. V. 19. № 3. P. 258–265.
Belskaya E., Gilev A., Belskii E. Ant (Hymenoptera, Formicidae) diversity along a pollution gradient near the Middle Ural Copper Smelter, Russia // Environmental Science and Pollution Research. 2017. V. 24. № 11. P. 10768–10777.
Garrido J.L., Rey P.J., Herrera C.M. Influence of elaiosome on postdispersal dynamics of an ant-dispersed plant // Acta Oecologica. 2009. V. 35. № 3. P. 393–399.
Lässig R., Močalov S.A. Frequency and characteristics of severe storms in the Urals and their influence on the development, structure and management of the boreal forests // Forest Ecology and Management. 2000. V. 135. № 1–3. P. 179–194.
Воробейчик Е.Л. Изменение мощности лесной подстилки в условиях химического загрязнения // Экология. 1995. № 4. С. 278–284.
Xiong S., Nilsson C. The effects of plant litter on vegetation: a meta-analysis // J. of Ecology. 1999. V. 87. № 6. P. 984–994.
Weltzin J.F., Keller J.K., Bridgham S.D. et al. Litter controls plant community composition in a northern fen // Oikos. 2005. V. 110. № 3. P. 537–546.
Verheyen K., Guntenspergen G.R., Biesbrouck B., Hermy M. An integrated analysis of the effects of past land use on forest herb colonization at the landscape scale // J. of Ecology. 2003. V. 91. № 5. P. 731–742.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В. и др. Многолетняя динамика лесной растительности в период снижения выбросов медеплавильного завода: результаты 25-летнего мониторинга // Экология. 2014. № 6. С. 448–458.
Rose R., Monteith D.T., Henrys P. et al. Evidence for increases in vegetation species richness across UK Environmental Change Network sites linked to changes in air pollution and weather patterns // Ecological Indicators. 2016. V. 68. P. 52–62.
Stevens C.J. How long do ecosystems take to recover from atmospheric nitrogen deposition? // Biological Conservation. 2016. V. 200. № Supplement C. P. 160–167.
Дополнительные материалы отсутствуют.


