Экология, 2020, № 6, стр. 403-416
Взаимодействие беспозвоночных и синтетических полимеров в почве (обзор)
В. Д. Леонов a, *, А. В. Тиунов a
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: v.d.leonov@gmail.com
Поступила в редакцию 28.03.2020
После доработки 18.04.2020
Принята к публикации 13.05.2020
Аннотация
Загрязнение окружающей среды, в том числе почвы, пластиком – одна из крупнейших мировых проблем, однако о влиянии синтетических полимеров на почвенное население мало известно. В обзоре обобщены результаты экспериментальных исследований влияния пластика на разные группы почвенных животных (21 работа) и почвенных животных на поступающий в почву пластик (13 работ). Наличие в почве микропластика отрицательно влияет на нематод, коллембол, энхитреид, дождевых червей. Механизмы влияния пластика на животных часто связаны с повреждением или нарушением работы пищеварительной системы. С другой стороны, почвенные животные могут способствовать механическому разрушению и стимулировать микробную деструкцию пластика в почве. Опираясь на богатый опыт исследования последствий загрязнения пластиком морских экосистем, мы обсуждаем основные проблемы, задачи и перспективы исследований взаимодействия пластика с почвенными животными.
Загрязнение окружающей среды синтетическими полимерами – одна из крупнейших экологических проблем. Повсеместно распространенный, пластик обнаруживается во всех средах, влияет на биоту планеты и благосостояние людей. Загрязнение пластиком может взаимодействовать с другими глобальными процессами и иметь отдаленные и долгосрочные последствия [1]. Масштабы загрязнения пластиком достаточны для того, чтобы использовать его в качестве стратиграфического индикатора антропоцена [2].
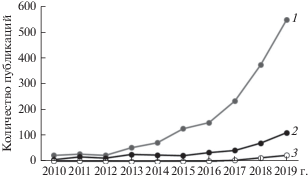
Возрастающее загрязнение пластиком Мирового океана и пресных водоемов уже много лет признается важнейшей угрозой в экологической, экономической и социальной сферах [3–5]. Последствия загрязнения пластиком морских экосистем исследованы в сотнях работ [6, 7]. Степень загрязнения пластиком наземных экосистем, в том числе почвы, также достигла угрожающих масштабов [8], однако связанные с этим экологические проблемы привлекали намного меньше внимания [9–11] (рис. 1).
Рис. 1.
Количество публикаций о загрязнении пластиком в базе данных Web of Science (Core Collection) с 2010 г. по 2019 г. (дата доступа 25 марта 2020 г.). Поисковые запросы: 1 – водные экосистемы: “*plastic pollution AND (aquatic OR marine OR freshwater)”; 2 – почва: “*plastic pollution AND soil”; 3 – почвенные животные: “*plastic pollution AND soil AND (soil-animal OR soil invertebrates OR soil biota OR soil fauna OR Protist OR Protozoa OR Nematoda OR Acari OR Mite OR Collembola OR Microarthropoda OR Springtail OR earthworm OR Lumbricidae OR Ant OR Gastropoda OR Oligochaeta OR Millipedes OR Woodlice OR Isoptera OR termites)”.
Пластик в наземных экосистемах, как правило, поступает в почву, и его дальнейшая судьба определяется способностями почвенной среды к самоочищению. Деструкция органического вещества в почве выполняется преимущественно живыми организмами, относящимися к детритной пищевой сети, хотя не следует упускать из вида абиотическую деструкцию [12, 13]. Почвенные животные составляют неотъемлемый блок детритной пищевой сети, среди важнейших функций которого достаточно назвать регуляцию активности микроорганизмов, механическое разрушение органических фрагментов и их перемещение в почвенном профиле, а во многих экосистемах и само формирование этого профиля [14–17].
Взаимодействие почвенных животных с поступающими в почву искусственными полимерами неизбежно, но пока слабо исследовано. В данном обзоре мы представляем имеющуюся информацию о влиянии пластика на почвенных животных, а также о воздействии педобионтов на попадающий в почву пластик. Опираясь на богатый опыт исследования последствий пластикового загрязнения в морских экосистемах, мы обсуждаем, какие из уже описанных типов воздействия пластика на живые системы могут быть наиболее актуальны в почве. Обзор опубликованных работ позволяет наметить основные методологические проблемы, задачи и перспективы исследований взаимодействия пластика с почвенными животными.
ПРОИЗВОДСТВО ПОЛИМЕРОВ И ПЛАСТИКОВОЕ ЗАГРЯЗНЕНИЕ
Согласно докладу, подготовленному в рамках Программы ООН по окружающей среде (UNEP), в 2015 г. в мире произведено более 388 млн т искусственных полимеров [18] (табл. 1), из них около 160 млн т оказалось в составе бытовых отходов. В процессе эксплуатации изделий из пластика и нарушения правил их утилизации около 8.3 млн т пластика поступило в окружающую среду. Основными процессами, приводящими к “утечкам” пластика, стали: нарушение правил захоронения отходов — 3.87 × 106 т, истирание автомобильных шин — 1.41 × 106 т, замусоривание — 0.8 × 106 т, городская пыль — 0.65 × 106 т, разрушение дорожной разметки — 0.59 × 106 т, стирка одежды — 0.26 × 106 т, косметика — 0.01 × 106 т. К этому следует прибавить неучтенное поступление пластика в результате разрушения различных конструкций и потерь при транспортировке [18].
Таблица 1.
Мировое производство основных искусственных полимеров по данным на 2015 г. (по [18])
| Полимер | Произведено, млн т | Доля в производстве, % |
|---|---|---|
| Полипропилен | 61.9 | 16 |
| Полипропиленовые волокна | 30.1 | 8 |
| Полиэтилен низкой плотности | 45.7 | 12 |
| Поливинилхлорид | 43.0 | 11 |
| Полиэтилен высокой плотности | 40.4 | 10 |
| Полиэтилентерефталат (ПЭТ) | 18.8 | 5 |
| ПЭТ волокна | 18.8 | 5 |
| Полистирол, вспененный полистирол | 18.8 | 5 |
| Полиуретан | 16.1 | 4 |
| Другие термопласты | 10.8 | 3 |
| Реактопласты | 33.7 | 9 |
| Эластомеры (включая искусственный каучук) | 15.0 | 4 |
| Клеи | 9.4 | 2 |
| Акрилонитрил бутадиен стирол, стирол акрилонитрила | 8.1 | 2 |
| Поликарбонат | 2.7 | 1 |
| Полиамид | 2.7 | 1 |
| Полиамидные волокна | 4.4 | 1 |
| Разнообразные покрытия | 3.9 | 1 |
| Герметики | 1.8 | 0.5 |
| Биопластики (например, полимолочная кислота) | 2.1 | 0.5 |
| Всего | 388.2 | 100 |
Исследование загрязнения пластиком окружающей среды и, особенно, почв сталкивается с рядом методических проблем, связанных с разнообразием состава искусственных полимеров и их химической инертностью. Современные пластики — это сложная смесь полимеров, остаточных мономеров и различных присадок. Из приблизительно 50 основных типов синтетических полимеров создано более 60 000 полимерных составов [19], а широкое применение в быту нашли около 20 из них [18] (см. табл. 1).
Поведение пластика в природных средах и его опасность для живых организмов определяются не только химическим составом, но и размером, формой и другими физическими характеристиками его частиц [4]. Подробная размерная классификация частиц пластика подразделяет их на макропластик (наибольшая длина частиц ≥25 мм), мезопластик (<25–5 мм), микропластик (<5–1 мм), минимикропластик (<1 мм–1 мкм) и нанопластик (<1 мкм) [20]. Но в большинстве работ используется менее дробная, стихийно сложившаяся классификация с несколько другими границами размерных классов: макропластик (>5 мм), микропластик (5 мм–1 мкм), нанопластик (<1 мкм) [21, 22]. Часто в качестве верхней границы класса микропластика принимается 1 мм (1000 микрометров) [23], кроме того, иногда выделяют мегапластик (>100 мм) [24]. В нашем обзоре сохранена принадлежность частиц к размерным классам, указанная авторами оригинальных исследований.
Особый класс частиц составляют полимерные волокна, образующиеся при разрушении синтетических тканей. Во время каждой стирки синтетические предметы одежды теряют около 2000 волокон [25] и около 100 синтетических волокон содержится в каждом литре сточных вод [26].
ПЛАСТИК В ПОЧВЕ
В последнее десятилетие появился ряд работ, посвященных поведению пластика в почве, взаимодействию с почвенными животными, миграции по пищевым цепям (см. рис. 1). Однако из-за объективных сложностей и непродолжительной истории исследований в этой области остается много белых пятен [27, 28]. Например, упомянутый выше доклад Программы ООН по окружающей среде освещает в основном загрязнение Мирового океана, а глава о почвах в нем отсутствует [18].
Пластик поступает в почву разнообразными путями: с компостами, включающими бытовые отходы, осадками сточных вод, при использовании пластиковой мульчи в сельском хозяйстве, при ирригации загрязненной пластиком водой, из стихийных свалок бытовых отходов в местах отдыха и вдоль дорог, в ходе деградации дорожного покрытия [23]. Все большую роль в расширении ореолов загрязнения приобретает перенос фрагментов пластика воздушными массами [22, 29, 30].
На поверхности почвы формируются относительно благоприятные условия для деградации пластика: прямое ультрафиолетовое излучение, доступность кислорода и сравнительно высокие температуры. Хорошо известно, что почвенные микроорганизмы могут ускорять биодеградацию пластмасс [31–33], а сельскохозяйственная обработка почвы может способствовать разрушению крупных фрагментов до микропластика [9]. Тем не менее разрушение пластика в почве по существующим оценкам нельзя назвать быстрым. Полиэтилен за 800 дней экспонирования в почве теряет 0.1–0.4% массы, полипропилен за год пребывания в почве – 0.4% массы, признаков деградации полистирола, поливинилхлорида и карбамидоформальдегидной смолы не было обнаружено после 32 лет нахождения в почве [9, 34]. Следовательно, почва может аккумулировать пластик и быть источником вторичного загрязнения пресноводных и морских акваторий, подземных вод [35].
При оценке интенсивности загрязнения почв пластиком возникают технические проблемы, связанные с особенностями почвы как многофазной органоминеральной системы [36]. Количественное выделение частиц пластика из почвы — сложный, многоэтапный и не слишком эффективный процесс [37–39]. Большинство из применяемых методов учитывает только частицы определенного химического состава и размерного класса, точность учетов обычно невысока [23].
Поступление пластика в почву вызывает изменения в ее фундаментальных свойствах, которые определяют параметры среды для педобионтов [40, 41]. В лабораторных условиях присутствие в почве полиамидного и полиэтиленового микропластика в концентрации 0.25–2% по массе, а также полиакриловых и полиэфирных волокон в концентрациях 0.05–0.4% привело к уменьшению общей плотности почвы, что может повлечь изменение других физических свойств. Добавление волокон полиэстера увеличило влагоудерживающую способность, что может отразиться на итоговой влажности почвы и повлиять на испарение. Внесение полиакриловых и полиэфирных волокон вызвало снижение количества водостойких агрегатов [40]. Присутствие в почве полимерных волокон меняет структуру порового пространства. В полевом эксперименте длительностью один год при концентрации полиэфирных волокон в почве 0.3% по массе количество пор размером более 30 мкм возросло на 21.4%, пор менее 30 мкм — на 44.4%. В то же время в контроле количество пор размером более 30 мкм выросло только на 10.3%, а менее 30 мкм — на 52.2%. В лабораторном эксперименте при добавлении полиэфирных волокон также наблюдался рост числа пор более 30 мкм после двух циклов увлажнения и высушивания. Через 6 циклов увлажнения и высушивания в почве с добавлением волокон количество макроагрегатов размером более 2 мм увеличилось на 43.6% по сравнению с контролем, где оно составило 30.8%. Напротив, в контроле значительно возросло содержание микроагрегатов размерами 0.25–0.05 мм [41]. Внесение полиакриловых и полиэфирных волокон снизило микробную активность в почве по сравнению с контролем [40]. Описанные выше изменения свойств почвы могут приводить к изменениям в составе и численности почвенных животных, влиять на состояние отдельных особей и популяций педобионтов.
ВЛИЯНИЕ ПЛАСТИКА НА ПОЧВЕННЫХ ЖИВОТНЫХ
Попадая в почву, пластик вступает во взаимодействие с комплексом почвенной биоты, в том числе с почвенными животными. На первый взгляд, по своим основным механическим свойствам пластик, особенно микропластик, аналогичен другим компонентам почвенного матрикса. Пластик химически инертен, а по физическим свойствам сходен с некоторыми естественными биополимерами (воск, хитин). В силу этого трудно ожидать ярко выраженного негативного влияния пластика на почвенную биоту. Однако химическая инертность пластика не гарантирует его биологическую нейтральность, что было многократно показано в водных экосистемах. Так, скорость фильтрации воды мидией Mytilus trossulus существенно падает, если естественные частицы ила заменить на частицы микропластика сходного размера в той же концентрации [42].
Пока трудно оценить степень вреда, наносимого пластиком, присутствующим в почве, почвообитающим организмам. В экспериментах отмечено отрицательное воздействие, отсутствие влияния и даже стимуляция некоторых процессов и жизненных функций [27]. В большей степени исследованы ущерб здоровью отдельных особей или изменения в популяциях из-за физического присутствия частиц пластика в среде или пище почвенных животных. Меньше известно о влиянии на животных разнообразных добавок, входящих в состав пластиков, например пластификаторов [43] или огнезащитных присадок [44]. Многие добавки, в том числе фталаты, алкилфенолы, полибромированные дифениловые эфиры, опасны для биоты и способны вызывать нарушения синтеза и работы гормонов [45]. Кроме того, пластик может быть вектором переноса гидрофобных токсикантов [46, 47] и тяжелых металлов [48].
Для сапротрофных почвенных животных важно изменение микробиома почвы, а для всех обитателей почвы – изменение ее физических свойств из-за присутствия частиц и волокон пластика [40, 41].
Далее мы рассматриваем опубликованные данные о влиянии пластика разного химического состава и с разным размером частиц на основные таксономические группы почвенных животных.
Нано- и микропластик
Простейшие. Почвенные простейшие (амебы, инфузории и жгутиконосцы) могут поглощать частицы микропластика размером менее нескольких микрометров посредством фагоцитоза. На данный момент не известно, оказывает ли присутствие частиц микропластика в среде какое-либо влияние на простейших [28].
Нематоды склонны к поглощению и аккумуляции в пищеварительном тракте частиц пластика, что приводит к негативным последствиям [49, 50]. Однако все опубликованные исследования о влиянии микропластика на нематод выполнены с использованием единственного модельного вида Caenorhabditis elegans, поэтому универсальность обнаруженных закономерностей остается под вопросом.
Частицы полиамидного, полиэтиленового, поливинилхлоридного и полипропиленового микропластика размером около 70 мкм вызывали увеличение смертности C. elegans при выращивании на чашках Петри. Уровень смертности не зависел от типа пластика и концентрации частиц в среде (от 0.5 до 10.0 мг/м2). При концентрации 5.0 мг/м2 частицы микропластика вызывали сокращение средней длины тела на 5–11% и уменьшение количества эмбрионов на 14–25% [50]. Важное значение имеет размер частиц микропластика. Сферические частицы полистирола размером 0.1, 0.5, 1, 2 и 5 мкм в концентрации 1 мг/л оказывали негативное влияние на нематод, при этом частицы диаметром 1 мкм обладали наиболее выраженным эффектом, увеличивая смертность на 32.3% [51].
Присутствие нано- и микропластика в среде, влияя на моторные нейроны, изменяет характер двигательной активности нематод. В суспензиях частиц размером 0.1, 1 и 2 мкм наблюдалось изменение частоты изгибов тела и средней скорости перемещения нематод. Двигательная активность C. elegans регулируется несколькими подтипами нейронов: холинергическими, ГАМКергическими и дофаминергическими. Воздействие частиц пластика вызывало повреждения в холинергических и ГАМК-нейронах. Кроме того, присутствие частиц всех размеров приводило к развитию оксидативного стресса [51].
Зависящее от размера частиц негативное влияние пластика предположительно связано с неодинаковой возможностью частиц разного размера накапливаться в пищеварительном тракте, что приводит к разным по степени тяжести повреждениям тканей и недостатку питательных веществ [50, 52, 53]. Размерно-зависимый характер токсического воздействия микропластика был ранее описан для копепод Tigriopus japonicus [54] и коловраток Brachionus koreanus [55].
При выращивании C. elegans из личинки до взрослой особи (около 4.5 дней) в присутствии частиц полистирола размером 0.1 мкм в концентрации 10 мкг/л возникали токсические эффекты в виде появления активных форм кислорода в кишечнике, угнетения двигательной активности, уменьшения размера кладки. Увеличение концентрации частиц выше 100 мкг/л вызывало аналогичные токсические эффекты в следующем поколении нематод, выращенных на чистых средах. Вероятно, это происходит из-за перемещения частиц нанополистирола в репродуктивные органы и их переноса в следующее поколение: некоторое количество частиц нанополистирола было обнаружено в потомстве экспонированных нематод. Трансгенерационные проявления могли возникнуть и из-за “материнского эффекта” [56].
Коллемболы. Присутствие микропластика в субстрате модифицирует поведение коллембол, заставляет их искать менее загрязненные местообитания, увеличивает смертность и влияет на метаболизм животных.
В микрокосмах с чистой и загрязненной микропластиком почвой (использованы частицы полиэтилена размером менее 500 мкм в концентрации 0.5 и 1% по массе) коллемболы Folsomia candida концентрировались в чистом субстрате [57]. В почве, загрязненной микропластиком в концентрации 1%, смертность коллембол за 28 дней эксперимента выросла на 26% по сравнению с контролем, а при концентрации микропластика 0.1% снижалось количество ювенильных особей. Причиной может быть повышенная смертность яиц в загрязненной почве или изменения в поведении коллембол, вынужденных затрачивать время и энергию на поиск незагрязненных участков [57]. Скорость размножения и масса тела F. candida снижались также и при загрязнении почвы частицами поливинилхлорида размером 80–250 мкм в концентрации 0.1% [58]. С другой стороны, скопления частиц микропластика не игнорировались коллемболами в качестве места откладки яиц [59].
По-видимому, коллемболы не проглатывают частицы микропластика [58, 59], однако пластик влияет на состав микробиоты их кишечника [57, 58]. Кроме того, у коллембол в загрязненной пластиком почве возросло содержание 15N и 13С в тканях, что, вероятно, отражает смену пищевого рациона или эффективности ассимиляции пищи [58].
В другом эксперименте короткие (12–2870 мкм) и длинные (4000–24 000 мкм) полиэфирные волокна в почве в концентрациях 0.02, 0.06, 0.17, 0.5 и 1.5% по массе не оказали какого-либо эффекта на смертность и размножение коллембол F. candida [60].
В силу своей гидрофобной природы частицы микропластика концентрируются на границах раздела сред и в условиях высокой влажности почвы могут затруднять движение микроартропод [61]. Наносферы полистирола размером 0.5 мкм при концентрации 8 мг/кг затрудняли передвижение коллембол Lobella (Protolobella) sokamensis. Аналогичный эффект наблюдался при загрязнении почвы более крупными частицами полистирола. Предполагаемый механизм заключается в выходе частиц микропластика из межагрегатного пространства в более крупные полости, в результате чего агрегаты и микроагрегаты почвы сливаются в плотную массу, которую коллемболы не в состоянии преодолеть. Помимо этого, частицы микропластика прилипают к покровам коллембол [61].
Панцирные клещи. Согласно единственному известному нам исследованию [60], присутствие полиэфирных волокон в почве в концентрации 0.5% по массе не оказало влияния на смертность и размножение орибатид Oppia nitens.
Мокрицы. Присутствие микропластика в пище мокриц и почве, по-видимому, не оказывает какого-либо влияния на этих животных. Мокрицы Porcellio scaber получали с пищей два типа микропластика с размером частиц около 150 мкм (химический состав пластика не приведен в публикации) в концентрации 0.4%. Через две недели показатели состояния мокриц (активность потребления пищи, частота дефекации, эффективность усвоения пищи, изменения в массе тела, смертность и пр.) в тестируемой и контрольной группах значимо не различались [62]. Присутствие в почве полиэфирных волокон также не оказывало влияния на смертность, пищевую активность и биомассу P. scaber [60].
Энхитреиды. Сведения о влиянии пластика на энхитреид немногочисленны и противоречивы. Добавление в культуральную среду полистирола (размер частиц 0.05–0.1 мкм) в концентрации 0.5% вызвало увеличение продукции коконов энхитреид Enchytraeus crypticus, что может быть обусловлено компенсационным ускорением размножения в условиях повышения токсичности среды. При концентрации пластика 10% наблюдали снижение массы энхитреид и изменения в микробиоме кишечника, которые могли быть вызваны как разбавлением пищи и ухудшением ее качества, так и изменением обмена веществ и общего состояния энхитреид. Одним из механизмов, объясняющих снижение массы червей, может быть повышенная выработка слизи при питании на энергетически бедном (из-за разбавления пластиком) субстрате. Смертность энхитреид, подвергнутых воздействию пластика, не возрастала [63].
Присутствие длинных (4000–24 000 мкм) полиэфирных волокон в почве в концентрациях 0.17 и 0.5% по массе увеличивало смертность E. crypticus, при концентрациях 0.02, 0.17, 0.5 и 1.5% снижалась скорость размножения энхитреид. Отрицательное влияние волокон, по-видимому, связано с повреждением внешних покровов, поскольку черви не заглатывали длинные волокна. Напротив, короткие волокна (12–2870 мкм) попадали в кишечник энхитреид, но не влияли на животных [60].
Дождевые черви. Присутствие микропластика в почве в невысокой концентрации, вероятно, не отражается на физиологическом состоянии дождевых червей, хотя на данный момент исследовано немного видов. Наличие в почве менее 0.5% по массе частиц полистирола размером 58 мкм не влияло на состояние червей Eisenia fetida [64]. Состояние Lumbricus terrestris при загрязнении подстилки частицами полиэтилена размером менее 150 мкм в концентрации 7% не отличалось от состояния животных в контрольной группе [65]. При содержании L. terrestris в почве, загрязненной полиэфирными волокнами (средняя длина – 362 мкм, диаметр – 41 мкм) в концентрациях 0.1 и 1.0%, смертность дождевых червей не возрастала. Черви не избегали загрязненной волокнами почвы, однако были зафиксированы изменения в содержании некоторых биомаркеров стресса в тканях и снижение продукции копролитов. Следовательно, несмотря на отсутствие повышенной смертности, изменения жизнедеятельности червей под действием пластика могут иметь последствия для функционирования почвенной системы [66].
Действительно, присутствие в почве пластика может изменять поведение дождевых червей. При добавлении в подстилку 7% полиэтилена (размер частиц менее 150 мкм) увеличивалась роющая активность L. terrestris, хотя этот эффект не наблюдался при увеличении концентрации пластика до 28, 45 и 60% [67].
Полиэтиленовый микропластик (частицы 250–1000 мкм) в концентрациях 0, 62.5, 125, 250, 500 и 1000 мг/кг сухой почвы не оказывал влияния на размножение, выживание и рост червей Eisenia andrei. Тем не менее гистопатологические исследования выявили повреждения кишечника и иммунный ответ [68]. Сходные результаты были получены в эксперименте с близкородственным видом E. fetida [69]. У дождевых червей, подвергшихся воздействию трех самых высоких концентраций микропластика, обнаружены маркеры оксидативного стресса [69].
Повышение концентрации микропластика негативно сказывается на состоянии дождевых червей. При концентрациях частиц полистирола в почве 1 и 2% снижалась масса тела и увеличивалась смертность E. fetida. При концентрации микропластика 2% погибло 40% тестируемых особей [64]. При загрязнении подстилки полиэтиленом в концентрациях 28, 45 и 60% увеличивалась смертность и снижалась скорость роста L. terrestris по сравнению с контролем и концентрацией 7%. Вероятные механизмы связаны с присутствием в пищевом субстрате балластного микропластика, не имеющего энергетической ценности. Также возможны повреждения пищеварительного тракта червей [65].
Макропластик
Вопрос о влиянии на почвенное население крупных фрагментов синтетических полимеров фактически не изучен. В единственном известном нам исследовании [70] отмечено негативное влияние больших концентраций крупных частиц (0.84 — 4.76 мм) полиэтилена, полистирола, стекла и песка на акароценоз при колонизации навоза крупного рогатого скота. Клещи одинаково колонизировали как контрольный навоз, так и навоз с умеренным количеством добавок (5 и 30% по объему). При концентрации частиц 60 и 90% отмечено статистически значимое снижение обилия клещей. Видимо, подобное воздействие связано с изменением физических свойств субстрата. Обилие клещей зависело только от концентрации твердых частиц, но не от их типа [70].
ВЛИЯНИЕ ПОЧВЕННЫХ ЖИВОТНЫХ НА ПЛАСТИК
Попадая в почву, пластик может подвергнуться воздействию со стороны почвенных животных, для которых характерны роющая активность, приводящая к перемещению разнообразных объектов в пределах почвенного профиля, а также способность измельчать прочные природные биополимеры [17]. Влияние почвенных животных на попадающие в почву искусственные полимеры можно разделить на два основных типа: прямое воздействие – прежде всего перемещение частиц пластика и их измельчение и опосредованное, вызванное ассоциированными с животным микроорганизмами.
Микропластик
Наиболее выраженное прямое воздействие на пластик могут оказывать такие активные средообразователи, как дождевые черви и термиты, однако даже мелкие почвообитающие животные способны к перемещению частиц микропластика в почве. В лабораторном эксперименте коллемболы Folsomia candida и Proisotoma minuta перемещали частицы карбамидоформальдегидной смолы размером менее 400 мкм и волокна ПЭТ. Более крупный вид F. candida транспортировал частицы пластика дальше и быстрее, чем мелкий P. minuta [59]. Коллемболы, орибатиды и мезостигматические клещи в лабораторном эксперименте перемещали частицы поливинилхлорида размером 80–250 мкм. Совместное содержание хищников и сапрофагов приводило к более активному распространению частиц [71].
Крупные роющие животные активно перемещают и перемешивают почву с содержащимися в ней частицами пластика. В лабораторном эксперименте с четырьмя размерными классами сферических гранул полиэтилена (710–850, 1180–1400, 1700–2000 и 2360–2800 мкм) крупные норные черви L. terrestris способствовали переносу частиц с поверхности в глубину почвы. У нижней границы мезокосмов, в которых содержались черви (глубина 10 см), наблюдалась максимальная концентрация наименьших по размеру гранул. Другие размерные классы гранул найдены в основном в центральной части мезокосмов. Гранулы двух наименьших размерных классов присутствовали и в копролитах червей. Отмечено прилипание гранул к телу дождевого червя. Таким образом, черви способны переносить микропластик в глубь почвенного профиля как проглатывая его, так и транспортируя случайно прилипшие частицы на поверхности тела [72].
Избирательное поведение дождевых червей в отношении различных размерных классов частиц пластика отмечено и другими исследователями. В течение двух недель содержания L. terrestris в мезокосмах, в подстилку которых была внесена смесь частиц полиэтилена размером менее 150 мкм в разных концентрациях, черви преимущественно инкорпорировали в стенки нор частицы размером менее 50 мкм [65, 67]. Авторы объясняют это тем, что L. terrestris селективно потребляли частицы размером не более 50 мкм [65]. Видимо, существуют другие механизмы, объясняющие наблюдаемое явление, поскольку L. terrestris способны проглатывать гораздо более крупные твердые частицы [73]. Возможно, черви переносили частицы на покровах тела, ввиду чего преимущественно переносятся небольшие по размеру частицы. В последующей работе [74] было высказано предположение, что пластик активно измельчается в кишечнике червей.
Макропластик
Перемещение пластика. Дождевые черви L. terrestris затаскивают в норы макроскопические фрагменты пластиковой мульчи (полиэтилен и биоразлагаемый пластик) размером 1.5 × 1.5 см и 2 × 2 см [75]. Погребение пластика может замедлить его разложение, поскольку основной механизм деструкции небиоразлагаемых полимеров — фотодеградация под действием видимого и ультрафиолетового излучения [76, 77]. Погребение пластика в глубоких горизонтах почвы может приводить к поступлению частиц пластика в грунтовые воды [9].
Деструкция пластика. Конструкции и материалы, предназначенные для эксплуатации в тропиках, подвергаются проверке на биостойкость, в том числе “термитоустойчивость” [78]. Термиты способны прогрызать сравнительно толстый пластик насквозь или оставлять на нем выемки и царапины [79]. Наименее подвержены повреждениям со стороны термитов полиамиды, а различные сорта полиэтилена менее устойчивы [79, 80]. Разные виды термитов обладают различной способностью к повреждению пластиков: Coptotermes acinaciformis и Mastotermes darwiniensis оставляют в пластике сквозные дыры; C. kalshoveni делают глубокие выемки большой площади; C. curvignathus, C. gestroi и C. formosanus наносят неглубокие и ограниченные по площади царапины [81].
Опосредованное воздействие
В ряде исследований отмечена способность бактерий, ассоциированных с различными таксонами беспозвоночных, эффективно разлагать искусственные полимеры до простых соединений, что делает перспективным применение животных в целях биодеструкции пластика.
Личинки большого мучного хрущака Tenebrio molitor способны питаться пенопластом (пенополистиролом). В течение 16-дневного эксперимента 47.7% поглощенного личинками углерода пенопласта превращалось в CO2, остаток выделялся в виде экскрементов, а в биомассу T. molitor включилось около 0.5% углерода. Разложение и ассимиляцию пенополистирола производили населяющие кишечник личинок T. molitor бактерии Exiguobacterium sp. [82, 83]. Гусеницы большой восковой моли Galleria mellonella способны разлагать полиэтилен. Возможно, гусеницы имеют собственные ферментные системы для разложения полиэтилена, в котором наиболее часто встречающейся углеродной связью является CH2-CH2, как и в естественной пище этого вида — пчелином воске. Разложение полиэтилена может происходить и с помощью микрофлоры, населяющей кишечник гусениц [84]. Из кишечника гусениц южной амбарной огневки Plodia interpunctella выделены два штамма микроорганизмов – Enterobacter asburiae и Bacillus sp., способных расти на полиэтилене [85]. Несмотря на критику методов и неоднозначность полученных результатов [86], эти феномены показывают теоретическую возможность активного участия животных в деструкции синтетических полимеров.
В рамках данного обзора особый интерес представляет выделение способных к разложению пластика микроорганизмов, ассоциированных с почвенными животными. Такие микроорганизмы были выделены из кишечника дождевых червей L. terrestris. В состав бактериального комплекса входили грамположительные бактерии (Actinobacteria и Firmicutes). В лабораторном эксперименте эти бактерии способствовали фрагментации частиц полиэтилена, внесенных в почву. Из микрокосмов, в которых присутствовали данные бактерии и полиэтилен, выделялись октадекан, эйкозан и другие вероятные продукты деструкции пластика [74].
БИОРАЗЛАГАЕМЫЕ МАТЕРИАЛЫ
Согласно немногочисленным исследованиям, биоразлагаемые синтетические полимеры менее опасны для почвенных животных, чем обычные пластики. Мокрицы Porcellio scaber поедали биоразлагаемый пластик на основе крахмала и целлюлозы без значимых негативных последствий [87]. Пленка из биоразлагаемого материала Mater-Bi при концентрации 10 г на 800 г почвы не влияла на дождевого червя E. andrei [88]. Норные черви L. terrestris потребляли некоторые виды биоразлагаемой мульчи после 6–12 мес. ее пребывания в почве, хотя полиэтилен игнорировался червями как пищевой объект [75].
МИГРАЦИЯ ПЛАСТИКА ПО ПИЩЕВЫМ ЦЕПЯМ
На территориях с высокой плотностью населения, где загрязнение окружающей среды пластиком всех типов и форм стало почти неизбежным следствием хозяйственной деятельности, ожидается активная миграция синтетических полимеров по пищевым цепям. На примере сельского хозяйства в Мексике показано возрастание концентрации микропластика от почвы к домашней птице: в почве концентрация микропластика составляла 0.87 ± 1.9 частиц/г, в выбросах дождевых червей – 14.8 ± 28.8 частиц/г, в экскрементах домашних кур – 129.8 ± 82.3 частиц/г. Аналогичные процессы переноса пластика по пищевых цепям наблюдаются в морских экосистемах [89].
ПЕРСПЕКТИВЫ ДАЛЬНЕЙШИХ ИССЛЕДОВАНИЙ
Проблема загрязнения пластиком морских экосистем активно изучается со второй половины XX в. В отличие от почв в водной среде пластик — чужеродный материал с почти не имеющими аналогов свойствами. Являясь инертным твердым веществом с плотностью, близкой к плотности воды, он не тонет и не растворяется. Кроме того, многие виды пластика отличаются большой механической прочностью. В отношении водной среды пластик можно назвать физическим ксенобиотиком. Загрязнение пластиком морей и океанов вызывает широкий спектр негативных последствий на разных уровнях организации живой материи (табл. 2): морские млекопитающие, птицы, рептилии, рыбы и ракообразные запутываются в макрообъектах пластика, получая травмы и теряя подвижность; проглатывание макропластика приводит к травмам и закупорке пищеварительного тракта и другим нарушениям. Адсорбированные пластиком токсины могут являться дополнительным поражающим фактором [90, 91].
Таблица 2.
Основные последствия загрязнения пластиком в морских экосистемах на разных иерархических уровнях организации живой материи (по литературным данным) и оценка актуальности аналогичных явлений для почвенных животных
| Тип воздействия или ущерба морским обитателям и экосистемам | Актуальность для почв и педобионтов |
|---|---|
| Социально-экономический уровень | |
| Угроза промышленности и деловой активности [3, 45, 95] | + |
| Утрата эстетической ценности среды [45, 96] | + |
| Экосистемный уровень | |
| Утрата биоразнообразия в результате травм и гибели морских животных из-за прямого контакта с крупными пластиковыми объектами [3, 97] | + |
| Создание в толще воды новой среды обитания, пригодной для жизни или размножения несвойственных пелагиали организмов [45] | – |
| Создание плавучих субстратов для мигрирующих организмов, что влечет распространение видов за пределы естественного ареала [98, 99] | – |
| Миграция по пищевой цепи микропластика и сопутствующих ему стойких органических загрязнителей [99] | + |
| Изменение микробиологического профиля среды, формирование специфических сообществ микроорганизмов, связанных с пластиком [100, 101] | + |
| Снижение темпов поступления органического вещества к бентосным организмам из-за уменьшения плотности фекальных частиц зоопланктона, потребляющего пластик [4] | – |
| Снижение интенсивности фотосинтеза водорослями вследствие блокирования потока света и адсорбции частиц микропластика [99, 102] | + |
| Популяционный уровень | |
| Замедление роста популяции из-за дефицита энергии, вызванного присутствием в пище “балластного” пластика или физического препятствования оплодотворению [103] | + |
| Увеличение смертности из-за дефицита энергии, вызванного присутствием в пище “балластного” пластика [4] | + |
| Нарушения репродуктивного цикла, вызванные переносом на частицах микропластика гормоноподобных соединений [45] | + |
| Организменный уровень | |
| Дефицит энергии и питательных веществ из-за присутствия в пище “балластного” пластика. Связанные с дефицитом энергии и нутриентов нарушения в росте и развитии [4] | + |
| Нарушение поведения и двигательной активности, наружные повреждения в результате контакта с объектами макропластика [96, 100] | + |
| Увеличение времени прохождения пищи по пищеварительному тракту и вызванные этим уменьшение подвижности и снижение пищедобывающей активности [4] | + |
| Разнообразные негативные воздействия, вызванные стойкими органическими загрязнителями, адсорбированными на частицах пластика [103] | + |
| Ущерб здоровью из-за закупорки пищеварительного тракта, развития воспалительных процессов, повреждения органов [104] | + |
| Суборганизменный уровень | |
| Закупорка и травмирование пищеварительного тракта, повреждения других органов [103] | + |
| Развитие воспалительных процессов и иммунных ответов, нарушение клеточного метаболизма [105, 106] | + |
| Аддитивный ущерб в результате совместного воздействия микропластика и иных токсикантов [107] | + |
Примечание. Уровни организации выделены в соответствии с [4] (с дополнениями). Актуальные последствия отмечены знаком “+”, неактуальные — знаком “–”.
Модификация пластиковым мусором условий среды может повлечь за собой существенные изменения в водных экосистемах. Например, пластик вызывает миграцию в пелагиаль бентосных организмов, личинки которых получают субстрат для прикрепления прямо в толще воды [45]. Макрообъекты пластика колонизируются разнообразными эпибионтами — мшанками, усоногими рачками, трубчатыми червями, фораминиферами, водорослями, коралловыми полипами и двустворчатыми моллюсками, в результате чего появляются не свойственные пелагиали сообщества [92, 93]. На частицах микропластика формируются биопленки микроорганизмов, некоторые из которых (например, бактерии рода Vibrio) могут вызывать инфекционные заболевания у морских животных [4]. Сообщества микроорганизмов, формирующиеся на поверхности частиц микропластика, существенно отличаются от таковых в окружающей воде. Для них предложено собственное название – “пластисфера” [94].
Поскольку почва является многофазной средой разнообразного химического состава, загрязнение химически инертным пластиком не должно иметь столь выраженных негативных последствий, как в случае водных экосистем. Это особенно относится к явлениям экосистемного уровня. По физическим свойствам частицы пластика не слишком отличаются от других присутствующих в почве компонентов и не формируют специфический и чужеродный субстрат. Вероятно, с этим связан невысокий интерес к исследованию влияния пластикового загрязнения на экосистемные процессы в почве, хотя в морской экологии этот вопрос уже хорошо разработан (см. табл. 2). Однако и для почв отмечено изменение физических свойств (общей плотности, влагоудерживающей способности, текстуры) в результате загрязнения микропластиком. Изменения физических свойств почвы приводят к изменениям микробной активности и последующим модификациям функциональных показателей [40].
На популяционном, организменном и более низких уровнях организации негативные эффекты, вызванные присутствием пластика в воде, в большинстве случаев актуальны и для педобионтов (см. табл. 2). Во многих случаях они уже описаны для почвенных животных. Сюда относятся появление активных форм кислорода в клетках, повреждения тканей и органов, дефицит энергии и вызываемое им угнетение жизнедеятельности, изменения в поведении и двигательной активности, влияние на размножение и плодовитость, изменение физиологического состояния животных и повышение смертности в популяциях (см. выше).
Проблема загрязнения искусственными полимерами имеет планетарный масштаб, и ее серьезность вполне осознана учеными. Несмотря на это, отсутствуют общепринятые протоколы и требования к проведению исследований по влиянию пластика на живые организмы, в частности на почвенных животных. Это относится к выбору показателей состояния животных, концентраций исследуемых веществ, самих веществ и т.п., что затрудняет сопоставление результатов разных экспериментов. В большинстве экспериментов игнорируется опыт токсикологии, имеющей хорошо разработанный методологический аппарат [108].
Почти все исследования о влиянии пластика на почвенных животных проведены в лаборатории, степень выраженности и важности отмеченных явлений в природных условиях не известна [8, 41]. Более того, во многих экспериментах использован пластик, имеющий весьма малое отношение к реальным загрязнителям. Не исследовано поведение микропластика в различных типах почв и характер проявления его токсичности в зависимости от окружающих условий, поэтому невозможно предсказать, какие сукцессии может запускать поступление макро- и микропластика в почву, к каким сдвигам в сообществе почвенных животных и в целом в экосистеме может приводить его присутствие. Прямые же исследования экосистемного уровня пока отсутствуют. Даже в случае относительно простых лабораторных экспериментов непосредственные механизмы влияния пластика на животных, их клетки, ткани и органы плохо понятны и обычно остаются на уровне предположений.
Влияние пластика на почвенных животных изучено в основном на примере микропластика. Верно и обратное: влияние почвенных животных на пластик также изучалось в большей степени в отношении микропластика. Пока нет надежно обоснованного экспериментальными данными представления о том, какова роль почвенных животных в разложении пластика. Единственной группой организмов, для которой на данный момент показана способность механически разрушать макропластик, являются термиты [79–81]. В почве присутствуют многие другие первичные деструкторы опада, например диплоподы или панцирные клещи, но их влияние на деструкцию пластика пока не исследовалось. Судьба образующихся при разрушении макропластика частиц микропластика и возможность их окончательной минерализации не установлены. Согласно немногочисленным исследованиям [109], погребение в толще почвы частиц пластика, вероятно, приведет к замедлению его деструкции из-за прекращения фото- и замедления термодеградации.
Влияние пластика на педобионтов изучено на крайне ограниченном числе видов. В случае коллембол и дождевых червей влияние пластика изучали на двух-трех видах животных, для нематод, мокриц, энхитреид и орибатид — только на одном виде. Взаимодействие с пластиком многих других ключевых групп почвенной фауны (например, диплопод, личинок насекомых) не исследовалось. Несмотря на то, что термиты являются одними из немногих животных, способных на механическое разрушение пластика, не ясно, оказывает ли потребляемый пластик негативное влияние на самих термитов.
Этот краткий критический анализ позволяет наметить основные задачи и перспективы исследования судьбы пластика, попадающего в почву, и последствий его взаимодействия с почвообитающими животными:
1. Унификация подходов и методологии исследований, модификация стандартных протоколов, применяемых в почвенной токсикологии.
2. Сближение экспериментальных подходов с реальной ситуацией. Использование пластика, близкого по своему химическому составу и физическим характеристикам к наиболее распространенным загрязнителям. Использование основанных на реальной ситуации концентраций и форм пластика.
3. Исследование взаимодействий почвенной биоты и крупных фрагментов пластика (макропластика).
4. Расширение набора изучаемых групп почвенных животных. Вовлечение в исследования первичных разрушителей растительных остатков и активных средообразователей: панцирных клещей, многоножек, личинок насекомых, а также различных экологических групп дождевых червей.
5. Проведение полевых исследований в разных климатических зонах и типах экосистем, имеющих разный набор таксонов и функциональных групп почвенных животных.
6. Оценка влияния макро- и микропластика на взаимосвязанные группы организмов, целые сообщества и экосистемы, а не только на отдельные особи и популяции. Исследование сукцессионных процессов в сообществах, подверженных загрязнению пластиком.
ЗАКЛЮЧЕНИЕ
Присутствие в почве частиц пластика представляет потенциальную угрозу для большинства групп почвенных животных. Негативное воздействие микропластика обнаружено в отношении нематод, коллембол, энхитреид, дождевых червей. Механизмы отрицательного влияния пластика на животных не всегда понятны, но часто связаны с нарушением работы и повреждением пищеварительной системы. В целом представления о влиянии пластикового загрязнения на почвенную биоту пока фрагментарны. Исследовано слишком мало таксономических и функциональных групп почвенных животных; большинство экспериментов проведено в искусственных условиях, мало отражающих естественную ситуацию (это относится и к выбору модельных видов пластика). Сопоставление с более обширными данными, полученными для морских экосистем, указывает на наличие многих типов воздействия пластика на живые системы, которые пока не были исследованы в почве.
С другой стороны, животное население почвы – важный компонент ее системы самоочистки. Животные не только модифицируют деятельность разрушающих пластик микроорганизмов, но и прямо участвуют в его механическом разрушении. Несмотря на потенциальную важность подобных взаимодействий, роль животных-средообразователей и первичных деструкторов растительных остатков в разрушении пластика в почве остается практически не исследованной.
Анализ опубликованных данных выявил ряд вопросов, решение которых должно сформировать более полную систему представлений о влиянии загрязнения почвы синтетическими полимерами на сообщества педобионтов и выполняемые ими экосистемные функции. Актуальность исследования пластикового загрязнения в наземных экосистемах не вызывает сомнений; число публикаций о взаимодействии почвенных животных с пластиком пока невелико, но быстро растет. Мы надеемся, что данный обзор будет полезен при планировании дальнейших исследований.
Работа выполнена при финансовой поддержке РФФИ (проект № 18-29-05076 мк).
Список литературы
Malizia A., Monmany-Garzia A.C. Terrestrial ecologists should stop ignoring plastic pollution in the Anthropocene time // Sci. Total Environ. 2019. V. 668. P. 1025–1029. https://doi.org/10.1016/j.scitotenv.2019.03.044
Zalasiewicz J., Waters C.N., do Sul J.A.I. et al. The geological cycle of plastics and their use as a stratigraphic indicator of the Anthropocene // Anthropocene. 2016. V. 13. P. 4–17. https://doi.org/10.1016/j.ancene.2016.01.002
Bonanno G., Orlando-Bonaca M. Ten inconvenient questions about plastics in the sea // Environ. Sci. Policy. 2018. V. 85. P. 146–154. https://doi.org/10.1016/j.envsci.2018.04.005
Galloway T.S., Cole M., Lewis C. Interactions of microplastic debris throughout the marine ecosystem // Nat. Ecol. Evol. 2017. V. 1. P. 0116. https://doi.org/10.1038/s41559-017-0116
Bergmann M., Gutow L., Klages M. Marine anthropogenic litter. Cham, Heidelberg, New York, Dordrecht, London: Springer, 2015. 447 p.
Chae Y., An Y.-J. Effects of micro- and nanoplastics on aquatic ecosystems: Current research trends and perspectives // Mar. Pollut. Bull. 2017. V. 124. № 2. P. 624–632. https://doi.org/10.1016/j.marpolbul.2017.01.070
de Sá L.C., Oliveira M., Ribeiro F. et al. Studies of the effects of microplastics on aquatic organisms: What do we know and where should we focus our efforts in the future? // Sci. Total Environ. 2018. V. 645. P. 1029–1039. https://doi.org/10.1016/j.scitotenv.2018.07.207
de Souza Machado A.A., Kloas W., Zarfl C. et al. Microplastics as an emerging threat to terrestrial ecosystems // Glob. Change Biol. 2018. V. 24. № 4. P. 1405–1416. https://doi.org/10.1111/gcb.14020
He D., Luo Y., Lu S. et al. Microplastics in soils: Analytical methods, pollution characteristics and ecological risks // Trends Anal. Chem. 2018. V. 109. P. 163–172. https://doi.org/10.1016/j.trac.2018.10.006
Horton A.A., Walton A., Spurgeon D.J. et al. Microplastics in freshwater and terrestrial environments: evaluating the current understanding to identify the knowledge gaps and future research priorities // Sci. Total Environ. 2017. V. 586. P. 127–141. https://doi.org/10.1016/j.scitotenv.2017.01.190
Peng J., Wang J., Cai L. Current understanding of microplastics in the environment: occurrence, fate, risks, and what we should do // Integrated Environ. Assess. Manag. 2017. V.13. № 3. P. 476–482. https://doi.org/10.1002/ieam.1912
Kemmitt S.J., Lanyon C.V., Waite I.S. et al. Mineralization of native soil organic matter is not regulated by the size, activity or composition of the soil microbial biomass – a new perspective // Soil Biol. Biochem. 2008. V. 40. № 1. P. 61–73. https://doi.org/10.1016/j.soilbio.2007.06.021
Swift M.J., Heal O.W., Anderson J.M. Decomposition in terrestrial ecosystems. Oxford: Blackwell Scientific Publications, 1979. V. 5. 372 p.
Filser J., Faber J.H., Tiunov A.V. et al. Soil fauna: key to new carbon models // Soil. 2016. V. 2. № 4. P. 565–582. https://doi.org/10.5194/soil-2-565-2016
Бызов Б.А. Зоомикробные взаимодействия в почве. М.: ГЕОС, 2005. 213 с.
Стриганова Б.Р. Локомоторная и трофическая активность беспозвоночных как фактор формирования почвенной структуры // Почвоведение. 2000. № 10. С. 1247–1254.
Стриганова Б.Р. Питание почвенных сапрофагов. М.: Наука, 1980. 244 с.
Ryberg M.W., Laurent A., Hauschild M. UN Environment. Mapping of global plastics value chain and plastics losses to the environment: with a particular focus on marine environment. United Nations Environment Programme. Nairobi, Kenya, 2018. 99 p.
Yvonne S. Conservation of Plastics: materials science, degradation and preservation. Slovenia: Butterworth-Heinemann, 2008. 286 p.
Crawford C.B., Quinn B. 5-Microplastics, standardisation and spatial distribution // Microplastic Pollutants / Ed. Crawford C.B., Quinn B. Elsevier, 2017. P. 101–130.
Arthur C., Baker J., Bamford H. Proceedings of the international research workshop on the occurrence, effects, and fate of microplastic marine debris, September 9–11, 2008. NOAA Technical Memorandum NOS-OR&R-30, 2009.
Dris R., Gasperi J., Rocher V. et al. Microplastic contamination in an urban area: a case study in Greater Paris // Environ. Chem. 2015. V. 12. № 5. P. 592–599. https://doi.org/10.1071/en14167
Bläsing M., Amelung W. Plastics in soil: Analytical methods and possible sources // Sci. Total Environ. 2018. V. 612. P. 422–435. https://doi.org/10.1016/j.scitotenv.2017.08.086
Barnes D.K., Galgani F., Thompson R.C., Barlaz M. Accumulation and fragmentation of plastic debris in global environments // Philos. Trans. R. Soc. B Biol. Sci. 2009. V. 364. P. 1985–1998. https://doi.org/10.1098/rstb.2008.0205
Andrady A.L. Plastics and Environmental Sustainability: Fact and Fiction. Wiley, 2015. 352 p.
Eerkes-Medrano D., Thompson R.C., Aldridge D.C. Microplastics in freshwater systems: a review of the emerging threats, identification of knowledge gaps and prioritisation of research needs // Water res. 2015. V. 75. P. 63–82. https://doi.org/10.1016/j.watres.2015.02.012
Chae Y., An Y.-J. Current research trends on plastic pollution and ecological impacts on the soil ecosystem: A review // Environ. Pollut. 2018. V. 240. P. 387–395. https://doi.org/10.1016/j.envpol.2018.05.008
Rillig M.C., Bonkowski M. Microplastic and soil protists: A call for research // Environ. Pollut. 2018. V. 241. P. 1128–1131. https://doi.org/10.1016/j.envpol.2018.04.147
Dris R., Gasperi J., Mirande C. et al. A first overview of textile fibers, including microplastics, in indoor and outdoor environments // Environ. Pollut. 2017. V. 221. P. 453–458. https://doi.org/10.1016/j.envpol.2016.12.013
Rezaei M., Riksen M.J., Sirjani E. et al. Wind erosion as a driver for transport of light density microplastics // Sci. Total Environ. 2019. V. 669. P. 273–281. https://doi.org/10.1016/j.scitotenv.2019.02.382
Ali M.I., Ahmed S., Robson G. et al. Isolation and molecular characterization of polyvinyl chloride (PVC) plastic degrading fungal isolates // J. Basic Microbiol. 2014. V. 54. № 1. P. 18–27. https://doi.org/10.1002/jobm.201200496
Cosgrove L., McGeechan P.L., Robson G.D., Handley P.S. Fungal communities associated with degradation of polyester polyurethane in soil // Appl. Environ. Microbiol. 2007. V. 73. № 18. P. 5817–5824. https://doi.org/10.1128/aem.01083-07
Crabbe J.R., Campbell J.R., Thompson L. et al. Biodegradation of a colloidal ester-based polyurethane by soil fungi // Int. Biodeter. Biodegr. 1994. V. 33. № 2. P. 103–113. https://doi.org/10.1016/0964-8305(94)90030-2
Otake Y., Kobayashi T., Asabe H. et al. Biodegradation of low-density polyethylene, polystyrene, polyvinyl chloride, and urea formaldehyde resin buried under soil for over 32 years // J. Appl. Polym. Sci. 1995. V. 56. № 13. P. 1789–1796. https://doi.org/10.1002/app.1995.070561309
Hurley R.R., Nizzetto L. Fate and occurrence of micro(nano)plastics in soils: Knowledge gaps and possible risks // Curr. Opin. Environ. Sci. Health. 2018. V. 1. P. 6–11. https://doi.org/10.1016/j.coesh.2017.10.006
Rillig M.C. Microplastic in terrestrial ecosystems and the soil? // Environ. Sci. Technol. 2012. V. 46. P. 6453−6454. https://doi.org/10.1021/es302011r
Corradini F., Bartholomeus H., Huerta-Lwanga E. et al. Predicting soil microplastic concentration using vis-NIR spectroscopy // Sci. Total Environ. 2019. V. 650. P. 922–932. https://doi.org/10.1016/j.scitotenv.2018.09.101
Qiu Q., Tan Z., Wang J. et al. Extraction, enumeration and identification methods for monitoring microplastics in the environment // Estuar. Coast. Shelf Sci. 2016. V. 176. P. 102–109. https://doi.org/10.1016/j.ecss.2016.04.012
Zhang S., Yang X., Gertsen H. et al. A simple method for the extraction and identification of light density microplastics from soil // Sci. Total Environ. 2018. V. 616–617. P. 1056–1065. https://doi.org/10.1016/j.scitotenv.2017.10.213
de Souza Machado A.A., Lau C.W., Till J. et al. Impacts of microplastics on the soil biophysical environment // Environ. Sci. Technol. 2018. V. 52. № 17. P. 9656–9665. https://doi.org/10.1021/acs.est.8b02212
Zhang G.S., Zhang F.X., Li X.T. Effects of polyester microfibers on soil physical properties: Perception from a field and a pot experiment // Sci. Total Environ. 2019. V. 670. P. 1–7. https://doi.org/10.1016/j.scitotenv.2019.03.149
Harris L.S.T., Carrington E. Impacts of microplastic vs. natural abiotic particles on the clearance rate of a marine mussel // Limnol. Oceanogr. Lett. 2020. V. 5. № 1. P. 66–73. https://doi.org/10.1002/lol2.10120
Babić S., Barišić J., Bielen A. et al. Multilevel ecotoxicity assessment of environmentally relevant bisphenol A concentrations using the soil invertebrate Eisenia fetida // J. Hazard. Mater. 2016. V. 318. P. 477–486. https://doi.org/10.1016/j.jhazmat.2016.07.017
Gaylor M.O., Harvey E., Hale R.C. Polybrominated diphenyl ether (PBDE) accumulation by earthworms (Eisenia fetida) exposed to biosolids-, polyurethane foam microparticle-, and penta-BDE-amended soils // Environ. Sci. Technol. 2013. V. 47. № 23. P. 13 831–13 839. https://doi.org/10.1021/es403750a
Avio C.G., Gorbi S., Regoli F. Plastics and microplastics in the oceans: From emerging pollutants to emerged threat // Mar. Environ. Res. 2017. V. 128. P. 2–11. https://doi.org/10.1016/j.marenvres.2016.05.012
Engler R.E. The complex interaction between marine debris and toxic chemicals in the ocean // Environ. Sci. Technol. 2012. V. 46. №. 22. P. 12 302–12 315. https://doi.org/10.1021/es3027105
Teuten E.L., Rowland S.J., Galloway T.S., Thompson R.C. Potential for plastics to transport hydrophobic contaminants // Environ. Sci. Technol. 2007. V. 41. № 22. P. 7759–7764. https://doi.org/10.1021/es071737s
Hodson M.E., Duffus-Hodson C.A., Clark A. et al. Plastic bag derived-microplastics as a vector for metal exposure in terrestrial invertebrates // Environ. Sci. Technol. 2017. V. 51. № 8. P. 4714–4721. https://doi.org/10.1021/acs.est.7b00635
Kiyama Y., Miyahara K., Ohshima Y. Active uptake of artificial particles in the nematode Caenorhabditis elegans // J. Exp. Biol. 2012. V. 215. № 7. P. 1178–1183. https://doi.org/10.1242/jeb.067199
Lei L., Wu S., Lu S. et al. Microplastic particles cause intestinal damage and other adverse effects in zebrafish Danio rerio and nematode Caenorhabditis elegans // Sci. Total Environ. 2018. V. 619. P. 1–8. https://doi.org/10.1016/j.scitotenv.2017.11.103
Lei L., Liu M., Song Y. et al. Polystyrene (nano) microplastics cause size-dependent neurotoxicity, oxidative damage and other adverse effects in Caenorhabditis elegans // Environ. Sci. Nano. 2018. V. 5. № 8. P. 2009–2020. https://doi.org/10.1039/c8en00412a
Füser H. Species-specific and particle-size-dependent ingestion of microplastics of laboratory cultures and artificially assembled and natural nematode communities // Building Bridges – Micro-, Meso- and Macrofauna Processes across Systems. Göttingen, 2019. P. 28.
Müller M.-T. Responses of nematodes to microplastic exposure – direct or indirect effects? // Building Bridges – Micro-, Meso- and Macrofauna Processes across Systems. Göttingen, 2019. P. 27.
Lee K.W., Shim W.J., Kwon O.Y., Kang J.H. Size-dependent effects of micro polystyrene particles in the marine copepod Tigriopus japonicus // Environ. Sci. Technol. 2013. V. 47. № 19. P. 11 278–11 283. https://doi.org/10.1021/es401932b
Jeong C.B., Won E.J., Kang H.M. et al. Microplastic size-dependent toxicity, oxidative stress induction, and p-JNK and p-p38 activation in the monogonont rotifer (Brachionus koreanus) // Environ. Sci. Technol. 2016. V. 50. № 16. P. 8849–8857. https://doi.org/10.1021/acs.est.6b01441
Zhao L., Qu M., Wong G., Wang D. Transgenerational toxicity of nanopolystyrene particles in the range of μg L−1 in the nematode Caenorhabditis elegans // Environ. Sci. Nano. 2017. V. 4. № 12. P. 2356–2366. https://doi.org/10.1039/c7en00707h
Ju H., Zhu D., Qiao M. Effects of polyethylene microplastics on the gut microbial community, reproduction and avoidance behaviors of the soil springtail, Folsomia candida // Environ. Pollut. 2019. V. 247. P. 890–897. https://doi.org/10.1016/j.envpol.2019.01.097
Zhu D., Chen Q.L., An X.L. et al. Exposure of soil collembolans to microplastics perturbs their gut microbiota and alters their isotopic composition // Soil Biol. Biochem. 2018. V. 116. P. 302–310. https://doi.org/10.1016/j.soilbio.2017.10.027
Maass S., Daphi D., Lehmann A., Rillig M.C. Transport of microplastics by two collembolan species // Environ. Pollut. 2017. V. 225. P. 456–459. https://doi.org/10.1016/j.envpol.2017.03.009
Selonen S., Dolar A., Kokalj A.J. et al. Exploring the impacts of plastics in soil–The effects of polyester textile fibers on soil invertebrates // Sci. Total Environ. 2020. V. 700. 134451. https://doi.org/10.1016/j.scitotenv.2019.134451
Kim S.W., An Y.-J. Soil microplastics inhibit the movement of springtail species // Environ. Int. 2019. V. 126. P. 699–706. https://doi.org/10.1016/j.envint.2019.02.067
Kokalj A.J., Horvat P., Skalar T., Kržan A. Plastic bag and facial cleanser derived microplastic do not affect feeding behaviour and energy reserves of terrestrial isopods // Sci. Total Environ. 2018. V. 615. P. 761–766.https://doi.org/10.1016/j.scitotenv.2017.10.020
Zhu B.-K., Fang Y.-M., Zhu D. et al. Exposure to nanoplastics disturbs the gut microbiome in the soil oligochaete Enchytraeus crypticus // Environ. Pollut. 2018. V. 239. P. 408–415. https://doi.org/10.1016/j.envpol.2018.04.017
Cao D., Wang X., Luo X. et al. Effects of polystyrene microplastics on the fitness of earthworms in an agricultural soil // IOP Conference Series: Earth and Environmental Science. IOP Publishing, 2017. V. 61. P. 012 148. https://doi.org/10.1088/1755-1315/61/1/012148
Huerta Lwanga E., Gertsen H., Gooren H. et al. Microplastics in the Terrestrial Ecosystem: Implications for Lumbricus terrestris (Oligochaeta, Lumbricidae) // Environ. Sci. Technol. 2016. V. 50. № 5. P. 2685–2691. https://doi.org/10.1021/acs.est.5b05478
Prendergast-Miller M.T., Katsiamides A., Abbass M. et al. Polyester-derived microfibre impacts on the soil-dwelling earthworm Lumbricus terrestris // Environ. Pollut. 2019. V. 251. P. 453–459. https://doi.org/10.1016/j.envpol.2019.05.037
Huerta-Lwanga E., Gertsen H., Gooren H. et al. Incorporation of microplastics from litter into burrows of Lumbricus terrestris // Environ. Pollut. 2017. V. 220. P. 523–531. https://doi.org/10.1016/j.envpol.2016.09.096
Rodriguez-Seijo A., Lourenço J., Rocha-Santos T.A.P. et al. Histopathological and molecular effects of microplastics in Eisenia andrei Bouché // Environ. Pollut. 2017. V. 220. № Pt A. P. 495–503. https://doi.org/10.1016/j.envpol.2016.09.092
Rodríguez-Seijo A., da Costa J.P., Rocha-Santos T. et al. Oxidative stress, energy metabolism and molecular responses of earthworms (Eisenia fetida) exposed to low-density polyethylene microplastics // Environ. Sci. Pollut. Res. 2018. V. 25. № 33, SI. P. 33 599–33 610. https://doi.org/10.1007/s11356-018-3317-z
Stamatiadis S., Dindal D.L. Coprophilous mite communities as affected by concentration of plastic and glass particles // Exp. Appl. Acarol. 1990. V. 8. P. 1–12. https://doi.org/10.1007/BF01193377
Zhu D., Bi Q.-F., Xiang Q. et al. Trophic predator-prey relationships promote transport of microplastics compared with the single Hypoaspis aculeifer and Folsomia candida // Environ. Pollut. 2018. V. 235. P. 150–154. https://doi.org/10.1016/j.envpol.2017.12.058
Rillig M.C., Ziersch L., Hempel S. Microplastic transport in soil by earthworms // Sci. Rep. 2017. V. 7. № 1. P. 1362. https://doi.org/10.1038/s41598-017-01594-7
Schulmann O.P., Tiunov A.V. Leaf litter fragmentation by the earthworm Lumbricus terrestris L. // Pedobiologia. 1999. V. 43. № 5. P. 453–458.
Huerta-Lwanga E., Thapa B., Yang X. et al. Decay of low-density polyethylene by bacteria extracted from earthworm’s guts: A potential for soil restoration // Sci. Total Environ. 2018. V. 624. P. 753–757. https://doi.org/10.1016/j.scitotenv.2017.12.144
Zhang L. Sintim H.Y., Bary A.I. et al. Interaction of Lumbricus terrestris with macroscopic polyethylene and biodegradable plastic mulch // Sci. Total Environ. 2018. V. 635. P. 1600–1608. https://doi.org/10.1016/j.scitotenv.2018.04.054
Albertsson A.-C., Andersson S.O., Karlsson S. The mechanism of biodegradation of polyethylene // Polym. Degrad. Stab. 1987. V. 18. № 1. P. 73–87. https://doi.org/10.1016/0141-3910(87)90084-X
Gewert B., Plassmann M.M., MacLeod M. Pathways for degradation of plastic polymers floating in the marine environment // Environ. Sci. V. 17. № 9. P. 1513–1521. https://doi.org/10.1039/C5EM00207A
Govorushko S. Economic and ecological importance of termites: A global review // Entomol. Sci. 2019. V. 22. № 1. P. 21–35. https://doi.org/10.1111/ens.12328
Tsunoda K., Rosenblat G., Dohi K. Laboratory evaluation of the resistance of plastics to the subterranean termite Coptotermes formosanus (Blattodea: Rhinotermitidae) // Int. Biodeterior. Biodegradation. 2010. V. 64. № 3. P. 232–237. https://doi.org/10.1016/j.ibiod.2009.12.008
Lenz M., Creffield J.W., Evans T.A. et al. Resistance of polyamide and polyethylene cable sheathings to termites in Australia, Thailand, USA, Malaysia and Japan: a comparison of four field assessment methods // Int. Biodeterior. Biodegradation. 2012. V. 66. № 1. P. 53–62. https://doi.org/10.1016/j.ibiod.2011.11.001
Lenz M., Kard B., Creffield J.W. et al. Ability of field populations of Coptotermes spp., Reticulitermes flavipes, and Mastotermes darwiniensis (Isoptera: Rhinotermitidae; Mastotermitidae) to damage plastic cable sheathings // J. Econom. Entomol. 2013. V. 106. № 3. P. 1395–1403. https://doi.org/10.1603/EC12514
Yang Y., Yang J., Wu W.-M. et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. Chemical and physical characterization and isotopic tests // Environ. Sci. Technol. 2015. V. 49. № 20. P. 12 080–12 086. https://doi.org/10.1021/acs.est.5b02661
Yang Y., Yang J., Wu W.-M. et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 2. Role of gut microorganisms // Environ. Sci. Technol. 2015. V. 49. № 20. P. 12 087–12 093. https://doi.org/10.1021/acs.est.5b02663
Bombelli P., Howe C.J., Bertocchini F. Polyethylene bio-degradation by caterpillars of the wax moth Galleria mellonella // Curr. Biol. 2017. V. 27. № 8. P. R292–R293. https://doi.org/10.1016/j.cub.2017.02.060
Yang J., Yang Y., Wu W.-M. et al. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms // Environ. Sci. Technol. 2014. V. 48. № 23. P. 13776–13784. https://doi.org/10.1021/es504038a
Weber C., Pusch S., Opatz T. Polyethylene bio-degradation by caterpillars? // Curr. Biol. 2017. V. 27. № 15. P. R744–R745. https://doi.org/10.1016/j.cub.2017.07.004
Wood C.T., Zimmer M. Can terrestrial isopods (Isopoda: Oniscidea) make use of biodegradable plastics? // Appl. Soil Ecol. 2014. V. 77. P. 72–79. https://doi.org/10.1016/j.apsoil.2014.01.009
Sforzini S., Oliveri L., Chinaglia S., Viarengo A. Application of biotests for the determination of soil ecotoxicity after exposure to biodegradable plastics // Front. Environ. Sci. 2016. V. 4. P. 68. https://doi.org/10.3389/fenvs.2016.00068
Huerta-Lwanga E., Mendoza Vega J., Ku Quej V. et al. Field evidence for transfer of plastic debris along a terrestrial food chain // Sci. Rep. 2017. V. 7. № 1. P. 14 071. https://doi.org/10.1038/s41598-017-14588-2
Anbumani S., Kakkar P. Ecotoxicological effects of microplastics on biota: a review // Environ. Sci. Pollut. Res. 2018. V. 25. № 15. P. 14 373–14 396. https://doi.org/10.1007/s11356-018-1999-x
Barboza L.G.A., Cózar A., Gimenez B.C.G. et al. Chapter 17–Macroplastics pollution in the marine environment // World Seas: an Environmental Evaluation. Academic Press, 2019. P. 305–328. https://doi.org/10.1016/B978-0-12-805052-1.00019-X
Thiel M., Gutow L. The ecology of rafting in the marine environment. I. The floating substrata // Oceanogr. Mar. Biol. 2005. V. 42. P. 181–264. https://doi.org/10.1201/9780203507810.ch6
Thiel M., Gutow L. The ecology of rafting in the marine environment. II. The rafting organisms and community // Oceanogr. Mar. Biol. 2005. V. 42. P. 289–428. https://doi.org/10.1201/9781420037449-9
Zettler E.R., Mincer T.J., Amaral-Zettler L.A. Life in the “plastisphere”: microbial communities on plastic marine debris // Environ. Sci. Technol. 2013. V. 47. № 13. P. 7137–7146. https://doi.org/10.1021/es401288x
Lusher A. Microplastics in the marine environment: distribution, interactions and effects // Marine anthropogenic litter. 2015. P. 245–307. https://doi.org/10.1007/978-3-319-16510-3_10
Gregory M.R. Environmental implications of plastic debris in marine settings-entanglement, ingestion, smothering, hangers-on, hitch-hiking and alien invasions // Phil. Trans. R. Soc. 2009. V. 364. P. 2013–2025. https://doi.org/10.1098/rstb.2008.0265
Sutherland W.J., Bardsley S., Bennun L. et al. A horizon scan of global conservation issues for 2010 // Trends Ecol. Evol. 2011. V. 26. № 1. P. 10–16. https://doi.org/10.1016/j.tree.2010.11.002
Moore C.J., Moore S.L., Leecaster M.K., Weisberg S.B. A comparison of plastic and plankton in the North Pacific Central Gyre // Mar. Pollut. Bull. 2001. V. 42. № 12. P. 1297–1300. https://doi.org/10.1016/S0025-326X(01)00114-X
Wright S.L., Thompson R.C., Galloway T.S. The physical impacts of microplastics on marine organisms: a review // Environ. Pollut. 2013. V. 178. P. 483–492. https://doi.org/10.1016/j.envpol.2013.02.031
Eerkes-Medrano D., Thompson R. Occurrence, fate, and effect of microplastics in freshwater systems // Microplastic Contamination in Aquatic Environments: An Emerging Matter / Ed. Zeng E.Y. Amsterdam: Elsevier Science Bv, 2018. P. 95–132.
Reisser J., Shaw J., Hallegraeff G. et al. Millimeter-sized marine plastics: A new pelagic habitat for microorganisms and invertebrates // PLOS ONE. 2014. V. 9. № 6. e100289. https://doi.org/10.1371/journal.pone.0100289
Bhattacharya P., Lin S., Turner J.P., Ke P.C. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis // J. Phys. Chem. C. 2010. V. 114. № 39. P. 16556–16561. https://doi.org/10.1021/jp1054759
Duis K., Coors A. Microplastics in the aquatic and terrestrial environment: sources (with a specific focus on personal care products), fate and effects // Environ. Sci. Eur. 2016. V. 28. № 1. P. 2. https://doi.org/10.1186/s12302-015-0069-y
Auta H.S., Emenike C.U., Fauziah S.H. Distribution and importance of microplastics in the marine environment: A review of the sources, fate, effects, and potential solutions // Environ. Int. 2017. V. 102. P. 165–176. https://doi.org/10.1016/j.envint.2017.02.013
Koehler A. Cellular fate of organic compounds in marine invertebrates // Comp. Biochem. Phys. A. 2010. V. 157. № 1. P. S8. https://doi.org/10.1016/j.cbpa.2010.06.020
von Moos N., Burkhardt-Holm P., Kohler A. Uptake and effects of microplastics on cells and tissue of the blue mussel Mytilus edulis L. after an experimental exposure // Environ. Sci. Technol. 2012. V. 46. № 20. P. 11 327–11 335. https://doi.org/10.1021/es302332w
Paul-Pont I., Lacroix C., Fernández C.G. et al. Exposure of marine mussels Mytilus spp. to polystyrene microplastics: Toxicity and influence on fluoranthene bioaccumulation // Environ. Pollut. 2016. V. 216. P. 724–737. https://doi.org/10.1016/j.envpol.2016.06.039
Zhu D., Ke X., Christie P., Zhu Y.-G. Rejoinder to “Comments on Zhu et al. (2018) Exposure of soil collembolans to microplastics perturbs their gut microbiota and alters their isotopic composition” [Soil Biol. Biochem. 116 302–310] // Soil Biol. Biochem. 2018. V. 124. P. 275–276. https://doi.org/10.1016/j.soilbio.2018.05.030
Shah A.A., Hasan F., Hameed A., Ahmed S. Biological degradation of plastics: a comprehensive review // Biotechnol. Adv. 2008. V. 26. № 3. P. 246–265. https://doi.org/10.1016/j.biotechadv.2007.12.005
Дополнительные материалы отсутствуют.


