Экология, 2020, № 6, стр. 471-480
Сообщества моллюсков лугового травостоя в условиях снижения выбросов медеплавильного производства
А. В. Нестерков a, *, М. Е. Гребенников a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: nesterkov@ipae.uran.ru
Поступила в редакцию 13.03.2020
После доработки 17.04.2020
Принята к публикации 30.04.2020
Аннотация
Проанализирована видовая структура сообществ наземных моллюсков травостоя в период относительно высоких (2006–2008 гг.) и почти прекратившихся (2015–2017 гг.) выбросов Среднеуральского медеплавильного завода. На сильнозагрязненной территории в эти периоды моллюски отсутствовали. На фоновой и умеренно загрязненной территориях во втором периоде видовое богатство моллюсков снизилось в 2 раза, обилие – в 2–3 раза, что связано с флуктуациями погодных условий (засуха в 2016 г.). На умеренно загрязненной территории влияние засухи проявилось сильнее, однако два вида (Discus ruderatus и Vitrina pellucida) появились во втором периоде и увеличилось их обилие. Восстановительные процессы могут быть связаны с нормализацией кислотности почвы и содержания в ней Ca, а также с уменьшением доли граминоидов в травостое, что должно привести к стабилизации микроклиматических условий.
В настоящее время во многих промышленных районах сокращаются атмосферные выбросы (в том числе содержащие тяжелых металлов) из-за уменьшения объемов производства или реконструкции предприятий [1]. Снижение выбросов, по крайней мере в отдаленной перспективе, должно инициировать восстановительные процессы в экосистемах импактных регионов. Для рассматриваемых нами луговых экосистем в окрестностях прекративших функционировать промышленных предприятий отмечено восстановление как растительных сообществ [2, 3], так и сообществ беспозвоночных травостоя [2]. Однако нам не известны исследования восстановления видовой структуры таксоценозов беспозвоночных.
Обитающих в травостое беспозвоночных традиционно считают отдельным ярусом животного населения, который характеризуется высоким обилием и таксономическим богатством, а также тесной связью с травяной растительностью [4]. Моллюсков в составе этого яруса можно отнести к стратохортофилам, т.е. ярусно-подвижным беспозвоночным, тесно связанным с травостоем, но совершающим периодические миграции в верхние почвенные горизонты [5]. Последнее обстоятельство важно, поскольку именно в них накапливаются наибольшие количества поллютантов [6].
Выбор моллюсков в качестве объекта исследования обусловлен их спецификой, позволяющей предположить быстрое восстановление сообществ после снижения выбросов. Во-первых, наземные моллюски относительно устойчивы к тяжелым металлам; по крайней мере, они способны накапливать их значительные количества без видимого вреда для себя [7–11]. Кроме того, для моллюсков критична обеспеченность кальцием [12–14]. Хотя тяжелые металлы способны формировать его дефицит у моллюсков [15, 16], наибольшее влияние на биодоступность оказывает pH почвы [12, 13]. Нормализация кислотности верхних почвенных горизонтов после прекращения выбросов [17] снимает это ограничение, что может инициировать восстановление сообществ моллюсков.
Во-вторых, для моллюсков важна вертикальная структура травяного яруса [14, 18, 19]. Вблизи заводов разнотравные луга часто трансформируются в злаковые [20, 21]: чем больше злаков, тем проще общая архитектура травостоя и тем контрастнее микроклимат, что неблагоприятно для моллюсков [18, 22]. Помимо этого, в разреженном злаковом травостое загрязненных территорий возрастает освещенность – еще один сильный негативный фактор [14]. По нашим данным, после сокращения выбросов доля разнотравья на умеренно загрязненной территории увеличивается, что также может быть драйвером восстановления сообществ моллюсков.
Выбросы Среднеуральского медеплавильного завода постепенно сокращались с начала 1990-х гг., а после 2010 г. почти полностью прекратились [17], что позволило исследовать закономерности восстановления экосистем. Население беспозвоночных травостоя изучали как на этапе больших выбросов [21], так и в период их сокращения [23]. Для моллюсков в составе почвенной фауны исследовано распределение на загрязненных территориях [24–26]. Кроме того, была рассмотрена связь моллюсков с некоторыми аспектами структуры травостоя [27].
Цель данной работы – анализ изменений сообществ моллюсков лугового травостоя в результате снижения выбросов медеплавильного завода. Мы проверяли гипотезу о том, что на территории с умеренным загрязнением снижение выбросов ведет к относительно быстрому восстановлению сообществ.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена в районе Среднеуральского медеплавильного завода (СУМЗ), расположенного на окраине г. Ревды (Свердловская обл.). В 1980 г. выбросы завода (SO2 и тяжелые металлы, ассоциированные с пылевыми частицами) составляли 225 тыс. т поллютантов в год, в 1990 г. – 148 тыс. т, в 2000 г. – 63 тыс. т, в 2010 г., после реконструкции, выбросы практически прекратились (снизились до 3 тыс. т/год). Общая масса атмосферных выбросов в период с 1980 г. по 2012 г. уменьшилась в 75 раз (в том числе SO2 – в 116 раз (с 201 до 1.7 тыс. т/год), пылевых частиц – в 44 раза (с 21 до 0.5 тыс. т/год)). Выбросы Cu сократились в 5500 раз (с 4.4 до 0.0008 тыс. т/год), As – в 1571 раз (с 0.9 до 0.0006 тыс. т/год), Pb – в 16 раз (с 1 до 0.07 тыс. т/год). Выбросы Zn в период с 1989 г. по 2012 г. сократились в 15 раз (с 1.8 до 0.1 тыс. т/год). Более подробная характеристика состава и динамики выбросов представлена ранее [17, 28].
Ключевые участки были расположены в западном направлении от СУМЗа (против направления господствующих ветров) в импактной (1 км от завода, сильное загрязнение), буферной (4 км, слабое загрязнение) и фоновой (30 км, нет загрязнения) зонах, в пониженных элементах рельефа на вторичных суходольных лугах, сформировавшихся на лесных полянах размером около 5000 м2 в результате вырубки леса около 70 лет назад. Флористический состав луговой растительности сильно различается в разных зонах нагрузки, что связано с исчезновением чувствительных видов разнотравья и замещением их злаками вблизи завода: в фоновой зоне луга разнотравные, в буферной – разнотравно-злаковые, в импактной – злаковые с абсолютным доминированием Agrostis capillaris L. Более детально травостой был описан ранее [23]. На момент проведения исследований выпас скота и сенокос на всех участках отсутствовали.
Моллюски травостоя собраны с помощью биоценометра (площадь основания 0.25 м2), совмещенного с портативным пылесосом с автономным источником питания [29]. Каждая проба – это результат однократной установки биоценометра с последующим сбором всех попавших в него беспозвоночных и срезанием на уровне почвы всех травянистых растений.
Первый период исследования осуществлен в 2006–2008 гг., второй – в 2015–2017 гг. В каждый год проводили три тура учетов, приуроченных ко второй половине каждого летнего месяца (1-й тур – июнь, 2-й – июль, 3-й – август). Пробные площади размером 50 × 50 м, по три в каждой зоне нагрузки, были расположены на расстоянии 100–300 м друг от друга. Пробные площади были постоянными и совпадали в оба периода исследования. Методика сбора проб и конструкция биоценометра были подробно описаны ранее [23, 29].
Объем выборки составлял 10 проб на пробную площадь за тур учета. Таким образом, за все время (6 лет, 18 туров) собрано 1620 проб беспозвоночных и растений (по 270 каждый год). В первый период собрано 1095 экз. моллюсков, во второй – 462 экз., которые были идентифицированы до вида (в отдельных случаях – до рода). Для растений измеряли общую воздушно-сухую массу, а также массу двух фракций – граминоидов (злаки, осоки и ситниковые) и разнотравья с точностью 0.1 г.
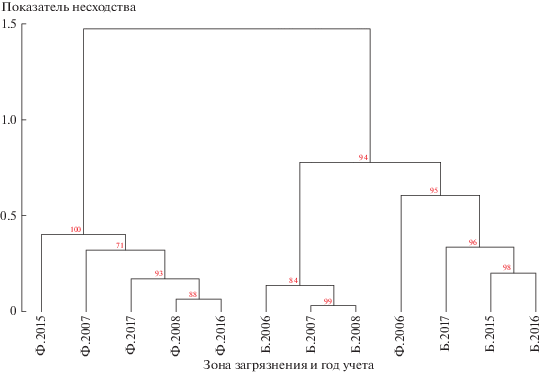
При анализе данных были рассчитаны описательные статистики (среднее и стандартная ошибка). Анализ влияния факторов (зона загрязнения, период, год и тур проведения учетов) на видовое богатство и обилие моллюсков выполнили с помощью обобщенных линейных моделей для квази-Пуассоновского распределения; множественные сравнения реализованы с помощью критерия Тьюки. Стандартизированный индекс засушливости (SPEI) рассчитан в пакете SPEI v. 1.7 для набора значений среднемесячной температуры воздуха и месячной суммы осадков для периода 1977–2018 гг. по данным метеостанции г. Ревды. Дендрограмма несходства видовой структуры между зонами загрязнения в разные годы учета построена в пакете pvclust v. 2.2-0 с помощью метода присоединения попарных средних на основе индекса сходства Чекановского-Съеренсена с учетом обилия видов. Надежность формирования кластеров определена с помощью бутстрэп-оценок. Расчеты выполнены в программной среде R [30].
РЕЗУЛЬТАТЫ
Погодные условия существенно различались между годами исследования. Индекс засушливости SPEI показал, что 2006, 2007, 2008 и 2017 гг. по соотношению осадков и интенсивности их испарения были близки к многолетнему среднему. Лето 2015 г. было одним из самых переувлажненных по отношению к климатической норме, а лето 2016 г., напротив, одним из самых сухих (рис. 1). В буферной зоне во втором периоде по сравнению с первым снизилась доля граминоидов (p < 0.001): соотношение граминоидов и разнотравья почти приблизилось к фоновым значениям. В импактной зоне соотношение было сходным в оба периода (p = 0.997; табл. 1). Эти различия необходимо учитывать при интерпретации результатов, полученных для сообществ моллюсков.
Рис. 1.
Индекс SPEI в годы исследований: а – рассчитан для каждого из летних месяцев; б – суммарно для четырех месяцев (май–август). Значения SPEI выше 1.5 соответствуют избыточному увлажнению, ниже 1.5 – засухе.
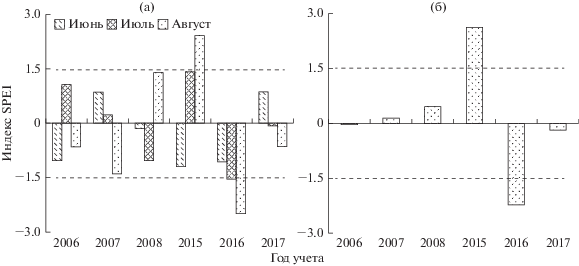
Таблица 1.
Параметры фитомассы лугового травостоя в разных зонах загрязнения в разные периоды и годы учета
| Период/год | Зона | Фитомасса общая, г/м2 | Фитомасса граминоидов, г/м2 | Доля граминоидов, % |
|---|---|---|---|---|
| I | Фоновая | 264.7 ± 13.6 | 74.5 ± 8.6 | 27.8 ± 2.5 |
| Буферная | 280.6 ± 14.7 | 126.3 ± 11.3 | 44.1 ± 2.6 | |
| Импактная | 166.3 ± 9.1 | 165.2 ± 9.3 | 99.2 ± 0.3 | |
| II | Фоновая | 209.7 ± 9.0 | 59.4 ± 3.6 | 28.8 ± 1.7 |
| Буферная | 251.8 ± 13.4 | 60.3 ± 6.1 | 25.2 ± 2.6 | |
| Импактная | 104.6 ± 4.8 | 100.9 ± 4.3 | 96.8 ± 0.9 | |
| 2006 | Фоновая | 337.5 ± 20.4 | 95.9 ± 17.1 | 28.3 ± 4.6 |
| Буферная | 378.0 ± 13.5 | 190.0 ± 16.5 | 50.4 ± 4.1 | |
| Импактная | 221.0 ± 12.0 | 220.7 ± 12.0 | 99.9 ± 0.1 | |
| 2007 | Фоновая | 235.8 ± 8.8 | 42.3 ± 3.4 | 18.0 ± 1.5 |
| Буферная | 248.4 ± 7.8 | 83.1 ± 9.0 | 33.1 ± 3.1 | |
| Импактная | 150.2 ± 4.8 | 150.0 ± 4.8 | 99.8 ± 0.1 | |
| 2008 | Фоновая | 220.7 ± 16.5 | 85.3 ± 13.4 | 37.2 ± 3.7 |
| Буферная | 215.5 ± 8.2 | 105.9 ± 9.5 | 48.7 ± 3.5 | |
| Импактная | 127.8 ± 7.4 | 125.0 ± 7.6 | 97.8 ± 0.7 | |
| 2015 | Фоновая | 214.9 ± 15.0 | 72.3 ± 3.4 | 34.8 ± 2.6 |
| Буферная | 265.9 ± 22.0 | 95.1 ± 8.9 | 36.3 ± 3.0 | |
| Импактная | 115.1 ± 7.4 | 106.0 ± 5.8 | 92.7 ± 2.0 | |
| 2016 | Фоновая | 194.5 ± 9.5 | 50.6 ± 5.6 | 26.8 ± 3.2 |
| Буферная | 239.2 ± 25.3 | 45.0 ± 4.4 | 23.3 ± 5.0 | |
| Импактная | 113.8 ± 4.9 | 112.6 ± 4.7 | 99.0 ± 0.4 | |
| 2017 | Фоновая | 219.8 ± 19.3 | 55.4 ± 6.8 | 24.7 ± 1.9 |
| Буферная | 250.4 ± 21.3 | 40.7 ± 5.6 | 15.9 ± 1.4 | |
| Импактная | 85.0 ± 7.9 | 84.0 ± 7.9 | 98.8 ± 0.4 |
В импактной зоне моллюски отсутствовали как в первый, так и во второй периоды. В других зонах и видовое богатство, и обилие моллюсков снижены во втором периоде по сравнению с первым: в фоновой видовое богатство – в 2.1 раза (p < 0.001), обилие – в 2.4 раза (p < 0.001), в буферной – в 2.0 раза (p < 0.001) и 3.4 раза (p < 0.001) соответственно. Тренд к снижению во втором периоде одинаково выражен в обеих зонах загрязнения (табл. 2). Однако при рассмотрении отдельных лет взаимодействие “зона × год” значимо: как видовое богатство, так и обилие в разные годы неодинаково изменяются в фоновой и буферной зонах. Взаимодействие “зона × тур” значимо для обилия, но не для видового богатства.
Таблица 2.
Результаты анализа обобщенной линейной модели влияния зоны загрязнения, периода, года и тура учетов на видовое богатство и обилие наземных моллюсков
| Источник изменчивости | df | dferror | Число видов | Обилие | ||
|---|---|---|---|---|---|---|
| F | p | F | p | |||
| Зона | 1 | 8 | 5.3 | 0.050 | 2.3 | 0.168 |
| Период | 1 | 8 | 13.7 | 0.006 | 8.5 | 0.019 |
| Зона × период | 1 | 8 | 11.3 | 0.010 | 2.4 | 0.159 |
| Зона | 1 | 72 | 34.0 | <0.001 | 11.1 | 0.001 |
| Год | 5 | 72 | 24.5 | <0.001 | 25.7 | <0.001 |
| Тур | 2 | 72 | 10.0 | <0.001 | 8.6 | <0.001 |
| Зона × год | 5 | 72 | 2.7 | 0.026 | 2.6 | 0.031 |
| Зона × тур | 2 | 72 | 1.3 | 0.291 | 4.2 | 0.019 |
| Год × тур | 10 | 72 | 4.3 | <0.001 | 3.4 | 0.001 |
В обеих зонах наибольшие значения видового богатства (рис. 2) и обилия (рис. 3) отмечены в 2006 и 2007 гг.; в 2008 г. они снижены и близки к значениям 2015 г.; самые низкие значения зарегистрированы в 2016 и 2017 гг.
Рис. 2.
Видовое богатство наземных моллюсков в фоновой (а) и буферной (б) зонах загрязнения. Приведены среднее арифметическое и стандартная ошибка для каждой пробной площади в каждый тур и год учетов; учетная единица – проба (n = 10).
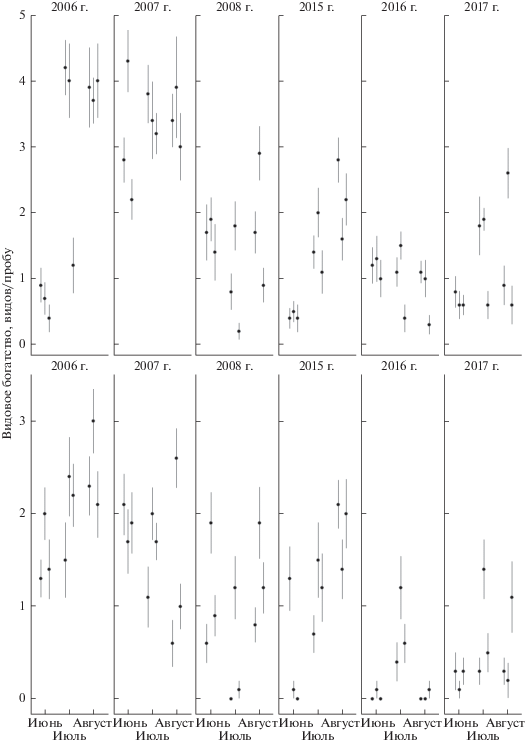
Рис. 3.
Обилие наземных моллюсков в фоновой (а) и буферной (б) зонах загрязнения. Приведены среднее арифметическое ± стандартная ошибка для каждой пробной площади в каждый тур и год учетов; учетная единица – проба (n = 10).
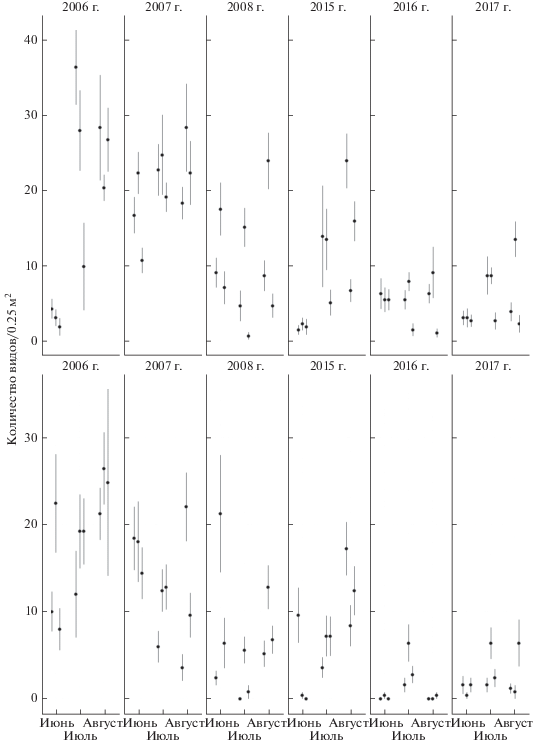
Тенденция к снижению видового богатства и обилия моллюсков в 1-м и 3-м турах учета 2016 г. в буферной зоне выражена сильнее, чем в фоновой (см. рис. 2, 3). Во втором периоде зарегистрировано снижение обилия всех видов, за исключением двух (табл. 3). Обилие Discus ruderatus (Hartmann, 1821) в буферной зоне в 2015 г. увеличилось в 8 раз по сравнению с 2008 г.; в 2016 г. оно значительно снизилось, однако в 2017 г. вновь возросло. Другой вид – Vitrina pellucida (O.F. Müller, 1774) – в буферной зоне впервые был отмечен в 2015 г., благополучно перенес засуху 2016 г. и также увеличил обилие в 2017 г. Таким образом, оба вида демонстрируют увеличение обилия на умеренно загрязненной территории во втором периоде, что соответствует ожидаемой восстановительной динамике.
Таблица 3.
Обилие наземных моллюсков (экз/м2) в травостое фоновой и буферной зон загрязнения в разные годы учета
| Вид | Зона | Год | |||||
|---|---|---|---|---|---|---|---|
| 2006 | 2007 | 2008 | 2015 | 2016 | 2017 | ||
| Arion subfuscus | Ф | 0.27 ± 0.11 | 0.13 ± 0.09 | – | 0.36 ± 0.15 | – | – |
| Б | 1.07 ± 0.24 | 0.40 ± 0.11 | 0.31 ± 0.10 | 0.98 ± 0.36 | 0.13 ± 0.09 | 0.27 ± 0.09 | |
| Deroceras agreste | Ф | 4.62 ± 1.60 | 1.02 ± 0.34 | 0.36 ± 0.25 | 3.11 ± 1.16 | – | 0.89 ± 0.27 |
| Б | 5.51 ± 0.99 | 0.71 ± 0.25 | 0.62 ± 0.27 | 4.09 ± 1.05 | 0.36 ± 0.29 | 0.53 ± 0.19 | |
| Deroceras reticulatum | Ф | 0.04 ± 0.04 | – | – | – | – | – |
| Б | 0.04 ± 0.04 | – | – | 0.04 ± 0.04 | – | – | |
| Discus ruderatus | Ф | – | – | 0.04 ± 0.04 | 0.04 ± 0.04 | – | – |
| Б | 0.09 ± 0.08 | – | 0.04 ± 0.04 | 0.31 ± 0.10 | 0.04 ± 0.04 | 0.22 ± 0.14 | |
| Euconulus fulva | Ф | 1.47 ± 0.35 | 0.76 ± 0.28 | 0.31 ± 0.15 | 0.09 ± 0.06 | 0.04 ± 0.04 | 0.18 ± 0.09 |
| Б | 3.02 ± 0.57 | 3.42 ± 0.58 | 1.51 ± 0.67 | 0.58 ± 0.23 | 0.09 ± 0.06 | 0.09 ± 0.06 | |
| Euomphalia strigella | Ф | 0.18 ± 0.07 | 0.18 ± 0.09 | 0.09 ± 0.06 | – | – | 0.04 ± 0.04 |
| Б | – | – | – | – | – | – | |
| Fruticicola fruticum | Ф | 1.38 ± 0.29 | 4.04 ± 1.27 | 5.64 ± 1.71 | 4.22 ± 1.09 | 3.73 ± 0.64 | 2.04 ± 0.41 |
| Б | – | – | – | – | – | – | |
| Perpolita hammonis | Ф | 3.69 ± 0.99 | 2.36 ± 0.36 | 0.62 ± 0.14 | 0.40 ± 0.22 | 0.04 ± 0.04 | 0.36 ± 0.21 |
| Б | 6.40 ± 1.26 | 5.96 ± 1.04 | 2.40 ± 0.56 | 0.18 ± 0.07 | 0.31 ± 0.16 | 0.09 ± 0.08 | |
| Punctum pygmaeum | Ф | 0.09 ± 0.06 | 0.84 ± 0.18 | 0.09 ± 0.06 | – | 0.04 ± 0.04 | 0.09 ± 0.08 |
| Б | – | – | – | – | – | – | |
| Succinea putris | Ф | 1.29 ± 0.46 | 1.96 ± 0.28 | 0.93 ± 0.20 | 0.18 ± 0.09 | 1.07 ± 0.21 | 0.58 ± 0.19 |
| Б | – | – | – | – | – | – | |
| Vallonia costata | Ф | – | 0.04 ± 0.04 | – | – | – | – |
| Б | – | – | – | – | – | – | |
| Vitrina pellucida | Ф | 0.09 ± 0.06 | 0.22 ± 0.11 | 0.04 ± 0.04 | 0.04 ± 0.04 | – | 0.13 ± 0.09 |
| Б | – | – | – | 0.44 ± 0.33 | 0.04 ± 0.04 | 0.40 ± 0.21 | |
| Zonitoides nitidus | Ф | – | – | – | – | – | – |
| Б | 1.96 ± 1.09 | 2.27 ± 1.13 | 1.87 ± 1.05 | 0.13 ± 0.09 | 0.04 ± 0.04 | 0.04 ± 0.04 | |
| Carychium sp. | Ф | – | 0.09 ± 0.06 | 0.09 ± 0.06 | – | – | – |
| Б | – | – | – | – | – | – | |
| Cochlicopa sp. | Ф | 2.93 ± 0.74 | 2.0 ± 0.33 | 0.58 ± 0.16 | 0.67 ± 0.22 | 0.09 ± 0.06 | 0.36 ± 0.17 |
| Б | – | 0.22 ± 0.17 | 0.04 ± 0.04 | 0.58 ± 0.25 | 0.09 ± 0.06 | 0.80 ± 0.29 | |
| Columella sp. | Ф | 1.02 ± 0.47 | 1.82 ± 0.40 | 0.44 ± 0.20 | 0.22 ± 0.09 | 0.40 ± 0.20 | 0.84 ± 0.21 |
| Б | 0.04 ± 0.04 | – | – | – | – | 0.04 ± 0.04 | |
| Vertigo sp. | Ф | 0.67 ± 0.17 | 4.76 ± 0.99 | 1.02 ± 0.31 | 0.18 ± 0.17 | 0.09 ± 0.06 | – |
| Б | – | 0.04 ± 0.04 | – | – | – | – | |
| Общее обилие |
Ф | 17.7 ± 4.1 | 20.2 ± 1.7 | 10.3 ± 2.3 | 9.5 ± 2.4 | 5.5 ± 0.8 | 5.5 ± 1.2 |
| Б | 18.1 ± 2.1 | 13.0 ± 1.9 | 6.8 ± 2.1 | 7.3 ± 1.7 | 1.11 ± 0.59 | 2.49 ± 0.72 | |
| Общее число видов |
Ф | 10.2 ± 2.1 | 13.3 ± 0.8 | 5.9 ± 1.0 | 5.5 ± 1.1 | 4.0 ± 0.5 | 4.6 ± 0.9 |
| Б | 8.1 ± 0.7 | 6.5 ± 0.8 | 3.8 ± 0.9 | 4.6 ± 0.9 | 1.07 ± 0.51 | 2.0 ± 0.56 | |
Наибольшие различия в видовой структуре населения моллюсков выявлены между зонами загрязнения (рис. 4), тогда как различия между годами, несмотря на контрастные погодные условия, значительно слабее. Интересно отметить сходство видовой структуры населения моллюсков фоновой зоны в 2006 г. и буферной зоны в 2015–2017 гг., что позволило объединить их в один кластер.
ОБСУЖДЕНИЕ
Снижение видового богатства и обилия моллюсков во втором периоде противоположно ожидаемому. Учитывая, что в фоновой зоне характер изменений такой же, как и в буферной, влияние загрязнения нельзя рассматривать в качестве его причины. Наиболее очевидное объяснение – флуктуация погодных условий, негативно отразившаяся на состоянии сообществ во всем районе исследований. Известно, что наземные моллюски тесно связаны с режимом увлажнения верхних почвенных горизонтов [22, 31], который на суходольных лугах определяется в первую очередь соотношением между атмосферными осадками и интенсивностью их испарения. Период с начала мая по конец августа 2015 г. был сильно переувлажнен по отношению к климатической норме, а лето 2016 г. можно считать аномально засушливым (см. рис. 1). Наземные моллюски в целом тяготеют к условиям значительного увлажнения [18, 22], поэтому избыточные осадки 2015 г. не могли оказать на них заметного негативного влияния. Видимо, погодной флуктуацией, приведшей к резкому снижению обилия моллюсков, стала именно засуха 2016 г. Возможный негативный эффект засухи косвенно подтверждают результаты эксперимента, в котором моллюски хорошо переносили длительное воздействие высоких температур при условии достаточного увлажнения, а при недостаточном их смертность возрастала до 100% [32]. Низкие значения видового богатства и обилия в 2017 г. связаны, вероятно, с постепенным восстановлением сообществ после прошлогодней “погодной катастрофы”.
При обсуждении вопроса о посттехногенном восстановлении важно заключение о том, что значительное снижение обилия во втором периоде касается не всех видов (см. табл. 3). Два из них – Discus ruderatus (Hartmann, 1821) и Vitrina pellucida (O.F. Müller, 1774) – демонстрируют увеличение обилия на умеренно загрязненной территории, что соответствует ожидаемой восстановительной динамике. Рассматриваемые виды – эврибионты, способные существовать в широком спектре биотопических условий [33], хотя V. pellucida предпочитает относительно более увлажненные местообитания [22]. Вероятно, именно относительная “неприхотливость” позволила им найти для себя подходящие условия в буферной зоне, возникшие вследствие описанных выше восстановительных изменений в структуре травостоя.
Показательно, что снижение видового богатства и обилия моллюсков в 1-м и 3-м турах учета 2016 г. в буферной зоне выражено сильнее, чем в фоновой (см. рис. 2, 3). Видовое богатство – достаточно консервативный параметр населения – в фоновой зоне было относительно стабильным в оба периода исследования. Обилие – менее консервативный параметр – в обеих зонах было выше во втором периоде. Можно предположить, что в фоновой зоне воздействие засухи на население моллюсков в значительной степени сглажено травостоем, в котором разнотравье отчетливо преобладает над граминоидами. Это означает усложнение общей архитектуры растительного яруса (за счет низкой доли растений с вертикально-линейной организацией, слабо выраженным ветвлением стебля и узкими листовыми пластинками), что в свою очередь способствует формированию стабильного микроклимата. В буферной зоне, несмотря на отчетливую восстановительную тенденцию (снижение доли граминоидов, см. табл. 1), травостой все же находится в угнетенном состоянии и менее эффективно компенсирует сильные погодные флуктуации. Колебания температуры и влажности в нем должны быть более выраженными, что неблагоприятно для многих групп беспозвоночных [34]. В таком травостое значительно возрастает освещенность, что также негативно для моллюсков [14]. Ранее мы показали обратную корреляцию обилия моллюсков с фитомассой граминоидов и прямую – с фитомассой разнотравья [27]. Выраженная связь с вертикальной структурой травостоя выявлена как для наземных моллюсков в целом [14, 18, 19], так и конкретно для одного из видов, увеличивших обилие в буферной зоне во втором периоде, – V. pellucida [22]. Впрочем, необходимо отметить, что обилие обоих рассматриваемых видов невелико, и наше заключение носит предварительный характер, а его справедливость может быть подтверждена в ходе дальнейшего мониторинга.
Приведенные результаты могут создать впечатление, что население моллюсков травостоя реагирует исключительно на воздействие климатических факторов, а техногенное загрязнение второстепенно. Тем не менее как в первый период, так и во второй моллюски отсутствовали в импактной зоне. При ее исключении наибольшие различия в видовой структуре по-прежнему проявляются между зонами загрязнения (см. рис. 4), а различия между годами, несмотря на контрастные погодные условия, сказываются значительно слабее. Впрочем, определенные признаки восстановления можно проследить и здесь: структура населения в буферной зоне во втором периоде демонстрирует сходство с фоновой зоной.
Тесная связь моллюсков травостоя с верхними почвенными горизонтами [5, 18] обусловливает постоянный контакт с аккумулированными там тяжелыми металлами [6], относящимися к основным компонентам выбросов металлургических предприятий. Известно, что наземные моллюски способны накапливать значительные концентрации тяжелых металлов (Cu, Pb, Cd и Zn) без видимых негативных последствий [8, 10]. При этом в ряде случаев происходит замедление темпов питания, роста и развития, хотя увеличения смертности не отмечали [9, 11, 35, 36], за исключением ряда экспериментов с питанием на растениях-гипераккумуляторах с очень высоким содержанием Ni [37, 38].
Такая устойчивость противоречит факту элиминации моллюсков вблизи завода: в составе почвенной фауны в импактной зоне СУМЗа присутствие моллюсков не регистрировали в 1990–2012 гг., единичные находки были отмечены только в 2014 г. [25], а в луговом травостое они не обнаружены до сих пор. В зоне действия металлургического комбината “Североникель” почвенные моллюски также были отмечены только на фоновой и слабозагрязненной территориях [39]. Моллюсков неоднократно регистрировали вблизи металлургических предприятий [7, 11, 40], но это касалось только случаев загрязнения металлами без подкисления почвы. Вероятно, основную роль играет не прямой токсический эффект металлов, а более сложные механизмы, в частности сочетанное действие разных факторов.
Наиболее эффективный метаболический барьер действует в отношении Pb: его содержание в тканях всегда существенно ниже, чем в пище [9, 34]. Экспериментальное повышение потребления этого элемента моллюсками приводит к снижению содержания в мягких тканях Ca и Mg, вероятно, расходующихся при работе механизма экскреции свинца [16]. При этом обеспеченность Ca снижается прежде всего для ранних стадий развития моллюсков – яиц [15] и молоди, приводя во втором случае к формированию утонченной раковины [16]. По-видимому, токсический эффект тяжелых металлов заключается в формировании дефицита Ca.
Содержание Ca – важный экологический фактор, определяющий качественные и количественные особенности населения моллюсков [12–14]. Содержание Ca в почве тесно связано с pH почвы [13], который под действием выбросов снижается с 5.1–6.0 до 3.5–3.8 [17]. Однако сокращение выбросов привело к тому, что к 2012 г. pH верхних почвенных горизонтов на загрязненных территориях уже был сопоставим с фоновыми значениями; при этом содержание Ca2+ в буферной зоне было близко к фоновому, но в импактной – двукратно снижено [17]. Следовательно, дефицит Ca перестал лимитировать моллюсков в буферной зоне СУМЗ, но продолжает – в импактной.
ЗАКЛЮЧЕНИЕ
Сравнение видовой структуры сообществ наземных моллюсков травостоя для двух периодов – относительно высоких (2006–2008 гг.) и почти прекратившихся (2015–2017 г.) выбросов – не подтвердило исходную гипотезу об относительно быстром восстановлении сообществ. В 2015–2017 гг. видовое богатство и обилие моллюсков и в фоновой, и в буферной зонах сильно снизилось по сравнению с 2006–2008 гг., что связано с флуктуациями погодных условий. Лишь для двух видов можно предположить восстановление после почти полного прекращения выбросов, проявляющееся в появлении и увеличении обилия на умеренно загрязненной территории. На сильнозагрязненной территории моллюски по-прежнему отсутствуют. Восстановительные процессы в сообществах моллюсков могут быть связаны с нормализацией кислотности почвы и содержания в ней Ca, а также с изменением соотношения граминоидов и разнотравья в травостое, которые в буферной зоне приближаются к фоновым значениям.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН.
Авторы признательны д.б.н. Е.Л. Воробейчику за ценные советы при обсуждении результатов.
Список литературы
Pacyna J.M., Pacyna E.G., Aas W. Changes of emissions and atmospheric deposition of mercury, lead, and cadmium // Atmospheric Environment. 2009. V. 43. № 1. P. 117–127.
Perner J., Voigt W., Bahrmann R. et al. Responses of arthropods to plant diversity: changes after pollution cessation // Ecography. 2003. V. 26. № 6. P. 788–800.
Blanke V., Schulze B., Gerighausen U. et al. The power of regeneration: lessons from a degraded grassland // Restoration Ecology. 2007. V. 15. № 2. P. 307–311.
Чернов Ю.И., Руденская Л.В. Комплекс беспозвоночных – обитателей травостоя как ярус животного населения // Зоол. журн. 1975. Т. 54. № 6. С. 884–894.
Лагунов А.В. Стратиграфическая структура хортобионтного комплекса беспозвоночных животных в Ильменском заповеднике // Экологические исследования в Ильменском государственном заповеднике. Миасс, 1994. С. 25–42.
Korkina I.N., Vorobeichik E.L. Humus Index as an indicator of the topsoil response to the impacts of industrial pollution // Applied Soil Ecology. 2018. V. 123. P. 455–463.
Rabitsch W.B. Metal accumulation in terrestrial pulmonates at a lead/zinc smelter site in Arnoldstein, Austria // Bull. of Environmental Contamination and Toxicology. 1996. V. 56. № 5. P. 734–741.
Beeby A., Richmond L. Evaluating Helix aspersa as a sentinel for mapping metal pollution // Ecological Indicators. 2002. V. 1. № 4. P. 261–270.
Gomot-de Vauflery A., Pihan F. Methods for toxicity assessment of contaminated soil by oral or dermal uptake in land snails: metal bioavailability and bioaccumulation // Environmental Toxicology and Chemistry. 2002. V. 21. № 4. P. 820–827.
Beeby A., Richmond L. Do the soft tissues of Helix aspersa serve as a quantitative sentinel of predicted free lead concentrations in soils? // Applied Soil Ecology. 2003. V. 22. № 2. P. 159–165.
Fritsch C., Coeurdassier M., Gimbert F. et al. Investigations of responses to metal pollution in land snail populations (Cantareus aspersus and Cepaea nemoralis) from a smelter-impacted area // Ecotoxicology. 2011. V. 20. № 4. P. 739–759.
Wareborn I. Environmental factors influencing the distribution of land molluscs of an oligotrophic area in Southern Sweden // Oikos. 1969. V. 21. № 2. P. 285–291.
Horsak M. Mollusc community patterns and species response curves along a mineral richness gradient: a case study in fens // J. of Biogeography. 2006. V. 33. № 1. P. 98–107.
Horsak M., Hajek M., Tichy L. et al. Plant indicator values as a tool for land mollusc autecology assessment // Acta Oecologica. 2007. V. 32. № 2. P. 161–171.
Beeby A., Richmond L. Variation in the mineral composition of eggs of the snail, Helix aspersa between populations exposed to different levels of metal contamination // Environmental Pollution. 1998. V. 101. № 1. P. 25–31.
Beeby A., Richmond L., Herpe F. Lead reduces shell mass in juvenile garden snails (Helix aspersa) // Environmental Pollution. 2002. V. 120. № 2. P. 283–288.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024.
Cook A. Behavioral ecology: on doing the right thing, in the right place at the right time // The biology of terrestrial molluscs. Wallingford: CABI Publishing, 2001. P. 447–487.
Dvorakova J., Horsak M. Variation of snail assemblages in hay meadows: disentangling the predictive power of abiotic environment and vegetation // Malacologia. 2012. V. 55. № 1. P. 151–162.
Hunter B.A., Johnson M.S., Thompson D.J. Ecotoxicology of copper and cadmium in a contaminated grassland ecosystem. I. Soil and vegetation contamination // J. of Applied Ecology. 1987. V. 24. № 2. P. 573–586.
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локал. уровень). Екатеринбург: Наука, 1994. 280 с.
Hettenbergerova E., Horsak M., Chandran R. et al. Patterns of land snail assemblages along a fine-scale moisture gradient // Malacologia. 2013. V. 56. № 1–2. P. 31–42.
Нестерков А.В., Воробейчик Е.Л. Изменение структуры населения беспозвоночных-хортобионтов под действием выбросов медеплавильного завода // Экология. 2009. № 4. С. 303–313. [Nesterkov A.V., Vorobeichik E.L. Changes in the structure of chortobiont invertebrate community exposed to emissions from a copper smelter // Rus. J. of Ecology. 2009. V. 40. № 4. P. 286–296.]
Воробейчик Е.Л., Ермаков А.И., Золотарев М.П. и др. Изменение разнообразия почвенной мезофауны в градиенте промышленного загрязнения // Rus. Entomological J. 2012. № 21. С. 203–218.
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148. [Vorobeichik E.L., Ermakov A.I., Grebennikov M.E. Initial stages of recovery of soil macrofauna communities after reduction of emissions from a copper smelter // Rus. J. of Ecology. 2019. V. 50. № 2. P. 146–160.]
Воробейчик Е.Л., Ермаков А.И., Нестеркова Д.В. и др. Крупные древесные остатки как микростации обитания почвенной мезофауны на загрязненных территориях // Изв. РАН. Сер. биологич. 2020. № 1. С. 85–95.
Нестерков А.В. Реакция моллюсков луговых сообществ на выбросы Среднеуральского медеплавильного завода // Сибирский экологич. журн. 2013. № 6. С. 891–899.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В. и др. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V. et al. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Rus. J. of Ecology. 2014. V. 45. № 6. P. 498–507.]
Нестерков А.В. Опыт использования биоценометра с вакуумным пробосборником для учета беспозвоночных травостоя // Евразиатский энтомологич. журн. 2014. Т. 13. № 3. С. 244–245.
R: a language and environment for statistical computing / R foundation for statistical computing. 2019. URL: http://www.R-project.org/
Schenkova V., Horsak M., Hajek M. et al. Mollusc assemblages of Scandinavian fens: species composition in relation to environmental gradients and vegetation // Annales Zoologici Fennici. 2015. V. 52. № 1–2. P. 1–16.
Dias R.J.P., Bessa E.C.D., D’Avila S. Influence of substrate humidity on desiccation resistance capacity in Subulina octona (Mollusca, Subulinidae) // Brazilian Archive of Biology and Technology. 2007. V. 50. № 1. P. 137–139.
Andersen J., Halvorsen O. Species composition, abundance, habitat requirements and regional distribution of terrestrial gastropods in Arctic Norway // Polar Biology. 1984. V. 3. № 1. P. 45–53.
Wenninger E.J., Inouye R.S. Insect community response to plant diversity and productivity in a sagebrush-steppe ecosystem // J. of Arid Environments. 2008. V. 72. № 1. P. 24–33.
Laskowski R., Hopkin S.P. Effect of Zn, Cu, Pb, and Cd on fitness in snails (Helix aspersa) // Ecotoxicology and Environmental Safety. 1996. V. 34. № 1. P. 59–69.
Ebenso I.E., Ologhobo A.D. Effects of lead pollution at industrial contaminated sites on sentinel juvenile Achatina achatina // Bull. of Environmental Contamination and Toxicology. 2009. V. 82. № 1. P. 106–110.
Boyd R.S., Davis M.A., Wall M.A. et al. Nickel defends the South African hyperaccumulator Senecio coronatus (Asteraceae) against Helix aspersa (Mollusca: Pulmonidae) // Chemoecology. 2002. V. 12. № 2. P. 91–97.
Boyd R.S., Jhee E.M. A test of elemental defence against slugs by Ni in hyperaccumulator and non-hyperaccumulator Streptanthus species // Chemoecology. 2005. V. 15. № 3. P. 179–185.
Танасевич А.В., Рыбалов Л.Б., Камаев И.О. Динамика почвенной мезофауны в зоне техногенного воздействия // Лесоведение. 2009. № 6. С. 63–76.
Hopkin S.P. Molluscs // Ecophysiology of metals in terrestrial invertebrates. Barking: Elsevier Applied Science, 1989. P. 97–107.
Дополнительные материалы отсутствуют.