Экология, 2021, № 4, стр. 278-288
Динамика населения птиц-дуплогнездников в условиях сокращения промышленных выбросов (на примере среднеуральского медеплавильного завода)
Е. А. Бельский a, *, А. Г. Ляхов a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: belskii@ipae.uran.ru
Поступила в редакцию 30.09.2020
После доработки 08.12.2020
Принята к публикации 14.12.2020
Аннотация
На основе многолетних непрерывных наблюдений (1989–2020 гг.) проанализирована динамика видового богатства, плотности гнездования и структуры населения птиц, заселяющих искусственные гнездовья, в условиях сокращения (в 50 раз) атмосферных выбросов Среднеуральского медеплавильного завода. В зоне сильного загрязнения (импактной) общая плотность меньше, чем в фоновой зоне, в лиственном лесу, тогда как в хвойном различий между зонами не было. Общая плотность населения дуплогнездников в импактной зоне увеличилась за 30-летний период, особенно в лиственном лесу в 2010–2020 гг., после существенного сокращения промышленных выбросов. Плотность гнездования двух самых массовых видов изменялась разнонаправленно: у мухоловки-пеструшки увеличивалась, а у обыкновенной горихвостки уменьшалась. Это привело к смене доминантов в импактной зоне: горихвостку, доминировавшую до 2012 г., сменила мухоловка-пеструшка. Различия динамики плотности видов, вероятно, связаны с начавшимся восстановлением растительного покрова вблизи завода, благоприятным для мухоловки-пеструшки, но не горихвостки.
Промышленное загрязнение среды подавляет воспроизводство птиц, оказывая токсическое действие на взрослых птиц и птенцов, а также изменяя местообитания, кормовую базу птиц, резистентность особей к инфекциям и паразитам [1–7]. В последние десятилетия в большинстве стран происходит уменьшение промышленных выбросов в результате совершенствования технологий и/или сокращения производства. Снижение техногенной нагрузки в нарушенных экосистемах запускает процессы восстановления, изучение которых привлекает все большее число исследователей. Объектами этих работ были почва [8], древесный, травяно-кустарничковый и мохово-лишайниковый ярусы [9–13], эпифитные лишайники [14], почвенные, герпетобионтные беспозвоночные и филлофаги [15–18], мелкие млекопитающие [19–21] и птицы [22–25]. Как правило, у птиц исследовали репродуктивные и физиолого-биохимические показатели. Лишь единичные публикации посвящены восстановлению населения лесных птиц при ослаблении техногенной нагрузки [26], хотя актуальность таких работ не вызывает сомнений. В качестве модельного объекта этих исследований можно использовать сообщества видов-дуплогнездников, охотно заселяющих искусственные гнездовья. Видовой состав, плотность и структура населения птиц-дуплогнездников связаны с условиями среды [27], что позволяет использовать эту группу для поиска общих закономерностей посттехногенного восстановления населения птиц.
Изменение плотности гнездования и структуры населения лесных дуплогнездников в условиях промышленного загрязнения изучали многие авторы [28–32]. Большинство исследований ограничены периодом в несколько лет, более продолжительные единичны. Многолетние наблюдения в Германии [29] приходятся на период стабильно высоких выбросов и продолжающейся деградации лесных экосистем. Работы по изучению многолетней динамики сообществ дуплогнездников в условиях сокращения промышленных выбросов нам не известны.
Плотность гнездового населения многих видов зависит от погодных условий весной, в период прилета и распределения по территории. В средних широтах наиболее важны температуры апреля и мая [33, 34]. В теплые годы численность гнездящихся птиц обычно возрастает благодаря хорошим кормовым условиям и лучшей выживаемости птиц в весенний период [34]. Однако не ясно, как влияют температурные условия весны на динамику населения дуплогнездников в условиях сокращения промышленных выбросов.
Цель настоящей работы ‒ охарактеризовать временную динамику видового богатства и плотности населения дуплогнездников в условиях сокращения выбросов Среднеуральского медеплавильного завода (СУМЗ) с учетом уровня загрязнения, биотопа и характера весны. При анализе многолетних данных предполагали, что изменения плотности дуплогнездников на незагрязненной территории менее выражены по сравнению с зоной сильного загрязнения, где сокращение промышленных выбросов сопровождается восстановлением растительного покрова. Учитывая различия между видами птиц по биотопическим предпочтениям, проверяли гипотезу, что многолетняя динамика разных видов различается вблизи завода, где начавшаяся демутационная сукцессия приводит к изменению структуры фитоценоза. Анализируя связь между погодными условиями и населением дуплогнездников, проверяли гипотезу об увеличении их плотности в годы с более теплой весной.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены в окрестностях Среднеуральского медеплавильного завода (СУМЗ), расположенного близ г. Ревды Свердловской обл. Предприятие функционирует с 1940 г., основные ингредиенты выбросов – газообразные соединения серы, фтора и азота, а также пылевые частицы с сорбированными тяжелыми металлами (Cu, Pb, Zn, Cd, Fe, Hg и др.) и металлоидами (As). В 1980-х годах валовые выбросы СУМЗа достигали 150–225 тыс. т поллютантов в год, что делало предприятие одним из крупнейших источников промышленного загрязнения в России. С начала 1990-х годов выбросы постепенно снижались, и после коренной реконструкции, завершившейся в 2009 г., стабилизировались на уровне 3–4 тыс. т/год [13].
Площадки с искусственными гнездовьями (ИГ) были заложены на расстоянии от 1 до 27 км к западу от СУМЗа, в двух лесных биотопах, типичных для этого района: елово-пихтовых (Picea obovata и Abies sibirica) и производных осиново-березовых лесах (Populus tremula, Betula pubescens и B. pendula) с примесью сосны (Pinus sylvestris). По мере приближения к источнику выбросов отмечено угнетение древесного яруса (снижение густоты древостоя, его запаса и проективного покрытия, увеличение доли сухостоя), уменьшение видового богатства и биомассы травяно-кустарничкового яруса [13].
Нами использованы данные по площадкам в фоновой (условно незагрязненной, контрольной) и сильно загрязненной (импактной) зонах (рис. 1). В фоновой зоне непрерывные ежегодные наблюдения проводили в хвойном лесу на площадке W20 (20 км к западу от СУМЗа) в 1989–2020 гг., в лиственном лесу – на площадках W16 (16 км западнее СУМЗа, 1996–2003 гг.) и W27 (27 км западнее СУМЗа, 2005–2020 гг.). В импактной зоне наблюдения проводили в хвойном лесу на площадке SW1 (1 км к юго-западу от СУМЗа) в 1990–2020 гг., в лиственном лесу – на площадке W1 (1 км к западу от СУМЗа) в 1989–2020 гг. На всех площадках развеска ИГ была однотипной: по 7–9 параллельных линий с интервалом между линиями 100 м, в линии 7–9 ИГ с интервалом 50 м, плотность 2 ИГ/га, по 50–80 ИГ на площадку; ИГ были сделаны из досок с площадью дна 10 × 10 см и диаметром летка 30–35 мм. Проверку ИГ проводили ежегодно в течение мая–июля с интервалом 1–7 дней. Плотность гнездования (далее в тексте “плотность”) дуплогнездников оценивали по количеству занятых ИГ, т.е. гнезд, где было отложено хотя бы одно яйцо, в пересчете на 1 км2. У синиц (Paridae) учитывали только первые кладки. Собрана информация по 2742 гнездам восьми видов птиц.
Рис. 1.
Расположение площадок с искусственными гнездовьями в окрестностях СУМЗа: 1 – населенные пункты; 2 – шоссе; 3 – река; 4 – СУМЗ; 5 – площадки.

Поскольку величина выбросов СУМЗа изменялась на протяжении наблюдений, необходимо было учесть фактор времени при анализе населения дуплогнездников. Для этого использовали два варианта временнóй шкалы: дискретную и непрерывную. В первом варианте мы разбили весь ряд наблюдений на три периода с разным уровнем промышленных выбросов: 1989–1998 гг. (высокий уровень, 71–157 тыс. т/год), 1999–2009 гг. (средний, 21–65 тыс. т/год), 2010–2020 гг. (низкий, 3–4 тыс. т/год). Различия между биотопами, зонами токсической нагрузки и временны́ми периодами по видовому богатству и плотности дуплогнездников анализировали с помощью дисперсионного анализа. В качестве повторности использовали показатели каждого года в конкретной зоне и биотопе (здесь и в последующих анализах). Плотность логарифмировали (lg(x + 1)) для достижения нормального распределения и однородности дисперсий, которую проверяли с помощью критерия Левена. Для множественных сравнений использован критерий Тьюки. Видовое богатство характеризовали двумя показателями: количество видов за сезон (S) на конкретной площадке отражает альфа-разнообразие, при этом для каждого периода рассчитывали среднее S; общее количество видов за временно́й период в конкретной зоне и биотопе отражает гамма-разнообразие. Чтобы исключить различия в размерах выборок, мы использовали количество видов на минимальную выборку (89 гнезд) – S ′, рассчитанную методом разрежения в программе PAST v.1.92 [35].
В анализе с непрерывной временно́й шкалой использовали многолетние ряды общей плотности населения, а также плотности массовых видов (мухоловки-пеструшки Ficedula hypo leuca, обыкновенной горихвостки Phoenicurus phoenicurus, большой синицы Parus major и московки Parus ater) отдельно в лиственном и хвойном лесу. Применяли множественную регрессию с пошаговым включением переменных. Независимыми переменными были порядковый номер года (в дальнейшем “год”), номер года в степени 2 (“год2”), среднемесячные температуры апреля и мая, а также плотность конкурентов за места гнездования (большая синица, вертишейка Jynx torquilla, поползень Sitta europaea и обыкновенная горихвостка – конкуренты для мухоловки-пеструшки, первые три вида и мухоловка-пеструшка – конкуренты для горихвостки). Рано гнездящиеся виды конкурируют за места гнездования друг с другом. Поползень – конкурент для большой синицы, поползень и большая синица – конкуренты для московки. Мухоловки-пеструшки, гнездящиеся позднее, могут занять ИГ, в котором московки начали кладку, но такие случаи были единичны. Номер года использован как показатель уровня атмосферного загрязнения ввиду того, что величина выбросов почти ежегодно сокращалась на протяжении периода наблюдений [13]. Корреляция между номером года и величиной выбросов за период 1989–2018 гг. составляла: r = −0.933, t = = −14.23, n = 30 лет, p < 0.0001. Переменная “год2” введена, чтобы учесть нелинейность динамики плотности. Для оценки связи между переменными использовали коэффициент корреляции Пирсона.
Среднемесячные температуры апреля и мая были включены для оценки эффекта погодных условий весны. Температуры этих месяцев не коррелировали друг с другом: r = −0.193, t = 1.08, p = 0.290. Многолетнюю динамику температур апреля и мая анализировали с помощью линейной регрессии. Данные по температуре воздуха на ближайшей метеостанции в г. Ревде предоставлены Свердловским центром по гидрометеорологии и мониторингу окружающей среды (1989–2019 гг.), а также получены на сайте www.pogodaiklimat.ru (2020 г.). Расчеты выполнены в пакете программ Statistica v.10.0 (StatSoft, Inc.).
РЕЗУЛЬТАТЫ
В районе исследований ИГ занимали восемь видов: наиболее часто – мухоловка-пеструшка, реже – обыкновенная горихвостка, большая синица и московка. Вертишейка, поползень, буроголовая гаичка Parus montanus и зарянка Erithacus rubecula гнездились единично (табл. 1). В лиственном лесу ИГ занимали 6 видов, в хвойном – 8 видов. Мухоловка-пеструшка – абсолютный доминант в фоновой зоне (81–96% всех гнезд, два биотопа объединены). В импактной зоне в первые два периода доминировала обыкновенная горихвостка (52–54% гнезд), а гнезд мухоловки-пеструшки было меньше (25–34%). В третьем периоде доля гнезд горихвостки упала до 17%, а мухоловки-пеструшки выросла до 55% (рис. 2). Заселяемость ИГ в фоновой зоне составила в среднем 46%, в импактной – 31%.
Таблица 1.
Плотность дуплогнездников (гнезд/км2, среднее ± SD) в двух зонах загрязнения, биотопах и в периоды с разным количеством выбросов СУМЗа
| Вид и показатель | Фоновая зона | Импактная зона | ||||
|---|---|---|---|---|---|---|
| Период, годы | ||||||
| 1989–1998 | 1999–2009 | 2010–2020 | 1989–1998 | 1999–2009 | 2010–2020 | |
| Осиново-березовый лес | ||||||
| Мухоловка-пеструшка | 136.5 ± 23.5′ | 134.2 ± 36.8' | 93.3 ± 19.5 | 9.0 ± 7.3″a | 15.9 ± 9.4a | 58.8 ± 26.8b |
| Обыкновенная горихвостка | 1.6 ± 2.7′ | 0.6 ± 1.8' | 0' | 22.4 ± 14.9″ab | 34.5 ± 17.4a | 14.8 ± 12.3″b |
| Московка | 1.6 ± 2.7 | 1.0 ± 2.1 | 2.8 ± 3.5 | 0.5 ± 1.5 | 1.1 ± 2.0 | 5.1 ± 4.0 |
| Большая синица | 1.6 ± 2.7 | 0.8 ± 2.6 | 3.6 ± 3.2′ | 5.8 ± 5.1ab | 1.5 ± 2.9b | 14.4 ± 8.8″a |
| Вертишейка | 0 | 0 | 0 | 1.4 ± 1.9 | 2.7 ± 3.6 | 2.0 ± 2.7 |
| Поползень | 0 | 0 | 0 | 0 | 0 | 0.3 ± 0.8 |
| Общая плотность | 141.3 ± 19.2′ | 136.5 ± 35.3′ | 99.7 ± 17.9 | 39.0 ± 17.6″a | 55.7 ± 15.7″a | 95.4 ± 26.9b |
| S | 2.0 ± 1.0 | 1.4 ± 0.8′ | 2.1 ± 0.9′ | 3.2 ± 0.9 | 3.0 ± 1.2″ | 4.0 ± 0.6″ |
| S ′ | 4.0 ± 0.0 | 2.16 ± 0.83 | 2.96 ± 0.21 | 4.77 ± 0.43 | 4.84 ± 0.38 | 5.10 ± 0.54 |
| N, лет | 3 | 10 | 11 | 10 | 11 | 11 |
| Темнохвойный лес | ||||||
| Мухоловка-пеструшка | 58.5 ± 17.5′ | 60.1 ± 19.6′ | 64.6 ± 21.5 | 17.3 ± 9.3″ | 24.0 ± 9.2″ | 36.0 ± 17.1″ |
| Обыкновенная горихвостка | 2.2 ± 3.0′ | 0′ | 0′ | 29.4 ± 8.3″ | 21.7 ± 2.8″ | 13.8 ± 8.0″ |
| Московка | 8.2 ± 5.8 | 3.1 ± 3.1 | 3.6 ± 5.4′ | 2.9 ± 4.8a | 8.7 ± 8.9ab | 13.5 ± 8.2″b |
| Большая синица | 5.8 ± 3.3 | 2.1 ± 4.2 | 2.4 ± 2.6′ | 10.3 ± 12.1ab | 2.7 ± 2.9a | 14.8 ± 9.8″b |
| Буроголовая гаичка | 0.3 ± 1.1 | 0 | 0 | 0 | 0 | 0 |
| Поползень | 0.3 ± 0.9 | 0.3 ± 0.9 | 0 | 1.2 ± 1.9 | 1.3 ± 1.8 | 1.3 ± 1.9 |
| Вертишейка | 0 | 0 | 0 | 0 | 0.3 ± 1.1 | 0 |
| Зарянка | 0 | 0 | 0 | 0 | 0 | 0.3 ± 1.1 |
| Общая плотность | 75.2 ± 13.1 | 65.6 ± 22.0 | 70.5 ± 21.7 | 61.1 ± 17.4 | 58.6 ± 17.6 | 79.8 ± 31.1 |
| S | 3.5 ± 0.7a | 1.9 ± 0.7′b | 2.0 ± 0.9′b | 3.6 ± 0.7 | 3.7 ± 0.6″ | 4.1 ± 0.9″ |
| S ′ | 4.65 ± 0.70 | 3.35 ± 0.51 | 2.97 ± 0.17 | 4.99 ± 0.10 | 5.45 ± 0.55 | 5.23 ± 0.60 |
| N, лет | 10 | 11 | 11 | 9 | 11 | 11 |
Примечание. S – количество видов за сезон; S ′ – количество видов на минимальную выборку (89 гнезд); сравнения проведены отдельно в каждом биотопе. Значения, обозначенные разными апострофами, значимо (p < 0.05) различаются между зонами внутри одного периода; значения, обозначенные разными буквами, значимо различаются между периодами внутри одной зоны.
Рис. 2.
Доля гнезд (среднее ± SE) массовых видов дуплогнездников (1 – мухоловка-пеструшка, 2 – обыкновенная горихвостка, 3 – большая синица, 4 – московка) в разные периоды в фоновой (а) и импактной (б) зонах (два биотопа объединены).
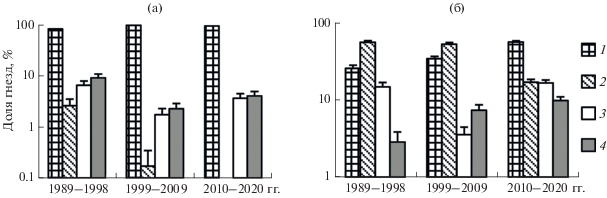
Существенные различия выявлены между зонами, биотопами и временны́ми периодами по видовому богатству и плотности дуплогнездников (табл. 2). В обоих биотопах видовое богатство дуплогнездников в импактной зоне больше, чем в фоновой, но только во втором и третьем периодах (см. табл. 1). Видовое богатство в большинстве случаев незначимо изменялось между периодами. Общая плотность дуплогнездников в лиственном лесу в фоновой зоне была существенно больше, чем в импактной, в первые 20 лет наблюдений, а в третьем периоде различия стали незначимы. В хвойном лесу различий по общей плотности между зонами и периодами не наблюдалось. Различия между биотопами значимы только в первом периоде в импактной зоне (3-факторный ANOVA, критерий Тьюки, p = 0.046) и во втором периоде в фоновой зоне (p = 0.0002). Плотность мухоловки-пеструшки в импактной зоне в обоих биотопах в первые два периода была меньше, чем в фоновой, а в третьем периоде различия между зонами стали незначимы (см. табл. 1).
Таблица 2.
Результаты дисперсионного анализа различий между зонами, биотопами и временны́ми периодами по видовому богатству и плотности дуплогнездников
| Источник изменчивости | df | Количество видов за сезон | Плотность гнездования | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| общая | мухоловки-пеструшки | обыкновенной горихвостки | большой синицы | московки | |||||||||
| F | p | F | p | F | p | F | p | F | p | F | p | ||
| Зона | 1 | 75.1 | <0.001 | 42.0 | <0.001 | 189.3 | <0.001 | 408.0 | <0.001 | 20.5 | <0.001 | 1.1 | 0.296 |
| Биотоп | 1 | 9.5 | 0.003 | 12.9 | <0.001 | 3.4 | 0.066 | 0.1 | 0.822 | 2.9 | 0.092 | 18.0 | <0.001 |
| Период | 2 | 5.4 | 0.006 | 3.0 | 0.054 | 11.2 | <0.001 | 10.9 | <0.001 | 21.1 | <0.001 | 4.2 | 0.017 |
| Зона × биотоп | 1 | 0.6 | 0.459 | 29.2 | <0.001 | 22.6 | <0.001 | 0.1 | 0.764 | 0.6 | 0.454 | 0.4 | 0.526 |
| Зона × период | 2 | 5.3 | 0.006 | 12.4 | <0.001 | 18.1 | <0.001 | 4.2 | 0.017 | 4.4 | 0.015 | 7.3 | 0.001 |
| Биотоп × период | 2 | 2.7 | 0.070 | 1.7 | 0.181 | 1.1 | 0.328 | 1.9 | 0.157 | 3.1 | 0.050 | 0.8 | 0.438 |
| Остаточная | 107 | ||||||||||||
Анализ многолетних рядов показал, что в фоновой зоне общая плотность дуплогнездников в обоих биотопах и мухоловки-пеструшки в хвойном лесу не менялась значимо на протяжении всего срока наблюдений (табл. 3), а плотность мухоловки-пеструшки в лиственном лесу сокращалась (рис. 3). В импактной зоне общая плотность в лиственном лесу, а также плотность мухоловки-пеструшки в обоих биотопах увеличивались, а плотность обыкновенной горихвостки в лиственном лесу возрастала до 2002 г. и сокращалась в последующие годы. Значимое влияние переменной “год2” указывает на нелинейный характер динамики горихвостки (см. табл. 3). В импактной зоне изменения плотности мухоловки и горихвостки противоположно направлены (см. рис. 3б, г), что особенно проявилось в лиственном лесу в третьем периоде, когда коэффициент корреляции плотности этих видов составил r = −0.80 ± 0.20, p = 0.003. В результате в зоне сильного загрязнения произошла смена доминантов: начиная с 2012 г. плотность мухоловки-пеструшки превысила таковую горихвостки, доминировавшей до этого (см. рис. 3б, г). Плотность большой синицы в хвойном лесу фоновой зоны, а также в импактной зоне изменялась нелинейно: уменьшалась к началу 2000-х гг., затем возрастала. Плотность московки в хвойном лесу фоновой зоны также изменялась нелинейно, а в импактной зоне возрастала на протяжении всего срока наблюдений (см. рис. 3).
Таблица 3.
Результаты множественного регрессионного анализа общей плотности и плотности доминирующих видов в двух зонах загрязнения и биотопах (β ± SE, в скобках уровень значимости p)
| Плотность, lg(x + 1) | Год | Год2 | Среднемесячная температура | Плотность конкурентов, lg(x + 1) | $R_{{{\text{adj}}}}^{2}$ | |
|---|---|---|---|---|---|---|
| апреля | мая | |||||
| Лиственный лес, фоновая зона (2005–2020 гг., n = 16) | ||||||
| Общая | NI | −0.45 ± 0.23 (0.071) | NI | 0.32 ± 0.23 (0.183) | NA | 0.206 |
| Мухоловка-пеструшка | 3.56 ± 2.09 (0.117) | −4.28 ± 2.10 (0.067) | NI | 0.51 ± 0.18 (0.017) | 0.34 ± 0.20 (0.114) |
0.553 |
| Большая синица | NI | 0.52 ± 0.23 (0.040) | NI | NI | NI | 0.217 |
| Московка | NI | NI | 0.30 ± 0.21 (0.172) | NI | 0.69 ± 0.21 (0.006) | 0.385 |
| Лиственный лес, импактная зона (1989–2020 гг., n = 32) | ||||||
| Общая | 0.80 ± 0.11 (<0.001) | NI | NI | NI | NA | 0.622 |
| Мухоловка-пеструшка | 0.85 ± 0.10 (<0.001) | NI | −0.18 ± 0.10 (0.084) | NI | NI | 0.697 |
| Обыкновенная горихвостка | 2.89 ± 0.42 (<0.001) | −3.45 ± 0.53 (<0.001) | NI | 0.10 ± 0.10 (0.308) | 0.09 ± 0.21 (0.686) |
0.747 |
| Большая синица | −2.34 ± 0.48 (<0.001) | 2.75 ± 0.48 (<0.001) | 0.24 ± 0.12 (0.049) | NI | NI | 0.586 |
| Московка | NI | 0.49 ± 0.13 (<0.001) | 0.48 ± 0.13 (<0.001) | NI | NI | 0.489 |
| Хвойный лес, фоновая зона (1989–2020 гг., n = 32) | ||||||
| Общая | NI | NI | NI | −0.27 ± 0.18 (0.137) | NA | 0.041 |
| Мухоловка-пеструшка | NI | NI | NI | −0.20 ± 0.18 (0.270) | NI | 0.008 |
| Большая синица | −1.85 ± 0.68 (0.011) | 1.66 ± 0.68 (0.021) | NI | NI | NI | 0.163 |
| Московка | −1.60 ± 0.66 (0.021) | 1.40 ± 0.65 (0.041) | NI | −0.28 ± 0.16 (0.095) | NI | 0.219 |
| Хвойный лес, импактная зона (1990–2020 гг., n = 31) | ||||||
| Общая | −1.37 ± 0.75 (0.079) | 1.58 ± 0.75 (0.045) | 0.18 ± 0.17 (0.304) | NI | NA | 0.119 |
| Мухоловка-пеструшка | 1.80 ± 0.78 (0.029) | −1.22 ± 0.76 (0.118) | 0.16 ± 0.15 (0.299) | NI | 0.53 ± 0.18 (0.006) | 0.357 |
| Обыкновенная горихвостка | 1.13 ± 0.59 (0.063) | −1.98 ± 0.61 (0.003) | 0.13 ± 0.13 (0.320) | NI | 0.39 ± 0.15 (0.018) | 0.531 |
| Большая синица | −2.53 ± 0.61 (<0.001) | 2.89 ± 0.62 (<0.001) | −0.14 ± 0.14 (0.324) | NI | −0.20 ± 0.14 (0.186) | 0.425 |
| Московка | 0.63 ± 0.15 (<0.001) | NI | 0.16 ± 0.15 (0.293) | −0.30 ± 0.16 (0.063) | NI | 0.341 |
Рис. 3.
Многолетняя динамика плотности гнездования мухоловки-пеструшки (черные ромбы и сплошная линия – 1), обыкновенной горихвостки (незакрашенные квадраты и штриховая линия – 2), большой синицы (незакрашенные кружки и штриховая линия – 3) и московки (черные треугольники и линия – 4) в лиственном (а, б, д, е) и хвойном (в, г, ж, з) биотопах фоновой (а, в, д, ж) и импактной (б, г, е, з) зон.

Температуры апреля и мая незначимо возрастали на протяжении всего периода исследований. Наклон (B) линии регрессионной зависимости средней температуры апреля от порядкового номера года составил B = 0.029 ± 0.050 (p = 0.569), мая – B = 0.052 ± 0.034 (p = 0.139). Температура весенних месяцев почти не влияла на плотность дуплогнездников. Лишь в лиственном лесу плотность мухоловки-пеструшки возрастала в годы с более теплым маем в фоновой зоне, а плотность большой синицы и московки возрастала в годы с более теплым апрелем в импактной зоне (см. табл. 3). С увеличением плотности конкурентов плотность мухоловки-пеструшки и горихвостки увеличивалась в хвойном лесу в импактной зоне.
ОБСУЖДЕНИЕ
Общее число видов, заселяющих ИГ, в хвойном лесу было больше, чем в лиственном. Это может быть связано с тем, что в хвойном лесу ИГ занимают не только массовые виды дуплогнездников (мухоловка-пеструшка, обыкновенная горихвостка, большая синица), но и типичные обитатели хвойного леса (московка, поползень), что подтверждают и данные других авторов [36]. Большее число видов, заселяющих ИГ в импактной зоне по сравнению с фоновой, очевидно, обусловлено дефицитом естественных дупел в нарушенном лесу, где древостой разрежен и мало старых деревьев. Более высокая плотность гнездования больших синиц вблизи СУМЗа, вероятно, объясняется синантропностью этого вида: они зимуют в населенных пунктах и предпочитают гнездиться в окрестных лесах [37, 38]. Появление вертишейки в населении дуплогнездников в импактной зоне, вероятно, обусловлено хорошими кормовыми условиями для этого вида. Вертишейки кормятся преимущественно муравьями, обилие и разнообразие которых особенно велико на хорошо прогреваемых территориях c угнетенным древостоем вблизи СУМЗа [39].
Два вида доминировали в сообществе дуплогнездников в районе исследований: мухоловка-пеструшка – в фоновой зоне, а обыкновенная горихвостка – в импактной (до 2012 г.). При этом их плотность по-разному изменялась в разных зонах загрязнения. Мухоловка-пеструшка преобладала в фоновой зоне на протяжении всего периода исследований (см. рис. 2а). В импактной зоне плотность видов изменялась разнонаправленно, что привело к смене доминантов в период стабильно низких промышленных выбросов (см. рис. 3).
Различия динамики плотности мухоловки-пеструшки и обыкновенной горихвостки могут быть связаны с рядом причин. Одна из них – изменения численности видов в пределах их ареалов, расположенных в основном в Европе. Если это так, то динамика их плотности на загрязненной и фоновой территориях, а также на большей части ареалов должна совпадать. Численность популяции мухоловки-пеструшки в Европе умеренно уменьшалась в 1990–2003 гг. [40] и 1990–2016 гг. [41]. В фоновой зоне плотность мухоловки-пеструшки в лиственном лесу также убывала, а в хвойном оставалась на одном уровне, тогда как в импактной зоне она увеличивалась (см. рис. 3). Численность обыкновенной горихвостки в Европе возрастала в 1990–2016 гг. [41], однако ее плотность в импактной зоне неуклонно снижалась после 2002 г. Таким образом, динамика плотности мухоловки-пеструшки и горихвостки в импактной зоне не совпадала с изменениями их численности в пределах видовых ареалов.
Вторая возможная причина различий динамики мухоловки-пеструшки и горихвостки – изменение местообитаний в районе исследований, повлиявшее на привлекательность изучаемых участков для этих видов. Мухоловка-пеструшка и горихвостка имеют разные экологические предпочтения: оба вида гнездятся в дуплах, но горихвостка более пластична и может устраивать гнезда также в пнях, кучах хвороста, постройках человека и других укрытиях [42–44]. Мухоловка-пеструшка предпочитает спелые и средневозрастные древостои, в которых больше дуплистых деревьев [обзор: 34]. В лесных массивах на загрязненных территориях увеличивается площадь, занятая редким и молодым древостоем, которых этот вид избегает. Определенную роль может играть ухудшение кормовой базы в нарушенных местообитаниях [3, 4]. В отличие от мухоловки-пеструшки обыкновенная горихвостка предпочитает осветленные участки леса с угнетенным травяно-кустарничковым ярусом, в том числе нарушенные человеком: гари, вырубки, окрестности жилья человека [42], избегает участков с высоким травостоем и кустарником [45]. Птицы высматривают добычу с присады и совершают прыжки для ее схватывания [46]. Горихвостки кормятся преимущественно на голой поверхности почвы, а также среди низкой травы [45, 47], где добыча более заметна.
Многолетнее воздействие промышленных выбросов привело к деградации лесных экосистем в окрестностях СУМЗа. В импактной зоне древостой разрежен, велика доля сухостоя, травяно-кустарничковый ярус угнетен и представлен несколькими видами, значительные площади заняты устойчивым к загрязнению мхом Pohlia nutans [13]. Увеличение безлесных пространств с угнетенным травостоем в период высоких выбросов явно благоприятствовало заселению обыкновенной горихвосткой ближайших окрестностей СУМЗа. В то же время отмирание древостоя привело к сокращению плотности мухоловки-пеструшки ввиду ухудшения условий гнездования. Сокращение выбросов СУМЗа способствовало началу медленного восстановления нарушенных экосистем: вблизи завода увеличиваются видовое богатство и обилие эпифитных лишайников [14], некоторых групп травянистых растений [48] и почвенной мезофауны [15]. Основной признак восстановления растительного покрова в импактной зоне – увеличение биомассы травостоя за счет Agrostis capillaris [13]. Зарастание злаками моховых дернин вблизи СУМЗа сокращает площадь открытой поверхности земли, что ухудшает условия кормежки для горихвосток, снижая заметность потенциальных жертв на поверхности почвы. В то же время восстановление травостоя, скорее, благоприятно для мухоловки-пеструшки, которая собирает корм с разных субстратов, в том числе с травянистых растений [49]. Увеличение поврежденности листвы берез (показатель биомассы беспозвоночных-фитофагов в кронах деревьев) вблизи СУМЗа в последние годы [18] свидетельствует об улучшении кормовой базы насекомоядных птиц.
Начавшееся после 2010 г. восстановление плотности мухоловки-пеструшки, а также большой синицы и московки в импактной зоне (см. рис. 3) может быть связано и с уменьшением выбросов СУМЗа. Токсическую нагрузку обычно оценивают по концентрациям тяжелых металлов и металлоидов [8]. Токсическое действие микроэлементов проявляется постепенно на протяжении гнездового периода у птиц, осевших на данной территории. Однако микроэлементы составляют лишь 2–8% от массы атмосферных выбросов СУМЗа [8]. Основной компонент выбросов – диоксид серы (>90%), который вызывает раздражение и повреждение слизистых оболочек глаз, дыхательных путей и органов дыхания [50–52]. Его действие проявляется раньше, чем у металлов, – уже в период занятия птицами гнездовых территорий. Высокие концентрации диоксида серы в воздухе в периоды высоких выбросов, возможно, оказывали репеллентное действие на птиц, которое почти прекратилось после 2010 г.
Мы не обнаружили заметного влияния температуры весны на плотность населения дуплогнездников. Увеличение плотности мухоловки-пеструшки в годы с более теплым маем в лиственном лесу фоновой зоны (см. табл. 3) согласуется с данными о положительной связи плотности населения этого вида с температурой в период прилета и занятия гнездовых территорий [33, 34, 53]. Видимо, благоприятные погодные условия в этот период способствуют лучшей выживаемости птиц перед началом гнездования, а также увеличению доли размножающихся птиц [54].
Плотность населения мухоловки-пеструшки и обыкновенной горихвостки в большинстве случаев не была связана с плотностью конкурентов за места гнездования. Эффект конкуренции вряд ли мог проявиться на исследованных участках, так как общая плотность населения не была большой: не менее половины ИГ пустовали. Более того, в хвойном лесу импактной зоны у мухоловки и горихвостки отмечена положительная связь с плотностью конкурентов (см. табл. 3). Это, по-видимому, отражает общий тренд увеличения плотности населения по мере сокращения промышленных выбросов.
ЗАКЛЮЧЕНИЕ
Впервые проанализирован длительный (более 30 лет) ряд ежегодных наблюдений за населением птиц-дуплогнездников в окрестностях крупного медеплавильного завода. Установлены различия между зонами загрязнения, биотопами и периодами с разным уровнем промышленных выбросов по видовому богатству и плотности населения дуплогнездников. Видовое богатство в импактной зоне больше, чем в фоновой. Общая плотность в хвойном лесу меньше, чем в лиственном. Общая плотность населения дуплогнездников вблизи СУМЗа увеличилась за 30-летний период, наиболее заметно в лиственном лесу в 2010–2020 гг., после существенного сокращения промышленных выбросов.
Многолетняя динамика плотности двух самых массовых видов различалась: сокращение промышленных выбросов сопровождалось увеличением плотности мухоловки-пеструшки и уменьшением плотности обыкновенной горихвостки. В результате в импактной зоне произошла смена доминантов: начиная с 2012 г. плотность мухоловки-пеструшки превысила плотность обыкновенной горихвостки, доминировавшей ранее. Различия динамики плотности этих видов, вероятно, связаны с начавшимся восстановлением растительного покрова вблизи завода, благоприятным для мухоловки-пеструшки, но не горихвостки.
Авторы благодарят двух анонимных рецензентов за ценные замечания при подготовке рукописи. Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН. Авторы заявляют об отсутствии конфликта интересов и подтверждают, что в ходе исследования соблюдались применимые этические нормы.
Список литературы
Лебедева Н.В. Экотоксикология и биогеохимия географических популяций птиц. М.: Наука, 1999. 199 с.
Куранов Б.Д. Гнездовая биология птиц в урбанизированном и техногенно загрязненном ландшафте: Автореф. дис. … докт. биол. наук. Томск: ТГУ, 2009. 49 с.
Eeva T., Lehikoinen E., Pohjalainen T. Pollution-related variation in food supply and breeding success in two hole-nesting passerines // Ecology. 1997. V. 78. P. 1120–1131.
Eeva T., Ryömä M., Riihimäki J. Pollution related changes in diets of two insectivorous passerines // Oecologia. 2005. V. 145. P. 629–639.
Eeva T., Klemola T. Variation in prevalence and intensity of two avian ectoparasites in a polluted area // Parasitology. 2013. V. 140. P. 1384–1393.
Бельский Е.А., Лугаськова Н.В., Карфидова А.А. Репродуктивные показатели мухоловки-пеструшки Ficedula hypoleuca Pall. и морфофизиологические характеристики ее птенцов в условиях техногенного загрязнения местообитаний // Экология. 2005. № 5. С. 362–369. [Belskii E.A., Lugas’kova N. V., Karfidova A.A. Reproductive parameters of adult birds and morphophysiological characteristics of chicks in the pied flycatcher (Ficedula hypoleuca Pall.) in technogenically polluted habitats // Russ. J. Ecol. 2005. V. 36. № 5. P. 342–350.]
Бельский Е.А., Бельская Е.А. Структура рациона птенцов мухоловки-пеструшки Ficedula hypoleuca в условиях промышленного загрязнения // Экология. 2009. № 5. С. 363–371. [Belskii E.A., Belskaya E.A. Composition of pied flycatcher (Ficedula hypoleuca Pall.) nestling diet in industrially polluted area // Russ. J. Ecol. 2009. V. 40. № 5. P. 342–350.]
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почвы в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024.
Зверев В.Е. Смертность и возобновление березы извилистой в зоне воздействия медно-никелевого комбината в период значительного сокращения выбросов: результаты 15-летнего мониторинга // Экология. 2009. № 4. С. 271–277. [Zverev V.E. Mortality and recruitment of mountain birch (Betula pubescens ssp. czerepanovii) in the impact zone of a copper-nickel smelter in the period of significant reduction of emissions: the results of 15-year monitoring // Russ. J. Ecol. 2009. V. 40. № 4. P. 254–260.]
Черненькова Т.В., Бочкарев Ю.Н. Динамика еловых насаждений Кольского Севера в условиях воздействия природно-антропогенных факторов среды // Журн. общ. биол. 2013. Т. 74. № 4. С. 283–303.
Копцик Г.Н., Копцик С.В., Смирнова И.Е. и др. Реакция лесных экосистем на сокращение атмосферных промышленных выбросов в Кольской Субарктике // Журн. общ. биол. 2016. Т. 77. № 2. С. 145–163.
Vávrová E., Cudlin O., Vavřiček D., Cudlin P. Ground vegetation dynamics in mountain spruce (Picea abies (L.) Karsten) forests recovering after air pollution stress impact // Plant Ecology. 2009. V. 205. № 2. P. 305–321.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V., Bergman I.E. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Russ. J. Ecol. 2014. V. 45. № 6. P. 498–507.]
Михайлова И.Н. Начальные этапы восстановления сообществ эпифитных лишайников после снижения выбросов медеплавильного завода // Экология. 2017. № 4. С. 277–281. [Mikhailova I.N. Initial stages of recovery of epiphytic lichen communities after reduction of emissions from a copper smelter // Russ. J. Ecol. 2017. V. 48. № 4. P. 335–339.]
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148. [Vorobeichik E.L., Ermakov A.I., Grebennikov M.E. Initial stages of recovery of soil macrofauna communities after reduction of emissions from a copper smelter // Russ. J. Ecol. 2019. V. 50. № 2. P. 146–160.]
Babin-Fenske J., Anand M. Patterns of insect communities along a stress gradient following decommissioning of a Cu-Ni smelter // Environmental Pollution. 2011. V. 159. P. 3036–3043.
Braun S.D., Jones T.H., Perner J. Shifting average body size during regeneration after pollution – a case study using ground beetle assemblages // Ecological Entomology. 2004. V. 29. P. 543–554.
Бельская Е.А. Динамика трофической активности филлофагов березы в период снижения атмосферных выбросов медеплавильного завода // Экология. 2018. № 1. С. 74–80. [Belskaya E.A. Dynamics of trophic activity of leaf-eating insects on birch during reduction of emissions from the Middle Ural Copper Smelter // Russ. J. Ecol. 2018. V. 49. № 1. P. 87–92.]
Воробейчик Е.Л., Нестеркова Д.В. Техногенная граница распространения крота в районе воздействия медеплавильного завода: смещение в период сокращения выбросов // Экология. 2015. № 4. С. 308–308. [Vorobeichik E.L., Nesterkova D.V. Technogenic boundary of the mole distribution in the region of copper smelter impacts: shift after reduction of emissions // Russ. J. Ecol. 2015. V. 46. № 4. P. 377–380.]
Катаев Г.Д. Воздействие выбросов медно-никелевого предприятия на состояние популяций и сообществ мелких млекопитающих Кольского полуострова // Nature Conservation Research. Заповедная наука. 2017. Т. 2. Приложение 2.
Мухачева С.В. Многолетняя динамика концентрации тяжелых металлов в корме и организме рыжей полевки (Myodes glareolus) в период снижения выбросов медеплавильного завода // Экология. 2017. № 6. С. 461–471. [Mukhacheva S.V. Long-term dynamics of heavy metal concentrations in the food and liver of bank voles (Myodes glareolus) in the period of reduction of emissions from a copper smelter // Russ. J. Ecol. 2017. V. 48. № 6. P. 559–568.]
Eeva T., Lehikoinen E. Recovery of breeding success in wild birds // Nature. 2000. V. 403. № 6772. P. 851–852.
Eeva T., Lehikoinen E. Long-term recovery of clutch size and egg shell quality of the pied flycatcher (Ficedula hypoleuca) in a metal polluted area // Environmental Pollution. 2015. V. 201. P. 26–33.
Berglund Å.M.M., Ingvarsson P.K., Danielsson H., Nyholm N.E.I. Lead exposure and biological effects in pied flycatchers (Ficedula hypoleuca) before and after the closure of a lead mine in northern Sweden // Environmental Pollution. 2010. V. 158. № 5. P. 1368–1375.
Berglund Å.M.M., Nyholm N.E.I. Slow improvements of metal exposure, health- and breeding conditions of pied flycatchers (Ficedula hypoleuca) after decreased industrial heavy metal emissions // Science of the Total Environment. 2011. V. 409. № 20. P. 4326–4334.
Feriancova-Masarova Z., Kalivodova E., Ferianc O. Hniezdne ornitocenozy biotopov okolia hlinikarne v Žiari nad Hronom po dvadsiatich rokoch // Biologia (Bratislava). 1985. V. 40. № 2. P. 199–209.
Koskimies P. Birds as a tool in environmental monitoring // Ann. Zool. Fennici. 1989. V. 26. P. 153–166.
Книстаутас А.Ю. Влияние промышленного загрязнения воздуха на популяции лесных птиц и их использование как биоиндикаторов: Автореф. дис. … канд. биол. наук. М., 1982. 22 с.
Möckel R. Häufigkeitsveränderungen höhlenbrütender Singvögel des Fichtenwaldes während des “Waldsterbens” im Westerzgebirge // Zoologische Jahrbücher. Abteilung für Systematik, Ökologie und Geographie der Tiere. 1992. V. 119. № 3. P. 437–492.
Krištín A., Žilinec M. Nest box occupancy and breeding success of hole-nesting passerines at various conditions in beech forests // Folia Zoologica. 1997. V. 46. № 3. P. 229–241.
Eeva T., Koivunen V., Hakkarainen H. Population densities of forest birds in a heavy metal pollution gradient // Avian Science. 2002. V. 2. № 4. P. 227–236.
Бельский Е.А., Ляхов А.Г., Коровин В.А., Вурдова И.Ф. Сообщества птиц, заселяющих искусственные гнездовья, в градиенте природных и антропогенных экологических факторов на Среднем Урале // Сибирский экологич. журн. 2002. Т. 9. № 4. С. 417–423.
Sokolov L.V. Spring ambient temperature as an important factor controlling timing of arrival, breeding, post-fledging dispersal and breeding success of Pied Flycatcher Ficedula hypoleuca in Eastern Baltic // Avian Ecology and Behaviour. 2000. V. 5. P. 79–104.
Артемьев А.В. Популяционная экология мухоловки-пеструшки в северной зоне ареала. М.: Наука, 2008. 267 с.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4. P. 1–9.
Зимин В.Б. Опыт привлечения дуплогнездников в таежные леса Карелии // Русский орнитологич. журн. 2018. Т. 27. № 1590. С. 1569–1571.
Смирнов О.П., Тюрин В.М. К биологии размножения большой синицы в Ленинградской области // Орнитология. 1981. Вып. 16. С. 185–188.
Мальчевский А.С., Пукинский Ю.Б. Птицы Ленинградской области и сопредельных территорий. Л.: ЛГУ, 1983. Т. 2. 504 с.
Belskaya E., Gilev A., Belskii E. Ant (Hymenoptera, Formicidae) diversity along a pollution gradient near the Middle Ural copper smelter, Russia // Environmental Science and Pollution Research. 2017. V. 24. № 11. P. 10 768–10 777.
Gregory R.D., Vorisek P., Van Strien A. et al. Population trends of widespread woodland birds in Europe // Ibis. 2007. V. 149. P. 78–97.
Schulze E.D., Craven D., Durso A.M. et al. Positive association between forest management, environmental change, and forest bird abundance // Forest Ecosystems. 2019. V. 6. № 1. P. 3.
Menzel H. Der Gartenrotschwanz. Ziemsen, 1984. 438 S.
Cramp S., Brooks D.J. (eds.). Handbook of the birds of Europe, the Middle East and North Africa. The Birds of the Western Palearctic. 1992. V. 6. Warblers. Oxford: Oxford University Press, 728 p.
Cramp S., Perrins C.M. (eds.). Handbook of the Birds of Europe, the Middle East and North Africa. The Birds of the Western Palearctic. 1993. V. 7. Flycatchers to Shrikes. Oxford: Oxford University Press, 577 p.
Sedláček O., Fuchs R., Exnerová A. Redstart Phoenicurus phoenicurus and black redstart P. ochruros in a mosaic urban environment: neighbours or rivals? // J. of Avian Biology. 2004. V. 35. № 4. P. 336–343.
Martinez N., Jenni L., Wyss E., Zbinden N. Habitat structure versus food abundance: the importance of sparse vegetation for the common redstart Phoenicurus phoenicurus // J. of Ornithology. 2010. V. 151. № 2. P. 297–307.
Симкин Г.Н. Певчие птицы. М.: Лесная пром-сть, 1990. 399 с.
Трубина М.Р. Уязвимость видов травяно-кустарничкового яруса к загрязнению выбросами медеплавильного завода: роль различий в способе распространения диаспор // Экология. 2020. № 2. С. 90–100. [Trubina M.R. Vulnerability to copper smelter emissions in species of the herb-dwarf shrub layer: role of differences in the type of diaspore dispersal // Russ. J. Ecol. 2020. V. 51. № 2. P. 107–117.]
Иноземцев А.А. Роль насекомоядных птиц в лесных биоценозах. Л.: ЛГУ, 1978. 264 с.
Lillie R.J. Air pollutants affecting the performance of domestic animals: a literature review. Washington, D.C.: US Department of Agriculture, 1970. Agriculture Handbook № 380. 109 p.
Gorriz A., Llacuna S., Durfort M., Nadal J. A study of the ciliar tracheal epithelium on passerine birds and small mammals subjected to air pollution: ultrastructural study // Archives of Environmental Contamination and Toxicology. 1994. V. 27. № 1. P. 137–142.
Sanderfoot O.V., Holloway T. Air pollution impacts on avian species via inhalation exposure and associated outcomes // Environmental Research Letters. 2017. V. 12. № 8. P. 083 002.
Järvinen A. Patterns and causes of long-term variation in reproductive traits of the pied flycatcher Ficedula hypoleuca in Finnish Lapland // Ornis Fennica. 1989. V. 66. P. 24–31.
Паевский В.А. Демография птиц. Л.: Наука, 1985. 285 с.
Дополнительные материалы отсутствуют.


