Экология, 2021, № 4, стр. 289-297
Многолетняя динамика зараженности щуки паразитами Triaenophorus crassus и T. nodulosus (Plathelminthes, Cestoda) в Рыбинском водохранилище: влияние гидростроительства и потепления климата
А. Е. Жохов a, b, *, М. Н. Пугачева a
a Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл, пос. Борок, Россия
b Лаборатория AquaBioSafe, Тюменский государственный университет
625003 Тюмень, ул. Володарского, 6, Россия
* E-mail: zhokhov@ibiw.ru
Поступила в редакцию 25.03.2020
После доработки 02.11.2020
Принята к публикации 20.11.2020
Аннотация
Изучена многолетняя динамика (период наблюдений превышает 70 лет) зараженности щуки цестодами Triaenophorus crassus и T. nodulosus в Рыбинском водохранилище (р. Волга) в сравнительном аспекте. Цестода T. crassus – вид-вселенец, проникший в водохранилище вместе с ряпушкой Coregonus albula (вторым промежуточным хозяином) из оз. Белое; T. nodulosus – местный вид, развивающийся с участием окуня в качестве второго промежуточного хозяина. Потепление климата в Рыбинском водохранилище выразилось в устойчивом росте средней температуры воды. Это привело к постепенному снижению зараженности щуки цестодой T. crassus в результате нарушения комплекса сложных экологических связей между паразитом и его хозяевами – снижение численности крупных щук, колебания уровня водохранилища, массовая гибель ряпушки в годы с аномально жарким летом и чередованием у этого короткоциклового вида (возраст от 1+ до 3+) урожайных и неурожайных поколений. Многолетняя динамика зараженности щуки T. nodulosus характеризуется стабильно высокими показателями и их незначительными колебаниями. Популяция окуня Рыбинского водохранилища сохраняет высокую численность, устойчивый возрастной состав, что способствуют высокой зараженности T. nodulosus как окуня, так и щуки. Цестода T. crassus встречается только у крупных щук (длиной 30 см и более), с возрастом зараженность увеличивается; T. nodulosus паразитирует преимущественно у молодых щук, начиная с сеголеток, а зараженность крупных щук снижается.
Глобальное потепление и инвазивные виды входят в число наиболее важных угроз для экосистем, но обычно рассматриваются независимо друг от друга. Ожидается, что потепление климата существенно повлияет на биоразнообразие, вызывая изменения в фенологии, генетическом составе и ареалах видов, на взаимодействие видов и экосистемные процессы в целом [1, 2]. Исследования, посвященные связи между этими двумя угрозами, в основном сосредоточены на идее о том, что виды из низких широт, которые адаптированы к более высокой температуре, чем в экосистемах высоких широт, будут лучше приспособлены к условиям в высоких широтах при повышении температуры [3‒5]. Напротив, северные холодолюбивые виды, продвинувшиеся на юг в период до потепления климата, при повышении температуры будут проявлять меньшую приспособленность к новым условиям.
В акватории Рыбинского водохранилища потепление климата выразилось по целому ряду признаков. В акватории водохранилища в период потепления среднегодовая температура воздуха повысилась с 3.6 до 4.2°С. До 2000 г. температура интенсивно росла в холодный период, в 2000–2013 гг. ее повышение отмечено также и в теплый период [6]. Увеличение температуры воздуха в зимние месяцы способствовало более раннему очищению акватории водохранилища ото льда. До 1976 г. ледовый покров исчезал в среднем 3 мая, в период с 1976 г. по 2010 г. – 30 апреля, в последнее десятилетие – 26 апреля. Таким образом, средняя продолжительность безледного периода увеличилась с 193 до 213 дней [7]. Потепление климата в Рыбинском водохранилище нашло отражение в устойчивом росте средней температуры воды, которая повысилась на 3.1°С за 30 лет наблюдений (1976–2005 гг.) [7, 8].
Основную роль в водном балансе водохранилища играет поверхностный сток, дающий 93.6% воды, осадки на зеркало водохранилища дают только 6.4%. Потепление климата привело к изменению циркуляционных процессов в атмосфере и стока рек, подверженных воздействию климатических факторов. В 1976–2010 гг. изменилось внутригодовое перераспределение стока рек бассейна водохранилища – зимний приток увеличился на 20%, а объем весеннего половодья снизился на 3% [7].
В результате потепления климата биота Рыбинского водохранилища обогатилась 15 видами южных вселенцев, из которых 4 вида относятся к зоопланктону [9], 7 – к бентосу [10] и 4 – к рыбам [11].
К числу паразитов, расширивших свой ареал в бассейне Волги в результате гидростроительства, относится цестода Triaenophorus crassus Forel, 1868, имеющая гетероксенный жизненный цикл: первый промежуточный хозяин – копеподы, второй – лососевидные рыбы, окончательный хозяин – щука [12]. У цестоды T. nodulosus такой же жизненный цикл, как и у T. crassus, только вторым промежуточным хозяином для нее служит в основном окунь. Этот вид встречается по всему бассейну Волги – его обширный ареал совпадает с ареалом щуки. Ареал T. crassus занимает северную часть ареала щуки [12].
В бассейне Волги T. crassus обитал в самой северной его части: в оз. Белое [13] и притоках р. Камы (реки Вятка и Чусовая) [14, 15]. В Рыбинское водохранилище эта цестода проникла из оз. Белое через р. Шексну вместе с европейской ряпушкой Coregonus albula, где была впервые обнаружена в 1947 г. [16], однако немного ранее (1943 и 1946 гг.) T. crassus был найден выше и ниже Рыбинского водохранилища [17]. Расселяясь в южном направлении, ряпушка достигла Саратовского водохранилища, в котором сейчас является редким видом [18]. Самая южная точка в Волге, куда до начала потепления климата проникла цестода T. crassus, – Горьковское водохранилище (р-он г. Волгореченска), где паразит впервые найден в 1977 г. [19, 20]. Есть информация о находке у щуки одного червя T. crassus у пос. Климовка (сейчас Саратовское водохр.) [21], но эти данные вызывают сомнения. Европейская ряпушка и цестода T. crassus – представители арктического пресноводного комплекса.
Цель настоящей работы – анализ многолетней динамики зараженности щуки цестодами T. crassus и T. nodulosus в Рыбинском водохранилище в связи с гидростроительством и потеплением климата, а также оценка возрастной динамики зараженности щуки этими цестодами в сравнительном аспекте.
МАТЕРИАЛ И МЕТОДЫ
Материалом для работы послужили архивные данные Лаборатории экологической паразитологии ИБВВ РАН (пос. Борок) по зараженности щук цестодами за период с 1965 г. по 1981 г. (собраны Б.И. Куперманом), а также данные авторов за период с 1988 г. по 2019 г. Общий период наблюдений превышает 70 лет (с 1943 г. по 2019 г.) с некоторыми перерывами и охватывает весь период существования Рыбинского водохранилища. Для оценки многолетней динамики зараженности щук цестодами T. crassus и T. nodulosus учитывали крупных рыб со стандартной длиной тела 483 ± 83 мм (среднее ± SD, 345–970 мм). Объемы выборок и размер рыб по годам приведены в табл. 1. Для оценки размерной динамики зараженности щук этими паразитами рыбы были разделены на 7 групп по длине тела – от сеголеток до самых крупных рыб. Всего использованы данные по зараженности 837 щук. Зараженность рыб оценивали по экстенсивности инвазии (%) (prevalence), индексу обилия (mean abundance) и интенсивности инвазии (intensity of infection, range). Все данные относятся к Волжскому плесу водохранилища (район пос. Борок и Брейтово). Данные по температуре воды Рыбинского водохранилища с 1947 г. по 2017 г. за июль, август и май–октябрь предоставлены Рыбинской гидрометеообсерваторией.
Таблица 1.
Количество и размер щук из Рыбинского водохранилища, исследованных на зараженность цестодами T. crassus и T. nodulosus
| Пока-затели | Годы | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1943* | 1946* | 1947** | 1948** | 1956–1958*** | 1965 | 1966 | 1967 | 1968 | 1969 | 1970 | 1971 | 1972 | 1973 | 1974 | |
| n | 15 | 15 | 15 | 20 | 102 | 36 | 53 | 31 | 6 | 39 | 50 | 22 | 31 | 39 | 28 |
| l ± SD | – | – | – | – | 47 | 42 ± ± 5.3 | 44 ± ± 6.4 |
45.5 ± ± 6.3 |
44 ± ± 7.4 |
46 ± ± 6.5 |
47.6 ± ± 9.3 |
51 ± 9 | 44 ± ± 3.4 |
45 ± ± 5.6 |
54 ± ± 11.6 |
| Годы | |||||||||||||||
| 1975 | 1976 | 1977 | 1978 | 1979 | 1981 | 1988 | 1990 | 1992 | 1999 | 2006 | 2010 | 2012 | 2018 | 2019 | |
| n | 18 | 45 | 38 | 51 | 21 | 26 | 19 | 23 | 15 | 10 | 13 | 15 | 16 | 12 | 13 |
| l ± SD | 51 ± ± 5.4 |
49.7 ± ± 10 |
48 ± ± 6.5 |
50 ± ± 7.8 |
48 ± ± 5.6 |
52 ± 6 | 54 ± ± 13.5 |
50.5 ± ± 10 |
58 ± ± 7.8 |
49 ± 6 | 56 ± ± 6.5 |
51 ± ± 7.1 |
47 ± ± 7.1 |
57 ± ± 5.7 |
49 ± ± 5.1 |
Индексы обилия паразитов сравнивали с помощью критерия Манна-Уитни (U-test), экстенсивность инвазии – по критерию Пирсона χ2 (анализ таблиц сопряженности). Для сравнения средней температуры воды использовали метод однофакторного дисперсионного анализа (ANOVA). Расчеты выполнены с использованием программы STATISTICA v 7.0.
РЕЗУЛЬТАТЫ
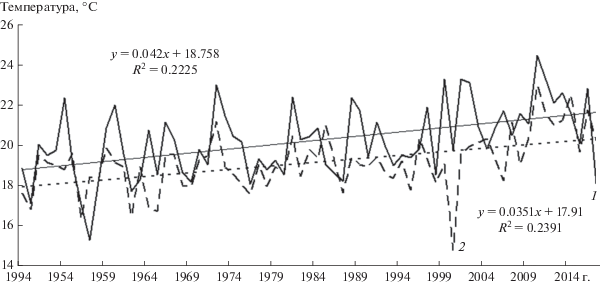
Динамика температуры воды. Для анализа динамики температуры воды весь период наблюдений (1947–2017 гг.) разбили на три условных десятилетних периода: 1) до начала потепления (1949–1958 гг.); 2) начало потепления с устойчивым ростом температуры (1976–1985 гг.) и 3) интенсивный рост температуры (2008–2017 гг.). Динамика средней температуры воды за весь теплый сезон c мая по октябрь за три десятилетних периода выглядела следующим образом: первый и второй периоды (13.5 и 14.0°С) по температуре не отличались (F = 1.98; p = 0.176); второй и третий (14.0 и 15.8°С) отличались существенно (F = 28.6; p < 0.001); еще большие различия были между первым и третьим периодами (13.5 и 15.8°С) (F = 51.7; p < 0.001).
Июльская температура воды за первый и второй периоды (18.7 и 19.7°С) также не отличалась (F = 1.73; p = 0.204); между вторым и третьим периодами наблюдались температурные различия (19.7 и 21.8°С) (F = 8.95; p = 0.008) и ещe большие различия были между периодами до начала потепления и интенсивного роста температуры (18.7 и 21.8°С) (F = 13.4; p = 0.002). Августовская температура воды показала такую же динамику: первый и второй периоды (18.4 и 19.1°С) не отличались (F = 2.32; p = 0.145); второй и третий периоды имели отличия (19.1 и 21.0°С) (F = 13.7; p = 0.002), также как первый и третий (18.4 и 21.0°С) (F = 25.9; p < 0.001). Эти данные за 69 лет наблюдений показывают отчетливый тренд в сторону роста средней температуры воды в Рыбинском водохранилище как за самые теплые месяцы (июль, август), так и за весь теплый сезон (май–октябрь) (см. рис. 4).
Размерная динамика зараженности. Цестода T. nodulosus заражает щуку на первом году жизни, как только переходит к хищничеству. Уже в августе–сентябре у сеголеток щуки в кишечнике встречаются молодые цестоды. Экстенсивность инвазии щук быстро возрастает, и щуки крупнее 30 см заражены на 90–100%. Индекс обилия максимален у щук с длиной тела 40–59 см, у более крупных рыб он снижается (рис. 1). Цестода T. crassus впервые появляется у щук с длиной тела не менее 30 см. С увеличением размеров рыб их зараженность возрастает и достигает максимальных значений у самых крупных особей (см. рис. 1).
Рис. 1.
Размерная динамика зараженности щуки цестодой Triaenophorus nodulosus (серые столбики) и T. crassus (черные столбики); а – экстенсивность инвазии, %; б – индекс обилия (экз.). Цифры в серых столбиках – объем выборки щук.

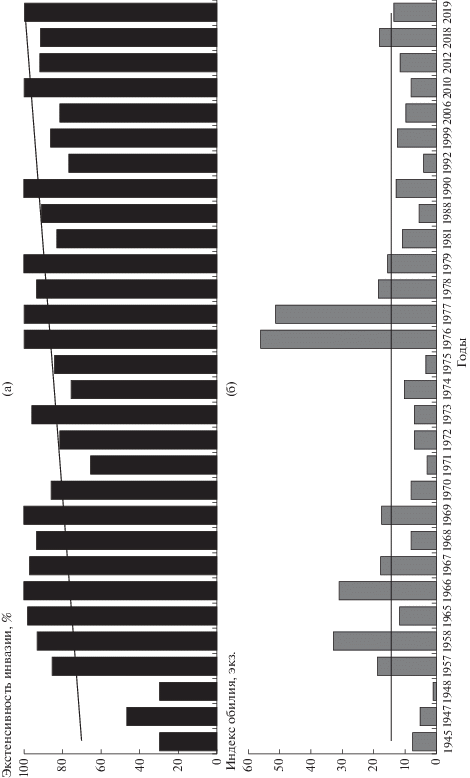
Многолетняя динамика зараженности. Зараженность щуки T. crassus в начальные годы существования водохранилища (1947–1948 гг.) была самой высокой за весь период наблюдений, однако в дальнейшем произошло ее снижение (рис. 2). В 1956–1958 гг. Н.А. Изюмова [22, 23] исследовала 102 крупные щуки из разных участков Рыбинского водохранилища и не обнаружила у них T. crassus. С 1966 г. по 1971 г. наблюдается подъем зараженности щуки T. crassus и вновь резкий спад с 1975 г. по 1978 г. С конца 1980-х годов до 2012 г. отмечен продолжительный, но невысокий подъем зараженности, а с 2018 г. снова произошло ее снижение. Общая многолетняя динамика зараженности щуки T. crassus имеет отчетливый тренд в сторону снижения по экстенсивности инвазии ($\chi _{{{\text{1966, 2012}}}}^{2}$ = 5.75, df = 1, p = 0.019) и индексу обилия (U1966, 2012 = 284, p = 0.046).
Рис. 2.
Многолетняя динамика зараженности щуки цестодой T. crassus в Рыбинском водохранилище: а – экстенсивность инвазии; б – индекс обилия.
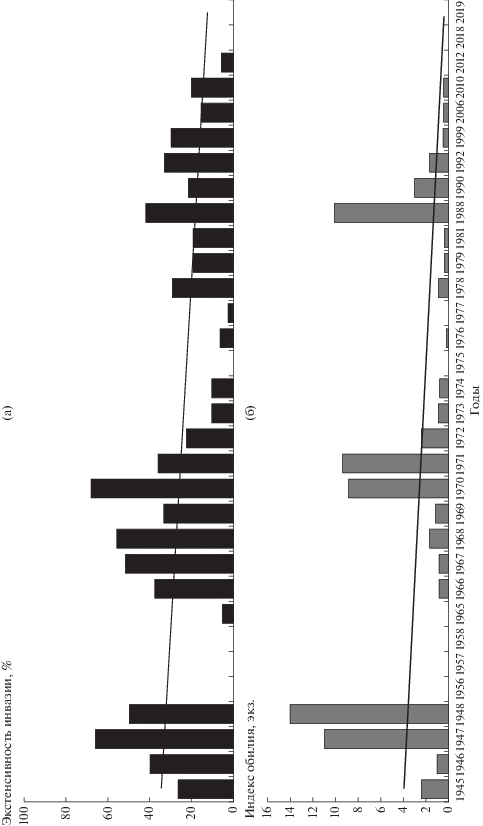
Многолетняя динамика зараженности щуки цестодой T. nodulosus выглядит иначе по сравнению с T. crassus. В 1947 и 1948 гг. зараженность щук T. nodulosus была невысокой, но в дальнейшем быстро выросла (рис. 3). Экстенсивность инвазии с 1965 г. по 2019 г. сохранялась высокой (80–100%), снижаясь лишь в отдельные годы до 60–70%. Индекс обилия в среднем не превышал 20 экз. на рыбу, хотя в отдельные годы (1966, 1976, 1977) резко возрастал до 30–50 экз. на рыбу (см. рис. 3). В целом за весь период наблюдений сохранялся стабильно высокий уровень зараженности щуки T. nodulosus без существенных колебаний, что подтверждается отсутствием значимых отличий как по экстенсивности инвазии ($\chi _{{{\text{1965, 2019}}}}^{2}$ = 0.16, df = 1, p = 0.698), так и индексу обилия (U1965, 2019 = 496, p = 0.638).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Цестода T. crassus как вид-вселенец в Рыбинском водохранилище всегда была малочисленным паразитом щуки по сравнению с T. nodulosus. По нашим данным, T. crassus встречается только у крупных щук (длиной 30 см и более) и с возрастом зараженность увеличивается. Объясняется это тем, что ряпушка (второй промежуточный хозяин T. crassus) как пелагический вид держится в толще воды вдали от берегов. Крупные щуки после нереста избегают хорошо прогретых мелководий и уходят на глубоководные участки водохранилища, где температура воды ниже [24]. Ряпушка – представитель арктического комплекса, вид холодолюбивый, также избегает теплых мелководий: мелкие особи держатся в поверхностных слоях воды, крупные особи, хуже переносящие летний прогрев воды, обитают в придонных слоях воды [25]. Зараженность ряпушки плероцеркоидами T. crassus с возрастом увеличивается. По данным Б.И. Купермана [26], в оз. Белое ряпушка в возрасте 1 года была заражена на 11%, в возрасте 3–4 лет – на 69%. Роль ряпушки в питании щуки невелика [24], однако в отдельные годы спектр предпочитаемых жертв может меняться. Преимущественное заражение T. crassus именно крупных щук ранее отмечено и другими авторами [20, 27].
Рис. 4.
Многолетние изменения средней температуры воды Рыбинского водохранилища: температура поверхностного слоя в июле (1) и августе (2).
Зараженность окуня плероцеркоидами T. nodulosus с увеличением возраста сначала растет, а потом снижается у крупных рыб. Наиболее сильно заражены молодые окуни в возрасте от 0+ до 2+ [28]. Мелкие щуки-сеголетки (длиной 10–20 см) и молодые щуки в летние месяцы постоянно держатся в прибрежной зоне на глубинах 1–1.5 м, где интенсивно питаются молодью различных видов рыб, при этом основу их питания составляет молодь окуня, в том числе сеголетки (42−73%) [24]. Все эти факторы способствуют очень раннему и сильному заражению щук T. nodulosus. Крупные щуки (длиной 70–100 см), обитающие в глубоководной зоне, переходят на потребление крупной добычи [24], что приводит к снижению их зараженности T. nodulosus.
Причиной появления европейской ряпушки в Рыбинском водохранилище стало изменение гидрологического режима этого участка Волги и превращение его в слабопроточное озеро. Только после создания водохранилища ряпушка как озерный вид нашла здесь для себя подходящие условия обитания, однако ее численность никогда не достигала промыслового уровня [25]. Многолетняя динамика зараженности щуки цестодой T. crassus характеризуется периодическими подъемами и спадами, что обусловлено колебаниями численности ряпушки – ее промежуточного хозяина.
К факторам, лимитирующим численность ряпушки, относятся морфометрия и уровенный режим водохранилища, а также температура [25]. Водохранилище имеет очень большие площади мелководий. Ряпушка откладывает икру осенью на чистых, незаиленных песчаных и каменистых грунтах. Ежегодно с октября по март происходит понижение уровня водохранилища на 3–3.5 м, осушаются пригодные для нереста ряпушки субстраты, что приводит к дефициту нерестовых площадей. Поэтому для многолетней динамики численности ряпушки характерны резкие колебания, обусловленные чередованием урожайных и неурожайных поколений. Возрастной и размерный состав ряпушки Рыбинского водохранилища в связи с коротким жизненным циклом (возраст от 1+ до 3+) постоянно изменяется: в отдельные годы популяция состоит то почти из одних сеголеток, то из двухлеток с высокой долей трехлеток.
Как холодолюбивый вид ряпушка чувствительна к повышению температуры воды. Потепление климата в Рыбинском водохранилище выразилось в устойчивом росте температуры воды с 1976 г. (рис. 4), который стал наиболее интенсивным в 2000-е годы [7]. Средняя температура воды водохранилища повысилась на 3.1°С за 30 лет наблюдений (1976–2005 гг.). Наибольшая скорость повышения приходилась на июль [8]. Средние многолетние значения температуры воды за июль–август заметно выросли: в 1951–1960-е гг. они составляли 19.6–18.9°C, в 1981–1990-е гг. – 20.0–18.7°C, в 2001–2010-е гг. – 21.7–19.8°C [7]. Годы с высокой летней температурой губительны для ряпушки. После аномально жаркого лета 1972 г. (температура воды в июле–августе была 23 и 21.2°C соответственно) наблюдалась массовая гибель ряпушки [25], что привело к снижению зараженности щуки T. crassus в последующие годы (см. рис. 2). Подобная картина, вероятно, наблюдалась после жары 2010 г. (температура воды в июле–августе была 24.5–23°C) и 2011 г. (23.3–21.6°C) (см. рис. 2). Однако полное отсутствие T. crassus у щуки, по крайней мере в Волжском плесе водохранилища в 1956–1958 гг. (см. рис. 2), не связано с температурным фактором, так как эти годы не были аномально жаркими. В годы с высокой температурой, когда прогревается вся толща воды, цветут сине-зеленые водоросли и возникает дефицит кислорода, погибают наиболее крупные особи ряпушки [25], сильно зараженные личинками T. crassus.
Причина резких колебаний зараженности щуки T. crassus может быть связана не только с гибелью ряпушки в аномально жаркие годы, но и в большей степени с непостоянством возрастного состава ее популяции. Когда в популяции преобладают слабо зараженные сеголетки, зараженность щуки T. crassus будет снижаться, так как нарушается передача паразита по пищевой цепи. Еще одна причина этого – снижение численности крупных щук и преобладания особей младших возрастных групп. По данным ихтиологов, важным фактором снижения численности крупных щук в водоеме является троллинг – способ любительского лова, эффективно применяемый для массового отлова щук на больших глубинах. И все же основной причиной изменения размерно-возрастной структуры популяции щуки в 2000-е гг. считается повышение температуры воды, вызванное климатическими изменениями [29].
Многолетняя динамика зараженности щуки T. nodulosus характеризуется стабильностью и незначительными колебаниями. В период наполнения водохранилища (1941–1947 гг.), когда экологические и трофические связи между компонентами биоценоза только формировались, зараженность щуки была низкой (см. рис. 3). В это время взрослая форма T. nodulosus паразитировала, кроме щуки, у судака и налима; вторым промежуточным хозяином T. nodulosus, помимо окуня, были ерш, судак, налим и уклейка [16]. В 1960-е годы окончательным хозяином T. nodulosus осталась только щука, круг промежуточных хозяев сократился до трех видов – окунь, ерш, налим [22]. Позднее и до настоящего времени основным вторым промежуточным хозяином T. nodulosus в водохранилище служит окунь, крайне редко – ерш. Популяция окуня Рыбинского водохранилища сохраняет стабильно высокую численность, а ее дифференциация на две экологические формы (прибрежную и глубинную) – залог устойчивого многолетнего функционирования популяции [30]. Стабильный возрастной состав и численность популяции окуня способствуют неизменно высокой зараженности T. nodulosus как окуня, так и щуки.
Многолетняя динамика зараженности щуки цестодой T. crassus характеризуется резкими подъемами и спадами и имеет отчетливый тренд в сторону снижения. В 2018 и 2019 гг. мы не нашли в Волжском плесе у щук этой цестоды, что может быть свидетельством очередного резкого снижения зараженности щуки или исчезновения цестоды из водохранилища. В водохранилищах, расположенных ниже Рыбинского, T. crassus, вероятно, исчез, учитывая низкую численность ряпушки в них [18, 31]. “Синантропный” очаг триэнофороза, вызываемого T. crassus, существовал в Горьковском водохранилище: он поддерживался не ряпушкой, а форелью, сбегавшей из садков Волгореченского рыбхоза [20]. Современная информация об этом очаге отсутствует. Рассматривая общую ситуацию с T. crassus в водохранилищах Волги, можно сказать, что этот северный вселенец и ранее не имел широкого распространения в Волге, а сейчас “сдает завоеванные ранее позиции” и отступает на север. Состояние популяции второго вида (T. nodulosus) остается стабильным, что подтверждается высокой зараженностью щуки за длительный период наблюдений.
ЗАКЛЮЧЕНИЕ
Проведенное нами исследование многолетней (более 70 лет) динамики зараженности щуки двумя видами цестод в Рыбинском водохранилище выявило отчетливый тренд снижения зараженности одним из них – Triaenophorus crassus. Этот паразит – северный вселенец, который проник в водохранилище в начальный период его наполнения вместе со своим промежуточным хозяином – ряпушкой. Второй паразит T. nodulosus – местный вид, развивающийся с участием окуня, сохраняет стабильно высокие показатели зараженности щуки без резких колебаний. Появление T. crassus в водохранилище обусловлено зарегулированием стока и превращением данного участка Волги в слабопроточное озеро. Причина резких колебаний зараженности щуки цестодой T. crassus и ее общего постепенного снижения связана с глобальным потеплением, которое в Рыбинском водохранилище выразилось в устойчивом росте средней температуры воды на 3.1°С за 30 лет наблюдений. Для T. crassus следствием глобального потепления стало нарушение комплекса сложных экологических связей между паразитом и его хозяевами (снижение численности крупных щук, колебания уровня водохранилища, массовая гибель ряпушки и чередование ее урожайных и неурожайных поколений), в результате которого вид, вероятно, выпал из фауны водохранилища.
Работа выполнена в рамках государственного задания Минобрнауки (АААА-А18-118012690100-5), а также при поддержке Правительства Тюменской области в рамках проекта Западно-Сибирского межрегионального научно-образовательного центра № 89-ДОН (2).
Авторы заявляют об отсутствии конфликта интересов. Были соблюдены национальные и внутриорганизационные принципы планирования и проведения исследований с использованием животных.
Список литературы
Walther G.-R., Post E., Convey P. et al. Ecological responses to recent climate change // Nature. 2002. V. 416. P. 389–395.
Root T.L., Price J.T., Hall K.R. et al. Fingerprints of global warming on animals and plants // Nature. 2003. V. 421. P. 57–60.
Юнчис О.Н. Возможные изменения паразитофауны рыб при глобальном потеплении // Проблемы ихтиопатологии в начале XXI века: Сб. научн. трудов ГосНИОРХ. С.-Петербург, 2009. Вып. 338. С. 240–246.
Hellmann J.J., Byers J.E., Bierwagen B.G., Dukes J.S. Five potential consequences of climate change for invasive species // Conservation Biology. 2008. V. 22. № 3. P. 534–543. https://doi.org/10.1111/j.1523-1739.2008.00951.x
Marcogliese D.J. The impact of climate change on the parasites and infectious diseases of aquatic animals // Rev. Sci. Tech. Off. Int. Epiz. 2008. V. 27. № 2. P. 467–484.
Литвинов А.С., Законнова А.В., Поддубный С.А. Климат и гидрологический режим // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века / Ред. Лазарева В.И. М.: РАН, 2018. С. 32–50.
Литвинов А.С., Законнова А.В. Экологические условия в Рыбинском водохранилище при потеплении климата // Географический вестник. 2014. № 2(29). С. 41–45.
Литвинов А.С., Рощупко В.Ф. Многолетние изменения элементов гидрометеорологического режима Рыбинского водохранилища // Метеорология и гидрология. 2010. № 7. С. 65–75.
Лазарева В.И. Зоопланктон // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века / Ред. Лазарева В.И. М.: РАН, 2018. С. 317–324.
Щербина Г.Х., Перова С.Н., Пряничникова Е.Г. Донные виды-вселенцы // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века / Ред. Лазарева В.И. М.: РАН, 2018. С. 324–329.
Боровикова Е.А., Герасимов Ю.В., Карабанов Д.П. Рыбы // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века / Ред. Лазарева В.И. М.: Ин-т биологии внутр. вод им. И.Д. Папанина РАН, 2018. С. 329–339.
Куперман Б.И. Ленточные черви рода Triaenophorus – паразиты рыб. Л.: Наука, 1973. 207 с.
Петрушевский Г.К. О заболевании рыб Белого озера // Изв. ВНИОРХ. 1957. Т. 42. С. 278–282.
Гревцева М.А. Систематический обзор гельминтов рыб бассейна реки Вятки // Труды Кировского с.-х. ин-та. Пермь, 1976. Т. 12. С. 64–71.
Костарев Г.Ф. Паразитофауна рыб реки Чусовой // Учен. зап. Пермского госуниверситета. 1969. Т. 179. С. 230–238.
Столяров В.П. Динамика паразитофауны промысловых рыб Рыбинского водохранилища // Труды Ленинградского о-ва естествоиспытателей. 1954. Т. 72. Вып. 4. С. 160–187.
Столяров В.П. Паразитарные болезни рыб Верхней Волги на участке Ярославской и Калининской областей // Записки Ленинградского с.-х. ин-та. 1955. Вып. 9. С. 180–201.
Ермолин В.П. Состав ихтиофауны Саратовского водохранилища // Вопросы ихтиологии. 2010. Т. 50. № 2. С. 280–284. [Ermolin V.P. Composition of the ichthiyofauna of the Saratov Reservoir // J. Ichthyology. 2010. V. 52. № 2. P. 211–215.] https://doi.org/10.1134/S0032945210020098
Соломатова В.П. Триенофороз лососевых при индустриальных методах выращивания // VII Всес. совещ. по паразитам и болезням рыб. Л.: Наука, 1979. С. 103–104.
Воронин В.Н., Чернышева Н.Б., Стрельбицкая И.Н. Характеристика очага триенофороза форели и меры борьбы с заболеванием в условиях садкового выращивания // Проблемы паразитологии и болезней рыб в современных индустриальных рыбоводных хозяйствах: Сб. научн. трудов ГосНИОРХ. С.-Петербург, 1992. Вып. 311. С. 9–22.
Богданова Е.А., Никольская Н.П. Паразитофауна рыб Волги до зарегулирования стока // Паразитофауна рыб бассейна р. Волги и вопросы загрязнения Пермского водохранилища / Изв. ГосНИИОРХ. 1965. Т. 60. С. 5–110.
Изюмова Н.А. К вопросу о динамике паразитофауны рыб Рыбинского водохранилища // Труды ИБВ АН СССР. 1959. Вып. 2(5). С. 174–190.
Изюмова Н.А. Сезонная динамика паразитофауны рыб Рыбинского водохранилища (щука, синец, густера) // Труды ИБВ АН СССР. 1960. Вып. 3(6). С. 284–299.
Герасимов Ю.В., Иванова М.Н., Свирская А.Н. Щука // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ярославль: Филигрань, 2015. С. 184–198.
Герасимов Ю.В., Боровикова Е.А., Столбунов И.А. Ряпушка // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ярославль: Филигрань, 2015. С. 157–169.
Куперман Б.И. Экологический анализ цестод рыб водоемов Волго-Балтийской системы // Труды ИБВВ АН СССР. 1979. Вып. 38(41). С. 133–159.
Иешко Е.П., Аникиева Л.В., Лебедева Д.И., Ильмаст Н.В. Особенности популяционной биологии цестод рода Triaenophorus в естественных и техногенно трансформированных водоемах // Паразитология. 2012. Т. 46. № 6. С. 434–443.
Евланов И.А. Распределение и механизм регуляции плероцеркоидов Triaenophorus nodulosus (Cestoda, Triaenophoridae) // Паразитология. 1987. Т. 21. № 5. С. 654–658.
Герасимов Ю.В., Иванова М.Н., Свирская А.Н. Пространственное распределение и структура популяции щуки Esox lucius Рыбинского водохранилища в период потепления климата // Вопросы ихтиологии. 2018. Т. 58. № 1. С. 31–44. https://doi.org/. [Gerasimov Y.V., Ivanova M.N., Svirskaya A.N. Spatial distribution and population structure of the pike Esox lucius L. in the Rybinsk Reservoir during the climate warming period // J. Ichthyol. 2018. V. 58. № 1. P. 38–51. https://doi.org/10.1134/S0032945218010058]https://doi.org/10.7868/S0042875218010058
Герасимов Ю.В., Иванова М.Н., Столбунов И.А., Павлов Д.Д. Окунь // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ярославль: Филигрань, 2015. С. 331–348.
Шакирова Ф.М., Северов Ю.А. Видовой состав ихтиофауны Куйбышевского водохранилища // Вопросы ихтиологии. 2014. Т. 54. № 5. С. 520–532. [Shakirova F.M., Severov Y.A. Species composition of ichthyofauna of the Kuibyshev reservoir // J. Ichthyology. 1914. V. 54. № 8. P. 513–525. https://doi.org/10.1134/S0032945214050099]https://doi.org/10.7868/S0042875214050105
Дополнительные материалы отсутствуют.