Экология, 2021, № 4, стр. 263-270
Влияние антропогенных факторов на способность узкочерепной полевки (Lasiopodomys gregalis) адаптироваться к условиям неволи
П. А. Задубровский a, *, А. В. Васина b, Е. В. Новикова a, Е. Ю. Кондратюк a, Л. Л. Мацкало b, Е. А. Новиков a, b
a Институт систематики и экологии животных Сибирского отделения РАН
630091 Новосибирск, ул. Фрунзе, 11, Россия
b Новосибирский государственный аграрный университет
630036 Новосибирск, ул. Добролюбова, 130, Россия
* E-mail: etolog@mail.ru
Поступила в редакцию 27.03.2020
После доработки 03.06.2020
Принята к публикации 13.08.2020
Аннотация
Для проверки предположения о более успешной адаптации к неволе животных, обитающих в местообитаниях с высокой антропогенной нагрузкой, неполовозрелых особей узкочерепной полевки, отловленных на территории Карасукского стационара ИСиЭЖ СО РАН и за его пределами, содержали в условиях лаборатории. Животные, отловленные в непосредственной близости от рабочих и жилых строений, быстро набирали вес, однако смертность у них была выше, чем у особей, отловленных на периферии стационара и за его пределами. Самую высокую выживаемость демонстрировали особи, отловленные на периферии стационара, – они отличались большей пугливостью и высокой социальной аффилиативностью. Таким образом, особи узкочерепной полевки, родившиеся и выросшие в условиях высокой антропогенной нагрузки, легче адаптировались к условиям неволи, но имели более низкую выживаемость по сравнению с животными из местообитаний с умеренной и слабой антропогенной нагрузкой.
Антропогенная трансформация ландшафтов в последние десятилетия становится одним из ведущих экологических факторов, обусловливающих нарушение структурной целостности экосистем и микроэволюционные процессы в популяциях отдельных видов [1]. Для многих видов позвоночных продемонстрировано повышение устойчивости к действию антропогенных стрессоров в урбанистических градиентах, хотя эта тенденция во многом зависит от адаптивных особенностей вида [2]. Можно предполагать, что одним из проявлений адаптации к действию антропогенных факторов будет способность выживать и размножаться под контролем человека. Однако данных об уровне и причинах смертности диких животных в процессе отлова и при последующем содержании в условиях неволи очень немного [3].
Наиболее подвержены гибели животные социальных видов, для которых изъятие из естественной среды обитания сопряжено с нарушением установившихся социальных связей. Кроме того, гибель животных после отлова может быть вызвана и другими причинами – сменой диеты, инфекциями. Очевидно, что как вероятность гибели в неволе, так и успешность размножения зависят от видовых и индивидуальных особенностей животных [4]. Отбор, происходящий в процессе доместикации, в значительной степени связан с устойчивостью к действию стрессоров, неизбежных при изъятии животного из естественной среды обитания и частых контактах с человеком [5, 6]. Эмоциональная природа подобных стрессоров делает их последствия для содержащихся в неволе животных особенно ощутимыми [4]. Поэтому очевидно, что как поиск путей снижения стрессовых воздействий, так и выработка критериев подбора наиболее устойчивых фенотипов могут существенно повысить успех разведения диких животных под контролем человека.
К сожалению, вопрос о существовании в популяциях животных изменчивости по реакции на человека и о влиянии этой изменчивости на успешность доместикации остается открытым. Выявление ex citu фенотипов, наиболее подходящих для доместикации, позволило бы снизить потери, неизбежные при отлове и помещении диких животных в неволю, повысив тем самым эффективность мероприятий по сохранению редких и исчезающих видов.
Наиболее удобной моделью для изучения естественной изменчивости по способности к доместикации является, очевидно, перемещение диких животных с известными свойствами в неволю и в дальнейшем контроль за их физическим состоянием, репродуктивным статусом и временем дожития. Для этой цели целесообразно использовать массовые виды с высокой плотностью популяций, обитающие в широком диапазоне значений экологических факторов, включая антропогенные. К числу таких видов можно отнести узкочерепную полевку (Lasiopodomys gregalis Pallas, 1779), имеющую обширный ареал и населяющую широкий спектр местообитаний. Так, на юге Западной Сибири данный вид доминирует в открытых местообитаниях степной и лесостепной зон [7, 8]. Семейно-групповой образ жизни и высокий территориальный консерватизм узкочерепной полевки делают ее удобной моделью для изучения пространственной неоднородности популяций. Высокая локальная плотность популяций, круглосуточная активность и легкость визуального обнаружения колоний [9, 10] позволяют отлавливать в короткие сроки значительное количество животных.
Цель нашей работы – выявление естественной изменчивости узкочерепной полевки, обусловленной уровнем антропогенной нагрузки, по способности адаптироваться к условиям лабораторного содержания. Исследовали популяционную группировку, обитающую в районе Карасукского стационара Института систематики и экологии СО РАН.
МАТЕРИАЛ И МЕТОДЫ
Узкочерепных полевок отлавливали на территории Карасукского стационара ИСиЭЖ СО РАН (53°43′48.1″ с.ш., 77°52′00.4″ в.д.) и за его пределами 7–9 августа 2019 г. Жилые колонии обнаруживали визуально, по наличию используемых нор и свежих погрызов травы [10]. В каждой колонии на тропах, ведущих к жилым норам, и возле их отверстий устанавливали 5‒10 трапиковых живоловок. Приманкой служили куски моркови. Ловушки оставляли открытыми в течение всего светлого времени суток, проверку производили ежечасно. Отловы проводили в трех типах местообитаний, различающихся по степени антропогенной нагрузки:
1. Рабочая зона стационара, подвергающаяся значительной антропогенной нагрузке в течение всех сезонов года, но преимущественно летом, когда на территории стационара может одновременно находиться до 100 человек (научные сотрудники, обслуживающий персонал, студенты, школьники). Здесь расположены лабораторные и жилые строения, складские помещения, гаражи, вольеры. Помимо присутствия людей, факторами беспокойства могут быть вибрация почвы и шум от работающей техники, ночное освещение. Растительный покров деградирован, высока доля рудеральной растительности, однако деятельность человека создает дополнительные источники пищи.
2. Периферийная зона стационара, подвергающаяся умеренной нагрузке. Антропогенное воздействие связано с эксплуатацией лабораторного корпуса и нескольких подсобных помещений в летнее время, парковкой нескольких единиц авто- и мототехники. Присутствуют посадки культурных растений, однако доминирует естественная разнотравно-злаковая растительность.
3. Зона слабой нагрузки находится за пределами огороженной части стационара. На расстоянии около 100 м от точек отлова проходит автодорога, являющаяся источником шума, периодически выпасается скот. Преобладает естественная разнотравно-полынно-злаковая и кустарниковая растительность.
Всего за три дня работы было отловлено 67 особей узкочерепной полевки при примерно равном численном соотношении во всех трех местообитаниях. Половозрастной состав пойманных животных приведен в табл. 1.
Таблица 1.
Половозрастной состав особей, отловленных в местообитаниях с разной антропогенной нагрузкой
| Антропогенная нагрузка | Самцы | Самки | ||
|---|---|---|---|---|
| молодые | взрослые | молодые | взрослые | |
| Сильная | 10 | 0 | 9 | 1 |
| Умеренная | 8 | 1 | 10 | 4 |
| Слабая | 12 | 1 | 9 | 2 |
Сразу после отлова животных подвергали визуальному осмотру для определения пола и репродуктивного статуса, взвешивали и отбирали пробу фекалий для последующего лабораторного анализа. Половозрелых особей выпускали в природу в точке поимки. Всех неполовозрелых зверьков (58 особей) после передержки доставили в ИСиЭЖ СО РАН для дальнейшего лабораторного содержания. Животных содержали в индивидуальных клетках размером 30 × 20 × 20 см с подстилкой из опилок и ватой в качестве гнездового материала в вентилируемом подвальном помещении с комфортной температурой (18–22°С) и фиксированным режимом освещения (16D:8L), имитирующим зимние условия существования. Это было необходимо для того, чтобы предотвратить преждевременное половое созревание молодых зверьков, принадлежащих к позднелетней (зимующей) когорте, и направить их развитие по естественной онтогенетической траектории. Кормом служили свежая морковь, зелень, сено и зерновая смесь. Пища и вода предлагались ad lib.
После месячной передержки в лаборатории животные были подвергнуты процедуре тестирования, включающей набор стандартных поведенческих тестов: открытое поле (3-минутный тест на круглой арене диаметром 63 см и высотой стенки 35 см [11]); черно-белая камера (5-минутный тест, животное помешается в темный отсек (25 × 15 × 25 см), соединенный проходом (3 × 3 см) со светлым отсеком (25 × 30 × 25 см) [12]); однополые парные ссаживания (10-минутный тест на круглой нейтральной арене диаметром 50 см и высотой стенки 35 см [13]). Тесты проводили с интервалом 5 дней. Поведение животных фиксировали на видеокамеру (Panasonic HC-V720M), полученный видеоматериал по тестам открытое поле и черно-белая камера анализировали с помощью программы Noldus EthoVision 3.1, при парном ссаживании визуально регистрировали частоты отдельных элементов поведения. Затем у животных измеряли величину стандартного и максимального обмена. Через 1 и 3 мес. после отлова проводили контрольные взвешивания. Все павшие особи были вскрыты для установления возможной причины гибели.
Величины стандартного и максимального энергообмена, а также способность к поддержанию температурного гомеостаза измеряли в респирометре закрытого типа: стандартный обмен – в термонейтральной зоне (+26 ± 1°С), максимальный – в условиях 15-минутного охлаждения в гелиево-кислородной (80 : 20) смеси при температуре 6 ± 1°С. До начала и сразу после окончания измерения максимального обмена у животных измеряли ректальную температуру тела [14].
Для оценки фонового уровня гормонов стресса определяли содержание метаболитов кортикостерона в фекалиях, собранных в ловушках при изъятии из них животных. Интервалы между проверками ловушек (1 ч) были значительно меньше, чем время, необходимое для попадания гормонов в фекалии [15], что позволяло избегать стрессирующего влияния процедуры отлова. Содержание метаболитов гормона в фекалиях определяли с помощью иммуноферментного анализа, по стандартной технологии, использованной нами в предыдущих исследованиях [16].
Для статистического анализа результатов применяли стандартные методы вариационной статистики (пакет Statistica 6.0). Сравнение кривых дожития проводили методом Каплана-Мейера. По количеству поведенческих актов агрессивного и аффилиативного поведения в тестах парного ссаживания рассчитывали соответствующие индексы. Результаты остальных поведенческих тестов обрабатывали с использованием компонентного анализа. Исходя из вклада поведенческих актов, первые две компоненты, полученные при анализе результатов теста открытого поля, интерпретировали как двигательную активность и эмоциональность; в тесте черно-белая камера первую компоненту интерпретировали как исследовательскую активность, вторую – как эмоциональность. Совместное влияние местообитания и пола животного на значения рассматриваемых показателей оценивали с помощью двухфакторного дисперсионного анализа, влияние местообитания на динамику массы тела – с помощью дисперсионного анализа с повторными измерениями. Множественные сравнения средних значений проводили на основании результатов дисперсионного анализа с использованием HSD теста Тьюки.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
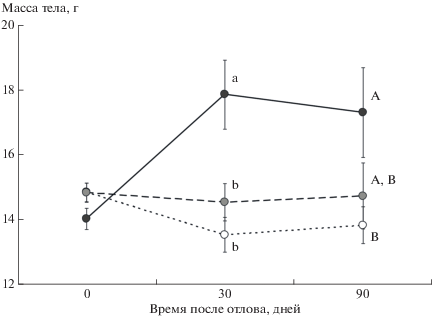
Дисперсионный анализ с повторными измерениями показал, что достоверное влияние на изменчивость массы тела животных оказывает уровень антропогенной нагрузки (F2.44 = 4.7; P < 0.05) и его совместное действие с повторностью измерения (F4.88 = 5.1; P < 0.01). В момент отлова зверьки из местообитаний с разным уровнем антропогенной нагрузки не различались по массе тела. Однако через 1 и 3 мес. после отлова особи, обитавшие на территории стационара на участках с высокой антропогенной нагрузкой, весили значительно больше, чем особи из местообитаний с умеренной и слабой нагрузкой, расположенных соответственно на периферии стационара и за его пределами (рис. 1).
Рис. 1.
Динамика массы тела при лабораторном содержании узкочерепных полевок из местообитаний с сильной (черные кружки, сплошная линия), умеренной (серые кружки, штрихпунктирная линия) и слабой (светлые кружки, пунктирная линия) нагрузкой. Случаи достоверных (Тьюки HSD тест; P < 0.05) различий средних значений массы тела, измеренной в одно и то же время, у особей из разных местообитаний помечены разными буквами.
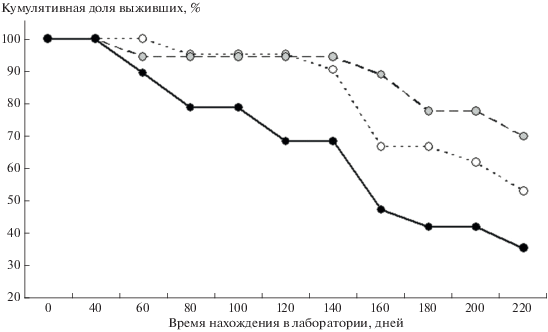
Основными зарегистрированными причинами смерти в первые 7 мес. лабораторного содержания были истощение, избыточное ожирение, патологии сердечно-сосудистой, респираторной и пищеварительной систем. Анализ кривых выживания выявил достоверное влияние уровня антропогенной нагрузки на дожитие узкочерепных полевок в лаборатории (X 2 = 6.7; P < 0.05). Кумулятивная доля выживших на конец февраля 2020 г. была минимальна для особей из местообитаний с высокой антропогенной нагрузкой (рис. 2).
Рис. 2.
Кумулятивная доля выживших особей из местообитаний с разной антропогенной нагрузкой при лабораторном содержании. Условные обозначения см. на рис. 1.
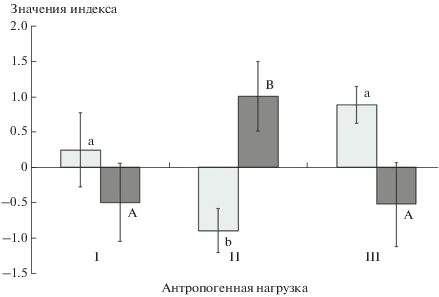
Двухфакторный дисперсионный анализ при использовании в качестве независимых переменных пола животного и уровня антропогенной нагрузки не выявил достоверного влияния изучаемых факторов на частоту проявления поведенческих актов, отражающих двигательную активность и эмоциональность в тесте открытого поля, эмоциональность в тесте черно-белая камера и агрессивность в тесте парного ссаживания (во всех случаях P > 0.05). Фактор антропогенной нагрузки оказывал достоверное влияние на исследовательскую активность в тесте черно-белая камера (F2.47 = 3.7; P < 0.05) и аффилиативное поведение животных в тесте парного ссаживания (F2.47 = 3.5; P < 0.05). Особи из местообитаний с умеренной нагрузкой демонстрировали достоверно меньшее число актов исследовательского и достоверно большее число актов аффилиативного поведения (рис. 3), чем особи остальных групп (тест Тьюки, P < 0.05).
Рис. 3.
Значения индексов исследовательского (светлые столбики) и аффилиативного (темные столбики) поведения у особей из местообитаний с разной антропогенной нагрузкой: I – слабая, II – умеренная , III – сильная. Здесь и на рис. 4 случаи достоверных (Тьюки HSD тест; P < 0.05) различий средних значений одного и того же признака у особей из разных местообитаний помечены разными буквами.
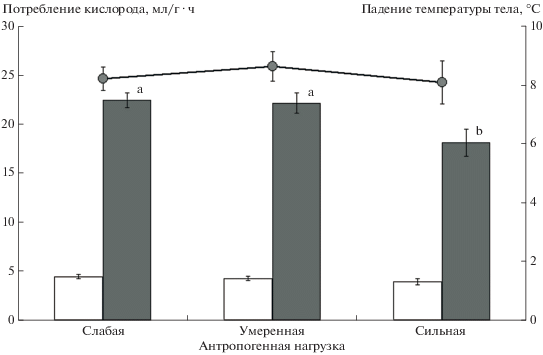
Двухфакторный дисперсионный анализ не выявил влияния уровня антропогенной нагрузки на величину стандартного энергообмена, но показал значимый эффект пола животных (F1.46 = 3.7; P < 0.05): у самцов был достоверно более низкий стандартный обмен, чем у самок: 4.0 ± 0.2 и 4.5 ± ± 0.2 мл/г ⋅ ч соответственно (t50 = 2.0; P < 0.05). На величину максимального обмена достоверное влияние оказывала только степень антропогенной нагрузки (F1.46 = 3.7; P < 0.05): у особей из местообитания с высокой антропогенной нагрузкой были достоверно более низкие значения этого показателя (рис. 4), чем у особей двух других групп. Пол животного и степень антропогенной нагрузки на местообитание не оказывали статистически значимого влияния на разность ректальных температур, измеренных у животного до и после теста. Не выявлено статистически значимого влияния рассматриваемых факторов и на содержание метаболитов кортикостерона в фекалиях, собранных в живоловках в момент отлова в природе. Вместе с тем коэффициент вариации значений этого показателя у животных, отловленных в местообитаниях с высокой антропогенной нагрузкой (104.6%), был значительно выше, чем в местообитаниях c умеренной (73.6%) и низкой (57.5%) нагрузкой за счет выраженной правосторонней асимметрии частотного распределения значений.
Рис. 4.
Средние значения стандартного (светлые столбики), максимального (темные столбики) энергообмена и разности ректальных температур, измеренных до и после теста (линия), у особей из местообитаний с разной антропогенной нагрузкой.
Данные отловов в августе 2019 г. показывают, что, как и повсеместно в степной зоне Северной Кулунды, в районе Карасукского стационара узкочерепная полевка является массовым видом грызунов [10]: на территории площадью около 6 га за три дня было отловлено 67 особей. И хотя учеты численности не входили в задачи исследования, тем не менее можно констатировать, что плотность популяции на данной территории как минимум превышает 10 особей на 1 га. Пространственно-этологическая структура изучаемой популяции типична для вида в целом: полевки формировали изолированные поселения, приуроченные к участкам предпочитаемой растительности. Количество отловленных в каждом таком поселении особей колебалось от 2 до 8, однако ограниченность периода отлова (не более 12 ч на одном месте) не позволила надежно оценить их состав. Тем не менее очевидно, что в конце лета в популяции численно преобладают неполовозрелые особи с примерно равным соотношением полов, как это было отмечено и в предыдущих исследованиях, посвященных изучению демографии узкочерепной полевки [9, 10]. Судя по встречаемости перезимовавших особей в отловах первой половины лета, продолжительность жизни зверьков позднелетних генераций в природе может достигать 12 мес., хотя значительная их часть погибает в течение холодного времени года по независящим от возраста причинам.
Можно предполагать, что в контролируемых условиях лаборатории риск гибели особи зависит от того, в каком состоянии она находилась в момент отлова, и прежде всего от ее исходного физического состояния, упитанности, эндокринного и иммунного статуса.
Сравнение физического состояния, физиологического статуса и поведения узкочерепных полевок, отловленных в территориально смежных местообитаниях с разным уровнем антропогенной нагрузки, выявило существенные различия между населяющими их особями. Прежде всего это касается динамики массы тела, которая наряду с поведенческим репертуаром и уровнем стрессированности рассматривается как один из основных критериев благополучия животных при их содержании в неволе [17]. Неполовозрелые особи, отловленные на территории стационара в непосредственной близости от строений, по массе тела в момент отлова не отличались от особей, отловленных на периферии стационара и за его пределами, но быстро набирали массу и затем сохраняли ее на постоянном уровне в течение трех последующих месяцев. У особей, отловленных в местообитаниях с умеренной и слабой антропогенной нагрузкой, масса тела после отлова оставалась неизменной или даже снижалась.
Можно предполагать, что на животных, живущих в непосредственной близости от человека, отлов и помещение в лабораторию не оказывают такого ощутимого стрессового воздействия, как на животных из естественных местообитаний. Оказавшись в комфортных условиях с неограниченным доступом к калорийной пище, эти животные начали быстро накапливать жир. Наличие избыточного подкожного жира является значимым фактором терморегуляции, позволяя эндотермным животным поддерживать температурный гомеостаз без дополнительных энергозатрат на теплопродукцию [18]. Именно с этим, очевидно, связано отсутствие межгрупповых различий по разности ректальных температур, измеренных до и после холодового теста, при достоверно более низком уровне максимального обмена у особей из местообитаний с высокой антропогенной нагрузкой. Кроме того, необходимо учитывать, что жировая ткань является метаболически инертной и не влияет на величину энергообмена на уровне целого организма [19]. Тощую массу, более точно отражающую удельную интенсивность метаболизма, в данной работе мы не оценивали, но можно предполагать, что межгрупповые различия по этому показателю не были бы значительными.
Особи из местообитаний с разным уровнем антропогенной нагрузки достоверно не различались по фоновому уровню глюкокортикоидов, показателем которого является содержание метаболитов кортикостерона в фекалиях [20]. Тем не менее выраженная правосторонняя асимметрия распределения этого показателя у особей из местообитаний с высокой антропогенной нагрузкой свидетельствует о том, что по крайней мере некоторые особи в момент отлова были достаточно сильно стрессированы. Поскольку временной промежуток от повышения секреторной активности надпочечников до поступления метаболитов глюкокортикоидов в фекалии составляет у мышевидных грызунов не менее 4–6 ч [15], можно полагать, что стресс в данном случае не был связан с процедурой отлова. Исходя из наблюдаемых частот распределения, можно предполагать, что особи, обитающие в непосредственной близости от строений, чаще других подвергаются стрессам, но достаточно быстро восстанавливают гормональный баланс.
Высокая стрессоустойчивость и быстрая адаптация к изъятию из естественной среды обитания узкочерепных полевок, живших рядом с человеком, не обеспечили, однако, их успешного выживания при длительном содержании в лаборатории. В первые месяцы после отлова смертность у особей, отловленных в местообитаниях с высокой антропогенной нагрузкой, была значительно выше, чем в двух других группах, однако причину их более высокой смертности при визуальном осмотре выявить не удалось. Лишь в одном случае гибель могла быть связана с избыточным ожирением. Тем не менее полученные данные отчетливо показывают, что обитание животного рядом с человеком еще не является гарантией его успешного содержания в неволе.
Интересны и результаты анализа поведения узкочерепных полевок в стандартных лабораторных тестах. В целом поведенческая реакция животных на экспериментально смоделированные эмоциональные стрессоры была однотипной, однако по ряду показателей животные из местообитаний с умеренной антропогенной нагрузкой достоверно отличались от остальных, демонстрируя пониженную исследовательскую мотивацию и большее “миролюбие” по отношению к конспецификам. Это свидетельствует о преобладании проактивного (пугливого) поведенческого типа [21] в местообитаниях, где контакты с человеком носят спорадический характер. Следует отметить, что именно эти особи лучше всего выживали в лаборатории в первые месяцы после отлова.
При анализе полученных результатов неизбежно возникает вопрос о непосредственных механизмах наблюдаемых различий по устойчивости животных к действию антропогенных факторов. Территориальная близость точек отлова и отсутствие естественных преград между ними исключают возможность существования нескольких изолированных и генетически разнородных внутрипопуляционных группировок с разнонаправленными векторами отбора на стрессоустойчивость. С другой стороны, можно предположить, что расселение молодых зверьков в неоднородном пространстве происходит направленно – в соответствии с их индивидуальными психофизиологическими особенностями: пугливые особи выселяются за пределы стационара, а более устойчивые к действию стрессоров перемещаются (или вытесняются) в зону с высокой антропогенной нагрузкой.
Следует также учитывать, что многие поведенческие и физиологические характеристики у млекопитающих программируются в раннем онтогенезе под воздействием стресс-стимулов, опосредованных реакцией материнского организма [22]. Поскольку объектами исследования были молодые зверьки, возраст которых на момент отлова не превышал 1–1.5 мес., можно предполагать, что их текущее физиологическое и эмоциональное состояние отражало интегрированную стрессированность беременных самок, величина которой варьировала в зависимости от местоположения колонии. Не исключено, что долгосрочные последствия стрессов, испытанных на ранних этапах онтогенеза, являлись одной из причин пониженной выживаемости зверьков, отловленных в местообитаниях с высокой антропогенной нагрузкой, при их лабораторном содержании.
Таким образом, при попытке выявить у узкочерепной полевки фенотип, оптимальный для лабораторного содержания, мы столкнулись с парадоксальным результатом. Особи, обитающие в условиях высокой антропогенной нагрузки и чаще других контактирующие с человеком, легче переносят отлов и транспортировку, однако по не ясным до конца причинам имеют достаточно низкую остаточную продолжительность жизни в неволе. Наиболее пригодными для доместикации оказались узкочерепные полевки, обитающие в условиях умеренной антропогенной нагрузки.
Работа выполнена при финансовой поддержке РФФИ (грант № 19-04-00929). Авторы благодарят В.А. Шило за содействие в организации полевых работ, И.А. Поликарпова и А.А. Халина – за помощь в получении фактических данных.
Авторы подтверждают отсутствие конфликта интересов. Методы отлова и содержания животных были адаптированы к особенностям биологии исследуемого вида, чтобы свести к минимуму вредные и стрессовые последствия содержания в неволе. Климатические режимы в лабораторных помещениях были комфортными для животных, рацион был сбалансированным и включал все питательные вещества, необходимые для нормального роста и развития. Помещения периодически стерилизовались с помощью кварцевой лампы. Фактор беспокойства был сведен к минимуму. Все экспериментальные процедуры выполнялись с осторожностью и в соответствии с местными и национальными законодательными требованиями. Протокол работы, утвержденный комиссией по этике ИСиЭЖ СО РАН, соответствует положениям Хельсинкской декларации.
Список литературы
McKinney M.L. Urbanization, biodiversity, and conservation: The impacts of urbanization on native species are poorly studied, but educating a highly urbanized human population about these impacts can greatly improve species conservation in all ecosystems // Bioscience. 2002. V. 52. № 10. P. 883–890. https://doi.org/10.1641/0006-3568(2002)052
Bonier F. Hormones in the city: endocrine ecology of urban birds // Hormones and Behavior. 2012. V. 61. № 5. P. 763–772. https://doi.org/10.1016/j.yhbeh.2012.03.016
Mason G.J. Species differences in responses to captivity: stress, welfare and the comparative method // Trends in Ecology & Evolution. 2010. V. 25. № 12. P. 713–721. https://doi.org/10.1016/j.tree.2010.08.011
Walker M.D., Duggan G., Roulston N. et al. Negative affective states and their effects on morbidity, mortality and longevity // Animal Welfare. 2012. V. 21. P. 497–509. https://doi.org/10.7120/09627286.21.4.497
Беляев Д.К., Трапезов О.В. Связь селекционного изменения поведения с репродуктивными функциями у американской норки // Журн. общ. биол. 1986. Т. 47. № 4. С. 445–450.
Трут Л.Н. Эволюционные идеи Д.К. Беляева как концептуальный мост между биологией, социологией и медициной // Вавиловский журн. генетики и селекции. 2008. Т. 12. № 1-2. С. 7–18.
Mal’kova M.G., Pal’chekh N.A., Yakimenko V.V., Kuz’min I.V. The spatiotemporal structure of rodent populations in the Steppe Zone of Western Siberia // Rus. J. of Ecology. 2004. V. 35. № 1. P. 27–34.
Дупал Т.А. Мелкие млекопитающие // Биоразнообразие Карасукско-Бурлинского региона (Западная Сибирь). Новосибирск: Изд-во СО РАН, 2010. С. 234–239.
Pal’chekh N.A., Mal’kova M.G., Kuz’min I.V., Yakimenko V.V. The structure of narrow-skulled vole (Microtus gregalis Pall.) colonies in Western Siberia // Rus. J. of Ecology. 2003. V. 34. № 5. P. 327–331.
Задубровский П.А., Задубровская И.В., Потапов М.А. и др. Типы поселений узкочерепной полевки (Lasiopodomys gregalis) в Северной Кулунде и сезонная динамика их демографического состава // Экология. 2016. Т. 1. С. 71–76. https://doi.org/10.7868/S0367059716010157
Задубровский П.А., Степанова А.В., Лопатина Н.В., Литвинов Ю.Н. Поведение неполовозрелых скальных полевок двух видов (Alticola strelzowi и A. tuvinicus) в тесте “открытое поле” // Сибирский экологич. журн. 2017. Т. 24. № 3. С. 257–263. https://doi.org/10.15372/SEJ20170303
Costall B., Jones B.J., Kelly M.E. et al. Exploration of mice in a black and white box: validation as a model of anxiety // Pharmacol. Biochem. Behav. 1989. V. 32. № 3. P. 777–785. https://doi.org/10.1016/0091-3057(89)90033-6
Потапов М.А., Задубровский П.А., Задубровская И.В. и др. Миролюбивое и агрессивное поведение как факторы формирования видоспецифических семейно-групповых отношений у грызунов // Докл. РАН. 2014. Т. 454. № 4. С. 491–493. https://doi.org/10.7868/S0869565214040306
Поликарпов И.А., Кондратюк Е.Ю., Петровский Д.В., Новиков Е.А. Межпопуляционная изменчивость эндокринно-метаболической реакции на холодовой стресс у красной полевки (Myodes rutilus) // Журн. общ. биол. 2016. Т. 77. № 4. С. 284–292.
Harper J.M., Austad S.N. Fecal glucocorticoids: a noninvasive method of measuring adrenal activity in wild and captive rodents // Physiological and Biochemical Zoology. 2000. V. 73. № 1. P. 12–22. https://doi.org/10.1086/316721
Novikov E., Kondratyuk E., Petrovski D. et al. Reproduction, aging and mortality rate in social subterranean mole voles (Ellobius talpinus Pall.) // Biogerontology. 2015. V. 16. № 6. P. 723–732. https://doi.org/10.1007/s10522-015-9592-x
The Welfare of Laboratory Animals. Springer, 2007. https://doi.org/10.1007/978-1-4020-2271-5
Шмидт-Нельсен К. Физиология животных. Приспособление и среда. М.: Мир, 1982. Т. 1. 416 с.
Miller A.T. Jr., Blyth C.S. Lean body mass as a metabolic reference standard // J. of Applied Physiology. 1953. V. 5. № 7. P. 311–316.
Touma C., Palme R. Measuring fecal glucocorticoid metabolites in mammals and birds: the importance of validation // Annals of the New York Academy of Sciences. 2005. V. 1046. № 1. P. 54–74. https://doi.org/10.1196/annals.1343.006
Réale D., Garant D., Humphries M.M.et al. Personality and the emergence of the pace-of-life syndrome concept at the population level // Philosophical Transactions of the Royal Society. Biological Sci. 2010. V. 365. № 1560. P. 4051–4063. https://doi.org/10.1098/rstb.2010.0208
Роговин К.А. Стресс в раннем онтогенезе как адаптивное явление // Журн. общ. биол. 2019. Т. 80. № 2. С. 95–123. https://doi.org/10.1134/S0044459619020064
Дополнительные материалы отсутствуют.


