Экология, 2021, № 6, стр. 470-480
Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. II. Бета-разнообразие
С. В. Мухачева a, *, А. Н. Созонтов a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: msv@ipae.uran.ru
Поступила в редакцию 02.04.2021
После доработки 31.05.2021
Принята к публикации 10.06.2021
Аннотация
Проанализирована многолетняя динамика β-разнообразия сообществ мелких млекопитающих (ММ) в зоне действия крупного медеплавильного завода в периоды высоких (1990–1997 гг.), сниженных (1998–2009 гг.) и почти прекратившихся (2010–2020 гг.) выбросов. Показано, что по мере приближения к заводу β-разнообразие сообществ увеличивается, при этом ключевую роль (до 25%) в формировании их структуры играет уровень загрязнения территории. На протяжении всех 30 лет наблюдений фоновые сообщества были менее изменчивы по сравнению с буферными и импактными: чем выше нестабильность среды, тем более вариабельны сообщества. Структурные перестройки импактных и буферных сообществ ММ в период сокращения выбросов привели к расхождению сообществ фоновых и загрязненных участков, усилившемуся во времени.
Для оценки разнообразия биотических сообществ традиционно используют показатели инвентаризационного (α, γ) и дифференцирующего (β) разнообразия [1–4]: первые отражают видовое богатство сообществ в масштабе локальных участков (α) или регионов (γ), вторые характеризуют сходство сообществ в пространстве или во времени.
Антропогенные воздействия могут приводить к разнонаправленным перестройкам структуры сообществ, которые определяются множеством факторов: характером и интенсивностью воздействий [5, 6], пространственным масштабом [7–9], качеством местообитаний [6, 10, 11], спецификой изучаемых объектов [10, 12–14]. Результатом таких трансформаций могут быть гомогенизация либо дивергенция биотических сообществ. Наиболее изученными в этом аспекте группами являются отдельные таксоны сосудистых растений, беспозвоночных и птиц. Работы, где в качестве модельных объектов используются мелкие млекопитающие (ММ), немногочисленны. В условиях промышленного загрязнения [15] и агроландшафтах [14] β-разнообразие сообществ ММ возрастало. В местообитаниях, трансформированных рубками, сходство сообществ ММ могло увеличиваться [9], уменьшаться [11] либо не изменялось [16]. Стабильностью состава характеризовались также некоторые сообщества ММ, населяющие агроландшафты с разной интенсивностью эксплуатации [12, 13, 17].
Исследования β-разнообразия представляют не только теоретический интерес, но и актуальны при выборе наиболее эффективных стратегий повышения устойчивости природных и модифицированных человеком экосистем [5, 10]. В локальном масштабе сходство сообществ – это результат динамического равновесия процессов гомогенизации и дивергенции. Первые обусловлены исчезновением из сообществ отдельных видов вследствие прямого (избирательная элиминация) или опосредованного (утрата пригодных местообитаний) воздействия [18–21], вторые – нарушениями обмена видами между локальными сообществами из-за фрагментации местообитаний [13, 22–24]. Экологические процессы, ведущие к сближению сообществ, не обязательно включают вымирание или инвазию отдельных видов [25]. Обычно они проявляются в смене доминантов: увеличении доли широко распространенных и экологически пластичных видов (“winners”) при снижении участия редких и специализированных (“losers”) [18, 26, 27].
Настоящая статья – вторая часть работы, посвященной изучению многолетней динамики сообществ ММ на загрязненных территориях в период высоких, сниженных и почти прекратившихся выбросов крупного медеплавильного завода. В первой части [28] были представлены данные по динамике инвентаризационного разнообразия (α и γ), видового состава и обилия сообществ. Установлено, что за 30 лет наблюдений (1990–2019 гг.) характер реакции сообществ ММ на загрязнение принципиально не изменился: в каждый из трех периодов регистрировали значимое снижение α-разнообразия и суммарного обилия при приближении к заводу, однако значения γ-разнообразия в градиенте загрязнения не менялись. Поэтому представляет интерес проанализировать динамику β-разнообразия. Нам не известны исследования, в которых на основе многолетних ежегодных учетов оценивали β-разнообразие сообществ ММ, населяющих территории с разным уровнем загрязнения, причем до и после сокращения выбросов.
Цель данной работы – проанализировать многолетние изменения β-разнообразия сообществ ММ фоновых и загрязненных территорий. Тестировали следующие гипотезы: 1) в период высоких выбросов β-разнообразие выше на загрязненных территориях; 2) сокращение выбросов приводит к увеличению сходства сообществ фоновых и загрязненных территорий; 3) импактные сообщества более изменчивы во времени, чем фоновые.
МАТЕРИАЛ И МЕТОДЫ
Сбор материала
Описание района исследований, ключевых участков и методика сбора материала подробно изложены в первой части работы [28]. Работы выполнены на 7 ключевых участках, которые были сгруппированы в три зоны загрязнения: импактную (сильное загрязнение; 1, 1.5 и 2 км от завода), буферную (умеренное загрязнение; 4 и 6 км) и фоновую (загрязнение на уровне регионального фона; 20 и 30 км). Исследования охватывали 30 лет, которые пришлись на периоды высоких (1990–1997 гг., период I), сниженных (1998–2009 гг., II) и почти прекратившихся (2010–2020 гг., III) выбросов. Животных отлавливали ежегодно (май, июль, сентябрь), одновременно на всех ключевых участках. Деревянные ловушки-плашки устанавливали на стационарных маркированных линиях (25 шт. через 5–7 м на 3–5 сут с ежедневной однократной проверкой), на каждом участке в течение тура располагали от 2 до 4 линий. Отработано более 100 тыс. ловушко-суток, отловлено почти 6000 особей.
В качестве учетной единицы рассматривали ключевой участок. Для оценки обилия отдельных видов (число особей/100 ловушко-суток) использовали общее число животных данного вида, добытых на ключевом участке в течение года (за все учетные туры), нормированное на величину выборочного усилия (число ловушек × число суток отлова). В отдельные годы, приходящиеся на фазу депрессии численности, на некоторых ключевых участках импактной зоны регистрировали “нулевые” выборки (n = 7), не содержавшие ни одной особи при стандартном выборочном усилии. Для однозначной трактовки представленных результатов расчеты, в которых использовали данные по обилию отдельных видов, называли абсолютным обилием, а варианты с учетом долевого участия видов – относительным.
Анализ данных
Для оценки β-разнообразия ММ использовали индекс Уиттекера (βW) и расстояние Брея-Кертиса (IBC). Первый рассчитывали как отношение общего числа видов (γ) к среднему числу видов в пробе ($\bar {\alpha }$) и интерпретировали как меру изменчивости видового состава. При анализе динамики β-разнообразия в масштабе всего градиента загрязнения в качестве α-разнообразия принимали число видов, зарегистрированное на каждом ключевом участке в пределах года, γ – общее число видов на всех ключевых участках за учетный год. При анализе β-разнообразия во времени в пределах отдельного ключевого участка в качестве α-разнообразия использовали число видов за год, а γ-разнообразия – общее число видов за период.
Расстояние Брея-Кертиса учитывает различия и в видовом составе, и в соотношении обилия видов: оно меняется от 0 (сравниваемые сообщества идентичны) до 1 (сообщества абсолютно различаются). Сходство двух “нулевых” выборок принимали равным 0. В пределах отдельного ключевого участка β-разнообразие во времени рассчитывали как среднее расстояние между пробами с данного ключевого участка в течение учетного периода, в масштабе всего градиента загрязнения – как среднее расстояние между пробами со всех ключевых участков за учетный год.
Поскольку число выявленных видов тесно связано с объемом материала, а индекс Уиттекера может оказаться чувствительным к размеру выборки, мы рассчитали другие индексы β-разнообразия, учитывающие только видовой состав: β−I – по Routledge, β−2 – по Harrison, β−3 – по Williams, и среднее расстояние Чекановского-Съёренсена [29]. Результаты, полученные при использовании этих метрик, в нашем случае привели к сходным выводам и в статью они не включены.
Динамику сходства сообществ разных зон анализировали методом главных координат (PCoA) на основе расстояния Брея-Кертиса [30], степень воздействия на нее факторов среды оценивали с помощью алгоритма PERMANOVA (9999 пермутаций) [31]. Для этого исходные данные были объединены в трехлетние интервалы, соответствующие циклическим изменениям обилия доминирующих видов (Myodes glareolus и M. rutilus, 70–80% от общей численности в каждой зоне), что позволило снизить влияние межгодовых флуктуаций на структуру сообществ разных зон. Цикл 1999–2001 гг. был исключен из расчетов из-за неполноты данных. Статистическую значимость трендов динамики β-разнообразия оценивали с помощью общих линейных моделей (LM), используя год в качестве независимой переменной.
Наличие 3-хлетних циклов численности ММ позволяет представить значения сходства между сообществами в виде временны́х рядов. В использованной нами аддитивной модели каждое значение исходного признака – это сумма трех компонентов: тренда, периодической составляющей и случайного шума [30, 32]. Декомпозиция временнóго ряда позволила проанализировать все три компонента отдельно и сопоставить их между собой. Пропущенные значения реконструированы алгоритмом фильтрации Калмана [33] из пакета zoo [34].
В статистических тестах значимыми считали различия при p < 0.05. Бутстрепные доверительные интервалы для βW и IBC получены на основе 9999 итераций. Расчеты и визуализация выполнены в среде программирования R v.4.0.3 [35] при помощи пакетов ape [36], vegan [37] и ggplot2 [38]. Исходные данные и код размещены по адресу: github.com/ANSozontov/ betadiv_2020.
РЕЗУЛЬТАТЫ
Многолетняя динамика сходства сообществ
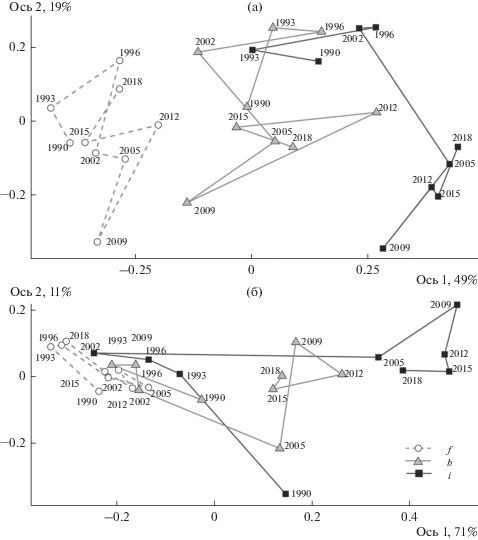
В течение всех 30 лет наблюдений максимально различались сообщества фоновой и импактной зон, буферной занимали промежуточное положение (рис. 1). Изменчивость фонового сообщества во времени выше при абсолютном, чем при относительном, обилии. Для импактного сообщества, характеризовавшегося стабильно низкими значениями абсолютного обилия, напротив, более высокую изменчивость демонстрировала ординация по долевому участию. Сообщество буферной зоны занимало промежуточное положение как по топологии в пространстве главных координат, так и по величине изменчивости: при учете абсолютного обилия оно “тяготело” к фоновой зоне, относительного обилия – к импактной.
Рис. 1.
Ординация во времени сообществ ММ разных зон загрязнения на основе абсолютного обилия видов (а) и их долевого участия (б). Зоны: f – фоновая, b – буферная, i – импактная. Данные объединены в 3-летние интервалы, указан начальный год каждого цикла.
Вклады пространственного (зона загрязнения) и временнóго (период исследования) факторов в варьирование структуры сообществ ММ различались: зоной загрязнения определялось 24% изменчивости, периодом – 9%, взаимодействие факторов (9%) также было значимым (табл. 1). Суммарная доля объясняемой дисперсии составила 42%.
Динамика β-разнообразия в масштабе всего градиента загрязнения
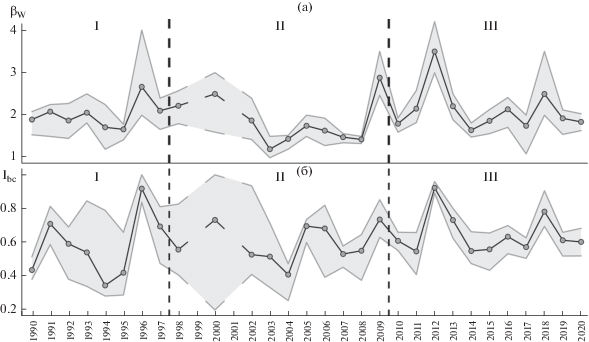
Значения показателей β-разнообразия, рассчитанные для всего градиента загрязнения на основе ежегодных регистраций, варьировали: βW – от 1.20 до 3.50, IBC – от 0.35 до 0.92 (рис. 2). Четко выраженные временны́е тренды отсутствовали (b = 0.003–0.004, p = 0.2–0.7). Максимальные значения приходились, как правило, на фазу депрессии (1996, 2005, 2009, 2012, 2018 гг.), а минимальные – пика (1995, 2004, 2014, 2017 гг.).
Рис. 2.
Многолетняя динамика βW (а) и IBC (б) сообществ ММ в масштабе всего градиента загрязнения. Вертикальные пунктирные линии отделяют периоды высоких (I), сниженных (II) и почти прекратившихся (III) выбросов. Данные за 1999 и 2001 гг. отсутствуют. Серым цветом показан 95%-ный доверительный интервал.
β-разнообразие во времени в масштабе ключевых участков
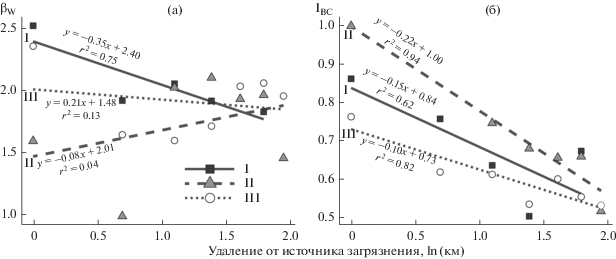
В период высоких выбросов по мере приближения к заводу регистрировали незначительное увеличение индекса βW (b = –0.35, p = 0.057), после сокращения выбросов (в периоды I и II) направленные изменения отсутствовали (b = 0.21 и –0.08, p = 0.431 и 0.655) (рис. 3а). Для IBC на протяжении всех трех периодов отмечались сходные изменения: по мере приближения к заводу величина индекса возрастала : для I периода b = –0.15, p = 0.115; для II и III периодов b = –0.10…–0.22, p = 0.001–0.005 (рис. 3б). В фоновой зоне β-разнообразие сообществ на протяжении 30 лет наблюдений поддерживалось на одном уровне: значения βW менялись в диапазоне от 1.83 до 2.06, IBC – от 0.52 до 0.67. На буферной территории перестройки были более выражены: значения βW варьировали от 1.72 до 2.10, IBC – от 0.51 до 0.68. На импактных территориях β-разнообразие достигало максимальных значений: βW менялось от 1.00 до 2.52, IBC – от 0.62 до 1.00.
Динамика компонентов сходства сообществ
На рис. 4 представлено разложение временнóго ряда расстояния Брея-Кертиса (1) на отдельные компоненты: линию тренда (2), циклические 3-летние изменения (3) и остатки (4). Для всех сравниваемых пар отмечали усиливающееся во времени расхождение сообществ (табл. 2). Максимально выраженные изменения регистрировали для расстояния между фоновой и импактной зонами. Начальный этап сокращения выбросов совпал с резким снижением сходства этих сообществ с последующей стабилизацией значений на более высоком уровне, сохраняющемся до сих пор. Сходство сообществ буферной и импактной зон в течение всех 30 лет наблюдений характеризовалось значительными межгодовыми флуктуациями, тогда как сообщества фоновой и буферной зон демонстрировали максимальное сходство. Во всех сравниваемых парах подавляющая часть дисперсии сходства объяснялась вкладом тренда (89–99%) и случайных факторов (около 5%). Вклад “циклической” компоненты был незначительным и в большинстве случаев не превышал 4%.
Рис. 4.
Динамика расстояния Брея-Кертиса (IBC) между сообществами трех зон загрязнения и разложение этого временного ряда на составляющие с учетом абсолютного обилия видов (а) и их долевого участия (б).

Таблица 2.
Результаты регрессионного анализа трендов динамики β-разнообразия сообществ
| Сравниваемые зоны | b1 | t-value | p-value |
|---|---|---|---|
| C учетом обилия видов | |||
| Фоновая – буферная | 0.006 | 3.28 | 0.003 |
| Фоновая – импактная | 0.008 | 4.77 | <0.0001 |
| Буферная – импактная | 0.006 | 2.81 | 0.009 |
| C учетом долевого участия видов | |||
| Фоновая – буферная | 0.009 | 5.21 | <0.0001 |
| Фоновая – импактная | 0.013 | 5.36 | <0.0001 |
| Буферная – импактная | 0.004 | 1.54 | 0.135 |
ОБСУЖДЕНИЕ
Как загрязнение влияет на β-разнообразие сообществ ММ?
Единого мнения по этому вопросу не существует: с одной стороны, характер и направление изменений β-разнообразия определяются действием множества факторов, с другой, количественные данные о β-разнообразии локальных сообществ наземных позвоночных в условиях промышленного загрязнения единичны. По аналогии с другими видами антропогенного воздействия можно ожидать и монотонное (увеличение/уменьшение), и нелинейное (U-образное/колоколообразное) изменение β-разнообразия в градиенте загрязнения. Преобладание в населении видов-генералистов, элиминация редких и специализированных видов в сочетании со способностью большинства видов к эффективному расселению по территории будут приводить к гомогенизации сообществ, т.е. снижению β-разнообразия. Например, такие изменения наблюдали в сообществах ММ, населяющих участки тропических лесов, трансформированные рубками [9], а также в сообществах пауков и мух-журчалок из агроценозов с разной степенью пестицидной нагрузки [10]. Напротив, нарушения метапопуляционной динамики отдельных видов в сочетании с высокой фрагментацией местообитаний создают предпосылки для формирования на отдельных участках уникального населения, следовательно, для увеличения β-разнообразия. Примером могут служить сообщества млекопитающих, занимающих территории с разной степенью хозяйственного освоения – агроландшафты [14], участки в окрестностях промышленных предприятий [15] либо подвергшиеся вырубке леса [11]. В некоторых случаях изменение β-разнообразия нелинейно: при сокращении количества пригодных местообитаний сообщества сначала становились менее похожими друг на друга, а затем их сходство увеличивалось [23]. Такой характер изменения β-разнообразия отмечали, например, в сообществах полужесткокрылых и растений [10]. Сообщества ММ часто оказываются более устойчивыми к нарушениям среды обитания в сравнении с другими таксономическими группами. Например, при интенсификации сельскохозяйственного производства в сообществах птиц и беспозвоночных отмечали исчезновение либо замену видов, тогда как видовой состав ММ в градиенте нагрузки оставался стабильным [12, 13].
Результаты наших исследований показали, что по мере приближения к заводу β-разнообразие сообществ постепенно увеличивалось (см. рис. 3). Наиболее выражены эти изменения были в первый период исследований, когда объемы промышленных выбросов СУМЗа многократно (валовые – в 50 раз, SO2 – в 80 раз, Cu – в 3000 раз, Pb – в 9 раз) превышали современные [39], а нарушения среды обитания в окрестностях завода были максимальными [40]. Особенно чувствительна к уровню загрязнения изменчивость видового состава, отражаемая индексом βW: в импактном сообществе его значения были выше фоновых. Этот эффект был менее выражен в отношении изменчивости населения (IBC) в I периоде, но сохранился во II и III периодах (см. рис. 3).
Наиболее специфичное население ММ формировалось на участках, граничащих с территорией техногенной пустоши (1–1.5 км). Сильно фрагментированные местообитания были малопригодны для существования ММ в течение полного жизненного цикла. Вероятно, такие депопулированные участки периодически (в бесснежный период) заселялись единичными транзитными особями разных видов мышевидных грызунов и мелких насекомоядных, причем в каждом сохранившемся “осколке” ресурсов хватало для ограниченного набора видов/особей. Помимо типично лесных видов, здесь регистрировались синантропы (Mus musculus) и виды, характерные для открытых пространств (Apodemus agrarius, Microtus arvalis), поэтому γ-разнообразие ММ могло быть значительным при крайне низких показателях α‑разнообразия и видового обилия [28]. В результате в период высоких выбросов население ММ вблизи завода характеризовалось наибольшей вариабельностью. Сообщество ММ буферной зоны по своим характеристикам (βW, IBC) было максимально сходным с населением прилегающего к ней импактного участка (2 км), что объясняется как сопоставимыми условиями обитания животных [28], так и территориальной близостью, способствующей интенсивному обмену видами [41]. Сообщество фоновой зоны отличалось наличием в своем составе супердоминанта (M. glareolus), остальные виды были малочисленны и присутствовали в отловах нерегулярно, что обусловило минимальные изменения β-разнообразия фонового сообщества в период высоких выбросов.
Таким образом, гипотеза об увеличении β-разнообразия сообществ при повышении техногенной нагрузки в период высоких выбросов получила в нашем исследовании существенную поддержку.
Как меняется β-разнообразие сообществ после снижения выбросов?
Логично ожидать, что сокращение промышленных выбросов инициирует процессы естественного восстановления лесных фитоценозов, которые в перспективе приведут к улучшению качества и количества местообитаний для разных видов ММ. Вероятным следствием такой трансформации среды будет увеличение сходства сообществ фоновой и загрязненных территорий. В первой части работы мы показали [28], что скорость подобных изменений неодинакова: в буферной зоне позитивные сдвиги в структуре сообществ ММ проявляются четче и охватывают разные трофические группы по сравнению с импактными участками.
Вопреки ожиданиям, сходство сообществ загрязненных и фоновой зон после сокращения выбросов не увеличилось. Напротив, во всех проанализированных парах зарегистрировано значимое расхождение сообществ (см. рис. 4, табл. 2). Поскольку показатели индексов βW и IBC, характеризующих сообщество фоновой зоны, в течение всего 30-летнего периода наблюдений варьировали незначительно, можно предположить, что снижение сходства с сообществами буферной и импактной зон обусловлено структурными перестройками, происходящими на загрязненных территориях.
Исчезновение редких видов, смена доминантов и изменения в долевом участии отдельных видов могут приводить к гомогенизации сообществ. Все перечисленные варианты отмечали в импактном сообществе в последние два десятилетия [28]. Снижение техногенной нагрузки (вследствие сокращения выбросов) сопровождалось сменой доминантов: М. glareolus заместился М. rutilus, а Sorex araneus – Sx. caecutiens. Причем перестройки были очень резкими и затронули как долевое участие (обоих видов), так и численность (только Sx. caecutiens) этих видов. Более того, видовые обилия грызунов (за исключением М. rutilus) к концу наблюдений даже снизились. Вероятной причиной подобных изменений может быть постепенное улучшение кормовой базы мелких насекомоядных [42] при отсутствии позитивных сдвигов в составе и обилии рациона фитофагов [43]. Кардинальные перестройки, которые пришлись на 2002–2007 гг., оказались настолько сильными, что население импактной зоны до и после снижения выбросов представлено двумя изолированными кластерами (см. рис. 1a). Эти изменения привели к обособлению сообщества импактной зоны, усиливающемуся во времени. Интересно, что после резкого скачка, совпавшего с началом сокращения выбросов (см. рис. 4), несходство фонового и импактного сообществ стабилизировалось на новом, более высоком, уровне.
Структурные перестройки в буферном сообществе выражались в увеличении числа доминирующих видов (с 2 до 4), которое сопровождалось эквивалентным ростом их долевого участия (за исключением М. glareolus) и обилия. Причем позитивные тренды отмечались в разных трофических группах – зоофагов, фитофагов, семеноядов [28]. Мы полагаем, что наблюдаемые изменения являются следствием постепенного восстановления среды обитания, в частности обилия и разнообразия кормовых ресурсов. Следствием этого стало усиление несходства буферного сообщества с остальными (см. рис. 4).
Таким образом, гипотеза об увеличении сходства сообществ фоновых и загрязненных территорий после сокращении выбросов не подтвердилась. Напротив, наши результаты свидетельствуют о дивергенции фоновых, буферных и импактных сообществ.
Какие сообщества более изменчивы: фоновые или импактные?
Полученные результаты убедительно свидетельствуют о том, что фоновые сообщества менее изменчивы во времени по сравнению с буферными и импактными, что выражается в минимальных структурных перестройках фонового сообщества (см. рис. 1) и низкой вариабельности индексов βW и IBC на протяжении 30 лет наблюдений. В сообществах буферной и, особенно, импактной зон подобные изменения имели бóльшую амплитуду и более выраженные тренды, вплоть до изменения доминантного комплекса. Если в фоновой зоне диапазон изменений индекса βW составлял 10%, в буферной – 20%, то в импактной – 250%. Причем размах колебаний βW импактного сообщества перекрывал буферные и фоновые значения. Сходная картина отмечалась и для индекса IBC: 30% – в фоновой и буферной зонах, до 60% – в импактной. Основной причиной значительных различий в вариабельности сравниваемых сообществ, на наш взгляд, могут быть условия существования животных в зонах с разным уровнем загрязнения: чем выше нестабильность среды, тем более вариабельны сообщества. Таким образом, наша гипотеза о меньшей изменчивости во времени фоновых сообществ подтвердилось полностью.
Результаты исследования позволяют также сделать вывод о ключевой роли исходного уровня загрязнения в формировании структуры сравниваемых сообществ ММ (см. табл. 1): даже спустя два десятилетия от начала сокращения выбросов этот фактор продолжает определять около 1/4 изменчивости. Вклад временнóй компоненты (период исследования) и взаимодействие факторов существенно ниже (9%).
На состав и численность ММ в окрестностях завода уровень загрязнения воздействует опосредованно – через качество местообитаний, разнообразие и доступность ресурсов. Наши результаты хорошо согласуются с литературными данными [44–46]. Мы полагаем, что прямое воздействие загрязнения, проявляющееся в избирательной элиминации особей, применительно к мышевидным грызунам и мелким насекомоядным незначительно вследствие их экологической пластичности и высокой подвижности. Основным механизмом реагирования, позволяющим животным минимизировать негативное влияние хронического загрязнения, является неравномерное размещение особей отдельных видов на наиболее пригодных для обитания микроучастках [15, 47] в сочетании с высокой миграционной подвижностью животных [41] и селективным отбором ими наименее загрязненных кормовых объектов [48–50].
ЗАКЛЮЧЕНИЕ
Нам не известны длительные исследования сообществ ММ в градиенте промышленного загрязнения, в которых на основе ежегодных регистраций проводили бы сравнения динамики видовой структуры до, во время и после сокращения выбросов. Гипотеза об увеличении β-разнообразия сообществ ММ в градиенте загрязнения при увеличении техногенной нагрузки в период высоких выбросов подтвердилась полностью: по мере приближения к заводу оно закономерно возрастало. При этом минимальным сходством характеризовались фоновые и импактные сообщества, а буферное занимало промежуточное положение: по видовому составу оно “тяготело” к импактному, а при учете видовых обилий – к фоновому. Ключевую роль в формировании структуры сравниваемых сообществ играл уровень загрязнения территории: вклад фактора составлял до 25%. Техногенное загрязнение значительно повышало изменчивость состава видов, в меньшей степени – соотношение их обилий. Вариабельность сообществ увеличивалась с ростом нестабильности среды обитания (по мере приближения к заводу).
Предположение о сближении сравниваемых сообществ ММ после многократного сокращения выбросов не подтвердилось. Во всех парах наблюдалось расхождение сообществ, усиливающееся во времени. В дальнейшем улучшение качества местообитаний на загрязненных участках, в первую очередь кормовых и защитных свойств, в сочетании с увеличением их экологической емкости и постепенным снижением фрагментированности создаст предпосылки для увеличения α-разнообразия сообществ, а также обилия отдельных видов. Эти факторы должны оказать существенное влияние на сходство сравниваемых сообществ. Вероятно, 20 лет – это недостаточный срок для выраженного восстановления сообществ ММ на сильно загрязненных территориях.
Анализ данных и подготовка рукописи выполнены в рамках государственного задания Института экологии растений и животных УрО РАН. Авторы благодарят Ю.Л. Суморокова, Е.Ю. Суморокову, С.Ю. Суморокова, А.А. Герасимова за участие в полевых работах, Е.Л. Воробейчика и анонимных рецензентов – за конструктивные замечания к тексту рукописи. Авторы заявляют об отсутствии конфликта интересов и подтверждают соблюдение применимых этических норм в работе с животными.
Список литературы
Уиттекер Р. Сообщества и экосистемы М.: Прогресс, 1980. 327 с.
Magurran A.E. Measuring biological diversity. Oxford, UK.: Blackwell Publishing, 2004. 256 p.
Anderson M.J., Crist T.O., Chase J.M. et al. Navigating the multiple meanings of beta-diversity: a roadmap for the practicing ecologist // Ecology Letters. 2010. V. 14. P. 1–15. https://doi.org/10.1111/j.1461-0248.2010.01552.x
Чернов Ю.И. Биологическое разнообразие: сущность и проблемы // Успехи соврем. биол. 1991. Т. 111. С. 499–507.
Socolar J.B., Gilroy J.J., Kunin W.E. et al. How should beta-diversity inform biodiversity conservation? // Trends in Ecology & Evolution. 2016. V. 31. № 1. P. 67–80.
Tscharntke T., Tylianakis J.M., Rand T.A. et al. Landscape moderation of biodiversity patterns and processes – eight hypotheses // Biol. Rev. 2012. V. 87. P. 661–685.
Cramer M.J., Willing M.R. Habitat heterogeneity, species diversity and null models // Oikos. 2005. V. 108. P. 209–218.
Pardini R., de Bueno A.A., Gardner T.A. et al. Beyond the fragmentation threshold hypothesis: Regime shift in biodiversity across fragment landscapes // PLoS One. 2010. V.5. №. 10. e13666. P. 1–10.
Püttker T., de Bueno A.A., Prado P.I. et al. Ecological filtering or random extinction? Beta-diversity patterns and the importance of niche-based and neutral processes following habitat loss // Oikos. 2015. V. 124. P. 206–215.
Dormann C.F., Schweiger O., Augenstein I.A. et al. Effects of landscape structure and land-use intensity on similarity of plant and animal communities // Global Ecol. Biogeogr. 2007. V. 16. P. 774–787.
Asfora P.H., Pontes A.R.M. The small mammals of the highly impacted North-eastern Atlantic Forest of Brazil, Pernambuco Endemism Center // Biota Neotrop. 2009. V. 9. №. 1. P. 31–35.
Burel F., Baudry J., Butet A. et al. Comparative biodiversity along a gradient of agricultural landscapes // Acta Oecologica. 1998. V. 19. P. 47–60.
Burel F., Butet A., Delettre Y.R. et al. Differential response of selected taxa to landscape context and agricultural intensification // Landsc. Urban Plan. 2004. V. 67. P. 195–204.
Decarre J. Diversity and structure of bird and mammal communities in the Semiarid Chaco Region: response to agricultural practices and landscape alterations // A thesis submitted for the degree of Doctor of Philosophy Division of Ecology and Evolution, Department of Life Sciences Imperial College London, 2015. 191 p.
Мухачева С.В., Давыдова Ю.А., Воробейчик Е.Л. Роль гетерогенности среды в сохранении разнообразия мелких млекопитающих в условиях сильного промышленного загрязнения // Докл. РАН. Сер. биологич. 2012. Т. 447. № 1. С. 106–109.
Krojerová-Prokešová J., Homolka M., Barančeková M. et al. Structure of small mammal communities on clearings in managed Central European forests // For. Ecol. Manage. 2016. V. 367. P. 41–51.
Jones S.K., Ripplinger J., Collins S.L. Species reordering, not changes in richness, drives long-term dynamics in grassland communities // Ecol. Lett. 2017. V. 20. P. 1556–1565.
McKinney M.L., Lockwood J.L. Biotic homogenization: A few winners replacing many losers in the next mass extinction // Trends Ecol. Evol. 1999. V. 14. P. 450–453.
Lavergne S., Thuiller W., Molina J. et al. Environmental and human factors influencing rare plant local occurrence, extinction and persistence: a 115-year study in the Mediterranean region // J. Biogeogr. 2005. V. 32. P. 799–811.
Tscharntke T., Brandl R. Plant-insect interactions in fragmented landscapes // Ann. Rev. Entomol. 2004. V. 49. P. 405–430.
Vickery J.A., Bradbury R.B., Henderson I.G. et al. The role of agri-environment schemes and farm management practices in reversing the decline of farmland birds in England // Biol. Conserv. 2004. V. 119. P. 19–39.
Hanski I. Metapopulation dynamics // Nature. 1998. V. 396. P. 41–49.
Hutton S.A., Giller P.S. The effects of the intensification of agriculture on northern temperate dung beetle communities // J. Appl. Ecol. 2003. V. 40. P. 994–1007.
Schweiger O., Maelfait J.P., van Wingerden W. et al. Quantifying the impact of environmental factors on arthropod communities in agricultural landscapes across organisational levels and spatial scales // J. Appl. Ecol. 2005. V. 42. P. 1129–1139.
Olden J.D., Poff N.L. Toward a mechanistic understanding and prediction of biotic homogenization // The American Naturalist. 2003. V. 162. P. 442–460.
Olden J.D., Rooney T.P. On defining and quantifying biotic homogenization // Global Ecol. Biogeogr. 2006. V. 15. P. 113–120.
Henle K., Davies K.F., Kleyer M. et al. Predictors of species sensitivity to fragmentation // Biodiv. and Conserv. 2004. V. 13. P. 207–251.
Мухачева С.В. Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. 1. Состав, обилие и разнообразие // Экология. 2021. № 1. С. 66–76.https://doi.org/10.1134/S1067413621010100
Koleff P., Lennon J.J., Gaston K.J. Measuring beta diversity for presence–absence data // J. Anim. Ecol. 2003. V. 72. P. 367–382.
Legendre P., Legendre L. Numerical ecology. 3-rd ed. Amsterdam, Oxford: Elsevier, 2012, 1006 p.
Anderson M.J. A new method for non-parametric multivariate analysis of variance // Austral Ecology. 2001. V. 26. P. 32–46.
Мастицкий С.Э. Анализ временных рядов с помощью R. 2020. Электронная книга, адрес доступа: https://ranalytics.github.io/tsawithr
Durbin J., Koopman S.J. Time series analysis by state space methods. 2-th ed. Oxford University Press, 2012. 129 p.
Zeileis A., Grothendieck G. Zoo: S3 Infrastructure for regular and irregular time series // J. of Statistical Software. 2005. V.14. № 6. P. 1–27.
R Core Team. 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL: https: //www. R‑project.org/
Paradis E., Schliep K. Ape 5.0: an environment for modern phylogenetics and evolutionary analyses in R // Bioinformatics. 2019. V. 35. P. 526–528.
Oksanen J., Blanchet M., Kindt R. et al. Vegan: Community Ecology Package. R package version 2.5-7. 2020.
Wickman H. ggplot2: Elegant Graphics for Data Analysis. New York: Springer-Verlag, 2016. 211+viii p.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024.
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: Наука, 1994. 280 с.
Мухачева С.В., Толкачёв О.В. Изучение миграционной подвижности мелких млекопитающих, населяющих техногенно трансформированные территории, методом группового мечения // Современные проблемы медицины и естественных наук. Йошкар-Ола: Мар. гос. ун-т, 2019. Вып. 8. С. 302–304.
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148. https://doi.org/10.1134/S1067413619020115
Трубина М.Р., Воробейчик Е.Л., Хантемирова Е.В. и др. Динамика лесной растительности после снижения промышленных выбросов: быстрое восстановление или продолжение деградации? // Докл. РАН. 2014. Т. 458. № 6. С. 721–725.
Лукьянова Л.Е., Лукьянов О.А. Реакция сообществ и популяций мелких млекопитающих на техногенные воздействия. 1. Сообщества // Успехи соврем. биол. 1998. Т. 118. Вып. 5. С. 613–622.
Москвитина Н.С., Кравченко Л.Б., Сучкова Н.Г. Динамика популяции европейской рыжей полевки (Clethrionomys glareolus Schreber) восточной периферии ареала // Сиб. эколог. журн. 2000. № 3. С. 373–382.
Гашев С.Н. Млекопитающие в системе экологического мониторинга (на примере Тюменской области). Тюмень: ТюмГУ, 2000. 220 с.
Мухачева С.В. Особенности пространственно-временного размещения населения рыжей полевки в градиенте техногенного загрязнения среды обитания // Экология. 2007. № 3. С. 178–184. https://doi.org/10.1134/S1067413607030034]
Зайченко О.А. Мелкие млекопитающие как индикатор антропогенных нагрузок. Природоохранные аспекты освоения ресурсов Минусинской котловины. Иркутск, Шушенское, 1990. С. 51–60.
Beernaert J., Scheirs J., Van Den Brande G. et al. Do wood mice (Apodemus sylvaticus L.) use food selection as a means to reduce heavy metal intake? // Environ. Pollut. 2008. V. 151. P. 599–607.
Ozaki S., Fritsch C., Valot B. et al. Does pollution influence small mammal diet in the field? A metabarcoding approach in a generalist consumer // Molecular Ecol. 2018. V. 27. P. 3700–3713.
Дополнительные материалы отсутствуют.