Экология, 2022, № 1, стр. 74-84
Подвижность сперматозоидов рыжей (Clethrionomys glareolus) и красной (Cl. rutilus) полевок в условиях промышленного загрязнения
Г. Ю. Смирнов *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: smirnov_gy@ipae.uran.ru
Поступила в редакцию 14.04.2021
После доработки 21.07.2021
Принята к публикации 23.07.2021
- EDN: KIVKXT
- DOI: 10.31857/S0367059722010103
Аннотация
У близкородственных видов грызунов – рыжей и красной полевок (Clethrionomys glareolus, n = 71; Cl. rutilus, n = 52), населяющих окрестности двух медеплавильных заводов на Среднем Урале, исследовали подвижность эпидидимальных сперматозоидов с учетом функциональной группы (сеголетки и перезимовавшие особи). Долю подвижных клеток (Motile) и показатели движения (VCL, VSL, VAP, ALH, BCF, STR, LIN) определяли с помощью автоматической системы анализа CASA (Hamilton Thorne, USA). Показатели подвижности сперматозоидов оказались видоспецифичными: скорость (VCL, VSL, VAP) и прямолинейность движения (LIN) у рыжей полевки оказалась выше, а частота колебаний головки (BCF) меньше по сравнению с красной. Подвижность сперматозоидов обоих видов не зависела от района и функциональной группы: у красной полевки подвижность не различались между участками с разной токсической нагрузкой, у рыжей полевки на сильно загрязненных участках доля подвижных клеток (Motile) и скорость сперматозоидов (VCL) были снижены по сравнению с фоновыми. Однако изменчивость показателей, обусловленная загрязнением, составляла всего 9 и 8% соответственно, т.е. показатели подвижности сперматозоидов грызунов из природных популяций слабо подвержены влиянию загрязнения.
Мелкие млекопитающие, населяющие промышленные районы, в процессе жизни подвергаются как непосредственному воздействию загрязненной токсикантами среды (в первую очередь через объекты питания – растения, беспозвоночных и воду), так и косвенному – через пессимизацию местообитаний [1–4]. Считается [4, 5], что приспособление к токсическим факторам среды реализуется на основе компенсаторных демографических реакций в популяциях. Для мелких насекомоядных и мышевидных грызунов в условиях техногенной деградации среды характерно снижение численности популяций и обеднение состава сообществ. Ключевая роль в адаптации, направленной на выживание вида в неблагоприятных условиях, принадлежит воспроизводству, однако, несмотря на обилие фактического материала, общие закономерности варьирования плодовитости животных, связанные с качеством среды обитания, до сих пор не выявлены [4, 5]. При этом большинство методов оценки фертильности животных из природных популяций (лабораторные эксперименты с затравкой, натурные наблюдения в природных биогеоценозах, математическое моделирование и экстраполяция и т.д.) базируется на методах, разработанных классической токсикологией [5].
Существует множество способов оценки мужской фертильности [6]. Одним из наиболее информативных методов, определяющих функциональные свойства половых клеток, считают оценку их подвижности [7]. Для лабораторных мышей (Swiss mice), например, установлены пороги “репродуктивного краха” – нижние уровни подвижности сперматозоидов, ведущие к резкому снижению фертильности самцов [8]. Подвижность сперматозоидов измеряют как “вручную”, с помощью счетных (Бюркера, Нойбауэра, Горяева, Петрова-Хауссера и др.) или специализированных камер (Маклера, MMC-SR), так и с помощью различных автоматизированных систем: Hamilton Thorne Sperm Analyser (IVOS, CEROS, USA), Sperm Class Analyzer (SCA, Spain), Androvision (Germany), MMC Сперм (Россия), SFA 500-2 (Россия) и др. У автоматического анализатора есть ряд преимуществ: он позволяет раскладывать движение клетки на несколько составляющих, что увеличивает информативность этого параметра. Кроме того, автоматический анализ более точен и надежен, что позволяет получать воспроизводимые данные и с некоторыми поправками сравнивать результаты разных исследователей [9].
Почти сразу после появления автоматических систем анализа спермы в середине 1980-х гг. они были апробированы в токсикологических экспериментах и для выявления эффектов загрязнения среды [10]. Однако до сих пор большинство работ этой направленности выполнены на человеке [11], хозяйственно значимых [12] и лабораторных животных [13]. Исследований животных из природных популяций значительно меньше [14, 15], а для условий загрязненной среды, за очень редким исключением [16, 17], практически нет.
Несмотря на то, что ежегодное количество исследований с использованием CASA (Сomputer-Assisted Sperm Analysis) составляет несколько сотен, у многих видов животных показатели подвижности сперматозоидов не изучены, поскольку отбор эякулята зачастую затруднен. У мышевидных грызунов отбор усложняется из-за небольших размеров репродуктивных органов и объема эякулята, поэтому у них чаще исследуют сперматозоиды из хвостовой части эпидидимиса как самые близкие по своим свойствам (жизнеспособности и фертильности) к сперматозоидам эякулята или клеткам из семявыносящего протока [18–20]. Полностью такие необходимые для естественного оплодотворения яйцеклетки свойства, как подвижность и капацитация, изначально иммобильные эпидидимальные сперматозоиды могут приобретать после добавления питательной среды, содержащей вещества, аналогичные семенной жидкости и веществам маточных путей [20, 21].
Большинство исследователей считают сперматозоиды чувствительными к загрязнению (например, для грызунов [3, 22]), однако до сих пор данные о качестве спермы животных из загрязненных территорий неполны и часто противоречивы: авторы не всегда обнаруживают токсические эффекты – уменьшение концентрации и подвижности сперматозоидов, а также увеличение доли аномальных клеток [20, 21, 23].
Цель настоящей работы – оценить влияние промышленного загрязнения, вызванного медеплавильным производством, на подвижность сперматозоидов двух близкородственных симпатрических видов грызунов: рыжую (Clethrionomys glareolus, Schreber, 1780) и красную (Cl. rutilus, Pallas, 1779) полевок.
Для оценки связи подвижности эпидидимальных сперматозоидов с уровнем загрязнения оценивали долю подвижных клеток и семь показателей, описывающих их движение. Ожидали, что высокий уровень загрязнения среды будет негативно влиять на показатели подвижности, а токсические эффекты будут выражены одинаково у обоих видов. Включение в анализ рыжей и красной полевок позволяет сравнить репродуктивный ответ близкородственных видов на условия загрязненной среды и проверить общность результатов.
Подвижность сперматозоидов полевок исследовали с учетом функциональных групп (сеголеток и перезимовавших особей), составляющих популяцию. Такая структура популяции, характерная для мышевидных грызунов природных зон умеренного пояса, обусловлена двумя вариантами онтогенеза, при которых сеголетки созревают в год своего рождения (I вариант) или на следующий год после зимовки (II вариант). Считается [24, 25], что вариант онтогенеза может детерминировать различные признаки животных, в том числе репродуктивные.
МАТЕРИАЛ И МЕТОДЫ
Район исследования
Работы проведены в окрестностях двух медеплавильных заводов – Среднеуральского (СУМЗ) и Кировградского (КМК). Оба предприятия расположены в одной ландшафтно-климатической зоне и имеют сопоставимый (на момент исследования) объем выбросов и сходный спектр приоритетных токсикантов – сернистый ангидрид (SO2), металлы (Cu, Zn, Pb, Cd, Fe, Hg и др.) и металлоиды (As). В результате многолетней работы предприятий (СУМЗ действует с 1940 г., КМК – с 1914 г.) в их окрестностях сформировались техногенные геохимические аномалии с повышенным в 10–100 раз по сравнению с фоновым содержанием металлов и других элементов в почве. Несмотря на реконструкцию предприятий и регистрируемое в последнее десятилетие снижение выбросов, степень их воздействия на экосистемы остается высокой [6, 26].
Участки отловов располагали на территориях с различной степенью поражения экосистем. Биотопы, в которых проводили отловы, представляли собой пихтово-еловые и смешанные леса. Зоны токсической нагрузки выделяли на основе геоботанических описаний и содержания металлов в лесной подстилке: незагрязненная, или фоновая зона (Bg, 20–40 км от заводов) и зона сильного загрязнения, или импактная (I, 1.5–6 км от заводов). С приближением к источнику выбросов наблюдали постепенную трансформацию различных параметров среды: увеличение содержания металлов в биосубстратах, пессимизацию микросредовых характеристик, снижение разнообразия и продуктивности травянистого и древесного ярусов и др. [4, 26, 27].
Отлов животных
В работе использовали материалы отловов мелких млекопитающих (рыжих и красных полевок) в 2018–2020 гг. Животных отлавливали с середины мая до конца августа с помощью деревянных трапиковых живоловок. Самцов передерживали 1–3 дня в лаборатории при естественном освещении и комнатной температуре. Животные получали овес, морковь и огурцы, для подстилки использовали древесные опилки и сено. Зверьков умерщвляли цервикальной дислокацией. По комплексу признаков (массе и размерам тела, состоянию половых желез, наличию тимуса и зубных корней) самцов дифференцировали на две функциональные группы – сеголеток (m) и перезимовавших особей (ow) [24]. В анализ включили только половозрелых самцов без видимых признаков инволюции семенников и семенных пузырьков. Различия, связанные с другими репродуктивными стадиями (созреванием, старением), в данной работе не исследовали [25].
Структура выборки отражала численность и состав сообществ грызунов в исследуемые годы (n = 123, табл. 1). Основную часть выборки составляли самцы, отловленные в годы высокой численности (2019–2020). При этом структура сообществ в разных зонах в районе СУМЗа различалась: на фоновых участках преобладала рыжая полевка, на импактных – доминировали оба вида [4].
Таблица 1.
Объем и структура выборок Cl. glareolus и Cl. rutilus для анализа подвижности сперматозоидов
| Вид | Источник загрязнения |
Зона загрязнения | Количество сеголеток/перезимовавших особей в разные годы | |||
|---|---|---|---|---|---|---|
| 2018 | 2019 | 2020 | все годы | |||
| Cl. glareolus | СУМЗ | Bg | 0/2 | 0/5 | 0/17 | 0/24 |
| I | 3/2 | 5/0 | 0/9 | 8/11 | ||
| КМК | Bg | 0/0 | 7/1 | 0/11 | 7/12 | |
| I | 0/0 | 0/0 | 5/4 | 5/4 | ||
| Cl. rutilus | СУМЗ | Bg | 1/0 | 0/0 | 0/1 | 1/1 |
| I | 2/0 | 8/1 | 6/8 | 16/9 | ||
| КМК | Bg | 0/0 | 6/1 | 0/5 | 6/6 | |
| I | 0/0 | 4/3 | 2/4 | 6/7 | ||
Определение подвижности сперматозоидов
После вскрытия у самцов извлекали эпидидимисы, делали тонкий прокол в их хвостовой части, с помощью микропипетки-дозатора (Proline, Sartorius AG, Finland, 0.1–2.5 мкл) отбирали 0.5 мкл эпидидимальной жидкости и помещали в питательную среду объемом 2 мл на 10–15 мин. Манипуляции с эпидидимисами выполняли под стереоскопическим микроскопом МС-2 (Биомед, Россия). Готовой суспензией заполняли обе камеры (по 10 мкл суспензии на камеру) предметных стекол (2X-CEL chamber, Hamilton Thorne, USA, глубина камеры 80 мкм) и закрепляли на нагревателе предметных стекол (MiniTherm, Hamilton Thorne, USA) под объективом микроскопа.
В качестве питательной среды использовали смесь растворов DMEM (Dulbecco’s Modified Eagle’s Medium, с L-глутамином и глюкозой 4.5 г/л) и 2% BSA (bovine serum albumin). Оба раствора – производства “БиолоТ”, Россия. Cмесь DMEM & BSA представляет собой модификацию питательных сред, применяемых для анализа подвижности сперматозоидов лабораторных мышей (Crlj:CD1 (ICR) mice) [28] и рыжих полевок из лабораторной колонии [29]. Готовую смесь разливали в стерильные микропробирки и помещали на термостолик (Микростат, Техном, Россия) при температуре 37°C.
Для анализа подвижности сперматозоидов использовали правый эпидидимис, кроме двух случаев выраженной асимметрии эпидидимисов (правый орган был в 2 раза меньше левого) и двух случаев технической ошибки при отборе проб. Подвижность измеряли с помощью системы CEROS CASA (Computer-assisted sperm analysis): специализированной программы MouseTraxx v. 12.3 (Hamilton Thorne, USA), микроскопа (Olympus CX41, Japan) и видеокамеры (Sony XC-ST50, Japan). Движение сперматозоидов снимали при увеличении объектива ×4 на 30 последовательных кадрах при скорости 60 кадр/с в 3 и более полях зрения. Клетки, попавшие только в часть отснятых кадров, в анализ не включали. Анализировали в среднем 450 (240–1782) треков движения сперматозоидов на особь. В данной работе исследовали долю подвижных клеток и показатели их движения (табл. 2, рис. 1). Подвижные клетки при этом не дифференцировали на медленные и прогрессивные.
Таблица 2.
Исследованные показатели подвижности сперматозоидов
| Обозначение показателя | Расшифровка | Единица измерения | Описание показателя |
|---|---|---|---|
| Motile | Motile cells | % | Доля подвижных клеток |
| VCL | Curvilinear line velocity | мкм/с | Скорость движения клетки по кривой отснятого трека |
| VSL | Straight line velocity | мкм/с | Скорость движения клетки по прямой от начала до конца трека |
| VAP | Average path velocity | мкм/с | Скорость движения клетки по усредненной траектории |
| ALH | Amplitude of lateral displacement | мкм | Амплитуда отклонения головки сперматозоида от усредненной траектории |
| BCF | Beat cross frequency | Гц | Частота колебаний головки сперматозоида |
| STR | Straightness | % | Прямолинейность усредненной траектории, степень направленности движения клетки, (VSL/VAP) ×100 |
| LIN | Linearity | % | Прямолинейность кривой отснятого трека, степень прямолинейности движения клетки, (VSL/VCL) ×100 |
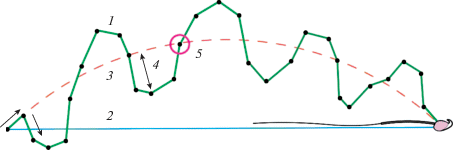
Рис. 1.
Схема показателей подвижности сперматозоидов: 1 – скорость криволинейного движения (VCL); 2 – скорость прямолинейного движения (VSL); 3 – скорость движения клетки по усредненному пути (VAP); 4 – амплитуда отклонения головки сперматозоида (ALH); 5 – частота колебаний головки сперматозоида (BCF); точки – положение клетки в момент съемки.
Статистический анализ
Статистический анализ выполнили в Statistica v. 8 (Statsoft Inc. 2007) и R (R Core Team 2020, IDE RStudio v. 1.4). Во всех случаях статистической единицей была особь. В расчетах использовали среднее арифметическое для особи, большинство показателей подвижности сперматозоидов имели нормальное распределение (тест Шапиро-Уилка). Структуру корреляций между показателями анализировали методом главных компонент.
Поскольку исходные данные представляют собой несбалансированный комплекс (см. табл. 1), влияние факторов (вид, функциональная группа, район, зона загрязнения) на подвижность сперматозоидов анализировали с помощью t-критерия Стьюдента. Для анализа доли объясненной дисперсии R2 использовали общие линейные модели (LM). Фактор “год” в данной работе не учитывали. Контроль над ожидаемой частотой ложных отклонений при множественных проверках статистических гипотез осуществляли с помощью поправки Беньямини-Йекутили (приведены скорректированные значения уровня значимости q).
РЕЗУЛЬТАТЫ
Доля подвижных сперматозоидов у разных видов не различалась, однако у Cl. glareolus по сравнению с Cl. rutilus оказались выше все показатели скорости и ниже значения BCF (табл. 3). Из-за видоспецифичности показателей далее их анализировали отдельно для каждого вида.
Таблица 3.
Показатели подвижности сперматозоидов Cl. glareolus и Cl. rutilus из фоновых территорий
| Показатель | Cl. glareolus, n = 43 |
Cl. rutilus, n = 14 |
q |
|---|---|---|---|
| Motile, % | 59.7 ± 1.35 (40.6–74.4) |
53.4 ± 2.84 (36.0–70.9) |
0.130 |
| VCL, мкм/с | 251.2 ± 4.88 (183.2–345.5) |
223.6 ± 6.23 (185.1–267.7) |
0.024 |
| VSL, мкм/с | 198.5 ± 3.62 (145.2–245.6) |
173.3 ± 6.82 (147.4–230.0) |
0.001 |
| VAP, мкм/с | 216.6 ± 3.89 (153.5–264.4) |
188.7 ± 6.62 (156.9–244.2) |
0.001 |
| ALH, мкм | 9.12 ± 0.27 (6.88–12.96) |
9.0 ± 0.53 (6.23–13.4) |
1.000 |
| BCF, Гц | 35.5 ± 0.48 (28.9–41.9) |
38.9 ± 0.92 (29.5–46.4) |
0.001 |
| STR, % | 91.1 ± 0.43 (83.3–96.3) |
91.3 ± 0.93 (83.2–96.5) |
1.000 |
| LIN, % | 79.0 ± 0.69 (68.0– 87.0) |
78.1 ± 1.73 (65.9–86.2) |
1.000 |
Примечание. Motile – доля подвижных клеток, VCL – скорость криволинейного движения, VSL – скорость прямолинейного движения, VAP – скорость движения клетки по усредненному пути, ALH – амплитуда отклонения головки сперматозоида, BCF – частота колебаний головки сперматозоида, STR – степень направленности движения клетки, LIN – степени прямолинейности движения клетки. Приведены среднее ± ошибка среднего, минимальные и максимальные значения показателей.
У Cl. glareolus на первые две главные компоненты (PC 1 и PC 2) изменчивости показателей подвижности сперматозоидов приходилось 76.9% общей дисперсии, у Cl. rutilus – 76% (табл. 4). В первую главную компоненту у обоих видов основной вклад вносили показатели, характеризующие скорость сперматозоидов, во вторую – направленность движения. Для дальнейшего анализа выбрали два прозрачно интерпретируемых показателя с высокими факторными нагрузками, не коррелирующие между собой, – VCL (PC 1) и STR (PC 2). Также анализировали долю подвижных клеток (Motile). На выбранные показатели не влияли ни функциональная группа, ни район отловов (для Cl. glareolus |t| = 0.31–1.65, p = 0.103–0.756; для Cl. rutilus |t| = 0.25–1.66, p = 0.103–0.805), что позволило объединить животных разных групп и из разных районов.
Таблица 4.
Факторные нагрузки двух главных компонент (PC 1 и PC 2) по показателям подвижности сперматозоидов Cl. glareolus и Cl. rutilus
| Показатель | Cl. glareolus | Cl. rutilus | ||
|---|---|---|---|---|
| PC 1 | PC 2 | PC 1 | PC 2 | |
| VCL, мкм/с | 0.89 | –0.25 | 0.90 | –0.35 |
| VSL, мкм/с | 0.95 | 0.24 | 0.97 | 0.20 |
| VAP, мкм/с | 0.98 | 0.02 | 0.98 | –0.09 |
| ALH, мкм | 0.24 | –0.93 | 0.35 | –0.92 |
| BCF, Гц | –0.45 | 0.34 | –0.28 | 0.27 |
| STR, % | 0.07 | 0.96 | 0.00 | 0.97 |
| LIN, % | 0.53 | 0.78 | 0.12 | 0.93 |
| Доля общей дисперсии, % | 43.2 | 33.7 | 38.9 | 37.1 |
Влияние зоны загрязнения на Motile и VCL у рыжей полевки оказалось значимым: на импактных участках доля подвижных клеток и их скорость оказались ниже, чем у красной (tMotile = –2.60, p = 0.011; tVCL = –2.43, p = 0.018) (рис. 2). Однако фактор “зона загрязнения” объяснял только 9% общей дисперсии для Motile и 8% – для VCL. У красной полевки оба показателя не различались между зонами (tMotile = –0.21, p = 0.837; tVCL = –1.87, p = 0.067).
Рис. 2.
Доля подвижных сперматозоидов (Motile, %) и скорость движения сперматозоидов по кривой (VCL, мкм/с) у Cl. glareolus и Cl. rutilus на фоновых (без заливки) и импактных (серая заливка) участках. Горизонтальная черта – медиана, границы ящика – межквартильный размах, усы – минимальное и максимальное значения, не превышающие 1.5 межквартильных размаха, точка – выброс. Звездочкой (*) отмечены различия при p < 0.05.
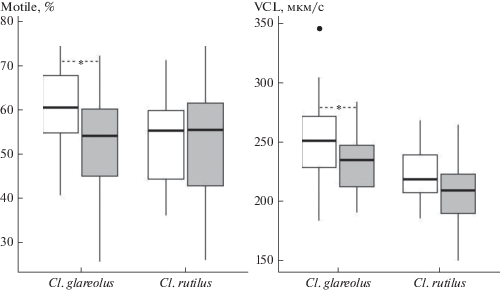
Показатель направленности движения (STR) сперматозоидов у обоих видов не различался между зонами: для Cl. glareolus t = 0.60, p = 0.548, для Cl. rutilus t = –0.76, p = 0.451.
Несмотря на то, что у красной полевки эффектов, связанных с зоной загрязнения, не обнаружено, изменчивость показателя VCL на импактных участках была выше, чем на фоновых (CVBg = = 10.43; CVI = 13.18). Также у обоих видов на этих участках была выше изменчивость показателя Motile: для рыжей полевки – CVBg = 14.85; CVI = 25.18; для красной – CVBg = 19.02; CVI = 23.37, причем только на импактных участках встречались животные с крайне низкими показателями подвижности сперматозоидов (см. рис. 2).
ОБСУЖДЕНИЕ
Референтные видовые значения показателей подвижности сперматозоидов
Несмотря на значительное количество работ о подвижности сперматозоидов, выполненных с помощью автоматических анализаторов [9, 30], для многих видов мелких млекопитающих сведения об этом параметре отсутствуют. Мы могли сравнить наши данные только для рыжей полевки. Так, M. Kotula-Balak et al. [31] приводят данные о подвижности сперматозоидов для 2-месячных самцов Cl. glareolus из лабораторной колонии, а M. Tourmente et al. [32] – для Cl. glareolus (n = 4) из природной популяции. Полученные нами средние значения показателей скорости движения сперматозоидов (VCL, VSL, VAP) отличаются от данных этих авторов (выше в 1.5–2 раза), при этом показатель частоты колебаний головки (BCF) был сходным. Причины различий могут быть разными – от особенностей выборок и условий содержания животных до методов отбора и анализа образцов спермы. К наиболее вероятным причинам, связанным с отбором и анализом образцов, относят глубину камер, состав питательной среды, соблюдение температурного режима во время анализа, время предынкубации, опыт работы исследователя, разное программное обеспечение приборов [9].
Влияние состава питательной среды на подвижность клеток не всегда очевидно. Так, сравнение разных питательных сред показало, что добавление кальция, магния или глюкозы не улучшает показатели движения сперматозоидов в краткосрочной перспективе, напротив, альбумин необходим для длительного поддержания подвижности [28]. В то же время цитируемые авторы [31, 32] использовали разные среды (IVF с глюкозой (≈1 г/л) и альбумином, и mT-H с глюкозой (6 г/л) без альбумина), но получили в целом сходные значения показателей подвижности.
Высокую степень корреляции показателей скорости движения (VCL, VSL, VAP) сперматозоидов, обнаруженную нами у обоих видов полевок (см. табл. 4), показали также L. Gómez Montoto et al. (2011) для 11 видов грызунов, M. Tourmente et al. (2015) для 18 видов, включая Cl. glareolus [32, 33]. Сходство связей показателей, приводимое этими авторами, может быть косвенным свидетельством валидности проведенного нами анализа. Кроме того, высокая степень корреляции показателей VCL, VSL, VAP является еще одним свидетельством прямолинейности их движения наряду с рассчитываемыми показателями STR и LIN.
A. Valverde et al. [34] на примере спермы хряков показали, что значения VSL и ALH устойчивы к настройкам съемки движения клеток. Этот важный результат позволяет ограничить список потенциальных факторов, влияющих на показатели подвижности сперматозоидов конкретного вида, двумя основными – особенностями методики отбора образцов и выборок. После стандартизации процедур отбора и анализа спермы показатели подвижности могут быть непосредственно интерпретированы как свойственные данной выборке (популяционной группе). Поскольку стандартизация отбора образцов спермы у мелких млекопитающих пока не достигнута, получение референтных значений для них возможно только в отдельно взятой лаборатории.
Межвидовые различия показателей подвижности сперматозоидов
Форма, размер и подвижность сперматозоидов являются следствием полового отбора и отражают их основную функцию – доставку генома самца в яйцеклетку [35–37]. Причиной эволюции размеров и формы сперматозоидов млекопитающих разные авторы считают меж- и внутривидовую конкуренцию [33, 38–40]. Так, М. Tourmente et al. [41] показали, что с возрастанием конкуренции увеличиваются все структурные элементы клетки, причем головки сперматозоидов становятся более вытянутыми. Эти авторы также обнаружили, что увеличение длины сперматозоидов связано с ростом скорости движения – адаптивной характеристикой при конкуренции.
Мы обнаружили, что при одинаковой доле подвижных клеток показатели скорости сперматозоидов рыжей полевки были выше, чем у красной (см. табл. 3). Однако некоторые морфометрические признаки сперматозоидов – длина головки, средней части хвоста и в целом всей клетки, наоборот, у красной полевки больше, чем у рыжей [42]. Форма головки сперматозоида у двух видов также несколько различается: у Cl. glareolus она утолщена в базальной части, у Cl. rutilus более вытянута.
Известно также, что у рыжей полевки по сравнению с красной выше индекс семенника (отношение массы органа к массе тела) и уровень тестостерона в тестикулах, но ниже уровень этого гормона в крови [43]. Для физиологии размножения животных (в том числе полевок) этот показатель чрезвычайно важен, так как может указывать на уровень производства половых гормонов и сперматозоидов и, как следствие, отражать степень меж- и внутривидовой конкуренции между самцами (т.е. чем выше индекс семенника, тем выше конкурентоспособность спермы вида или особи) [39, 44–46]. Связь подвижности сперматозоидов с массой тела, семенников и придаточных желез у Cl. glareolus из лабораторной колонии обнаружили M. Kruzcek et al. [29]. Увеличение подвижности половых клеток авторы объясняли секреторной активностью придаточных половых желез, которые находятся под непосредственным контролем андрогенов. В свою очередь уровень андрогенов (в том числе тестостерона) связан с ростом и развитием половых органов. Однако в больших количествах тестостерон может подавлять выработку спермы, а также секрецию гормонов гипофиза (ФСГ и ЛГ), участвующих в контроле стероидогенеза [47].
На первый взгляд, конкурентное преимущество должны иметь самцы с более крупными половыми органами и сперматозоидами, однако, по-видимому, успешность репродукции вида обусловлена более сложными взаимодействиями (структурными и биохимическими) элементов репродуктивной системы, а не только их размерами. Необходимо также отметить, что различия формы, размеров и подвижности сперматозоидов рыжей и красной полевок не препятствуют их гибридизации в лаборатории [48] и природе [49].
Подвижность сперматозоидов у самцов разных функциональных групп
Cвязь подвижности сперматозоидов с возрастом, как и многие другие аспекты анализа качества спермы, чаще изучают у человека [50], хозяйственно значимых [51], лабораторных [52] и диких животных в эксперименте [29, 53]. Для животных из природных популяций таких работ значительно меньше, однако известны примеры возрастной изменчивости показателей подвижности спермы у южноафриканского гепарда (Acinonyx jubatus) [54] и испанского благородного оленя (Cervus elaphus hispanicus) [55]. У некоторых видов долгоживущих животных (сельскохозяйственных и диких) изучали сезонную компоненту возрастных изменений подвижности спермы [51, 56].
Влияние абсолютного возраста на долю прогрессивно подвижных сперматозоидов Cl. glareolus из лабораторной колонии обнаружили M. Kruzcek et al. [29]: самая высокая доля этого класса клеток была у 4-месячных самцов по сравнению с более молодыми и более старыми. Авторы также обнаружили, что с 6-месячного возраста до конца репродуктивного периода (возраст 15 мес.) качество спермы (включая показатели подвижности) полевок значительно снижалось.
Для мышевидных грызунов природных зон умеренного пояса характерно бивариантное развитие, при котором одна часть животных в популяции созревает в год рождения (I вариант, сеголетки, продолжительность жизни 3–5 мес.), другая – на следующий год после зимовки (II вариант, перезимовавшие особи, продолжительность жизни 13–14 мес.) [24]. Существует несколько гипотез относительно того, с чем связаны физиологические особенности каждой из этих групп: среди них называют наличие зимней диапаузы, кумулятивное действие разных факторов среды и т.д. Однако до сих пор большинство авторов, за редким исключением [57], описывают феноменологию различий, а не механизмы поливариантности развития.
Ранее мы показали [25] для Cl. glareolus, что для анализа морфологии нормальных сперматозоидов не важно, на какой стадии зрелости/старения находятся животные и когда они достигают половозрелости. Однако частота сперматозоидов с дефектами головки была существенно ниже у половозрелых сеголеток по сравнению с перезимовавшими особями, поэтому при анализе аномальных клеток следует учитывать вариант онтогенеза животных. Кроме того, мы также не обнаружили различий показателей подвижности сперматозоидов у половозрелых самцов разных функциональных групп. Однако нельзя исключить, что это связано с небольшим объемом выборок и несбалансированностью в них возрастного состава (см. табл. 1).
Влияние токсического воздействия на подвижность сперматозоидов
В токсикологическом эксперименте, как правило, отмечают дозовую зависимость между уровнями токсикантов и показателями подвижности. Так, у опытной группы Cl. glareolus из лабораторной колонии при затравке сульфатом меди и хлоридом алюминия обнаружено снижение доли подвижных сперматозоидов по сравнению с контрольными животными (с 82 до 61%) [3, 22]. При этом снижение подвижности сперматозоидов сопровождалось увеличением доли клеток с аномальной головкой. Авторы предположили, что, например, медь при высоких концентрациях могла вызывать окислительный стресс, повреждающий сперматозоиды и, как следствие, снижающий их подвижность и оплодотворяющую способность.
L.V. Tannenbaum et al. [16, 17] исследовали сперму разных видов грызунов, обитающих на участках, в почве которых содержатся высокие уровни тяжелых металлов, тротила, гексогена и других опасных веществ. Они показали, что метод оценки спермы грызунов (Rodent Sperm Analysis, RSA) хорошо дискриминирует чистые и загрязненные территории. Однако, несмотря на статистические различия показателей сперматозоидов грызунов из фоновых и загрязненных участков, эти различия не превышали пороговых (40–50% – для показателей подвижности клеток, 60% – для количества подвижных клеток) для признания территории опасной [17]. Главным аргументом для проведения такой высокой границы служит большое количество производимых грызунами сперматозоидов, в 10–20 раз превышающее необходимое для успешной репродукции.
Почти все цитируемые авторы исследовали комплекс показателей спермы. Так, М. Kotula-Balak et al. [31] показали разнонаправленное влияние фотопериода и ксеноэстрогенов на показатели подвижности сперматозоидов Cl. glareolus, причем оба фактора влияли на изменение доли сперматозоидов с дефектами хвоста: при коротком световом дне и затравке ксенобиотиками доля патологических клеток увеличивалась. В эксперименте с затравками сульфатом меди и хлоридом алюминия у Cl. glareolus в опытной группе уменьшались и доля подвижных клеток, и доля морфологически нормальных клеток [3, 22].
Наоборот, L.V. Tannenbaum et al. [16] у белоногого хомячка (Peromyscus leucopus) возле завода боеприпасов (RVAAP) не обнаружили влияния загрязнения ни на долю подвижных сперматозоидов (она составляла 94–99%), ни на долю патологических клеток (они отсутствовали). В другом исследовании этих же авторов, проведенном на нескольких видах грызунов из разных районов, доля подвижных клеток животных не коррелировала с долей аномальных клеток: изменения доли подвижных клеток на фоновых и загрязненных территориях достигали 47%, а частота патологий не превышала 0.1% [17].
Несмотря на противоречивость опубликованных данных, комплексный анализ показателей спермы представляется важным, поскольку позволяет оценить согласованность их изменений. Так, Л.В. Осадчук и М.А. Клещёв [58] показали, что у мышей линии CBA/Lac низкое содержание сперматозоидов в обоих эпидидимисах (эпидидимальный резерв) сопровождалось увеличением их подвижности и снижением доли аномальных клеток. По мнению этих авторов, поддержание фертильности самцов на оптимальном уровне может обеспечиваться компенсаторным характером изменчивости показателей спермы.
Мы пока только косвенно и только для одного вида – рыжей полевки – могли сопоставить показатели подвижности сперматозоидов с их морфологией. На загрязненных участках возле СУМЗа частота аномальных клеток [59] и подвижность сперматозоидов были ниже, чем на фоновых участках. Чтобы понять, является ли это компенсационным механизмом, необходимо сопоставить данные морфологии, концентрации и подвижности сперматозоидов у одних и тех животных, что мы предполагаем выполнить в дальнейшем.
ЗАКЛЮЧЕНИЕ
Для близкородственных симпатрических видов грызунов (Clethrionomys glareolus, Cl. rutilus), населяющих окрестности двух медеплавильных заводов, проверяли гипотезу о снижении подвижности сперматозоидов под действием загрязнения. Для Cl. rutilus подвижность эпидидимальных сперматозоидов изучена впервые. Также впервые показатели подвижности исследованы с учетом функциональной группы грызунов. Как и для морфологических признаков нормальных сперматозоидов [25], для анализа подвижности оказалось не важно, когда животные достигают половозрелости – в год своего рождения или на следующий год после зимовки.
Наша гипотеза подтвердилась частично. Токсические эффекты – снижение доли подвижных клеток и их скорости на загрязненных участках – обнаружены только у рыжей полевки. Отсутствие токсических эффектов у красной полевки может быть связано с небольшими размерами выборки.
В целом полученные результаты свидетельствуют о том, что показатели подвижности сперматозоидов грызунов из природных популяций слабо подвержены влиянию загрязнения, что можно объяснить рядом причин: пространственной мозаичностью токсической нагрузки, подвижностью грызунов, которая позволяет избегать неблагоприятных местообитаний, небольшим уровнем регистрируемого загрязнения, недостаточным для существенного сдвига исследуемых репродуктивных показателей.
Несмотря то, что обнаруженные эффекты оказались слабы, анализ спермы животных, в том числе показателей подвижности, в отличие от косвенных оценок риска для природных популяций позволяет непосредственно оценивать здоровье и качество репродукции животных в меняющихся условиях среды.
Выражаю благодарность Е.Л. Воробейчику – за обсуждение результатов, Ю.А. Давыдовой – за всестороннюю помощь и постоянную поддержку. Исследование выполнено при поддержке РФФИ (проект № 19-34-90004).
Автор заявляет об отсутствии конфликта интересов и подтверждает, что все процедуры, выполняемые при работе с животными, соответствовали этическим нормам Института экологии растений и животных РАН.
Список литературы
Wijnhoven S., Leuven R.S.E.W., van der Velde G. et al. Heavy-metal concentrations in small mammals from a diffusely polluted floodplain: importance of species-and location-specific characteristics // Archives of Environmental Contamination and Toxicology. 2007. V. 52. № 4. P. 603–613.
Lukáň M. Heavy metals in alpine terrestrial invertebrates // Oecologia Montana. 2009. V. 18. № 1–2. P. 31–38.
Miska-Schramm A., Kruczek M., Kapusta J. Effect of copper exposure on reproductive ability in the bank vole (Myodes glareolus) // Ecotoxicology. 2014. V. 23. № 8. P. 1546–1554.
Мухачева С.В. Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. 1. Состав, обилие и разнообразие // Экология. 2021. № 1. С. 66–76. [Mukhacheva S.V. Long-term dynamics of small mammal communities in the period of reduction of copper smelter emissions. 1. Composition, abundance, and diversity // Russ. J. Ecol. 2021. V. 52. № 1. P. 84–93.]
Безель В.С. Экологическая токсикология: популяционный и биоценотический аспекты. Екатеринбург: “Гощицкий”, 2006. 280 с.
Van der Horst G., du Plessis S.S. Not just the marriage of Figaro: but the marriage of WHO/ESHRE semen analysis criteria with sperm functionality // Adv. Androl. Online. 2017. V. 4. P. 6–21.
Amann R.P., Waberski D. Computer-assisted sperm analysis (CASA): capabilities and potential developments // Theriogenology. 2014. V. 81. № 1. P. 5–17.
Chapin R.E., Sloane R.A., Haseman J.K. The relationships among reproductive endpoints in Swiss mice, using the reproductive assessment by continuous breeding database // Toxicological Sciences. 1997. V. 38. № 2. P. 129–142.
Yeste M., Bonet S., Rodríguez-Gil J.E., Del Álamo M.M.R. Evaluation of sperm motility with CASA-Mot: which factors may influence our measurements? // Reproduction, Fertility and Development. 2018. V. 30. № 6. P. 789–798.
Amann R.P., Katz D.F. Andrology lab corner*: Reflections on casa after 25 years // Journal of Andrology. 2004. V. 25. № 3. P. 317–325.
Nobles C.J., Schisterman E.F., Ha S. et al. Ambient air pollution and semen quality // Environmental Research. 2018. V. 163. P. 228–236.
Silva E.F.D.S.J., Missio D., Martinez C.S. et al. Mercury at environmental relevant levels affects spermatozoa function and fertility capacity in bovine sperm // Journal of Toxicology and Environmental Health. Part A. 2019. V. 82. № 4. P. 268–278.
Adamkovicova M., Toman R., Cabaj M. et al. Computer assisted semen analysis of epididymal spermatozoa after an interperitoneal administration of diazinon and cadmium // Scientific Papers Animal Science and Biotechnologies. 2012. V. 45. № 1. P. 105–110.
Gizejewski Z., Szafranska B., Steplewski Z. et al. Cottonseed feeding delivers sufficient quantities of gossypol as a male deer contraceptive // European J. of Wildlife Research. 2008. V. 54. № 3. P. 469–477.
Baberschke N., Schaefer F., Meinelt T., Kloas W. Ion-rich potash mining effluents affect sperm motility parameters of European perch, Perca fluviatilis, and impair early development of the common roach, Rutilus rutilus // Science of the Total Environment. 2021. V. 752. № 15. P. 141938.
Tannenbaum L.V., Bazar M., Hawkins M.S. et al. Rodent sperm analysis in field-based ecological risk assessment: pilot study at Ravenna army ammunition plant, Ravenna, Ohio // Environmental Pollution. 2003. V. 123. № 1. P. 21–29.
Tannenbaum L.V., Thran B.H., Williams K.J. Demonstrating ecological receptor health at contaminated sites with wild rodent sperm parameters // Archives of Environmental Contamination and Toxicology. 2007. V. 53. № 3. P. 459–465.
Lakoski K.A., Carron C.P., Cabot C.L., Saling P.M. Epididymal maturation and the acrosome reaction in mouse sperm: response to zona pellucida develops coincident with modification of M42 antigen // Biology of Reproduction. 1988. V. 38. № 1. P. 221–233.
Seed J., Chapin R.E., Clegg E.D. et al. Methods for assessing sperm motility, morphology, and counts in the rat, rabbit, and dog: a consensus report // Reproductive Toxicology. 1996. V. 10. № 3. P. 237–244.
Monteiro G.A., Papa F.O., Zahn F.S. et al. Cryopreservation and fertility of ejaculated and epididymal stallion sperm // Animal Reproduction Science. 2011. V. 127. № 3–4. P. 197–201.
Li H., Hung P., Suarez S.S. Ejaculated mouse sperm enter cumulus-oocyte complexes more efficiently in vitro than epididymal sperm // PLoS One. 2015. V. 10. № 5. P. e0127753.
Miska-Schramm A., Kapusta J., Kruczek M. The effect of aluminum exposure on reproductive ability in the bank vole (Myodes glareolus) // Biological Trace Element Research. 2017. V. 177. № 1. P. 97–106.
Llobet J.M., Colomina M.T., Sirvent J.J. et al. Reproductive toxicology of aluminum in male mice // Fundamental and Applied Toxicology. 1995. V. 25. № 1. P. 45–51.
Оленев Г.В. Определение возраста цикломорфных грызунов, функционально-онтогенетическая детерминированность, экологические аспекты // Экология. 2009. № 2. С. 103–115. [Olenev G.V. Determining the age of cyclomorphic rodents: Functionalontogenetic determination, ecological aspects // Russ. J. Ecol. 2009. V. 40. № 2. P. 93–104.]
Смирнов Г.Ю., Давыдова Ю.А. Онтогенетические изменения морфологии сперматозоидов рыжей полевки (Clethrionomys glareolus) // Экология. 2020. № 2. С. 156–159. [Smirnov G.Yu., Davydova Yu.A. Ontogenetic сhanges in bank vole (Clethrionomys glareolus) sperm morphology // Russ. J. of Ecol. 2020. V. 51. № 2. P. 195–198.]
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. [Vorobeichik E.L., Kaigorodova S.Yu. Long-term dynamics of heavy metals in the upper horizons of soils in the region of a copper smelter impacts during the period of reduced emission // Eurasian Soil Science. 2017. V. 50. № 8. P. 977–990.]
Трубина М.Р., Воробейчик Е.Л., Хантемирова Е.В. и др. Динамика лесной растительности после снижения промышленных выбросов: быстрое восстановление или продолжение деградации? // Докл. РАН. 2014. Т. 458. № 6. С. 721–725. [Trubina M.R., Vorobeichik E.L., Khantemirova E.V. et al. Dynamics of forest vegetation after the reduction of industrial emissions: Fast recovery or continued degradation? // Doklady Biological Sciences. 2014. V. 458. № 1. P. 302–305.]
Tayama K., Fujita H., Takahashi H. et al. Measuring mouse sperm parameters using a particle counter and sperm quality analyzer: a simple and inexpensive method // Reproductive Toxicology. 2006. V. 22. № 1. P. 92–101.
Kruczek M., Styrna J., Kapusta J. Reproductive capacity of male bank voles (Myodes glareolus Schreber, 1780) – age-dependent changes in functional activity of epididymal sperm // Belgian Journal of Zoology. 2013. V. 143. № 2. P. 131–141.
Van der Horst G., Maree L., du Plessis S.S. Current perspectives of CASA applications in diverse mammalian spermatozoa // Reproduction, Fertility and Development. 2018. V. 30. № 6. P. 875–888.
Kotula-Balak M., Grzmil P., Chojnacka K. et al. Do photoperiod and endocrine disruptor 4-tert-octylphenol effect on spermatozoa of bank vole (Clethrionomys glareolus)? // General and Comparative Endocrinology. 2014. V. 201. P. 21–29.
Tourmente M., Villar-Moya P., Varea-Sánchez M. et al. Performance of rodent spermatozoa over time is enhanced by increased ATP concentrations: the role of sperm competition // Biology of Reproduction. 2015. V. 93. № 3. P. 64, 1–13.
Gómez Montoto L., Sánchez M.V., Tourmente M. et al. Sperm competition differentially affects swimming velocity and size of spermatozoa from closely related muroid rodents: head first // Reproduction. 2011. V. 142. № 6. P. 819–830.
Valverde A., Madrigal M., Caldeira C. et al. Effect of frame rate capture frequency on sperm kinematic parameters and subpopulation structure definition in boars, analysed with a CASA-Mot system // Reproduction in Domestic Animals. 2019. V. 54. № 2. P. 167–175.
Pahl T., McLennan H.J., Wang Y. et al. Sperm morphology of the Rattini–are the interspecific differences due to variation in intensity of intermale sperm competition? // Reproduction, Fertility and Development. 2018. V. 30. № 11. P. 1434–1442.
Lüpold S., Pitnick S. Sperm form and function: what do we know about the role of sexual selection? // Reproduction. 2018. V. 155. № 5. P. 229–243.
Rossi L.F., de la Sancha N.U., Luaces J.P. et al. Morphological description and comparison of sperm from eighteen species of cricetid rodents // Journal of Mammalogy. 2018. V. 99. № 6. P. 1398–1404.
Ward P.I. Intraspecific variation in sperm size characters // Heredity. 1998. V. 80. № 6. P. 655–659.
Gómez Montoto L., Sánchez M.V., Tourmente M. et al. Sperm competition, sperm numbers and sperm quality in muroid rodents // PLoS One. 2011b. V. 6. № 3. P. 1–10/e18173.
Šandera M., Albrecht T., Stopka P. Variation in apical hook length reflects the intensity of sperm competition in murine rodents // PLoS One. 2013. V. 8. № 7. P. e68427.
Tourmente M., Gomendio M., Roldan E.R.S. Sperm competition and the evolution of sperm design in mammals // BMC Evolutionary Biology. 2011. V. 11. № 1. P. 1–10.
Smirnov G.Yu., Modorov M.V., Davydova Yu.A. Inter- and intraspecific variability of morphometric parameters of rodent spermatozoa // Zoomorphology. 2021. https://doi.org/10.1007/s00435-021-00531-7
Громов В.С., Осадчук Л.В. Забота о потомстве и секреция тестостерона у самцов лесных грызунов: сенситизация и андрогенная стимуляция родительского поведения // Изв. РАН. Серия биологич. 2015. № 4. С. 423–430.
Амбарян А.В., Мальцев А.Н., Котенкова Е.В. Взаимосвязь характеристик полового поведения и показателей конкурентоспособности спермы самцов у таксонов надвидового комплекса Mus musculus sensu lato // Жур. общ. биол. 2015. Т. 76. № 3. С. 212–224.
Tourmente M., Zarka-Trigo D., Roldan E.R.S. Is the hook of muroid rodent’s sperm related to sperm train formation? // Journal of Evolutionary Biology. 2016. V. 29. № 6. P. 1168–1177.
Lüpold S., de Boer R.A., Evans J.P. et al. How sperm competition shapes the evolution of testes and sperm: a meta-analysis // Philosophical Transactions of the Royal Society B. 2020. V. 375. № 1813. P. 1–10.
Matsumoto A.M., Karpas A.E., Bremner W.J. Chronic human chorionic gonadotropin admininstration in normal men: evidence that follicle-stimulating hormone is necessary for the maintenance of quatitatively normal spermatogenesis in man // The Journal of Clinical Endocrinology & Metabolism. 1986. V. 62. № 6. P. 1184–1192.
Осипова О.В., Соктин А.А. Моделирование процесса древней гибридизации рыжих и красных полевок в эксперименте // Докл. РАН. 2008. Т. 420. № 1. С. 139–141.
Абрамсон Н.И., Родченкова Е.Н., Фокин М.В. и др. Современная и историческая интрогрессия митохондриальной ДНК между красной (Clethrionomys rutilus) и рыжей (Clethrionomys glareolus) полевками (Rodentia, Cricetidae) // Докл. РАН. 2009. Т. 425. № 3. С. 415–418.
Johnson S.L., Dunleavy J., Gemmell N.J., Nakagawa S. Consistent age-dependent declines in human semen quality: a systematic review and meta-analysis // Ageing Research Rev. 2015. V. 19. P. 22–33.
Ntemka A., Kiossis E., Boscos C. et al. Impact of old age and season on Chios ram semen quality // Small Ruminant Research. 2019. V. 178. P. 15–17.
Syntin P., Robaire B. Sperm structural and motility changes during aging in the Brown Norway rat // Journal of Andrology. 2001. V. 22. № 2. P. 235–244.
Wolf K.N., Wildt D.E., Vargas A. et al. Age-dependent changes in sperm production, semen quality, and testicular volume in the black-footed ferret (Mustela nigripes) // Biology of Reproduction. 2000. V. 63. № 1. P. 179–187.
Crosier A.E., Marker L., Howard J. et al. Ejaculate traits in the Namibian cheetah (Acinonyx jubatus): influence of age, season and captivity // Reproduction, Fertility and Development. 2007. V. 19. № 2. P. 370–382.
Martínez A.F., Martínez-Pastor F., Álvarez M. et al. Sperm parameters on Iberian red deer: Electroejaculation and post-mortem collection // Theriogenology. 2008. V. 70. № 2. P. 216–226.
Kozdrowski R., Dubiel A. The effect of season on the properties of wild boar (Sus scrofa L.) semen // Animal Reproduction Science. 2004. V. 80. № 3–4. P. 281–289.
Новиков Е.А., Мошкин М.П. Роль стресса в модификации онтогенетических программ // Успехи современной биологии. 2009. Т. 129. № 3. С. 227–238.
Осадчук Л.В., Клещёв М.А. Межлинейные различия показателей сперматогенеза у инбредных мышей // Морфология. 2016. Т. 149. № 2. С. 54–57.
Смирнов Г.Ю., Давыдова Ю.А. Влияние промышленного загрязнения среды обитания на встречаемость аномальных сперматозоидов у рыжей полевки (Myodes glareolus) // Экология. 2018. № 5. С. 403–408. [Smirnov G.Yu., Davydova Yu.A. Effect of industrial pollution of the environment on the frequency of abnormal spermatozoa in the bank vole, Myodes glareolus // Russ. J. of Ecol. 2018. V. 49. № 5. P. 459–463.]
Дополнительные материалы отсутствуют.


