Экология, 2022, № 1, стр. 67-73
Влияние цвета окружающего пространства на окраску молоди креветки Macrobrachium rosenbergii
Р. Р. Борисов a, *, И. Н. Никонова a, А. В. Паршин-Чудин a, Н. П. Ковачева a
a Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
107140 Москва, ул. Верхняя Красносельская, 17, Россия
* E-mail: borisovrr@mail.ru
Поступила в редакцию 27.02.2021
После доработки 15.06.2021
Принята к публикации 23.07.2021
- EDN: SXCNUZ
- DOI: 10.31857/S0367059722010036
Аннотация
Исследовано влияние на окраску молоди креветки Macrobrachium rosenbergii хроматических и яркостных характеристик окружающего пространства. В первом эксперименте креветок содержали 10 сут в емкостях с белым, серым, черным, зеленым, синим и красным фонами, во втором – 30 сут в емкостях с красным, серым и синим фонами. По окончании экспериментов в цветовом пространстве CIELab оценены показатели цвета на участках абдомена, бранхиостегита, рострума. При смене фона у молоди M. rosenbergii наблюдалось изменение яркостной составляющей элементов окраски. Максимально этот эффект был выражен на черном фоне. Хроматические показатели окраски также изменялись, что свидетельствует об участии цветового зрения в регулировании окраски. Изменение хроматических показателей окраски было менее выражено, и статистически значимыми были изменения только в более длительном эксперименте.
Изучение окраски животных затрагивает фундаментальные и прикладные аспекты, относящиеся к широкому кругу областей, включая поведенческую экологию и адаптацию к окружающей среде. Маскировка – ключевая функция окраски для большинства животных, имеющая решающее значение для выживания [1–7]. Чаще всего это достигается за счет криптической окраски, которая позволяет сливаться с фоном [3, 4]. Еще один вариант маскировки – дизруптивная окраска. Для нее характерно наличие контрастных пятен и полос, “разрушающих” контур тела, что делает особь менее заметной [1, 5, 8–10]. Дизруптивная окраска часто сочетается с криптической, т.е. пятна в окраске животного гармонируют с фоном [11–13]. Скрадывающая окраска основана на эффекте противотени: более освещенные участки животных окрашены темнее, а менее освещенные, напротив, – светлее. У многих планктонных и некоторых бентосных организмов прозрачность тела или его частей является важным элементом камуфляжа [8, 14].
Примером использования сочетания сразу нескольких вариантов маскировочной окраски может служить молодь креветки Macrobrachium rosenbergii (de Man, 1879). Молодь этого вида имеет зеленоватую или коричневато-серую окраску, иногда с синеватым оттенком. На карапаксе располагаются продольные нерегулярные синие полосы, а отдельные участки тела могут быть практически прозрачными. В формировании окраски креветок основная роль принадлежит красным хроматофорам звездчатого типа и клеткам гиподермы, которые могут окрашиваться в синий цвет [15].
Регуляция окраски у ракообразных осуществляется гормонами, в синтезе которых принимает участие синусовая железа, находящаяся в глазном стебельке [16–21]. В свою очередь на деятельность этой железы оказывает влияние информация, получаемая органами зрения. Многие десятиногие ракообразные под влиянием интенсивности освещения, а также яркости и хроматических характеристик окружающего биотопа могут менять окраску [9, 22–26 и др.]. Часто несколько факторов воздействуют на особь одновременно, что затрудняет оценку их влияния. При этом наиболее сложным является вопрос о влиянии хроматических характеристик окружающего пространства на окраску ракообразных. Проведенные в последнее время эксперименты [27–29] показали, что креветки M. rosenbergii имеют цветовое зрение и используют его при выборе пищи и убежищ. В связи с этим молодь креветки M. rosenbergii является интересным объектом для изучения механизмов и стратегий изменения окраски в зависимости от цветовых характеристик окружающего пространства. Цель данного исследования – анализ влияния на окраску молоди креветки M. rosenbergii яркостных и хроматических характеристик окружающего пространства.
МАТЕРИАЛ И МЕТОДЫ
В ходе работ выполнены два эксперимента. Все особи, задействованные в исследовании, получены от одной самки гигантской пресноводной креветки Macrobrachium rosenbergii. При проведении экспериментов молодь содержали в прямоугольных емкостях (объем воды 5 л), на дно и три стенки которых с внутренней стороны были наклеены пластиковые фоны для предметной фотосъемки. До пересадки в экспериментальные емкости особей содержали в бассейне синего цвета (объем воды 500 л). Для освещения при содержании до и во время эксперимента использовали люминесцентные лампы Sun-Glo (производства Hagen, Япония), разработанные для аквариумистики и имитирующие спектр солнечного света – цветовая температура –4200 K. Освещенность на дне экспериментальных емкостей составляла 400 лк. Режим освещения – 12 свет : 12 темнота. Кормление осуществляли два раза в сутки комбикормом TetraMin Granules (производства Tetra, Германия). Количество вносимого корма регулировали в зависимости от его потребления особями. Все емкости были подключены к единой системе биологической фильтрации. Температура содержания 27–28°С.
В первом эксперименте в емкостях размещали по 5 экз. молоди креветки. Использовали емкости шести цветов: белого, серого, черного, синего, зеленого, красного. Продолжительность эксперимента – 10 сут. Для каждого варианта эксперимента выполнено от пяти до семи повторностей. Общее количество особей для каждого варианта без учета особей, погибших в результате каннибализма, составило не менее 20 экз. По окончании эксперимента масса особей в среднем составила 0.87 (±0.38) г, длина – 34.2 (±4.4) мм.
Во втором эксперименте молодь размещали индивидуально в емкостях серого, синего и красного цветов. Продолжительность эксперимента – 30 сут. Выполнены 24 повторности для каждого варианта. За время проведения эксперимента все особи перелиняли от одного до трех раз (в среднем два раза). По окончании эксперимента масса особей в среднем составила 4.40 (±1.20) г, длина – 55.8 (±4.8) мм.
В последние сутки экспериментов, через 5 ч после включения освещения, креветок отлавливали из емкостей. При помощи планшетного сканера Epson Perfection 4990 (разрешение 1200 dpi) получены изображения креветок с латеральной стороны. Для предотвращения искажения цвета сканирование осуществляли без использования автоматических алгоритмов цветокоррекции, а в область сканирования помещали эталонный образец. Измеряли массу и длину тела (от глазной выемки до конца тельсона).
При анализе полученных изображений использовали программу Adobe Photoshop CS6. На всех изображениях выполняли коррекцию цвета по эталону, после чего в цветовом пространстве CIELab (CIE L*a*b*) измеряли показатели, характеризующие окраску особи. Измерения проводили на латеральной части второго сегмента абдомена, синей полосе на карапаксе и первой трети рострума (рис. 1). В цветовом пространстве CIELab координатой L обозначена яркость, или светлота (изменяется от 0 до 100, т.е. от самого темного до самого светлого). Хроматическая составляющая в CIELab задана двумя декартовыми координатами a и b: первая обозначает положение цвета в диапазоне от зеленого до красного, вторая – от синего до желтого. Сходную методику оценки цвета особей с использованием цветового пространства CIELab применяли при изучении креветок Penaeus monodon [24], Penaeus vannamei [23] и омара Homarus americanus [30]. Мы также учитывали количество темных полос на бранхиостегите креветок.
Рис. 1.
Общий вид молоди креветки Macrobrachium rosenbergii: 1–3 – точки измерения яркостных и хроматических показателей окраски: 1 – абдомен, 2 – полоса на карапаксе, 3 – рострум.

Статистическая обработка результатов выполнена в программе Statistica v.12. Влияние цвета фона и освещенности на окраску особей оценивали с помощью критерия Краскела-Уоллиса. При обнаружении статистически значимых различий между группами проводили апостериорные сравнения с помощью критерия Манна-Уитни. При проведении множественных сравнений критический уровень значимости рассчитывали по формуле p* = 1 – 0.951/n, где n – количество проводимых сравнений. Для выявления различий между вариантами экспериментов применяли канонический дискриминантный анализ [31]. Использовали пошаговую процедуру отбора признаков. Этот метод позволяет выделить наиболее информативные признаки и их сочетания. Статистическую значимость обнаруженных различий оценивали при помощи лямбда-критерия Уилкса.
РЕЗУЛЬТАТЫ
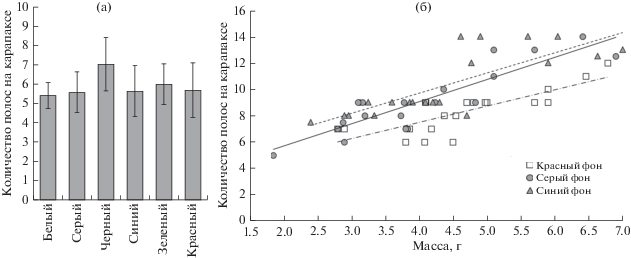
В первом эксперименте спустя 10 сут обнаружены статистически значимые отличия в окраске молоди креветок. Сильнее всего выделялись особи, содержавшиеся на черном фоне: они были темнее по всем показателям, а самую светлую окраску имели особи, которые находились на белом фоне (рис. 2). В окраске абдомена у особей, содержавшихся на черном фоне, преобладал синий оттенок, а рострум часто был окрашен в красный цвет (рис. 3). Усредненные показатели окраски (яркость – координата L и хроматическая составляющая – координаты а и b) абдомена и рострума молоди креветок, содержавшейся на черном фоне, имели статистически значимые отличия от всех прочих вариантов эксперимента (см. рис. 2а, в; 3а, в). У креветок, содержавшихся в емкостях с серым, синим, зеленым, красным и белым фонами, отмечены сходные показатели яркости окраски (см. рис. 2), а различия хроматической составляющей окраски (координат а и b в цветовом пространстве CIELab) между этими группами не были статистически значимыми (см. рис. 3). Следует отметить, что различия в яркостной и хроматической составляющих для абдомена и рострума были выражены сильнее, чем те же показатели для полос на карапаксе. Статистически значимых отличий между группами по характеристикам цвета полос на карапаксе не выявлено, однако у особей из варианта с черным фоном число полос на карапаксе было больше (рис. 4), и они были четче выражены, чем у особей из прочих вариантов эксперимента.
Рис. 2.
Показатели яркости окраски (координата L в цветовом пространстве CIELab) у молоди креветки Macrobrachium rosenbergii в зависимости от цвета фона в эксперименте продолжительностью 10 сут: а – абдомен; б – полоса на карапаксе; в – рострум.
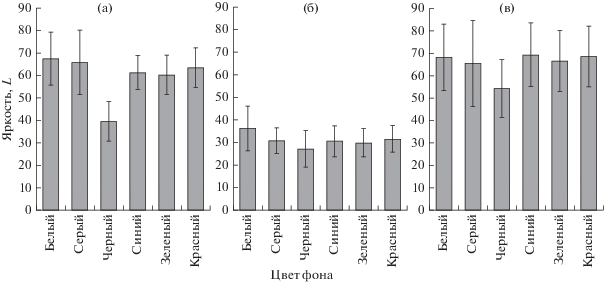
Рис. 3.
Показатели хроматической составляющей (координаты а и b в цветовом пространстве CIELab) окраски у молоди креветки Macrobrachium rosenbergii в зависимости от цвета фона в эксперименте продолжительностью 10 сут: а – абдомен; б – полоса на карапаксе; в – рострум.
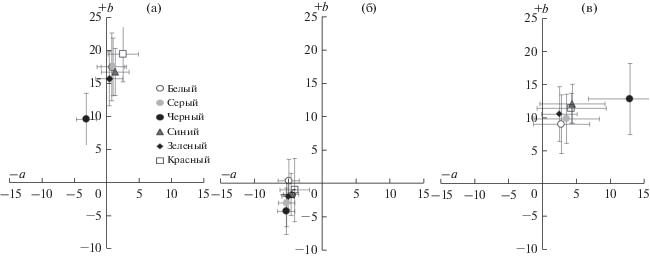
Рис. 4.
Количество полос на бранхиостегите молоди креветки Macrobrachium rosenbergii в зависимости от цвета фона: а – в эксперименте продолжительностью 10 сут; б – в эксперименте продолжительностью 30 сут.
При проведении дискриминантного анализа по комплексу признаков было выявлено, что большую часть различий описывают первые две дискриминантные функции (комбинации переменных): первая переменная учитывала 72% исходной изменчивости, вторая – 18%, а в целом они характеризовали 90% всей дисперсии. Наибольший вклад в различение выборок (рассчитывали по сумме значений стандартизированных коэффициентов первых двух дискриминантных функций) вносили данные, связанные с координатами L и a – цвета абдомена и рострума. Статистически значимые различия по всему комплексу признаков отмечены для вариантов с черным и белым фонами (за исключением сочетаний белый–серый и белый–зеленый). В результате дискриминации четко обособился вариант эксперимента с черным фоном, тогда как все остальные варианты образовали плотную группу, что указывает на превалирование значений яркостных составляющих окраски для разделения групп.
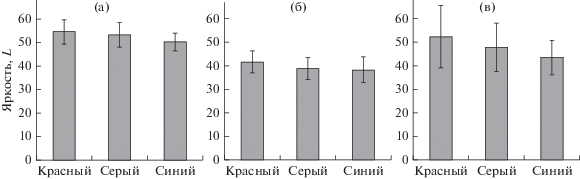
Во втором эксперименте спустя 30 сут отмечено наличие статистически значимых отличий по хроматическим (координаты а и b в цветовом пространстве CIELab) показателям окраски креветок, содержавшихся на красном фоне, от особей, содержавшихся на сером и синем фонах (рис. 5). Статистически значимыми отличия были для всех трех точек проведения измерений. Кроме того, молодь креветки на красном фоне оказалась светлее (рис. 6), а количество полос на карапаксе у нее было меньше (см. рис. 4б), однако эти различия не были статистически значимы. Отличия в хроматических и яркостных показателях окраски особей, содержавшихся на сером и синем фонах, также не были статистически значимы.
Рис. 5.
Показатели хроматической составляющей (координаты а и b в цветовом пространстве CIELab) окраски у молоди креветки Macrobrachium rosenbergii в зависимости от цвета фона в эксперименте продолжительностью 10 сут: а – абдомен; б – полоса на карапаксе; в – рострум.
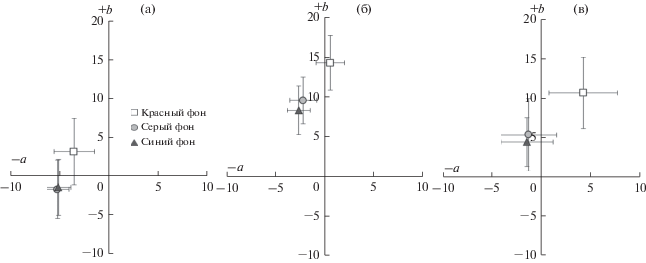
Рис. 6.
Показатели яркости окраски (координата L в цветовом пространстве CIELab) у молоди креветки Macrobrachium rosenbergii в зависимости от цвета фона в эксперименте продолжительностью 10 сут: а – абдомен; б –полоса на карапаксе; в – рострум.
При проведении дискриминантного анализа по комплексу признаков было выявлено, что большую часть (96%) различий описывает первая дискриминантная функция. Наибольший вклад в различение выборок вносит хроматическая составляющая окраски абдомена и рострума. В результате дискриминации четко обособился вариант эксперимента при содержании на красном фоне – наблюдаемые различия были статистически значимы.
Морфологически яркость окраски в первую очередь зависела от окрашенных в синий цвет участков гиподермы. У особей с темной окраской наблюдалось увеличение площади, занятой участками гиподермы, окрашенными в синий цвет, в том числе рост числа полос на карапаксе. У особей, демонстрировавших более светлою окраску, напротив, площадь, занятая окрашенными в синий цвет участками гиподермы, была меньше.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эффективность криптической окраски определяется ее соответствием окружающему особь пространству: окрашенные в светлые тона особи будут заметны на темном фоне, а темные – на светлом. Аналогичные проблемы возникают и в случае наличия цветового контраста между окраской особи и фоном. В меняющихся условиях среды камуфлирующие свойства окраски могут достигаться тремя основными способами: коррекцией окраски, перемещением особи в более подходящие биотопы, использованием компромиссного универсального варианта окраски, подходящего для широкого диапазона биотопов [7, 32, 33]. Механизм изменения окраски в постоянно трансформирующихся условиях среды должен поддерживать эффективный баланс между скоростью изменения окраски и затратами на этот процесс. Создание высокоэффективного механизма требует существенных энергетических затрат и эволюционных ресурсов [34], поэтому лишь небольшое количество групп животных смогло сформировать системы, позволяющие очень быстро изменять окраску. Среди гидробионтов такими способностями обладают головоногие моллюски и некоторые виды рыб [35, 36]. У других видов животных распространенным является изменение окраски, связанное с сезонами или стадиями онтогенетического развития [1, 2, 34]. Для многих видов ракообразных характерна коррекция окраски при изменении фона. Чаще всего данный процесс растянут во времени и может занимать от нескольких часов до нескольких дней и даже месяцев [23, 24, 26, 30, 37]. В некоторых случаях это обусловлено наличием твердого и непрозрачного экзоскелета и связано с линочными процессами [13].
У молоди креветки M. rosenbergii эффект камуфляжа достигается за счет сочетания нескольких стратегий: “разрушающего” контур тела рисунка полос на карапаксе; общего тона окраски тела, который позволяет особи сливаться с окружающим фоном; прозрачности отдельных участков тела; более темной окраски спины и светлой брюшной стороны. Наши исследования продемонстрировали наличие у молоди M. rosenbergii механизмов, позволяющих изменять яркостные и хроматические характеристики окраски. Полученные нами в первом эксперименте результаты показали, что изменение в окраске молоди M. rosenbergii происходит в первую очередь для ее коррекции в соответствии с яркостными характеристиками окружающего биотопа. Использование черного фона привело к значимым изменениям окраски: окраска особей стала темнее и насыщенней, при этом ее хроматические показатели не претерпели существенных изменений.
Результаты второго эксперимента демонстрируют наличие изменений хроматической составляющей окраски. Зафиксированные нами изменения окраски особей, находившихся на красном фоне, подтверждают литературные данные [27–29] о наличии цветного зрения у креветки M. rosenbergii и свидетельствуют о том, что оно задействовано в процессах адаптации криптической окраски особи. Однако отсутствие статистически значимых различий между группами, содержавшимися в емкостях с фоном разного цвета, может свидетельствовать о том, что изменения яркостных характеристик окраски превалируют над изменениями хроматических составляющих окраски. Изменение окружающих условий сказывается в первую очередь на яркостных характеристиках окраски. Возможно, изменение яркости субстратов в естественных условиях происходит чаще, чем изменение их цвета.
Другим объяснением того, что у молоди креветки изменения яркостных характеристик окраски превалируют над изменениями ее хроматических составляющих, может быть то, что в общем паттерне окраски молоди преобладают дизруптивные элементы. Это подтверждают минимальные изменения хроматической составляющей полос на карапаксе. В результате сочетание криптической и дизруптивной окраски у молоди M. rosenbergii оказывается достаточно эффективным в широком цветовом диапазоне. Такой тип окраски особенно эффективен в зарослях, где часто предпочитает держаться молодь M. rosenbergii [38, 39]. Интересно, что изменение как яркостных, так и хроматических составляющих окраски сильнее всего проявляется на абдомене, который в меньшей степени участвует в создании рисунка у M. rosenbergii, что отличает ее от креветки-хамелеона Hippolyte varians, у которой изменение хроматических составляющих окраски в зависимости от фона выражено очень ярко [34, 37].
Итак, наши эксперименты показали, что основой маскировки у молоди креветки M. rosenbergii является сочетание криптического и дизруптивного типов окраски, основной паттерн которых остается устойчивым в широком диапазоне условий. При смене фона происходит коррекция яркостной составляющей как элементов криптической, так и дизруптивной окраски. Хроматические составляющие окраски также изменяются, но для их устойчивого проявления требуется более длительный период времени. Изменение хроматических характеристик окраски свидетельствует об участии цветного зрения в регулировании окраски у молоди креветки M. rosenbergii.
Мы признательны коллективу отдела марикультуры беспозвоночных ФГБНУ “ВНИРО” за помощь в проведении экспериментов. Работа выполнена в рамках государственного задания ФГБНУ “Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии”.
Авторы заявляют об отсутствии конфликта интересов. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. В работе не содержится каких-либо исследований с участием людей.
Список литературы
Thayer G.H. Concealing-Coloration in the animal kingdom: an exposition of the lawsof disguise through colorand pattern: beinga summary of Abbott H.Thayer’s discoveries. New York: Macmillan, 1909. 469 p. https://doi.org/10.5962/bhl.title.57368
Cott H.B. Adaptive coloration in animals. New York: Oxford University Press, 1940. 600 p.
Endler J.A. Disruptive and cryptic coloration // Proc. Roy. Soc. Lond. B. 2006. V. 273. P. 2425–2426. https://doi.org/10.1098/rspb.2006.3650
Stevens M. Predator perception and the interrelation between different forms of protective coloration // Proc. Roy. Soc. B, 2007. V. 274. P. 1457–1464. https://doi.org/10.1098/rspb.2007.0220
Stevens M., Merilaita S. Introduction. Animal camouflage: current issues and new perspectives // Phil. Trans. R. Soc. B. 2009. V. 364. P. 423–427. 0217https://doi.org/10.1098/rstb.2008
Darnell M.Z. Ecological physiology of the circadian pigmentation rhythm in the fiddler crab Uca panacea // J. Exp. Mar. Biol. Ecol. 2012. V. 426-427. P. 39–47. 014.https://doi.org/10.1016/j.jembe.2012.05
Price T., Green S., Troscianko J. et al. Background matching and disruptive coloration as habitat-specific strategies for camouflage // Sci. Rep. 2019. V. 9. №1:7840. https://doi.org/10.1038/s41598-019-44349-2
Carvalho L.N., Zuanon J., Sazima I. The almost invisible league: crypsis and association between minute fishes and shrimps as a possible defence against visually hunting predators // Neotrop. Ichthyol. 2006. № 4. P. 219–224. https://doi.org/10.1590/S1679-62252006000200008
Tume R.K., Sikes A.L., Tabrett S. et al. Effect of background colour on the distribution of astaxanthin in black tiger prawn (Penaeus monodon): Effective method for improvement of cooked color // Aquaculture. 2009. V. 296. P. 129–135. https://doi.org/10.1016/j.aquaculture.2009.08.006
Stevens M., Merilaita S. Defining disruptive coloration and distinguishing its functions // Phil. Trans. R. Soc. B. 2009. V. 364. P. 481–488. https://doi.org/10.1098/rstb.2008.0216
Stevens M., Cuthill I.C., Windsor A.M., Walker H.J. Disruptive contrast in animal camouflage // Proc. R. Soc. B. 2006. V. 273. P. 2433–2438. https://doi.org/10.1098/rspb.2006.3614
Fraser S., Callahan A., Klassen D., Sherratt T.N. Empirical tests of the role of disruptive coloration in reducing detectability // Proc. Biol. Sci. B. 2007. V. 274. P. 1325–1331. https://doi.org/10.1098/rspb.2007.0153
Stevens M. Color change, phenotypic plasticity, and camouflage // Front. Ecol. Evol. 2016. V. 4. № 51. P. 1–10. doi: 10. 3389/fevo.2016.00051
Johnsen S. Hidden in Plain Sight: The Ecology and Physiology of Organismal Transparency // Reference: Biological Bulletin. 2001. V. 201. P. 301–318. https://doi.org/10.2307/1543609
Борисов Р.Р., Печенкин Д.С., Ковачева Н.П. Формирование окраски и товарный вид гигантской пресноводной креветки Macrobrachium rosenbergii // Рыбное хозяйство. 2016. № 3. С. 60–66.
Браун Ф.А. Хеморецепторы и изменение окраски // Сравнительная физиология животных / Под ред. Браун Ф.А. М.: Мир, 1978. Т. 3. С. 519–583.
Carlisle D.B., Knowles F.G.W. Endocrine control in crustaceans. Cambridge Univ. Press, 1959. 120 p.
Rao K.R. Pigmentary effectors // The Biology of crustacea: integument, pigments and hormonal processes / Eds. Bliss D.E., Mantel L.H. New York: Academic Press, 1985. P. 395–462.
Rao K.R. Crustacean pigmentary-effector hormones: chemistry and functions of RPCH, PDH, and related peptides // Am. Zool. 2001. V. 41. P. 364–379.
McNamara J.C., Milograna S.R. Adaptive color change and the molecular endocrinology of pigment translocation in crustacean chromatophores // The Natural History of the Crustacea. V. 4. Physiology / Eds. Chang E.S., Thiel M. Oxford University Press, 2015. P. 68–102.
Aréchiga-Palomera M.A., Vega-Villasante F., Montoya-Martínez C. et al. Background color effect on the pigmentation of prawn Macrobrachium tenellum // Lat. Am. J. Aquat. Res. 2018. V. 46. № 3. P. 610–614. https://doi.org/10.3856/vol46-issue3-fulltext-16
Bauer R.T. Color patterns of the shrimps Heptacarpus pictus and H. paludicola (Caridea: Hippolytidae) // Marine Biology. 1981. V. 64. P. 141–152.
Parisenti J., Beirao J.L., Mourino F.N. Vieira effect of background color on shrimp pigmentation // Boletim do Instituto de Pesca. 2011. V. 37. № 2. P. 177–182.
Wade N.M., Anderson M., Sellars M.J. et al. Mechanisms of colour adaptation in the prawn Penaeus monodon // J. Exp. Biol. 2012. V. 215. № 2. P. 343–350. https://doi.org/10.1242/jeb.064592
Stevens M., Lown A., Wood L. Color change and camouflage in juvenile shore crabs Carcinus maenas // Frontiers in Ecology and Evolution. 2014. V. 2:14. P. 1–14. https://doi.org/10.3389/fevo.2014.00014
Díaz-Jiménez L., Hernández M., Pérez-Rostro C. The effect of background colour and lighting of the aquarium on the body pigmentation of the peppered shrimp Lysmata wurdemanni // Aquaculture Res. 2018. V. 49. P. 3508–3516. https://doi.org/10.1111/are.13816
Kawamura G., Bagarinao T.U., Yong A.S.K. Sensory systems and feeding behaviour of the giant freshwater prawn, Macrobrachium rosenbergii, and the marine whiteleg shrimp, Litopenaeus vannamei // Borneo J. of Marine Science and Aquaculture. 2017. V. 1. P. 80–91.
Kawamura G., Bagarinao T.U., Yong A.S.K. et al. Shelter colour preference of the postlarvae of the giant freshwater prawn Macrobrachium rosenbergii // Fish. Sci. 2017. V. 83. P. 259–264. https://doi.org/10.1007/s12562-017-1062-8
Kawamura G., Bagarinao T.U., Yong A.S.K. et al. Limit of colour vision in dim light in larvae of the giant freshwater prawn Macrobrachium rosenbergii // Fisheries Science. 2018. V. 84. № 4. P. 365–371. https://doi.org/10.1007/s12562-018-1179-4
Tlusty M.F., Metzler A., Huckabone S. et al. Morphological colour change in the american lobster (Homarus americanus) in response to background colour and UV light // New. Zeal. J. Mar. Fresh. 2009. V. 43. P. 247–255. https://doi.org/10.1080/00288330909509998
Тюрин В.В., Щеглов С.Н. Дискриминантный анализ в биологии. Краснодар: Кубанский гос. ун-т, 2015. 126 с.
Merilaita S., Tuomi J., Jormalainen V. Optimization of cryptic coloration in heterogeneous habitats // Biol. J. Linn. Soc. 1999. V. 67. P. 151–161. https://doi.org/10.1111/j.1095-8312.1999.tb01858.x
Houston A.I., Stevens M., Cuthill I.C. Animal camouflage: compromise or specialise in a two patch-type environment? // Behavioral Ecology. 2007. V. 18. P. 769–775. https://doi.org/10.2495/DNE-V4-N3-183-202
Duarte R., Flores A., Stevens M. Camouflage through colour change: Mechanisms, adaptive value and ecological significance // Philos. Trans. R. Soc. B. Biol. Sci. 2017. V. 372. P. 20160342 https://doi.org/10.1098/rstb.2016.0342
Mäthger L.M., Chiao C.C., Barbosa A. et al. Disruptive coloration elicited on controlled natural substrates in cuttlefish, Sepia officinalis // J. Exp. Biol. 2007. V. 210. P. 2657–2666. https://doi.org/10.1242/jeb.004382
Smithers S., Wilson A., Stevens M. Rock pool gobies change their body pattern in response to background features // Biol. J. Linn. Soc. 2017. V. 121. P. 1–13. https://doi.org/10.1093/biolinnean/blw022
Green S., Duarte R., Kellett E. et al. Colour change and behavioural choice facilitate chameleon prawn camouflage against different seaweed backgrounds // Commun. Biol. 2019. V. 230. № 2. P. 1–10. https://doi.org/10.1038/s42003-019-0465-8
New M.B., Valenti M.B., Tidwell J.H. et al. Freshwater prawns. Biology and farming. Wiley-Blackell, 2010. 544 p.
Ковачева Н.П., Жигин А.В., Борисов Р.Р. и др. Биология и культивирование гигантской пресноводной креветки Macrobrachium rosenbergii (de Man, 1876). М.: Изд-во ВНИРО, 2015. 112 с.
Todd P.A., Qiu W., Chong K.Y. Ontogenetic shifts in carapace patterning and/or colouration in intertidal and subtidal brachyuran crabs // Raffles B. Zool. 2009. V. 57. P. 543–550.
Дополнительные материалы отсутствуют.


