Экология, 2022, № 5, стр. 402-408
Отсутствие снега в бореальном лесу может снижать трофическую активность почвенных беспозвоночных летом
А. А. Фатеева a, А. А. Кудрин a, *
a Институт биологии Коми научного центра УрО РАН
167000 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: kudrin@ib.komisc.ru
Поступила в редакцию 29.03.2022
После доработки 08.04.2022
Принята к публикации 08.04.2022
- EDN: AYZCVF
- DOI: 10.31857/S0367059722050043
Аннотация
Для оценки влияния снежного покрова на трофическую активность почвенных детритофагов в условиях средней тайги был проведен краткосрочный полевой эксперимент. На участках чернично-зеленомошного ельника в зимний период удаляли снег, а в последующий вегетационный период оценивали трофическую активность почвенных животных с использованием bait-lamina test. Контролем служили участки без манипуляций. Отсутствие снежного покрова привело к значительному промерзанию почвы и снизило трофическую активность в лесной подстилке на 11.4%, тогда как в подлежащей минеральной почве активность почти не изменилась.
Глобальное изменение климата привело к увеличению температуры земной поверхности и отразилось на режимах выпадения осадков [1]. Так, в северном полушарии наблюдается уменьшение площади и продолжительности залегания снежного покрова [2, 3]. В свою очередь снежный покров играет важную роль в функционировании почв [3–5]. В силу специфических особенностей снега он существенно меняет радиационный и тепловой балансы подстилающей поверхности в холодных регионах, предохраняя почву [5, 6], сообщества почвенных организмов [7] и растения от неблагоприятного воздействия низких температур [8]. Почвы без изолирующего влияния снежного покрова обычно подвержены более глубокому промерзанию [4]. Для прогнозирования последствий изменений климата важно понимать, как уменьшение толщины снежного покрова может повлиять на выполняемые почвенной биотой функции, о чем пока известно очень мало [4].
Почвенная фауна играет существенную роль в реализации многих экосистемных функций: она принимает участие в деструкции опада, круговороте элементов питания, определяет плодородие почв [9]. Понимание того, как прогнозируемые сценарии изменения климата повлияют на различные функции почв, важно для предсказания круговорота питательных веществ и особенностей функционирования экосистем в будущем. Несмотря на важную роль почвенных беспозвоночных, влияние изменений климата на выполняемые ими функции исследовано недостаточно [10–14]. Ряд данных [12, 13] свидетельствуют о том, что изменение гидротермического режима в летний период может влиять на трофическую активность почвенной фауны. Однако неизвестно, как на это может повлиять изменение условий обитания в зимний период [13].
Цель настоящей работы – оценить, как отсутствие снежного покрова может повлиять на трофическую активность почвенных детритофагов. Для этого был выполнен полевой эксперимент по оценке трофической активности в течение вегетационного периода, следующего за зимними манипуляциями, связанными с удалением снега на участках чернично-зеленомошного ельника. Тестируемая гипотеза – отсутствие снежного покрова и вызванное этим промерзание почвы приведут к снижению трофической активности почвенных беспозвоночных в летний период.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводили в 2019 г. в ельнике чернично-зеленомошном, расположенном в окрестностях г. Сыктывкара, в подзоне средней тайги северо-западной части России. Среднегодовая температура воздуха составляет здесь 0.5°C, годовое количество осадков – около 600 мм (400 мм в теплый период и 200 мм – в холодный). Теплый период (с температурами выше 0°C) в среднем составляет 180 дней, период с устойчивым снежным покровом – 190 дней [15]. В древесном ярусе доминирует ель сибирская (Picea obovata), местами встречаются Betula pubescens и Populus tremula. В травяно-кустарничковом ярусе преобладают Oxalis acetosella и Vaccinium myrtillus, менее обильны Maianthemum bifolium и Pyrola rotundifolia. В моховом покрове доминируют Hylocomium splendens, Pleurozium schreberi и Rhytidiadelphus triquetrus. Ельник имеет характерный для средней тайги микрорельеф с приствольными корневыми повышениями и обилием валежа. Почвенный покров представлен типичными подзолистыми почвами на суглинистых почвообразующих породах. В профиле почвы выражена маломощная (4–5 см) лесная подстилка (O), дифференцируемая на три подгоризонта с различной степенью разложения органического вещества. Под лесной подстилкой залегает минеральная толща, представленная элювиальным (EL), субэлювиальным (BEL) и текстурным (BT) горизонтами, переходящими в материнскую породу С.
Эксперимент проводили на трех участках, расположенных на расстоянии не менее 100 м друг от друга. На каждом участке заложили по две пробные площади (ПП) размером 3 × 6 м, расстояние между которыми составляло около 30 м. Каждую ПП разбили на две равные части, соответствующие двум вариантам воздействия (рис. 1). Первый вариант предусматривал отсутствие снежного покрова в зимний период, которое достигалось сооружением навесов (деревянный каркас, покрытый полиэтиленовой пленкой) высотой 1 м. Выпавший снег регулярно удаляли с навесов для предотвращения их обрушения. Второй вариант был контрольным и не предусматривал каких-либо манипуляций. Навесы смонтировали в начале ноября 2018 г. перед установлением постоянного снежного покрова и демонтировали в конце апреля следующего года. На трех ПП в каждом варианте воздействия на глубине 5 см установили по паре регистраторов температуры (HOBO U12-008, ONSET), запрограммированных на 6 измерений в сутки (см. рис. 1). Мощность снежного покрова к концу зимы в исследованном лесу составила 70–80 см. Температура воздуха охарактеризована по данным метеостанции г. Сыктывкара (http:// www.pogodaiklimat.ru).
Трофическую активность почвенных животных оценивали при помощи приманочных пластин (bait-lamina test) на основе данных о количестве съеденной за определенное время приманки. Метод приманочных пластин малозатратен и практичен, не требует дополнительных специальных навыков или оборудования, поэтому его часто применяют для оценки активности почвенных беспозвоночных как в лабораторных условиях, так и полевых исследованиях [16, 17] для решения различных задач [13, 18–20]. Основными потребителями приманки считаются дождевые черви [17] и энхитреиды, в меньшей степени – коллемболы и почвенные клещи [21, 22], вклад почвенных микроорганизмов незначителен [21].
В работе использовали стандартный вариант bait-lamina test: полоски из твердого пластика длиной 12 см с 16 отверстиями диаметром 1.5 мм, расположенными через каждые 5 мм. Отверстия пластин заполняли приманкой из смеси измельченных до порошкообразного состояния микрокристаллической целлюлозы (65% по массе), пшеничных отрубей (20%) и агар-агара (15%). Пластины помещали вертикально в почву на 14 дней. Первая установка была проведена в начале июня, последняя – в середине октября, всего – 10 периодов. Пластины устанавливали в центре каждого варианта воздействия на расстоянии 5 см друг от друга. Места установки пластин за все периоды закладки были постоянными.
В каждый период экспозиции устанавливали по 72 пластины, по 6 в каждом варианте эксперимента на каждой ПП. В общей сложности было экспонировано 720 пластин (6 пластин × 2 варианта × 6 ПП × 10 периодов). Для оценки трофической активности использовали трехбалльную шкалу: полностью перфорированному отверстию присваивали 1 балл, частично перфорированному – 0.5, нетронутому – 0 [13, 16–18]. Таким образом, число баллов на одну пластинку могло варьировать от 0 до 16, где 0 означает полное отсутствие трофической активности (0%), а 16 – ее максимальное значение (100%). Трехбалльная шкала наименее смещена относительно более точной пятибалльной шкалы, корректно оценивающей скорость потребления приманки [19].
Данные по трофической активности в лесной подстилке (0–4 см) и подлежащей минеральной почве (4–8 см) анализировали раздельно, поскольку трофическая активность почвенных животных обычно убывает вниз по почвенному профилю [23, 24]. Значения по 6 пластинам в пределах варианта эксперимента на каждой ПП в каждый период усредняли, дальнейшие расчеты проводили с использованием усредненных значений, т.е. статистической единицей была ПП. Различия между вариантами эксперимента оценивали по критерию Манна-Уитни с поправкой Бонферрони при p < 0.05. Расчеты выполнены в программе PAST 4.0.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
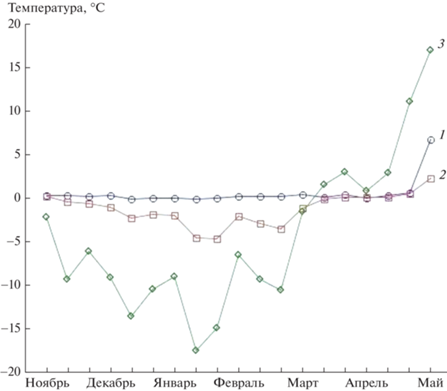
Отсутствие снежного покрова привело к значительному изменению температурного режима почвы в зимний период. Почва без снега промерзала значительно сильнее: среднедекадная температура почвы на них опускалась до –4.8°C, тогда как в вариантах со снегом она не опускалась ниже –0.2°C (рис. 2).
Рис. 2.
Среднедекадная температура воздуха и почвы на исследуемых ПП с ноября 2018 г. по май 2019 г.: 1 – со снегом, 2 – без снега, 3 – воздух.
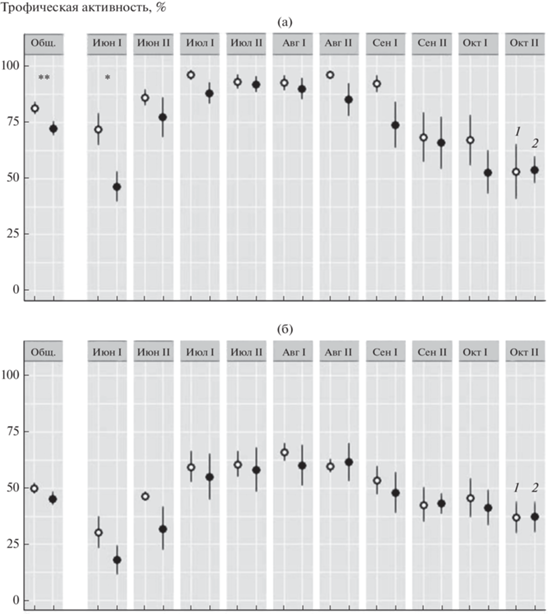
Отсутствие снежного покрова вызвало снижение трофической активности в лесной подстилке (0–4 см) (U = 1281, p < 0.01), в среднем по всему вегетационному периоду разница составила 11.4% (рис. 3a). В слое 4–8 см сокращение составило 9.3% и было статистически незначимым (рис. 3б). Снижение трофической активности наиболее четко проявилось в лесной подстилке в первый период экспонирования пластин (июнь), когда разница между вариантами эксперимента достигла почти 30% (U = 3.5, p < 0.05). В течение следующих периодов разница между вариантами со снегом и без него уменьшалась и была статистически незначима (см. рис. 3). Максимальная трофическая активность была зарегистрирована в первой половине августа, минимальная – в начале вегетационного периода (первая половина июня).
Рис. 3.
Трофическая активность почвенных животных в слое 0–4 см (a) и 4–8 см (б) на участках со снегом (1) и без снега (2) в среднем за весь период (Общ.) и отдельно по каждому периоду (Mann-Whitney U test; * p < 0.05; ** p < 0.01).
Известно [12, 13], что климатические факторы влияют на выполняемые почвенными животными функции. Так, максимальная трофическая активность энхитреид в лабораторном эксперименте наблюдалась при 14°C, тогда как увеличение температуры до 24°C приводило к ее снижению практически в 2 раза [22]. Влажность почвы также является важным фактором регуляции трофической активности, приводя к ее снижению на слабо увлажненных участках [24]. В работе M.P. Thakur et al. [13] показано, что искусственное увеличение температуры на 3.4°C в сочетании с уменьшением количества осадков в течение вегетационного периода приводит к снижению трофической активности почвенных детритофагов на 14%.
Результаты проведенного эксперимента свидетельствуют о том, что изменение условий в зимние месяцы также может влиять на выполняемые почвенными животными функции в течение последующего вегетационного сезона. В соответствии с нашей гипотезой отсутствие снега и вызванное этим промерзание почвы привели к сокращению их трофической активности в летний период. Одна из причин данного эффекта может быть связана с отрицательным действием низких температур на почвенных животных. Известно, что интенсивное промерзание почвы может вызывать гибель педобионтов [25, 26], снижение их численности и скорости размножения [27]. Ранее было показано [28], что периоды сильных морозов вызывают смертность среди энхитреид. Согласно К. Dózsa-Farkas [29], энхитреиды погибают в диапазоне температур от –4 до –10°C. В лабораторных экспериментах численность энхитреид сильно сократилась даже при постоянной умеренной температуре –2°C [30]. Дождевые черви также могут быть восприимчивы к низким температурам. Полевые наблюдения [31] показывают, что промерзание почвы часто смертельно для люмбрицид, и их низкая холодоустойчивость является одной из причин невысокого разнообразия червей на севере [32]. С другой стороны, ряд видов дождевых червей могут быть устойчивы к низким температурам и переживать значительное промерзание почвы [33]. Комплексы микроартропод также могут успешно переживать зимний период и даже в отсутствие снежного покрова и значительного промерзания почвы не сокращают свою численность [30]. Видимо, зимний период не может рассматриваться для ряда почвенных обитателей как период покоя, на что указывает сохранение трофической активности на ненулевом уровне [34].
Другая причина обнаруженного нами феномена также может быть связана с промерзанием почвы, однако снижение трофической активности, вероятно, проявляется не через терминальное воздействие, а из-за замедления активности животных вследствие более длительного сохранения низких температур почвы после зимнего периода. Промерзание почвы, вызванное отсутствием снежного покрова, приводит к значительному замедлению ее прогрева, особенно в начале вегетационного периода [35]. К сожалению, из-за технических трудностей мы не смогли оценить изменение температурного режима почвы в весенне-летний период проведения эксперимента.
Следует подчеркнуть, что обнаруженное снижение трофической активности касалось только верхнего слоя почвы и было относительно слабым (около 11.4%), кроме того, наиболее четко оно проявилось только в начале вегетационного периода. Возможно, короткий период воздействия (один зимний сезон) не позволил в полной мере проявиться последствиям отсутствия снежного покрова, и влияние промерзания будет более выражено в долгосрочной перспективе. Так, в работе de Long et al. [4] было показано, что однолетнее промерзание не отражалось на почвенных нематодах, тогда как длительное воздействие (11 зимних сезонов) привело к их существенному угнетению.
Считается общепризнанным, что глобальное потепление климата приведет к увеличению скорости разложения органического вещества [36–38]. Однако эти прогнозы в основном базируются на данных об активности почвенных микроорганизмов [39] и игнорируют реакции почвенных беспозвоночных на изменение климата [13]. Пока понимание характера акклиматизации почвенных беспозвоночных к потеплению очень ограничено [40], поскольку большинство свидетельств об увеличении их активности при более высоких температурах получено в краткосрочных лабораторных исследованиях [41, 42]. В свою очередь долгосрочные полевые эксперименты дают основание полагать, что функциональная роль почвенных животных может снизиться в результате глобального потепления, тем самым корректируя микробиальное увеличение скорости деструкции органического вещества [12, 13]. Полученные нами данные указывают на возможность развития такого сценария, в том числе и за счет изменения зимних условий. Однако для полного понимания роли снежного покрова в функциональной деятельности почвенных беспозвоночных необходимы дополнительные исследования.
Авторы выражают благодарность Т.Н. Конаковой за помощь в проведении эксперимента, а также А.А. Колесниковой за ценные рекомендации при обсуждении. Работа выполнена в рамках госбюджетной темы НИР отдела экологии животных “Разнообразие фауны и пространственно-экологическая структура животного населения Европейского Северо-Востока России и сопредельных территорий в условиях изменения окружающей среды и хозяйственного освоения”, рег. № 122040600025-2.
Список литературы
Stocker T.F., Qin D., Plattner M. et al. IPCC, 2013. Climate Change 2013: The Physical Science Basis. Contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change. Cambridge Univ. Press, 2013. https://doi.org/10.1017/CBO9781107415324
Christensen J.H., Carter T.R., Rummukainen M., Amanatidis G. Evaluating the performance and utility of regional climate models: the PRUDENCE project // Climatic Change. 2007. V. 81. P. 1–6. https://doi.org/10.1007/s10584-006-9211-6
Decker K.L.M., Wang D., Waite C., Scherbatskoy T. Snow removal and ambient air temperature effects on forest soil temperatures in Northern Vermont // Soil Science Society of Amer. J. 2003. V. 67. № 4. P. 1234–1242. https://doi.org/10.2136/sssaj2003.1234
De Long J.R., Laudon H., Blume-Werry G., Kardol P. Nematode community resistant to deep soil frost in boreal forest soils // Pedobiologia. 2016. V. 59. P. 243–251. https://doi.org/10.1016/j.pedobi.2016.10.001
Zhang T.J. Influence of the seasonal snow cover on the ground thermal regime: An overview // Reviews of Geophysics. 2005. V. 43. 23 p. https://doi.org/10.1029/2004RG000157
Zhang T.J., Barry R.G., Gilichinsky D. et al. An amplified signal of climatic change in soil temperatures during the last century at Irkutsk, Russia // Climatic Change. 2001. V. 49. № 1. P. 41–76. https://doi.org/10.1023/A:1010790203146
Coulson S.J., Hodkinson I.D., Strathdee A.T. et al. Thermal environments of Arctic soil organisms during winter // Arctic and Alpine Research. 1995. V. 27. P. 364–370. https://doi.org/10.2307/1552029
Johansson M., Callaghan T.V., Julia B. et al. Rapid responses of permafrost and vegetation to experimentally increased snow cover in sub-arctic Sweden // Environmental Research Letters. 2013. V. 8. № 3. 10 p. https://doi.org/10.1088/1748-9326/8/3/035025
Wagg C., Bendera S.F., Widmer F., van der Heijdena M.G.A. Soil biodiversity and soil community composition determine ecosystem multifunctionality // PNAS. 2014. V. 111. № 14. P. 5266–5270. https://doi.org/10.1073/pnas.1320054111
Woodward G., Benstead J.P., Beveridge O.S. et al. Ecological networks in a changing climate // Adv. Ecol. Res. 2010. V. 42. P. 72–138. https://doi.org/10.1016/B978-0-12-381363-3.00002-2
Binzer A., Guill C., Rall B.C., Brose U. Interactive effects of warming, eutrophication and size structure: Impacts on biodiversity and food-web structure // Global Change Biology. 2016. V. 22. P. 220–227. https://doi.org/10.1111/gcb.13086
Figueroa L.L., Maran A., Pelini S.L. Increasing temperatures reduce invertebrate abundance and slow decomposition // PLoS ONE 2001. V. 16. № 11. e0259045. https://doi.org/10.1371/journal.pone.0259045
Thakur M.P., Reich P.B., Hobbie S.E. et al. Reduced feeding activity of soil detritivores under warmer and drier conditions // Nature Clim. Change. 2018. V. 8. № 1. P. 75–78. https://doi.org/10.1038/s41558-017-0032-6
Rustad L.E. The response of terrestrial ecosystems to global climate change: towards an integrated approach // Science of the Total Environment. 2008. V. 404. P. 222–235. https://doi.org/10.1016/j.scitotenv.2008.04.050
Атлас по климату и гидрологии Республики Коми. М.: Дрофа, ДиК, 1997. 116 с.
Von Torne E. Assessing feeding activities of soil-living animals: I. Bait-lamina tests // Pedobiologia. 1990. V. 34. P. 89–101.
Römbke J., Hofer H., Garcia M.V.B., Martius C. Feeding activities of soil organisms at four different forest sites in Central Amazonia using the bait lamina method // Journal of Tropical Ecology. 2006. V 22. P. 313–320. https://doi.org/10.1017/S0266467406003166
Eisenhauer N., Wirsch D., Craven D., Cesarz S. Organic textile dye improves the visual assessment of the bait-lamina test // Applied Soil Ecology. 2014. V. 82. P. 78–81. https://doi.org/10.1016/j.apsoil.2014.05.008
Vorobeichik E.L., Bergman I.E. Bait-lamina test for assessment of polluted soils: Rough vs. Precise scales // Ecol. Indicators. 2021. V. 122. 10 p. https://doi.org/10.1016/j.ecolind.2020.107277
Larink O., Sommer R. Influence of coated seeds on soil organisms tested with bait lamina // Eur. J. Soil Biol. 2002. V. 38. № 3–4. P. 287–290. https://doi.org/10.1016/S1164-5563(02)01161-5
Helling B., Pfeiff G., Larink O. A comparison of feeding activity of collembolan and enchytraeid in laboratory studies using the bait-lamina test // Applied Soil Ecology. 1998. V. 7. № 3. P. 207–212. https://doi.org/10.1016/S0929-1393(97)00065-6
Gongalsky K.B., Persson T., Pokarzhevskii A.D. Effects of soil temperature and moisture on the feeding activity of soil animals as determined by the bait-lamina test // Applied Soil Ecology. 2008. V. 39. № 1. P. 84–90. https://doi.org/10.1016/j.apsoil.2007.11.007
Gongalsky K.B., Pokarzhevskii A.D., Filimonova Z.V., Savin F.A. Stratification and dynamics of bait-lamina perforation in three forest soils along a north-south gradient in Russia // Applied Soil Ecology. 2004. V. 25. № 2. P. 111–122. https://doi.org/10.1016/j.apsoil.2003.09.001
Simpson J.E., Slade E., Riutta T., Taylor M.E. Factors affecting soil fauna Feeding activity in a fragmented lowland temperate deciduous woodland // PLoS One. 2012. V. 7. № 1. P. e29616. https://doi.org/10.1371/journal.pone.0029616
Sinclair B.J., Vernon P., Klok C.J., Chown S.L. Insects at low temperatures: an ecological perspective // Trends in Ecology & Evolution. 2003. V. 18. № 5. P. 257–262. https://doi.org/10.1016/S0169-5347(03)00014-4
Vannier G. The thermobiological limits of some freezing intolerant insects: the supercooling and thermostupor points // Acta Oecologica. 1994. V. 15. P. 31–42.
Нагуманова Н.Г. Влияние гидротермических условий почвы на комплексы беспозвоночных Бузулукского бора // Вестник ОГУ. 2006. № 4. С. 79–80.
Huhta V. Mortality in enchytraeid and lumbricid populations caused by hard frosts // Animal Adaptations to Winter Conditions. Moscow: Acad. Nauk USSR, 1980. P. 141–145.
Dózsa-Farkas K. Some preliminary data on the frost tolerance of Enchytraeidae // Obscula Zool. Budabest. 1973. V. 11. P. 95–97.
Sulkava P., Huhta V. Effects of hard frost and freeze-thaw cycles on decomposer communities and N mineralization in boreal forest soil // Applied Soil Ecology. 2003. V. 22. P. 225–239. https://doi.org/10.1016/S0929-1393(02)00155-5
Holmstrup M. Overwintering adaptations in earthworms // Pedobiologia. 2003. V. 47. P. 504–510. https://doi.org/10.1016/S0031-4056(04)70229-2
Лейрих А.Н. Холодоустойчивость почвообитающих беспозвоночных животных на Северо-Востоке Азии: Автореф. дис. … докт. биол. наук. Санкт-Петербург, 2012. С. 348.
Berman D.I., Leirikh A.N. Cold hardiness of mass soil invertebrate animals of northeastern Asia: 1. Cold hardiness and the mechanisms of its maintenance // Biology Bull. 2018. V. 45. № 7. P. 669–679. https://doi.org/10.1134/S1062359018070038
Гонгальский К.Б. Количественная оценка активности почвенной фауны зимой // Доклады РАН. 2003. Т. 392. № 1. С. 135–137.
Öquist M.G., Laudon H. Winter soil frost conditions in boreal forests control growing season soil CO2 concentration and its atmospheric exchange // Global Change Biology. 2008. V. 14. № 12. P. 2839–2847. https://doi.org/10.1111/j.1365-2486.2008.01669.x
Pries C.E., Castanha C., Porras R., Torn M.S. The whole-soil carbon flux in response to warming // Science. 2017. V. 355. P. 1420–1423. https://doi.org/10.1126/science.aal1319
Crowther T., Todd-Brown K.E.O., Rowe C.W., Wieder W.R. Quantifying global soil carbon losses in response to warming // Nature. 2016. V. 540. P. 104–108. https://doi.org/10.1038/nature20150
Davidson E.A., Janssens I.A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change // Nature. 2006. V. 440. P. 165–173. https://doi.org/10.1038/nature04514
Allison S.D., Wallenstein M.D., Bradford M.A. Soil-carbon response to warming dependent on microbial physiology // Nature Geoscience. 2010. V. 3. № 5. P. 336–340. https://doi.org/10.1038/ngeo846
Lang B., Rall B.C., Brose U. Warming effects on consumption and intraspecific interference competition depend on predator metabolism // Journal of Animal Ecology. 2012. V. 81. № 3. P. 516–523. https://doi.org/10.1111/j.1365-2656.2011.01931.x
A’Bear A.D., Boddy L., Hefin Jones T. Impacts of elevated temperature on the growth and functioning of decomposer fungi are influenced by grazing collembola // Global Change Biology. 2012. V. 18. № 6. P. 1823–1832. https://doi.org/10.1111/j.1365-2486.2012.02637.x
Del Toro I., Ribbons R.R., Ellison A.M. Ant-mediated ecosystem functions on a warmer planet: effects on soil movement, decomposition and nutrient cycling // Journal of Animal Ecology. 2015. V. 84. № 2. P. 1233–1241. https://doi.org/10.1111/1365-2656.12367
Дополнительные материалы отсутствуют.



