Экология, 2022, № 5, стр. 321-333
Динамика границ распространения эпифитных макролишайников после снижения выбросов медеплавильного завода
И. Н. Михайлова *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: mikhailova@ipae.uran.ru
Поступила в редакцию 20.04.2022
После доработки 11.05.2022
Принята к публикации 16.05.2022
- EDN: UJLAJV
- DOI: 10.31857/S0367059722050080
Аннотация
Исследования естественного восстановления лесных экосистем после прекращения воздействия выбросов крупных промышленных предприятий необходимы для понимания механизмов их устойчивости. Однако дефицит данных для разных компонентов экосистем, природных зон и источников выбросов не позволяет пока выявить общие закономерности восстановительных сукцессий. Нами изучена динамика распространения и обилия макролишайников на стволах березы в южно-таежных лесах Среднего Урала, подвергавшихся многолетнему воздействию выбросов Среднеуральского медеплавильного завода. Сравнивали два периода – высоких (1995–1997 гг.) и почти прекратившихся (2014–2016 гг.) атмосферных выбросов. От первого периода ко второму зарегистрирован сдвиг техногенной границы распространения всех исследованных видов лишайников ближе к заводу, а также увеличение обилия большинства видов во всех зонах нагрузки, включая слабозагрязненную и фоновую. Тем не менее во втором периоде сохраняется градиент снижения встречаемости и обилия видов по мере приближения к заводу. Реакция эксплерента Tuckermanopsis sepincola противоположна: вид исчезает с фоновой и слабозагрязненной территорий, достигая максимального обилия в зоне очень сильного загрязнения.
Снижение выбросов промышленных предприятий предоставляет уникальную возможность исследовать закономерности естественного восстановления экосистем, нарушенных многолетним токсическим воздействием. Сообщества эпифитных лишайников – один из наиболее уязвимых компонентов экосистем, поэтому их восстановление до фонового состояния может потребовать длительного времени [1]. Успешность реколонизации лишайниками ранее загрязненных территорий зависит от многих факторов – как внешних, так и внутренних. Среди первых темпы снижения токсической нагрузки (т.е. концентраций поллютантов в воздухе и коре форофитов), а также скорость восстановления микроклимата местообитаний, которая определяется динамикой древесного и травяно-кустарничкового ярусов. К внутренним факторам можно отнести характеристики видов, определяющие их способность к заселению ранее нарушенных местообитаний (радиус рассеивания диаспор, скорость роста талломов).
Среди видов, заселяющих ранее загрязненные территории, преобладают активные колонизаторы, тогда как степень их токситолерантности не имеет решающего значения [2–4]. Высказано предположение, что виды с вегетативным типом воспроизводства имеют преимущества при заселении ранее нарушенных территорий, поскольку на формирование спор полового размножения негативно влияют остаточные концентрации металлов в субстрате [5]. В ряде случаев после снижения уровня загрязнения толерантные виды исчезают или снижается их встречаемость, например Lecanora conizaeoides Nyl. ex Cromb. [6]. Среди причин феномена предполагают физиологическую необходимость соединений серы для жизнедеятельности этого вида, и лишь в небольшой степени – рост конкуренции с более чувствительными видами [6].
Исследований восстановительной динамики лишайникового покрова в районах крупных промышленных предприятий мало [7], поэтому важно накопление данных для разных источников выбросов и природных зон, а также видов, различающихся жизненными формами и экологическими стратегиями.
Цель настоящей работы – проанализировать изменение встречаемости и обилия наиболее распространенных видов макролишайников в районе воздействия крупного медеплавильного завода на Среднем Урале после снижения его выбросов. Для этого предприятия имеется большое количество данных о состоянии эпифитных лишайниковых сообществ в период высоких выбросов – в 1990–1996 гг. [8–10]. Некоторые признаки восстановления сообществ эпифитных лишайников в пихтово-еловых лесах были задокументированы уже в течение первого десятилетия после начала снижения выбросов, а именно: заселение ранее существовавшей “лишайниковой пустыни” в непосредственной близости от завода и увеличение видового богатства на остальной загрязненной территории [3, 4]. Для более полного понимания закономерностей восстановительной динамики необходимы исследования на большей территории, включающей другие типы леса и виды форофитов.
В данной работе тестировали две гипотезы: 1) снижение уровня загрязнения инициирует смещение техногенных границ распространения макролишайников, а также изменение их встречаемости и обилия; 2) направление и выраженность этих процессов зависят от жизненной стратегии видов и их обилия в зрелых сообществах.
МАТЕРИАЛ И МЕТОДЫ
Исследования проведены в районе Среднеуральского медеплавильного завода (СУМЗ), расположенного около г. Ревды Свердловской области. Примерно в 10 км к востоку от города проходит граница между двумя природными районами – низкогорьями Среднего Урала и восточными предгорьями Урала [11]. К западу от этой границы преобладают темнохвойные леса, к востоку – светлохвойные.
Завод функционирует с 1940 г. Основные компоненты выбросов – оксиды серы и пылевые частицы с сорбированными на них металлами (Сu, Fe, Zn, Pb, Cd и др.) и металлоидами (As). В 1980 г. выбросы завода составляли 225 тыс. т в год. Снижение объема выбросов началось с конца 1980-х–начала 1990-х гг. В 1995–1998 гг. объем выбросов составлял 71–96 тыс. т в год, а после кардинальной реконструкции предприятия в 2010 г. – около 3–5 тыс. [12]. Описания района исследований, степени деградации и восстановительной динамики ряда объектов опубликованы ранее [12–14].
Первое картирование состояния сообществ эпифитных лишайников было выполнено в 1995–1997 гг., в период высоких выбросов СУМЗа [10]. На территории размером примерно 40 × × 50 км, в центре которой расположен завод, было заложено 208 пробных площадей (ПП) размером 25 × 25 м. При подборе ПП руководствовались следующими критериями: отсутствие сильных локальных антропогенных нарушений и свежих (менее 5 лет) пожаров, расстояние до ближайших автомобильных дорог не менее 100 м, возраст доминирующей древесной породы не менее 60 лет, участие березы в древостое не менее 20%. На каждой ПП выполнены описания лишайниковых сообществ на 10 стволах березы (Betula pubescens Ehrh. или B. pendula Roth). Для стандартизации материала выбирали стволы без признаков патологии, с диаметром более 25 см и наклоном не более 5°. На каждом стволе регистрировали полный список видов лишайников и оценивали обилие каждого вида с помощью раздвижной сетки высотой 50 см и шириной, равной половине окружности ствола [15]. Сетку накладывали на ствол со стороны максимального покрытия лишайниками на двух уровнях – основании ствола и высоте 1–1.5 м. Обилие на каждом уровне оценивали как число клеток сетки (от 0 до 10), в которых встречен вид. Видам, обнаруженным за пределами рамки, присваивали значение обилия 0.1. Для дальнейшего анализа показатели обилия на двух высотах суммировали и выражали в % от максимально возможного (т.е. от 20).
В 2014–2016 гг. было выполнено повторное картирование состояния лишайниковых сообществ на 110 ПП по той же методике. Погрешность расхождения местоположений пробных площадей между двумя картированиями составляла не более 100–200 м. Основным критерием при выборе площадей для повторного картирования был равномерный охват исследуемой территории. Из ПП, обследованных в период высоких выбросов, в анализ включены только те, на которых были выполнены повторные описания.
Из 18 зарегистрированных на стволах берез видов макролишайников с листоватыми, чешуйчато-кустистыми и кустистыми талломами для анализа были выбраны 9 (табл. 1). Критерием для включения в анализ служило нахождение вида более чем на 10 ПП хотя бы в один из периодов. Не вошли в число анализируемых видов Bryoria nadvornikiana (Gyeln.) Brodo et D. Hawksw., Cladonia botrytes (K.G. Hagen) Willd., Hypogymnia tubulosa (Schaer.) Hav., Imshaugia aleurites (Ach.) S.L.F. Mey., Melanohalea olivacea (L.) O. Blanco, A. Crespo, Divakar, Essl., D. Hawksw. & Lumbsch, Parmeliopsis hyperopta (Ach.) Vain., Physcia stellaris (L.) Nyl., Platismatia glauca (L.) W.L. Culb. & C.F. Culb., Usnea subfloridana Stirton.
Таблица 1.
Распространение видов лишайников в 1995–1997 (I) и 2014–2016 (II) гг.
| Виды | Max $K_{i}^{{}}$ | Доля заселенных ПП, % | Занятая площадь, % от площади карты | ||
|---|---|---|---|---|---|
| I | II | I | II | ||
| Устойчивые | |||||
| Cladonia coniocraea (Flörke) Spreng. | 54.8 | 87.3 | 92.7 | 97.3 | 98.8 |
| C. fimbriata (L.) Fr | 54.8 | 41.8 | 47.3 | 47.8 | 56.5 |
| Vulpicida pinastri (Scop.) J.-E. Mattsson & M.J. Lai. | 52.0 | 76.4 | 84.6 | 91.5 | 94.6 |
| Tuckermanopsis sepincola (Ehrh.) Hale | 45.4 | 45.5 | 14.6 | 48.5 | 5.4 |
| Hypogymnia physodes (L.) Nyl. | 45.3 | 68.2 | 88.2 | 87.0 | 97.1 |
| Чувствительные | |||||
| Cladonia cenotea (Ach.) Schaer. | 31.8 | 44.6 | 60.0 | 62.5 | 77.8 |
| Parmeliopsis ambigua (Wulfen) Nyl. | 28.2 | 19.1 | 23.6 | 30.8 | 36.7 |
| Parmelia sulcata Taylor | 27.9 | 10.9 | 29.1 | 14.5 | 32.4 |
| Очень чувствительные | |||||
| Evernia mesomorpha Nyl. | 12.9 | 20.9 | 24.6 | 32.1 | 28.0 |
Зонирование территории по степени загрязнения выполнено на основе содержания кислоторастворимых форм металлов (Cu, Zn, Cd, Pb) в лесной подстилке в 1995–1997 гг. Подробнее методы отбора проб и химического анализа описаны ранее [16]. Данные о содержании металлов были свернуты в индекс загрязнения:
где Ki – индекс загрязнения на i-й ПП, Сji – концентрация j-го элемента на i-й ПП, Cjf – концентрация j-го элемента на фоновой территории, n – число элементов. Индекс показывает, во сколько превышен региональный фоновый уровень загрязнения в среднем по всем четырем металлам. В качестве характеристики регионального фонового уровня были приняты данные для Сысертского района Свердловской области (100 км к юго-востоку от района СУМЗа). Для зонирования территории массив данных был разбит на 5 градаций, обеспечивающих сходное число ПП в пределах каждой зоны: 1) зона очень сильного загрязнения (Ki > 40, 22 ПП); 2) сильного загрязнения (Ki от 17 до 40, 21 ПП); 3) умеренного загрязнения (Ki от 7 до 17, 23 ПП); 4) слабого загрязнения (Ki от 4 до 7, 26 ПП) , 5) фонового загрязнения (Ki < 4, 18 ПП). Карта района работ с нанесенными границами зон приведена на рис. 1.Статистический анализ выполнен в пакете Statistica 8. Различия между зонами загрязнения и периодами наблюдений оценивали с помощью двухфакторного дисперсионного анализа с повторными наблюдениями (two-way repeated measures ANOVA), учетная единица – ПП. Для множественных сравнений использовали критерий Тьюки. Значимость различий частот встречаемости между зонами оценивали с помощью точного критерия Фишера.
Карты зон загрязнения и распространения видов выполнены в программе QGIS 3.16.5. Система координат – МСК66, зона 1. Для интерполяции использован метод обратных квадратов (ОВР). Общая площадь карты – 1734.26 км2. При расчете площадей распространения видов не учитывали площади 11 крупных водоемов (суммарно 50.4 км2), городов Ревда и Первоуральск и территории СУМЗа (суммарно 76.8 км2).
РЕЗУЛЬТАТЫ
Ранжирование видов лишайников по токситолерантности. Анализ распространения видов в период высоких выбросов (1995–1997 гг.) позволил выделить три группы по степени их токситолерантности (см. табл. 1). К толерантным отнесены виды, зарегистрированные во всех зонах нагрузки, включая зону очень сильного загрязнения (предельные значения Ki, при которых обнаружены виды, более 40); к чувствительным – виды, не обнаруженные в зоне очень сильного загрязнения (предельные значения Ki лежат в диапазоне от 27 до 32); к группе очень чувствительных отнесен один вид, отсутствовавший в зонах очень сильного и сильного загрязнения (Evernia mesomorpha).
Толерантные виды. Из пяти видов этой группы четыре размножаются преимущественно с помощью вегетативных диаспор – соредий, и только один (Tuckermanopsis sepincola) – спорами полового размножения. Рассмотрим их по отдельности.
Наиболее распространены Cladonia coniocraea, Hypogymnia physodes и Vulpicida pinastri (табл. 1, рис. 2). В период высоких выбросов все они были отмечены на более чем 80% территории, отсутствуя лишь в непосредственной близости от завода и на нескольких “островках”, расположенных в северо-восточном направлении от завода. Cladonia fimbriata (см. табл. 1, рис. 2) зарегистрирована на меньшей площади (около 50%), преимущественно в западной части района.
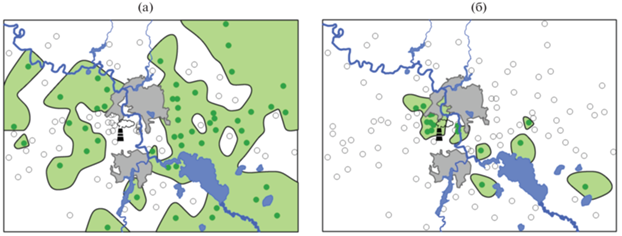
Рис. 2.
Карты распространения толерантных соредиозных видов лишайников в 1995–1997 гг. (а) и 2014–2016 гг. (б). Здесь и на рис. 4, 6 область распространения лишайников показана зеленым цветом.

Несмотря на присутствие видов этой группы во всех зонах нагрузки, в период высоких выбросов влияние загрязнения на них в той или иной степени очевидно: снижение доли заселенных ПП и обилия по мере приближения к заводу (рис. 3, табл. 2). Выраженность реакции различается между видами: для C. coniocraea доля заселенных ПП и обилие снижены только в зоне очень сильного загрязнения; для H. physodes градиент можно разбить на две части: 1) зоны от очень сильного до умеренного загрязнения с резко сниженным обилием и 2) слабозагрязненная и фоновая зоны. Эти части различаются как по обилию, так и по доле заселенных ПП, в то время как внутри частей различия между зонами незначимы. Обилие V. pinastri и C. fimbriata значимо различается только между крайними значениями градиента загрязнения.
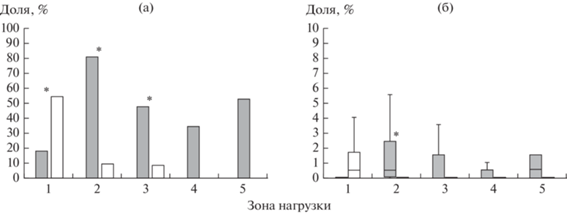
Рис. 3.
Доля заселенных ПП (а) и обилие (б) толерантных видов лишайников в 1995–1997 гг. (серая заливка) и 2014–2016 гг. (без заливки). Здесь и на рис. 5, 7 показаны медиана и межквартильный размах; * – значимые различия между периодами наблюдений.
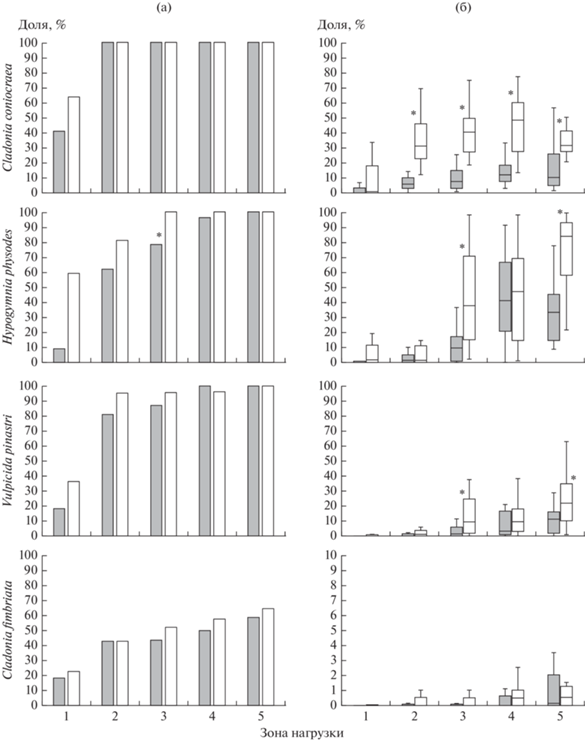
Таблица 2.
Результаты дисперсионного анализа различий обилия видов лишайников между зонами загрязнения и периодами наблюдений
| Вид | Источник изменчивости | ||
|---|---|---|---|
| зона (df = 4) | период (df = 1) | зона × период (df = 4) | |
| Cladonia cenotea | 9.1*** | 38.2*** | 5.1** |
| C. coniocraea | 17.0*** | 393.0*** | 16.3*** |
| C. fimbriata | 3.2* | 0.8 | 1.7 |
| Evernia mesomorpha | 8.8*** | 0.1 | 2.9* |
| Hypogymnia physodes | 31.7*** | 59.7*** | 11.0*** |
| Parmelia sulcata | 6.9*** | 0.3 | 0.1 |
| Parmeliopsis ambigua | 1.4 | 4.0* | 1.0 |
| Tuckermanopsis sepincola | 2.7* | 15.7*** | 0.0 |
| Vulpicida pinastri | 14.7*** | 34.7*** | 4.1** |
Снижение выбросов инициировало сдвиг границы распространения толерантных соредиозных видов ближе к заводу (см. рис. 2) и соответственно увеличение площади, на которой они зарегистрированы (см. табл. 1). Доля заселенных этими видами ПП выше во втором периоде наблюдений по сравнению с первым во всех зонах нагрузки, особенно в зонах очень сильного и сильного загрязнения (см. рис. 3). Связь обилия видов с периодом наблюдения статистически значима для всех видов группы, за исключением C. fimbriata (см. табл. 2). Для трех видов (C. coniocraea, H. physodes, V. pinastri) значимо возросло обилие и в фоновой зоне (см. рис. 3). Тем не менее и во втором периоде наблюдения загрязнение продолжает оказывать влияние: обилие C. coniocraea по-прежнему значимо отличается от фонового уровня только в зоне очень сильного загрязнения, обилие H. physodes и V. pinastri в зоне умеренного загрязнения достигло уровня зоны слабого загрязнения, но в обеих зонах по-прежнему значимо отличается от фонового уровня.
Для T. sepincola картина принципиально другая. В период высоких выбросов вид был распространен на 45.5% площади, преимущественно в восточной части района (рис. 4). Максимальные доля заселенных ПП и обилие были зарегистрированы не на фоновой территории, а в зоне сильного загрязнения (рис. 5). После снижения выбросов площадь его распространения снизилась до 5.4%: вид зарегистрирован только в непосредственной близости от завода и в нескольких “анклавах” в восточном направлении. Соответственно максимум доли заселенных ПП сдвинулся в зону очень сильного загрязнения, там же отмечено и максимальное обилие вида, сравнимое с показателями 1995–1997 гг. для зон сильного и умеренного загрязнения. Во втором периоде в зонах сильного и умеренного загрязнения доля заселенных ПП резко снизилась, а на фоновой территории и в зоне слабого загрязнения вид не был обнаружен.
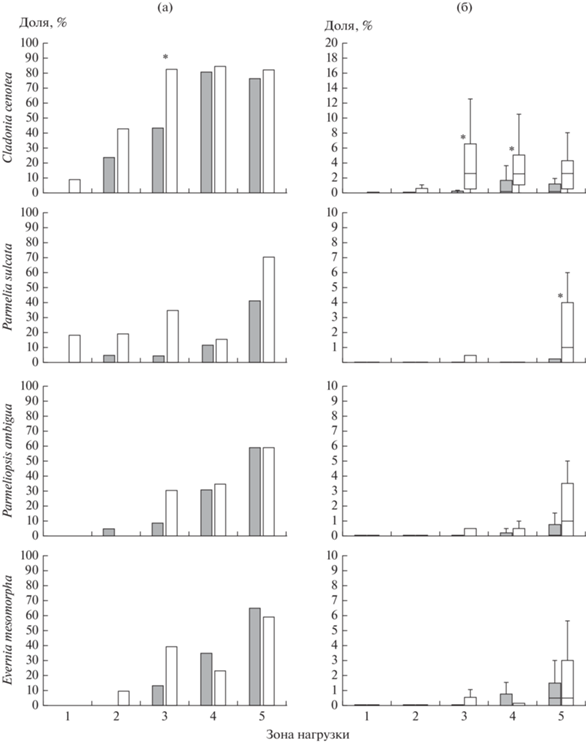
Чувствительные виды. Cladonia cenotea – наиболее распространенный и обильный вид этой группы (рис. 6). После снижения выбросов доля заселенной площади возросла на 15% (см. табл. 1), однако вид по-прежнему отсутствует на значительной территории вокруг завода и на нескольких ПП в фоновой зоне и зоне слабого загрязнения. Во втором периоде вид зарегистрирован в зоне очень сильного загрязнения, однако его обилие здесь крайне низкое (рис. 7). Ко второму периоду значимо увеличилась доля заселенных ПП в зоне умеренного загрязнения, причем обилие здесь и в зоне слабого загрязнения не отличается от фоновых показателей.
Рис. 6.
Карты распространения чувствительных и очень чувствительного видов в 1995–1997 гг. (а) и 2014–2016 гг. (б).
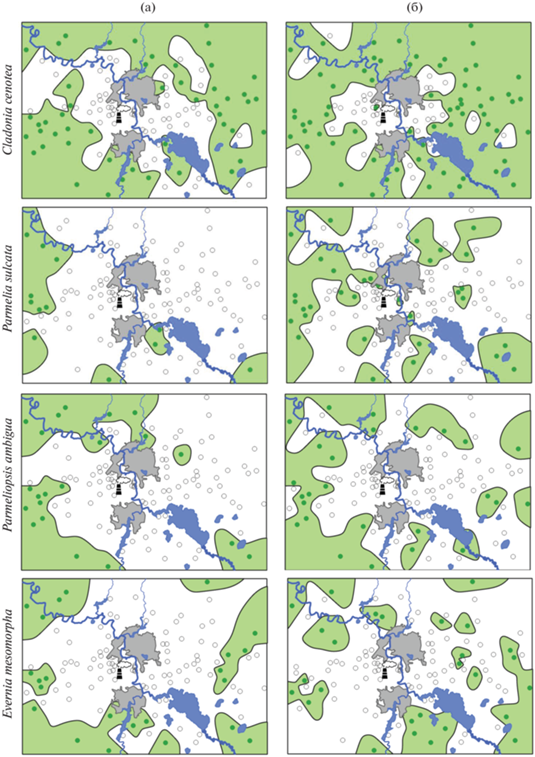
В период высоких выбросов P. sulcata и P. ambigua были единично зарегистрированы в зонах от слабого до сильного загрязнения (см. табл. 1), с крайне низким обилием во всех зонах, значимо отличающимся от фонового. В период высоких выбросов виды обнаружены преимущественно в фоновой зоне (см. рис. 6), а после их снижения продвинулись к заводу не “сплошной волной”, а отдельными “анклавами”. Тем не менее общая площадь распространения этих видов увеличилась (см. табл. 1). После снижения выбросов P. sulcatа продвинулся в зону очень сильного загрязнения, однако его обилие на загрязненных территориях существенно не изменилось (влияние периода наблюдения незначимо – см. табл. 2). P. ambigua в 2014–2016 гг. не был зарегистрирован даже в зоне сильного загрязнения (в 1995–1997 гг. в этой зоне была лишь единичная находка), т.е. площадь его распространения увеличилась главным образом за счет более плотного заселения зоны умеренного загрязнения. Обилие вида на загрязненных территориях остается крайне низким и по-прежнему значимо отличается от фонового.
Очень чувствительный вид E. mesomorpha после снижения выбросов продвинулся ближе к заводу вплоть до зоны сильного загрязнения, однако не обнаружен на некоторых площадях фоновой и слабозагрязненной зон, в результате чего площадь его распространения незначительно сократилась (на 4%, см. табл. 1 и рис. 6). Изменения обилия этого вида и доли заселенных ПП после снижения выбросов статистически незначимы (см. рис. 7). Множественные сравнения свидетельствуют лишь о сохраняющихся отличиях обилия во всех зонах от фоновых значений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сравнение двух последовательных картирований распространения эпифитных макролишайников в районе воздействия многолетнего атмосферного загрязнения свидетельствует о том, что снижение выбросов инициировало заселение лишайниками ранее загрязненных территорий. Это подтверждает выводы, сделанные ранее по результатам мониторинга на постоянных ПП в пихтово-еловых лесах района [3, 4]. Из 9 рассмотренных видов макролишайников для 8 показано расширение площади обитания в пределах исследованной территории. Необходимо, однако, подчеркнуть, что указанные на картах границы распространения видов нельзя считать абсолютными, поскольку они прочерчены на основании данных только для одного субстрата – стволов березы. Например, в непосредственной близости от завода C. coniocraea отсутствует на стволах берез, но, по нашим наблюдениям, обитает на мертвой древесине и обнаженной поверхности почвы.
Помимо сдвига границ распространения ближе к источнику выбросов, для большинства исследованных видов показано увеличение плотности заселения территории (т.е. доли заселенных ПП), а для 6 из 9 видов – значимое увеличение обилия. Тем не менее на распространение и обилие всех исследованных видов продолжает оказывать влияние загрязнение. Это проявляется, во-первых, в существовании видовых «пустынь» разной величины вокруг источника выбросов: даже наиболее распространенный и один из наиболее толерантных видов C. coniocraea отсутствует на стволах березы на нескольких ПП в непосредственной близости от завода; во-вторых, снижены плотность заселения загрязненных территорий и обилие видов. В крайних проявлениях показатели снижены либо только в зоне очень сильного загрязнения (например, у C. coniocraea), либо, наоборот, на всем градиенте, кроме фоновой зоны (у P. sulcata, P. ambigua, E. mesomorpha).
Известно, что темпы развития вегетативных диаспор очень низки: так, в районе исследования развитие H. physodes от соредий до стадии простых лопастей занимает 16 мес., а до начала ветвления лопастей – 29. Размеры талломов этого возраста не превышают 0.5 мм [17]. Поэтому сложно было бы полагать, что обилие лишайников за прошедшее с момента снижения выбросов десятилетие может достичь фоновых значений. Однако факт заселения загрязненных территорий сам по себе может быть показателем успешности распространения. При исследовании постпирогенных сукцессий лишайниковых сообществ установлено, что успешность колонизации в значительной степени определяется количеством диаспор в окружающей среде [18]. Это справедливо и для реколонизации бывших загрязненных районов: наиболее успешно их колонизируют обильные в прилежащих биотопах виды с высоким потенциалом к расселению [3]. Результаты данной работы подтверждают эту закономерность: наиболее распространенные и обильные виды продвигаются к источнику выбросов фактически “сплошной волной”. Более редкие виды при продвижении образуют “анклавы”, приуроченные, вероятно, к оптимальным для них условиям. Обилие таких видов на реколонизированных территориях крайне низкое.
Как уже отмечалось выше, токситолерантность видов нельзя считать фактором, определяющим успех колонизации [2, 4]. Очень чувствительный вид E. mesomorpha в течение первого десятилетия после снижения выбросов продвинулся в зону сильного загрязнения (в этой же зоне отмечены его находки в пихтово-еловом лесу [4]). По соотношению обилия на фоновой и загрязненной территориях вид на настоящий момент не отличается от менее чувствительных видов (P. sulcata и P. ambigua). Другими словами, нет оснований утверждать, что высокая чувствительность к токсикантам затрудняет распространение этого вида на загрязненной территории.
Наши данные подтверждают достаточно высокую скорость реколонизации лишайниками бывших “пустынь” после снижения выбросов. В частности, для комбината г. Садбери (Канада) показано сокращение площади “лишайниковой пустыни” на 80% уже через 6 лет после снижения выбросов, а ее исчезновение – через 18 лет. Площадь зоны с низким (<10) числом видов лишайников сократилась уже в течение первого десятилетия [2].
Одним из наиболее интересных результатов работы представляется отличная от остальных видов траектория ответа T. sepincola на снижение выбросов. Несмотря на широкое распространение в период высоких выбросов, на фоновой и слабозагрязненной территориях вид был малообилен. Это определяется его жизненной стратегией: в березовых лесах T. sepincola – эксплерент, заселяющий молодые стволы березы. В ходе дальнейших микросукцессий вид вытесняется виолентами, главным образом С. coniocraea и H. physodes [19]. В период высоких выбросов пик встречаемости вида в зоне сильного загрязнения объяснялся снижением межвидовой конкуренции в сочетании с оптимальным для него микроклиматом (повышенная инсоляция в разреженных древостоях). Приуроченность вида к осветленным местообитаниям хорошо иллюстрируется преимущественным распространением вида в восточной части района с преобладающими сосново-березовыми и березовыми лесами, что контрастирует с западной частью района, где преобладают темнохвойные леса [11].
После снижения выбросов T. sepincola “прижимается” к заводу: встречаемость и обилие максимальны в зоне очень сильного загрязнения, но на малонарушенной и фоновой территориях вид практически исчезает. Причины роста плотности заселения территории вблизи завода очевидны: снижение токсической нагрузки в сочетании с благоприятным микроклиматом и отсутствием межвидовой конкуренции.
Интересны находки T. sepincola на стволах пихты в пихтово-еловых лесах вблизи завода, т.е. в совершенно не свойственных для вида местообитаниях [3], которые свидетельствуют об оптимальности условий бывших загрязненных территорий для развития данного вида. Сходный феномен был показан для вида-эксплерента Hypocenomyce caradocensis (Leight. ex Nyl.) P. James & Gotth. Schneid. в пихтово-еловых лесах района исследования: его обилие после снижения выбросов резко увеличилось в загрязненных местообитаниях, превысив фоновые значения благодаря отсутствию межвидовой конкуренции [4].
Относительно причин снижения обилия T. sepincola на слабозагрязненной и фоновой территориях можно предположить действие двух факторов: первый – конкурентное исключение, вызванное значительным увеличением обилия основных конкурентов – H. physodes и C. coniocraea; второй – смена микроклимата местообитаний, которые стали более затененными. Участки слабозагрязненной территории, на которых вид сохранился после снижения выбросов, находятся в восточной части района, т.е. в более осветленных местообитаниях.
Наблюдается некоторое сходство в реакции на снижение выбросов между T. sepincola и высокотолерантными видами Lecanora conizaeoides и Scoliciosporum chlorococcum (Graewe ex Stenh.) Vězda, обильно развивающимися в загрязненных местообитаниях и исчезающими и/или снижающими обилие после снятия нагрузки. Однако лежащие в основе этих реакций механизмы различны, поскольку T. sepincola не отличается от конкурентов по токситолерантности – максимально переносимые уровни загрязнения у этих видов одинаковы. Более того, несмотря на высокое обилие вида в загрязненных местообитаниях, в период высоких выбросов на талломах были отмечены морфологические признаки поражения токсикантами [19]. Заселение видом максимально загрязненных зон не поддерживает мнение о большем успехе соредиозных видов по сравнению с видами с половой репродукцией [5].
ЗАКЛЮЧЕНИЕ
Таким образом, исходные гипотезы работы подтвердились. В течение первого десятилетия после резкого снижения выбросов медеплавильного завода техногенные границы распространения большинства рассмотренных видов эпифитных лишайников сдвинулись ближе к заводу, при этом возросли плотность заселения видами загрязненной территории и их обилие. Наиболее выражена положительная динамика обилия у видов, доминирующих в зрелых лишайниковых сообществах фоновой территории (C. coniocraea, H. physodes). У вида-эксплерента T. sepincola реакция на снижение выбросов противоположна, поскольку успешность его развития в значительной степени зависит от межвидовой конкуренции при формировании лишайниковых сообществ. Следовательно, необходимо учитывать экологические стратегии лишайников при прогнозировании скорости их восстановления после нарушающих воздействий.
Для получения устойчивых выводов о закономерностях восстановления редких и минорных видов лишайников необходимы дальнейшие наблюдения. Особенно важным представляется совместный анализ восстановления лишайниковых сообществ и других компонентов лесных экосистем, в первую очередь древесного и травяно-кустарничкового ярусов. Вполне вероятно, что именно изменения светового и гидротермического режимов под пологом древостоя существенно влияют на ход реколонизации бывших загрязненных территорий редкми видами эпифитных лишайников.
Выражаю глубокую признательность Д.В. Нестерковой за построение карт распространения видов и вычисление площадей, а также Е.Л. Воробейчику за предоставление данных по содержанию металлов в подстилке и ценные замечания в ходе работы над рукописью. Картирование состояния лишайниковых сообществ в 1995–1997 гг. было выполнено при финансовой поддержке ИНТАС (проект № 93-1645), в 2015–2016 гг. – при поддержке РФФИ (проект № 15-04-06828). Сбор данных 2014 г., интерпретация результатов и подготовка рукописи выполнены в рамках государственного задания Института экологии растений и животных УрО РАН.
Автор заявляет об отсутствии конфликта интересов.
Настоящая работа выполнена без участия людей или животных в качестве объектов исследования.
Список литературы
Schram L.J., Wagner C., McMullin R.T., Anand M. Lichen communities along a pollution gradient 40 years after decommissioning of a Cu–Ni smelter // Environ. Sci. Pollut. Res. 2015. V. 22. № 12. P. 9323–9331. https://doi.org/10.1007/s11356-015-4088-4
Beckett P.J. Lichens: sensitive indicators of improving air quality // Restoration and recovery of an industrial region / Ed. Gunn J.M. New York: Springer, 1995. P. 81–92.
Михайлова И.Н. Начальные этапы восстановления сообществ эпифитных лишайников после снижения выбросов медеплавильного завода // Экология. 2017. № 4. С. 277–281. [Mikhailova I.N. Initial stages of recovery of epiphytic lichen communities after reduction of emissions from a copper smelter // Russ. J. Ecol. 2017. V. 48. № 4. P. 277–281. doi: 10.1134/S1067413617030110]https://doi.org/10.7868/S0367059717030118
Михайлова И.Н. Динамика сообществ эпифитных лишайников в начальный период после снижения выбросов медеплавильного завода // Экология. 2020. № 1. С. 43–45. [Mikhailova I.N. Dynamics of epiphytic lichen communities in the initial period after reduction of emissions from a copper smelter // Russ. J. Ecol. 2020. V. 51. № 1. P. 38–45. doi: 10.1134/S10 67413620010075]https://doi.org/10.31857/S0367059720010072
Howe N.M., Lendemer J.C. The recovery of a simplified lichen community near the Palmerton zinc smelter after 34 years // Bibliotheca Lichenologica. 2011. V. 106. P. 120–136.
Bates J.W., Bell J.N.B., Massara A.C. Loss of Lecanora conizaeoides and other fluctuations of epiphytes on oak in S.E. England over 21 years with declining SO2 concentrations // Atmosph. Environ. 2001. V. 35. P. 2557–2568. https://doi.org/10.1016/S1352-2310(00)00402-7
Воробейчик Е.Л. Естественное восстановление наземных экосистем после прекращения промышленного загрязнения. 1. Обзор современного состояния исследований // Экология. 2022. № 1. С. 3–41. [Vorobeichik E.L. Natural recovery of terrestrial ecosystems after the cessation of industrial pollution: 1. A state-of-the-art review // Russ. J. Ecol. 2022. V. 53. № 1. P. 1–39. doi: 10.1134/S1067413622010118]https://doi.org/10.31857/S0367059722010115
Михайлова И.Н., Воробейчик Е.Л. Эпифитные лихеносинузии в условиях химического загрязнения: зависимости доза–эффект // Экология. 1995. № 6. С. 455–460. [Mikhailova I.N., Vorobeichik E.L. Epiphytic lichenosynusia under conditions of chemical pollution: dose–effect dependencies // Russ. J. Ecol. 1995. V. 26. № 6. P. 425–431.]
Михайлова И.Н. Эпифитные лихеносинузии лесов Среднего Урала в условиях аэротехногенного загрязнения: Автореф. дис. … канд. биол. наук. Екатеринбург, 1996. 24 с.
Scheidegger C., Mikhailova I. Umweltforschung – Flechten als Bioindikatoren fur die Luftverschmutzung im Ural: Eindrucke von einem gemeinsamen Forschungsprojekt // Naturwerte in Ost und West. Forschen fur eine nachhaltige Entwicklung vom Alpenbogen bis zum Ural / Ed. Landolt R. Birmensdorf: Eidgenossische Forschungsanstalt WSL, 2000. S. 55–59.
Капустин В.Г. Физико-географическое районирование Свердловской области // География и современные проблемы естественно-научного познания: Мат-лы конф. Екатеринбург, 2009. С. 11–24.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobeichik E.L., Trubina M.R., Khantemirova E.V., Bergman I.E. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Russ. J. Ecol. 2014. V. 45. № 6. P. 498–507. doi: 10.1134/S1067413614060150]https://doi.org/10.7868/S0367059714060158
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем (локальный уровень). Екатеринбург: Наука, 1994. 280 с.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. [Vorobeichik E.L., Kaigorodova S.Yu. Long-term dynamics of heavy metals in the upper horizons of soils in the region of a copper smelter impacts during the period of reduced emission // Eurasian Soil Science. 2017. V. 50. № 8. P. 977–990. doi: 10.1134/S1064229317080130]https://doi.org/10.7868/S0032180X17080135
Herzig R., Urech M. Flechten als Bioindikatoren. Integriertes biologisches Messsystem der Luftverschmutzung für dasSchweizer Mittelland // Bibliotheca Lichenologica. 1991. Bd 43. S. 1–283.
Воробейчик Е.Л. Реакция лесной подстилки и ее связь с почвенной биотой при токсическом загрязнении // Лесоведение. 2003. № 2. С. 32–42.
Mikhailova I., Scheidegger C. Early development of Hypogymnia physodes (L.) Nyl. in response to emissions from a copper smelter // Lichenologist. 2001. V. 33. P. 527–538. https://doi.org/10.1006/lich.2001.0347
Eversman S., Horton D. Recolonization of burned substrates by lichens and mosses in Yellowstone National Park // Northwest Sci. 2004. V. 78. P. 85–92.
Mikhailova I. Populations of epiphytic lichens under stress conditions: survival strategies // Lichenologist. 2007. V. 39. № 1. P. 83–89. https://doi.org/10.1017/S0024282907006305
Дополнительные материалы отсутствуют.