Экология, 2022, № 6, стр. 468-478
Признаки восстановления сообществ беспозвоночных травостоя после снижения выбросов медеплавильного завода
А. В. Нестерков *
ФГБУН Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: nesterkov@ipae.uran.ru
Поступила в редакцию 11.04.2022
После доработки 15.06.2022
Принята к публикации 22.06.2022
- EDN: KXWRFP
- DOI: 10.31857/S0367059722060130
Аннотация
Сообщества беспозвоночных травостоя изучены в периоды относительно высоких (2006–2008 гг.) и почти прекратившихся (2015–2017 гг.; общий объем снизился в 75 раз до 3 тыс. т/год) выбросов Среднеуральского медеплавильного завода (основные поллютанты – SO2 и тяжелые металлы). В 2015 и 2016 гг. отмечены сильные погодные флуктуации, потенциально способные нивелировать начавшиеся восстановительные процессы. Несмотря на это, на умеренно загрязненной территории зарегистрированы признаки восстановления как травостоя (увеличение фитомассы разнотравья в 1.5 раза и его доли в общей фитомассе с 56 до 76%, а также увеличение сходства видовой структуры с незагрязненными участками), так и сообществ беспозвоночных (снижение обилия сосущих фитофагов в 1.3 раза и цикадовых в 1.6 раза, увеличение сходства трофической и таксономической структур сообществ фоновой и буферной зон). На сильно загрязненной территории признаков восстановления не выявлено. Полученные результаты подтверждают гипотезы о стабильности нарушенного состояния луговых сообществ на сильно загрязненных участках и об относительно быстром их восстановлении на умеренно загрязненных.
Обитающих в травостое беспозвоночных традиционно рассматривают как отдельный ярус наземной фауны, характеризующийся высоким обилием и таксономическим богатством, а также тесной связью всех его элементов с травяной растительностью [1]. Интерес к изучению данной группы обусловлен наличием в ее составе представителей большинства других наземных ярусов, что с известной осторожностью позволяет экстраполировать оценку их устойчивости к стрессовым воздействиям на население беспозвоночных в целом.
В настоящее время повсеместно отмечается снижение атмосферных выбросов вследствие модернизации или закрытия металлургических предприятий [2]. В экосистемах, окружающих такой “бывший” источник загрязнения, это должно привести к инициации и постепенному развитию восстановительных процессов. Действительно, зарегистрированы примеры восстановления растительных сообществ [3–5], сообществ беспозвоночных-герпетобионтов [6] и обитателей травостоя [3]. Однако в приведенных работах описан единственный и довольно специфичный источник загрязнения: завод фосфатных удобрений, деятельность которого привела к защелачиванию верхних почвенных горизонтов (pH увеличен с 7 до 9). Для условий загрязнения тяжелыми металлами вблизи плавильных заводов более характерно продолжение дигрессии сообществ беспозвоночных, описанное, например, для почвенного [7] и подстилочного [8, 9] ярусов. Эти результаты соответствуют “инерционной гипотезе”, согласно которой биота надолго сохраняется в угнетенном состоянии даже после полного прекращения выбросов [10, 11]. В целом число исследований, посвященных беспозвоночным в условиях снижения выбросов, на данный момент крайне невелико [12].
Выбросы Среднеуральского медеплавильного завода постепенно сокращались с начала 1990-х гг., а после 2010 г. почти полностью прекратились [13], что позволило приступить к исследованию закономерностей восстановления экосистем. На наиболее загрязненной территории в подстилке и верхних почвенных горизонтах лесных участков происходит снижение концентрации Cu и нормализуется pH [13], хотя признаки восстановления в травяно-кустарничковом ярусе лесных экосистем пока отсутствуют [14–16]. Это дает основание предполагать, что и в луговых сообществах, вплотную примыкающих к описанным лесным участкам, темпы восстановления невелики. В то же время на умеренно загрязненной территории вероятна большая выраженность восстановительных процессов. Некоторые предпосылки этого (например, увеличение доли разнотравья), а также возможные тренды восстановления были описаны нами ранее [17–19].
Цель данной работы – анализ изменений, происходящих в сообществах беспозвоночных лугового травостоя в результате снижения выбросов медеплавильного завода. Проверяли гипотезу о том, что на территории с умеренным загрязнением снижение выбросов ведет к относительно быстрому восстановлению сообществ, тогда как на сильно загрязненной территории восстановление отсутствует или выражено слабее.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена в районе Среднеуральского медеплавильного завода (СУМЗ), расположенного на окраине г. Ревды (Свердловская обл.). В 1980 г. выбросы завода (SO2 и тяжелые металлы, ассоциированные с пылевыми частицами) составляли 225 тыс. т в год, в 1990 г. – 148 тыс. т, в 2000 г. – 63 тыс. т, после реконструкции в 2010 г. выбросы практически прекратились (составляют около 3 тыс. т/год). Общая масса атмосферных выбросов в период с 1980 г. по 2012 г. уменьшилась в 75 раз (в том числе SO2 – в 116 раз (с 201 до 1.7 тыс. т/год), пылевых частиц – в 44 раза (с 21 до 0.5 тыс. т/год)). Выбросы Cu сократились в 5500 раз (с 4.4 до 0.0008 тыс. т/год), As – в 1571 раз (с 0.9 до 0.0006 тыс. т/год), Pb – в 16 раз (с 1 до 0.07 тыс. т/год). Выбросы Zn в период с 1989 г. по 2012 г. сократились в 15 раз (с 1.8 до 0.1 тыс. т/год). Более подробная характеристика состава и динамики выбросов представлена ранее [13, 14].
Ключевые участки были расположены в западном направлении от СУМЗа (против направления господствующих ветров) в импактной (1 км от завода, сильное загрязнение), буферной (4 км, слабое загрязнение) и фоновой (30 км, загрязнение на уровне регионального фона) зонах, в пониженных элементах рельефа на вторичных суходольных лугах, сформировавшихся на лесных полянах размером около 5000 м2 в результате вырубки леса около 70 лет назад. Основания для выделения зон загрязнения подробно рассмотрены в работах [11, 13, 14]. Флористический состав луговой растительности сильно различается между зонами нагрузки, что связано с исчезновением чувствительных видов разнотравья и замещением их злаками вблизи завода: в фоновой зоне – луга разнотравные, в буферной – разнотравно-злаковые, в импактной – злаковые, с абсолютным доминированием Agrostis capillaris L. Более детально травостой был описан ранее [17]. На момент проведения исследований выпас скота и сенокос на всех участках отсутствовали.
Беспозвоночные травостоя собраны с помощью модифицированного биоценометра Конакова–Онисимовой (площадь основания 0.25 м2), совмещенного с портативным пылесосом с автономным источником питания. Каждая проба – результат однократной установки биоценометра с последующим сбором всех попавших в него беспозвоночных и срезанием на уровне почвы всех травянистых растений. Первый период исследования осуществлен в 2006–2008 гг., второй – в 2015–2017 гг. Каждый год проводили три тура учетов, приуроченных ко второй половине каждого летнего месяца (1-й тур – июнь, 2-й – июль, 3-й – август). Пробные площади размером 50 × 50 м, по три в каждой зоне нагрузки, были расположены на расстоянии 100–300 м друг от друга. Пробные площади были постоянными и совпадали в оба периода исследования. Конструкция биоценометра [20], а также методика и порядок сбора проб [17] подробно описаны ранее.
Объем выборки составил по 10 проб на пробную площадь за тур учета. Таким образом, за 6 лет (18 туров) собрано 1620 проб беспозвоночных и растений (по 270 каждый год). В первый период собрано более 62 600 экз. беспозвоночных, во второй – более 61 900 экз. Для растений измеряли общую воздушно-сухую массу, а также массу двух фракций – граминоидов (злаки, осоки и ситниковые) и разнотравья с точностью 0.1 г. Видовая принадлежность растений определена для материала, собранного в августе 2008 и 2015 гг.
В лабораторных условиях были установлены таксономическая принадлежность (до уровня семейств) и трофическая специализация беспозвоночных. Всего рассмотрено 6 трофических групп: сосущие и грызущие фитофаги, сосущие и грызущие зоофаги, гемофаги и прочие (табл. 1).
Таблица 1.
Состав трофических групп
| Трофическая группа | Таксономическая или сборная группа |
|---|---|
| Сосущие фитофаги | Heteroptera: Berytinidae, Coreidae, Lygaeidae, Miridae, Pentatomidae (кроме Asopinae), Rhopalidae, Scutelleridae, Tingidae |
| Auchenorrhyncha: Aphrophoridae, Cicadellidae, Cixiidae, Delphacidae, Membracidae | |
| Sternorrhyncha: Psyllidae, Aphididae, Coccinea | |
| Diptera: Brachycera anthophaga | |
| Lepidoptera: Lepidoptera (i) | |
| Грызущие фитофаги | Orthoptera: Acrididae |
| Coleoptera: Attelabidae, Apionidae, Brentidae, Buprestidae, Byrrhidae, Cerambycidae, Chrysomelidae, Curculionidae, Elateridae, Lagriidae, Mordellidae, Nitidulidae, Oedemeridae | |
| Diptera: Nematocera anthophaga | |
| Lepidoptera: Lepidoptera (l) | |
| Hymenoptera: Symphyta | |
| Gastropoda: Agriolimacidae, Arionidae, Bradybaenidae, Cochlicopidae, Discidae, Ellobiidae, Euconulidae, Gastrodontidae, Hygromiidae, Oxychilidae, Punctidae, Succineidae, Valloniidae, Vertiginidae, Vitrinidae | |
| Сосущие зоофаги | Heteroptera: Anthocoridae, Nabiidae, Pentatomidae (Asopinae), Reduviidae, Saldidae |
| Neuroptera: Chrysopidae (l) | |
| Diptera: Asilidae | |
| Aranei: Araneidae, Clubionidae, Corinnidae, Dictynidae, Eutichuridae, Gnaphosidae, Hahniidae, Linyphiidae, Liocranidae, Lycosidae, Mimetidae, Oxyopidae, Philodromidae, Pisauridae, Salticidae, Sparassidae, Tetragnathidae, Theridiidae, Thomisidae, Zoridae | |
| Грызущие зоофаги | Odonata: Odonata (i) |
| Coleoptera: Cantharidae, Carabidae, Coccinellidae, Colydiidae, Lampyridae, Malachidae | |
| Neuroptera: Chrysopidae (i) | |
| Opiliones: Nemastomatidae, Phalangiidae | |
| Lithobiomorpha: Lithobiidae | |
| Гемофаги | Diptera: Culicidae, Simuliidae, Tabanidae, Brachycera haemophaga |
| Ixodida: Ixodidae | |
| Прочие трофические группы | Blattoptera: Blattidae |
| Orthoptera: Tettigonidae | |
| Heteroptera: Aradidae, Heteroptera indet. (l) | |
| Coleoptera: Anthicidae, Catopidae, Helodidae, Hydrophilidae, Lathridiidae, Staphylinidae, Coleoptera (l), Coleoptera (p) | |
| Hymenoptera: Apoidea, Vespoidea, Hymenoptera microparasitica | |
| Diptera: Tipulidae, Diptera (l) | |
| Insecta: Insecta indet. (l), Insecta indet. (p) | |
| Nematoda | |
| Annelida: Lumbricidae |
При обработке данных были рассчитаны стандартные описательные статистики (среднее и стандартная ошибка). Анализ влияния зоны загрязнения и периода исследования на обилие беспозвоночных и фитомассу выполнен в пакете LMERConvenienceFunctions [21] на основе обобщенных линейных моделей со смешанными эффектами: фиксированные факторы – зона загрязнения и период исследования, случайный фактор – пробная площадь. Множественные сравнения реализованы с помощью критерия Тьюки в пакете multcomp [22].
Стандартизированный индекс сухости (SPEI) рассчитан в пакете SPEI [23] для набора значений среднемесячной температуры воздуха и суммарного месячного количества осадков для периода с января 1959 г. по декабрь 2021 г. по данным метеостанции г. Ревда (WMO ID 28430, [24]); результаты визуализированы в пакете ggplot2 [25]. Индекс SPEI предназначен для учета соотношения осадков и потенциальной эвапотранспирации на любой территории в глобальном масштабе; значения индекса можно существенно уточнить при использовании данных местных метеорологических наблюдений за достаточно протяженный период (30–50 лет и более). Индекс SPEI позволяет оценить условия увлажнения в интересующий период (с точностью до месяца) по отношению к многолетнему среднему: значения выше 1.5 соответствуют избыточному увлажнению, ниже –1.5 – засухе.
Дендрограмму несходства видовой структуры растительных сообществ построили в пакете pvclust [26] методом Варда на основе матрицы расстояний Брея-Кертиса. Структуру сообществ беспозвоночных по соотношению трофических и крупных таксономических групп визуализировали с помощью неметрического многомерного шкалирования (nMDS) на основе матриц расстояний Брея-Кертиса в пакетах vegan (функция metaMDS [27]) и ggord [28]. Значимость различий структуры сообществ между зонами и периодами оценили с помощью перестановочного многомерного дисперсионного анализа (PERMANOVA; 999 перестановок; функция adonis2 пакета vegan) и апостериорных (post-hoc) множественных сравнений в пакете pairwiseAdonis [29]. Все расчеты выполнены в программной среде R [30].
РЕЗУЛЬТАТЫ
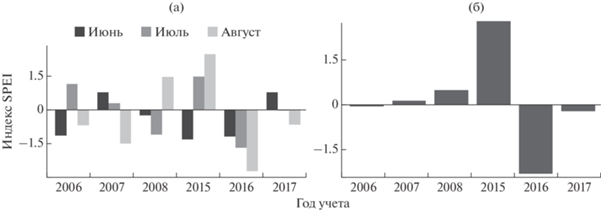
Согласно индексу сухости SPEI, лето 2015 г. было одним из самых переувлажненных за более чем 60-летний период, а лето 2016 г., напротив, одним из самых засушливых. В то же время 2006–2008 и 2017 гг. по влагообеспеченности были близки к многолетнему среднему (рис. 1).
Рис. 1.
Индекс SPEI в годы исследований: а – рассчитан для каждого из летних месяцев; б – суммарно для четырех месяцев (май–август). Значения SPEI выше 1.5 соответствуют избыточному увлажнению, ниже –1.5 – засухе.
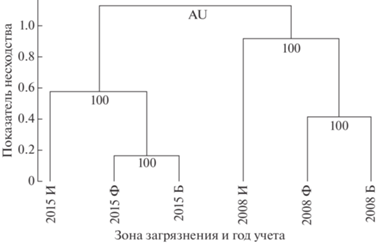
В фоновой зоне фитомасса травянистых растений (как общая, так и обеих фракций) не различалась между периодами (табл. 2, 3). В буферной зоне фитомасса граминоидов в 1.7 раза снизилась, а фитомасса разнотравья в 1.5 раза возросла между периодами. В импактной зоне тенденция аналогична (в 1.5 и 4.0 раза соответственно). В первом периоде общая фитомасса в буферной зоне не отличалась от фоновой, во втором – увеличилась в 1.2 раза за счет разнотравья; фитомасса граминоидов снизилась до значений, близких к фоновым. Видовая структура травостоя сильнее всего различалась между периодами, а различия между зонами загрязнения менее контрастны (рис. 2).
Таблица 2.
Обилие беспозвоночных (экз/м2) и фитомасса растений (г/м2) в травостое исследуемых лугов
| Трофическая группа/фракция фитомассы | Период исследования и зона загрязнения | |||||
|---|---|---|---|---|---|---|
| I | II | |||||
| фоновая | буферная | импактная | фоновая | буферная | импактная | |
| Беспозвоночные | ||||||
| Общее обилие | $\frac{{227.9 \pm 11.2}}{{213 - 237}}$ | $\frac{{297.8 \pm 13.6}}{{243 - 333}}$ | $\frac{{403.6 \pm 33.3}}{{275 - 485}}$ | $\frac{{223.7 \pm 18.0}}{{164 - 285}}$ | $\frac{{221.8 \pm 16.2}}{{184 - 277}}$ | $\frac{{472.6 \pm 45.9}}{{420 - 532}}$ |
| Фитофаг сосущий | $\frac{{95.9 \pm 7.5}}{{92 - 103}}$ | $\frac{{161.0 \pm 10.6}}{{139 - 172}}$ | $\frac{{328.3 \pm 31.2}}{{195 - 400}}$ | $\frac{{132.6 \pm 15.8}}{{76 - 204}}$ | $\frac{{126.2 \pm 14.0}}{{92 - 185}}$ | $\frac{{415.1 \pm 46.3}}{{363 - 503}}$ |
| цикадовые | $\frac{{63.9 \pm 6.1}}{{56 - 72}}$ | $\frac{{116.6 \pm 8.6}}{{91 - 140}}$ | $\frac{{283.1 \pm 30.1}}{{152 - 351}}$ | $\frac{{89.2 \pm 12.8}}{{36 - 142}}$ | $\frac{{73.3 \pm 10.5}}{{44 - 108}}$ | $\frac{{377.5 \pm 45.2}}{{318 - 467}}$ |
| клопы-фитофаги | $\frac{{11.9 \pm 1.8}}{{9 - 16}}$ | $\frac{{20.4 \pm 4.0}}{{14 - 30}}$ | $\frac{{25.0 \pm 4.3}}{{20 - 28}}$ | $\frac{{13.8 \pm 2.0}}{{10 - 20}}$ | $\frac{{14.8 \pm 1.7}}{{11 - 20}}$ | $\frac{{20.3 \pm 4.7}}{{6 - 31}}$ |
| короткоусые двукрылые-фитофаги | $\frac{{13.2 \pm 1.4}}{{12 - 14}}$ | $\frac{{16.9 \pm 2.1}}{{13 - 23}}$ | $\frac{{12.1 \pm 1.3}}{{10 - 16}}$ | $\frac{{25.0 \pm 3.5}}{{14 - 34}}$ | $\frac{{33.8 \pm 5.4}}{{17 - 51}}$ | $\frac{{13.0 \pm 1.3}}{{8 - 19}}$ |
| Фитофаг грызущий | $\frac{{45.2 \pm 3.0}}{{41 - 52}}$ | $\frac{{46.1 \pm 2.9}}{{38 - 54}}$ | $\frac{{11.0 \pm 1.3}}{{7 - 14}}$ | $\frac{{33.9 \pm 2.8}}{{26 - 46}}$ | $\frac{{40.1 \pm 3.8}}{{29 - 59}}$ | $\frac{{16.7 \pm 4.2}}{{4 - 39}}$ |
| жуки-фитофаги | $\frac{{5.5 \pm 0.5}}{{5 - 6}}$ | $\frac{{8.6 \pm 1.2}}{{5 - 12}}$ | – | $\frac{{1.5 \pm 0.4}}{{1 - 2}}$ | $\frac{{4.9 \pm 1.1}}{{2 - 10}}$ | – |
| длинноусые двукрылые-фитофаги | $\frac{{10.2 \pm 1.8}}{{7 - 16}}$ | $\frac{{9.2 \pm 1.2}}{{6 - 12}}$ | $\frac{{4.4 \pm 1.1}}{{1 - 6}}$ | $\frac{{18.1 \pm 2.2}}{{12 - 28}}$ | $\frac{{24.9 \pm 3.8}}{{12 - 42}}$ | $\frac{{14.7 \pm 3.9}}{{3 - 34}}$ |
| моллюски | $\frac{{16.4 \pm 1.9}}{{10 - 21}}$ | $\frac{{13.0 \pm 1.5}}{{7 - 19}}$ | – | $\frac{{6.8 \pm 1.0}}{{5 - 10}}$ | $\frac{{3.6 \pm 0.9}}{{1 - 7}}$ | – |
| Зоофаг сосущий | $\frac{{25.8 \pm 1.4}}{{24 - 28}}$ | $\frac{{32.6 \pm 2.3}}{{29 - 38}}$ | $\frac{{16.3 \pm 1.5}}{{12 - 22}}$ | $\frac{{24.1 \pm 2.4}}{{16 - 34}}$ | $\frac{{20.4 \pm 1.3}}{{16 - 24}}$ | $\frac{{7.7 \pm 0.6}}{{6 - 9}}$ |
| клопы-зоофаги | $\frac{{3.9 \pm 0.5}}{{3 - 4}}$ | $\frac{{6.8 \pm 0.8}}{{6 - 8}}$ | $\frac{{2.7 \pm 0.5}}{{0 - 4}}$ | $\frac{{5.6 \pm 0.8}}{{3 - 8}}$ | $\frac{{3.9 \pm 0.6}}{{1 - 6}}$ | $\frac{{0.4 \pm 0.2}}{{0 - 1}}$ |
| пауки | $\frac{{22.2 \pm 1.2}}{{21 - 24}}$ | $\frac{{26.4 \pm 2.0}}{{23 - 32}}$ | $\frac{{14.1 \pm 1.3}}{{11 - 20}}$ | $\frac{{19.0 \pm 2.0}}{{14 - 26}}$ | $\frac{{15.4 \pm 1.3}}{{12 - 18}}$ | $\frac{{6.8 \pm 0.5}}{{5 - 8}}$ |
| Зоофаг грызущий | $\frac{{5.8 \pm 0.8}}{{5 - 6}}$ | $\frac{{3.4 \pm 0.7}}{{3 - 4}}$ | $\frac{{0.1 \pm 0.1}}{{0 - 1}}$ | $\frac{{4.4 \pm 0.7}}{{4 - 5}}$ | $\frac{{3.0 \pm 0.6}}{{1 - 5}}$ | – |
| жуки-зоофаги | $\frac{{1.3 \pm 0.4}}{{1 - 2}}$ | $\frac{{1.2 \pm 0.5}}{{1 - 1}}$ | $\frac{{0.1 \pm 0.1}}{{0 - 1}}$ | $\frac{{0.3 \pm 0.2}}{{0 - 1}}$ | $\frac{{0.6 \pm 0.3}}{{0 - 1}}$ | – |
| сенокосцы | $\frac{{3.9 \pm 0.8}}{{4 - 4}}$ | $\frac{{1.2 \pm 0.4}}{{1 - 2}}$ | – | $\frac{{3.6 \pm 0.7}}{{3 - 4}}$ | $\frac{{1.5 \pm 0.6}}{{0 - 2}}$ | – |
| Гемофаг | $\frac{{36.9 \pm 10.9}}{{14 - 57}}$ | $\frac{{31.3 \pm 6.6}}{{20 - 38}}$ | $\frac{{20.7 \pm 6.8}}{{15 - 30}}$ | $\frac{{11.9 \pm 4.0}}{{3 - 28}}$ | $\frac{{10.4 \pm 2.6}}{{3 - 16}}$ | $\frac{{6.7 \pm 1.5}}{{1 - 10}}$ |
| Прочие группы | $\frac{{18.8 \pm 1.6}}{{12 - 22}}$ | $\frac{{23.7 \pm 2.2}}{{15 - 30}}$ | $\frac{{27.0 \pm 2.3}}{{21 - 35}}$ | $\frac{{17.5 \pm 1.5}}{{14 - 22}}$ | $\frac{{23.1 \pm 2.2}}{{17 - 31}}$ | $\frac{{26.7 \pm 3.1}}{{17 - 32}}$ |
| Травянистые растения | ||||||
| Общая фитомасса | $\frac{{219.4 \pm 10.1}}{{200 - 236}}$ | $\frac{{236.4 \pm 7.8}}{{216 - 249}}$ | $\frac{{149.9 \pm 5.5}}{{128 - 171}}$ | $\frac{{209.9 \pm 9.0}}{{194 - 220}}$ | $\frac{{252.3 \pm 13.4}}{{240 - 266}}$ | $\frac{{104.9 \pm 4.8}}{{86 - 115}}$ |
| граминоиды | $\frac{{63.6 \pm 7.2}}{{44 - 86}}$ | $\frac{{104.3 \pm 7.4}}{{84 - 125}}$ | $\frac{{149.0 \pm 5.6}}{{126 - 170}}$ | $\frac{{60.1 \pm 3.5}}{{52 - 72}}$ | $\frac{{60.6 \pm 6.2}}{{41 - 96}}$ | $\frac{{101.2 \pm 4.3}}{{84 - 113}}$ |
| разнотравье | $\frac{{156.6 \pm 7.9}}{{137 - 194}}$ | $\frac{{132.7 \pm 7.0}}{{112 - 166}}$ | $\frac{{0.9 \pm 0.4}}{{0 - 3}}$ | $\frac{{150.5 \pm 8.0}}{{143 - 165}}$ | $\frac{{192.0 \pm 13.0}}{{171 - 210}}$ | $\frac{{3.6 \pm 1.4}}{{0 - 9}}$ |
Таблица 3.
Результаты множественных сравнений для обобщенных линейных моделей со смешанными эффектами (фиксированные факторы – зона загрязнения и период исследования, случайный фактор – пробная площадь) обилия трофических групп беспозвоночных травостоя и фитомассы фракций луговой травянистой растительности
| Группа | Зона загрязнения и период исследования | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| отличия внутри зон | отличия между зонами | ||||||||
| Ф1–Ф2 | Б1–Б2 | И1–И2 | Ф1–Б1 | Ф2–Б2 | Б1–И1 | Б2–И2 | Ф1–И1 | Ф2–И2 | |
| Общее обилие беспозвоночных | 0.995 | <0.001 | <0.001 | <0.001 | 1.000 | <0.001 | <0.001 | <0.001 | <0.001 |
| Фитофаг сосущий | <0.001 | <0.001 | <0.001 | <0.001 | 0.996 | <0.001 | <0.001 | <0.001 | <0.001 |
| цикадовые | <0.001 | <0.001 | <0.001 | <0.001 | 0.512 | <0.001 | <0.001 | <0.001 | <0.001 |
| клопы-фитофаги | 0.921 | 0.137 | 0.446 | 0.002 | 0.997 | 0.540 | 0.189 | <0.001 | 0.060 |
| короткоусые двукрылые-фитофаги | <0.001 | <0.001 | 0.997 | 0.636 | 0.176 | 0.340 | <0.001 | 0.997 | <0.001 |
| Фитофаг грызущий | 0.012 | 0.545 | 0.049 | 1.000 | 0.660 | <0.001 | <0.001 | <0.001 | <0.001 |
| жуки-фитофаги | 0.002 | 0.070 | – | 0.369 | 0.014 | – | – | – | – |
| длинноусые двукрылые-фитофаги | 0.002 | <0.001 | <0.001 | 0.994 | 0.251 | 0.026 | 0.007 | 0.005 | 0.764 |
| моллюски | <0.001 | <0.001 | – | 0.610 | 0.092 | – | – | – | – |
| Зоофаг сосущий | 0.991 | <0.001 | <0.001 | 0.183 | 0.696 | <0.001 | <0.001 | 0.002 | <0.001 |
| клопы-зоофаги | <0.001 | <0.001 | <0.001 | <0.001 | 0.127 | <0.001 | <0.001 | 0.415 | <0.001 |
| пауки | <0.001 | <0.001 | <0.001 | 0.245 | 0.212 | <0.001 | <0.001 | <0.001 | <0.001 |
| Зоофаг грызущий | 0.855 | 0.996 | – | 0.339 | 0.711 | 0.018 | – | 0.003 | – |
| жуки-зоофаги | 0.344 | 0.842 | – | 1.000 | 0.975 | 0.418 | – | 0.338 | – |
| сенокосцы | 0.992 | 0.964 | – | 0.061 | 0.210 | – | – | – | – |
| Гемофаг | <0.001 | <0.001 | <0.001 | 0.978 | 0.997 | 0.287 | 0.460 | 0.058 | 0.213 |
| Прочие трофические группы | 0.993 | 1.000 | 1.000 | 0.374 | 0.198 | 0.842 | 0.780 | 0.023 | 0.005 |
| Общая фитомасса | 0.840 | 0.421 | <0.001 | 0.298 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
| граминоидов | 0.963 | 0.001 | <0.001 | <0.001 | 1.000 | 0.001 | <0.001 | <0.001 | <0.001 |
| разнотравья | 0.929 | <0.001 | 0.020 | 0.139 | 0.005 | <0.001 | <0.001 | <0.001 | <0.001 |
Рис. 2.
Несходство (индекс Брея-Кертиса) видовой структуры травостоя в фоновой (Ф), буферной (Б) и импактной (И) зонах загрязнения в разные годы учета. Цифры в основаниях ветвей дендрограммы – относительно несмещенные числа поддержки (AU, %). Кластеры с AU ≥ 95% считают статистически значимыми.
Общее обилие беспозвоночных в первый и второй периоды оказалось сходным – 309.7 ± 14.9 и 306.0 ± 21.7 экз/м2 соответственно. В фоновой зоне общее обилие беспозвоночных, а также обилие зоофагов не различалось между периодами (см. табл. 2, 3). В буферной зоне обилие грызущих фитофагов и зоофагов не различалось между периодами; в импактной зоне различалось обилие всех трофических групп.
При сравнении фоновой и буферной зон общее обилие в первом периоде различалось, тогда как во втором различия отсутствовали (см. табл. 2, 3). Исчезновение различий обусловлено снижением в 1.3 раза в буферной зоне обилия сосущих фитофагов, и в их числе двух наиболее обильных групп – цикадовых (в 1.6 раза) и клопов (в 1.3 раза). Также данная тенденция отмечена для клопов-зоофагов (обилие снижено в 1.7 раза). В целом во втором периоде заметно увеличилось количество трофических и таксономических групп, у которых различия между фоновой и буферной зонами отсутствуют. Исключение составили жуки-фитофаги, обилие которых во втором периоде снизилось в обеих зонах, причем в фоновой зоне значительно сильнее (в 3.7 раза), чем в буферной (в 1.8 раза), что и привело к статистической значимости различий. Сравнение фоновой и буферной зон с импактной выявило значимые различия общего обилия как в первом, так и во втором периодах за счет стабильно высокой численности сосущих фитофагов (и в их числе цикадовых) на наиболее загрязненной территории. Сходная тенденция отмечена для всех трофических и большей части таксономических групп.
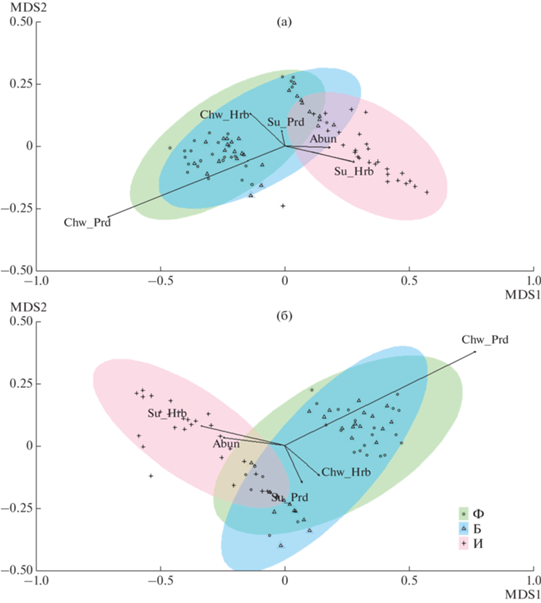
Структура сообществ беспозвоночных по соотношению трофических и таксономических групп разных зон загрязнения различалась между периодами исследования. Соотношение трофических групп (рис. 3) в первом периоде (число измерений ординационной диаграммы 2, стресс 0.061) отличалось между всеми зонами загрязнения (p = 0.001). Во втором периоде (число измерений 2, стресс 0.098) различия между фоновой и буферной зонами отсутствовали (p = 0.804), а при сравнении импактной зоны с прочими сохранялись (p = 0.001). Среднее расстояние до центроидов для всех зон увеличилось от первого периода ко второму: фоновая – с 0.120 до 0.192, буферная – с 0.108 до 0.175, импактная – с 0.194 до 0.241.
Рис. 3.
Ординация методом неметрического многомерного шкалирования (nMDS) обилия основных трофических групп беспозвоночных травостоя в первом (а) и втором (б) периодах исследования. Группы: Abun – общее обилие, Su_Hbv – сосущие фитофаги, Chw_Hbv – грызущие фитофаги, Su_Prd – сосущие зоофаги, Chw_Prd – грызущие зоофаги. Зоны загрязнения: Ф – фоновая, Б – буферная, И – импактная.
Соотношение таксономических групп (рис. 4) менялось аналогично: в первом периоде (число измерений 2, стресс 0.120) все зоны различались между собой (p = 0.001). Во втором периоде (число измерений 2, стресс 0.160) различия между фоновой и буферной зонами также исчезли (p = 0.192), при сравнении импактной зоны с прочими сохранились (p = 0.001). Среднее расстояние до центроидов также увеличилось для всех зон от первого периода ко второму: фоновая – с 0.220 до 0.280, буферная – с 0.188 до 0.273, импактная – с 0.234 до 0.287.
Рис. 4.
Ординация методом неметрического многомерного шкалирования (nMDS) обилия крупных таксономических групп беспозвоночных травостоя в первом (а) и втором (б) периодах исследования. Группы: Hrb_beetles – жуки-фитофаги, Hrb_bugs – клопы-фитофаги, Hrb_brach – короткоусые двукрылые-фитофаги, Hrb_hopp – цикадовые, Hrb_moll – моллюски, Hrb_nemat – длинноусые двукрылые-фитофаги, Prd_beetles – жуки-зоофаги, Prd_bugs – клопы-зоофаги, Prd_Harv – сенокосцы, Prd_spiders – пауки. Зоны загрязнения см. на рис. 3.
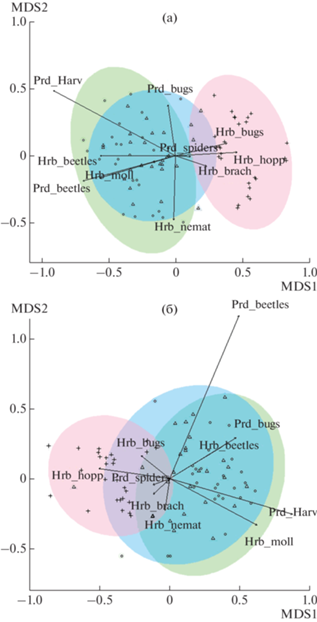
В оба периоды значения общего обилия, обилия сосущих фитофагов, а также цикадовых и клопов-фитофагов положительно коррелировали между собой и уровнем загрязнения. Обилие грызущих фитофагов, жуков-фитофагов и моллюсков отрицательно коррелировало с загрязнением; сходную тенденцию во втором периоде проявили сосущие зоофаги (клопы-зоофаги). Грызущие зоофаги (как и сосущие зоофаги в первом периоде) демонстрировали слабую связь с уровнем загрязнения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Важный результат работы – отсутствие различий общего обилия беспозвоночных между первым и вторым периодами в фоновой зоне (см. табл. 2, 3). Ранее мы уже отмечали [19] выраженные погодные различия между периодами исследования. Расширение на треть интервала лет, по которым рассчитывали индекс сухости SPEI, подтвердило этот факт (см. рис. 1). Несмотря на выраженные погодные флуктуации, население беспозвоночных травостоя в целом оказалось стабильным. При этом во втором периоде в ординационных диаграммах расстояние до центроидов увеличилось, что отражает наличие дестабилизирующего влияния и хорошо согласуется с описанными погодными аномалиями во втором периоде.
Стабильность населения беспозвоночных на фоновой территории позволяет предположить, что на загрязненных участках различия между периодами в первую очередь обусловлены снижением загрязнения, что инициировало восстановительные процессы в травостое, включая увеличение разнообразия растений, снижение вклада граминоидов и смягчение микроклимата, который ранее был сдвинут в сторону большей “аридности” [18, 19].
Сравнивая наши данные с результатами исследования, проведенного в период высоких выбросов СУМЗа (1988–1989 гг. [11]), необходимо отметить значительное увеличение фитомассы разнотравья в буферной зоне: по сравнению с 1988–1989 гг. она увеличилась в 1.5 раза в первом периоде и в 2.2 раза во втором, как и общая фитомасса (в 1.1 и 1.4 раза соответственно). Показательно изменение соотношения фракций в общей фитомассе: доля разнотравья возросла с 50% в 1989 г. до 56% в первом периоде и до 76% во втором. Таким образом, структура фитомассы в буферной зоне во втором периоде вплотную приблизилась к значениям фоновой зоны. Видовая структура травостоя здесь также приобрела большее сходство с фоновой территорией (см. рис. 2). Эти изменения можно расценивать как проявление восстановительных процессов в ярусе травянистой растительности.
В импактной зоне, напротив, по сравнению с 1988–1989 гг. сильно снизилась фитомасса граминоидов, а за счет этого и общая фитомасса – в 2 и 3 раза для первого и второго периодов. Несмотря на четырехкратное увеличение фитомассы разнотравья во втором периоде по сравнению с первым (см. табл. 2), ее абсолютные значения остались ничтожными; в результате соотношение долей фракций в общей фитомассе в импактной зоне не претерпело изменений.
В указанной выше работе [11] был использован несколько иной подход при формировании трофических групп беспозвоночных по сравнению с нашим, что осложняет прямое сравнение данных. Тем не менее для ряда параметров это оказалось возможным. Так, по нашим данным, общее обилие беспозвоночных травостоя в буферной зоне увеличилось в первом периоде в 1.6 раза по сравнению с 1989 г., однако во втором периоде почти вернулось к исходным значениям из-за снижения обилия ряда групп, в первую очередь сосущих фитофагов (цикадовых и клопов). Важно отметить, что во втором периоде значения обилия – общего, сосущих фитофагов и цикадовых – вплотную приблизились к показателям фоновой зоны (см. табл. 2 и 3; рис. 3). Сосущие фитофаги – одна из немногих групп, обилие которых часто увеличивается на загрязненных территориях [31]. Выраженную положительную связь этой группы с загрязнением также подтверждают наши результаты (см. рис. 3 и 4). Следовательно, снижение обилия сосущих фитофагов с некоторой осторожностью можно расценивать как признак восстановительной динамики после снижения выбросов. Доли сосущих фитофагов и цикадовых в общем обилии в буферной зоне снижались – с 86 и 80% в 1989 г. до 56 и 39% в первый и 53 и 33% во второй периоды соответственно, что также добавляет аргументов в пользу восстановления сообществ. Отметим, что снижение долей этих групп было зарегистрировано еще в первом периоде, т.е. до почти полного прекращения выбросов в 2010 г.
В импактной зоне общее обилие беспозвоночных последовательно возрастало: в 1.4 раза по сравнению с 1989 г. в первом периоде и 1.7 раза во втором. Это обусловлено увеличением доли цикадовых – с 60% в 1989 г. до 70% в первый и до 80% во второй периоды. Доля сосущих фитофагов составляла 88, 81 и 88% соответственно. Стабильно высокая численность сосущих фитофагов (в частности, цикадовых) на наиболее загрязненной территории в оба периоды также косвенно свидетельствует о наличии восстановительных процессов в буферной зоне.
Таким образом, анализ населения лугового травостоя на уровне общего обилия, обилия и соотношения трофических и таксономических групп позволяет говорить о достаточно выраженном восстановлении на умеренно загрязненной территории, тогда как на сильно загрязненных участках восстановительная динамика не выявлена. Этот вывод хорошо согласуется с “инерционной гипотезой” [10, 14, 32], согласно которой угнетенное состояние экосистем вблизи предприятия значительное время сохраняется даже после полного прекращения выбросов, а процессы естественного восстановления начинаются с задержкой и поначалу слабо выражены.
Помимо СУМЗа, восстановление луговых сообществ было исследовано только возле завода фосфатных удобрений в Германии. Было показано быстрое (в пределах 10 лет после прекращения выбросов) и выраженное увеличение разнообразия луговых растений [3–5], а также видового богатства герпетобионтов [6] и беспозвоночных травостоя [3]. Однако в данном случае выбросы завода защелачивали среду, что радикально отличается от воздействия СУМЗа, загрязняющего экосистемы тяжелыми металлами в сочетании с подкислением среды. Для подобной структуры выбросов описано либо полное отсутствие признаков восстановления, либо только его начальные стадии.
Примеры полного отсутствия восстановительной динамики сообществ беспозвоночных известны для почвенной макрофауны через 15 лет [7] и сообществ герпетобионтов через 30 лет [8, 9] после снижения выбросов. В случаях наличия признаков восстановления процесс растянут на десятилетия, что также хорошо согласуется с “инерционной гипотезой”. В результате 10-летнего мониторинга, проведенного на этапе снижения выбросов СУМЗа, выявлены признаки восстановления трофической активности филлофагов березы, что связали со снижением концентраций тяжелых металлов в листьях [33]. Отдельные признаки восстановления (появление новых видов) отмечены для населения моллюсков лугового травостоя на умеренно загрязненной территории в районе СУМЗа [19]. Для почвенной макрофауны на сильно загрязненных участках в этом же районе характерно увеличение общего обилия и продвижение ближе к заводу дождевых червей, энхитреид и моллюсков на последнем этапе 25-летнего мониторинга [34]. Реколонизацию территории этими группами связывают в том числе с расселением из “микросайтов выживания” – крупных валежных стволов на поздних стадиях разложения [35]. Продвижением дождевых червей также обусловлен сдвиг границы распространения европейского крота к заводу через 15–18 лет после снижения выбросов [36].
ЗАКЛЮЧЕНИЕ
Произведена оценка параметров лугового травостоя и сообществ населяющих его беспозвоночных в периоды относительно высоких (2006–2008 гг.) и почти прекратившихся (2015–2017 гг.) выбросов крупного медеплавильного завода. Во втором периоде отмечены сильные погодные флуктуации, потенциально способные негативно повлиять на изучаемые сообщества и нивелировать начавшиеся восстановительные процессы. Несмотря на это, на умеренно загрязненной территории зарегистрированы признаки восстановления как в травостое (увеличение фитомассы разнотравья, смещение соотношения фракций фитомассы, изменение видовой структуры), так и в сообществах беспозвоночных (снижение обилия сосущих фитофагов, в том числе цикадовых, увеличение сходства трофической и таксономической структур сообществ с фоновой зоной). Учитывая, что на фоновой территории обилие и структура сообществ беспозвоночных почти не различались между периодами, описанные изменения можно интерпретировать как восстановление. На сильно загрязненной территории признаков восстановления не выявлено. Описанная ситуация соответствует “инерционной гипотезе” и исходному предположению об относительно быстром восстановлении луговых сообществ в условиях умеренного загрязнения.
Подобные результаты получены для сообществ беспозвоночных травостоя впервые. Представляет интерес дальнейшее исследование видовой структуры сообществ беспозвоночных травостоя в условиях снижения выбросов, что позволит, в частности, более надежно отделить тренд восстановления от погодных флуктуаций. Кроме того, в условиях повсеместного снижения выбросов предприятий перспективным становится расширение географии работ и анализ особенностей восстановления сообществ в разных природных зонах.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН. Автор признателен Е.Л. Воробейчику (ИЭРиЖ УрО РАН) за ценные советы при обсуждении рукописи.
Автор заявляет об отсутствии конфликта интересов. В процессе работы соблюдались применимые этические нормы.
Список литературы
Чернов Ю.И., Руденская Л.В. Комплекс беспозвоночных – обитателей травостоя как ярус животного населения // Зоол. журн. 1975. Т. 54. Вып. 6. С. 884–894.
Pacyna J.M., Pacyna E.G., Aas W. Changes of emissions and atmospheric deposition of mercury, lead, and cadmium // Atmospheric Environment. 2009. V. 43. № 1. P. 117–127. https://doi.org/10.1016/j.atmosenv.2008.09.066
Perner J., Voigt W., Bährmann R. et al. Responses of arthropods to plant diversity // Ecography. 2003. V. 26. № 6. P. 788–800. https://doi.org/10.1111/j.0906-7590.2003.03549.x
Wagner M., Heinrich W., Jetschke G. Seed bank assembly in an unmanaged ruderal grassland recovering from long-term exposure to industrial emissions // Acta Oecologica. 2006. V. 30. № 3. P. 342–352. https://doi.org/10.1016/j.actao.2006.06.002
Blanke V., Schulze B., Gerighausen U. et al. The power of regeneration // Restoration Ecology. 2007. V. 15. № 2. P. 307–311.
Braun S.D., Jones T.H., Perner J. Shifting average body size during regeneration after pollution – a case study using ground beetle assemblages // Ecological Entomology. 2004. V. 29. № 5. P. 543–554. https://doi.org/10.1111/j.0307-6946.2004.00643.x
Танасевич А.В., Рыбалов Л.Б., Камаев И.О. Динамика почвенной мезофауны в зоне техногенного воздействия // Лесоведение. 2009. № 6. С. 63–76.
Babin-Fenske J., Anand M. Terrestrial insect communities and the restoration of an industrially perturbed landscape // Restoration Ecology. 2010. V. 18. № SUPPL. 1. P. 73–84. https://doi.org/10.1111/j.1526-100X.2010.00665.x
Babin-Fenske J., Anand M. Patterns of insect communities along a stress gradient following decommissioning of a Cu-Ni smelter // Environmental Pollution. 2011. V. 159. № 10. P. 3036–3043. https://doi.org/10.1016/j.envpol.2011.04.011
Тарко А.М., Быкадоров А.В., Крючков В.В. Моделирование действия атмосферных загрязнений на лесные экосистемы в регионе // Доклады РАН. 1995. Т. 341. № 4. С. 571–573.
Воробейчик Е.Л., Садыков О.Ф., Фарафонтов М.Г. Экологическое нормирование техногенных загрязнений наземных экосистем. Екатеринбург: Наука, 1994. 280 с.
Воробейчик Е.Л. Естественное восстановление наземных экосистем после прекращения промышленного загрязнения. 1. Обзор современного состояния исследований // Экология. 2022. № 1. С. 3–41. [Vorobeichik E.L. Natural recovery of terrestrial ecosystems after the cessation of industrial pollution: 1. A state-of-the-art review // Russ. J. Ecol. 2022. V. 53. № 1. P. 1–39. DOI: 10.1134/s1067413622010118]https://doi.org/10.31857/S0367059722010115
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024. https://doi.org/10.7868/S0032180X17080135
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В. и др. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458. [Vorobei-chik E.L., Trubina M.R., Khantemirova E.V. et al. Long-term dynamic of forest vegetation after reduction of copper smelter emissions // Russ. J. Ecol. 2014. V. 45. № 6. P. 498–507. DOI: 10.1134/S1067413614060150]https://doi.org/10.7868/S0367059714060158
Трубина М.Р., Воробейчик Е.Л., Хантемирова Е.В. и др. Динамика лесной растительности после снижения промышленных выбросов // Доклады РАН. 2014. Т. 458. № 6. С. 721–725. https://doi.org/10.7868/S0869565214300252
Трубина М.Р., Дьяченко А.П. Современное состояние мохового покрова лесов после сокращения выбросов Среднеуральского медеплавильного завода // Поволжский экологич. журн. 2020. № 4. С. 477–491. https://doi.org/10.35885/1684-7318-2020-4-477-491
Нестерков А.В., Воробейчик Е.Л. Изменение структуры населения беспозвоночных-хортобионтов под действием выбросов медеплавильного завода // Экология. 2009. № 4. С. 303–313. [Nesterkov A.V., Vorobeichik E.L. Changes in the structure of chortobiont invertebrate community exposed to emissions from a copper smelter // Russ. J. Ecol. 2009. V. 40. № 4. P. 286–296. DOI: 10.1134/S1067413609040109]
Золотарев М.П., Нестерков А.В. Паукообразные (Aranei, Opiliones) лугов // Экология. 2015. № 1. С. 48–56. [Zolotarev M.P., Nesterkov A.V. Arachnids (Aranei, Opiliones) in meadows: Response to pollution with emissions from the Middle Ural Copper Smelter // Russ. J. Ecol. 2015. V. 46. № 1. P. 81–88. DOI: 10.1134/S1067413614060162]https://doi.org/10.7868/S036705971406016X
Нестерков А.В., Гребенников М.Е. Сообщества моллюсков лугового травостоя в условиях снижения выбросов медеплавильного производства // Экология. 2020. № 6. С. 471–480. [Nesterkov A.V., Grebennikov M.E. Grassland land snail communities after reduction of emissions from a copper smelter // Russ. J. Ecol. 2020. V. 51. № 6. P. 578–588. DOI: 10.1134/s1067413620060065]https://doi.org/10.31857/S0367059720060062
Нестерков А.В. Опыт использования биоценометра с вакуумным пробосборником для учета беспозвоночных травостоя // Евразиатский энтомол. журн. 2014. Т.13. № 3. С. 244–245.
Tremblay A., Canada S., Ransijn J. et al. LMERConvenienceFunctions: Model selection and post-hoc analysis for (G)LMER models. R package version 3.0. https://CRAN.R-project.org/package=LMERConvenienceFunctions
Hothorn T., Bretz F., Westfall P. Simultaneous inference in general parametric models // Biometrical Journal. 2008. V. 50. № 3. P. 346–363.
Begueria S., Vicente-Serrano S.M. SPEI: Calculation of the standardised precipitation-evapotranspiration index. R package version 1.7. https://CRAN.R-project.org/ package=SPEI
Расписание погоды. Информация о погодных условиях метеостанции г. Ревда (синоптический индекс станции – 28430). https://www.rp5.ru.
Wickham H. ggplot2: Elegant graphics for data analysis. New York: Springer-Verlag, 2016. 260 p.
Suzuki R., Terada Y., Shimodaira H. pvclust: Hierarchical clustering with P-values via multiscale bootstrap resampling. R package version 2.2-0. https://CRAN.R-project.org/package=pvclust
Oksanen J., Blanchet F.G., Friendly M. et al. vegan: Community ecology package. R package version 2.5-7. https://CRAN.R-project.org/package=vegan
Beck M.W. ggord: Ordination plots with ggplot2. R package version 1.1.6. https://zenodo.org/badge/latestdoi/35334615
Martinez Arbizu P. pairwiseAdonis: Pairwise multilevel comparison using adonis. R package version 0.4. https://github.com/pmartinezarbizu/ pairwiseAdonis
R Core Team. R: a language and environment for statistical computing. http://www.R-project.org/.
Zvereva E., Kozlov M. Responses of terrestrial arthropods to air pollution // Environmental Science and Pollution Research. 2010. V. 17. № 2. P. 297–311. https://doi.org/10.1007/s11356-009-0138-0
Зверев В.Е. Смертность и возобновление березы извилистой в зоне воздействия медно-никелевого комбината в период значительного сокращения выбросов // Экология. 2009. № 4. С. 271–277. [Zverev V. Mortality and recruitment of mountain birch (Betula pubescens ssp. czerepanovii) in the impact zone of a copper-nickel smelter in the period of significant reduction of emissions: The results of 15-year monitoring // Russ. J. Ecol. 2009. V. 40. № 4. P. 254–260. DOI: 10.1134/S1067413609040055]
Бельская Е.А. Динамика трофической активности филлофагов березы в период снижения атмосферных выбросов медеплавильного завода // Экология. 2018. № 1. С. 74–80. [Belskaya E. Dynamics of trophic activity of leaf-eating insects on birch during reduction of emissions from the Middle Ural Copper Smelter // Russ. J. Ecol. 2018. V. 49. № 1. P. 87–92. DOI: 10.1134/S1067413617060029]https://doi.org/10.7868/S0367059718010092
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148. [Vorobeichik E.L., Ermakov A.I., Grebennikov M.E. Initial stages of recovery of soil macrofauna communities after reduction of emissions from a copper smelter // Russ. J. Ecol. 2019. V. 50. № 2. P. 146–160. DOI: 10.1134/S1067413619020115]https://doi.org/10.1134/S0367059719020112
Воробейчик Е.Л., Ермаков А.И., Нестеркова Д.В. и др. Крупные древесные остатки как микростации обитания почвенной мезофауны на загрязненных территориях // Изв. РАН. Серия биологическая. 2020. № 1. С. 85–95. https://doi.org/10.31857/S0002332920010178
Воробейчик Е.Л., Нестеркова Д.В. Техногенная граница распространения крота в районе воздействия медеплавильного завода // Экология. 2015. № 4. С. 308–312. [Vorobeichik E.L., Nesterkova D.V. Technogenic boundary of the mole distribution in the region of copper smelter impacts: Shift after reduction of emissions // Russ. J. Ecol. 2015. V. 46. № 4. P. 377–380. DOI: 10.1134/S1067413615040165]https://doi.org/10.7868/S0367059715040162
Дополнительные материалы отсутствуют.


