Экология, 2022, № 6, стр. 445-457
Соотношение биотопической и межгодовой изменчивости у рыжей полевки в трансформированных ветровалом и пожаром лесных биотопах Среднего Урала
А. Г. Васильев a, *, Л. Е. Лукьянова a, Ю. В. Городилова a
a ФГБУН Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: vag@ipae.uran.ru
Поступила в редакцию 28.01.2022
После доработки 23.06.2022
Принята к публикации 05.07.2022
- EDN: RPBUMK
- DOI: 10.31857/S0367059722060178
Аннотация
Оценивали проявления биотопической и межгодовой форм изменчивости у рыжей полевки (Clethrionomys glareolus) в биотопах, возникших после ветровала и последующего лесного пожара на территории Висимского заповедника (Средний Урал). С помощью методов геометрической морфометрии провели сравнение изменчивости формы нижней челюсти и морфофункциональных мандибулярных индексов в одновозрастных выборках сеголеток, отобранных в климатически различные смежные годы в зонах ветровала и гари. Между ними выявлены существенные морфогенетические различия и функциональные особенности мандибул. Межгодовые климатогенные различия сопоставимы по величине с биотопическими, но имеют другую направленность в общем морфопространстве. На гари размах климатогенной изменчивости формы мандибул выше, чем в зоне ветровала. В год с дождливым летом усилилась морфофункциональная дифференциация полевок обоих биотопов, связанная с трофическими предпочтениями зверьков. Высокая фенотипическая пластичность, выявленная в разные годы в восстанавливающихся биотопах, прямо указывает на присутствие у зверьков ценопопуляций исторически возникших преадаптаций индивидуального развития в виде спектра адаптивных модификаций морфогенеза к определенным флуктуациям климата и биотопическим последствиям природных катастроф – ветровала и пожара.
В последние годы часто оцениваются отдаленные последствия различных антропогенных воздействий на изменчивость локальных популяций модельных видов [1–8]. В то же время проблема косвенного влияния последствий природных катастроф на изменчивость изучена недостаточно [9–11]. В отличие от антропогенных и техногенных воздействий, с которыми природные популяции за время своего существования практически не сталкивались, природные катастрофы: ураганы, наводнения, ветровалы, пожары и др., напротив, многократно влияли на условия обитания видов и считаются естественными факторами. На многие из них у видов животных должны были исторически сформироваться системные адаптивные реакции на ценотическом [10], популяционном [2, 6] и индивидуальном [12, 13] уровнях, которые в первую очередь затрагивают процессы индивидуального развития. Поэтому можно ожидать, что в отличие от антропогенных воздействий природные катастрофические явления должны вызывать вполне определенные модификационные переключения развития, компенсирующие негативные изменения среды, смену растительного состава биотопов и формирующие адаптивные перестройки морфогенеза.
При ветровале происходит резкое изменение исходных биотопических условий: изменяется состав растительных сообществ, временно формируются многочисленные убежища для мелких млекопитающих, привлекаются древоразрушающие грибы, насекомые и микроорганизмы, которые способствуют утилизации выпавшего древостоя. Высохшая древесина во многом является причиной возникновения в последующие годы на месте ветровала лесного пожара (сухие грозы, антропогенные причины). При пожаре происходит неизбирательная элиминация растительности и локального населения многих видов животных, в том числе мелких млекопитающих. В дальнейшем, по мере восстановления растительности, на гарь за счет набега из прилегающих не тронутых пожаром участков проникают мелкие млекопитающие, и заново происходит формирование их локального сообщества. Сходный процесс наблюдается после массовой неизбирательной дератизации [11].
Ранее мы неоднократно обнаруживали в популяциях переключения индивидуального развития в ответ на разную полноту состава сообщества [14], на неизбирательную элиминацию [11], а также на разные фазы динамики численности (соответственно разную плотность и уровень стресса). Такие стресс-индуцированные переключения программы развития могут проявляться при восстановлении локальных популяций как адаптивная морфогенетическая реакция на новые изменившиеся экологические условия.
Подобные эффекты встречаются не только у грызунов и имеют более общий характер, поскольку обнаружены и у другой группы мелких млекопитающих – землероек (Soricidae). Так, А.В. Бадяев с соавт. [15, 16] установили, что после локальных сплошных вырубок перестойного леса в штате Монтана (США) с последующим выжиганием оставшегося лесного дебриса представители локальных сообществ землероек (Sorex) испытывают в измененных открытых биотопах сильный стресс, вызывающий повышенную эмбриональную смертность, снижение численности, аномалии и нестабильность развития (в том числе возрастание флуктуирующей асимметрии (FA) нижней челюсти). В.М. Захаровым с соавт. [17] также была выявлена связь уровня FA с динамикой численности популяции обыкновенной бурозубки в Финляндии: нестабильность развития, маркируемая FA, возрастала на спадах численности при неблагоприятных условиях. Таким образом, стресс индивидуального развития мелких млекопитающих при резких изменениях условий обитания в локальных биотопах может существенно влиять на состояние, численность и стабильность развития популяций животных, выступая как общебиологический фактор, действие которого может усилиться при климатических и антропогенных изменениях, а также под влиянием природных катастроф. Дальнейшее изучение данной тематики на модельных видах мелких млекопитающих может потенциально пролить свет на решение проблемы механизмов мозаичной эволюции [16, 18].
Представляет интерес оценить проявление морфогенетических эффектов в природных модельных ценопопуляциях в условиях измененных природных биотопов, формирующихся после природных катастрофических воздействий. До сих пор не ясно, как проявляется биотопическая изменчивость в климатически разные годы: одинаково ли направлены межгодовые морфогенетические изменения в ценопопуляциях разных биотопов или в первую очередь проявляется биотопическая специфика? На природных модельных ценопопуляциях грызунов, обитающих в контрастных биотопах, возникших после таких природных катастроф, как ветровал и лесной пожар, представляется возможность решить эти задачи.
Оценка изменчивости формы и размеров биологических объектов может быть получена методами геометрической морфометрии [19–23], которые допускают возможность морфогенетической интерпретации выявляемых различий формы [23–25] и позволяют использовать данный подход для оценки воздействия на морфогенез определенных климатических или биотопических условий.
Цель настоящей работы – анализ морфогенетических эффектов нарушения условий обитания рыжей полевки (Clethrionomys glareolus Schreber, 1780) в лесных биотопах (главным образом изменения состава растительности) под влиянием двух природных катастрофических явлений – ветровала (1995 г.) и последующего пожара (1998 г.) в Висимском заповеднике на Среднем Урале. В качестве объекта для работы была выбрана нижняя челюсть, поскольку изменчивость ее формы и размеров тесно связана с функциональными нагрузками при обработке кормовых объектов и трофикой грызунов [14, 26, 22]. Последнее позволяет, как было показано ранее [11, 14, 27], оценить морфофункциональные различия между ценопопуляциями рыжей полевки, связанные с их трофическими предпочтениями.
Особое внимание уделяли изучению морфогенетических и функциональных реакций на контрастные экологические условия двух смежных лет в двух ценопопуляциях вида, населяющего трансформированные биотопы – зону ветровала и пирогенную зону – зарастающую гарь. Речь в данном случае идет не об отдаленных морфологических последствиях изменения биотопических условий, а об оценке дарвиновской определенной изменчивости и фенотипической пластичности, отражающих проявление характерных модификаций морфогенеза в разных экологических условиях.
МАТЕРИАЛ И МЕТОДЫ
Краниологический материал для изучения влияния биотопических и климатогенных эффектов на морфогенез нижней челюсти в популяции рыжей полевки представлен выборками, собранными в Висимском государственном природном биосферном заповеднике (Средний Урал, Свердловская обл.: 57°28′ с.ш., 60°00′ в.д.) в августе 2003 и 2004 гг. в зоне ветровала, произошедшего в июне 1995 г., и пирогенной зоне – гари, возникшей после лесного пожара в июне 1998 г.
Отлов животных проведен Л.Е. Лукьяновой методом стандартных ловушко-линий с использованием в трансекте 100 проволочных капканчиков, расставленных на расстоянии 10 м друг от друга на 5 сут. Проверку ловушек осуществляли ежедневно в утренние часы. Оценку относительной численности проводили в пересчете на 100 лов.-сут. Для характеристики погодных условий разных лет использовали данные метеостанции “Висим”.
В работе использованы краниологические коллекции, хранящиеся в Музее Института экологии растений и животных УрО РАН. Все изученные выборки представлены сеголетками обоих полов (ювенильные и зимовавшие особи исключены). Объем изученного материала составил 70 экз. (зона ветровала (В): 2003 г. – 11 экз., 2004 г. – 16 экз.; пирогенная зона (П): 2003 г. – 33 экз., 2004 г. – 10 экз.).
Для сравнения формы и размеров нижней челюсти применили методы геометрической морфометрии с использованием фотографий правых ветвей нижней челюсти рыжей полевки с лингвальной стороны, полученных с помощью планшетного сканера при оптическом разрешении 1200 dpi. На изображениях с помощью программ tpsUtil [28] и tpsDig2 [29] разместили по 16 ландмарок (landmarks), характеризующих изменчивость формы (shape) нижней челюсти (рис. 1).
Рис. 1.
Размещение меток-ландмарок (landmarks) (1–16) на лингвальной стороне нижней челюсти рыжей полевки и пять исходных промеров (A–E) для расчетов мандибулярных морфофункциональных индексов (TI, TM, MI, MM, AM) [по 27, 30].
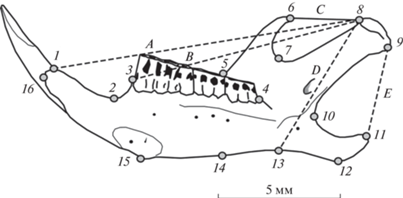
Для оценки морфофункциональных особенностей нижней челюсти использовали пять промеров: A – сочленовно-резцовый, B – сочленовно-молярный, C – темпорально-сочленовный, D – сочленовно-массетерный и E – сочленовно-угловой (см. рис. 1). По промерам вычислили морфофункциональные мандибулярные индексы [см. 27, 30, 31]: TI – темпорально-резцовый, TM – темпорально-молярный, MI – массетерно-резцовый, MM – массетерно-молярный и AM – ангулярно-массетерный. Расчет индексов провели по формулам [23, 27]: TI = C/A; TM = C/B; MI = D/A; MM = D/B и AM = E/D. Поясним, что индексы TI и TM характеризуют интенсивность продольных режуще-жевательных движений, а индексы MI и MM – интенсивность движений, связанных с грызением, раздавливанием и дроблением кормовых объектов. Предложенный ранее индекс AM косвенно характеризует интенсивность поперечных жевательных движений, которые связаны с поперечным перетиранием корма [26, 30].
Вычисление прокрустовых координат (Procrustes coordinates) выполнили с помощью генерализованного Прокрустова анализа – GPA [19] на основе метода наименьших квадратов. Центроидный размер (centroid size – CS), косвенно характеризующий размер объекта, вычисляли как корень квадратный из суммы квадратов дистанций от центра объекта до каждой из ландмарок [19]. Предварительная двукратная повторная расстановка ландмарок не выявила значимых смещений оценок, связанных с влиянием ошибок оператора [32].
Межгрупповые различия формы нижней челюсти оценили с помощью канонического анализа прокрустовых координат. Множественные межгрупповые сравнения по центроидному размеру и отдельным каноническим переменным провели методом однофакторного дисперсионного анализа (One-Way ANOVA). Для оценки возможных аллометрических эффектов изменения формы мандибул выполнили анализ главных компонент (Principal components) прокрустовых координат в каждой из четырех выборок и оценили регрессионные зависимости между центроидными размерами и значениями PC1 в соответствующих выборках.
Для оценки вклада канонических переменных в межгрупповые различия, связанные с погодными условиями и принадлежностью к биотопу, провели многомерный непараметрический двухфакторный дисперсионный анализ PERMANOVA. Значимость межгрупповых различий оценивали по факторам год (Y) и биотоп (B) с учетом их взаимодействия (Y × B). Расчет выполнен в программе PAST 4.06 [33] с использованием евклидовой метрики и перестановочного теста (Permutation test) при 10 000 повторных реплик. Влияние каждого экологического фактора на форму мандибул оценили на основе линейного дискриминантного анализа с вычислением его значимости на основе теста T2 Хотеллинга. Параллельно попарно вычислили прокрустовы дистанции d и уровни их значимости.
Показатель внутригруппового морфоразнообразия (morphological disparity) рассчитали на основе анализа паттерна ближайших соседних ординат (nearest neighbour point pattern analysis) внутри полигонов изменчивости выборок (convex hulls) [34, 35] для первых двух канонических переменных (CV1 и CV2). Оценили показатель R – отношение средней дистанции между ближними соседними ординатами (MNND – mean nearest neighbor distance) к величине ожидаемой средней ближайшей дистанции (ExpNND – expected nearest neighbor distance). Если R < 1, то выражена кластеризация ординат, при R = 1 – пуассоновский тип рассеивания, а при R > 1 – сверхрассеивание (overdispersion). Последний случай при возрастании MNND интерпретировали как увеличение внутригруппового морфоразнообразия [35], а с позиций геометрической морфометрии как расширение веера морфогенетических траекторий особей в морфопространстве – эффект стресса развития, приводящего к его нестабильности [23]. Оценку нулевой гипотезы о равенстве MNND значению ExpNND при равной плотности ординат полигона изменчивости провели на основе Z-критерия ближайшего соседа [34]. Вероятные краевые эффекты рассеивания ординат для полигонов изменчивости компенсировали методом Доннелли [36].
Статистические расчеты, включая использование методов геометрической морфометрии, выполнили с помощью пакетов программ TPS [28, 29], MorphoJ 1.6d [22] и PAST 4.06 [33].
РЕЗУЛЬТАТЫ
Экологическая специфика лет сравнения обусловлена разной динамикой выпадения осадков весной и летом 2003 и 2004 гг. на фоне сходной среднемесячной динамики температуры (рис. 2). Если в 2003 г. значительное количество осадков наблюдалось в мае и июне, а июль и август были засушливыми, то на следующий год в мае осадков было в 2 раза меньше, но все летние месяцы были дождливыми. При этом динамика среднемесячных температур в эти годы была практически одинакова (см. рис. 2).
Рис. 2.
Динамика суммарных осадков по месяцам (а) и среднемесячных значений температуры (б) в Висимском заповеднике на Среднем Урале в 2003 и 2004 гг.

Центроидные размеры (CS) нижней челюсти у изученных групп сеголеток рыжей полевки на разных участках и в разные годы были близки и статистически не различались (F-критерий Уэлша = 1.86; d.f. = 24.74; p = 0.1063). Половые различия по центроидному размеру мандибул были также незначимы (F-критерий Уэлша = 3.07, d.f. = 67.42; p = 0.0843), что позволило объединить выборки по полу при использовании центроидных размеров. Специальный предварительный дискриминантный анализ прокрустовых координат нижней челюсти самцов и самок рыжей полевки на объединенных выборках разных лет не выявил значимых различий между полами (T2 Хотеллинга = 67.77; F = 1.15; p = 0.3368), что также позволяет проводить дальнейшее исследование на объединенных по полу выборках. Отсутствие половых различий по форме мандибул обнаружено нами в 2003 г. на фазе высокой численности и в соседней сылвинской популяции рыжей полевки, локализованной в 70 км юго-западнее Висимского заповедника [14].
В канонический анализ прокрустовых координат, характеризующих изменчивость формы нижней челюсти, включили объединенные по полу выборки 2003 и 2004 гг. как из зоны ветровала, так и пирогенной зоны. Результаты сравнения представлены в табл. 1 и на рис. 3. Значимые различия проявились вдоль первых двух канонических переменных – CV1 и CV2 (см. табл. 1). Различия вдоль третьей канонической оси формально статистически достоверны, но лишь на первом уровне значимости, поэтому являются статистически слабо обоснованными. Межгрупповая дисперсия вдоль первых двух канонических осей составляет 85.24% от общей, что позволяет достаточно надежно интерпретировать различия вдоль этих двух переменных.
Таблица 1.
Итоги канонического анализа прокрустовых координат, характеризующих изменчивость формы нижней челюсти рыжей полевки, в выборках 2003 и 2004 гг. из ценопопуляций участков ветровала и гари Висимского заповедника
| Биотоп, год, показатель |
Каноническая переменная | ||
|---|---|---|---|
| CV1 | CV2 | CV3 | |
| Центроиды выборок (±SE) | |||
| Зона ветровала, 2003 | –1.646 ± 0.315 | 1.911 ± 0.329 | –1.255 ± 0.279 |
| Зона ветровала, 2004 | –1.978 ± 0.243 | 0.137 ± 0.167 | 1.458 ± 0.230 |
| Пирогенная зона, 2003 | 2.098 ± 0.183 | –0.047 ± 0.175 | 0.036 ± 0.175 |
| Пирогенная зона, 2004 | –1.947 ± 0.245 | –2.167 ± 0.408 | –1.072 ± 0.369 |
| Итоги канонического анализа | |||
| Λ Уилкса (Wilks’ Λ) | 0.0497 | 0.2491 | 0.6188 |
| Собственные числа | 4.1746 | 1.3267 | 0.8523 |
| Каноническая корреляция | 0.87 | 0.71 | 0.62 |
| Доля дисперсии, % | 64.70 | 20.54 | 14.76 |
| Критерий χ2 | 159.04 | 73.66 | 28.08 |
| Число степеней свободы (d.f.) | 84 | 54 | 15 |
| Уровень значимости, p | <0.0001 | 0.0002 | 0.0211 |
Рис. 3.
Результаты канонического анализа прокрустовых координат, характеризующих изменчивость формы нижней челюсти рыжей полевки в Висимском заповеднике в разные годы (2003–2004 гг.) в зоне ветровала (В2003, В2004) и пирогенной зоне (П2003, П2004). Здесь и на рис. 4, 5 контуры конфигураций ландмарок деформационных решеток соответствуют минимальным и максимальным значениям вдоль осей.
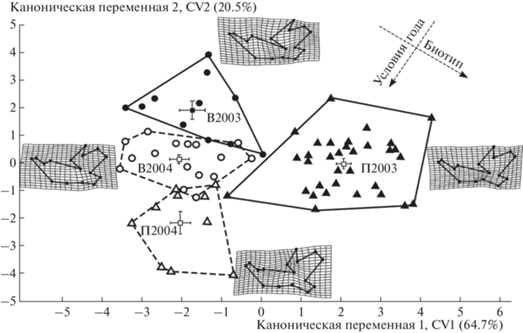
Полигоны изменчивости всех четырех выборок занимают свои собственные области морфопространства вдоль двух первых канонических переменных (см. рис. 3). Наиболее удалена от других выборка 2003 г. из пирогенной зоны.
В 2003 г. ценопопуляции из участков ветровала и гари различаются в наибольшей степени. В 2004 г. межгрупповые различия выражены меньше, но полигоны изменчивости выборок из обеих ценопопуляций существенно смещаются в морфопространстве. В большей степени это наблюдается для особей, обитающих на гари. Интересно отметить, что направление смещения полигонов в сравниваемые годы и в обеих ценопопуляциях существенно различается. На рис. 3 стрелками указаны разные направления смещений центроидов в зависимости от экологических условий разных лет и для выборок, принадлежащих ценопопуляциям разных биотопов. Так, полигоны изменчивости обеих выборок 2003 г. из разных биотопов размещены в верхней и правой областях морфопространства, а выборки 2004 г. смещены вниз и в левую область. С другой стороны, если провести секущую диагональ из левого нижнего угла в правый верхний, то пары выборок из одних и тех же биотопов, но разных лет сбора будут размещены на разных сторонах (левой и правой) общего морфопространства.
Многомерный непараметрический дисперсионный анализ PERMANOVA по значениям трех канонических переменных (CV1–CV3) позволил оценить их взаимный вклад в межгрупповые различия с учетом влияния двух экологических факторов: условий года и принадлежности к биотопу (табл. 2). Из таблицы следует, что по совокупности всех трех канонических переменных факторы условий года (Y), принадлежности к биотопу (B) и их взаимодействия (Y × B) оказывают значимое влияние на межгрупповую изменчивость формы нижней челюсти рыжей полевки. Доли межгрупповой дисперсии, обусловленной влиянием обоих основных факторов , близки по величине: если на влияние условий года приходится 25.6%, то на влияние условий биотопа – 25.2%. Поскольку взаимодействие факторов практически не выражено (доля дисперсии – 2.5%), направления межгрупповой изменчивости, обусловленные факторами год (Y) и биотоп (B), почти ортогональны в плоскости морфопространства, как показано стрелками на рис. 3. Это означает, что они влияют на межгрупповую изменчивость независимо друг от друга.
Таблица 2.
Двухфакторный непараметрический многомерный дисперсионный анализ (PERMANOVA) влияния факторов условий года (Y), биотопа (B) и их взаимодействия (Y × B) на изменчивость формы лингвальной стороны нижней челюсти рыжей полевки в Висимском заповеднике на Среднем Урале (2003–2004 гг.)
| Источник изменчивости | Сумма квадратов | Число степеней свободы, d.f. | Средний квадрат | F | Уровень значимости, p |
|---|---|---|---|---|---|
| Год (Y) | 0.75553 | 1 | 0.75553 | 36.17 | 0.0001 |
| Биотоп (B) | 0.74473 | 1 | 0.74473 | 35.65 | 0.0001 |
| Взаимодействие (Y × B) | 0.07349 | 1 | 0.07349 | 3.52 | 0.0001 |
| Остаточная | 1.37970 | 66 | 0.02089 | ||
| Общая | 2.95245 | 69 |
Прямая оценка межгрупповых различий, связанных с влиянием упомянутых экологических факторов, была осуществлена с помощью линейного дискриминантного анализа. В результате установлено, что межгодовые различия проявились в наибольшей степени (Прокрустова дистанция d = 0.0162; обобщенная дистанция Махаланобиса D2 = 8.940; T2 Хотеллинга = 146.08; p = = 0.0004). Несколько меньше выражены различия между выборками двух контрастных биотопов – ветровала и гари (d = 0.0135; D2 = 8.845; T2 = = 146.73; p = 0.0004). Межгодовые (рис. 4) и биотопические (рис. 5) различия формы нижней челюсти носят до некоторой степени противоположный характер по направлению изменений конфигурации мандибул. Сплайны конфигураций нижней челюсти на деформационных решетках, приведенных на рисунках, соответствуют крайним – максимальному (справа) и минимальному (слева) – значениям дискриминантной функции.
Рис. 4.
Результаты линейного дискриминантного анализа прокрустовых координат, характеризующих изменчивость формы нижней челюсти рыжей полевки в Висимском заповеднике в 2003 и 2004 гг.

Рис. 5.
Результаты линейного дискриминантного анализа прокрустовых координат, характеризующих изменчивость формы нижней челюсти рыжей полевки Висимского заповедника, на участках ветровала и гари.

В 2003 г. нижняя челюсть рыжих полевок имеет относительно широкое тело, горизонтально вытянутый угловой отросток, утонченный венечный отросток, смещенный кзади (см. рис. 4). В 2004 г. она характеризуется большей грацильностью, имеет относительно узкое тело, прогиб кверху в массетерной области на стыке с угловым отростком, отклоненным книзу, а также смещение кпереди венечного отростка. Последнее было характерно и для другого вида – малой лесной мыши, обитавшей в неблагоприятных условиях [5]. При сравнении биотопических различий в форме нижней челюсти (см. рис. 5) сходные варианты строения, т.е. относительно утолщенное тело мандибулы с горизонтально направленным угловым отростком и смещением кзади венечного отростка, наблюдаются у зверьков в зоне ветровала.
Ранее было показано [27, 28, 30], что по комплексу морфофункциональных мандибулярных индексов можно оценить особенности кормообрабатывающей активности грызунов. Поэтому представляло интерес оценить морфофункциональные особенности мандибул у зверьков обеих микропопуляций и их трансформации в разные годы, которые связаны с изменением локальных кормовых условий.
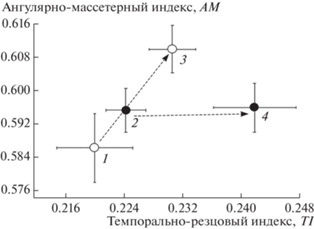
Сравнивали значения мандибулярных индексов в тех же двух аллохронных парах синтопных выборок рыжей полевки из зоны ветровала и пирогенной зоны по тем же оцифрованным изображениям лингвальной стороны нижнечелюстных ветвей. Результаты сравнения приведены в табл. 3 и частично на рис. 6. Из табл. 3 следует, что значения индексов во внутрипопуляционных группировках слабо различаются по показателям MI и MM, т.е. по степени грызущей активности. Для показателей TI, TM и AM, связанных с разными проявлениями жевательной активности, различия выражены в большей степени. В частности, при сравнении межгрупповых различий в изменчивости индексов TI и AM (см. рис. 6) в зоне ветровала от 2003 г. к 2004 г. значимо возрос индекс AM, т.е. усилилась способность к поперечной жевательной активности. В то же время в пирогенной зоне от 2003 г. к 2004 г. значимо увеличились средние значения индексов TI и TM, т.е. в этом биотопе у полевок возросла продольная жевательная активность.
Таблица 3.
Значения морфофункциональных мандибулярных индексов с учетом их стандартных ошибок (±SE) в аллохронных выборках (2003–2004 гг.) рыжей полевки в зоне ветровала (В) и пирогенной зоне (П) Висимского заповедника на Среднем Урале
| Выборка, год (экз.) | Морфофункциональные мандибулярные индексы | ||||
|---|---|---|---|---|---|
| TI ± SE | TM ±SE | MI ±SE | MM ±SE | AM ±SE | |
| В2003 (11) | 0.220 ± 0.005 | 0.284 ± 0.007 | 0.553 ± 0.007 | 0.714 ± 0.006 | 0.586 ± 0.008 |
| В2004 (16) | 0.231 ± 0.003 | 0.295 ± 0.004 | 0.557 ± 0.003 | 0.713 ± 0.005 | 0.610 ± 0.006 |
| П2003 (33) | 0.224 ± 0.003 | 0.287 ± 0.003 | 0.559 ± 0.002 | 0.717 ± 0.003 | 0.595 ± 0.005 |
| П2004 (10) | 0.242 ± 0.006 | 0.308 ± 0.007 | 0.555 ± 0.004 | 0.707 ± 0.005 | 0.596 ± 0.006 |
Рис. 6.
Ординация средних значений с учетом стандартных ошибок (±SE) морфофункциональных мандибулярных индексов TI (темпорально-резцового) и AM (ангулярно-массетерного) для аллохронных выборок рыжей полевки из зоны ветровала (1 – 2003 г., 3 – 2004 г.) и пирогенной зоны (2 – 2003 г., 4 – 2004 г.) в Висимском заповеднике (Средний Урал).
В заключение оценили проявление внутригруппового морфоразнообразия по показателю MNND в сравниваемых ценопопуляциях рыжей полевки в смежные годы (табл. 4). Напомним, что показатель MNND был рассчитан по значениям первых двух канонических переменных (CV1 и CV2). Поскольку канонический анализ характеризует изменчивость наименее варьирующих признаков, но максимально различающих выборки друг от друга, в данном случае имеется возможность оценить стабильность протекания морфогенеза на примере изменчивости формы нижней челюсти в морфопространстве для каждой из сравниваемых групп зверьков [см. 23, 25].
Таблица 4.
Внутригрупповое морфоразнообразие (morphological disparity) в аллохронных (2003–2004 гг.) выборках рыжей полевки в двух характерных биотопах на территории Висимского заповедника – ветровальной (В) и пирогенной (П) зонах
| Выборка | MNND ± SE | ExpD ± SE | R | Z | p | n |
|---|---|---|---|---|---|---|
| Зона ветровала | ||||||
| В2003 | 0.782 ± 0.205 | 0.478 ± 0.015 | 1.63 | 3.51 | 0.0005 | 11 |
| В2004 | 0.454 ± 0.052 | 0.336 ± 0.006 | 1.35 | 2.38 | 0.0174 | 16 |
| Пирогенная зона | ||||||
| П2003 | 0.347 ± 0.048 | 0.303 ± 0.002 | 1.15 | 1.45 | 0.1461 | 33 |
| П2004 | 0.616 ± 0.218 | 0.483 ± 0.016 | 1.28 | 1.45 | 0.1474 | 10 |
Судя по данным табл. 4, показатель MNND, характеризующий морфоразнообразие локальных группировок рыжей полевки по форме мандибулы, у зверьков в зоне ветровала значимо выше (t = 2.1), чем в этом же году на гари. Величина R-отношения для выборок из зоны ветровала в оба смежных года значимо выше 1.0 (см. табл. 4), что указывает на сверхрассеивание (overdispersion) ординат в морфопространстве. Напротив, в выборках на гари в оба смежных года величина R-отношения статистически не отличается от 1.0 (см. табл. 4), т.е. формально соответствует случайному пуассоновскому распределению. Таким образом, развитие на гари осуществляется случайно в пределах нормы в отличие от зоны ветровала, где, вероятно, полевки в онтогенезе испытывали стресс.
ОБСУЖДЕНИЕ
Относительно сухое лето 2003 г. и дождливое лето 2004 г. (см. рис. 2) в Висимском заповеднике обусловили различия в эти годы в сезонной динамике растительного покрова. Соответственно эти обстоятельства должны были проявиться и в динамике численности вида в сравниваемые годы: если в 2003 г. популяция в целом была на пике численности, то в 2004 г. наметился некоторый ее спад [37]. В 2003 г. пик численности вида наблюдался на Среднем Урале и в соседней сылвинской популяции из окрестностей д. Шигаево вблизи пос. Сылва [14].
Ранее нами было показано [14], что половые различия у сеголеток рыжей полевки на Среднем Урале почти не выражены в благоприятные годы при высокой численности вида и поливидовом составе сообщества грызунов, но усиливаются в неблагоприятные годы при низкой численности и олиговидовом составе сообщества, т.е. при численном доминировании вида в сообществе. Отсутствие половых различий по CS нижней челюсти обнаружено нами в том же 2003 г. [14] в соседней, удаленной на 70 км к юго-западу сылвинской популяции вида при относительно высокой численности. Поэтому отсутствие у сеголеток выраженных половых различий в висимской популяции рыжей полевки не является особым случаем и косвенно указывает на относительно благоприятные условия развития вида в сравниваемые годы.
При расчете линейной регрессии первой главной компоненты (PC1), вычисленной по прокрустовым координатам, по отношению к логарифмам значений центроидных размеров (CS) между этими переменными не была выявлена значимая зависимость для выборки из зоны ветровала (доля предсказанной изменчивости 5.48% при p = 0.2250). Однако обнаружена регрессионная зависимость в выборках пирогенной зоны (доля предсказанной изменчивости 45.62% при p < 0.0001). Полученные результаты прямо указывают на отсутствие существенного влияния аллометрии на изменчивость формы мандибул в зоне ветровала, но наличие такового в пирогенной зоне. Возможно, этот аллометрический ростовой механизм, влияющий на характерное нелинейное изменение формы нижней челюсти при увеличении ее размеров, связан с повышенной миграцией группы быстро созревающих и растущих сеголеток на участок восстанавливающейся гари. Подобный экологический эффект биотопической фильтрации (habitat filtering) данной группы сеголеток [38] вполне вероятен, но для проверки требует дальнейших исследований.
В предыдущих исследованиях на этом виде, проведенных в сходном биотопе вблизи дер. Шигаево Шалинского района Свердловской области, было установлено [14], что полигоны изменчивости формы нижней челюсти практически не перекрываются в морфопространстве при разных уровнях численности, а также при полном и неполном составе сообщества грызунов. Последнее согласуется с полученными для Висимского заповедника данными. И в этом случае полигоны изменчивости настолько разобщены друг от друга в морфопространстве, что можно говорить об отчетливо выраженном модификационном переключении морфогенеза нижней челюсти у полевок сравниваемых ценопопуляций.
В пирогенной зоне у рыжей полевки преобладает грацильный вариант строения нижней челюсти со смещенным кпереди венечным отростком. Выше уже отмечалось, что такой вариант характерен для импактных поселений данного вида, а также для малой лесной мыши в техногенно измененных условиях [5, 11]. Оба рассмотренных выше варианта строения мандибулы ─ и в зоне ветровала, и в пирогенной зоне ─ могут быть интерпретированы как характерные биотопические модификации морфогенеза нижней челюсти рыжей полевки. Другими словами, в локальных поселениях вида в разных биотопах и в годы с разными погодными условиями происходят определенные переключения морфогенеза, реализующие характерные фенотипические черты мандибул.
Поскольку ветровалы и последующие за ними лесные пожары – характерные природные катастрофические явления, относящиеся к естественным неблагоприятным экологическим факторам, с которыми этот лесной вид за время своего существования многократно встречался, то рыжая полевка, по-видимому, способна определенным образом переключать морфогенез на ранних этапах онтогенеза. При этом используется исторически сложившийся пул наследующихся модификаций, которые адекватны возникающим экологическим условиям.
В “Летописи природы Висимского государственного природного биосферного заповедника за 2003 год” отмечено, что в зоне ветровала в этом году наблюдался высокий урожай ели, рябины и шиповника. В то же время на ранних этапах зарастания гари в заповеднике после пожара 1998 г. (1998–2002 гг.) отмечалось увеличение общего покрытия травянистой растительности до 70–80% [39]. В 2003–2004 гг. ее площадь не снижалась, а в составе травостоя в разные годы доминировали иван-чай узколистный (Chamaenerion angustifolium) и вейники тупочешуйный (Calamagrostis obtusata) и Лангсдорфа (Calamagrostis langsdorffii), т.е. на гари в оба года преобладал густой травянистый покров (в основном представленный злаками) и отсутствовал древесный ярус (взрослые деревья). Можно предположить, что отмеченное выше (см. табл. 4) усиление поперечной жевательной активности у зверьков в зоне ветровала в 2004 г. было обусловлено возможностью использования в пищу семян ели и ягод. Напротив, усиление функции продольного жевания на гари может объясняться преобладающим питанием рыжей полевки частями доминирующих здесь травянистых растений (главным образом использования в пищу злаков). Плотный травянистый покров за счет двух видов вейников – тупочешуйного и Лангсдорфа – и отсутствие развитого древостоя в эти годы привели к высокой обеспеченности рыжей полевки убежищами и защитными ремизами на сравнительно открытой безлесной территории пирогенной зоны. Возможно, именно это дополнительное обстоятельство способствовало повышению относительной численности вида на данном участке, выполняя функцию положительного экологического фильтра (ecological filtering) [38] и усиливая иммиграцию активно растущих и созревающих сеголеток в этот биотоп при расселении из сопредельных территорий.
В зоне ветровала в оба смежных года, судя по величине показателя MNND (см. табл. 4), значимо проявляется нестабильность развития, а на гари морфогенез нижней челюсти протекает относительно стабильно (распределение ординат носит случайный пуассоновский характер, величина MNND низка, а межгодовые различия незначимы). Из этого также можно заключить, что на восстанавливающейся гари с плотным травянистым покрытием экологические условия оказываются не только привлекательными для расселяющихся сеголеток, но и сравнительно более благоприятными для протекания их морфогенеза, что также косвенно подтверждает эффект экологической фильтрации в данный биотоп расселяющихся сеголеток рыжей полевки.
Ранее А.В. Бадяев с соавт. [16] также обнаружили сходный эффект на примере 4 видов землероек рода Sorex: в измененных вырубкой лесных биотопах существенно возрос уровень флуктуирующей асимметрии (FA) промеров мандибул по сравнению с контрольными незатронутыми участками. Все это указывает на сходные реакции разных представителей мелких млекопитающих на стресс развития, возникающий при трансформации среды обитания.
Выявленные нами быстрые межгодовые изменения морфогенеза, возможно, обусловлены определенными направленными перестройками функционирования популяционной эпигенетической системы [40, 41]. Аналогичные эффекты, связанные с разным проявлением эпигенетической изменчивости в локальных поселениях обыкновенной бурозубки (Sorex araneus) контрастных лесных биотопов Беловежской Пущи (Польша), ранее были обнаружены Я.М. Вуйчиком с соавт. [42]. В частности, показано, что в разных биотопах наблюдается неодинаковый уровень эпигенетической изменчивости, оцененный по комплексу неметрических признаков осевого черепа и нижней челюсти. Выше мы уже упоминали об исследовании В.М. Захарова с cоавт. [17], которые на том же виде по билатеральным неметрическим признакам черепа показали возрастание нестабильности развития (эпигенетической изменчивости) при низкой численности в неблагоприятные годы. Реальность быстрых эпигенетических изменений нижней челюсти линейных мышей, питающихся разными по консистенции кормами, была доказана в ряде экспериментальных работ [27, 43]. Проявления биотопической изменчивости могут быть разными по своему размаху не только у грызунов, но и у насекомоядных млекопитающих. Например, для обыкновенной бурозубки (Sorex araneus) известен случай, когда влияние локальных условий разных высотных поясов гор Урала на развитие животных может быть настолько велико, что размах биотопической изменчивости поселений вида на разных высотах может превышать морфологические различия между представителями разных хромосомных рас, обитающих на равнине [44]. При историческом формировании подобной высотной биотопической изменчивости также могли первоначально проявиться эпигенетические перестройки, позволившие освоить виду новые экстремальные биотопы.
Сказанное выше позволяет предполагать, что стресс-индуцированные эпигенетические механизмы переключения морфогенеза в направлении тех или иных определенных модификаций развития и их возможное дальнейшее трансгенерационное наследование [40, 45, 46] могут способствовать выработке адаптивных изменений морфогенеза в короткие сроки. Поскольку лесные пожары и вырубки леса в отличие от ветровалов достаточно частые явления, в дальнейших исследованиях на серии выборок модельных видов, собранных при соответствующих условиях, можно проверить гипотезу о специфичности морфогенетических реакций на определенные констелляции экологических факторов, возникающие после пожара или сплошной вырубки, опираясь на методы геометрической морфометрии. Дальнейший анализ эпигенетической изменчивости на тех же выборках как по комплексу билатеральных неметрических признаков скелета [11, 42], так и по индивидуальной и групповой выраженности флуктуирующей асимметрии (FA) морфологических структур [2, 15, 17] представляет собой реальный путь для выявления характерных фенотипов, возникающих как ответ на определенный комплекс стрессовых факторов развития. Проведение таких исследований позволит оценить роль эпигенетической изменчивости в формировании определенных модификаций морфогенеза, устойчивых к стрессу и усиливающих выживаемость данных фенотипов, что может влиять на устойчивость и динамику популяции в целом.
ЗАКЛЮЧЕНИЕ
Итоги исследования позволяют сделать следующие выводы. Возникшие в Висимском заповеднике после ветровала и последующего пожара биотопы вполне пригодны для нормального существования рыжей полевки. Установлено, что на морфогенетическую изменчивость нижней челюсти рыжей полевки почти в равной степени влияют как климатогенные (абиотические) факторы, так и экологические особенности вновь возникших биотопов (биотические). Показано, что морфогенез нижней челюсти лабилен и способен переключаться на ранних стадиях развития в ответ на складывающиеся условия обитания. Есть основания предполагать, что в силу обычности таких природных явлений, как лесные ветровалы и пожары, модельный вид с момента своего возникновения накопил пул потенциально доступных модификаций развития (допустимых траекторий морфогенеза), которые адекватны формирующимся естественным экологическим условиям как после природных катастрофических явлений, так и при последующей демутационной сукцессии локальных сообществ.
На основании полученных оценок можно считать, что условия в зоне ветровала в целом менее благоприятны для рыжей полевки по сравнению с восстанавливающейся гарью (пирогенной зоной). При обитании вида в обоих биотопах формируются характерные конфигурации нижней челюсти, во многом связанные с разной морфофункциональной нагрузкой при питании неодинаковым спектром кормов, различным для данных биотопов. Во время относительно сухого лета 2003 г. при пике численности вида в пирогенной зоне биотопические различия в протекании морфогенеза нижней челюсти были велики, но не наблюдалась их морфофункциональная специализация. Возможно, последнее было обусловлено доступностью и обилием корма (урожай ели, рябины, шиповника). В 2004 г. при высоком уровне осадков в весенне-летний период, повлиявшем на вегетацию растений, морфогенетические различия между обитателями разных биотопов уменьшились, однако между ними усилилась морфофункциональная специализация, сопровождающаяся характерными изменениями конфигурации мандибул. Так, в зоне ветровала усилилась способность к функции поперечных давящих жевательных усилий нижней челюсти при питании твердыми кормовыми объектами, зернами и семенами. На гари усилилась функция продольных двигательных усилий мандибул, связанная с продольным разрезанием и жеванием растительного корма, вероятнее всего, питанием зелеными частями травянистых растений.
Таким образом, высокая фенотипическая пластичность, лабильность морфогенеза и исторически запасенный спектр потенциально доступных модификаций развития обеспечивают высокую устойчивость и быструю адаптацию ценопопуляций рыжей полевки к биотопам, сформированным при воздействии природных катастрофических явлений – ветровала и лесного пожара.
В результате исследований на примере модельного вида грызунов выявлена тесная связь между изменением локальных климатогенных и биотопических условий и изменчивостью формы мандибул, а также адаптивными морфофункциональными перестройками постнатального морфогенеза. Все это доказывает перспективность использования экоморфологических подходов в сочетании с методами геометрической морфометрии для получения дополнительных мониторинговых оценок устойчивости, приспособленности и экологического состояния ценопопуляций модельных видов мелких млекопитающих.
Работа выполнена в рамках государственного задания ФГБУН Института экологии растений и животных УрО РАН (№ 122021000091-2). Авторы благодарят Музей ИЭРиЖ РАН за предоставленные коллекционные материалы и сотрудников Висимского государственного природного биосферного заповедника за поддержку в работе.
Список литературы
Захаров В.М. Асимметрия животных (популяционно-феногенетический подход). М.: Наука, 1987. 213 с.
Zakharov V.M. Population phenogenetics: Analysis of developmental stability in natural populations // Acta Zool. Fenn. 1992. V. 191. P. 7–30.
Шадрина Е.Г., Вольперт Я.Л., Данилов В.А., Шадрин Д.Я. Биоиндикация воздействия горнодобывающей промышленности на наземные экосистемы Севера: Морфогенетический подход. Новосибирск: Наука, 2003. 110 с.
Kozlov M.V. Contrasting response of mountain birch to damage by Eriocrania leafminers in polluted and unpolluted habitats // Can. J. Bot. 2005. V. 83. P. 73–79.
Большаков В.Н., Васильев А.Г., Васильева И.А. и др. Техногенная морфологическая изменчивость малой лесной мыши (Sylvaemus uralensis Pall.) на Урале // Экология. 2012. № 6. С. 427–433. [Bol’shakov V.N., Vasil’ev A.G., Vasil’eva I.A. et al. Technogenic morphological variation of the Pygmy Wood Mouse (Sylvaemus uralensis Pall.) in the Urals // Russ. J. of Ecology. 2012. V. 43. № 6. P. 448–453.]
Васильев А.Г., Васильева И.А., Городилова Ю.В., Чибиряк М.В. Сопряженная техногенная морфологическая изменчивость двух симпатрических видов грызунов в зоне влияния Восточно-Уральского радиоактивного следа // Вопросы радиационной безопасности: науч.-практ. журн. / ПО “Маяк”. 2013 (Спец. вып.: 2013 год – год охраны окружающей среды). С. 4–13.
Коротеева Е.В., Веселкин Д.В., Куянцева Н.В., Чащина О.Е. В градиенте влияния выбросов Карабашского медеплавильного комбината изменяется размер, но не флуктуирующая асимметрия листа березы повислой // Докл. РАН. 2015. Т. 460. С. 36–39.
Kozlov M.V., Zverev V. Temperature and herbivory, but not pollution, affect fluctuating asymmetry of mountain birch leaves: Results of 25-year monitoring around the copper nickel smelter in Monchegorsk, northwestern Russia // Science of the Total Environment. 2018. V. 640–641. P. 678–687.
Ефимов В.М., Галактионов Ю.К., Шушпанова Н.Ф. Анализ и прогноз временны́х рядов методом главных компонент. М.: Наука, 1988. 70 с.
Pausas J.G., Verdú M. Fire reduces morphospace occupation in plant communities // Ecology. 2008. V. 89. P. 2181–2186.
Васильев А.Г., Большаков В.Н., Васильева И.А. и др. Оценка эффектов неизбирательной элиминации в сообществе грызунов методами геометрической морфометрии // Экология. 2016. № 4. С. 290–299. [Vasil’ev A.G., Bol’shakov V.N., Vasil’eva I.A. et al. Assessment of nonselective elimination effects in rodent communities by methods of geometric morphometrics // Russ. J. of Ecology. 2016. V. 47. № 4. P. 383–391.]
Bolnick D.I., Svanbäck R., Fordyce J.A. et al. The ecology of individuals: incidence and implications of individual specialization // Amer. Nat. 2003. V. 161. P. 1–28.
Violle C., Enquist B.J., McGill B.J. et al. The return of the variance: intraspecific variability in community ecology // Trends in Ecology and Evolution. 2012. V. 27. № 4. P. 244–252.
Васильев А.Г., Васильева И.А., Городилова Ю.В., Добринский Н.Л. Принцип компенсации Ю.И. Чернова и влияние полноты состава сообщества грызунов на изменчивость популяции рыжей полевки (Clethrionomys glareolus) на Среднем Урале // Экология. 2017. № 2. С. 116–125. [Vasil’ev A.G., Vasil’eva I.A., Gorodilova Yu.V., Dobrinskii N.L. Chernov’s compensation principle and the effect of rodent community completeness on the variability of Bank vole (Clethrionomys glareolus) population in the Middle Urals // Russ. J. of Ecology. 2017. V. 48. № 2. P. 161–169.]
Badyaev A.V., Foresman K.R., Fernandes M.V. Stress and developmental stability: vegetation removal causes increased fluctuating asymmetry in shrews // Ecology. 2000. V. 81. P. 336–345.
Badyaev A.V., Foresman K.R., Young R.L. Evolution of morphological integration: developmental accommodation of stress-induced variation // Amer. Nat. 2005. V. 166. № 3. P. 382–395.
Zakharov V.M., Pankakoski E., Sheftel B.I. et al. Developmental stability and population dynamics in the common shrew, Sorex araneus // Amer. Nat. 1991. V. 138. P. 797–810.
Badyaev A.V., Foresman K.R. Extreme environmental change and evolution: stress-induced morphological variation is strongly concordant with patterns of evolutionary divergence in shrew mandibles // Proc. of the Royal Soc. of London B. 2000. V. 267. P. 371–377.
Rohlf F.J., Slice D. Extension of the Procrustes method for the optimal superimposition of landmarks // Syst. Zoology. 1990. V. 39. № 1. P. 40–59.
Павлинов И.Я., Микешина Н.Г. Принципы и методы геометрической морфометрии // Журн. общ. биол. 2002. Т. 63. № 6. С. 473–493.
Zelditch M.L., Swiderski D.L., Sheets H.D., Fink W.L. Geometric morphometrics for biologists: a primer. New York–London: Elsevier Acad. Press., 2004. 443 p.
Klingenberg C.P. MorphoJ: an integrated software package for geometric morphometrics // Mol. Ecol. Resour. 2011. V. 11. P. 353–357.
Васильев А.Г., Васильева И.А., Шкурихин А.О. Геометрическая морфометрия: от теории к практике. М.: Тов-во научн. изд. КМК, 2018. 471 с.
Zelditch M.L., Mezey J., Sheets H.D. et al. Developmental regulation of skull morphology II: ontogenetic dynamics of covariance // Evolution and Development. 2006. V. 8. № 1. P. 46–60.
Sheets H.D., Zelditch M.L. Studying ontogenetic trajectories using resampling methods and landmark data // Hystrix, the Italian J. of Mammalogy. 2013. V. 24. № 1. P. 67–73.
Воронцов Н.Н. Низшие хомякообразные (Cricetidae) мировой фауны. Ч. I. Морфология и экология // Фауна СССР. Млекопитающие. Т. III. Л.: Наука, 1982. 451 с.
Anderson P.S.L., Renaud S., Rayfield E.J. Adaptive plasticity in the mouse mandible // BMC Evolutionary Biology. 2014. V. 14. № 85. P. 2–9.
Rohlf F.J. TpsUtil, file utility program, version 1.60. Department of Ecology and Evolution, State University of New York at Stony Brook, 2013a (program).
Rohlf F.J. TpsDig2, digitize landmarks and outlines, version 2.17. Department of Ecology and Evolution, State University of New York at Stony Brook, 2013b (program).
Васильев А.Г., Большаков В.Н., Васильева И.А. и др. Соотношение хронографической и географической изменчивости морфофункциональных признаков рыжей полевки (Clethrionomys glareolus Shreb.) на юге ареала // Экология. 2019. № 4. С. 286–296. [Vasil’ev A.G., Bol’shakov V.N., Vasil’eva I.A. et al. The ratio between chronographic and geographic variation in the morphofunctional features of Bank Vole (Clethrionomys glareolus Shreb.) in the south of its range // Russ. J. of Ecology. 2019. V. 50. № 4. P. 361–371.]
Васильев А.Г., Васильева И.А., Городилова Ю.В., Чибиряк М.В. Сопряженная хронографическая изменчивость морфофункциональных признаков в ценопопуляциях двух симпатрических видов грызунов // Экология. 2020. № 4. С. 284–297. [Vasil’ev A.G., Vasil’eva I.A., Gorodilova Yu.V., Chibiryak M.V. Coupled chronographic variation of morphofunctional traits in cenopopulations of two sympatric rodent species // Russ. J. of Ecology. 2020. V. 51. № 4. P. 363–375.]
Fruciano C. Measurement error in geometric morphometrics // Develop. Genes and Evol. 2016. V. 3. P. 139–158.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological Statistics Software Package for Education and Data Analysis // Palaeontologia Electronica. 2001. V. 4. № 1. P. 1–9.
Дэвис Д.С. Статистический анализ данных в геологии. М.: Недра, 1990. Кн. 2. 427 с.
Hammer Ø. New methods for the statistical analysis of point alignments // Computers and Geosciences. 2009. V. 35. P. 659–666.
Donnelly K.P. Simulations to determine the variance and edge effect of total nearest neighbor distance // Simulation studies to archeology / Ed. Hodder I. Cambridge: Cambridge Univ. Press., 1978. P. 91–95.
Лукьянова Л.Е. Мелкие млекопитающие в экологически дестабилизированной среде: последствия локальных природных катастроф: Автореф. дис. … докт. биол. наук. Екатеринбург, 2013. 42 с.
Mayfield M.M., Boni M.F., Ackerly D.D. Traits, habitats, and clades: Identifying traits of potential importance to environmental filtering // Amer. Nat. 2009. V. 174. P. E1–E22.
Сибгатуллин Р.З. Начальные этапы пирогенной сукцессии растительности в Висимском заповеднике // Современное состояние и перспективы развития ООПТ Урала: Мат-лы науч.-практ. конф. Екатеринбург, 2011. С. 250–253.
Jablonka E., Raz G. Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution // Qvart. Rev. Biol. 2009. V. 84. P. 131–176.
Duncan E.J., Gluckman P.D., Dearden P.K. Epigenetics, plasticity and evolution: How do we link epigenetic change to phenotype? // J. Exp. Zool. Part B. Molec. and Develop. Evol. 2014. V. 322. P. 208–220.
Wójcik J.M., Polly P.D., Wójcik A.M., Sikorski M.D. Epigenetic variation of the common shrew, Sorex araneus in different habitats // Russ. J. Theriol. 2007. V. 6. №. 1. P. 43–49.
Renaud S., Auffray J.-C., de la Porte S. Epigenetic effects on the mouse mandible: common features and discrepancies in remodeling due to muscular dystrophy and response to food consistency // BMC Evolutionary Biology. 2010. V.10. № 28. P. 2–13. http://www. biomedcentral.com/1471-2148/10/28
Shchipanov N.A., Bobretsov A.V., Kuprianova I.F., Pavlova S.V. Interracial and population variability of phenotypic (cranial) characters in the common shrew Sorex araneus L., 1758 // Russ. J. of Genet. 2011. V. 47. № 1. P. 66–75.
Boskovic A., Rando O.J. Transgenerational epigenetic inheritance // Annual Rev. Genet. 2018. V. 52. P. 21–41.
Donelan S.C., Hellmann J.K., Bell A.M. et al. Transgenerational plasticity in human-altered environments // Trends in Ecology and Evolution. 2020. V. 35. № 2. P. 115–124.
Дополнительные материалы отсутствуют.


