Экология, 2023, № 3, стр. 188-203
Филогеография видов дуба в Крыму выявляет плейстоценовые рефугиумы и пути миграций
С. А. Семерикова a, *, С. М. Подергина a, А. Н. Ташев b, В. Л. Семериков a
a Институт экологии растений и животных УрO РAH
620144 Екатеринбург, ул. 8 Марта, 202, Россия
b Лесотехнический университет
1797 София, бульвар Климент Охридски, 10, Болгария
* E-mail: s.a.semerikova@ipae.uran.ru
Поступила в редакцию 09.09.2022
После доработки 06.01.2023
Принята к публикации 15.01.2023
- EDN: ECEIHY
- DOI: 10.31857/S0367059723030058
Аннотация
Изменчивость хлоропластной ДНК была изучена у 872 деревьев дуба черешчатого (Quercus robur L.), дуба скального (Q. petraea (Matt.) Liebl.) и дуба пушистого (Q. pubescens Willd.) на Крымском полуострове, на Западном Кавказе и в Балканском регионе с целью исследования филогеографии и взаимодействия данных видов в Причерноморье. Секвенированием пяти фрагментов общей длиной более 10 000 пар нуклеотидов выявлено 12 гаплотипов хлоропластной ДНК. Для типирования гаплотипов в изученных выборках использовали хлоропластные микросателлиты (cpSSR), секвенирование и рестрикционный анализ. Установлена принадлежность гаплотипов к нескольким дивергентным филогенетическим линиям. Изученные виды слабо различаются между собой по составу гаплотипов при выраженной географической структуре изменчивости, что демонстрирует некоторый уровень генетического потока между ними в смешанных популяциях. Гаплотипы Балканского региона близкородственны гаплотипам изученных ранее популяций из Восточной Европы и западной части Русской равнины и не встречаются в Крыму и на Кавказе. На Крымском п-ове выделяются две географические группы популяций, резко различающиеся по составу гаплотипов. Показано отличие западной и центральной частей полуострова от восточной, что предполагает различное происхождение популяций дуба в Крыму в результате миграций из двух источников, чему могли содействовать периодические понижения уровня Черного моря и его опреснение, неоднократно случавшиеся в плейстоцене и голоцене. Преобладание двух дивергентных гаплотипов в западной части полуострова, сходных с гаплотипами Малой Азии, свидетельствует о проникновении дуба в Крым из этого региона и наличии в горных лесных районах Крыма изолированного рефугиума во время последнего ледникового максимума. При этом на востоке горно-лесной части Восточного Крыма у дуба распространены гаплотипы, общие с Западным Кавказом. Резкая граница между областями распространения “западных” и “восточных” гаплотипов в Восточном Крыму свидетельствует об относительно недавнем времени формирования зоны вторичного контакта между местными и кавказскими популяциями дуба в результате послеледниковой колонизации.
Южные окраинные популяции деревьев европейских умеренных и бореальных лесов благодаря возможной адаптации к жарким и засушливым условиям являются источником генетической изменчивости, потенциально важной для выживания при глобальных климатических изменениях. Для исследования геномных основ климатических адаптаций необходима информация о биогеографии вида: происхождении популяций, их дифференциации, миграциях и вторичных гибридных контактах. Лесная область Причерноморья является уникальным анклавом европейских лесов, содержащим большую долю биологического и генетического разнообразия [1–7]. Однако в большинстве исследований филогеографии европейских древесных растений (например, [8, 9]) юго-восточным областям, включая этот регион, было уделено недостаточное внимание. На основании генетических и палеоботанических исследований видов дуба в Европе были выделены три основных рефугиума, расположенные на полуостровах Средиземноморья [8, 9], а в последнее время выявлены дополнительные, расположенные севернее и восточнее [10, 11]. Однако роль Причерноморского региона в качестве месторасположения рефугиумов, их взаимодействие и возможный вклад в генетическое разнообразие и дифференциацию современных европейских популяций изучены недостаточно.
Крымский полуостров, являясь частью Причерноморского региона, находится на границе циркумбореальной и средиземноморской флористических областей [2, 12] и на перекрестке древних миграционных путей флор соседних регионов [1, 2, 13]. Лесные сообщества в Крыму распространены в горных и предгорных областях [14, 15]. Крымские горы протянулись на 180 км вдоль юго-восточного побережья тремя параллельными хребтами (грядами). Ближняя к морю Главная гряда Крымских гор (высота до 1500 м) задерживает большое количество осадков и защищает южные склоны от холода, формируя особое сочетание климатических условий как на южном, так и на северном макросклонах. Современная растительность Горного Крыма сформировалась в древности и имеет широкие биогеографические связи [1, 2, 15]. Флора Горного Крыма наиболее сходна с флорой северной части Западного Закавказья, что подтверждает правомерность выделения Крымско-Новороссийской флористической провинции [1, 12]. В меньшей степени представлен крымско-балканский и крымско-малоазиатский элементы флоры [1, 13]. Важную часть флоры Крыма составляет голарктический географический элемент [1], и крымские леса в разные эпохи могли иметь флористическую связь с лесами более северных регионов. Структура лесной растительности достаточно сложная, однако преобладающей во всех районах Горного Крыма лесной породой является дуб, занимающий 2/3 всей лесной площади [14, 15].
В Крыму произрастают три вида робуроидных дубов (секция Quercus, Roburoids [16]): дуб скальный Q. petraea (Matt.) Liebl., дуб пушистый Q. pubescens Willd. и дуб черешчатый Q. robur L. [1, 2, 14, 15, 17]. Эти виды широко распространены в Европе, включая все Причерноморские регионы. Их ареалы во многом перекрываются, однако виды различаются экологическими требованиями и репродуктивной стратегией. Отмечается наличие генетического потока между тремя видами [16, 18]. Их взаимному генетическому влиянию посвящен ряд работ (см. [11, 16] и ссылки в этих работах), в которых показано, что степень и направление интрогрессии могут варьировать не только между таксонами, но и в зависимости от региона, что может быть вызвано локальными факторами окружающей среды и разной историей популяции [11, 18, 19]. В Крыму три вида часто сосуществуют в смешанных популяциях [15] и также неизбежно испытывают взаимное генетическое влияние. Очевидно, что исследования генетического разнообразия, филогеографии и микроэволюции возможны лишь при рассмотрении данных видов в комплексе.
Большое значение в распространении видов дуба в Крыму имеют температурный режим, условия увлажнения и особенности горных пород [15]. Преобладающей лесообразующей породой является дуб скальный (Q. petraea), который встречается почти повсеместно в горно-лесной области. Дуб пушистый (Q. pubescens) произрастает главным образом на известковых субстратах и в более засушливых местообитаниях. Менее распространен в Крыму дуб черешчатый (Q. robur) – им занято только около 1% площадей дубовых лесов [15]. На южном макросклоне Q. robur отсутствует, где, вероятно, он не выдерживает конкуренции с сидячецветными дубами (Q. petraea/Q. pubescens). На северном макросклоне Q. robur произрастает на высотах до 600 м, в долинах рек, на пологих склонах и депрессиях рельефа с более богатыми почвами.
Хотя рельеф Крыма не имеет ледниковых проявлений, плейстоценовые ледниковые циклы оказывали значительное воздействие на лесную биоту [6, 20–23]. Анализ современной и палеофауны показывает, что непрерывная лесная зона не сохранялась на протяжении всего плейстоцена [22–24]. Степень распространения и постоянство широколиственных лесов в максимумы стадиалов не известны, в последний ледниковый максимум преобладала степная растительность с небольшими лесными элементами [20]. Помимо влияния на размер популяций, ледниковые циклы плейстоцена были источником периодических трансгрессий, регрессий и опреснений вод Черного моря, что открывало и закрывало сухопутные и морские миграции лесных видов между Крымом и соседними регионами [25]. Это повлияло на генетическую структуру благородного оленя, некоторых видов пресмыкающихся, амфибий и др. [3, 7, 26]. Молекулярные исследования палеоостатков благородного оленя (Cervus elaphus) предполагают процесс исчезновения локальных популяций в холодные фазы и неоднократные волны колонизаций Крыма из разных направлений [26]. Исследования с помощью молекулярных маркеров видов тиса, бука, сосны [27–29] выявили влияние Балкан, Кавказа, Малой Азии на генетический пул популяций в Крыму, что также указывает на миграции между Крымом и этими регионами.
В филогеографических исследованиях видов дуба широко используются маркеры хлоропластной ДНК (хпДНК), имеющей у покрытосеменных растений материнское наследование, что позволяет, анализируя географическое распределение генетических линий, изучать прошлые процессы расселения вида, происходившие посредством распространения семян (желудей). Широкомасштабное филогеографическое исследование видов европейских робуроидных дубов [8, 9], основанное на PCR-RFLP анализе четырех хлоропластных фрагментов, выявило высокую степень дифференциации и географические “паттерны” хпДНК, отражающие пути послеледниковых колонизаций Европы. В работах R.J. Petit et al. [8, 9] было описано и нанесено на карту в общей сложности 32 RFLP-гаплотипа, объединенных в шесть материнских линий, из которых три (линии “A”, “E”, “F”) были распространены в восточной части ареала, из них линии “E” и “F” – в Крымско-Кавказском регионе. В Крыму было изучено только несколько образцов [9], не решивших вопросы связи Крыма с Кавказом, Малой Азией и Балканами.
В нашей предыдущей работе по исследованию изменчивости маркеров хпДНК в Крымско-Кавказском регионе [30] в анализ было включено 105 образцов из девяти крымских выборок трех видов Quercus. Предложенные оптимизированные варианты генотипирования предполагали сочетание анализа микросателлитных локусов хлоропластной ДНК (cpSSR), секвенирования и рестриктного анализа (PCR-RFLP). Показано, что анализ cpSSR хорошо маркирует хпДНК изменчивость, так как определенные этим методом гаплотипы совпадают с выявленными методом секвенирования. Кроме того, использование cpSSR-маркеров существенно снижает затраты и трудоемкость генотипирования. В Крыму было выявлено пять хпДНК гаплотипов [30]. Популяции дуба на Крымском п-ве по хлоропластным маркерам были дифференцированы как от основного ареала дубов, его северной части, так и от Кавказа. Сравнительный анализ наших данных [30] с данными авторов из Турции [5] показал, что происхождение нескольких гаплотипов было связано с Малой Азией. В популяциях восточной части полуострова обнаружен западно-кавказский гаплотип (Z-I), что свидетельствует об исторических контактах популяций дуба из восточного Крыма с Западным Кавказом.
Целью настоящей работы является исследование филогеографии и структуры генетической изменчивости трех видов Quercus в Крыму. Для детального понимания географического распределения гаплотипов внутри лесной зоны Крыма, а также для установления соотношений частот гаплотипов у разных видов мы существенно увеличили число выборок с охватом большей части ареала трех видов дуба в Крыму. Для прояснения возможной связи с прилегающими территориями юго-восточной Европы и Кавказа были исследованы популяции Quercus в этих регионах и проведен анализ палеогеографических данных. Использовались разработанные в предыдущей работе [10] маркеры хлоропластной ДНК и оптимизированные варианты генотипирования [30].
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 55 популяционных выборок трех видов Quercus – всего 872 образца из трех географических регионов (табл. 1, рис. 1а). На Крымском п-ве дополнительно к ранее изученным было проанализировано 488 новых образцов из 33 выборок. Всего в Крыму исследовано 593 дерева из 42 популяционных выборок трех видов дуба. У дуба черешчатого (Q. robur) изучено 178 деревьев из 14 популяций, сбор образцов проводился в предгорной области и на северном макросклоне Крымских гор, в лесистых областях Главной и Внутренней гряд, охватывая весь ареал дуба черешчатого на полуострове, начиная с нижнего течения р. Бельбек и Байдарской долины на западе до крайне восточной точки произрастания Q. robur в районе Старого Крыма. У дуба скального (Q. petraea) и дуба пушистого (Q. pubescens) исследовано 415 деревьев из 28 популяций западного и восточного Крыма, материал отбирали как на северном, так и на южном макросклонах: в предгорной области, на хребтах Главной и Внутренней гряд и на южном берегу Крыма, на склонах разных экспозиций со значительным перепадом высот между выборками. В случаях совпадения или непосредственной близости точек сбора разных видов Quercus название у выборок совпадало, различаясь по номеру (см. табл. 1).
Таблица 1.
Характеристика исследованных популяций дуба черешчатого Q. robur (rb), дубов скального Q. petraea (pt) и пушистого Q. pubescens (pb)1
| № выборки |
Популяции | Координаты2 | Высота над ур. м., м |
n | H | Гаплотипы (число особей) |
|
|---|---|---|---|---|---|---|---|
| с. ш. | в. д. | ||||||
| Крым,Q. robur | |||||||
| 1* | р. Бельбек (rb) | 44°40′45″ 44°41′02″ |
33°36′55″ 33°40′05″ | 20 | 13 | 0.1538 | K (12), T (1) |
| 2 | Тыловое (rb) | 44°26′13″ 44°25′15″ |
33°44′42″ 44°45′41″ | 295 | 13 | 0.5128 | K (8), T (5) |
| 3 | Озерное – Павловка (rb) |
44°29′22″ 44°27′04″ |
33°47′40″ 33°48′24″ | 245–290 | 19 | 0.4561 | K (13), T (6) |
| 4 | р. Боса (rb) | 44°27′07″ 44°27′14″ |
33°49′37″ 33°50′42″ | 305–340 | 9 | 0.5000 | K (6), T (3) |
| 5 | р. Марта (rb) | 44°41′56″ 44°42′06″ |
34°00′40″ 34°02′16″ | 290 | 28 | 0.5079 | T (16), K (12) |
| 6* | р. Бодрак (rb) | 44°45′59″ | 34°02′00″ | 280 | 5 | 0.4000 | T (4), K (1) |
| 7* | г. Ак-Кая (rb) | 45°07′01″ 45°06′50″ |
34°35′56″ 34°36′55″ | 142–227 | 15 | 0 | T (15) |
| 8 | р. Биюк-Карасу (rb) | 44°59′09″ | 34°36′36″ | 230 | 8 | 0 | K (8) |
| 9 | Головановка – Красноселовка (rb) | 44°57′47″ 44°55′54″ | 34°37′25″ 34°37′56″ | 310–360 | 14 | 0.1429 | K (13), T (1) |
| 10 | Земляничное (rb) | 44°57′45″ | 34°49′27″ | 391 | 6 | 0 | Z-I (6) |
| 11 | Пятницкое (rb) | 44°59′45″ 45°00′06″ | 34°52′26″ 34°51′53″ | 283–261 | 6 | 0 | Z-I (6) |
| 12 | Переваловка – Грушевка (rb) |
45°00′14″ 44°58′20″ | 34°58′25″ 34°58′18″ | 280–420 | 23 | 0 | Z-I (23) |
| 13* | г. Агармыш (rb) | 45°00′38″ 45°00′48″ | 35°00′07″ 35°02′30″ | 340–420 | 17 | 0 | Z-I (17) |
| 14 | Старый Крым (rb) | 45°00′38″ | 35°01′48″ | 2 | 0 | Z-I (2) | |
| Среднее | 12.7 | 0.2057 | |||||
| Всего | 178 | ||||||
| Крым,Q. petraea, Q. pubescens | |||||||
| 15 | Аязьма (pb) | 44°27′37″ | 33°38′28″ | 110 | 6 | 0 | К (6) |
| 16 | Тыловое (pt) | 44°26′13″ 44°25′15″ | 33°44′42″ 44°45′41″ | 295 | 11 | 0 | К (11) |
| 17 | Боса (pt) | 44°27′23″ 44°26′37″ | 33°50′18″ 33°51′12″ | 300–520 | 28 | 0.0714 | К (27), Е-II (1) |
| 18 | Мангуп (pt) | 44°34′40″ 44°35′11″ | 33°46′20″ 33°48′14″ | 250–335 | 18 | 0 | К (18) |
| 19* | Чуфут-Кале (pt) | 44°44′18″ | 33°55′58″ | 410 | 6 | 0 | K (6) |
| 20 | р. Марта | 44°42′37″ 44°42′07″ | 34°00′27″ 34°01′37″ | 260–420 | 27 | 0.5128 | К (15), Т (12) |
| 21 | Кореизская тропа (pb) | 44°27′23″ 44°26′28″ | 34°04′18″ 34°04′58″ | 275–600 | 26 | 0 | К (26) |
| 22 | Боткинская тропа | 44°30′07″ | 34°06′08″ | 310 | 12 | 0 | К (12) |
| 23 | Никита | 44°30′28″ | 34°14′21″ | 100 | 8 | 0 | К (8) |
| 24 | г. Аю-Даг | 44°33′36″ | 34°20′21″ | 270–500 | 19 | 0 | К (19) |
| 25 | Малый Маяк | 44°37′03″ | 34°21′30″ | 390 | 18 | 0 | К (18) |
| 26 | г. Сераус (pt) | 44°38′38″ 44°39′36″ | 34°22′09″ 34°20′37″ | 395–580 | 21 | 0 | К (19), К`(2) |
| 27* | Изобильное (pt) | 44°42′07″ 44°41′45″ | 34°20′46″ 34°20′13″ | 245 | 9 | 0 | K (9) |
| 28 | Солнечногорск – Рыбачье (pt) | 44°40′58″ 44°45′49″ | 34°30′05″ 34°35′04″ | 120–145 | 14 | 0 | К (14) |
| 29 | Солнечногорск – Рыбачье (pb) | 44°40′58″ 44°45′49″ | 34°30′05″ 34°35′04″ | 70–140 | 16 | 0 | К (16) |
| 30* | р. Биюк-Карасу (pt) | 44°58′49″ | 34°36′33″ | 230 | 11 | 0 | K (11) |
| 31 | Головановка – Красноселовка (pt) | 44°57′47″ 44°55′54″ | 34°37′25″ 34°37′56″ | 310–360 | 11 | 0 | К (11) |
| 32 | Морское | 44°49′50″ | 34°48′05″ | 8 | 0 | Z-I (8) | |
| 33 | Земляничное–Ворон– Веселое | 44°53′30″ 44°54′05″ | 34°49′05″ 34°49′14″ | 260–590 | 25 | 0.5200 | К (13), Z-I (12) |
| 34 | Новый Свет (pb) | 44°49′45″ | 34°54′45″ | 14 | 0 | Z-I (14) | |
| 35 | Топловский монастырь | 44°59′54″ | 34°52′32″ | 370 | 5 | 0 | Z-I (5) |
| 36 | Переваловка – Грушевка (pt) | 45°00′09″ 44°56′42″ | 34°58′28″ 34°57′32″ | 260–430 | 18 | 0 | Z-I (18) |
| 37 | г. Агармыш (pt) | 45°01′10″ 45°00′36″ | 35°01′53″ 35°00′12″ | 350–510 | 23 | 0 | Z-I (23) |
| 38 | ур. Кизилташ (pt) | 44°55′43″ 44°55′35″ | 35°06′44″ 35°01′09″ | 150–360 | 12 | 0 | Z-I (12) |
| 39 | Эчки-Даг (pt) | 44°55′38″ 44°55′55″ | 35°07′49″ 35°08′45″ | 140–270 | 15 | 0.1333 | Z-I (14), E-III (1) |
| 40* | Эчки-Даг (pb) | 44°54′36″ 44°53′21″ | 35°08′40″ 35°07′03″ | 220–270 | 14 | 0.3626 | Z-I (11), E-III (3) |
| 41 | Старый Крым (pt) | 45°01′20″ 44°59′57″ | 35°07′02″ 35°08′33″ | 240–310 | 5 | 0 | Z-I (5) |
| 42* | Старый Крым (pb) | 44°58′56″ 44°59′49″ | 35°09′47″ 35°08′45″ | 130–220 | 15 | 0.1333 | Z-I (14), E-I (1) |
| Среднее | 14.8 | 0.0619 | |||||
| Всего | 415 | ||||||
| Кавказ,Q. robur, Q. petraea, Q. pubescens | |||||||
| 43 | Темрюк (rb) | 45°12′31″ | 37°17′06″ | 0 | 5 | 0 | Z-I (5) |
| 44 | Школьный (rb) | 45°03′14″ | 37°34′33″ | 230 | 20 | 0 | Z-I (20) |
| 45 | Гостагаевская (rb) | 44°58′58″ | 37°30′21″ | 150 | 11 | 0 | Z-I (11) |
| 46 | Семигорский (rb) | 44°53′53″ | 37°36′10″ | 100 | 25 | 0 | Z-I (25) |
| 47 | Крымск (rb) | 44°56′28″ | 38°03′24″ | 20 | 22 | 0 | Z-I (22) |
| 48 | Сукко (pt) | 44°47′37″ | 37°24′56″ | 115 | 28 | 0 | Z-I (28) |
| 49 | Кабардинка (pb) | 44°40′40″ | 37°53′56″ | 90 | 16 | 0 | Z-I (16) |
| Среднее | 18.1 | 0 | |||||
| Всего | 127 | ||||||
| Болгария, Румыния,Q. robur | |||||||
| 50 | София (rb) | 42°38′22″ 42°37′40″ |
23°18′39″ 23°19′37″ |
680–810 | 25 | 0 | S"(25) |
| 51 | р. Искыр (rb) | 43°40′14″ 43°40′02″ | 24°25′58″ 24°25′25″ | 25 | 24 | 0 | S'(23), S"(1) |
| 52 | о. Вардим, р. Дунай (rb) |
43°37′31″ 43°37′22″ | 25°29′10″ 25°28′53″ | 27 | 27 | 0 | S'(27) |
| 53 | р. Ведеа (rb) | 43°48′36″ 43°48′39″ | 25°28′01″ 25°27′47″ | 34 | 25 | 0.2200 | G (22), S'(2), N (1) |
| 54 | Комана (rb) | 44°10′36″ 44°10′39″ | 26°09′22″ 26°09′53″ | 65 | 25 | 0 | N (22), R (3) |
| 55 | р. Тунджа (rb) | 42°25′32″ 42°15′02″ | 26°30′15″ 26°33′48″ | 115 | 26 | 0 | S'(26) |
| Среднее | 25.3 | 0.0037 | |||||
| Всего | 152 | ||||||
Примечание. n – объем выборки; H – несмещенное гаплотипическое разнообразие [36], вычисленное без учета изменчивости микросателлитных повторов; 1 – в выборках, где не проводилось разделение на Q. petraea или Q. pubescens, таксон не указан; 2 – указаны координаты начала и конца маршрута; * – популяционные выборки, исследованные в работе [30].
Рис. 1.
Географическое распределение хлоропластных гаплотипов Quercus robur, Q. petraea, Q. pubescens (а) в Крымском (№ 1–42), Западно-Кавказском (№ 43–49) и Балканском (№ 50–55) регионах: цифрами обозначены номера популяций из табл. 1, где указаны координаты и частоты гаплотипов; в рамке приведены номера выборок (10*,11*, 17*) из работы [30]; цветовые обозначения гаплотипов соответствуют рис. 2; площадь диаграмм пропорциональна размеру выборки; указана северная граница крымско-кавказской части ареала дуба; треугольником маркировано происхождение пластома из базы данных [42]; б – распределение хлоропластных гаплотипов в популяциях дуба черешчатого Quercus robur на Крымском полуострове (сплошной линией обозначена граница ареала); в – распределение хлоропластных гаплотипов в популяциях дуба скального (Q. petraea) и дуба пушистого (Q. pubescens) на Крымском полуострове (прерывистой линией указана северная граница распространения дубов в Крыму); в выборках, где приводилось определение до вида, указан таксон: pt – Q. petraea, pb – Q. pubescens.
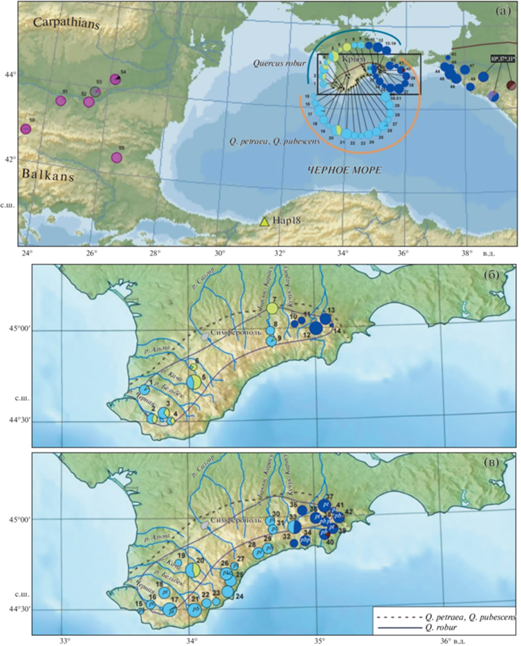
На Западном Кавказе дополнительно к двум имеющимся было проанализировано семь выборок из наиболее близких к Керченскому проливу территорий – из Западного Предкавказья, Западного Кавказа и Северо-Западного Закавказья, всего 127 образцов из пяти популяций Q. robur и двух популяций Q. petraea и Q. pubescens (см. табл. 1, рис. 1а). В Болгарии и на юге Румынии (далее в тексте – Балканский регион) нами исследовано шесть выборок Q. robur, всего 152 образца (см. табл. 1, рис. 1а).
Все выборки собраны в естественных местообитаниях дубов, вдали от населенных пунктов. Расстояние между изученными деревьями составляло не менее 50 м. Большинство выборок отбирали по маршруту протяженностью в несколько километров. В этом случае в таблице указаны координаты начала и конца маршрута, с перепадом высот внутри выборки. Таксономическую принадлежность устанавливали по описаниям, приведенным в работах [19, 31]. Виды идентифицировали по форме листа, характеру опушения, а также по длине плодоножек. Разделение образцов сидячецветных дубов на виды Q. pubescens или Q. petraea проводилось не для всех выборок, так как Q. pubescens отличает наличие густого войлочного опушения на листьях и молодых побегах, а часть выборок собирали весной в безлистном состоянии. При этом принадлежность образцов к Q. robur устанавливали при сборе в любом состоянии, благодаря хорошей сохранности плюсок c плодоножками и листьев с черешками. Выделение геномной ДНК проводилось с помощью метода CTAB [32] из листьев, высушенных в силикагеле, или из свежих листьев, полученных в результате проращивания побегов, собранных в безлистном состоянии.
Для генотипирования был использован анализ изменчивости хлоропластных микросателлитных локусов (cpSSR) [10, 33] в сочетании с секвенированием и рестрикционным анализом. В наших предыдущих работах [10, 30] было установлено соответствие cpSSR-гаплотипов с гаплотипами, выявленными в результате секвенирования хлоропластных фрагментов, чем была подтверждена возможность типирования маркерами cpSSR-гаплотипов дуба в пределах регионов. Как было показано ранее [30], в Крыму почти все выявленные гаплотипы могут быть определены cpSSR-маркерами. Методика исследования изменчивости cpSSR-локусов методом вертикального электрофореза подробно описана в предыдущей работе [10]. Для всех 767 новых образцов Крымско-Кавказского и Балканского регионов был проведен анализ изменчивости четырех cpSSR-локусов (μdt1, μdt3, μdt4, μcd4), установлено сочетание аллелей (cpSSR-гаплотипы) (см. Приложение, табл. S1). Образцы каждого выявленного cpSSR-гаплотипа были секвенированы по пяти хлоропластным фрагментам у разных видов в географически разных популяциях – всего у 48 образцов (рис. 2). Разделение гаплотипов, не отличающихся по cpSSR-маркерам внутри региона (гаплотипы E-I, E-II и E-III), осуществляли секвенированием фрагмента TFq. Подтверждали правильность типирования гаплотипов из разных регионов, кроме секвенирования, анализом RFLP (сочетание фрагмент/рестриктаза см. в Приложении, табл. S1).
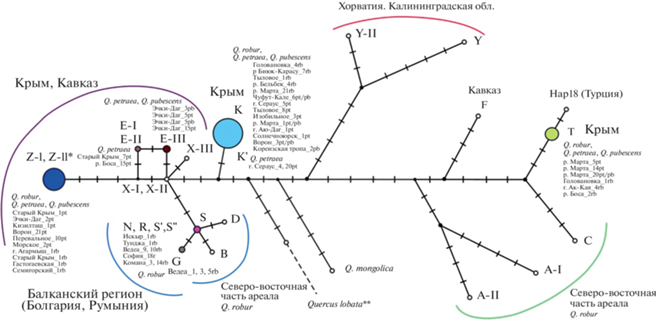
Рис. 2.
Филогенетическая сеть хлоропластных гаплотипов Quercus robur, Q. petraea, Q. pubescens, Q. mongolica и Q. lobata, построенная на основе нуклеотидных последовательностей пяти фрагментов хпДНК с помощью метода “Median Joining ” в программе NETWORK [41]: цветными кругами обозначены гаплотипы, полученные в настоящей работе; указаны виды с перечислением образцов, секвенированных для данного гаплотипа, с названием выборки и указанием номера образца и таксона (rb, pt, pb); площади кругов крымских гаплотипов пропорциональны доле гаплотипов в крымских популяциях Quercus; обозначения гаплотипов из Кавказского и Восточно-Европейского регионов соответствуют принятым в работах [10, 30]; поперечные линии обозначают мутации; * – при построении филогенетической сети не учитывалась инверсия в CDq [30]; ** – при построении филогенетической сети не учитывались мутации, специфичные для внешней группы Q. lobata.
Последовательности гаплотипов были получены для пяти хлоропластных фрагментов – psaA-trnS (ASq), psbC-trnD (CDq), trnT-trnF (TFq), trnK-matK и trnH-psbA, общей длиной ~10 100 пн (пар нуклеотидов). Используемые праймеры, условия амплификации и секвенирования описаны ранее в работах [10, 30]. ПРЦ-продукты очищали с помощью набора ExoSAP-IT (Affimetrix). Реакцию секвенирования проводили с помощью набора BigDye v. 3.1 (Applied Biosystems), продукты реакции анализировали на автоматическом секвенаторе Нанофор 05 (Институт аналитического приборостроения РАН, Россия) в Центре коллективного пользования “Современные технологии для экологических исследований” ИЭРиЖ УрО РАН. Редактирование и выравнивание полученных последовательностей выполняли вручную в программе BioEdit v. 7.2.5 [34].
С помощью пакета программ Arlequin ver 3.5 [35] для каждой популяции оценивали несмещенное гаплотипическое разнообразие (H) [36]. Филогенетические деревья гаплотипов построены с использованием байесовского подхода (BI) в программе MrBayes v. 3.1.2 [37] и метода максимальной экономии (MP) в программном пакете PAUP*4.0b1 [38], параметры и модели BI- и MP-анализов описаны в работе [39]. В анализ включены все точковые мутации, инделы и инверсии, за исключением мутаций числа повторов микросателлитных последовательностей из-за их высокой гомоплазии [40]. Таким образом, близкородственные гаплотипы, которые отличались друг от друга только числом микросателлитных повторов (см. раздел “Результаты”), в филогенетическом анализе рассматривали как один гаплотип. Для изучения взаимоотношений гаплотипов был также использован подход “Median Joining” в программе NETWORK 5.0.1.0 [41]. В этом случае в анализ были включены все точковые мутации и инделы без учета изменчивости микросателлитных повторов, гомоплазмичной инверсии во фрагменте CDq [30] и парсимонически неинформативных мутаций внешней группы.
В филогенетический анализ, кроме гаплотипов из Крымско-Кавказского и Балканского регионов, были включены гаплотипы, ранее полученные из восточной части основного ареала Q. robur [10], и гаплотипы робуроидных дубов из других областей Кавказского региона [30], последовательности которых были помещены в GenBank. В анализе присутствовал гаплотип из Турции “Qpetraea_249.35.12.4” (RFLP-гаплотип Hap18 согласно [9]). Были взяты участки соответствующих фрагментов полной последовательности хлоропластного генома (пластома) из коллекции пластомов европейских робуроидных дубов [42]. В анализ был также включен гаплотип восточно-азиатского робуроидного дуба Q. mongolica Fisch. ex Ledeb. (секция Quercus, Roburoids) (пластом из GenBank, номер MK564083). В качестве внешней группы использован американский вид Q. lobata Nee (пластом из GenBank, CM012305) (секция Quercus, Dumosae), поскольку евроазиатские виды секции Quercus монофилетичны относительно американских видов той же секции по хпДНК [43].
РЕЗУЛЬТАТЫ
Генотипирование cpSSR-маркерами было проведено для 872 деревьев дуба из всех популяций трех регионов. Выявлено пять cpSSR-гаплотипов в Крыму и на Западном Кавказе и пять – в Балканском регионе; сочетание аллелей cpSSR-локусов приведено в табл. S1 Приложения. По совокупности результатов секвенирования пяти фрагментов хпДНК в исследованных популяциях присутствовало 12 хлоропластных гаплотипов, из которых семь (K, K', T, E-I, E-II, E-III, Z-I) встретились в выборках Крыма и Западного Кавказа, пять (S', S", N, R, G) распространены в Болгарии и Румынии. Большинство гаплотипов было описано в наших предыдущих работах [10, 30], буквенные обозначения совпадают с принятыми ранее. Гаплотипы G, N, R встречались в более северных районах Восточной Европы у Q. robur [10]. Новые гаплотипы (K', S', S") были близки описанным ранее и отличались от них одним или несколькими микросателлитными повторами в секвенированных фрагментах и/или cpSSR-локусах. В настоящей работе у таких вариантов к буквенному обозначению родственного гаплотипа добавлялся апостроф. Гаплотипы S', S" из Болгарии и Румынии были близкородственны ранее описанному гаплотипу S, распространенному на западе Русской равнины [10]. В Крыму редкий гаплотип K' отличается от преобладающего гаплотипа K аллелем в cpSSR-локусе μcd4.
Секвенирование фрагментов хпДНК выявило полное соответствие результатам идентификации гаплотипов cpSSR-маркерам внутри двух регионов (Крымско-Кавказского или Балканского). Между регионами некоторые гаплотипы совпадают по сочетанию cpSSR-аллелей (см. Приложение, табл. S1). Результаты RFLP-анализа подтвердили правильность генотипирования и отсутствие общих гаплотипов между Крымско-Кавказским и Балканским регионами. В GenBank помещены последовательности, полученные для новых гаплотипов и новых таксонов Quercus, для фрагментов TFq, CDq и ASq (номера OP971967–OP971999).
По составу гаплотипов в популяциях видов Quercus исследованные регионы делятся на три области (см. рис. 1а): 1) Балканский регион, куда входят выборки Болгарии и южной Румынии; 2) Западный Крым и западная часть Восточного Крыма; 3) восток горно-лесной части Восточного Крыма и Западный Кавказ. В популяциях Q. robur Балканского региона распространено пять гаплотипов (S', S", N, R, G), которые близки или совпадают с гаплотипами запада Русской равнины [10]. При этом в исследованных выборках Крыма и Кавказа гаплотипов северной (основной) части ареала, в т. ч. Балканского региона, не выявлено.
В Крыму в популяциях дуба обнаружено семь гаплотипов. Наиболее частые гаплотипы (K, T, Z-I) присутствуют у всех видов. У Q. robur преобладает гаплотип K (73%), два других гаплотипа – Z-I (30.3%) и T (28.7%) – также встречаются с высокой частотой. У Q. petraea/Q. pubescens преобладающими являются гаплотипы К (62.4%) и Z-I (32.8%), редкими – гаплотипы T (2.9%), E-III (0.96%), E-I (0.24%), E-II (0.24%), К'(0.5%). Для популяций дуба Крыма характерна низкая внутрипопуляционная изменчивость: в выборках не встречается больше двух гаплотипов, в большинстве популяций обнаружен один гаплотип. В крымских популяциях Q. robur был выше показатель гаплотипического разнообразия (среднее H = 0.2057), что связано с присутствием во многих выборках гаплотипов K и T с почти равной частотой.
Внутри Крымского полуострова наблюдается четкая географическая дифференциация популяций по составу гаплотипов, имеющая сходную структуру как у Q. pubescens/Q. petraea, так и в выборках Q. robur. По составу самые восточные популяции трех видов Горного Крыма сходны с Западно-Кавказском регионом, где во всех исследованных выборках разных видов Quercus присутствовал только гаплотип Z-I.
В Западном Крыму во всех популяциях Q. robur наблюдалась смесь гаплотипов K и T при некотором преобладании гаплотипа K. Далее на восток гаплотипы T и K распределялись более неравномерно (см. рис. 1б). В самой восточной области Горного Крыма во всех выборках Q. robur присутствовал только гаплотип Z-I.
В западной и центральной частях полуострова у Q. petraea и Q. pubescens преобладают популяции с гаплотипом К, гаплотип Т обнаружен в единственной выборке (см. рис. 1в). Аналогично распределению гаплотипов в популяциях Q. robur, у Q. petraea и Q. pubescens на востоке горно-лесной области Восточного Крыма, начиная с выборки Морское (№ 32), наблюдается преобладание гаплотипа Z-I. Популяция Ворон (№ 33) является переходной – в ней совместно присутствуют гаплотипы K и Z-I почти в равном соотношении. Гаплотипы группы E (E-I, E-II, E-III) в малом количестве (6 деревьев, 1%) встретились в четырех выборках Q. petraea и Q. pubescens в основном в Восточном Крыму, в области преобладания Z-I. Редкий гаплотип K' обнаружен у Q. petraea в выборке г. Сераус.
Преобладающие в Крыму и на Кавказе гаплотипы не являются близкородственными: крымские гаплотипы Т и К отличаются 14 мутациями, гаплотипы К и Z-I – семью (см.рис. 2). Гаплотип Т почти совпадает с гаплотипом пластома Hap18 из Турции с разницей в одну мутацию, причем крымский гаплотип T на сети гаплотипов является предковым турецкому гаплотипу Hap18.
При построении филогенетических деревьев и сети хлоропластных гаплотипов мы не использовали информацию о числе микросателлитных повторов, поскольку они имеют высокую скорость мутирования, несопоставимую со скоростью обычных точковых мутаций или инделов и соответственно за время образования основных клад накапливают гомоплазии [40]. При этом у неродственных гаплотипов дуба из разных линий, выявленных в настоящем исследовании, часто наблюдается одинаковое число повторов, в том числе в используемых для типирования cpSSR-локусах (см. Приложение, табл. S1). Так как число микросателлитных повторов не учитывалось при филогенетическом анализе, на сети гаплотипов и филогенетическом дереве гаплотипы S, R, N, S', S", а также гаплотипы K и K', E-I и E-II занимают одинаковую позицию (см.рис. 2, 3).
Рис. 3.
Филогенетическое дерево хлоропластных гаплотипов Quercus robur, Q. petraea, Q. pubescens, Q. mongolica и внешней группы Q. lobata, построенное с помощью байесовского метода (50%-ный консенсус) на основе нуклеотидных последовательностей пяти фрагментов хпДНК общей длиной~10 100 пн: над линиями приведена статистическая поддержка байесовским методом (значения апостериорной вероятности, %), под линиями – бутстреп-поддержка (MP, 1000 репликаций); цветными кругами маркированы гаплотипы, полученные в настоящей работе. Обозначения гаплотипов из Кавказского и Восточно-Европейского регионов и филогенетические линии I и II соответствуют принятым в работах [10, 30]; для гаплотипов Q. mongolica и Q. lobata приводятся номера пластомов из GenBank; треугольником обозначен гаплотип пластома из базы данных [42].
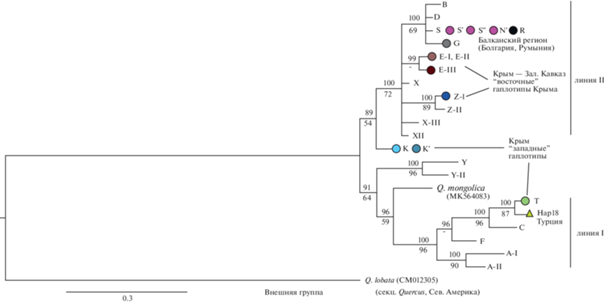
Топология сети гаплотипов была сходной с топологией филогенетического дерева. На рис. 3 представлено байесовское дерево (BI) с указанием значений статистических поддержек клад обоих деревьев. Разрешение дерева в базальной части слабое, гаплотипы исследуемых европейских робуроидных дубов не образуют монофилетичную группу, топология дерева сходна с полученной нами ранее [30]. Некоторая разница в степени разрешения базальной части дерева связана с различием выбранной внешней группы. В нашей предыдущей работе [30] в качестве внешней группы был использован представитель рода Trigonobalanus (Fagaceae), так как анализировались представители дубов разных секций. Пластом Q. lobata ближе к последовательностям робуроидных дубов, что дает более разрешенную картину, в частности более точно определяет положение дуба монгольского. Гаплотип Q. mongolica с невысокой поддержкой (96/59) объединяется с восточной линией (линия I). На сети гаплотипов Q. mongolica занимает промежуточную позицию между основными кладами европейских робуроидных дубов (см. рис. 2).
Обнаруженные в Крыму гаплотипы филогенетически значительно отличаются, наиболее частые (K, T, Z-I) входят в разные клады, соответствующие дивергентным филогенетическим линиям (см. рис. 3). Гаплотип Т относится к кладе гаплотипов линии I (100/96). Данная ветвь соответствует зеленой линии “E” из работы R.J. Petit et al. [8], гаплотипы которой распространены в восточной части ареала европейских робуроидных дубов. Гаплотипы E-I, E-III и Z-I входят в общую субкладу (100/72), состоящую из гаплотипов восточно-европейской части ареала и Кавказа (линия II). Ветвь гаплотипов восточно-европейской части ареала, куда входят гаплотипы из Балканского региона (G, S', S", R, N) (100/69), соответствует синей линии “A” из работы [8]. Крымско-кавказские гаплотипы из этой субклады соответствуют фиолетовой линии “F” из [8], однако они не образуют монофилетичную кладу и, скорее, занимают базальную позицию к линии “A”.
Дивергентный гаплотип K и соответствующую ему филогенетическую линию не удается сопоставить с линиями, определенными в работе R.J. Petit et al. [8]. Гаплотип К находится в базальном положении (89/54) к линии II, на сети гаплотипов ветвь K занимает промежуточную позицию между ветвями линии II и ветвью гаплотипов Y, Y-II из Хорватии и Калининградской обл. (Апеннинская линия “C” согласно [8]).
Анализ состава гаплотипов в выборках сидячецветных дубов, где был определен таксон (Q. petraea или Q. pubescens), показал совпадение между видами по частотам и составу гаплотипов. Несколько отличаются состав и географическое распределение гаплотипов у Q. robur, у которого доля гаплотипа Т (28.7%) значительно больше, чем в популяциях Q. petraea/Q. pubescens (2.9%). Гаплотип Т у Q. robur встретился как в западной, так и в восточной частях полуострова в 8 выборках, что говорит о его более широком распространении в популяциях этого вида. У сидячецветных дубов гаплотип Т был обнаружен в единственной выборке р. Марта (№ 20), где присутствуют гаплотипы K и T в соотношении 56 и 44% соответственно, что почти совпадает с частотами гаплотипов у Q. robur в этой популяции. В отличие от Q. petraea/Q. pubescens у Q. robur не удалось выявить выборки, в которых бы происходило смешение “западных” и “восточных” гаплотипов (K и Z-I). Возможно, это связано с меньшей встречаемостью Q. robur в переходной зоне. Редкие гаплотипы E-I, E-II, E-III, отмеченные в Крыму у Q. petraea и Q. pubescens, не были встречены у Q. robur.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Филогенетические отношения гаплотипов и возможные исторические связи Крыма с другими регионами Причерноморья
Выявленные в исследованных популяциях робуроидных дубов гаплотипы хпДНК относятся к нескольким дивергентным филогенетическим кладам (см. рис. 3). Наиболее вероятно, что дифференциация на глубоко дивергированные линии хлоропластной ДНK возникла в начале эволюции представителей секции Quercus в Евразии после их проникновения в Евразию из Америки в среднем и позднем миоцене [16]. Время расхождения основных линий хпДНК совпадает со временем дифференциации на европейскую и восточно-азиатскую группы робуроидных дубов и соответствует концу миоцена [44]. Таким образом, древность линий наиболее дивергентных гаплотипов исключает наличие связи между их филогенетическими отношениями и взаимным географическим распространением, поскольку происходившие плиоценовые и плейстоценовые вымирания [16] и неоднократные колонизации во многом изменили первичную филогеографическую структуру. Примером может служить смешение гаплотипов разных линий в Малой Азии, на Кавказе и Балканах [5, 30, 45].
В то же время географическое распределение гаплотипов в исследованных регионах демонстрирует три почти не перемешивающиеся области, резко отличающиеся составом гаплотипов: 1) Балканский регион; 2) Западная часть Крыма; 3) Восток Крыма и Западный Кавказ. Гаплотипы Балканского региона близкородственны гаплотипам изученных ранее популяций из Восточной Европы и западной части Русской равнины [10, 45] и соответствуют линии хпДНК, связанной своим распространением c балканским рефугиумом [8, 9]. По результатам настоящего исследования и нашим предыдущим данным [30], а также из проведенного сравнительного анализа данных из Грузии и Турции [4, 5], на Кавказе, в Крыму и Малой Азии гаплотипы этой линии отсутствуют.
Гаплотипы Крыма и Западного Кавказа относятся к трем дивергентным филогенетическим линиям (см. рис. 3). Два неродственных между собой гаплотипа T и K распространены в западной и центральной частях Горного Крыма, их нет в восточной части Горного Крыма, на Кавказе и Балканах, но родственные им гаплотипы совместно присутствуют в Малой Азии. Так, на западе Турции широко распространен гаплотип H5 [5], совпадающий с пластомом Hap18, который отличается одной мутацией от гаплотипа T в Крыму. По тем же данным [5], в Турции и на юго-востоке Балканского п-ва распространены три гаплотипа, близкородственные гаплотипу K. Очевидное родство гаплотипов отражает историческую связь и миграции между Малой Азией и Крымом. Причем намного больший размер популяций и большее гаплотипическое разнообразие Quercus в Малой Азии [5] по сравнению с Крымом позволяет предполагать, что миграции происходили из Малой Азии в Крым. В Крыму почти нет гаплотипов, родственных T и K, в то время как в Малой Азии родственных гаплотипов несколько. Отсутствие близкородственных гаплотипов в Крыму может быть связано как с недостатком времени для накопления мутаций, прошедшего с момента миграции, так и с малым эффективным размером популяции. В современных популяциях Болгарии и Румынии, по результатам настоящего исследования и работ других авторов [9, 45], преобладают гаплотипы балканской линии, следовательно, если миграция малоазиатских гаплотипов в Крым проходила через Балканы, то это могло происходить в другую эпоху, когда состав гаплотипов в этом регионе был иной.
Предполагаемые древние связи с последующей изоляцией популяций дуба в Крыму могли происходить со времен конца плиоцена–начала плейстоцена, с формированием современного глубоководного Черноморского бассейна [25] и началом изолированной эволюции крымской биоты [2]. В регрессивные фазы Черноморского бассейна, происходившие в плейстоцене (~2.6 млн л. н., 1–2 млн л. н., ~80 тыс. л. н., ~30 тыс. л. н., ~10 тыс. л. н.) [25], сопровождавшиеся опреснением и обычно совпадавшие с эпохами похолоданий, неоднократно обнажались значительные площади шельфа, и Крым становился частью материка, что делало возможным обмен биотой как с Балканами, так и Кавказом. Время таких миграций оценить затруднительно при недостатке палеоданных для большей части плейстоцена. В конце плейстоцена, с усилением тенденции на похолодание и повышение уровня моря [25], вероятность миграции по западному пути снижалась. В прибрежных районах Черного моря от Болгарии до Крыма во время последнего оледенения формировались степные сообщества [46], что исключало обмен лесными видами.
Относительно путей древних миграций также есть предположение, что расселение видов происходило не только через сухопутные мосты, но и обходными путями – по типу распространения прибрежных флор, а также посредством дальнего переноса (см. [2]). Данное предположение сходно с миграциями вдоль линии моря. Свидетельства о пересечении водных пространств с помощью птиц и посредством гидрохории у дубов предполагалось ранее в Балтийском бассейне [47, 48], где описаны пути колонизации вдоль морских побережий и через проливы. Предполагаемые расстояния составляли от 80 до 300 км, желуди не теряли всхожесть после нахождения в течение нескольких дней даже в соленой воде (см. [48] и ссылки в этой работе). Гипотеза распространения вдоль черноморского побережья Балканского полуострова очень вероятна и может объяснить сходство гаплотипов робуроидных дубов Крыма и Малой Азии. Наши данные пока не могут окончательно подтвердить эту гипотезу, которая должна быть протестирована сбором материала вдоль линии побережья, возможно, выявив скрытые следы миграций. В частности, проверки требует описанный ранее в дельте Дуная RFPL-гаплотип 9' [45], ассоциированный нами предположительно с гаплотипами групп E и Z [30], обнаруженными в Крыму и на Кавказе.
При исследовании филогеографии сосны обыкновенной (Pinus sylvestris L.) на территории Причерноморья (Крым, Кавказ, Турция, Балканы) было обнаружено совпадение крымского гаплотипа митохондриальной ДНК с гаплотипом из Малой Азии (Турции) и Малого Кавказа и отличие от гаплотипов Большого Кавказа, Балкан и северной части ареала сосны обыкновенной [29]. В качестве объяснения была предположена древняя миграция из Малой Азии в Крым через Кавказ, с последующим распространением на Северном Кавказе производного гаплотипа и вытеснением предкового [29]. Однако возможно и альтернативное объяснение – дальний перенос семян сосны из Малой Азии в Крым по морю во время его опреснения. Родство гаплотипов Турции и Крыма, выявленное для дуба и сосны обыкновенной, их отличие от сопредельных территорий Кавказа и Балкан, очевидно, не являются случайными и отражают прошлые конфигурации ареалов, прошлые миграции и связи лесной растительности этих регионов при последующей изоляции лесной растительности Крымского полуострова.
Существование рефугиумов Quercus в западной части Горного Крыма
Распространение гаплотипов К и T на большей части горно-лесной области Крыма предполагает сохранение популяций дуба в изолированных рефугиумах, располагавшихся во время плейстоцена в Горном Крыму. По имеющимся палеоданным, объединяющим несколько исследований (см. обзор [22]), пыльца Quercus отмечается в горно-лесном Крыму непрерывно, начиная с плиоцена. В периоды оледенений ареал широколиственных пород значительно сокращался. Быстрое появление пыльцы дуба в областях предгорий в межстадиалы, особенно в западной части полуострова, свидетельствует о наличии рефугиумов в непосредственной близости, предположительно на теплых склонах южной экспозиции долин, пересекающих достаточно увлажненный северный макросклон Главной гряды Крымских гор [22]. По обзорным палеоматериалам, начиная с 120 тыс. л. н. [20, 22], если на востоке полуострова лесостепь неоднократно сменялась степью, то на западе такая смена происходила только в последние валдайские стадиалы. В более влажные периоды широколиственная растительность в Западном Крыму восстанавливалась значительно быстрее. Именно на юго-западе Горного Крыма наблюдается зона “микрорефугиумов” мезофильного вида ящериц Lacerta agilis tauridica, выявленная обособлением отдельных митохондриальных линий [6].
Несмотря на богатый палеозоологический материал, долгое время отмечалось отсутствие датированных растительных палеоданных из горных районов Крыма в периоды стадиалов [22], однако в последних исследованиях [21] появились свидетельства присутствия пыльцы дуба (в том числе Q. robur) на склонах высокой части Главной гряды в конце LGM. При наличии несомненных свидетельств непрерывного присутствия дуба на полуострове в плейстоцене сниженное гаплотипическое разнообразие и почти полное отсутствие гаплотипов, близкородственных K и T, подтверждают значительные сокращения размеров популяций. Можно предположить, что в неблагоприятные эпохи ареал дуба с “западнокрымскими” гаплотипами T и K был сильно фрагментирован и ограничен небольшими рефугиумами, располагавшимися в западной и центральной частях современной горно-лесной зоны. Один из рефугиумов угадывается в предгорной части северного макросклона (р. Марта), где совпадение состава гаплотипов выборок разных видов свидетельствует о длительном совместном произрастании Q. robur и Q. petraea в районе обширных дубовых лесов на северном макросклоне наиболее высокой части Крымских гор. Отмечается [7], что распространение центральной линии ящериц Darevskia lindholmi также приурочено к самой высокой и влажной части Главной гряды, а также к самой влажной лесистой части Южного берега Крыма. Согласно ботанико-географическому и флористическому районированию, эти территории относятся к Бахчисарайско-Ялтинскому району [1] и Ялтинскому флористическому округу [2], которые характеризуются наибольшими высотами в Крыму, вследствие чего здесь наблюдается наибольшая дифференциация климата и других факторов.
Особенности популяций дуба Восточного Крыма и их связь с Западным Кавказом
Распространение в лесах восточной части Крыма исключительно кавказских гаплотипов Z-I, E-I и E-III доказывает кавказское происхождение дуба на востоке полуострова, что в свою очередь предполагает отсутствие здесь рефугиумов – источников послеледниковой реколонизации. Исходя из обзора палеоданных [22], разница в растительности между западными и восточными областями на протяжении всего плейстоцена была существенной: восточные районы Крыма были более засушливыми, чем центральные и западные, и лесная растительность там исчезала неоднократно, сменяясь сухой степью. Значительное уменьшение атмосферного увлажнения в восточном направлении также проявляется в современном распределении температуры и осадков [1]. Для сравнительно низких гор восточной части Восточного Крыма, с менее выраженной поясностью и отсутствием четкого разделения на макросклоны, снижается возможность формирования микрорефугиумов.
Достаточно резкая граница между областями распространения хлоропластных гаплотипов дуба в Крыму может свидетельствовать об относительно недавнем времени формирования зоны вторичного контакта между местными и кавказскими популяциями дуба. Единственная выборка (№ 33) со смешанными гаплотипами обнаружена в очень локальном районе, к востоку от р. Кучук-Карасу. К западу и востоку от указанного района у всех видов дуба найдены “западные” (T и K) или “восточные” (Z-I, группа E) гаплотипы соответственно. Ни одного из “восточных” гаплотипов (за исключением одной особи с E-II) не было найдено к западу от выборок Ворон, Земляничное и Морское. В районе зоны контакта отсутствуют географические барьеры – сравнительно невысокие горные хребты и перевалы не могли стать препятствием на пути расселения или обмена. Наблюдаемая структура может быть результатом “конкурентной” колонизации при миграции из разных источников. Расселение из западно-крымского рефугиума популяций с “западными” гаплотипами K и T достигло основных рек на востоке, берущих начало с Главной гряды Крымских гор (реки Биюк-Карасу и Индол). Вполне вероятно, что дальнейшая колонизация на восток автохтонных популяций из западно-центральных районов Горного Крыма была остановлена встречным потоком, несущим “восточные” гаплотипы. Распределение двух групп гаплотипов маркирует зону встречи. Узость этой зоны может свидетельствовать об относительно недавней колонизации, по-видимому после LGM. Очевидно, что источником волны колонизации, несущей гаплотипы Z-I, E-I и E-II, мог быть только Кавказ, где они распространены на более обширной территории, чем в Крыму, и имеют там филогенетически родственные гаплотипы [30]. Менее вероятна локализация рефугиума в невысоких горах Восточного Крыма, так как граница между группами гаплотипов при наличии нескольких рефугиумов была бы менее четкой.
Формирование и долговременная устойчивость контактных зон матерински наследуемых гаплотипов ранее обсуждались для видов Quercus в Скандинавии [47], для северо-восточной части ареала Q. robur [10] и у пихты белой Abies alba в Карпатах [49]. Описанная в данных работах резкая граница в зоне контакта свидетельствует о встрече фронтов колонизации, когда выживание вновь прибывших семян очень маловероятно в уже существующих популяциях. Нераспространение далее матерински наследуемых гаплотипов свидетельствует о наличии местного пула желудей, который эффективно подавляет любой поток цитоплазматических генов на уже занятую дубом территорию [47]. Это приводит к сохранению устойчивых зон “цитоплазматической демаркации” в местах начального контакта двух разнонаправленно распространяющихся популяций из рефугиумов, что неоднократно имело место в истории европейских дубов.
Зона встречи гаплотипов разного происхождения у видов Quercus в Крыму совпадает с западной границей распространения митохондриальных гаплотипов кавказского происхождения у прыткой ящерицы, проникших в Крым в ходе голоценовой экспансии восточного подвида Lacerta a. exigua и формировании гибридных популяций с аборигенным горно-крымским подвидом L. a. tauridica. Распространение в Крым мезофильной западно-кавказской биоты, возможно, произошло на рубеже плейстоцена и голоцена, когда Азовского моря не существовало, либо в теплые и влажные периоды начала голоцена, отмечаемые как в Крыму [21, 22], так и на прилегающей к Крыму территории Прикубанья и Таманского полуострова [50].
Согласно геоботаническому районированию Горного Крыма, область “восточных” гаплотипов дуба совпадает с границей Судакско-Феодосийского р-на, который включает территорию к востоку от р. Кучук-Карасу [1] и соответствует восточно-горно-крымскому флористическому району [2]. Эта наиболее восточная в Горном Крыму территория характеризуется более холодным и сухим полуконтинентальным климатом, со снижением роли средиземноморских видов при возрастании роли степной биоты. Флористические особенности района заключаются в наличии целого ряда дифференцирующих видов [1]. По данным изменчивости хпДНК дуба, именно в этом районе проявляется связь лесной биоты Крыма с Кавказом. Исследования структуры генетической изменчивости и филогеографии других видов деревьев (тис, бук) в Причерноморье, включая Крым, демонстрируют смешение в Крыму генетических линий разного географического происхождения [27, 28], однако в настоящей работе впервые показана дифференциация популяций древесных видов в пределах Крыма, обусловленная его колонизацией из разных источников. Для подтверждения гипотезы о роли лесной биоты Западного Кавказа в колонизации восточной части лесной зоны Крыма необходимы дальнейшие исследования с привлечением других древесных видов.
Сравнение структуры изменчивости хпДНК видов Quercus в Крыму
Установлено значительное совпадение по составу гаплотипов популяций трех видов Quercus в Крыму. Полиморфизм хпДНК дубов в Крыму слабо связан с таксономический принадлежностью и в основном структурирован географически: у всех трех видов совпадают наиболее частые гаплотипы, для всех из них наблюдаются различия западных и восточных популяций. Однако соотношение гаплотипов у Q. robur отличается от состава гаплотипов в популяциях Q. petraea и Q. pubescens. Основное различие заключается в частоте встречаемости гаплотипа T (см. рис. 1б, 1в), присутствие которого у сидячецветных дубов наблюдалось только в выборке р. Марта (№ 20), где Q. petraea образует смешанную популяцию с Q. robur. Интересно, что в других смешанных популяциях, где у дуба черешчатого присутствует гаплотип T, у видов Q. petraea/Q. pubescens он не встретился ни разу. Поэтому можно заключить, что, во-первых, первоначально гаплотип T в Крыму появился у Q. robur и, во-вторых, гибридизация Q. robur с другими дубами – достаточно редкое явление. Выраженное различие в соотношении гаплотипов на крайнем юго-западе, в популяциях Байдарской долины (см. рис. 1б, 1в), может свидетельствовать о недавнем проникновении современных популяций дуба в долину Западного Крыма из горных рефугиумов. При ограниченном текущем потоке в популяциях [18] обмен материнских генов происходит достаточно продолжительное время, что объясняет неравенство в соотношении гаплотипов.
Для видов Q. petraea и Q. pubescens не обнаружено различий в соотношении гаплотипов. Ожидаемо, что у этих наиболее распространенных в Крыму видов выявлено несколько большее число гаплотипов. Редкие гаплотипы кавказского происхождения (E-I, E-II, E-III) найдены здесь как у Q. petraea, так и у Q. pubescens как примесь к гаплотипам Z-I, но не встречены в крымских популяциях Q. robur. Однако они широко распространены у дубов, в том числе у Q. robur, на Кавказе [30]. Возможной причиной является отсутствие Q. robur на южном макросклоне, где в основном был найден гаплотип E. Характерно, что гаплотипы группы E обнаружены в основном в восточных районах Крыма, однако отсутствуют в наиболее близких к Крыму популяциях Кавказа (см. рис. 1а). Гаплотипы группы E на Кавказе начинают встречаться и преобладать в более удаленных от Крыма областях как вдоль побережья, так и на северном макросклоне, а также в Закавказье, что было показано в предыдущей работе [30]. В связи с этим наиболее правдоподобным объяснением появления гаплотипов группы E в Крыму могут быть множественные миграции как по сухопутному мосту через Таманский п-ов, так и по морю со стороны кавказского побережья из районов распространения гаплотипа E. Последнее обстоятельство также объясняет отсутствие Q. robur среди крымских носителей гаплотипа E.
Близкий состав гаплотипов трех видов дуба в Крыму говорит о долговременном совместном существовании крымских популяций разных видов. Причиной наблюдаемого различия частот гаплотипов между Q. robur и другими видами может быть разный уровень исторического генного потока между этими близкородственными видами [5, 16, 18]. Во многих работах было показано [16, 18], что степень гибридизации у Q. robur с сидячецветными дубами ниже, чем между Q. petraea и Q. pubescens, что обусловлено более выраженным репродуктивным барьером. Несовпадение частот гаплотипов Q. robur с другими видами на территории Крыма в локальном масштабе подтверждает невысокую степень гибридизации и ограничение текущего генного потока между Q. robur и Q. petraea/Q. pubescens.
Исследование выполнено за счет гранта Российского научного фонда № 22-24-00667, https:// rscf.ru/project/22-24-00667/. Авторы выражают благодарность Л.И. Агафонову, Н.В. Семерикову, Е.Г. Филиппову, В.В. Кукарских, Х.У. Алиеву, Т.В. Семериковой, М.А. Полежаевой, Е.С. Кашириной, В.В. Корженевскому за помощь в сборе образцов дуба и анонимному рецензенту за конструктивные замечания.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объектов людей и животных. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Дидух Я.П. Растительный покров горного Крыма (структура, динамика, эволюция и охрана). Киев: Наукова думка, 1992. 256 с.
Ена А.В. Природная флора Крымского полуострова. Симферополь: Н. Орiанда, 2012. 232 с.
Dufresnes C., Litvinchuk S.N., Leuenberger J. et al. Evolutionary melting pots: a biodiversity hotspot shaped by ring diversifications around the Black Sea in the Eastern tree frog (Hyla orientalis) // Mol. Ecol. 2016. V. 25. P. 4285–4300. https://doi.org/10.1111/mec.13706
Ekhvaia J., Simeone M.C., Silakadze N., Abdaladze O. Morphological diversity and phylogeography of the Georgian durmast oak (Q. petraea subsp iberica) and related Caucasian oak species in Georgia (South Caucasus) // Tree Genet. Genom. 2018. V. 14. № 2. Article number 17. https://doi.org/10.1007/s11295-018-1232-6
Tekpinar A.D., Aktas C., Kansu C. et al. Phylogeography and phylogeny of genus Quercus L. (Fagaceae) in Turkey implied by variations of trnT((UGU))-L-(UAA)-F ((GAA)) chloroplast DNA region // Tree Genet. Genom. 2021. V. 17. № 5. Article number 40. https://doi.org/10.1007/s11295-021-01522-x
Кукушкин О.В., Ермаков О.А., Иванов А.Ю. и др. Филогеография прыткой ящерицы в Крыму по результатам анализа гена цитохрома b: древний рефугиум на полуострове, поздняя экспансия с севера и первые свидетельства гибридизации подвидов Lacerta agilis tauridica и L. a. exigua (Lacertidae: Sauria) // Труды ЗИН РАН. 2020. Т. 324. № 1. С. 56–99. https://doi.org/10.31610/trudyzin/2020.324.1.56
Kukushkin O., Ermakov O., Gherghel I. et al. The mitochondrial phylogeography of the Crimean endemic lizard Darevskia lindholmi (Sauria, Lacertidae): Hidden diversity in an isolated mountain system // Vertebrate Zoology. 2021. V. 71. P. 559–576. https://doi.org/10.3897/vz.71.e62729
Petit R.J., Csaikl U.M., Bordacs S. et al. Chloroplast DNA variation in European white oaks – phylogeography and patterns of diversity based on data from over 2600 populations // Forest Ecol. Management. 2002. V. 156. № 1–3. P. 5–26. https://doi.org/10.1016/S0378-1127(01)00645-4
Petit R.J., Brewer S., Bordacs S. et al. Identification of refugia and postglacial colonisation routes of European white oaks based on chloroplast DNA and fossil pollen evidence // Forest Ecol. Management. 2002. V. 156. P. 49–74. https://doi.org/10.1016/S0378-1127(01)00634-X
Семерикова С.А., Исаков И.Ю., Семериков В.Л. Изменчивость хлоропластной ДНК и филогеография дуба черешчатого Quercus robur L. в восточной части ареала // Генетика. 2021. Т. 57. № 1. С. 56–71. [Semerikova S.A., Isakov I.Yu, Semerikov V.L. Chloroplast DNA variation and phylogeography of pedunculate oak Quercus robur L. in the eastern part of the range // Russ. J. Genet. 2021. V. 57. № 1. P. 47–60. doi:10.1134/S1022795421010130]https://doi.org/10.31857/S0016675821010136
Degen B., Yanbaev Y., Mader M. et al. Impact of gene flow and introgression on the range wide genetic structure of Quercus robur (L.) in Europe // Forests. 2021. V. 12. № 10. Article number 1425. https://doi.org/10.3390/f12101425
Тахтаджян А.Л. Флористические области Земли. Л.: Наука, 1978. 247 с.
Гаркуша Л.Я., Багрова Л.А., Позаченюк Е.А. Разнообразие ландшафтов Крыма со средиземноморскими элементами флоры // Уч. зап. Таврического национального ун-та им. В.И. Вернадского. Серия “География”. 2012. Т. 25 (64). № 2. С.36–47.
Леса СССР. М.: Наука, 1966. Т. 3 (Леса юга европейской части СССР и Закавказья). 463с. (СО АН СССР, Институт леса и древесины).
Плугатарь Ю.В. Леса Крыма. Симферополь: ИТ “Ариал”, 2015. 385 с.
Kremer A., Hipp A.L. Oaks: an evolutionary success story // New Phytologist. 2020. V. 226. № 4. P. 987–1011. https://doi.org/10.1111/nph.16274
Меницкий Ю.Л. Дубы Азии. Л.: Наука,1984. 315 с. [Menitsky Y.L. Oaks of Asia. Science Publishers of Enfield Press, USA, 2005. 549 p.]
Curtu A.L., Gailing O., Finkeldey R. Evidence for hybridization and introgression within a species-rich oak (Quercus spp.) community // BMC Evolutionary Biology. 2007. V. 7. Article number 218. https://doi.org/10.1186/1471-2148-7-218
Семериков Л.Ф. Популяционная структура древесных растений (на примере видов дуба европейской части СССР и Кавказа). М.: Наука, 1986. 140 с.
Gerasimenko N. Environmental changes in the Crimean mountains during the Last Interglacial–Middle Pleniglacial as recorded by pollen and lithopedology // Quat. Int. 2007. V. 164–165. P. 207–220. https://doi.org/10.1016/j.quaint.2006.12.018
Gerasimenko N.P., Bezusko L.G., Avdieienko Y.L., Yanevich A.A. Late Glacial and Holocene vegetational and climate changes and their impact on material cultures in the Crimean Mountains (founded on pollen data from cave deposits) // Quat. Int. 2022. V. 632. № 20. P. 139–153. https://doi.org/10.1016/j.quaint.2021.12.018
Cordova C.E., Gerasimenko N.P., Lehman P.H., Kliukin A.A. Late Pleistocene and Holocene paleoenvironments of Crimea: pollen, soils, geomorphology, and geoarchaeology // Geology and Geoarchaeology of the Black Sea Region: Beyond the Flood Hypothesis / Eds. Buynevich I.V., Yanko-Hombach V., Gilbert A.S., Martin R.E. Book series: Geological Society of America Special Paper. 2011. V. 473. P. 133–164. https://doi.org/10.1130/2011.2473(09)
Markova A.K. Small mammals from Palaeolithic of the Crimea // Quat. Int. 2011. V. 231. № 1–2. P. 22–27. https://doi.org/10.1016/j.quaint.2010.07.016
Cameron R.A.D., Pokryszko B.M., Horsak M. Forest snail faunas from Crimea (Ukraine), an isolated and incomplete Pleistocene refugium // Biological J. Linnean Soc. 2013. V. 109. P. 424–433. https://doi.org/10.1111/bij.12040
Krijgsman W., Tesakov A., Yanina T. et al. Quaternary time scales for the Pontocaspian domain: Interbasinal connectivity and faunal evolution // Earth-Science Reviews. 2019. V. 188. P. 1–40. earscirev.2018.10.013https://doi.org/10.1016/j
Doan K., Mackiewicz P., Sandoval-Castellanos E. et al. The history of Crimean red deer population and Cervus phylogeography in Eurasia // Zoological Journal of the Linnean Society. 2018. V. 183. № 2. P. 208–225. https://doi.org/10.1093/ZOOLINNEAN/ZLX065
Mayol M., Riba M., González-Martínez S. C. et al. Adapting through glacial cycles: insights from a long-lived tree (Taxus baccata) // New Phytologist. 2015. V. 208. № 3. P. 973–986. https://doi.org/10.1111/nph.13496
Gomory D., Paule L., Mačejovsky V. Phylogeny of beech in Western Eurasia as inferred by approximate Bayesian computation // Acta Soc. Botan. Poloniae. 2018. V. 87. № 2. P. 1–11. https://doi.org/10.5586/ asbp.3582
Semerikov N.V., Petrova I.V., Sannikov S.N. et al. Cytoplasmic DNA variation does not support a recent contribution of Pinus sylvestris L. from the Caucasus to the main range // Tree Genetics & Genomes. 2020. V. 16. № 4. Article number 59. https://doi.org/10.1007/s11295-020-01458-8
Семерикова С.А. Маркеры хлоропластной ДНК в исследовании филогеографии робуроидных дубов (Quercus L. sect. Quercus, Fagaceae) крымско-кавказского региона // Генетика. 2023. Т. 59. № 1. С. 50–64. doi: 10.31857/S0016675823010095
Определитель высших растений Крыма. Под ред. Рубцова Н.И. Л.: Наука, 1972. 555 с.
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. № 6. P. 673–679. https://doi.org/10.1007/BF00226088
Deguilloux M.F., Dumolin-Lapegue S., Gielly L. et al. A set of primers for the amplification of chloroplast microsatellites in Quercus // Mol. Ecol. Notes. 2003. V. 3 № 1. P. 24–27. https://doi.org/10.1046/j.1471-8286.2003.00339.x
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids Symp. Series. 1999. V. 41. P. 95–98.
Excoffier L., Lischer H. ARLEQUIN ver. 3.5: An integrated software package for population genetics data analysis. Bern: Computational and Molecular population genetics Lab (CMPG). Institute of Ecology and Evolution, Univ. Bern, Bern, Switzerland, 2011. 174 p.
Nei M. Molecular evolutionary genetics. N. Y.: Columbia University Press, 1987. 512 p.
Ronquist F., Huelsenbeck J.P. MrBAYES 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. № 12. P. 1572–1574. https://doi.org/10.1093/bioinformatics/btg180
Swofford D.L. PAUP*. Phylogenetic analysis using parsimony (* and other methods). Version 4.0 beta10. Sunderland: Sinauer Associates, Massachusetts. 2002.
Семерикова С.А., Исаков И.Ю., Семериков В.Л. Изменчивость хлоропластной ДНК отражает историю Tilia cordata s. l. в восточной части ареала // Генетика. 2020. Т. 56. № 2. С. 188–200. [Semerikova S.A., Isakov I.Yu, Semerikov V.L. Chloroplast DNA variation shed light on the history of lime tree (Tilia cordata s. l.) in the eastern part of the range // Russ. J. Genet. 2020. V. 56. № 2. P. 192–203. doi:10.1134/s1022795420020118]https://doi.org/10.1134/S0016675820020113
Ingvarsson P.K., Ribstein S., Taylor D.R. Molecular evolution of insertions and deletion in the chloroplast genome of Silene // Mol. Biol. Evol. 2003. V. 20. № 11. P. 1737–1740. https://doi.org/10.1093/molbev/msg163
Bandelt H.J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
https://quercusportal.pierroton.inra.fr/index.php?p= GENOMIC_SEQ).
Pham K.K., Hipp A.L., Manos P.S., Cronn R.C. A time and a place for everything: phylogenetic history and geography as joint predictors of oak plastome phylogeny // Genome. 2017. V. 60. № 9. P. 720–732. https://doi.org/10.1139/gen-2016-0191
Hipp A.L., Manos P.S., Hahn M. et al. Genomic landscape of the global oak phylogeny// New Phytologist. 2020. V. 226. № 4. P. 1198–1212. https://doi.org/10.1111/nph.16162
Curtu A.L., Sofletea N., Toader A.V., Enescu M.C. Leaf morphological and genetic differentiation between Quercus robur L. and its closest relative, the drought-tolerant Quercus pedunculiflora K. Koch. // Annals of Forest Science. 2011. V. 68. № 7. P. 1163–1172. https://doi.org/10.1007/s13595-011-0105-z
Atanassova A. Palaeoecological setting of the western Black Sea area during the last 15000 years // The Holocene. 2005. V. 15. P. 576–584. https://doi.org/10.1191/0959683605hl832rp
Ferris C., King R.A., Vainola R., Hewitt G.M. Chloroplast DNA recognises three refugial sources of European oaks and shows independent eastern and western immigrations to Finland // Heredity. 1998. V. 80. P. 584–593.
Jensen J.S., Gillies A., Csaikl U. et al. Chloroplast DNA variation within the Nordic countries // Forest Ecol. Management. 2002. V.156. P. 167–180. https://doi.org/10.1016/S0378-1127(01)00641-7
Gomory D., Paule L., Krajmerova D. et al. Admixture of genetic lineages of different glacial origin: a case study of Abies alba Mill. in the Carpathians // Plant Syst Evol. 2012. V. 298. P. 703–712. https://doi.org/10.1007/s00606-011-0580-6
Bolikhovskaya N.S., Porotov A.V., Richards K. et al. Detailed reconstructions of Holocene climate and environmental changes in the Taman Peninsula (Kuban River delta region) and their correlation with rapid sea-level fluctuations of the Black Sea // Quat. Int. 2018. V. 465. P. 22–36. https://doi.org/10.1016/j.quaint.2017.08.013
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S1. Хлоропластные гаплотипы и описание соответствующих им аллелей хлоропластных микросателлитных локусов (cpSSR), используемых для типирования гаплотипов.


