Экология, 2023, № 4, стр. 281-290
За 50 лет зарастания отвала золы содержание азота и фосфора изменилось в эмбриоземе, но не изменилось в растениях
А. А. Бетехтина a, *, О. А. Некрасова a, А. П. Учаев a, П. С. Некрашевич a, А. В. Малахеева a, Т. А. Радченко a, Д. И. Дубровин a, Т. А. Петрова a, Д. В. Веселкин b
a Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620083 Екатеринбург, просп. Мира, 19, Россия
b Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: A.A.Betekhtina@urfu.ru
Поступила в редакцию 13.12.2022
После доработки 14.03.2023
Принята к публикации 17.03.2023
- EDN: RQCRXX
- DOI: 10.31857/S0367059723040042
Аннотация
Исследовали изменение содержания азота (N) и фосфора (P) в зольном субстрате и листьях растений в ходе первичной сукцессии зарастания разновозрастных отвалов золы. Работы проведены на молодом (длительность зарастания 5–8 лет) и старом (длительность зарастания 53–56 лет; два участка – с луговой и лесной растительностью) золоотвалах одной тепловой электростанции на Среднем Урале. В формирующейся почве и листьях модельных растений на каждом отвале определили содержание N и P. В молодых почвах установлена предсказуемая и объяснимая сукцессионная динамика N и P: за 53–56 лет содержание N возросло в 2.4–7.1 раза, а содержание P снизилось в 1.1–2.1 раза. В листьях растений содержание N и P на разных этапах зарастания было фактически константным: N – 1.6–2.1%, P – 2.2–2.9 мг/г. В целом установлено, что и в сукцессионно молодых местообитаниях, и в более продвинутых, с формирующейся лесной растительностью на фоне кратного увеличения содержания N в почве содержание N в растениях остается низким. С большой вероятностью на обоих отвалах доступность азота является ограничивающим развитие растений фактором. Об этом свидетельствуют результаты анализа соотношения N/P в листьях и сравнения нашего массива значений N в листьях с глобальными содержаниями N у этих же видов. Таким образом, результаты, полученные в отношении сукцессионной динамики содержания азота и фосфора в почвах и растениях разновозрастных отвалов, оказались неожиданно мало согласованными между собой.
Азот (N) и фосфор (P) – основные элементы минерального питания растений, доступность которых определяет продуктивность и структуру их сообществ [1, 2]. Содержание элементов в биомассе растения определяется стехиометрическими потребностями растений [3, 4]. Однако в глобальном и региональном масштабах содержание N в листьях положительно связано с доступностью N в почве [5, 6].
Для изучения связи между содержанием N и P в почвах и растениях используют эксперименты с внесением удобрений [7, 8] или наблюдения в разных градиентах: увлажнения [9], опустынивания [10], лесовосстановления [11]. В большинстве природных и экспериментальных ситуаций экстремально низкие содержания N и P в субстратах не моделируются, но чрезвычайно низкие содержания N и P в почвах удается наблюдать при исследовании первичных сукцессий [12]. В ходе первичных сукцессий часто регистрируется накопление органического вещества и N с нулевых или околонулевых отметок при постепенном снижении рН субстрата и доступности P [13–16].
На бедных азотом субстратах его недостаток лимитирует развитие растений [17]. Однако даже при низкой доступности N и высокой доступности P сукцессия может протекать быстро, а N быстро накапливаться микроорганизмами и растениями [18]. Пионерные растения начальных этапов зарастания бедных азотом песчаных дюн, вулканогенных отложений и хвостохранилищ хорошо адаптированы к дефициту N [19, 20] и способны получать его или в результате симбиотической азотфиксации, или за счет быстрого поглощения следов N из субстрата [21].
В умеренной зоне по мере продвижения сукцессий N накапливается в почве преимущественно в органической форме, в которой он становится доступным прежде всего для растений с экто- и эрикоидной микоризой [22]. Экосистемы с доминированием растений с такой микоризой также считаются лимитированными азотом [23]. Другими словами, недостаток азота – важный фактор состояния сообществ растений не только на начальных, но и на близких к заключительным стадиях сукцессий. Поэтому сложно судить о степени дефицита N в экосистеме только по его содержанию в почве, и для определения степени доступности N предложено использовать его содержание или соотношение N/Р в листьях [24, 25].
Прямые наблюдения раннесукцессионных изменений молодых почв и растительности затруднены в связи с их большой длительностью. Один из методов изучения таких процессов – реконструкция сукцессии по последовательности разновозрастных объектов, из которых удобны отвалы золы. Зола – относительно гомогенный субстрат, практически не содержащий N, как правило, имеющий щелочную реакцию и разное содержание подвижных форм P [26, 27]. На Среднем Урале два разновозрастных золоотвала Верхнетагильской государственной электростанции – старый, давно сформированный, и молодой, сформированный недавно, – спонтанно заросли растительностью разной сукцессионной продвинутости. Субстрат на этих отвалах, на котором формируется молодая почва, имеет следы N и щелочную реакцию среды. Различия между отвалами наблюдаются по содержанию подвижных фосфатов (P2O5), которых в субстрате молодого отвала относительно много (41.0 мг/100 г), а в старом относительно мало (23.5 мг/100 г). По мере увеличения возраста почв на техногенных и вулканогенных субстратах, схожих по свойствам с золой, содержание подвижных фосфатов, как правило, снижается [16, 19].
Нас интересовало, можно ли на основании содержания N и Р в растениях сукцессионно молодых местообитаний установить ведущий фактор состояния растений. Цель работы: исследовать содержание азота и фосфора в формирующихся почвах и листьях растений в ходе первичной сукцессии зарастания 5–56-летних отвалов золы. Мы предполагали, что изменение содержания азота и фосфора в почве по мере сукцессионных изменений соответствующим образом отражается на количестве этих элементов в растениях.
МАТЕРИАЛ И МЕТОДЫ
Район. Работы проведены на Среднем Урале (Россия, Свердловская обл., г. Верхний Тагил) в пределах Белоярского южно-таежного ботанико-географического округа Свердловской области. Мезорельеф района холмисто-увалистый с преобладанием высот 300–350 м над ур. м. Климат умеренно континентальный с продолжительной (5–6 мес.) холодной зимой и коротким (около 3 мес.) теплым летом. Среднегодовая температура +1.7…+2.4°С, среднегодовое количество осадков 510–580 мм. Район типично лесной, с южно-таежными сосновыми с лиственницей, сосново-еловыми и вторичными березовыми и смешанными лесами.
Местообитания и пробные площади. Работы проведены на двух разновозрастных отвалах золы (золоотвалах) Верхнетагильской государственной районной электростанции. Молодой золоотвал (57°40′ с.ш., 59°90′ в.д.) состоит из летучей золы бурых углей Экибастузского месторождения (Казахстан) и занимает площадь 358 га. Зарастание разных участков началось в 2014–2017 гг. На момент проведения полевого этапа работы (2020–2021 гг.) зарастание исследованных участков длилось 5–8 лет. Старый золоотвал (57°20′ с.ш., 59°56′ в.д.) состоит из летучей золы бурых углей Челябинского и Богословского месторождений (Урал, Россия) и занимает площадь 125 га. Зарастание разных участков началось в 1965–1968 гг. Ко времени наших исследований после начала зарастания прошло 53–56 лет и на отвале представлены разные сообщества. На каждом золоотвале существуют рекультивированные и нерекультивированные участки. Для исследования выбраны только нерекультивированные участки, на которых растительность развивалась спонтанно. Размер пробной площади 10 × 10 м в луговых местообитаниях, 20 × 20 м – в лесных.
На молодом золоотвале две пробные площади были расположены по одной на двух участках. Участок I расположен относительно близко к локальному понижению, заполненному водой; это простая растительная группировка однолетних и многолетних растений с преобладанием Oxybasis glauca, Rorippa sp., Artemisia vulgaris, A. absinthium, Epilobium sp., Alopecurus aequalis, Persicaria maculosa, Ranunculus sceleratus, Calamagrostis epigejos, Tripleurospermum inodorum, Puccinellia distans, Salix sp. и др.; среднее проективное покрытие надземных частей растений 0–5%. Участок II расположен относительно дальше от уреза воды, и растительность на нем представлена сложной группировкой многолетних растений: Melilotus albus, M. officinalis, Tussilago farfara, Trifolium pratense, Puccinellia distans, Tripleurospermum inodorum, Agrostis gigantea, Bídens tripartita, Rorippa sp., Trifolium hybridum, Epilobium palustre, Juncus sp. и др.; среднее проективное покрытие надземных частей растений 5–10%.
На старом золоотвале также две пробные площади были расположены по одной на двух участках – луговом и лесном. Луг – разнотравно-злаковое сообщество с доминированием Calamagrostis epigeios, Poa pratensis, Pimpinella saxifraga, Silene nutans, Achillea millefolium, Epilobium angustifolium, Erigeron acris, Plantago media – всего 34 вида; среднее проективное покрытие надземных частей растений 50%. Лиственный лес – лесное сообщество с деревьями Betula pendula, B. pubescens и Populus tremula возрастом 35–40 лет и высотой 8–14 м; в напочвенном покрове всего зарегистрировано 26 видов, из которых доминируют Pyrola rotundifolia, Orthilia secunda, Poa pratensis, Ranunculus auricomus, Trifolium repens, встречаются Neottia ovata, Platanthera bifolia; среднее покрытие крон 60–70%; среднее проективное покрытие надземных частей растений травяно-кустарничкового яруса 20–25%. Названия видов растений даны по [28].
Отбор и химический анализ образцов формирующихся почв. На каждой пробной площади в конце июня–начале июля 2020–2021 гг. описаны по 3 почвенных разреза. Образцы для аналитических исследований из верхней толщи золоотвалов отбирали подробно, послойно, с учетом видимых границ формирующихся почвенных горизонтов и подготавливали к анализу общепринятыми методами. Для установления физико-химических характеристик верхнего слоя зольного субстрата толщиной 10 см рассчитывали средневзвешенные значения показателей, учитывающие мощности слагающих этот слой горизонтов. Значения рН определяли с помощью потенциометра Анион 4100; содержание подвижного фосфора (P2O5) – по Чирикову спектрофотометрически (с использованием спекторофотометра UV Probe-1650) [29, 30]; содержание общего азота – методом мокрого сжигания по Къельдалю (с использованием Heating Digestor DK 20 Velp и Distilation Unit UDK 12 Velp) и титриметрическим окончанием.
Отбор и химический анализ образцов растений. На каждой пробной площади в конце июня–начале июля 2020–2021 гг. собрали листья растений, имеющих наибольшее проективное покрытие надземных частей. Для анализа брали все перечисленные выше виды. Зрелые и неповрежденные листья отбирали только от взрослых особей, перед анализом листья не мыли. Из всех образцов каждого вида растения на каждой пробной площади были сформированы 2–3 пробы массой по 10 г листьев в свежем состоянии. Пробы сушили 48 ч при 70°С, затем тонко измельчали. Содержание N в растительном материале определяли в трехкратной повторности тем же методом, что и в образцах золы. Содержание общего фосфора измеряли спектрофотометрически после мокрого сжигания по Къельдалю. Всего проанализировано 24 вида растений с молодого отвала, 8 – с лугового участка старого отвала, 10 – с лесного участка старого отвала.
Данные из TRY Plant Trait Database. Опубликованные оценки содержания N и P в сухой массе листа получили из глобальной базы данных TRY Plant Trait Database [31]. Запрос формировали на сайте базы данных по искомым признакам (leaf nitrogen (N) content per leaf dry mass, TraitID – 14; leaf phosphorus (P) content per leaf dry mass, TraitID – 15). Оценки для содержания N получили для 31 вида исследованных нами растений (от 1 до 462 измерений у каждого вида), для P – для 18 видов растений (от 1 до 182 измерений у каждого вида). Полученные фрагменты электронных баз данных проверили на наличие ошибок и выбросов. Выбросом считали максимальное или минимальное значение, более чем в 2 раза отличающееся от ближайшего значения параметра. После исключения немногочисленных выбросов рассчитали средние значения признаков для каждого вида растения.
Функциональные группы растений формировали на основании учета способа их почвенного питания: 1) немикоризные; 2) с арбускулярными микоризами; 3) с азотфиксирующим симбиозом; 4) эктомикоризные; 5) с арбутоидными микоризами; 6) с микоризами орхидных. Во многих случаях способ почвенного питания, свойственный виду растения, устанавливали, не проводя эмпирического исследования, на основе сведений из опубликованных сводок [32, 33] и предыдущих наших данных [34, 35]. При вероятности как немикоризного, так и арбускулярно микоризного статуса растения собирали образцы его тонких корней, фиксировали их в 70%-ном этиловом спирте и микроскопически (×200–400) регистрировали гифы, арбускулы и везикулы на давленых препаратах после мацерации в KOH на водяной бане и окрашивания корней анилиновым синим. Решение об отнесении вида к арбускулярно микоризным принимали при нахождении в корнях либо везикул, либо арбускул. При их отсутствии вид в данном исследовании считали немикоризным.
Статистический анализ. При сравнении данных использовали одновыборочный t-критерий, t-критерий для связанных совокупностей, коэффициент корреляции Пирсона, однофакторный дисперсионный анализ (ANOVA). Единицей наблюдения в статистическом анализе было значение признака у вида на пробной площади (n = 43). При некоторых сравнениях использовали дополнительные критерии формирования выборок, и число наблюдений было меньше. Чтобы определить оптимальный способ группировки эмпирических данных, использовали скорректированный информационный критерий Акаике (CAIC). Расчеты выполнены в пакете STATISTICA 8.0 (StatSoft Inc., USA, 1984–2007): SE – стандартная ошибка; SD – стандартное отклонение; 95CI – 95%-ный доверительный интервал.
РЕЗУЛЬТАТЫ
Состав золы. Самозарастание золоотвалов сопряжено с процессами почвообразования и формированием на поверхности золы молодых почв – эмбриоземов [36, 37]. За 53–56 лет, прошедших после окончания формирования отвала, химические свойства верхних 10 см субстрата заметно изменились: концентрация N в субстрате возросла в 2.4–7.1 раза, а концентрация P снизилась в 1.1–2.1 раза. Значения pH за это время уменьшились на 0.2–2.0 ед. Все изменения статистически значимы. В однофакторном ANOVA с вариантом “участок” (отдельно рассматривали все 4 участка: I и II – на молодом отвале , “луг” и “лес” – на старом) получены следующие оценки значимости: для N – F(3;8) = 84.57, P < 0.0001; для P – F(3;8) = = 4.55, P = 0.0384; для pH – F(3;8) = 16.01, P = = 0.0010. При визуальном анализе (рис. 1) изменчивости средних значений химических свойств субстрата и на основании результатов попарных сравнений с помощью критерия Тьюки видно, что на молодом отвале на обоих участках (т.е. на участках I и II) концентрации N и P, а также значения pH были близки. На длительно зарастающем отвале содержание N и pH почвы между участками “луг” и “лес” различались.
Рис. 1.
Содержание N (а), P (б) и pHвод (в) в верхнем 10-см слое почвы на двух отвалах, различающихся длительностью зарастания. На каждом отвале оценки показаны для двух участков, абсолютный размах – для трех значений на каждом участке. Одинаковыми буквенными индексами обозначены гомогенные (P < 0.05) по критерию Тьюки совокупности.
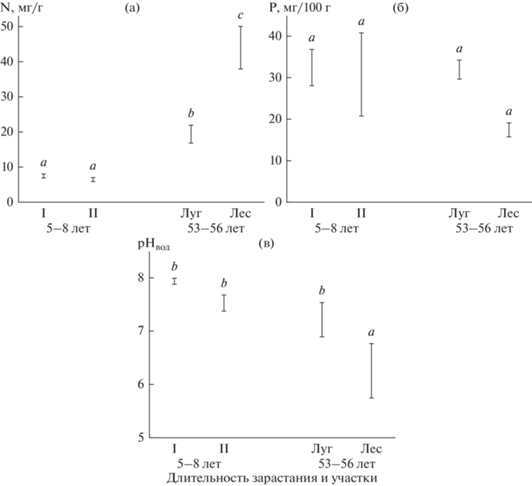
Чтобы определить оптимальный способ группировки участков для лучшего объяснения изменчивости химических свойств почвы, использовали критерий CAIC. Сравнили четыре способа группировки участков: 1) два отвала (молодой отвал, т.е. объединение участков I + II, и старый отвал, т.е. объединение участков “луг” + “лес”); 2) 4 группы – все 4 участка отдельно: I, II, “луг”, “лес”; 3) 3 группы – молодой отвал (I + II), отдельно участки “луг” и “лес”; 4) 2 группы – группа “безлесные местообитания” (I + II + “луг”), отдельно участок “лес”. Наименьшие значения CAIC наблюдались для двух последних способов группировки (табл. 1). Из двух оптимальных вариантов группировки выбрали способ, при котором растения, росшие на двух участках молодого отвала, рассматривали как одну совокупность, а растения с лугового и лесного участков на старом отвале – как разные совокупности. Такое подразделение трактовали как подразделение на этапы сукцессии зарастания отвала: на молодом отвале представлен ранний этап сукцессии – растительные группировки; на старом – относительно менее сукцессионно продвинутое луговое сообщество и относительно более сукцессионно продвинутое лесное.
Таблица 1.
Значения критерия CAIC для разных способов группировки участков при объяснении изменчивости химических свойств почвы на двух отвалах
| Способ группировки участков | Концентрация N | Концентрация P | pH |
|---|---|---|---|
| 1) 2 отвала: (I + II) – (“луг” + “лес”) | 98.15 | 91.86 | 25.24 |
| 2) 4 группы: I – II – “луг” – “лес” | 78.75 | 93.29 | 22.04 |
| 3) 3 группы: (I + II) – “луг” – “лес” | 73.91 | 88.26 | 20.40 |
| 4) 2 группы: (I + II + “луг”) – “лес” | 85.87 | 83.07 | 20.32 |
Содержание N и P в растениях: сопоставление собственных и опубликованных данных. Так как некоторые виды растений были изучены более чем на одном отвале, общее число сопоставляемых пар оценок составило 33. Абсолютные размахи содержания N, установленные нами и извлеченные из TRY Plant Trait Database, близки, но не совпадали полностью. Коэффициент корреляции между двумя массивами оценок составил r = 0.68, P < 0.0001. Абсолютный размах в массиве наших измерений составил 0.6–3.4%, в опубликованном – 1.4–4.7% (рис. 2а). В среднем на изученных отвалах содержание N в листьях было на 0.6% меньше, чем в TRY Plant Trait Database (t = 5.65; dF = 32; P < < 0.0001; t-критерий использовали для связанных совокупностей). Установленные нами и опубликованные данные о содержании N совпадали только в узкой области низких концентраций. Большая часть наблюдавшихся значений содержания N была значимо ниже оценок, опубликованных для этих видов растений.
Рис. 2.
Зависимость между опубликованными (TRY Plant Trait Database) и наблюдавшимися в нашей работе содержаниями N (а; n = 33) и P (б; n = 25) в листьях растений; незалитые точки – растения с молодого отвала, серые – с луга, черные – из леса. Красная сплошная линия – прямая с наклоном +1, черная штриховая линия – аппроксимация эмпирической зависимости, для которой серой заливкой показана область 95%-ного доверительного интервала.
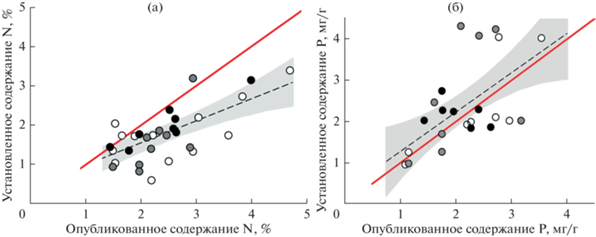
Общее число сопоставляемых пар оценок для P составило 25, коэффициент корреляции между массивами r = 0.64, P = 0.0006 (рис. 2б). Абсолютные размахи содержания P, установленных нами (1.0–4.3 мг/г) и извлеченных из TRY Plant Trait Database (1.1–3.5 мг/г), фактически совпадали. Средние содержания P в двух массивах также не различались (t = 1.31; dF = 24; P = 0.2022). Установленные нами и опубликованные значения совпадали во всем диапазоне наблюдавшихся уровней P.
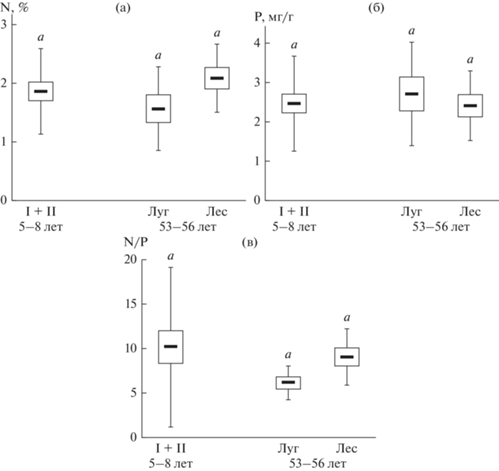
Содержание N и P в листьях растений в зависимости от этапа сукцессии. Различия средних значений содержания N и P в листьях растений на разных этапах зарастания отвалов установить не удалось. Диапазон варьирования содержания N во всех пробах составил 1.6–2.5% (95CI; рис. 3а): на молодом отвале – 1.6–2.1%, на луговом участке старого отвала – 1.0–2.1%, на лесном участке – 1.7–2.5% (в однофакторном ANOVA F(2;40) = 1.41, P = 0.2570). Диапазон варьирования содержания P во всех пробах составил 1.7–3.1 мг/г (95CI; рис. 3б): на молодом отвале – 2.0–3.0 мг/г, на луговом участке старого отвала – 1.7–3.7 мг/г, на лесном – 1.8–3.1 мг/г (в однофакторном ANOVA F(2;40) = = 0.19, P = 0.8279).
Рис. 3.
Содержание азота (а), фосфора (б) и соотношение N/P (в) в листьях растений на молодом отвале и двух участках длительно зарастающего отвала. Центральная тенденция – среднее; “ящик” – ±SE; линии – ±SD. Одинаковыми буквенными индексами показаны гомогенные (P < 0.05) по критерию Тьюки совокупности.
Известно, что содержание азота специфично у растений разных функциональных групп [38]. Поэтому мы проверили, не различалось ли содержание N и P в зависимости от этапа зарастания золы в какой-либо относительно гомогенной группе растений. Для этого выбрали многочисленную и представленную во всех местообитаниях группу видов с арбускулярными микоризами. Всего проанализировали 26 таких растений. В зависимости от этапа сукцессии они также не различались по содержанию N (F(2;23) = 0.14, P = 0.8672) и P (F(2;23) = = 0.14, P = 0.8685). Содержание составило (95CI): N – 1.3–1.9%, P – 2.1–3.0 мг/г.
Содержание N и P в растениях разных функциональных групп. При анализе особенностей элементного состава листьев растений разных функциональных групп приуроченность к местообитаниям не учитывали. Растения различались по содержанию N (F(5;37) = 4.81, P = 0.0017), но не различались по содержанию P (F(5;37) = 0.88, P = 0.5043). Наименьшее содержание N было у растений с арбутоидными (0.8–2.0%; 95CI) и арбускулярными (1.3–1.9%) микоризами, наибольшее ─ у бобовых растений с азотфиксирующим симбиозом (2.6–3.3%). Немикоризные растения и растения с эктомикоризами занимали промежуточное положение.
Соотношение N/P. Между концентрациями N и P в листьях отмечена положительная связь, описываемая коэффициентом корреляции r = 0.45, P = = 0.0022. Соотношение N/P варьировало в диапазоне 7–11 (95CI для 43 измерений) и не изменялось в зависимости от этапа сукцессии (рис. 3в; F(2;40) = 1.05, P = 0.3591). Также соотношение N/P не изменялось у растений разных функциональных групп (F(5;37) = 1.38, P = 0.2548). Только у бобовых это соотношение составило 12–23 (95CI), а у всех остальных растений 6–10. Таким образом, в листьях бобовых для наблюдающегося уровня содержания P относительно много N.
С помощью одновыборочного t-критерия сравнили средние значения N/P в листьях растений на разных этапах зарастания отвалов с константами 14 и 10 [24, 25]. Средние значения N/P в листьях ниже константы 14 во всех изученных сообществах на уровнях значимости P = 0.0001–0.0489, а ниже константы 10 (на уровне значимости P = 0.0003) только в луговом сообществе старого отвала.
ОБСУЖДЕНИЕ
На начальных этапах зарастания зольный субстрат характеризовался низким содержанием N, высоким – подвижных фосфатов и щелочными условиями. При этом зафиксированное нами содержание N в формирующейся почве 5–8-летнего отвала оказалось выше, чем ранее опубликованные оценки содержания N в золе в момент начала почвообразования [26]. Это может объясняться накоплением N в почве вследствие жизнедеятельности азотфиксирующих организмов.
Установленное направление сукцессионной трансформации химических свойств субстрата за 53–56 лет в целом ожидаемо: кратный рост содержания N, снижение pH и содержания P. Эти преобразования соответствуют универсальной модели почвообразования [39]. Выраженность изменений свойств субстрата сопряжена не с абсолютным временем, прошедшим с момента формирования биотопа, а с уровнем сукцессионной продвинутости формирующегося на золоотвале сообщества. Под лесом трансформация зольного субстрата выражена сильнее, чем под лугом.
Увеличение содержания N под лесом можно связать с интенсивным накоплением органического вещества в подстилке и корнеобитаемом слое вследствие большого объема листового и корневого опада. Например, считается, что Populus tremula, доля которой в древостое лесного участка составляет 30%, оказывает на почвы улучшающее влияние, хотя экспериментальные свидетельства и подтверждают [40], и не подтверждают [41] этот тезис. Тонкие корни лесных растений по сравнению с корнями растений, растущих на лугах, обогащены N [42, 43]. Опад тонких корней может представлять важный путь накопления стабильного органического вещества почвы и азота в нем [44, 45]. Также в лесных почвах может быть низкой скорость минерализации N [46, 47], что может приводить к его накоплению.
Снижение содержания подвижных фосфатов в эмбриоземах в ходе первичных сукцессий отмечается как на техногенных субстратах [48], так в поствулканогенных почвах [49, 50]. Как правило, уменьшение содержания подвижных фосфатов связывают с подкислением почв, переходом Р в органические соединения, химическим связыванием с Al и Fe в кислых и Са и Мg в щелочных условиях [50, 51]. Также ожидаемо и объяснимо подкисление почвы в ходе сукцессии, так как при разложении растительного опада образуются органические кислоты [52, 53]. Подкисление субстрата может быть связано и с формированием системы гумусовых кислот [54].
Средние количества N в листьях в отличие от почвы не зависели от сукцессионного этапа развития сообществ. Следовательно, в отношении азота наше основное предположение не подтвердилось, поскольку его содержание в листьях не было связано с уровнем N в почвах. В сравнениях иного масштаба показано [5, 6], что содержание N в листьях положительно связано с доступностью N в почве. В градиенте экологического масштаба на примере зарастания песчаных дюн достоверного возрастания уровня N в листьях при его увеличении в почве не показано [20]. Близость концентраций N в листьях растений разновозрастных отвалов можно объяснять по-разному. У растений начальных этапов сукцессии, вероятно, существуют какие-то приспособления для быстрого поглощения N, поступающего из осадков от свободноживущих [21, 55] или симбиотических азотфиксаторов. Например, в нашем случае большинство бобовых были выраженно приурочены к сообществам молодого отвала: на нем бобовые составляли 23% от общего числа видов по сравнению с 4% видов от общего числа видов на поздних этапах зарастания. Отсутствие обогащения N растений при его накоплении в почве под лесом обусловлено, вероятно, возрастанием напряженности конкуренции между растениями или накоплением N в органической форме, в которой он доступен преимущественно для растений со специализированными эрикоидной и эктомикоризой [22].
Содержание P в растениях также было не связано с его уровнем в почвах. Это можно объяснить тем, что на изученных золоотвалах P не является ограничивающим фактором и, несмотря на снижение содержания в почве по ходу сукцессии, его достаточно для роста растений. Об этом же свидетельствует совпадение наших оценок с оценками из глобальной базы TRY Plant Trait Database.
Критерием доступности N и P в почве является соотношение N/P в растениях [24, 25]. Обзор 40 исследований по внесению удобрений показал, что соотношение N/P > 16 указывает на ограничение развития растительных сообществ доступностью фосфора, а соотношение N/P < 14 – на ограничение доступностью азота [24]. В работе [25] соответствующими порогами рекомендовано считать N/P > 20 и N/P < 10. При ориентире на константу N/P = 14 все изученные сообщества лимитированы низкой доступностью азота. При константе N/P = 10 только сообщество луга лимитировано N. Мы склонны считать, что ограничение доступностью азота наблюдается на всех изученных участках.
Растения с разными способами почвенного питания имеют доступ к разным источникам N и P [46], что может влиять на содержание и соотношение этих элементов. Как правило, виды с азотфиксирующим симбиозом имеют высокое содержание N в листьях [56] и корнях [43], а растения с экто- и эрикоидной микоризой обычно содержат меньше N в сравнении с растениями с арбускулярной микоризой [38]. Наши данные подтверждают эти закономерности только частично – только в отношении N и N/P у бобовых с ризобиальным симбиозом. В настоящей работе с помощью привлечения сведений о способах почвенного питания растений не удалось улучшить понимание закономерностей аккумуляции N и P в листьях на разновозрастных отвалах.
ЗАКЛЮЧЕНИЕ
Результаты, полученные в отношении сукцессионной динамики содержания азота и фосфора в зольном субстрате и растениях разновозрастных отвалов, оказались неожиданно мало согласованными между собой. В формирующихся почвах установлена предсказуемая и объяснимая сукцессионная динамика N и P. В растениях содержания N и P на разных этапах зарастания фактически константны, хотя видовой состав и структура сообществ за 50 лет сильно изменились. И в сукцессионно молодых местообитаниях, и в более продвинутых, с формирующейся лесной растительностью на фоне кратного увеличения содержания N в почве в растениях оно остается низким. Можно утверждать, что доступность азота – это фактор, ограничивающий развитие растений и их сообществ, что подтверждают результаты анализа значений соотношения N/P в листьях и сравнения нашего массива значений N в листьях с глобальным средним содержанием N у этих же видов. В целом результаты свидетельствуют об актуальности специального анализа экологических и физиологических механизмов перераспределения азота между видами растений и компонентами биомассы в сообществах, в частности механизмов, с помощью которых обеспечивается снабжение азотом раннесукцессионных растений. По-видимому, раннесукцессионные виды способны накапливать азот в листьях за счет разнообразных механизмов, один из наиболее вероятных – быстрое поглощение азота от свободноживущих азотфиксаторов, активная деятельность которых обеспечивается корневыми выделениями растений.
Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках Программы развития Уральского федерального университета им. первого Президента России Б.Н. Ельцина в соответствии с программой стратегического академического лидерства “Приоритет-2030”; геоботанические исследования и анализ растений проводились в рамках государственного задания (тема № FEUZ-2023-0023).
Авторы декларируют отсутствие конфликта интересов.
Список литературы
Elser J.J., Bracken M.E.S., Cleland E.E. et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems // Ecol Lett. 2007. V. 10. № 12. P. 1135–1142. https://doi.org/10.1111/j.1461-0248.2007.01113.x
Bui E.N., Henderson B.L. C : N : P stoichiometry in Australian soils with respect to vegetation and environmental factors // Plant and Soil. 2013. V. 373. P. 553–568. https://doi.org/10.1007/s11104-013-1823-9
Chapin F.S. III, Vitousek P.M., Van Cleve K. The nature of nutrient limitation in plant communities // American Naturalist. 1986. V. 127. P. 48–58.
Aerts R., Chapin F.S. The mineral nutrition of wild plants revisited: a re-evaluation of processes and patterns // Adv. Ecol. Res. 2000. V. 30. P. 1–67. https://doi.org/10.1016/S0065-2504(08)60016-1
Wang G. Leaf trait co-variation, response and effect in a chronosequence // J. Vegatation Sci. 2007. V. 18. № 4. P. 563–570. https://doi.org/10.1111/j.1654-1103.2007.tb02570.x
He M., Dijkstra F.A., Zhang K. Leaf nitrogen and phosphorus of temperate desert plants in response to climate and soil nutrient availability // Scientific Reports. 2014. V. 4. P. 1–7.
Soudzilovskaia N.A., Onipchenko V.G., Cornelissen J.H.C. et al. Biomass production, N : P ratio and nutrient limitation in a Caucasian alpine tundra plant community // J. Vegetation Sci. 2005. V. 16. P. 399–406.https://doi.org/10.1111/j.1654-1103.2005.tb02379.x
von Oheimb G., Power S.A., Falk K. et al. N : P Ratio and the nature of nutrient limitation in Calluna-dominated heathlands // Ecosystems. 2010. V. 13. P. 317–327. https://doi.org/10.1007/s10021-010-9320-y
Liu B., Han F., Ning P. et al. Root traits and soil nutrient and carbon availability drive soil microbial diversity and composition in a northern temperate forest // Plant and Soil. 2022. V. 479. P. 281–299. https://doi.org/10.1007/s11104-022-05516-z
Ning Z., Zhao X., Yulin L. et al. Plant community C : N : P stoichiometry is mediated by soil nutrients and plant functional groups during grassland desertification // Ecol Eng. 2021. V. 162. № 1. P. 106–179. https://doi.org/10.1016/j.ecoleng.2021.106179
Yan T., Lu X.-T., Zhu J.-J. et al. Changes in nitrogen and phosphorus cycling suggest a transition to phosphorus limitation with the stand development of larch plantations // Plant and Soil. 2018. V. 422. P. 385–396. https://doi.org/10.1007/s11104-017-3473-9
Peltzer D.A., Wardle D.A., Allison V.J. et al. Understanding ecosystem retrogression // Ecol. Monogr. 2010. V. 80. № 4. P. 509–529. https://doi.org/10.1890/09-1552.1
Махонина Г.И. Экологические аспекты почвообразования в техногенных экосистемах Урала. Екатеринбург: Изд-во Урал. ун-та, 2003. 355 с.
Vitousek P.M. Nutrient cycling and limitation: Hawaii as a model system. Princeton, N. J.: Princeton University Press, 2004. 232 p.
Laliberte E., Turner B. L., Costes T. et al. Experimental assessment of nutrient limitation along a 2-million year dune chronosequence in the south-western Australia biodiversity hotspot // J. Ecol. 2012. V. 100. P. 631–642. https://doi.org/10.1111/j.1365-2745.2012.01962.x
Coomes D.A., Bentley W.A., Tanentzap A.J. et al. Soil drainage and phosphorus depletion contribute to retrogressive succession along a New Zealand chronosequence // Plant Soil. 2013. V. 367. P. 77–91. https://doi.org/10.1007/s11104-013-1649-5
Olde Venterink H., Gusewell S. Competitive interactions between two meadow grasses under nitrogen and phosphorus limitation // Funct Ecol. 2010. V. 24. P. 877–886. https://doi.org/10.1111/j.1365-2435.2010.01692.x
Darcy J.L., Schmidt S.K., Knelman J.E. Phosphorus, not nitrogen, limits plants and microbial primary producers following glacial retreat // Science Advances. 2018. V. 4. № 5. P. 1–7. https://doi.org/10.1126/sciadv.aaq0942
Satti P., Mazzarino M.J., Roselli L. Factors affecting soil P dynamics in temperate volcanic soils of southern Argentina // Geoderma. 2007. V. 139. P. 229–240.
Hayes P.E., Turner B.L., Lambers H. et al. Foliar nutrient concentrations and resorption efficiency in plants of contrasting nutrient-acquisition strategies along a 2-million-year dune chronosequence // J. Ecol. 2014. V. 102. P. 396–410. https://doi.org/10.13140/2.1.5050.4968
Zhong H., Zhou J., Wong W-S. et al. Exceptional nitrogen-resorption efficiency enables Maireana species (Chenopodiaceae) to function as pioneers at a mine-restoration site // Sci. Tot. Environ. 2021. V. 779. https://doi.org/10.1016/j.scitotenv.2021.146420
Read D.J., Perez-Moreno J. Mycorrhizas and nutrient cycling in ecosystems-a journey towards relevance? // New Phytol. 2003. V. 157. P. 475–492. https://doi.org/10.1046/j.1469-8137.2003.00704.x
Dickie I.A., Martinez-Garcia Laura B., Koele N. et al. Mycorrhizal and mycorrhizal fungal communities throughout ecosystem development // Plant Soil. 2013. V. 367. P. 11–39. https://doi.org/10.1007/s11104-013-1609-0
Koerselman W., Meuleman A.F.M. The vegetation N : P ratio: a new tool to detect the nature of nutrient limitation // J. Appl Ecol. 1996. V. 33. № 6. P. 1441–1450. http://www.jstor.org/stable/2404783
Güsewell S. N : P ratios in terrestrial plants: variation and functional significance // New Phytol. 2004. V. 164. P. 243–266. https://doi.org/10.1111/j.1469-8137.2004.01192.x
Пасынкова М.В. Зола как субстрат для выращивания растений // Растения и промышленная среда. Свердловск: УрГУ, 1974. С. 29–44.
Gajic G., Djurdjevic L., Kostic O. et al. Ecological potential of plants for phytoremediation and ecorestoration of Fly Ash Deposits and Mine Wastes // Fron. Environ. 2018. V. 6. 124 p. https://doi.org/10.3389/fenvs.2018.00124
The Plant List [Электронный ресурс]. URL: http://www.theplantlist.org/ (дата обращения: 21.11.2022).
Аринушкина Е.В. Руководство по химическому анализу почв. М.: МГУ, 1970. 478 с.
Теория и практика химического анализа почв. Под ред. Воробьева Л.А.Новосибирск: Изд-во “ГЕОС”, 2006. 400 с.
Kattge J., Boenisch G., Diaz S. et al. TRY plant trait database – enhanced coverage and open access // Global Change Biology. 2020. № 26. P. 119–188. https://doi.org/10.1111/gcb.14904
Wang B., Qiu Y.L. Phylogenetic distribution and evolution of mycorrhizas in land plants // Mycorrhiza. 2006. V. 16. № 5. P. 299–363.
Akhmetzhanova, A.A., Soudzilovskaia N.A., Onipchenko V.G. et al. A rediscovered treasure: mycorrhizal intensity database for 3000 vascular plant species across the former Soviet Union // Ecology. 2012. V. 93. № 3. P. 689–690. https://doi.org/10.1890/11-1749.1
Бетехтина А.А., Веселкин Д.В. Распространенность и интенсивность микоризообразования у травянистых растений Среднего Урала с разными типами экологических стратегий // Экология. 2011. № 3. С. 176–183. [Betekhtina A.A., Veselkin D.V. Prevalence and intensity of mycorrhiza formation in herbaceous plants with different types of ecological strategies in the Middle Urals // Russ. J. Ecol. 2011. V. 42. № 3. P. 192–198.] https://doi.org/10.1134/S1067413611030040
Betekhtina A.A., Veselkin D.V. Mycorrhizal and non-mycorrhizal dicotyledonous herba-ceous plants differ in root anatomy: evidence from the Middle Urals, Russia. // Symbiosis. 2019. V. 77. № 2. P. 133–140. https://doi.org/10.1007/s13199-018-0571-2
Гаджиев И.М., Курачев В.М. Генетические и экологические аспекты исследования и классификация почв техногенных ландшафтов // Экология и рекультивация техногенных ландшафтов. Новосибирск: Наука, 1992. С. 6–15.
IUSS Working Group WRB. World Reference Base for Soil Resources. International soil classification system for naming soils and creating legends for soil maps. 4th edition. // International Union of Soil Sciences (IUSS), Vienna, Austria, 2022. 234 p.
Cornelissen J.H.C., Aerts R., Cerabolini B. et al. Carbon cycling traits of plant species are linked with mycorrhizal strategy // Oecologia. 2001. V. 129. № 4. P. 611–619.
Walker T.W., Syers J.K. The fate of phosphorus during pedogenesis // Geoderma. 1976. V. 15. P. 1–19.
Назарюк В.М., Калимуллина Ф.Р. Роль природных экосистем в восстановлении плодородия выпаханных почв Западной Сибири // Проблемы агрохимии и экологии. 2017. № 1. С. 43–50.
Комаров А.С., Чертов О.Г., Быховец С.С. и др. Воздействие осиновых плантаций с коротким оборотом рубки на биологический круговорот углерода и азота в лесах бореальной зоны: модельный эксперимент // Математическая биология и биоинформатика. 2015. Т. 10. № 2. С. 398–415. [Komarov A., Chertov O., Bykhovets S.S. et al. Effects of the Aspen Short-Rotation Plantation on the C and N biological cycles in Boreal Forests: The Model Experiment // Math. Biol. Bioinform. 2015. V. 10. № 2. P. 398–415.] https://doi.org/10.17537/2015.10.398
Бетехтина А.А., Некрасова О.А., Дергачева М.И. и др. Разложение корней луговых и лесных растений в зольном субстрате отвалов электростанций: лабораторный эксперимент // Известия РАН. Серия биологическая. 2020. № 3. С. 318–324. [Betekhtina A.A., Nekrasova O.A., Dergacheva M.I. et al. Decomposition of meadow and forest plant roots in the Ash substrate of power plant dumps: a laboratory experiment // Biology Bulletin. 2020. V. 47. № 3. P. 299–305.] https://doi.org/10.1134/S1062359020010033
Бетехтина А.А., Ганем А., Некрасова О.А. и др. Факторы содержания углерода и азота в тонких корнях растений Среднего Урала // Экология. 2021. № 2. С. 83–92. [Betekhtina A.A., Ganem A., Nekrasova O.A. et al. Factors of carbon and nitrogen contents in the fine roots of plants in the Middle Urals // Rus. J. Ecol. 2021. V. 52. № 2. P. 99–108.] https://doi.org/10.1134/S106741362102003X
Ghafoor A., Poeplau C., Kätterer T. Fate of straw–and root– derived carbon in a Swedish agricultural soil // Biol.Fertility Soils. 2017. V. 53. № 2. P. 257–267. https://doi.org/10.1007/s00374-016-1168-7
Poirier V., Roumet C., Munson A.D. The root of the matter: Linking root traits and soil organic matter stabilization processes // Soil Biol. Biochem. 2018. V. 120. P. 246–259. https://doi.org/10.1016/j.soilbio.2018.02.016
Макаров М.И. Роль микоризообразования в трансформации соединений азота в почве и азотном питании растений (обзор) // Почвоведение. 2019. № 2. С. 220–233. [Makarov M.I. The role of mycorrhiza in transformation of nitrogen compounds in soil and nitrogen nutrition of plants: a review // Eurasian Soil Science. 2019. V. 52. № 2. P. 193–205.] https://doi.org/10.1134/S1064229319100077
Макаров М.И., Лавренов Н.Г., Онипченко В.Г. Азотное питание растений альпийской лишайниковой пустоши в условиях обогащения почвы элементами минерального питания // Экология. 2020. № 2. С. 83–89. [Makarov M.I., Lavrenov N.G., Onipchenko V.G. Nitrogen nutrition of plants in an Alpine lichen heath under the conditions of soil enrichment with biogenic elements // Russ. J. Ecol. 2020. V. 51. № 2. P. 99–106.] https://doi.org/10.1134/S1067413620020083
Cross A.T., Lambers H. Young calcareous soil chronosequences as a model for ecological restoration on alkaline mine tailings // Sci. Tot. Environ. 2017. V. 607–608. P. 168–175. https://doi.org/10.1016/j.scitotenv.2017.07.005
Crews T.E., Kitayama K., Fownes J.H. et al. Changes in soil phosphorus fractions and ecosystem dynamics across a long chronosequence in Hawaii // Ecology. 1995. V. 76. P. 1407–1424. https://doi.org/10.2307/1938144
Satti P., Mazzarino M. J., Roselli L. et al. Factors affecting soil P dynamics in temperate volcanic soils of southern Argentina // Geoderma. 2007. V. 139. № 1–2. P. 229–240. https://doi.org/10.1016/j.geoderma.2007.02.005
Макаров М.И. Фосфор органического вещества почв : Автореф. дис. … докт. биол. наук. М., 2004. 49 с.
Kraus T.E., Dahlgren R.A., Zasoski R.J. Tannins in nutrient dynamics of forest ecosystems – a review // Plant and Soil. 2003. V. 256. № 1. P. 41–66. https://doi.org/10.1023/A:1026206511084
Mallik A.U. Conifer regeneration problems in boreal and temperate forest with ericaceous understory: role of disturbance, seedbed limitation, and keystone change // Crit. Rev. Plant Sci. 2003. V. 22. P. 341–366.
Дергачева М.И. Система гумусовых веществ почв. Новосибирск: Наука, 1989. 110 с.
Brady N.C., Well R.R. Elementos da natureza e propriedades dos solos. 3 ed. Porto Alegre: Bookman, 2013. 686 p.
Vergutz L., Manzoni S., Porporato A. et al. Global resorption efficiencies and concentrations of carbon and nutrients in leaves of terrestrial plants // Ecological Monographs. 2012. V. 82. P. 205–220.
Дополнительные материалы отсутствуют.


