Электрохимия, 2019, T. 55, № 1, стр. 106-115
Синтез нового катализатора (Ti0.5V0.5)3C2 – модификатора угольного пастового электрода для определения пропранолола в реальных образцахМ. Р. Натеги
М. Р. Натеги *
Факультет химии, Отделение в Язде, Исламский университет Азада
Язд, Иран
* E-mail: mnateghi@iauyazd.ac.ir
Поступила в редакцию 02.09.2016
После доработки 09.06.2017
Принята к публикации 19.06.2017
Аннотация
Синтезирован материал (Ti0.5V0.5)3AlC2 путем шарового помола порошков прекурсоров Ti, V, Al и C в мольном отношении 1.5 : 1.5 : 1.1 : 1.9 с последующим отжигом полученного мелкого порошка при 1400°C в течение 20 мин в атмосфере аргона. Морфология и структура продуктов охарактеризованы методами рентгенодифракционного анализа и СЭМ. Затем Al химически вытравливали из синтезированного (Ti0.5V0.5)3AlC2 путем погружения соединения в 40%-ный раствор HF при комнатной температуре на 20 ч. Полученную суспензию центрифугировали для отделения порошка и тщательно промывали дистиллированной водой. Полученный (Ti0.5V0.5)3C2 использовали в качестве нового модификатора для приготовления угольного пастового электрода. Модифицированный электрод на основе (Ti0.5V0.5)3C2 демонстрирует высокую эффективность в измерениях концентрации пропранолола в фармацевтических составах. Уровень обнаружения и относительное стандартное отклонение для n = 5 составляют 0.16 мкМ/л и 4% соответственно.
ВВЕДЕНИЕ
MXene-соединения – новое семейство графеноподобных 2D карбидных и нитрокарбидных материалов, полученных недавно из нового класса соединений, называемых MAX-фазами [1–6]. MAX-фазы – группа тройных карбидных и нитридных соединений с гексагональной структурой с общей формулой Mn+ 1AXn (n = 1–3), где M – переходный металл c небольшим числом d-электронов, А – элемент A-группы (главным образом IIIA и IVА), а X – C и/или N [5, 7]. При n = 1 слои A разделены двумя слоями атомов M. Для n = 2 и 3 слои A разделены тремя и четырьмя слоями атомов M соответственно [2, 4]. Эти материалы демонстрируют необычные свойства, а именно устойчивость к окислению и коррозии, термическую и электрическую проводимость, высокую термическую стабильность, стойкость к термоударам и пластичность при высоких температурах [2].
Ti3AlC2 – одна из наиболее изученных MAX-фаз. Связь M–A относительно слабая. Таким образом, атомы Al в Ti3AlC2 наиболее реакционноспособны, и их можно удалить из структуры Ti3AlC2 [8]. Нагиб и соавторы недавно показали, что слои Al можно селективно вытравить путем погружения порошков Ti3AlC2 в 50%-ный раствор HF при комнатной температуре на 2 ч в соответствии со следующей реакцией [8]:
Ti3C2 образует двумерную слоистую структуру, обладающую характеристиками, средними между металлом и керамикой. MXene-соединения рассматривались в качестве электродов в аккумуляторах энергии, поскольку они обладают хорошими электрическими свойствами [9, 10]. Их также применяли для иммобилизации Pt-наночастиц при разработке катализатора для топливных элементов [11]. Первый отчет о применении иммобилизованного ферментом MXene-соединения в качестве биосенсора был опубликован Ваном и соавторами в 2013 г. [12]. Был синтезирован материал на основе Ti3C2 (MXene-Ti3C2), который затем использовали для иммобилизации гемоглобина (Hb) для изготовления безмедиаторного биосенсора [12]. Вследствие большой площади поверхности и высокой проводимости MXene–Ti3C2 облегчается прямой перенос электрона, и изготовленные биосенсоры демонстрировали хорошие результаты при определении нитрита [12]. Недавно Сюй и соавторы изготовили новый микроразмерный полевой транзистор на основе MXene-соединения (Ti3C2) и использовали его для определения допамина на микроуровне [13].
Было синтезировано несколько новых MXene-соединений путем замены элементов M или X. Один из методов синтеза новых MXene-соединений с желаемыми свойствами – частичное замещение элемента Ti другим подходящим элементом, таким как V, Cr, Nb или Ta [4]. Нагиб и соавторы впервые сообщили о синтезе (Ti0.5V0.5)3AlC2 в 2014 г. [5]. Они смешивали порошки Ti, V, Al и C (все с дисперсностью 45 мкм) путем их перетирания в течение 18 ч в пластиковом сосуде, а затем прокаливали смешанный порошок при 1450°C в течение 2 ч в атмосфере Ar в трубчатой печи.
В данной работе мы изготовили (Ti0.5V0.5)3AlC2 с применением метода, описанного Нагибом [5]. Соответствующее MXene-соединение (Ti0.5V0.5)3C2 получено путем вымачивания (Ti0.5V0.5)3AlC2 в растворе 40% HF, а затем были изучены его электрокаталитические свойства в реакции окисления лекарственного препарата – пропранолола. Пропранолол или 1-(изопропиламино)-3-(1-нафтилокси)-2-пропанол (схема 1) – широко применяемый β-блокатор, используемый при различных сердечно-сосудистых заболеваниях, таких как гипертензия, сердечные аритмии, стенокардия, инфаркт миокарда и тревожность. Применение этого лекарства было запрещено в некоторых видах спорта, поскольку оно замедляет сердечный ритм, ослабляет тремор и улучшает показатели в тех видах спорта, которые не требуют значительных физических усилий, таких как стрельба. Таким образом, весьма актуальна разработка надежного, чувствительного и недорогого метода определения пропранолола в лекарствах, клинических препаратах и еде.
Схема 1. Химическая структура пропранолола.
До сих пор сообщалось о нескольких методах определения пропранолола, включая спектрофотометрию, хроматографию и хемилюминесценцию [14–21]. Эти методы времязатратны и требуют больших усилий для предварительной подготовки образцов. Были попытки применения вольтамперометрии для непосредственного определения пропранолола, однако селективность и чувствительность измерений были низкими из-за высокого перенапряжения реакции окисления пропранолола на немодифицированных электродах, таких как стеклоуглерод. Можно снизить перенапряжение при использовании электрокатализатора, что приводит к улучшению чувствительности и селективности [22–29].
В этой работе (Ti0.5V0.5)3C2 впервые применяется для изготовления модифицированного угольного пастового электрода и показано, что модифицированный электрод демонстрирует хорошую электрокаталитическую активность при определении пропанолола. Известно, что MXene-материалы благодаря их высокой стабильности, хорошей проводимости и способности катализировать редокс-реакции органических веществ являются хорошими кандидатами для изготовления модифицированных электродов для ускорения редокс-реакций, протекающих при высоких перенапряжениях.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Химические вещества и реагенты
Все химические вещества произведены компанией Merck и имеют квалификацию “ч. д. а.”. Все растворы готовили на дважды дистиллированной воде. Маточный раствор готовили путем растворения пропранолола в дважды дистиллированной воде и хранили в холодильнике вдали от света. Рабочие растворы готовили каждый день путем разведения маточного раствора буферным раствором Бриттона–Робинсона с pH 7.0. Коммерческие фармацевтические образцы пропранолола гидрохлорида (таблетки с 20 мг действующего вещества) были изготовлены компанией DaruPakhsh Pharmaceutical Co. (Иран), приобретены в местной аптеке и использованы без дополнительной очистки.
Синтез (Ti0.5V0.5)3AlC2
Исходными материалами были титан (Ti), ванадий (V), графит (С) и алюминий (Al) производства компании Merck. Ti, V, Al и C в соотношении 1.5 : 1.5 : 1.1 : 1.9 смешивали в шаровой мельнице с шарами диаметром 3 мм. Алюминий использовали в количестве, превышающем стехиометрическое, для обеспечения наличия жидкой фазы с целью ускорения реакции во время прокаливания. Графит использовали в количестве менее стехиометрического для предотвращения формирования TiC. Полученный порошок прокаливали при 1250, 1300, 1350 и 1400°C в течение 20 мин в атмосфере аргона.
Синтез (Ti0.5V0.5)3C2
Синтезированные частицы (Ti0.5V0.5)3AlC2 диспергировали в растворе 40% HF в течение 20 ч для удаления слоев Al. Суспензию центрифугировали для отделения синтезированного порошка MXene-соединения ((Ti0.5V0.5)3C2) с последующим промыванием порошка несколько раз дистиллированной водой.
Оборудование
Дифрактограммы регистрировали при помощи рентгеновского дифрактометра Philips X’Pert Pro с применением CuKα-излучения (Ni-фильтр). Изображения со сканирующего электронного микроскопа (СЭМ) получали при помощи прибора Tescan. Вольтамперометрическое исследование осуществляли с применением электрохимической системы Autolab PGSTAT 302N (Eco Chemie) с использованием стандартной трехэлектродной ячейки с Ag/AgCl (нас.)-электродом сравнения, платиновым стержнем в качестве противоэлектрода и угольного пастового электрода в качестве рабочего электрода. Эксперименты методом электрохимического импеданса (EIS) выполняли при помощи измерителя частотных характеристик Autolab (AUT20. FRA2- AUTOLAB, Eco Chemie, B.V., Нидерланды) в диапазоне частот от 100 мГц до 1 МГц при амплитуде переменного тока 10 мВ.
Изготовление немодифицированного и модифицированного угольного пастового электрода
Немодифицированный угольный пастовый электрод получали путем смешения графитового порошка и жидкого парафина в ступке в весовом соотношении 4 : 1 в течение 3 ч. Этой пастой заполняли тефлоновую трубку, затем использовали медный стержень в качестве проводника и для спрессовывания данной пасты. Модифицированную угольную пасту изготавливали тем же способом; паста состояла из 5–20 вес. % (Ti0.5V0.5)3C2 в качестве модификатора, графита и жидкого парафина.
Электрохимические исследования
Характеризацию при помощи циклической вольтамперометрии и электрохимической импедансной спектроскопии немодифицированного и модифицированного угольного пастового электрода осуществляли в 5.0 мМ [Fe(CN)6]3–/[Fe(CN)6]4– в 0.50 М KCl. Пропранолол определяли при помощи дифференциальной импульсной вольтамперометрии (DPV). Амплитуда импульса и скорость развертки составляли 50 мВ и 25 мВ/с.
Аналитические зависимости получали путем добавления небольших объемов концентрированных стандартных растворов пропранолола. Дифференциальные импульсные вольтамперограммы получали для образца и добавления каждой аликвоты в оптимизированных условиях. После каждого добавления раствор перемешивали для гомогенизации образца, затем останавливали перемешивание на несколько секунд и фиксировали DPV. Аналитические параметры сравнивали и использовали наилучшие результаты для количественного определения пропранолола в коммерческих образцах. Оценочный предел обнаружения составлял 3Sb/m, где Sb – стандартное отклонение в фоновом растворе (n = 5), а m – наклон аналитической кривой. Для исследований реальных образцов, изготовленных из таблеток, добавляли аликвоту стандартного раствора аналита.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 показаны дифрактограммы образцов, прокаленных при различных температурах. В соответствии с единственным предыдущим сообщением о синтезе (Ti0.5V0.5)3AlC2 [5] пики при 2θ = 9.8°, 19.8°, 22.7°, 34.4° и 39.2° относятся к (Ti0.5V0.5)3AlC2. Пик при 2θ = 35.6° показывает, что помимо (Ti0.5V0.5)3AlC2 также формируется небольшое количество TiC. Для изучения морфологии образца, приготовленного при 1400°C, использовали СЭМ.
Рис. 1.
Дифрактограммы порошкообразной смеси Ti,V/Al/C, прокаленной при: а – 1250, б – 1300, в – 1350 и г – 1400°C в течение 20 мин.

Как видно из рис. 2, (Ti0.5V0.5)3AlC2 состоит из наночешуйчатых структур (объективная характеристика MAX-фаз), а тонкий срез показывает типичный вид слоистого тройного соединения Ti3AlC2 [4].
Рис. 2.
СЭМ-изображения микроструктуры образцов, прокаленных при 1400°C (время прокаливания – 20 мин) до обработки в HF.

Для удаления слоев Al порошки (Ti0.5V0.5)3AlC2 погружали в 40%-ный раствор HF при комнатной температуре на 20 ч. Полученную суспензию центрифугировали для отделения порошков, а затем промывали несколько раз деионизованной водой. Морфологию и структуру порошка после обработки HF охарактеризовывали при помощи рентгенодифракционного анализа и СЭМ (рис. 3). После удаления Al из промежутков между слоями (Ti0.5V0.5)3AlC2 расслаивали и получали MXene-соединение (Ti0.5V0.5)3C2 с низким содержанием примеси TiC. Сравнение результатов рентгенодифракционного анализа до и после обработки HF показывает, что основные пики (Ti0.5V0.5)3AlC2 сдвигаются в сторону меньших углов в случае (Ti1.5V1.5)C2, расширяются, и их интенсивность снижается, что говорит об успешном синтезе соответствующего MXene-соединения [12].
Рис. 3.
СЭМ-изображение образца, прокаленного при 1400°C (время прокаливания 20 мин) после обработки в HF в течение 20 ч (а). Дифрактограммы образцов (Ti0.5V0.5)3AlC2 и (Ti0.5V0.5)3C2 (б).

Для исследования характеристик модифицированного угольного пастового электрода изготавливали несколько электродов с 5, 10 и 15% (Ti0.5V0.5)3C2 и сравнивали с немодифицированным угольным электродом. Свежеприготовленные электроды погружали в раствор 5 мМ [Fe(CN)6]3–/[Fe(CN)6]4– + 0.5 М KCl. Как видно на рис. 4а, высота редокс-пиков реакции ферроцианида–феррицианида возрастает, а разность потенциалов пиков окисления и восстановления снижается при повышении содержания модификатора. Эти эффекты свидетельствуют, что электроды, модифицированные MXene-соединениями, обладают лучшими характеристиками, чем немодифицированный электрод. Возрастание тока в пике может быть связано с повышением эффективной площади поверхности электрода вследствие добавления Mxene-соединения с большой площадью поверхности, а уменьшение разности потенциалов пиков окисления и восстановления связано с ростом обратимости переноса электрона на электродах, модифицированных Mxene-соединениями, по мере увеличения содержания (Ti0.5V0.5)3C2. Для исследования граничного поведения электрода, погруженного в раствор 5 мМ [Fe(CN)6]3– + 0.5 М раствор KCl, при +0.15 В, использовали электрохимическую импедансную спектроскопию (рис. 4б). Эти спектры включают полуокружность при более высоких частотах, что связано с кинетическим контролем переноса заряда, и линейный элемент Варбурга при более низких частотах, что указывает на контролирующую стадию диффузионного массопереноса. Как видно из рисунка, диаметр полуокружностей снижается с увеличением содержания (Ti0.5V0.5)3C2, что означает повышение скорости переноса заряда на поверхности Mxene-модифицированных электродов.
Рис. 4.
Циклические вольтамперограммы (а) чистого угольного пастового электрода (1) и модифицированного электрода с различным весовым содержанием (Ti0.5V0.5)3C2: 5% (2), 10% (3) и 15% (4) в растворе 5.0 мМ [Fe(CN)6]3–/[Fe(CN)6]4– + 0.5 М KCl при скорости развертки 0.05 В с–1. Соответствующие годографы импеданса в том же растворе при +0.15 В (б).

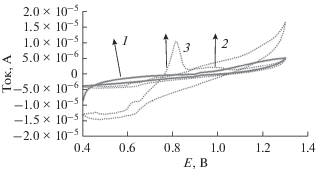
Исследование методом циклической вольтамперометрии осуществляли в растворе 5 × 10–6 M пропранолола в буфере Бриттона–Робинсона (pH 7.0) в диапазоне 0.4–1.3 В (отн. Ag/AgCl) на немодифицированном и модифицированном Mxene-соединением угольном пастовом электроде. Результаты показаны на рис. 5. Как можно видеть, на модифицированном электроде в фоновом электролите (кривая 1) отсутствуют пики окисления или восстановления в исследованном окне потенциалов. В присутствии пропранолола на немодифицированном электроде появляется широкий слабый пик при потенциале около 0.94 В, связанный с окислением пропранолола, тогда как на угольном пастовом электроде, модифицированном Mxene-соединением, имеется сильный пик при 0.83 В. Появление сильного пика окисления при меньшем потенциале связано с более легким окислением пропранолола на поверхности модифицированного электрода. Очевидно, реакцию электроокисления пропранолола на поверхности модифицированного электрода в значительной мере катализирует (Ti0.5V0.5)3C2. Можно считать, что на поверхности электрода окисляются обе функциональные группы OH- и NH-пропранолола. Однако, как следует из механизма, описанного в литературе, представляется, что более вероятная реакция, связанная с OH-группой, следующая [24, 27]:
Рис. 5.
Циклические вольтамперограммы электрода, модифицированного MXene, в фоновом растворе Бриттона–Робинсона (1), чистом угольном пастовом электроде (2) и электрода, модифицированного Mxene (3), в буферном растворе Бриттона–Робинсона (pH 7.0) с добавкой 5 × 10–6 M пропранолола в диапазоне 0.4–1.3 В. Скорость развертки 0.05 В/с.
Для изучения влияния pH были проведены измерения DPV в буферном растворе Бриттона–Робинсона в диапазоне 0.0–1.3 В для 5 × 10–6 M пропранолола при варьировании pH от 5 до 9. Максимальный пик тока зафиксирован при pH 7.0 (рис. 6). Потенциал пика окисления группы OH при возрастании pH сдвигается к меньшим значениям, что обусловлено образованием протонов в реакции окисления пропранолола. На рис. 7 приведена кривая зависимости Ep от pH. Пик окисления линейно снижается с ростом pH с наклоном –0.051; это означает, что число участвующих в электрохимической реакции окисления электронов и протонов одинаково.
Рис. 6.
Данные DPV в буферном растворе Бриттона–Робинсона с добавкой 5 × 10–6 M пропранолола и pH 5–9 в диапазоне потенциалов 0.0–1.3 В.

На рис. 8 показано влияние весового содержания (Ti0.5V0.5)3C2 (5–20%) на ток пика окисления. Ток пика окисления 5 × 10–6 M пропранолола быстро возрастает при увеличении содержания (Ti0.5V0.5)3C2 в композитном электроде от 5 до 15%, после чего рост тока пика замедляется, что может быть обусловлено уменьшением числа активных участков на композитном электроде, доступных электроактивным молекулам аналита.
Рис. 8.
Влияние концентрации (Ti0.5V0.5)3C2 (5–2 вес. %) на ток пика окисления. Токи пиков окисления были получены в измерениях методом DPV (амплитуда импульса 50 мВ, скорость развертки 25 мВ/с) в буферном растворе Бриттона–Робинсона с pH 7.0 с добавкой 5 × 10–6 M пропранолола.

Для определения концентрации пропранолола использовали пик окисления, полученный в экспериментах DPV. На рис. 9 и 10 показаны вольтамперограммы и аналитическая кривая образцов с различной концентрацией пропранолола в буферном растворе Бриттона–Робинсона с pH 7. Ток в пике окисления пропранолола на модифицированном электроде (Ep = +0.83 В) линейно изменяется с концентрацией в интервале 0.5–5 мкМ пропранолола (уравнение (1)):
(1)
$\begin{gathered} {{I}_{{\text{p}}}} = 6.0 \times {{10}^{{--6}}}\left[ {{\text{п р о п р а н о л о л }}} \right]--4.0{\text{ }} \times {\text{ }}{{10}^{{--7}}}, \\ {{r}^{2}} = {\text{ }}0.996. \\ \end{gathered} $Рис. 9.
Вольтамперограмма образцов с различной концентрацией пропранолола в буферном растворе Бриттона–Робинсона при pH 7.0. Снизу вверх концентрации пропранолола: 0.0, 0.5, 2.0, 3.0, 3.5, 4.0 и 5.0 мкМ. Стрелки указывают на увеличение тока, отвечающего росту концентрации аналита. Амплитуда импульса 50 мВ; скорость развертки 25 мВ/с.
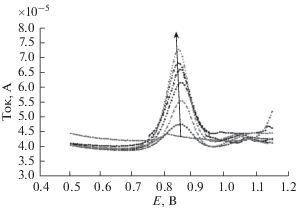
Рис. 10.
Аналитическая кривая образцов с различной концентрацией пропранолола в буферном растворе Бриттона–Робинсона при pH 7.0.

Предел обнаружения и относительное стандартное отклонение для n = 5 составляли 0.16 мкМ и 4% соответственно. Для проверки точности предлагаемого метода в случае реальных образцов использовали таблетку с дозировкой 20 мг пропранолола. Определенное количество пропранолола растворяли в буферном растворе Бриттона–Робинсона с pH 7 для изготовления 2 мкМ раствора пропранолола. Результаты анализа дали концентрацию 18.8 мг в каждом таблетке, что хорошо согласуется с фактической концентрацией (20 мг в таблетке).
ЗАКЛЮЧЕНИЕ
В настоящей работе был успешно синтезирован материал (Ti0.5V0.5)3AlC2 путем отжига при 1400°C порошка из смеси компонентов с последующим протравливанием фазы MAX в растворе 40% HF для получения соответствующего MXene-соединения. Фазы MAX и MXene были охарактеризованы методами СЭМ и рентгенодифракционного анализа. С использованием полученного MXene-соединения был разработан высокочувствительный модифицированный (Ti0.5V0.5)3C2 угольный пастовый электрод для определения пропранолола в фармацевтическом препарате в нейтральном растворе. Несколько модифицированных и немодифицированных электродов было использовано для измерения содержания пропранолола в сильнокислом и сильнощелочном растворе [31]. Хотя и в этих средах возможно обеспечить низкий предел обнаружения, применимость сенсора для анализа реальных образцов ограничена, поскольку пропранолол нестабилен в кислом растворе и недостаточно протонирован для формирования катионов при более высоких значениях pH [31]. Таким образом, для электрохимического определения пропранолола предпочтительными являются нейтральные растворы. Модифицированный электрод позволяет определять пропранолол при концентрации вплоть до 1.6 × 10−7 M, что меньше или сравнимо со многими опубликованными ранее результатами (табл. 1).
Таблица 1.
Сравнение некоторых литературных данных по определению пропранолола, полученных ранее утвержденными методами, с результатами настоящей работы*
| Электрод | Модификатор | Использованный метод | Среда для измерения | Предел обнаружения, мкМ | Линейный динамический диапазон, мкМ | Ссылка |
|---|---|---|---|---|---|---|
| CPE | – | DPV | Буферный
раствор BR, pH 2.0 |
0.2 | 0.6–50 | [25] |
| Допированный бором алмаз | – | SWV | H2SO4, 0.1 моль/л | 0.18 | 0.2–9 | [23] |
| GCE | – | DPV | Буферный
раствор BR, pH 3.0 |
1.37 | 4.32–135 | [28] |
| CPE | CuO NP | DPV | Буферный
раствор BR, pH 10.0 |
2.91 | 10–104 | [22] |
| CPE | МСУНТ–циклодекстрин | DPAdSV | Буферный
раствор BR, pH 1.5 |
0.04 | 0.14–47.6 | [27] |
| Силиконовая резина | МСУНТ | SWV | Буферный
раствор BR, pH 7.0 |
0.078 | 0.3–5.4 | [24] |
| GCE | МСУНТ/8-гидрокси-8-пропоксикаликс [8]арен | DPV | PBS, pH 7.0 | 0.14 | 0.34–54.1 | [26] |
| – | – | SPE LC/MS | Метанол/вода (80 : 20) | 50 пг/мл | 0.2–135 нг/мл | [21] |
| – | – | Фосфорометрический анализ | 0.1 М сульфит натрия | 14.14 нг/мл | 0.0–500 нг/мл | [30] |
| CPE | (Ti0.5V0.5)3C2 | DPV | Буферный раствор BR, pH 7.0 | 0.16 | 0.5–5.0 | Настоящая работа |
* CPE: угольный пастовый электрод, DPV: дифференциальная импульсная вольтамперометрия, GCE: стеклоуглеродный электрод, SWV: квадратно-волновая вольтамперометрия, SPE: твердофазная экстракция, LC/MS: жидкостная хроматография/масс-спектрометрия, BR: буферный раствор Бриттона–Робинсона, DPAdSV: дифференциально-импульсная адсорбционная инверсионная вольтамперометрия, NP: наночастицы.
Список литературы
Barsoum, M.W., The Mn+ 1AXn Phases: A New Class of Solids; Thermodynamically Stable Nanolaminates. Prog. Solid State Chem., 2000, vol. 28, p. 201; Naguib, M., Mochalin, V.N., Barsoum, M.W., and Gogotsi, Y., MXenes: A New Family of Two-Dimensional Materials. Adv. Mat., 2014, vol. 26, p. 992.
Eklund, P., Beckers, M., Jansson, U., Högberg, H., and Hultman L., The Mn+ 1AXn phases: Materials science and thin-film processing. Thin Solid Films, 2010, vol. 518, p. 1851.
Khazaei, M., Arai, M., and Sasaki, T., Novel Electronic and Magnetic Properties of Two-Dimensional Transition Metal Carbides and Nitrides. Adv. Funct. Mater., 2012, vol. 23, p. 2185.
Lei, J.C., Zhang, X., and Zhou, Z., Recent advances in MXene: Preparation, properties, and applications. Front. Phys., 2015, vol. 10, p. 107303:1.
Naguib, M., Bentzel, G.W., and Shah, J., New Solid Solution MAX Phases: (Ti0.5V0.5)3AlC2, (Nb0.5V0.5)2AlC, (Nb0.5V0.5)4AlC3 and (Nb0.8Zr0.2)2AlC. Mater. Res. Lett., 2014, p. 1.
Naguib, M., Mashtalir, O., and Carle, J., Two-Dimensional Transition Metal Carbides. ACS Nano, 2012, vol. 6, p. 1322.
Kuchida, S., Muranaka, T., and Kawashima, K., Superconductivity in Lu2SnC. Physica C, 2013, vol. 494, p. 77.
Naguib, M., Dyatkin, B., Gogotsi, Y., and Barsoum, M.W., Kinetics of aluminum extraction from Ti3AlC2 in hydrofluoric acid. Mater. Chem. Phys., 2013, vol. 139, p. 147.
Come, J., Naguib, M., and Rozier, P., A non-aqueous asymmetric cell with a Ti2C-based two-dimensional negative electrode, J. Electrochem. Soc., 2012, vol. 159, p. A1368.
Hu, J., Xu, B., and Ouyang, C., Investigations on V2C and V2CX2 (X = F, OH) monolayer as a promising anode material for Li ion batteries from first principles calculations. J. Phys. Chem. C, 2014, vol. 118, p. 24274.
Xie, X., Chen, S., and Ding, W., An extraordinarily stable catalyst: Pt NPs supported on two-dimensional Ti3C2X2 (X = OH, F) nanosheets for oxygen reduction reaction. Chem. Commun. 2013, vol. 49, p. 10112.
Wang, F., Yang, C.H., and Duan, C.Y., An organ-like titanium carbide material (MXene) with multilayer structure encapsulating hemoglobin for a mediator-free biosensor. J. Electrochem. Soc., 2015, vol. 162, p. B16; Liu, H., Duan, C., and Yang, C., A novel nitrite biosensor based on the direct electrochemistry of hemoglobin immobilized on MXene-Ti3C2. Sens. Actuat. B, 2015, vol. 218, p. 60.
Xu, B., Zhu, M., and Zhang, W., Ultrathin MXene micrcropattern-Based Field-Effect Transistor for Probing Neural Activity. Adv Mater., 2016, vol. 28, p. 3333.
El-Ries, M.A., AbouAttia, F.M., and Ibrahim, S.A., AAS and spectrophotometric determination of propranolol HCl and metoprolol tartrate. J. Pharm. Biomed. Anal., 2000, vol. 24, p. 179.
Vignaduzzo, S.E., Maggio, R.M., Castellano, P.M., and Kaufman, T.S., PLS and first derivative of ratio spectra methods for determination of hydrochlorothiazide and propranolol hydrochloride in tablets. Anal. Bioanal. Chem., 2006, vol. 386, p. 2239.
Aminot, Y., Litrico, X., and Chambolle, M., Development and application of a multi-residue method for the determination of 53 pharmaceuticals in water, sediment, and suspended solids using liquid chromatography-tandem mass spectrometry. Anal. Bioanal. Chem., 2015, vol. 407, p. 8585.
Boonjob, W., Sklenářová, H., and Lara, F.J., Retention and selectivity of basic drugs on solid-phase extraction sorbents: Application to direct determination of β‑blockers in urine. Anal. Bioanal. Chem., 2014, vol. 406, p. 4207.
Junior, J.M.M., Muller, A.L.H., and Foletto, E.L., Determination of Propranolol Hydrochloride in Pharmaceutical Preparations Using Near Infrared Spectrometry with Fiber Optic Probe and Multivariate Calibration Methods. J. Anal. Methods Chem., 2015, vol. 2015, p. 1.
He, Y., Chai, X.J., and Zeng, S., Reversed-phase high-performance liquid chromatographic analysis of seven pairs of chiral drug enantiomers in transport medium after chiral derivatization. J. Chin. Pharm. Sci., 2010, vol. 19, p. 104.
Marques, K.L., Santos, J.L.M., and Lima, J.L.F.C., Chemiluminometric determination of propranolol in an automated multicommutated flow system. J. Pharm. Biomed. Anal., 2005, vol. 39, p. 886.
Partani, P., Modhave, Y., and Gurule, S., Simultaneous determination of propranolol and 4-hydroxy propranolol in humanplasma by solid phase extraction and liquid chromatography/electrospraytandem mass spectrometry. J. Pharm. Biomed. Anal. 2009, vol. 50, p. 966.
Shadjou, N., Hasanzadeh, M., and Saghatforoush, L., Electrochemical behavior of atenolol, carvedilol and propranolol on copper-oxide nanoparticles. Electrochim. Acta, 2011, vol. 58, p. 336.
Sartori, E.R., Medeiros, R.A., Rocha-Filho, R.C., and Fatibello-Filho, O., Square wave voltammetric determination of propranolol and atenolol in pharmaceuticals using boron doped diamond electrode. Talanta, 2010, vol. 81, p. 1418.
Santos, S.X., Cavalheiro, E.T.G., and Brett, C.M.A., Analytical Potentialities of Carbon Nanotube/Silicone Rubber Composite Electrodes: Determination of Propranolol. Electroanalysis, 2010, vol. 22, p. 2776.
Radi, A., Wassel, A.A., and El Ries, M.A., Adsorptive behavior and voltammetric analysis of propranolol at carbon paste electrode. Chem. Anal. (Warsaw), 2004, vol. 49, p. 51.
Kun, Z., Shuai, Y., Dongmei, T., and Yuyang, Z., Electrochemical behavior of propranolol hydrochloride in neutral solution on calixarene/multi-walled carbon nanotubes modified glassy carbon electrode. J. Electroanal. Chem., 2013, vol. 709, p. 99.
Gaichore, R.R. and Srivastava, A.K., Electrocatalytic determination of propranolol hydrochloride at carbon paste electrode based on multiwalled carbon-nanotubes and c-cyclodextrin. J. Incl. Phenom. Macrocycl. Chem., 2014, vol. 78, p. 195.
Baranowska, I. and Koper, M., Electrochemical behavior of propranolol and its major metabolites, 40-hydroxypropranolol and 40-hydroxypropranolol sulfate, on glassy carbon electrode. J. Braz. Chem. Soc., 2011, vol. 22, p. 1601.
Gurtova, O., Ye, L., and Chmilenko, F., Potentiometric propranolol-selective sensor based on molecularly imprinted polymer. Anal. Bioanal. Chem., 2013, vol. 405, p. 287.
Canabate Diaz, B., Cruces Blanco, C., Segura Carretero, A., and Fernandez Gutierrez, A., Simple determination of propranolol in pharmaceutical preparations by heavy atom induced room temperature phosphorescence. J. Pharm. Biomed. Anal., 2002, vol. 30, p. 987.
Kun, Z., Yi, H., Chengyun, Z., Yue, Y., Shuliang, Z., and Yuyang, Z., Electrochemical behavior of propranolol hydrochloride in neutral solution on platinum nanoparticles doped multi-walled carbon nanotubes modified glassy carbon electrode. Electrochim. Acta, 2012, vol. 80, p. 405.
Дополнительные материалы отсутствуют.





