Электрохимия, 2019, T. 55, № 10, стр. 1276-1280
Синтез и ионная проводимость NaZr2(AsO4)x(PO4)3 – x
В. И. Петьков a, *, А. С. Шипилов a, **, Е. Ю. Боровикова b, И. А. Стенина c, А. Б. Ярославцев b, c
a Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Московский государственный университет им. М.В. Ломоносова
Москва, Россия
c Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: petkov@inbox.ru
** E-mail: as-shipilov@yandex.ru
Поступила в редакцию 01.03.2019
После доработки 01.03.2019
Принята к публикации 10.05.2019
Аннотация
Арсенат-фосфаты NaZr2(AsO4)x(PO4)3 –x получены золь–гель-методом с последующим обжигом при 1123 К и исследованы с помощью рентгенофазового анализа, ИК- и импедансной спектроскопии. В системе NaZr2(AsO4)x(PO4)3 –x образуется неограниченный твердый раствор (0 ≤ x ≤ 3) со структурой NaZr2(PO4)3 (NASICON). Согласно данным импедансной спектроскопии увеличение содержания мышьяка в системе NaZr2(AsO4)x(PO4)3 –x приводит к повышению натрий-ионной проводимости, которая для NaZr2(AsO4)3 достигает 8 × 10–5 См/см при 773 K. В то же время энергия активации проводимости этого материала (50 ± 1 кДж/моль) оказывается вдвое ниже энергии активации проводимости NaZr2(PO4)3 (100 ± 1 кДж/моль).
ВВЕДЕНИЕ
Идея создания литий-ионных аккумуляторов была предложена менее полувека назад. Но в настоящий момент жизнь современного человека уже невозможна без этих устройств, которые благодаря высокой удельной энергоемкости и надежности стали незаменимыми при энергоснабжении практически всех портативных устройств [1, 2]. В последние годы бурное распространение получает альтернативная энергетика, которая выгодно отличается экологической безопасностью. При этом в первую очередь речь идет о солнечных батареях и ветрогенераторах [3]. Однако генерация энергии с их помощью неизбежно связана с провальными периодами, что приводит к необходимости использования систем аккумулирования энергии [4, 5]. Когда речь заходит о внедрении таких систем в большую энергетику возможности литий-ионных аккумуляторов ставятся под сомнение в связи с высокой стоимостью лития и ограниченностью его ресурсов [6, 7]. В связи с этим перед исследователями стоит задача разрабатывать эффективные натрий-ионные батареи с высокой емкостью и материалы для них [8–15].
Если речь идет о жидких электролитах, то большинство работ посвящено использованию растворов солей натрия в апротонных растворителях [16–19]. В то же время значительное внимание уделяется разработке твердых электролитов с натриевой проводимостью для создания полностью твердотельных аккумуляторов, отличающихся высокой надежностью [20–25]. В литературе представлены исследования по проводимости ионов натрия в соединениях и твердых растворах, основанных на каркасной структуре NASICON [26, 27]. Максимальной проводимости удается добиться при гетеровалентном замещении фосфора на кремний (Na3Zr2(SiO4)2PO4), сопровождающимся повышением концентрации натрия в междоузлиях [28].
Величина ионной проводимости определяется произведением концентрации носителей на их подвижность. Для повышения концентрации носителей обычно используют гетеровалентное допирование, в то время как величина ионной подвижности обычно связана с размером проводящих каналов [29]. Исследования проводимости по ионам натрия показали положительную динамику при увеличении размеров проводящих каналов. Так наибольшую проводимость в ряду фосфатов состава Na3L2(PO4)3 (L = Sc, Cr, Fe, In) проявляет Na3Sc2(PO4)3 [30]. С другой стороны Na3In2(PO4)3 имеет более низкую проводимость, чем фосфаты, включающие железо и хром, при большем объеме элементарной ячейки. Подобные противоречия демонстрируют необходимость изучения влияния размеров элементарной ячейки на проводимость по ионам натрия. На размер ячейки и проводящих каналов могут влиять анионные замещения фосфора на другие элементы. Так замещение фосфора, имеющего ионный радиус 0.17 Å, на мышьяк с радиусом 0.33 Å в системах LiZr2(AsO4)x(PO4)3 –x и Mg0.5Zr2(AsO4)x(PO4)3 –x со структурой SW (Sc2(WO4)3) показали различное влияние увеличения концентрации мышьяка на проводимость. В случае системы LiZr2(AsO4)x(PO4)3 –x [31] замещение фосфора на мышьяк позволяло достигать больших значений проводимости по сравнению с исходным фосфатом, что может быть связано как с разупорядочением решетки, а так же увеличением размеров проводящих каналов. В системе Mg0.5Zr2(AsO4)x(PO4)3–x, напротив, увеличение содержания мышьяка приводило к снижению проводимости во всей области твердых растворов [32].
В связи с этим целью данной работы являлись синтез арсенат-фосфатов состава NaZr2(AsO4)x(PO4)3 –x и исследование их ионной проводимости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения образцов NaZr2(AsO4)x(PO4)3 –x (0 ≤ x ≤ 3) стехиометрические количества 1 М водного раствора хлорида натрия и оксихлорида циркония ZrOCl2 сливали при постоянном перемешивании при комнатной температуре. Затем при перемешивании добавляли раствор мышьяковой и ортофосфорной кислот. Раствор мышьяковой кислоты готовили из элементарного мышьяка, путем его растворения при нагревании в растворе азотной и соляной кислот, взятых в соотношении 1 : 1 (по объему). Образовавшийся гель высушивали при 90°С, нагревали и выдерживали последовательно при 270, 600, 850°С в течение 12–24 ч на каждой стадии. Поэтапный нагрев чередовали с диспергированием для обеспечения гомогенизации смесей. После отжига при 600°С порошки смешивали с оксидом цинка (0.75 мас. %), способствующим увеличению скорости взаимодействия твердофазных реагентов за счет спекания [33], прессовали и подвергали дальнейшему отжигу.
Контроль химического состава и однородности образцов проводили на сканирующем электронном микроскопе JEOL JSM-7600F с термополевой электронной пушкой (катод Шоттки). Микроскоп оснащен системой микроанализа – энергодисперсионным спектрометром OXFORD X-Max 80 (Premium) с полупроводниковым кремний-дрейфовым детектором. Точность определения элементного состава образцов составляла 2 мол. %.
Рентгенограммы образцов записывали на дифрактометре Shimadzu XRD-6000 (CuKα-излучение, λ = 1.54178 Å, диапазон углов 2θ = 10°–50°, шаг сканирования 0.02°, скорость записи 1 град/мин). Рентгенофазовый анализ использовали для установления фазового состава образцов в процессе их получения после каждого этапа отжига и контроля однофазности полученных продуктов.
Ионную проводимость измеряли с помощью моста переменного тока ИПУ-62 в диапазоне частот 10 Гц–2 MГц с использованием цилиндрических прессованных таблеток (R = 5 мм, h = 2 мм) с платиновыми электродами в интервале температур 323−1033 K. Скорость нагрева составляла 2 К/мин. Величину проводимости рассчитывали экстраполяцией полуокружности объемной составляющей проводимости на ось активных сопротивлений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
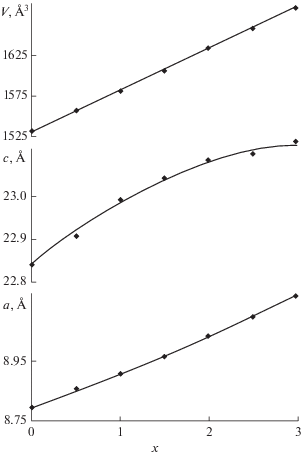
Согласно результатам РФА при температуре 850°С наблюдается кристаллизация однофазных образцов NaZr2(AsO4)x(PO4)3 –x со структурой NASICON. Рентгенограммы арсенат-фосфатов обнаруживают плавное смещение дифракционных максимумов с ростом значений х (рис. 1). На основании полученных рентгенограмм рассчитаны параметры элементарных ячеек для всех образцов системы. Увеличение содержания более крупного, по сравнению с фосфором, атома мышьяка приводило к монотонному увеличению параметров элементарных ячеек, что свидетельствует об образовании неограниченного ряда твердых растворов замещения (рис. 2). Отклонения зависимостей параметров ячейки от правила Вегарда обусловлены релаксацией каркаса структуры при постепенном замещении фосфора на мышьяк.
Рис. 1.
Рентгенограммы образцов NaZr2(AsO4)x(РO4)3 –x , где x = 0 (1), 0.5 (2), 1.0 (3), 1 (4), 2.0 (5), 2.5 (6), 3.0 (7).

ИК-спектры образцов твердого раствора NaZr2(AsO4)x(PO4)3 –x представлены на рис. 3. С увеличением содержания мышьяка появляются полосы колебаний иона ${\text{AsO}}_{4}^{{3 - }}$ при 876 и 500 см−1 и увеличивается их интенсивность. Одновременно полосы поглощения аниона ${\text{PO}}_{4}^{{3 - }}$ смещаются к меньшим частотам: высокочастотная полоса с максимумом при 1210 см−1 смещается на ∼100 см−1, наиболее интенсивная полоса νas-колебаний фосфорного иона смещается на 30 см−1 (1049 → 1020 см−1). Полосы деформационных νaδ‑колебаний также смещаются к меньшим частотам. С другой стороны, полосы колебаний аниона ${\text{AsO}}_{4}^{{3 - }}$ смещаются в область больших частот при уменьшении содержания мышьяка в составе промежуточных образцов. Плавное смещение полос колебаний анионов ${\text{PO}}_{4}^{{3 - }}$ и ${\text{AsO}}_{4}^{{3 - }}$ соответственно к меньшим и большим частотам также свидетельствует об образовании непрерывного твердого раствора замещения в ряду NaZr2(AsO4)x(PO4)3 –x.
Рис. 3.
ИК-спектры арсенат-фосфатов NaZr2(AsO4)x(PO4) 3 –x, где x = 0 (1), 0.5 (2), 1.0 (3), 1.5 (4), 2.0 (5), 2.5 (6), 3.0 (7).

Ионная проводимость твердого раствора NaZr2(AsO4)x(PO4)3 –x в области температур 423–773 K изменяется в соответствии с законом Аррениуса (рис. 4). При этом прослеживается четкая тенденция роста ионной проводимости с увеличением значения x. Одновременно в том же ряду существенно снижается величина энергии активации проводимости. Так для NaZr2(PO4)3 она составляет 100 ± 1 кДж/моль, а для NaZr2(AsO4)3 – 50 ± 1 кДж/моль. В фосфатах щелочных металлов и циркония со структурой NASICON миграция катионов обычно осуществляется по междоузлиям [34, 35]. В структуре NASICON на одну формульную единицу приходится одна позиция М1 и три позиции М2, в которых могут размещаться однозарядные катионы [30, 36]. Причем для структур типа NaZr2(AsO4)x(PO4)3 −x позиции М1, имеющие больший размер, заселяются предпочтительно и оказываются занятыми практически полностью. Поэтому перемещение натрия осуществляется посредством выхода однозарядных катионов в позиции М2, то есть по междоузельному механизму. Замещение фосфора на более крупный атом мышьяка приводит к росту объема ячейки и, как следствие, к увеличению размеров проводящих каналов, что облегчает миграцию достаточно крупных ионов натрия. Именно поэтому максимальная проводимость наблюдается у NaZr2(AsO4)3 и составляет 8 × 10−5 См/см при 773 K.
ЗАКЛЮЧЕНИЕ
Проведен синтез образцов NaZr2(AsO4)x(PO4)3 –x. Результаты РФА и ИК-спектроскопии свидетельствуют об образовании неограниченного твердого раствора со структурой типа NASICON. При изовалентном замещении P5+ → As5+ c увеличением x объем элементарной ячейки кристаллической структуры твердого раствора NaZr2(AsO4)x(PO4)3 –x возрастает в соответствии с тем, что ионный радиус As5+ (0.33 Å) существенно больше, чем для P5+ (0.17 Å). При этом увеличивается и ионная проводимость, а энергия ее активации, напротив, понижается вдвое.
Список литературы
Scrosati, B. and Garche, J., Lithium Batteries: Status, Prospects and Future, J. Power Sources, 2010, vol. 195, p. 2419.
Ярославцев, А.Б., Кулова, Т.Л., Скундин, А.М. Электродные наноматериалы для литий-ионных аккумуляторов. Успехи химии. 2015. Т. 84. № 8. С. 826. [Yaroslavtsev, A.B., Kulova, T.L., and Skundin, A.M., Electrode nanomaterials for lithium-ion batteries, Russ. Chem. Rev., 2015, vol. 84, no. 8, p. 826.]
Фортов, В.Е., Попель, О.С. Энергетика в современном мире, Долгопрудный: Издательский дом “Интеллект”, 2011. 168 с. [Fortov, V.E. and Popel, O.S., Energy in the modern world, Dolgoprudny: Publishing house “Intellect”, 2011, 168 p.]
Попель, О.С., Тарасенко, А.Б. Современные виды электрохимических накопителей электрической энергии и их применение в автономной и централизованной энергетике. Теплоэнергетика. 2011. № 11. С. 2. [Popel’, O.S. and Tarasenko, A.B., Modern kinds of electric energy storages and their application in independent and centralized power systems, Thermal Engineering, 2011, vol. 58, no. 11, p. 883.]
Yaroslavtsev, A.B., Stenina, I.A., Kulova, T.L., Skundin, A.M., and Desyatov, A.V., Nanomaterials for Electrical Energy Storage.// in Comprehensive nanoscience and nanotechnology. Second edition. Ed. Andrews D.L., Lipson R.H., Nann T. V.5 Application of nanoscience. Ed. Bradshaw D.S. Elsevier. Academic. Press. Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney, Tokio. 2019. p. 165.
Slater, M.D., Kim, D., Lee, E., and Johnson, C.S., Sodium ion batteries, Adv. Funct. Mat., 2013, vol. 23, p. 947.
Skundin, A.M., Kulova, T.L., and Yaroslavtsev, A.B., Sodium-Ion Batteries (a Review), Russ. J. Electrochem., 2018, vol. 54, p. 113.
Kim, S.W., Seo, D.H., Ma, X., Ceder, G., and Kang, K., Electrode Materials for Rechargeable Sodium-Ion Batteries: Potential Alternatives to Current Lithium-Ion Batteries, Adv. Energy Mater., 2012., vol. 2, p. 710.
Hong, S.Y., Kim, Y., Park, Y., Choi, A., Choi, N.S., and Lee, K.T., Charge carriers in rechargeable batteries: Na ions vs. Li ions, Energy Environ. Sci., 2013, vol. 6, p. 2067.
Hueso, K.B., Armand, M., and Rojo, T., High Temperature Sodium Batteries: Status, Challenges and Future Trends, Energy Environ. Sci., 2013, vol. 6, p. 734.
Ellis, B.L. and Nazar, L.F., Sodium and sodium-ion energy storage batteries, Curr. Op. Solid St. M., 2012, vol. 16, no. 4, p. 168.
Jian, Z., Han, W., Lu, X., Yang, H., Hu, Y.-S., Zhou, J., Zhou, Z., Li, J., Chen, W., Chen, D., and Chen, L., Superior Electrochemical Performance and Storage Mechanism of Na3V2(PO4)3 Cathode for Room-Temperature Sodium-Ion Batteries, Adv. Energy Mater., 2013, vol. 3, no. 2, p. 156.
Senguttuvan, P., Rousse, G., Seznec, V., Tarascon, J.-M., and Palacin, M.R., Na2Ti3O7: Lowest voltage ever reported oxide insertion electrode for sodium ion batteries, Chem. Mater., 2011, vol. 23, no. 18, p. 4109.
Kim, S. W., Seo, D.H., Ma, X., Ceder, G., and Kang, K., Electrode materials for rechargeable sodium-ion batteries: potential alternatives to current lithium-ion batteries, Adv. Energy Mater., 2012. vol. 2, p. 710.
Yabuuchi, N., Kubota, K., Dahbi, M., and Komaba, S., Research development on sodium-ion batteries, Chem. Rev., 2014, vol. 114, no. 23, p. 11636.
Ponrouch, A., Marchante, E., Courty, M., Tarascon, J.-M., and Palacín, M.R., In search of an optimized electrolyte for Na-ion batteries, Energy Environm. Sci., 2012, vol. 5, p. 8572.
Monti, D., Jónsson, E., Palacín, M.R., and Johansson, P., Ionic liquid based electrolytes for sodium-ion batteries: Na+ solvation and ionic conductivity, J. Power Sources, 2014, vol. 245, p. 630.
Noor, S.A.M., Yoon, H., Forsyth, M., and MacFarlane, D.R., Gelled ionic liquid sodium ion conductors for sodium batteries, Electrochim. Acta, 2015, vol. 169, p. 376.
Sawicki, M. and Shaw, L.L., Advances and challenges of sodium ion batteries as post lithium ion batteries, RSC Adv., 2015, vol. 5, p. 53129.
Onchi, T., A material design on new sodium ion conductor for sodium–sulfur battery. I. NaAlO(CN)2 and NaxAl1 –x/3(CN)3 perovskite, Quantum Chem., 2012, vol. 112, p. 3777.
Hayashi, A., Noi, K., Tanibata, N., Nagao, M., and Tatsumisago, M., High sodium ion conductivity of glass–ceramic electrolytes with cubic Na3PS4, J. Power Sources, 2014, vol. 258, p. 420.
Smaha, R.W., Roudebush, J.H., Herb, J.T., Seibel, E.M., Krizan, J.W., Fox, G.M., Huang, Q., Arnold, C.B., and Cava, R.J., Tuning Sodium Ion Conductivity in the Layered Honeycomb Oxide Na3 –xSn2 –xSbxNaO6, Inorg. Chem., 2015, vol. 54, p. 7985.
Hibi, Y., Tanibata, N., Hayashi, A., and Tasumisago, M., Preparation of sodium ion conducting Na3PS4–NaI by a mechanochemical technique, Solid State Ionics, 2015, vol. 270, p. 6.
Peet, J.R., Widdifield, C.M., Apperley, D.C., Hodgkinson, P., Johnson, M.R., and Radosavljević, Evans I., Na+ mobility in sodium strontium silicate fast ion conductors, Chem. Commun., 2015, vol. 51, p. 17163.
Ярославцев, А.Б. Основные направления разработки и исследования твердых электролитов. Успехи химии. 2016. Т. 85. С. 1255. [Yaroslavtsev, A.B., Solid electrolytes: main prospects of research and development, Russ. Chem. Rev., 2016, vol. 85 (11), p. 1255.]
Anantharamulu, N., Rao, K.K., Rambabu, G., Kumar, B.V., Radha, V., and Vital, M., A wide-ranging review on Nasicon type materials, J. Mater. Sci., 2011, vol. 46, no. 9, p. 2821.
Didisheim, J.-J., Prince, E., and Wuensch, B.J., Neutron Rietveld analysis of structural changes in NASICON solid solutions Na1 +xZr2SixP3 −xO12 at elevated temperatures: x = 1.6 and 2.0 at 320°C, Solid State Ionics, 1986, vols. 18−19, Pt 2, p. 944.
Jian, Z, Hu, Y.S., Ji, X., and Chen, W., NASICON-Structured Materials for Energy Storage, Adv Mater., 2017, vol. 20, p. 29.
Стенина, И.А., Ярославцев, А.Б. Низко- и среднетемпературные протонпроводящие электролиты. Неорган. Материалы. 2017. Т. 53. С. 241. [Stenina, I.A. and Yaroslavtsev, A.B., Low- and intermediate-temperature proton-conducting electrolytes, Inorg. Mater., 2017, vol. 53, no. 3, p. 253.]
Yaroslavtsev, A.B. and Stenina, I.A., Complex Phosphates with the NASICON Structure (MxA2(PO4)3), Russ. J. Inorg. Chem., 2006, vol. 51, Suppl. 1, p. S97.
Петьков, В.И., Суханов, М.В., Шипилов, А.С., Куражковская, В.С., Боровикова, Е.Ю., Пинус, И.Ю., Ярославцев, А.Б. Синтез и свойства LiZr2(AsO4)3 и LiZr2(AsO4)x(PO4)3 –x. Неорган. Материалы. 2014. Т. 50. № 3. С. 285. [Pet’kov, V.I., Sukhanov, M.V., Shipilov, A.S., Kurazhkovskaya, V.S., Borovikova, E.Y., Pinus, I.Y., and Yaroslavtsev, A.B., Synthesis and properties of LiZr2(AsO4)3 and LiZr2(AsO4)x(PO4)3 –x, Inorg. Mater., 2014, vol. 50, no. 3, p. 263.]
Петьков, В.И., Шипилов, А.С., Боровикова, Е.Ю., Ковальский, А.М., Стенина, И.А., Ярославцев, А.Б. Синтез, структурные, ИК-спектроскопические и ионопроводящие характеристики Mg0.5Zr2(AsO4)x(PO4)3 –x. Неорган. материалы. 2018. Т. 54. № 10. С. 1079. [Pet’kov, V.I., Shipilov, A.S., Borovikova, E.Y., Kovalskii, A.M., Stenina, I.A., and Yaroslavtsev, A.B., Synthesis, structure, IR-spectroscopic characterization, and ionic conductivity of Mg0.5Zr2(AsO4)x(PO4)3 –x, Inorg. Mater., 2018, vol. 54, no. 10, p. 1021.]
Суханов, М.В., Петьков, В.И., Фирсов, Д.В. Механизм спекания высокоплотной NZP-керамики. Неорган. материалы. 2011. Т. 47. № 6. С. 753. [Sukhanov, M.V., Pet’kov, V.I., and Firsov, D.V., Sintering mechanism for high-density NZP ceramics, Inorganic Materials, 2011, vol. 47, no. 6, p. 674.]
Стенина, И.А., Кислицын, M.Н., Пинус, И.Ю., Архангельский, И.В., Журавлев, Н.А., Ярославцев, А.Б. Фазовые превращения и катонная подвижность в двойных фосфатов лития–циркония со структурой НАСИКОН Li1 ±xZr2 –xMx(PO4)3 (M = Sc, Y, In, Nb, Ta), Журн. неорган. химии. 2005. Т. 50. С. 985. [Stenina, I.A., Pinus, I.Y., Yaroslavtsev, A.B., Kislitsyn, M.N., Arkhangel’skii, I.V., and Zhuravlev, N.A., Phase transformations and cation mobility in NASICON lithium zirconium double phosphates Li1 ± xZr2 –xMx(PO4)3 (M = Sc, Y, In, Nb, Ta), Russ. J. Inorg. Chem., 2005, vol. 50, no. 6, p. 906.]
Stenina, I.A., Pinus, I.Yu., Rebrov, A.I., and Yaroslavtsev, A.B., Lithium and hydrogen ions transport in materials with NASICON structure, Solid State Ionics, 2004, vol. 175, p. 445.
Song, W., Ji, X., Wu, Z., Zhu, Y., Yang, Y., Chen, J., Jing, M., Li, F., and Banks, C.E., First exploration of Na-ion migration pathways in the NASICON structure Na3V2(PO4)3, J. Mater. Chem. A, 2014, vol. 2, p. 5358.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия