Электрохимия, 2019, T. 55, № 10, стр. 1155-1163
Электрокаталитическая эффективность PbO2 в водоочистке
Ф. Смайли a, *, А. Бенчеттара a
a Лаборатория электрохимии, коррозии, металлургии и неорганической химии, химический факультет,
Университет науки и техники – Уари Бумедьен
16111 Эль Алия Баб Эззуар, п/я 32, Алжир
* E-mail: rahmasmaili@yahoo.fr
Поступила в редакцию 19.01.2018
После доработки 12.09.2018
Принята к публикации 30.03.2019
Аннотация
В настоящей работе осуществлено электроосаждение диоксида свинца на свинцовом электроде потенциостатическим методом в растворе 0.5 М серной кислоты при 1.3 В (н. к. э.) в течение 30 мин. Результат рентгеновского дифракционного анализа показал, что кристаллическая структура PbO2 в кислом растворе представляет собой чистый β-PbO2. Электроразложение хлорида трис(4-(диметиламиино)фенил)метилия (краситель метиловый фиолетовый 10B) в водном растворе 0.1 М сульфата натрия исследовано потенциостатическим методом с применением β-PbO2 в качестве анода. Метиловый фиолетовый 10B успешно окислялся гидроксильными радикалами, генерированными при электроокислении воды на поверхности электрода Pb/β-PbO2. Анодное окисление метилового фиолетового 10B соответствовало кинетике псевдопервого порядка. Время и приложенный потенциал производили значительное воздействие на электрохимическое разложение метилового фиолетового 10B на электроде Pb/β-PbO2 со скоростью разложения 10.5 г/(м2 сут).
ВВЕДЕНИЕ
В настоящее время загрязнение сточной воды токсичными органическими красителями представляет собой огромную проблему. Она вызвала повышенный интерес к разработке мощных методов окисления, таких как метод электрохимического окисления для удаления и разложения токсичных органических красителей до их попадания в водоемы [1]. Этот электрохимический метод может быть осуществлен двумя путями [2‒5]: непосредственно, когда органическое загрязняющее вещество окисляется в результате переноса электронов непосредственно на электроде (например, при разложении красителя реактивного черного 5 [6] и удалении красителя малахитового зеленого в водном растворе [7]), или косвенно, когда этот перенос электронов происходит с участием некоторых электроактивных частиц (например, при ускоренном обесцвечивании диазокрасителя кислотного коричневого 14 в водной среде [8] и обесцвечивании красителя основного желтого CI 28 [9]). На механизм электрохимического окисления значительно влияет электродный материал, который классифицируют как активный или неактивный в зависимости от его характеристик адсорбции гидроксильных радикалов [10]. Для электрохимической обработки растворов красителей было исследовано множество электродных материалов, таких как оксид олова SnO2 [11–14], оксид рутения (RuO2) [15], оксид иридия (IrO2) [16], графит [17], платина (Pt) [18] и легированный бором алмаз (ЛБА), который представляет собой наиболее подходящий анод для электрохимического окисления, поскольку он производит большее количество гидроксильных радикалов (OH•), чем другие анодные материалы [19–21], однако стоимость получения, повышенное энергопотребление и низкая механическая устойчивость этих материалов стимулировали применение альтернативных дешевых материалов [22]. PbO2 заметно проявил себя как превосходный металлооксидный электрод для удаления органических соединений благодаря своей низкой стоимости по сравнению с благородными металлами, простоте получения, химической устойчивости в агрессивных средах [23–26], а также своему высокому перенапряжению кислорода, что ставит его в ряд наиболее часто используемых анодов для разложения органических соединений [27–29]. Цель настоящего исследования заключается в том, чтобы продемонстрировать интерес к процессу непосредственного электрохимического окисления при разложении красителя. В данном контексте настоящее исследование сосредоточено на окислении метилового фиолетового 10B в водном растворе на пленочном электроде PbO2. Краситель метиловый фиолетовый 10B или основной фиолетовый 3 также известен как кристаллический фиолетовый и генциановый фиолетовый. Его широко применяют в качестве фиолетового красителя в текстильной промышленности для окрашивания хлопка и шелка [30]. Он также находит применение в производстве художественных и печатных красок [31]. Он способен вызывать умеренное раздражение глаз, производя болезненную сенсибилизацию к свету [32], и является высокотоксичным для клеток млекопитающих; кроме того, при поглощении в опасных количествах через кожу он может вызывать раздражение кожи и пищеварительного тракта [31, 33].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты
Все химические вещества, использованные в настоящей работе, имели категорию “ч. д. а.”. Эксперименты осуществляли при постоянной температуре 25.0°C. В настоящем исследовании использовали сульфат натрия Na2SO4 с чистотой 99% в качестве фонового электролита. Серную кислоту с чистотой 97% использовали при анодировании свинцового электрода для получения диоксида свинца. Раствор красителя получали, растворяя метиловый фиолетовый 10B в концентрации 10–2 М в растворе 0.1 М сульфата натрия (pH 6). Все электрохимические измерения осуществляли, используя потенциостат модели Versastat 3, управляемый с помощью программного обеспечения Versa-Studio. Электрохимические исследования осуществляли в стеклянной ячейке с тремя электродами, включая электрод PbO2 (42.14 см2) в качестве рабочего электрода, насыщенный каломельный электрод (н. к. э.), наполненный KCl, в качестве электрода сравнения (XR 110, Radiometer) и вспомогательный электрод, изготовленный из углеродного войлока (30 см2). Чтобы получить воспроизводимое состояние поверхности образца, осуществляли предварительную обработку свинцовой подложки перед анодированием. Свинец полировали в установке Mecapol Presi типа 2B в потоке воды, используя карбид кремния 1200/4000, а затем водную суспензию 0.3 мкм Al2O3. Перед каждым исследованием полированный образец промывали дистиллированной водой.
Анализ
Анодный слой PbO2 исследовали, используя рентгеновский дифрактометр PANalytical X’pert PROMPD Alpha1 с излучением CuKα (λ = 0.15418 нм). ИК-спектры с преобразованием Фурье регистрировали, используя спектрометр Bruker ALPHA-P. Эти спектры обрабатывали и анализировали с помощью программного обеспечения для сбора данных OPUS 6.5.
Спектры красителя в УФ и видимом диапазонах от 200 до 800 нм регистрировали, используя спектрофотометр Shimadzu 1800. В этом спектре максимум поглощения метилового фиолетового 10B наблюдали при длине волны (λmax) 590 нм. Таким образом, остаточную концентрацию красителя в реакционной смеси при различной продолжительности реакции вычисляли, измеряя интенсивность поглощения при λmax = 590 нм по калибровочной кривой.
Эффективность обесцвечивания выражали следующим соотношением [34]:
(1)
${\text{Эффективность }}\left( \% \right) = {\text{ }}(1{\text{ }}--{{{{c}_{t}}} \mathord{\left/ {\vphantom {{{{c}_{t}}} {{{c}_{0}}}}} \right. \kern-0em} {{{c}_{0}}}}),$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Превращение свинца в пленку диоксида свинца
Циклическая вольтамперометрия. Рисунок 2 представляет циклическую вольтамперограмму на свинцовом электроде в растворе 0.5 М H2SO4 при 5 мВ/с. Развертку потенциала осуществляли в анодном направлении от –1.2 до 2.0 В. При развертке один анодный пик появляется при ‒0.43 В (A1), однако в обратном направлении наблюдаются четыре пика: один анодный пик при 1.3 В (A2) и три катодных пика при 1.25 В (C1), ‒0.43 В (C2) и –0.56 В (C3), соответственно.
Рис. 2.
Циклическая вольтамперограмма Pb в растворе 0.5 М H2SO4 при скорости развертки потенциала 5 мВ/с.

Пик (A1) соответствует анодному окислению Pb до Pb2+ согласно уравнению:
(2)
${\text{P}}{{{\text{b}}}_{{{\text{(s)}}}}} \rightleftarrows {\text{P}}{{{\text{b}}}^{{2 + }}} + 2{\text{e}}.$После образования Pb2+ происходит химическое осаждение PbSO4 на поверхности электрода согласно уравнению:
(3)
${\text{P}}{{{\text{b}}}^{{2 + }}} + {\text{SO}}_{4}^{{2 - }} \rightleftarrows {\text{PbS}}{{{\text{O}}}_{4}}.$Интегрирование пика (A1) дает количество электричества Q1 = 0.111 Кл. Соответственно, молярная концентрация образующихся ионов Pb2+ составляет 3.83 × 10–6 М.
Поскольку ионное произведение PbSO4: [Pb2+][${\text{SO}}_{4}^{{2 - }}$ ] = 3.83 × 10–6 × 0.5 = 1.92 × 10–6 больше чем произведение растворимости PbSO4 (KS = 1.58 × 10–8), можно сделать вывод, что пленка PbSO4 осаждается на свинцовом электроде.
Складывая уравнения (2) и (3), получаем (4):
(4)
${\text{P}}{{{\text{b}}}_{{{\text{(s)}}}}} + {\text{SO}}_{4}^{{2 - }} \rightleftarrows {\text{PbS}}{{{\text{O}}}_{4}} + 2{\text{e}}.$Пик (C2) представляет собой восстановление Pb2+ до Pb, и пик (C3) представляет собой восстановление PbSO4 до Pb. При обратной развертке потенциала анодный пик (A2), соответствующий окислению PbSO4 до PbO2, появляется согласно уравнению:
(5)
${\text{PbS}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \rightleftarrows {\text{Pb}}{{{\text{O}}}_{2}} + 2{\text{e}} + {\text{SO}}_{4}^{{2 - }} + 4{{{\text{H}}}^{ + }}.$Складывая уравнения (4) и (5), получаем (6)
(6)
${\text{P}}{{{\text{b}}}_{{{\text{(s)}}}}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \rightleftarrows {\text{Pb}}{{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }} + 4{\text{e}}.$Пик (C1) соответствует восстановлению PbO2 до PbSO4. На основании этих результатов можно сделать вывод, что полная реакция при образовании PbO2 в растворе H2SO4 включает две стадии: на первой стадии Pb окисляется до PbSO4, а затем на второй стадии PbSO4 окисляется до PbO2, и это происходит при более положительных потенциалах, чем 1.2 В.
Хроноамперометрия. Рисунок 3 показывает, что ток быстро уменьшается в течение первой секунды. Это начальное уменьшение обусловлено процессом заряжения двойного слоя. Ток продолжает уменьшаться и затем стабилизируется практически на постоянном уровне (0.078 мА). Уменьшение тока обусловлено постепенным покрытием свинцовой поверхности диоксидом свинца, в то время как постоянство тока является показателем скорости роста оксидной пленки, который контролирует механизм диффузии.
Исследование PbO2
Рентгеновская дифракция. Рентгеновская дифрактограмма анодной пленки, выращенной в растворе 0.5 М H2SO4 при 1.3 В в течение 30 мин, представлена на рис. 4. Обычно PbO2 существует в двух формах, включая тетрагональный β-PbO2 и орторомбический α-PbO2. Сравнивая полученные фазовые углы, соответствующие различным дифракционным пикам ((101 при 31.9° 2θ), (200 при 36.1° 2θ), (220 при 52.5° 2θ), (310 при 62.4° 2θ) и (202 при 66.7° 2θ)), которые индицированы согласно карте JCPDS (номер 760564), видно, что кристаллическая структура PbO2 представляет собой чистый β-PbO2, что согласуется с литературными данными, согласно которым диоксид свинца, электроосажденный из кислого раствора, существует в форме β-PbO2, но в щелочном растворе основной формой является α-PbO2 [35], и β-PbO2 имеет пористую структуру, которая обеспечивает увеличенную площадь электроактивной поверхности для анодного окисления [36].
Спектроскопия импеданса. Метод спектроскопии электрохимического импеданса (EIS) использовали для исследования свойств анодного слоя, образующегося при 1.3 В. Измерения методом осуществляли при свободном потенциале в растворе 0.1 М Na2SO4 в диапазоне частот от 105 до 10–2 Гц с амплитудой 10 мВ. Диаграмма Найквиста границы раздела PbO2/Na2SO4 (рис. 5) содержит полуокружность в высокочастотной области, которой соответствует реакция переноса заряда [37], и прямую линию в низкочастотной области, которой соответствует контролируемый диффузией процесс в электролите. Данные смоделированы для эквивалентной электрической цепи с применением программного обеспечения Zview software. Рисунок 5 (вставка) представляет эквивалентную цепь, в которой Rs (17.44 Ом) и Rct (6419 Ом) представляют собой сопротивление раствора и сопротивление переноса заряда, соответственно, CPE1 (2.29 мкФ) представляет собой постояннофазовый элемент двойного слоя; W представляет собой импеданс Варбурга (3843 Ом), обусловленный массопереносом ионов в поверхностной пленке, n (0.84) представляет собой коэффициент гомогенности (0 < n ≤ 1). Rct имеет относительно большое значение, потому что PbO2 является химически устойчивым, и n > 0.5 показывает, что поверхность PbO2 является гладкой и плоской [38].
Применение электроразложения метилового фиолетового 10B
Рисунок 6 представляет вольтамперограмму с линейной разверткой на Pb/PbO2 в растворе 0.1 М при скорости развертки потенциала 20 мВ/с. Кривая показывает, что потенциал начала выделения кислорода составляет 1.6 В (н. к. э.) (перенапряжение выделения кислорода на PbO2 составляет 0.61 В (н. в. э.), что соответствует литературным данным (1.5–1.7 В (н. к. э.)) [39]. Такое поведение показывает, что Pb/PbO2 имеет более широкое электрохимическое окно, обеспечивая возможность получения гидроксильных радикалов, адсорбированных на аноде PbO2, при положительной поляризации в области окисления воды (см. уравнение (7)). Эти адсорбированные гидроксильные радикалы (OH•) способы разлагать почти все органические загрязняющие вещества благодаря своей очень высокой окислительной силе (2.81 В (н. в. э.)) и отсутствию селективности по отношению к органическим микропримесям. Это подтвердили недавние исследования, показывающие почти полную минерализацию множества органических загрязняющих веществ [22]. В данном контексте исследовано анодное окисление красителя метилового фиолетового 10B на диоксиде свинца.
(7)
${\text{Pb}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \rightleftarrows {\text{Pb}}{{{\text{O}}}_{2}}({\text{O}}{{{\text{H}}}^{\centerdot }}) + {{{\text{H}}}^{ + }} + {\text{e}}.$Рис. 6.
Вольтамперограмма с линейной разверткой, полученная на электроде PbO2 в растворе 0.1 М Na2SO4 при скорости развертки потенциала 20 мВ/с и 25°C.

Чтобы продемонстрировать каталитические свойства PbO2, электрохимическое поведение метилового фиолетового 10B исследовали на модифицированном PbO2 свинцовом электроде в растворе 0.1 М Na2SO4 в присутствии 10–5 М метилового фиолетового 10B при скорости развертки потенциала 20 мВ/с и 25°С. Как показано на рис. 7, циклическая вольтамперометрия фонового электролита (0.1 М Na2SO4) не проявляет пик окисления на границе раздела Pb/PbO2 в области потенциалов от 1.2 до 1.8 В (н. к. э.), но после добавления метилового фиолетового 10B в электролит (кривая б), анодный пик, соответствующий прямому окислению метилового фиолетового 10B на поверхности PbO2, наблюдали при 1.62 В (н. к. э.) в области потенциала выше выделения кислорода (E > 1.6 В (н. к. э.)), и это окисление представляет собой необратимый процесс. Это наблюдение можно интерпретировать присутствием большого количества гидроксильных радикалов (OH•), образующихся на поверхности PbO2, которые являются доступными только в условиях выделения кислорода и представляют собой очень сильный окислитель, способный реагировать с органическими соединениями [40], в данном случае с метиловым фиолетовым 10B (уравнение (8)):
(8)
$\begin{gathered} {\text{Метиловый фиолетовый }}10{\text{B}} + {\text{O}}{{{\text{H}}}^{ \bullet }} \to {\text{ }} \\ \to {\text{промежуточные продукты}} \to {\text{ }} \to {\text{ }} \to {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Рис. 7.
Циклические вольтамперометрические кривые в растворе 0.1 М Na2SO4 (a) при отсутствии и (б) в присутствии 10–5 М метилового фиолетового 10B при 25°С и скорости развертки потенциала 20 мВ/с.

Рисунок 8 представляет изменение спектра поглощения в УФ и видимом диапазоне раствора 10‒5 М метилового фиолетового 10B в течение его разложения в процессе электролиза при 1.7 В (н. к. э.). Исходный пик поглощения метилового фиолетового 10B до обработки наблюдается при 590 нм.
Рис. 8.
Спектры поглощения в УФ и видимом диапазонах раствора 10–5 М метилового фиолетового 10B в 0.1 М Na2SO4 при различной продолжительности электролиза (от 0 до 100 мин) и 1.7 В.

Экспериментальные результаы показали, что электрохимическое разложение метилового фиолетового 10B усиливается при увеличении продолжительности электролиза от 0 до 100 мин. Когда продолжительность электролиза достигала 100 мин, этот пик метилового фиолетового 10B при 590 нм полностью исчезал, позволяя сделать вывод, что произошло полное разложение метилового фиолетового 10B.
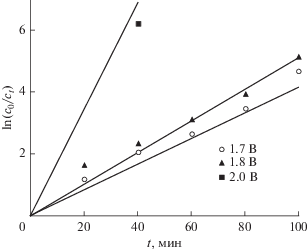
В электрохимической системе потенциал играет очень важную роль в течение процесса анодного окисления. Поведение метилового фиолетового 10B при разложении исследовали при различных потенциалах от области разряда воды от 1.7 до 2 В (рис. 9). Скорость реакции увеличивалась с увеличением потенциала. Возможное объяснение заключается в том, что при увеличении потенциала образуется больше гидроксильных радикалов.
Рис. 9.
Влияние потенциала на электрохимическое окисление 10–5 М метилового фиолетового 10B в 0.1 М Na2SO4, T = 25°C.

Кинетика окисления может быть выражена следующим образом [41]:
(9)
$\ln {{{{c}_{0}}} \mathord{\left/ {\vphantom {{{{c}_{0}}} {{{c}_{t}}}}} \right. \kern-0em} {{{c}_{t}}}} = {{K}_{{{\text{app}}}}}t,$Таблица 1.
Значения константы скорости реакции псевдопервого порядка (Kapp) и R2 разложения красителя
| Потенциал, В | Кажущаяся константа скорости, мин−1 | R2 |
|---|---|---|
| 1.7 | 4.16 × 10–2 | 0.980 |
| 1.8 | 5.15 × 10–2 | 0.996 |
| 2 | 1.72 × 10–1 | 0.995 |
Реакция псевдопервого порядка может быть обусловлена тем, что в потенциостатических условиях достигается стационарная концентрация радикалов OH• [42].
Чтобы подтвердить существование явления адсорбции и разложения для 10–5 М метилового фиолетового 10B в растворе 0.1 М Na2SO4 на β‑PbO2, проведен анализ методом ИК-спектроскопии с преобразованием Фурье поверхности β‑PbO2 до и после разложения красителя (рис. 11). Спектр β-PbO2 позволяет определить присутствие полосы колебаний от Pb=O, которой соответствуют линии в спектре β-PbO2 (600.7215; 636.2537; 965.7335; 1052.9488; 1169.2358 см–1); с другой стороны, полученный спектр осадка, образовавшегося в результате разложения метилового фиолетового 10B на электроде β-PbO2, позволяет продемонстрировать исчезновение специфических пиков метилового фиолетового 10B (исчезают два пика 1354.46, 1600, характерные для C=C; пик при 1164.25 см–1, соответствующий валентным колебаниям C–N, и пик при 1059.54 см−1, соответствующий деформационным колебаниям C–H) и появление новых пиков (3049.2091 и 3136.4244 см–1 –OH карбоксильной группы, 1406.4884 см–1 –CH2, 2186.7471, 2351.4871 и 2338.5663 см–1 –C≡N) продуктов разложения красителя, помимо видимых на спектре следов β‑PbO2.
ВЫВОДЫ
В настоящей работе диоксид свинца успешно получали на свинцовой подложке посредством анодирования в сернокислой среде, используя потенциостатический метод. Результат рентгеновского дифракционного анализа показал, что кристаллическая структура PbO2 в кислом растворе представляет собой чистый β-PbO2. Благодаря своему максимальному перенапряжению выделения кислорода (0.61 В (н. в. э.)) и максимальной электроактивной площади, электрокаталитическую эффективность электрода Pb/β-PbO2 исследовали в электрохимическом окислении метилового фиолетового 10B. Электролитические исследования показали, что окисление метилового фиолетового 10B происходило посредством гидроксильных радикалов, образующихся при окислении воды на границе раздела β-PbO2 и раствора 0.1 М Na2SO4 в потенциостатических условиях в нейтральной среде. Эти радикалы могут разлагать весь присутствующий краситель вследствие своей высокой окислительной силы и реакционной способности. Электрохимическое окисление метилового фиолетового 10B на электродах β-PbO2 соответствует кинетике псевдопервого порядка. Время и приложенный потенциал значительно влияют на электрохимическое разложение метилового фиолетового 10B на электроде β‑PbO2 со скоростью разложения 10.5 г/(м2 сут).
Список литературы
Rajeev, K. and Rais, A., Biosorption of hazardous crystal violet dye from aqueous solution onto treated ginger waste (TGW), Desalin., 2011, vol. 265, p. 112.
Panizza, M. and Cerisola, G., Direct And Mediated Anodic Oxidation of Organic Pollutants, Chem. Rev., 2009, vol. 109, p. 6541.
Scialdone, O., Randazzo, S., Galia, A., and Silvestri, G., Electrochemical oxidation of organics in water: Role of operative parameters in the absence and in the presence of NaCl, Water Res., 2009, vol. 43, p. 2260.
Aquino, J.M., Irikura, K., Rocha-Filho, R.C., Bocchi, N., and Biaggio, S.R., A comparison of electrodeposited Ti/β-PbO2 and Ti-Pt/β-PbO2 anodes in the electrochemical degradation of the direct yellow 86 dye, Quim. Nova., 2010, vol. 33, p. 2124.
Cavalcanti, E.B., Garcia-Segura, S., Centellas, F., and Brillas, E., Electrochemical incineration of omeprazole in neutral aqueous medium using a platinum or boron-doped diamond anode: degradation kinetics and oxidation products, Water Res., 2013, vol. 47, p. 1803.
Jager, D., Kupka, D., Vaclavikova, M., Ivanicova, L., and Gallios, G., Degradation of Reactive Black 5 by electrochemical oxidation, Chemosphere, 2017, vol. 120, p. 405.
Singh, S., Lien Lo, S., Srivastava, V.C., and Hiwarkar, A.D., Comparative study of electrochemical oxidation for dye degradation: Parametric optimization and mechanism identification, J. Environ. Chem. Eng., 2016, vol. 4, p. 2911.
Bassuoni, D.G., Hamad, H.A., El-Ashtoukhy, E-S.Z., Amin, N.K., and Abd El-Latif, M.M., Comparative performance of anodic oxidation and electrocoagulation as clean processes for electrocatalytic degradation of diazo dye Acid Brown 14 in aqueous medium, J. Hazard. Mater., 2017, vol. 335. p. 178.
Dušan, Z.M., Milka, L.A.I., Antonije, E.O., and Branimir, N.G., Decolorization of textile dye CI Basic Yellow 28 with electrochemically generated active chlorine, Chem. Eng. J., 2012, vol. 206, p. 151.
Sasidharan Pillai, I.M. and Gupta, A.K., Potentiostatic electrodeposition of a novel cost effective PbO2 electrode: Degradation study with emphasis on current efficiency and energy consumption, J. Electroanal. Chem., 2015, vol. 749, p. 16.
Oliveira, F.H., Osugi, M.E., Paschoal, F.M.M., Profeti, D., Olivi, P. and Zanoni, M.V.B., Electrochemical oxidation of an acid dye by active chlorine generated using Ti/Sn(1 –x)IrxO2 electrodes, J. Appl. Electrochem., 2007, vol. 37, p. 583.
Chen, Y., Hong, L., Xue, H., Han, W., Wang, L., Sun, X., and Li, J., Preparation and characterization of TiO2–NTs/SnO2–Sb electrodes by electrodeposition, J. Electroanal. Chem., 2010, vol. 648, p. 119.
Ciriaco, L., Santos, D., Pacheco, M.J., and Lopes, A., Anodic oxidation of organic pollutants on a Ti/SnO2–Sb2O4 anode, J. Appl. Electrochem., 2011, vol. 41, p. 577.
Chen, Y., Ni, Q., Han, W., Wang, L., Kirk, D.W., and Thorpe, S.J., Electroless deposition of SnOx–Sb nanocoating in ordered titania pores for enhancing electrical conductivity, Scripta Mater., 2011, vol. 65, p. 986.
Chen, X. and Chen, G., Stable Ti/RuO2–Sb2O5–SnO2 electrodes for O2 evolution, Electrochim. Acta, 2005, vol. 50, p. 4155.
Tolba, R., Tian, M., Wen, J., Jiang, Z., and Chen, A., Electrochemical oxidation of lignin at IrO2-based oxide electrodes, J. Electroanal. Chem., 2010, vol. 649, p. 9.
Regisser, F., Lavoie, M., Champagne, G.Y., and Belanger, D., Randomly oriented graphite electrode. Part 1. Effect of electrochemical pretreatment on the electrochemical behavior and chemical composition of the electrode, J. Electroanal. Chem., 1996, vol. 415, p. 47.
Oturan, N., Hamza, M., Ammar, S., Abdelhedi, R., and Oturan, M.A., Oxidation/mineralization of 2-nitrophenol in aqueous medium by electrochemical advanced oxidation processes using Pt/carbon-felt and BDD/carbon-felt cells, J. Electroanal. Chem., 2011, vol. 661, p. 66.
Santos, E.V., Sáez, C., Martínez-Huitle, C.A., Cañizares, P., and Rodrigo, M.A., The role of particle size on the conductive diamond electrochemical oxidation of soil-washing effluent polluted with atrazine, Electrochem. Commun., 2015, vol. 55, p. 26.
Araújo, D.M., Sáez, C., Martínez-Huitle, C.A., Ca˜nizares, P., and Rodrigo, M.A., Influence of mediated processes on the removal of Rhodamine with conductive—diamond electrochemical oxidation. Appl. Catal., B: Environmental, 2015, vol. 166, p. 454.
Garcia-Segura, S., Vieira dos Santos, E., and Martínez-Huitle, C.A., Role of sp3/sp2 ratio on the electrocatalytic properties of boron-doped diamond electrodes: A mini review Electrochemistry . Electrochem. Commun., 2015, vol. 59, p. 52.
Chianca de Mouraa, D., Antonio Quirozb, M., Ribeiro da Silvaa, D., and Salazarc, R. Martínez-Huitlea, C.A., Electrochemical degradation of Acid Blue 113 dye using TiO2-nanotubes decorated with PbO2 as anode, Environ. Nanotechnol. Monit. Manage, 2016, vol. 5, p. 13.
Awad, H.S. and Galwa, N.A., Electrochemical degradation of Acid Blue and Basic Brown dyes on Pb/PbO2 electrode in the presence of different conductive electrolyte and effect of various operating factors, Chemosphere, 2005, vol. 61, p. 1327.
Devilliers, D., Dinh-Thi, M.T., Mahe, E., and Xuan, Q.L., Cr(III) oxidation with lead dioxide-based anodes, Electrochim. Acta, 2003, vol. 48, p. 4301.
Sirés, I., Brillas, E., Cerisola, G., and Panizza, M., Comparative depollution of mecopropaqueous solutions by electrochemical incineration using BDD and PbO2 as high oxidation power anodes, J. Electroanal. Chem., 2008, vol. 38, p. 923.
Li, Xi., Li, X., Yang, W., Chen, X., Li, W., Luo, B., and Wang, K., Preparation of 3D PbO2 nanospheres @SnO2 nanowires/Ti Electrode and Its Application in Methyl Orange Degradation, Electrochim. Acta., 2014, vol. 146, p. 15.
Panizza, M. and Cerisola, G., Influence of anode material on the electrochemical oxidation of 2-naphthol: Part 2. Bulk electrolysis experiments, Electrochim. Acta, 2004, vol. 49, p. 3221.
Polcaro, A.M., Palmas, S., Renoldi, F., and Mascia, M., On the performance of Ti/SnO2 and Ti/PbO2 anodes in electrochemical degradation of 2-chlorophenol for wastewater treatment, J. Appl. Electrochem., 1999, vol. 29, p. 147.
Quiroz, M.A., Reyna, S., Martinez-Huitle, C.A., Ferro, S., and De Battisti, A., Electrocatalytic oxidation of p-nitrophenol from aqueous solutions at Pb/PbO2 anodes, Appl. Catal. B, 2005, vol. 59, p. 259.
Chakraborty, S., Chowdhury,S., and Das Saha, P., Adsorption of Crystal Violet from aqueous solution onto NaOH-modified rice husk, Carbohydr. Polym., 2011, vol. 86, p. 1533.
Mittal, A., Malviya, J., Kaur, A., D., and Gupta, V.K., Adsorption of hazardous dye crystal violet from wastewater by waste materials, J. Colloid Interface Sci., 2010, vol. 343, p. 463.
Rais, A., Studies on adsorption of crystal violet dye from aqueous solution onto coniferous pinus bark powder, J. Hazard Mater., 2009, vol. 171, p. 767.
Silva Ferreira, B.C., Teodoro, F.S., Mageste, A.B., Gil, L.F., Pereira de Freitas, R., and Gurgel, L.V.A., Application of a new carboxylate-functionalized sugarcane bagasse for adsorptive removal of crystal violet from aqueous solution: Kinetic, equilibrium and thermodynamic studies, Ind. Crops Prod., 2015, vol. 65, p. 521.
Zhou, D. and Gao, L., Effect of electrochemical preparation methods on structure and properties of PbO2 anodic layer, Electrochim. Acta., 2007, vol. 53, p. 2060.
Velichenko, A.B., and Devilliers, D., Electrodeposition of Fluorine-Doped Lead Dioxide, J. Fluorine Chem., 2007, vol. 128, p. 269.
Hongyi, L., Yong, C., Yaohui, Z., Weiqing, H., Xiuyun, S., Jiansheng, L., and Lianjun, W., Preparation of Ti/PbO2–Sn anodes for electrochemical degradation of phenol, J. Electroanal. Chem., 2013, vol. 689, p. 193.
Yu, N. and Gao, L., Electrodeposited PbO2 thin film as positive electrode in PbO2/AC hybrid capacitor, Electrochim. Commun., 2009, vol. 11, p. 220.
Bingqian, D., Zhen, C., Qiang, Y., Wei, Z., Wen, Y., and Zhongcheng, G., Effect of temperature on the residual stress of a β-PbO2 coating, Surf. Eng., 2017, vol. 34, p. 689.
Hao, X., Dan,S., Qian, Z., Honghui, Y., and Yan, W., Preparation and characterization of PbO2 electrodes from electro-deposition solutions with different copper concentration, RSC Adv., 2014, vol. 4, p. 25011.
Brillas, E., Sirés, I., and Oturan, M.A., Electro-Fenton process and related electrochemical technologies based on Fenton’s reaction chemistry, Chem. Rev., 2009, vol. 109, p. 6570.
Johra, F.T. and Jung, W.G., RGO–TiO2–ZnO composites: synthesis, characterization, and application to photocatalysis, Appl Catal A., 2015, vol. 491, p. 52.
Rodriguez, J., Rodrigo, M.A., Panizza, M., and Cerisola, G., Electrochemical oxidation of Acid Yellow 1 using diamond anode, J. Appl. Electrochem., 2009, vol. 39, p. 2285.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия