Электрохимия, 2019, T. 55, № 12, стр. 1543-1551
Новый твердый электролит Li8 – xZr1 – xTaxO6 (x = 0–0.5) для литиевых источников тока
М. И. Пантюхина a, *, С. В. Плаксин a, Н. С. Саетова a, А. А. Расковалов a
a Институт высокотемпературной электрохимии УрО РАН
620137 Екатеринбург, ул. С. Ковалевской, 22/ ул. Академическая, 20, Россия
* E-mail: marpantyuhina@yandex.ru
Поступила в редакцию 06.11.2018
После доработки 17.01.2019
Принята к публикации 30.03.2019
Аннотация
В работе синтезированы новые литийпроводящие твердые электролиты на основе цирконата лития, полученные путем допирования фазы Li8ZrO6 изоструктурным Li7TaO6. Показано, что в системе Li8 – xZr1– xTaxO6 образуется ряд твердых растворов х = 0−0.5 на основе Li8ZrO6. Проводимость полученных твердых растворов Li8– xZr1– xTaxO6 возрастает на 1–2 порядка величины по сравнению с недопированным цирконатом Li8ZrO6 за счет образования литиевых вакансий в тетра- и октаэдрических слоях структуры. Проведено электрохимическое испытание полностью твердофазных электрохимических ячеек с электролитом Li7.85Zr0.85Ta0.15O6, стеклокерамическими анодом 0.75Li2SnMo3O12 · 0.25B2O3 и катодом 0.2Li2O · 0.2LiF · 0.45V2O5 · 0.25B2O3. Показано, что сопротивление ячейки 0.75Li2SnMo3O12 · 0.25B2O3|Li7.85Zr0.85Ta0.15O6|0.2Li2O · 0.2LiF · 0.45V2O5 · 0.25B2O3 уменьшается после проведения циклов заряд/разряд.
ВВЕДЕНИЕ
Поиск новых литийпроводящих твердых электролитов вызван, прежде всего, возможностью создания на их основе полностью твердофазных химических источников тока (ХИТ). Примерами таких твердых электролитов могут служить электролиты на основе керамики [1, 2], стекла [3, 4] или стеклокерамики [5–7], полимерных электролитов (полимеры с растворенной в них солью) [8, 9] и композитов (полимер + твердый электролит) [10], (керамика + керамика) [11], (керамика + + стекло) [12–15]. Преимуществом твердофазных ХИТ [16, 17] является пожаро- и взрывобезопасность, широкий интервал эксплуатационных температур, более высокий срок службы, а также расширение возможностей изготовления различных конструкций источника.
Основные требования, предъявляемые к твердым ионным проводникам – это высокий уровень ионной проводимости, низкая энергия активации (0.3–0.4 эВ) и ее униполярный характер, который обусловлен высокой подвижностью одного сорта иона, на 4–6 порядков превышающий проводимость других ионов [18]. Помимо высокой ионной проводимости, электролиты для таких источников должны быть стабильными по отношению к аноду из металлического лития (или его сплавов), которые представляют собой сильный восстановитель, и к материалам катода, являющихся окислителями. Из оценок термодинамической устойчивости к литию привлекательными могут быть двойные оксиды LixMyOz (где М – Be, лантаноид, актиноид, Al, Hf, Zr, Sc, Y) [19]. Фаза Li8ZrO6 может быть перспективной при использовании в качестве электролита в ХИТ, так как обладает хорошей литий-ионной проводимостью [20, 21] и наилучшей устойчивостью к литийсодержащим анодным материалам среди цирконатов лития [22, 23].
В работе было проведено допирование цирконата лития Li8ZrO6 изоструктурной фазой Li7TaO6, обладающей униполярной литий-ионной проводимостью. Кристаллическая решетка Li7TaO6, как и Li8ZrO6, состоит из октаэдрических слоев, между которыми находятся тетраэдрически координированные ионы лития. Но в отличие от Li8ZrO6, в танталате лития одна литиевая позиция из восьми вакантна, поэтому его формулу можно записать как Li7◻TaO6 (где ◻ – вакансия в литиевой подрешетке) [21]. Она располагается и в окта-, и в тетра- позициях лития, в соответствии с формулой: (Li5.25◻0.75)tetr(Li1.75◻0.25Ta)octO6 [21]. Таким образом, танталат лития Li7TaO6 можно характеризовать как структурно разупорядоченную фазу. В связи с чем, при допировании можно ожидать образования структурных вакансий, как в Li7◻TaO6, что должно привести к росту проводимости твердых растворов Li8– xZr1– xTaxO6.
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве исходных материалов для синтеза твердых растворов Li8– xZr1– xTaxO6 были использованы карбонат лития Li2CO3 (ос. ч.), оксид циркония ZrO2 (х. ч.) и оксид тантала Ta2O5 (ос. ч.). Синтез осуществляли в герметичном реакторе под вакуумом с периодической продувкой гелием, осушенным путем вымораживания в жидком азоте на адсорбенте, для понижения парциального давления газообразных продуктов в реакторе, образующихся при синтезе. Синтез проводили поэтапно в интервале температур от 300 до 1040°C. Чистый цирконат состава Li8ZrO6 был получен по методике, описанной в работе [24]. Прохождение синтеза контролировали методом РФА и сравнением массы полученного продукта с расчетной. Кроме того, был выполнен химический анализ на полноту разложения карбоната лития.
Рентгенофазовый анализ (РФА) синтезированных образцов проводили на дифрактометре Rigaku DMAX-2200PC (Japan) в монохроматизированном СuKα-излучении. Набор первичных данных, их обработку, анализ фазового состава образцов осуществляли c использованием картотеки PDF2 [25].
Для электрохимических измерений из порошкообразного материала твердого электролита готовили керамические образцы в виде таблеток диаметром 10 мм. Образцы прессовали под давлением 500 МПа из порошка фракции менее 50 мкм. Затем, полученные таблетки спекали на воздухе в течение 30 ч в засыпке из того же материала на никелевой подложке при температуре 900°C. Плотность образцов составляла 92–95% от кристаллографической. Для измерения электропроводности на полученные образцы наносили серебряные электроды в виде пасты из канифоли и карбоната серебра с последующим выжиганием органического связующего. Измерение электропроводности проводили методом электрохимического импеданса в двухэлектродной ячейке в режиме охлаждения на импедансметре E7-25 в интервале частот 106–25 Гц в нескольких параллелях. Все измерения проводили в токе сухого азота.
Электронную составляющую проводимости находили поляризационным методом с никелевыми электродами в режиме охлаждения [26], в интервале температур 600–300°C, на электроды прикладывали постоянное напряжение равное 0.2 В, которое меньше напряжения разложения электролита.
Катодные 0.2Li2O · 0.2LiF · 0.45V2O5 · 0.25B2O3 (LVBF) и анодные стекла 0.75Li2SnMo3O12 · 0.25B2O3 (LSMB) получены традиционным способом закалки расплава. В качестве исходных реагентов использовали карбонат лития Li2CO3 (ос. ч.), фторид лития LiF (ч.), оксид ванадия V2O5 (х. ч.), борную кислоту H3BO3 (х. ч.), оксид олова SnO2 (ч.) и оксид молибдена MoO3 (х. ч.). Реагенты смешивали в стехиометрических пропорциях, тщательно перетирали в яшмовой ступке и плавили в платиновых тиглях на воздухе. Для получения катодного стекла перед закалкой расплав выдерживали при температуре 1200°C, а для анодного – при 1100°C. Расплав закаливали между пластинами нержавеющей стали при комнатной температуре.
В качестве электроактивного материала катода было использовано стекло состава 0.2Li2O · 0.2LiF · · 0.45V2O5 · 0.25B2O3. В качестве анодного материала была взята стеклокерамика состава 0.75Li2SnMo3O12 · 0.25B2O3. Для изготовления полностью твердофазной электрохимической ячейки был взят твердый электролит состава Li7.85Zr0.85Ta0.15O6 в виде керамической таблетки диаметром 13 мм и толщиной 1.35 мм. Затем на одну сторону электролита была нанесена паста, приготовленная из измельченного катодного материала, карбонильного железа и этиленгликоля. Для изготовления пасты LVBF и железо были взяты в объемном соотношении 3 : 1, что аналогично массовому соотношению 3.3 : 3.9. Далее в тщательно перетертую смесь LVBF и железа при постоянном перемешивании медленно по каплям добавляли этиленгликоль до получения однородной пасты коричневого цвета. После этого, полученный двухслойный образец медленно сушили в вакуумной печи при постепенном повышении температуры от 25 до 350°C в течение 2 ч с последующей выдержкой при 350°C в течение 2 ч и медленным охлаждением до комнатной температуры. После охлаждения на образец со стороны электролита аналогичным способом наносили пасту из LSMB и карбонильного железа с этиленгликолем, полученную также как катодный материал, содержащую LSMB и карбонильное железо, взятых в том же объемном соотношении, что соответствовало массовому отношению 3.0 LSMB : 3.2 Fe, с последующей сушкой по указанной выше методике. Оценочная масса электроактивного катодного (LVBF) и анодного (LSMB) материалов составили 0.027 и 0.034 г соответственно.
Электрохимические измерения полученной твердофазной ячейки проводили с помощью потенциостата-гальваностата BioLogic SP-200 со встроенным импедансометром. Годографы импеданса снимали в интервале частот 2 × 106–0.1 Гц с амплитудой 10 мВ, гальваностатические измерения (заряд/разряд) выполняли на токах 0.1 и 0.2 мА с промежуточными релаксациями.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены рентгенограммы недопированной фазы Li8ZrO6 (1), нескольких составов для твердого раствора Li8 –xZr1 –xTaxO6 : : Li7.9Zr0.9Ta0.1O6 (2) и Li7.6Zr0.6Ta0.4O6 (3) и штрих-рентгенограмма для стандарта Li8ZrO6 (4). Из них видно, что рентгенограммы для всех составов твердых растворов имеют одинаковый набор рентгеновских пиков, как у фазы Li8ZrO6 с небольшим сдвигом. Примесей исходных веществ и других цирконатов лития на рентгенограммах не обнаружено. В табл. 1 приведены параметры и объемы элементарной ячейки для исходного ромбоэдрического цирконата лития Li8ZrO6 с пространственной группой $R\bar {3}H$ [27] и исследованных составов твердых растворов. На основании подобия рентгенограмм и монотонного изменения параметров ячейки был сделан вывод об образовании ряда твердых растворов Li8 –xZr1 –xTaxO6 с х = 0−0.5 на основе фазы Li8ZrO6.
Рис. 1.
Дифрактограммы фазы 1 – Li8ZrO6; 2 – твердого раствора состава Li7.9Zr0.1Ta0.9O6; 3 – твердого раствора состава Li7.6Zr0.4Ta0.6O6; 4 – штрих-дифрактограмма для стандарта Li8ZrO6 картотеки PDF2 № 26-0867.

Таблица 1.
Параметры и объемы элементарной ячейки для составов твердых растворов Li8 –xZr1 –xTaxO6
| Состав твердого раствора | Параметры элементарной ячейки | V, Å3 | ||
|---|---|---|---|---|
| a, Å | b, Å | c, Å | ||
| Li8ZrO6 | 5.486(8) | 5.486(8) | 15.415(2) | 403.24 |
| Li7.95Zr0.95Ta0.05O6 | 5.481(2) | 5.481(2) | 15.433(0) | 403.09 |
| Li7.85Zr0.85Ta0.15O6 | 5.479(4) | 5.479(4) | 15.446(9) | 402.19 |
| Li7.7Zr0.7Ta0.3O6 | 5.461(6) | 5.461(6) | 15.459(3) | 399.91 |
| Li7.6Zr0.6Ta0.4O6 | 5.456(4) | 5.456(4) | 15.467(1) | 399.34 |
| Li7.5Zr0.5Ta0.5O6 | 5.450(9) | 5.450(9) | 15.479(7) | 398.86 |
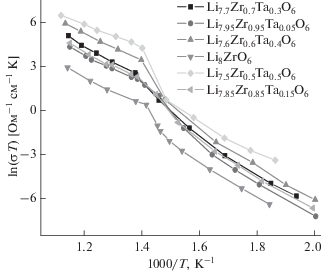
Электропроводность полученной керамики измерена импедансной спектроскопией в интервале температур 600−250°С. В качестве примера, на рис. 2 представлены годографы для керамического образца состава Li7.6Zr0.6Ta0.4O6 при разных температурах. Представленные спектры импеданса типичны для ионных проводников [28]. Из этих годографов были определены значения общего сопротивления по точке пересечения годографа с действительной осью и построены температурные зависимости общей удельной электропроводности для всех составов твердых растворов Li8 –xZr1 –xTaxO6 с х = 0−0.5 (рис. 3). Доля электронной составляющей проводимости для фазы Li8ZrO6 и твердых растворов Li8 –xZr1 –xTaxO6, оцененная поляризационным методом, составила менее 0.1% от величины общей проводимости. Таким образом, было показано, что проводимость является преимущественно ионной. Температурные зависимости электропроводности для всех составов в координатах Аррениуса приведены на рис. 3. Они состоят из двух линейных участков – высокотемпературного с меньшей энергией активации и низкотемпературного с большей, разделенные участком с резким изменением проводимости в интервале температур 370–430°C для твердых растворов, как и для исходного цирконата Li8ZrO6. В работе [21, 29] авторами подобное поведение политерм электропроводности для фаз с идентичной слоистой структурой Li7MO6 (M = Sb, Ta, Bi, Nb) и Li8MO6 (M = Zr, Hf, Sn, Pb) при температуре около 400°C было объяснено разупорядочением литиевой подрешетки. Для твердых растворов Li8 –xZr1 –xTaxO6 такой переход происходит в более широком интервале температур, а его начало сдвигается в более высокотемпературную область (примерно на 20°C для Li7.5Zr0.5Ta0.5O6 по сравнению с исходным Li8ZrO6). Это, вероятно, связано с более широким температурным интервалом перехода в суперионное состояние из-за большей концентрации дефектов в структуре твердых растворов по сравнению с чистым Li8ZrO6.
Рис. 2.
Годографы импеданса электрохимической ячейки Ag│Li7.6Zr0.6Ta0.4O6│Ag при температурах 600°С (а), 412°С (б), 366°С (в).
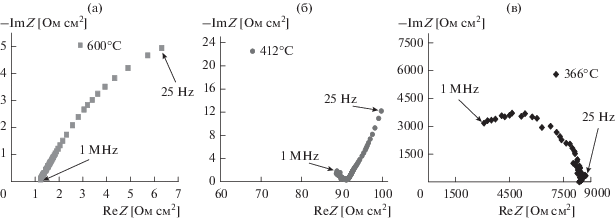
Рис. 3.
Температурная зависимость электропроводности для твердых растворов Li8 –xZr1 –xTaxO6 в координатах Аррениуса.
На рис. 4 приведены зависимости электропроводности от состава при различных температурах для системы Li8 –xZr1 –xTaxO6. Из них видно, что проводимость твердых растворов возрастает 1.5–2 порядка величины относительно чистого цирконата Li8ZrO6. Это, вероятно, происходит вследствие образования вакансий в литиевой подрешетке в тетра- и окта-позициях, как у фазы подобной структуры Li7TaO6, в соответствии с предложенной схемой замещения:
(1)
${\text{L}}{{{\text{i}}}_{{\text{7}}}}{\text{Ta}}{{{\text{O}}}_{6}} \to 7{\text{Li}}_{{{\text{Li}}}}^{x} + {\text{V}}_{{{\text{Li}}}}^{'} + {\text{Ta}}_{{{\text{Zr}}}}^{\centerdot } + 6{\text{O}}_{{\text{o}}}^{x}~ \to {\text{L}}{{{\text{i}}}_{8}}{\text{Zr}}{{{\text{O}}}_{6}}.$Рис. 4.
Логарифмические зависимости электропроводности от состава для твердых растворов Li8 –xZr1 –xTaxO6.

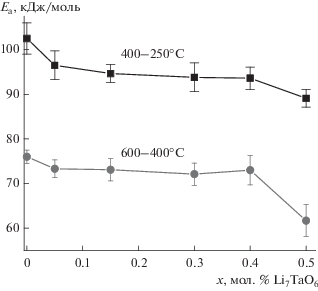
Этот факт, судя по всему, способствует движению ионов лития в твердых растворах Li8 –xZr1 –xTaxO6 с меньшим энергетическим барьером в тетраэдрических и октаэдрических слоях кристаллической решетки за счет образованных структурных вакансий по сравнению с недопированной фазой Li8ZrO6. Закономерным образом ведет себя зависимость энергии активации проводимости от состава (рис. 5), которая уменьшается с увеличением мольной доли Ta2O5, причем более значительно в низкотемпературной области.
Рис. 5.
Зависимости энергии активации проводимости от состава для твердых растворов Li8 –xZr1 –xTaxO6.
Испытания полностью твердофазной электрохимической ячейки проводили при температуре 300°C. При этой температуре сопротивление электролита с указанными геометрическими параметрами должно составлять величину порядка 1 кОм. Импедансная спектроскопия показала, что полное сопротивление ячейки превышало 600 кОм (рис. 6), т.е. большая часть сопротивления относится не к сопротивлению твердого электролита, а к другим составляющим, например сопротивлению электродов и межфазных границ. Мы полагаем, что использованные электродные материалы изначально находятся в разряженном состоянии. Известно, что в стеклах на основе оксидов ванадия одновременно присутствуют ионы V4+ и V5+ [30, 31]. С точки зрения возможности литиевой интеркаляции такого катода, необходимо, чтобы количество четырехвалентного ванадия было не меньше количества деинтеркалируемого лития. Если допустить, что количество Li+ в стекле 0.2Li2O · 0.2LiF · 0.45V2O5 · 0.25B2O3 равно количеству V4+, то его формулу следует поправить до вида 0.2Li2O · 0.2LiF · 0.3V2O4 · 0.15V2O5 · 0.25B2O3. В случае полной деинтеркаляции лития из такого катодного материала его удельная емкость должна составлять ~548 Кл/г (~152 мА ч/г) (табл. 2), как было рассчитано по формуле:
где, q – заряд (де)интеркалируемого иона; n – число ионов, которые могут быть (де)интеркалированы из одной формульной единицы электродного материала; F – постоянная Фарадея, ~96 484 Кл/моль; M – молекулярная масса электродного материала. Масса активного катодного материала в собранной электрохимической ячейке составляла 0.024 ± 0.005 г. С учетом вычисленной удельной емкости катод можно зарядить на 13.2 Кл (3.6 мА ч). Схематически электродную полуреакцию на катоде (в сторону заряда) можно записать в виде:(3)
$\begin{gathered} {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O--LiF--}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{--}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{5{\text{ }}--{\text{ }}\delta }}} \leftrightarrow \\ \leftrightarrow {\text{L}}{{{\text{i}}}_{2}}_{{--x}}{\text{O--L}}{{{\text{i}}}_{{1{\text{ }}--y}}}{\text{F--}}{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{--}}{{{\text{V}}}_{{\text{2}}}}{{{\text{O}}}_{{5{\text{ }}--{\text{ }}\delta }}} + \\ + \left( {x + y} \right){\text{L}}{{{\text{i}}}^{ + }} + {\text{ }}\left( {x + y} \right){\text{}}{\text{.}} \\ \end{gathered} $Рис. 6.
Годографы импеданса электрохимической ячейки 0.75Li2SnMo3O12 · 0.25B2O3|Li7.85Zr0.85Ta0.15O6|0.2Li2O · · 0.2LiF · 0.45V2O5 · 0.25B2O3 при температуре 300°C до (а) и после (б) циклирования.

Таблица 2.
Электрохимические характеристики катода и анода ячейки 0.75Li2SnMo3O12 · · 0.25B2O3|Li7.85Zr0.85Ta0.15O6|0.2Li2O · 0.2LiF · 0.45V2O5 · 0.25B2O3: теоретическая удельная емкость (C), масса электродного материала (m), заряд (Q)
| Электрод | Формула | C, Кл/г | m, г | Q, Кл |
|---|---|---|---|---|
| Катод | 0.2Li2O · 0.2LiF · 0.45V2O5 · 0.25B2O3 | 548 | 0.024 ± 0.005 | 13.2 |
| Анод | 0.75Li2SnMo3O12 · 0.25B2O3 | 1117 | 0.034 ± 0.005 | 38.0 |
В предыдущих работах [32, 33] в качестве анодного материала использовали галлий-серебряный сплав, поскольку он не окисляется в атмосфере воздуха и обладает хорошей адгезией к керамическим материалам, однако в этих же работах было показано, что деинтеркаляция лития из галлий-серебряного анода (разряд) осуществляется с большими перенапряжениями. Причиной этого явления может быть образование фаз системы Li–Ga с прочной ковалентной связью. Поэтому в данной работе в качестве анода был выбран оксидный материал, где литий связан с кислородом ионной связью. Данный материал представляет собой стеклокерамику на основе молибдата лития–олова Li2SnMo3O12, где олово и молибден находятся в своих максимальных степенях окисления, +4 и +6 соответственно. Предполагается, что в ходе литиевой интеркаляции (заряда) анод можно восстановить до двухвалентного олова и четырехвалентного молибдена:
(4)
$\begin{gathered} 0.75{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{SnM}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{{12}}}\,\,\cdot\,\,0.25{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 6{\text{L}}{{{\text{i}}}^{ + }} + 6{\text{}} \leftrightarrow \\ \leftrightarrow 0.75{\text{L}}{{{\text{i}}}_{{{\text{10}}}}}{\text{SnM}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{{12}}}\,\cdot{\text{ }}0.25{{{\text{B}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}. \\ \end{gathered} $Исходя из данной реакции, удельная емкость анодного материала должна составить 1117 Кл/г (310 мА ч/г). С учетом массы анодного материала 0.034 ± 0.005 г, анод можно зарядить на 38 Кл (10.5 мА ч), таким образом емкость ячейки лимитирована емкостью катодного материала.
Далее был проведен цикл заряда/разряда электрохимической ячейки 0.75Li2SnMo3O12 · · 0.25B2O3|Li7.85Zr0.85Ta0.15O6|0.2Li2O · 0.2LiF · · 0.45V2O5 · 0.25B2O3 с промежуточными релаксациями при токе 100 мкА в течение 24 ч (рис. 7а). С учетом площади таблетки, плотность тока составила величину порядка 76 мкА/см2. Она выше плотностей токов, которые обычно удается реализовать на полностью твердофазных ячейках [32–40]. При заряде происходит резкое увеличение потенциала ячейки, а затем его спад. Видимо, это связано с изначально большой поляризацией электродов, а затем постепенным ее падением. Импедансная спектроскопия показала, что после первого цикла сопротивление ячейки упало до величин порядка 12 кОм, затем была проведена серия быстрых зарядов/разрядов при плотности тока 152 мкА/см2 (рис. 7б). После чего сопротивление еще несколько уменьшилось, а годограф несколько изменил вид (рис. 7б). Данные изменения могут быть связаны образованием высокопроводящих путей интеркаляции лития в ходе окисления/восстановления электродных материалов.
ЗАКЛЮЧЕНИЕ
Синтезированы новые литийпроводящие твердые электролиты на основе фаз родственной структуры Li8ZrO6 и Li7TaO6. Показано, что в системе Li8 –xZr1 –xTaxO6 образуется ряд твердых растворов с х = 0−0.5. Установлено, что проводимость твердых растворов Li8 –xZr1 –xTaxO6 увеличивается на 1–2 порядка величины по сравнению с исходной фазой Li8ZrO6. Основными факторами, определяющими увеличение электропроводности твердых растворов Li8 –xZr1 –xTaxO6, являются образование литиевых вакансий в тетра- и октаэдрических слоях допированного цирконата лития. Полученный электролит был использован для создания полностью твердофазной электрохимической ячейки. На основании электрохимических измерений сделан вывод о возможности совместного использования электролита Li8 –xZr1 –xTaxO6 с катодом системы Li2O–LiF–V2O5–B2O3 и анодом системы Li2O–SnO2–MoO3–B2O3.
Список литературы
Tian, Y.J., Ding, F., Zhong, H., Liu, C., He, Y.B., Liu, J.Q., and Xu, Q., Li6.75La3Zr1.75Ta0.25O12 @amorphous Li3OCl composite electrolyte for solid state lithium-metal batteries, Energy Storage Materials, 2018, vol. 14, p. 49.
Takada, K., Progress in solid electrolytes toward realizing solid-state lithium batteries, J. Power Sources, 2018, vol. 394, p. 74.
Li, L., Liu, S., Xue, X., and Zhou, H., Effects of rough interface on impedance of solid LiPON in MIM cells, Ionics, 2018, vol. 24, p. 351.
Saetova, N.S., Raskovalov, A.A., Antonov, B.D., Yaroslavtseva, T.V., Reznitskikh, O.G., and Kadyrova, N.I., The influence of lithium oxide concentration on the transport properties of glasses in the Li2O–B2O3–SiO2 system, J. Non-Crystalline Solids, 2016, vol. 443, p. 75.
Kato, A., Kowada, H., Deguchi, M., Hotehama, C., Hayashi, A., and Tatsumisago, M., XPS and SEM analysis between Li/Li3PS4 interface with Au thin film for all-solid-state lithium batteries, Solid State Ionics, 2018, vol. 322, p. 1.
Choi, S., Lee, S., Park, J., Nichols, W., and Shin, D. Facile synthesis of Li2S–P2S5 glass-ceramics electrolyte with micron range particles for all-solid-state batteries via a low-temperature solution technique (LTST), Appl. Surface Sci., 2018, vol. 444, p. 10.
Yu, K., Gu, R., Wu, L., Sun, H., Ma, R., Jin, L., Xu, Y., Xu, Z., and Wei, X., Ionic and electronic conductivity of solid electrolyte Li0.5La0.5TiO3 doped with LiO2–SiO2–B2O3 glass, J. Alloys and Compounds, 2018, vol. 739, p. 892.
Tang, W., Tang, S., Zhang, C., Ma, Q., Xiang, Q., Yang, Y-W., and Luo, J., Simultaneously Enhancing the Thermal Stability, Mechanical Modulus, and Electrochemical Performance of Solid Polymer Electrolytes by Incorporating 2D Sheets, Advanced Energy Materials, 2018, vol. 8. https://doi.org/10.1002/aenm.201800866
Tong, Y., Lyu, H., Xu, Y., Thapaliya, B.P., Li, P., Sun, X-G., and Dai, S., All-solid-state interpenetrating network polymer electrolytes for long cycle life of lithium metal batteries, J. Materials Chemistry A, 2018, vol. 6, p. 14847.
Li, C., Yue, H., Wang, Q., Li, J., Zhang, J., Dong, H., Yin, Y., and Yang, S., A novel composite solid polymer electrolyte based on copolymer P (LA-co-TMC) for all-solid-state lithium ionic batteries, Solid State Ionics, 2018, vol. 321, p. 8.
Лаврова, Г.В., Пономарева, В.Г., Пономаренко, И.В., Кирик, С.Д., Уваров, Н.Ф. Нанокомпозитные протонные проводники с мезопористыми оксидными добавками как перспективные мембраны для топливных элементов. Электрохимия. 2014. Т. 50. С. 676. [Lavrova, G.V., Ponomareva, G.V., Ponomarenko, I.V., Kirik, S.D., and Uvarov, N.F., Nanocomposite Proton Conductors Containing Mesoporous Oxides as the Promising Fuel Cell Membranes, Russ. J. Electrochem., 2014, vol. 50, p. 608.]
Il’Ina, E.A., Raskovalov, A.A., Saetova, N.S., Antonov, B.D., and Reznitskikh, O.G., Composite electrolytes Li7La3Zr2O12–glassy Li2O–B2O3–SiO2, Solid State Ionics, 2016, vol. 296, p. 26.
Pershina, S.V., Il’Ina, E.A., and Reznitskikh, O.G., Phase Composition, Density, and Ionic Conductivity of the Li7La3Zr2O12-Based Composites with LiPO3 Glass Addition, Inorganic Chemistry, 2017, vol. 56, p. 9880.
Il’ina, E.A., Raskovalov, A.A., Antonov, B.D., Pankratov, A.A., Reznitskikh, O.G., Composite electrolytes ceramic Li7La3Zr2O12/glassy Li2O–Y2O3–SiO2, Materials Research Bulletin, 2017, vol. 93, P. 157.
Il’ina, E.A., Pershina, S.V., Antonov, B.D., Pankratov, A.A., and Vovkotrub, E.G., The influence of the glass additive Li2O–B2O3–SiO2 on the phase composition, conductivity, and microstructure of the Li7La3Zr2O12, J. Alloys and Compounds, 2018, vol. 765, p. 841.
Keller, M., Varzi, A., and Passerini, S., Hybrid electrolytes for lithium metal batteries, J. Power Sources, 2018, vol. 392, p. 206.
Chen, S., Wen, K., Fan, J., Bando, Y., and Golberg, D., Progress and future prospects of high-voltage and high-safety electrolytes in advanced lithium batteries: from liquid to solid electrolytes, J. Materials Chemistry A, 2018, vol. 6, p. 11631.
Атовмян, Л.О., Укше, Е.А. В сб.: Физическая химия. Современные проблемы, М.: Химия, 1983. С. 92–115. [Avtomyan, L.O. and Ukshe, E.A., Physical chemistry. Modern problem (in Russian), Moscow: Khimiya, 1983, p. 92–115.]
Баталов, Н.Н., Желтоножко, О.В., Зарембо, С.Н., Ахметзянов, Т.М., Волкова, О.В., Зелютин, Г.В., Обросов, В.П., Тамм, В.Х. Твердоэлектролитные сепараторы на основе двойных нитридов для высокотемпературных литиевых аккумуляторов. Электрохимия. 1995. Т. 31. С. 394. [Batalov, N.N., Zheltolozhko, O.V., Zarembo, S.N., Ahmetzyanov, T.M., Volkova, O.V., Zelyutin, G.V., and Obrosov, V.P., Solid-electrolyte separators based on double nitrides for high-temperature lithium batteries, Russ. J. Electrochem., 1995, vol. 31, p. 285.]
Hellstrom, E.E., and van Gool, W., Li-ion conductivity in Li2ZrO3; Li4ZrO4 and LiScO2, Rev. Chim. Mineral, 1980, vol. 17, p. 263.
Muhle, C., Dinnebier, R.E., Wullen, L., Schwering, G., and Jansen, M., New Insights into the Structural and Dynamical Features of Lithium Hexaoxometalates Li7MO6 (M = Nb, Ta, Sb, Bi), Inorg. Chem., 2004, vol. 43, p. 874.
Андреев, О.Л., Баталов, Н.Н., Софронова, Т.В. О термодинамической устойчивости электролитов на основе соединений оксида лития и оксидов Al, Be, Zr, Sc, Y к металлическому литию. Электрохимическая энергетика. 2002. Т. 2. № 2. С. 61. [Andreev, O.L., Batalov, N.N., and Sofronova, T.V., On thermodynamic stability of electrolytes based on lithium oxide compounds and oxides of Al, Be, Zr, Sc, Y to metallic lithium, Electrohim. Energetika (in Russian), 2002, vol. 2, № 2, p. 61.]
Моисеев, Г.К., Ватолин, Н.А. Взаимодеиствие цирконатов лития с литием в равновесных условиях. Докл. Академии наук. 2003. Т. 388. С. 505. [Moiseev, G. K. and Vatolin, N.A., Interaction of lithium zirconate with lithium under equilibrium conditions, Doklady Phys. Chem., 2003, vol. 388, p. 33.]
Пантюхина, М.И., Андреев, О.Л., Антонов, Б.Д., Баталов, Н.Н. Синтез и электрические свойства цирконатов лития. Журн. неорг. химии. 2002. Т. 47. С. 1778. [Pantyukhina, M.I., Andreev, O.L., Anto-nov, B.D., and Batalov, N.N., Synthesis and electrical properties of lithium zirconates, Russ. J. Inorg. Chem., 2002, vol. 47, p. 1526.]
JCPDS (Joint committee of powder diffraction standards) 2003.
Чеботин, В.Н., Перфильев, М.В. Электрохимия твердых электролитов, М.: Химия, 1978. 313 с. [Chebotin, V.N. and Perfilev, M.V., Electrochemistry of solid electrolytes (in Russian), Moscow: Khimiya, 1978. 313 p.]
Duan Yu., Structural and electronic properties of Li8ZrO6 and its CO2 capture capabilities: an ab initio thermodynamic approach, Phys. Chem. Chem. Phys., 2013, vol. 15, p. 9752.
Букун, Н.Г., Укше, А.Е., Укше, Е.А. Частотный анализ импеданса и определение элементов эквивалентных схем в системах с твердыми электролитами. Электрохимия. 1993. Т. 29. С. 110. [Bukun, N.G., Ukshe, A.E., and Ukshe, E.A., Frequency impedance analysis and determination of equivalent circuit elements in systems with solid electrolytes, Russ. J. Electrochem., vol. 29, p. 96.]
Пантюхина, М.И., Щелканова, М.С., Плаксин, С.В. Синтез и электрохимические свойства твердых растворов Li8 –xZr1 –xNbxO6. Физика твердого тела. 2013. Т. 55. С. 650. [Pantyukhina, M.I., Shchelkanova, M.S., and Plaksin, S.V., Synthesis and electrochemical properties of Li8 –xZr1 –xNbxO6 solid solutions, Phys. Solid State, 2013, vol. 55, p. 707.]
McKnight, M., Whitmore, K.A., Bunton, P.H., Baker, D.B., Vennerberg, D.C., and Feller, S.A., EPR study of RLi2O · V2O5, RNa2O · V2O5, RCaO · V2O5 and RBaO · V2O5 modified vanadate glass system, J. Non-Cryst Solids, 2010, vol. 356, p. 2268.
Saetova, N.S., Raskovalov, A.A., Antonov, B.D., Yaroslavtseva, T.V., Reznitskikh, O.G., Zabolotskaya, E.V., Kadyrova, N.I., and Telyatnikova, A.A., Conductivity and spectroscopic studies of Li2O–V2O5–B2O3 glasses, Ionics, 2018, vol. 24, p. 1929.
Ильина, Е.А., Саетова, Н.С., Расковалов, А.А. Полностью твердофазный перезаряжаемый источник тока Li–Ga–Ag|Li7La3Zr2O12 + Li2O–Y2O3–SiO2|Li2O–V2O5–B2O3. Журн. прикл. химии. 2016. Т. 89. С. 1142. [Il’ina, E.A., Saetova, N.S., and Raskovalov, A.A., All-solid-state battery Li–Ga–Ag|Li7La3Zr2O12 + Li2O–Y2O3–SiO2|Li2O–V2O5–B2O3, Russ. J. Appl. Chem., 2016, vol. 89, p. 1434.]
Raskovalov, A.A., Il’ina, E.A., Saetova, N.S., and Pershina, S.V., The all-solid-state battery with vanadate glass-ceramic cathode, Ionics, 2018, Accepted manuscript. https://doi.org/10.1007/s11581-018-2686-0
Iriyama, Ya. and Kako, T., Charge transfer reaction at the lithium phosphorus oxynitride glass electrolyte/lithium cobalt oxide thin film interface, Solid State Ionics, 2005, vol. 176, P. 2371.
Kotobuki, M. and Kanamura, K., Fabrication of all-solid-state battery using Li5La3Ta2O12 ceramic electrolyte, Ceram. International, 2013, vol. 39, p. 6481.
Trong, L.D., Thao, T.T., and Dinh, N.N., Characterization of the Li-ionic conductivity of La(2/3 –x)Li3xTiO3 ceramics used for all-solid-state batteries, Solid State Ionics, 2015, vol. 278, p. 228.
Yu, R., Bao, J.-J., et al., Solid polymer electrolyte based on thermoplastic polyurethane and its application in all-solid-state lithium ion batteries, Solid State Ionics, 2017, vol. 309, p. 15.
Schichtel, P. and Geib, M., On the impedance and phase transition of thin film all-solid-state batteries based on the Li4Ti5O12 system, J. Power Sources, 2017, vol. 360, p. 593.
Suzuki, Sh. and Kawaji, J., Development of complex hydride-based all-solid-state lithium ion battery applying low melting point electrolyte, J. Power Sources, 2017, vol. 359, p. 97.
Lin, J., Wu, Yu., Bi, R., and Guo, H., All-solid-state microscale lithium-ion battery fabricated by a simpleprocess with graphene as anode, Sensors and Actuators A, 2017, vol. 253, p. 218.
Дополнительные материалы отсутствуют.



