Электрохимия, 2019, T. 55, № 12, стр. 1532-1542
Деметаллизированные PtCu/C-катализаторы электровосстановления кислорода
С. А. Киракосян a, А. А. Алексеенко a, *, В. Е. Гутерман a, И. Н. Новомлинский a, В. С. Меньщиков a, Е. В. Герасимова b, А. Ю. Никулин a
a Южный федеральный университет, химический факультет НИИ Физики
344090 Ростов-на-Дону, ул. Зорге, 7, Россия
b Институт проблем химической физики РАН
142432 Московская область, Черноголовка, просп. Академика Семенова, 1, Россия
* E-mail: an-an-alekseenko@yandex.ru
Поступила в редакцию 29.04.2019
После доработки 29.04.2019
Принята к публикации 04.07.2019
Аннотация
Платиносодержащие биметаллические наночастицы демонстрируют высокие функциональные характеристики в качестве электрокатализаторов. Для использования PtCu/C-катализаторов в низкотемпературных топливных элементах необходимо минимизировать селективное растворение меди, катионы который могут загрязнять полимерную мембрану, снижая ее протонную проводимость. В работе определен состав, измерена площадь электрохимически активной поверхности и изучено электрохимическое поведение PtCu/C-катализаторов, содержащих наночастицы со структурой “оболочка–ядро”, в исходном состоянии (как получено) и после предобработки в растворах различных кислот. Сравнительное определение активности катализаторов в электрохимической ячейке и их тестирование в мембранно-электродном блоке топливных элементов показало, что прошедшие обработку PtCu/C-материалы, обладающие значительно более высокой стабильностью по сравнению с Pt/C, не уступают последним и по активности в реакции электровосстановления кислорода.
ВВЕДЕНИЕ
Водородно-воздушные топливные элементы с протонообменной мембраной (ТПТЭ) являются перспективными источниками энергии для транспортных средств благодаря высокой эффективности преобразования энергии и отсутствию вредных выбросов в окружающую среду [1–3]. Одну из ключевых ролей в обеспечении высоких удельных характеристик ТПТЭ играют электрокатализаторы – важный компонент мембранно-электродных блоков топливных элементов [2–6]. Высокая стоимость Pt-содержащих катализаторов является одной из проблем коммерциализации ТПТЭ [7–9]. Такие катализаторы обычно используются как в анодном, так и в катодном каталитических слоях мембранно-электродных блоков. Однако, поскольку реакция электровосстановления кислорода (РВК), протекающая на катоде ТПТЭ, является лимитирующей, на кислородном электроде используются Pt/С-катализаторы с большей загрузкой платины [9–14].
За последнее десятилетие выросло число публикаций, посвященных решению фундаментальных и прикладных научных проблем, связанных с повышением активности электрокатализаторов и понижением содержания в них драгоценного металла [6–12]. Большая часть таких работ связана с легированием Pt некоторыми d-металлами (Co, Ni, Cu и др.) [10, 15–20]. Имеются многочисленные экспериментальные данные, свидетельствующие о существенном повышении активности биметаллических катализаторов в РВК по сравнению со стандартными Pt/С-катализаторами [21–24]. Позитивное влияние легирующих компонентов на активность платины в РВК может быть связано с: изменением электронной структуры металла; сокращением межатомного расстояния в кристаллической решетке, что способствует адсорбции молекул кислорода; образованием на поверхности наночастиц активной тонкой оболочки Pt, происходящим вследствие селективного растворения легирующего компонента; изменением состава поверхностных оксидов и повышением коррозионной стойкости сплава по сравнению с чистой Pt [25–29].
Возможность применения технологичных методов жидкофазного синтеза для получения биметаллических наночастиц с различной архитектурой, а также высокая активность и/или стабильность в РВК, обусловливают высокий интерес исследователей к PtCu/C-электрокатализаторам [25–32]. Учитывая пониженную (по сравнению с платиной) термодинамическую стабильность меди, практический интерес могут представлять катализаторы на основе PtCu-наночастиц, состоящих из обогащенной платиной оболочки и медного ядра. Так, например, A. Manthiram с сотр. путем гальванического замещения меди на платину синтезировали из ранее полученных Cu/C-материалов серию PtCu/C-электрокатализаторов с ядром из PtCu-сплава и Pt-оболочкой [33]. Такие наночастицы продемонстрировали значительное более высокую активность в РВК по сравнению с коммерческим Pt/C-катализатором. Высокоактивные Cu@Pt/C-катализаторы получены и исследованы в работах [34, 35].
К сожалению, нанести на поверхность углеродного носителя множество платиномедных наночастиц с бездефектной платиновой оболочкой и предотвратить тем самым селективное растворение меди, по-видимому, невозможно. P. Strasser с сотр. показали, что платиномедные наночастицы после растворения части меди (de-alloyed nanoparticles), могут проявлять весьма высокую активность в РВК [25, 26]. При этом получение наночастиц с высокоактивной оболочкой, обогащенной Pt, и PtCu-ядром, может быть проведено посредством электрохимического растворения меди из Pt–Cu/С-катализаторов [25, 36]. Перспективные результаты были получены и для других de-alloyed PtM-систем [36–38]. Первоначально PtM-наночастицы в таких системах содержат значительное количество легирующего компонента, но после специальной обработки, вызывающей выщелачивание легирующего компонента, превращаются в катализаторы, содержащие относительно небольшое количество переходного металла. Высокая активность de-alloyed PtCu-катализаторов может быть обусловлена разными факторами – развитием поверхности платины в результате реорганизации структуры наночастиц (следствие – большая площадь электрохимически активной поверхности), повышением доли наиболее эффективных с точки зрения электрокатализа участков поверхности, остаточным позитивным влиянием небольших количеств атомов легирующего компонента на активность платины [38–40].
Ранее нами были получены и исследованы PtCux/C-катализаторы, проявившие высокую стабильность и активность в РВК [41, 42]. При этом было установлено, что уже на начальном этапе электрохимической стандартизации PtCux/C-катализаторов происходит интенсивное селективное растворение меди, в то время как далее, в процессе стресс-тестирования, изменение соотношения Pt : Cu выражено гораздо слабее [42]. Это позволило условно разделить изначально присутствующую в катализаторах медь на “слабо” (быстро и легко вымывается) и “сильно” связанную (растворяется с малой скоростью в условиях последующего стресс-тестирования). Мы полагаем, что удаление “слабо связанной” меди из двухкомпонентных PtCu-катализаторов может быть проведено не только электрохимическим путем, но и посредством предварительной обработки в растворах кислот, что открывает дорогу к последующему использованию de-alloyed PtCu-катализаторов в МЭБ ТПТЭ. Отметим, что предобработка PtM-катализаторов в кислоте рассматривается в качестве обязательного этапа их приготовления различными авторами [39, 40].
Целью настоящей работы являлось сравнительное исследование электрохимического поведения de-alloyed PtCuх–y/C-катализаторов, полученных посредством кислотной предобработки одного и того же PtCuх/C-предшественника в различных условиях. При постановке задач мы исходили из предположения, что изменение состава и структуры платиномедных наночастиц в результате обработки в кислотах может зависеть как от их исходного состава/структуры, так и от условий обработки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез PtCu/C-электрокатализаторов проводили посредством последовательного многостадийного восстановления прекурсоров платины (H2PtCl6 ⋅ 6H2O) и меди (CuSO4 ⋅ 5H2O) в водно-органической среде (вода–этиленгликоль). В качестве носителя использовали графитизированную углеродную сажу Vulcan XC-72. Синтез проводили в щелочной среде (NaOH, pH ~ 13), в качестве восстановителя использовали боргидрид натрия (NaBH4).
На первой стадии путем восстановления меди были получены медные наночастицы на углеродном носителе (образец A1). На второй стадии на образовавшиеся медные ядра осаждали совместно платину и медь путем восстановления металлов из раствора соответствующих прекурсоров (образец A2). Далее вновь осаждали платину и медь на ранее полученные PtCu/C-материалы, при этом в маточном растворе была уменьшена концентрация меди и увеличена концентрация платины (образец A3). На четвертой стадии на полученные наночастицы PtCun/С была осаждена только платина. После чего полученный материал (образец A4) был отфильтрован, промыт дистиллированной водой и высушен в эксикаторе над P2O5 в течение суток. Таким образом мы пытались получить наночастицы, в которых концентрация меди уменьшается, а концентрация платины растет в направлении от ядра к поверхности. Параллельно проводили аналогичный синтез, в котором продукт (A1, A2, A3) выделяли на каждой стадии.
В дальнейшем отдельные порции образца А4 подвергли 6-часовой обработке при комнатной (22–24°С) температуре в растворах кислот. Полученные материалы были отфильтрованы, промыты дистиллированной водой и высушены в течение суток в эксикаторе над P2O5.
Термогравиметрический анализ полученных материалов проводили на совмещенном ТГА/ДСК/ДТА-анализаторе NETZSCH STA 449 C в атмосфере, состоящей из N2 – 80% и O2 – 20%, в диапазоне температур от 20 до 750°С при скорости нагрева 10°С/мин и скорости потока газа 20 мл/мин, с использованием корундовых тиглей. При расчете массовых долей металлов в PtCu/C-образцах считали, что несгораемый остаток состоит из Pt и CuO. Точность определения массовых долей составила ±0.4%.
Соотношение металлов Cu : Pt в образцах определяли методом рентгенофлуоресцентного анализа на спектрометре с полным внешним отражением рентгеновского излучения РФС-001 (НИИ физики ЮФУ). Время экспозиции образцов – 300 с.
Состав и концентрация растворов кислот, а также маркировка исходного и прошедших обработку образцов приведены в табл. 2.
Съемку рентгенограмм проводили на порошковом дифрактометре ARL X`TRA с геометрией по Бреггу–Брентано (θ–θ), Cu Kα-излучение (λ = 0.15405618 нм). Измерения проводили при комнатной температуре. Образцы тщательно перемешивали и помещали в кювету глубиной 1.5 мм или на бесфоновую подложку. Сьемку проводили в интервале углов 15–55 градусов с шагом 0.02 градуса и скоростью от 8 до 0.5 градусов в минуту, в зависимости от поставленной задачи. Средний размер кристаллитов металлической фазы определяли по уравнению Шеррера для более интенсивного отражения (111), как это описано в [43, 44]. Исследование электрохимического поведения полученных образцов проводили методом цикличеcкой вольтамперометрии в стандартной трехэлектродной ячейке при температуре 22–24°С на потенциостате Pine Research Instrumentation. В качестве электролита использовали 0.1 М раствор HClO4, электрода сравнения – насыщенный хлоридсеребряный электрод. Значения потенциалов в работе приведены относительно обратимого водородного электрода (ОВЭ).
Для сравнения функциональных характеристик полученных нами образцов использовали коммерческий Pt/C-электрокатализатор HiSPEC3000 (Johnson Matthey) с близкой массовой долей платины – 20%.
Катализатор наносили на торец ВДЭ в виде капли суспензии. Для получения суспензии катализатора (каталитических “чернил”) к 0.0060 г каждого из образцов добавляли 900 мкл изопропилового спирта и 100 мкл 0.5% водной эмульсии полимера Nafion®. Далее суспензию диспергировали ультразвуком в течение 15 мин. При непрерывном перемешивании с помощью микродозатора отбирали аликвоту “чернил” объемом 6 мкл и наносили на торец отполированного и обезжиренного стеклоуглеродного электрода площадью 0.196 см2, регистрируя точный вес капли. Для закрепления каталитического слоя, после его высыхания наносили 7 мкл 0.05% эмульсии Nafion® [42], после чего электрод высушивали на воздухе еще в течение 15 мин.
Перед измерением площади электрохимически активной поверхности (ЭХАП) катализатора электролит насыщали аргоном в течение 30 мин. Далее проводили стандартизацию электрода – 100 циклов развертки потенциала в диапазоне от 0.03 до 1.26 В со скоростью 200 мВ/с. Затем на неподвижном электроде регистрировали 2 циклических вольтамперограммы со скоростью развертки потенциала 20 мВ/с. Расчет ЭХАП проводили для второй циклической вольтамперограммы (ЦВА) по количеству электричества, затраченному на электрохимическую адсорбцию и десорбцию атомарного водорода с учетом вклада токов заряжения двойного электрического слоя, как это описано в [42].
Для оценки активности катализаторов в РВК электролит насыщали кислородом в течение 1 ч, после чего проводили измерение серии вольтамперограмм в диапазоне от 0.12 до 1.19 В с линейной разверткой потенциала со скоростью 20 мВ/с при скоростях вращения электрода 400, 900, 1600 и 2500 об/мин. Для учета вклада омического падения потенциала и процессов, не связанных с РВК, вольтамперограммы, полученные при развертке потенциала в сторону более положительных значений, нормализовали по общепринятым методикам [45, 46]. Для этого потенциал исследуемого электрода уточняли по формуле: E = = Eизм – ItR, где: Eизм– задаваемое значение потенциала, ItR – омическое падение потенциала, равное произведению силы тока на сопротивление (R) слоя раствора между электродом сравнения и исследуемым электродом, которое составляло в данном случае 23 Ом. Такое значение сопротивления хорошо соответствует литературным данным [29, 46]. Учет вклада процессов, протекающих на электроде в обескислороженном растворе (атмосфера Ar) проводили, вычитая из вольтамперограммы аналогичную кривую, зарегистрированную на этом же электроде при проведении измерений в атмосфере Ar: (I(O2) – I(Ar)), как это описано в [44]. Каталитическую активность катализаторов в РВК (кинетический ток) определяли по нормализованным вольтамперограммам с учетом вклада массопереноса в условиях ВДЭ [29]. Расчет кинетического тока проводили по уравнению Коутетского–Левича: 1/j = 1/jk+ 1/jd, где j – экспериментально измеряемый ток, jd – диффузионнный ток, jk – кинетический ток. Расчет значений кинетических токов проводили для потенциала 0.90 В (ОВЭ).
Испытания электрокатализаторов в мембранно-электродном блоке проводили следующим образом. Диспергируя катализатор и эмульсию Nafion (DE-1021, 10 мас. %) (масс. соотношение Nafion/Углерод = 0.7) в смеси вода/изопропанол, готовили каталитические чернила, которые затем наносили на газодиффузионный слой (ГДС) Freudenberg. Для формирования катодного и анодного слоев наносили исследуемый катализатор в необходимом количестве для достижения загрузки платины 0.4 мг/см2.
Сборку МЭБ проводили на воздухе. Прессование осуществляли в течение 3 мин при температуре 130°С и под давлением 80 атм/см2. Тестирование МЭБ проводили в ячейке Electrochem с активной областью 1 см2 на станции GreenLight Innovation G40 (водород/воздух, со скоростью потока водорода 0.1 л/мин, воздуха – 0.4 л/мин, увлажнение газов 100%, температура 20°С). Для регистрации вольт-амперной кривой использовали потенциостат Elins P40X. Время съемки одной циклической вольтамперограммы – 13 мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Нанесенный на углерод платиномедный катализатор, являющийся конечным продуктом синтеза (образец А4), содержит около 23 мас. % металлов, состав металлической компоненты – PtCu2.2. Массовая доля металлов в промежуточных продуктах А1–А3 возрастает от 5.2 до 19.8 мас. %, а содержание платины составляет 5 (А2) и 11.2 (А3) мас. % (табл. 1).
Таблица 1.
Состав и структурные характеристики Cu/C(А1)- и PtCu/C(А2–А4)-образцов, полученных на каждой стадии синтеза
| Образец | Массовая доля металлов, % | Массовая доля платины, % | Средний размер кристаллитов (РФА), нм | Положение максимума для пика отражения (111) – 2θ, град |
|---|---|---|---|---|
| А1 | 5.3 ± 0.4 | – | 2.3 ± 0.2 | 43.2 |
| А2 | 13.9 ± 0.4 | 5.0 ± 0.2 | 1.5 ± 0.2 | 42.2 |
| А3 | 20.1 ± 0.4 | 11.0 ± 0.4 | 1.9 ± 0.2 | 41.9 |
| А4 | 23.4 ± 0.4 | 13.6 ± 0.4 | 2.2 ± 0.2 | 41.2 |
Таблица 2.
Состав и структурные характеристики PtCu/C-образцов, полученных после обработки в кислотах
| Образец | Состав раствора для обработки | Состав металли-чеcкой компоненты | Массовая доля, мас. % | Средний размер кристаллитов (РФА), нм | ||
|---|---|---|---|---|---|---|
| несгораемого остатка | металлической компоненты | платины, % | ||||
| А4 | – | PtCu2.20/C | 25.7 ± 0.4 | 23.4 ± 0.4 | 13.6 ± 0.4 | 2.8 ± 0.2 |
| А4-1N | 1 M HNO3 | PtCu0.76/C | 18.3 ± 0.4 | 17.4 ± 0.4 | 14.0 ± 0.4 | 2.4 ± 0.2 |
| A4-1Cl | 1 M HClO4 | PtCu0.74/C | 18.0 ± 0.4 | 17.2 ± 0.4 | 13.8 ± 0.4 | 2.6 ± 0.2 |
| A4-1S | 1 M H2SO4 | PtCu0.72/C | 18.6 ± 0.4 | 17.8 ± 0.4 | 14.4 ± 0.4 | 2.5 ± 0.2 |
| A4-5N | 5 M HNO3 | PtCu0.58/C | 17.3 ± 0.4 | 16.6 ± 0.4 | 14.0 ± 0.4 | 1.8 ± 0.2 |
Пик в области 2 тета = 43.3 град на рентгенограмме образца А1 соответствует отражению грани (111) меди. По мере увеличения содержания платины в образцах А2–А4 наблюдается закономерное смещение пика (111) в область меньших значений 2 тета (рис. 1), обусловленное формированием биметаллических систем с повышающейся (от А2 к А4) концентрацией платины.
Рис. 1.
Рентгенограммы металл-углеродных материалов, полученных на каждой стадии последовательного соосаждения меди и платины (вертикальными линиями указаны значения характерных отражений чистых платины и меди).
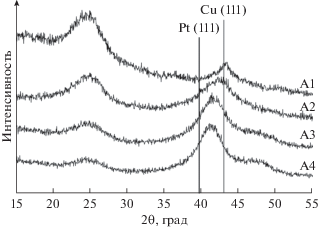
Средние размеры кристаллитов каждого образца, рассчитанные по формуле Шеррера, приведены в табл. 1. При анализе полученных данных учитывали, что рентгеновская дифрактометрия зачастую не дает информации о характере распределения металлов в двухкомпонентных наночастицах [44, 47]. Более того, расчет размера кристаллитов по формуле Шеррера, выполняемый по уширению характерного отражения на рентгеновской дифрактограмме, может давать неточные результаты для наночастиц с неравномерным распределением компонентов, что обусловлено невозможностью разделения отражений фаз на основе каждого компонента [44]. Тем не менее, на основе полученных данных можно сделать вывод о том, что со второй и по четвертую стадию синтеза происходит постепенный рост образующихся наночастиц (кристаллитов) (табл. 1). Уменьшение рассчитанного размера кристаллитов от 2.3 до 1.5 нм при переходе от первой стадии ко второй может быть связано как с усилением неоднородности структуры и вкладом этого фактора в уширение пика, так и с частичным растворением меди и замещением части атомов меди на атомы платины [42].
Далее, разделив полученный многостадийным способом синтеза образец PtCu2.2/C (А4) на порции, подвергли их обработке в различных кислотах (табл. 2), после чего изучили структурные и электрохимические характеристики полученных материалов (табл. 2).
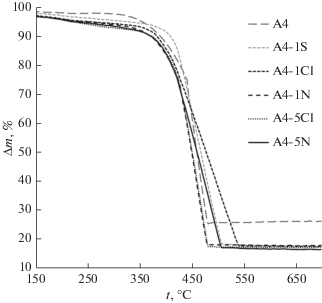
Во всех материалах, полученных после кислотной обработки исходного образца А4, наблюдается близкое снижение массовой доли металлов от 23.4 до 16.6–17.8 мас. %, происходящее за счет селективного растворения значительной части меди и небольшого количества платины. Это приводит к изменению состава металлической компоненты наночастиц от PtCu2.20 в исходном образце А4 до PtCu0.72–0.76 в большинстве образцов (табл. 2). Наименьшее остаточное содержание меди характерно для образца, обработанного 5 М азотной кислотой (PtCu0.58), что может быть связано со спецификой природы кислоты, в которой проводилась его обработка, в сочетании с ее высокой концентрацией (табл. 2). Нельзя также полностью исключать коррозию углеродного носителя, особенно при получении А4-5N. Отметим, что термограммы высокотемпературного окисления PtCu/C-материалов (рис. 2) имеют вид, характерный для платиноуглеродных катализаторов [48, 49]. При этом наиболее быстрое окисление углеродного носителя наблюдается для исходного образца PtCu2.20/C (A4) и материала PtCu0.76/C (А4-1N), подвергнутого обработке в 1 М азотной кислоте. Учитывая приведенные в табл. 2 данные о составе и размере наночастиц, а также результаты работы [48], большая или меньшая продолжительность (температурный диапазон) интенсивного горения исследуемых материалов может быть обусловлена более (быстрое окисление) или менее (медленное окисление) упорядоченным распределением наночастиц по поверхности микрочастиц углеродного носителя.
Рис. 2.
Термограммы высокотемпературного окисления исходного и обработанных в растворах кислот металл-углеродных материалов (маркировка дана в соответствии с табл. 2).
Изменение состава металлической компоненты катализаторов, полученных после кислотной обработки, подтверждают также и результаты рентгеновской дифрактометрии (рис. 3). Максимум отражения (111) для всех постобработанных образцов (рис. 3) смещается в сторону меньших значений углов 2 тета, что является следствием снижения концентрации меди в наночастицах.
Рис. 3.
Рентгенограммы исходного и полученных после его обработки в кислотах металл-углеродных материалов. На врезке (справа) – укрупненный фрагмент области рентгенограммы, выделенной пунктиром.

Для всех катализаторов, полученных после кислотной обработки, характерно снижение значений средних размеров кристаллитов от первоначальных 2.8 до 2.6–1.8 нм (табл. 2). Наиболее существенное уменьшение данного параметра по сравнению с исходным образцом также наблюдается для образца А4-5N, полученного после обработки исходного материала в наиболее агрессивной среде. Возможно, что в условиях быстрой перестройки структуры, обусловленной интенсивной коррозией меди, кристаллиты этого материала приобретают наиболее высокую дефектность, что дает дополнительный вклад в уширение пика на рентгенограмме (рис. 3) и приводит к занижению их среднего размера при расчете по уравнению Шеррера [47].
Циклические вольтамперограммы исходного (А4) и обработанных в кислотах PtCu/C-электрокатализаторов, зарегистрированные в процессе стандартизации, имеют вид, характерный для наночастиц платины или ее сплавов, нанесенных на углеродный носитель Vulcan XC-72 (рис. 4) [16, 50]. В водородной области ЦВА (0.03–0.3 В) наблюдается постепенное увеличение значений токов, обусловленное очисткой и развитием поверхности PtCu/C-материалов (рис. 4). При этом на анодных ветвях ЦВА исходного и всех обработанных в кислотах PtCu/C-материалов (рис. 4) отсутствуют пики в диапазоне потенциалов 0.25–0.35 В, связанные с растворением меди из собственной фазы [16, 36, 44]. Это косвенно свидетельствует об отсутствии прямого контакта фазы меди с электролитом. В то же время разработка поверхности образца A4 (состояние “как получено”) выражена гораздо больше (продолжается в течение большего числа циклов), чем для обработанных в кислоте PtCu/C-катализаторов (рис. 4). Очевидно, что это во многом связано с селективным анодным растворением атомов меди. Этот процесс происходит преимущественно в диапазоне потенциалов 0.60–0.85 В, связан с растворением меди из твердого раствора Pt–Cu [36, 43, 51] и отражается появлением на ЦВА постепенно спадающего локального максимума (рис. 4, образец А4) при вышеуказанных потенциалах. Различия в характере изменений в анодной части ЦВА, наблюдаемые для А4 по сравнению с de-alloyed катализаторами при потенциалах около 1 В, по-видимому, также обусловлены существенным отличием состава поверхности наночастиц.
Рис. 4.
Типичные циклические вольтамперограммы PtCu/C-электрокатализаторов, соответствующие 1, 25, 50, 75 и 100-му циклам стандартизации: а – образец А4, б – образец А4-1N. Стрелками указано направление смещения ЦВА в процессе стандартизации.

Наиболее высокое значение ЭХАП, рассчитанное по области десорбции атомарного водорода на ЦВА стандартизированного катализатора (рис. 5), продемонстрировал образец А4-1Cl – 107 м2/г (Pt), наименьшее, 87 м2/г (Pt) – А4-1S (табл. 3). При этом значения ЭХАП образцов А4‑1Cl, А4-5N и А4 оказались чуть выше, а А4-1N – примерно таким же, как и у коммерческого Pt/C-катализатора (табл. 3). Учитывая точность определения значений ЭХАП (табл. 3), результаты проведенных измерений сами по себе не позволяют говорить о достоверной зависимости ее значений от условий обработки катализатора в кислотах.
Рис. 5.
Циклические вольтамперограммы стандартизированных электрокатализаторов. Скорость развертки потенциала 20 мВ/с, 2-й цикл. Электролит – 0.1 М раствор HClO4, насыщенный Ar при атмосферном давлении.
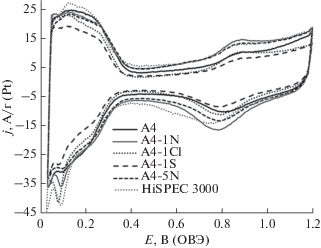
Таблица 3.
Некоторые характеристики Pt/C- и PtCu/C-катализаторов
| Образец | Состав металлической компоненты после проведения электрохимических измерений | ЭХАП, м2/г (Pt) | E1/2, B (1600 мин–1) | Кинетический ток, jk (при E = 0.9 В) | n | |
|---|---|---|---|---|---|---|
| A/г(Pt) | A/м2(Pt) | |||||
| А4 | PtCu0.50/C | 96 ± 9 | 0.90 | 167 | 1.7 | 3.6 |
| А4-1N | PtCu0.55/C | 103 ± 10 | 0.90 | 200 | 1.9 | 4.4 |
| A4-1Cl | PtCu0.45/C | 110 ± 11 | 0.89 | 130 | 1.2 | 4.0 |
| A4-1S | PtCu0.47/C | 88 ± 9 | 0.90 | 117 | 1.3 | 4.2 |
| A4-5N | PtCu0.39/C | 98 ± 9 | 0.90 | 140 | 1.4 | 3.5 |
| HiSPEC 3000 | Pt/C | 95 ± 10 | 0.89 | 182 | 1.9 | 4.0 |
Отметим, что в процессе проведения электрохимических измерений (стандартизация электродов, определение ЭХАП, оценка активности катализаторов в РВК при разных скоростях вращения дискового электрода) все исследованные образцы теряют то или иное количество меди (сравните составы, приведенные в табл. 2 и 3). Потеря составляет от 77% процентов (катализатор А4) до 28–39% (предобработанные в кислотах материалы) от исходной концентрации меди в этих катализаторах. Наименьшая степень извлечения меди характерна для катализаторов А4-1N и А4-5N, обработанных в растворах азотной кислоты (табл. 2, 3).
Активность электрокатализаторов в РВК изучали, регистрируя вольтамперограммы с линейной разверткой потенциала на ВДЭ в атмосфере кислорода. Нормализованные, как это описано в разделе “Экспериментальная часть”, вольтамперограммы представлены на рис. 6а. Связь силы тока и скорости вращения анализировали при потенциале 0.90 В в координатах Коутецкого–Левича (рис. 6б).
Рис. 6.
(а) Потенциодинамические поляризационные кривые катализаторов в РВК. Скорость вращения диска 1600 об/мин. (б) Зависимости 1/Iуд от ω–1/2 при потенциале 0.9 В. Образцы: 1 – А4, 2 – А4-1N, 3 – А4-1Cl, 4 – А4-1S, 5 – А4-5N, 6 – HiSPEC3000. Скорость развертки потенциала 20 мВ/с, электролит – 0.1 М раствор HClO4, насыщенный О2 при атмосферном давлении.

Вольтамперограммы, полученные на всех исследованных PtCu/C-катализаторах, характеризуются близкими значениями потенциала полуволны (табл. 3). Для всех исследуемых образцов РВК протекает по характерному для платины четырехэлектронному механизму (число электронов n ≈ 4) (табл. 3). Масс-активность платиномедных катализаторов в РВК растет в ряду A4-1S ≤ A4-1Cl < < A4-5N < А4 ≤ А4-1N (табл. 3). При этом высокую удельную активность, практически не уступающую активности коммерческого Pt/C-катализатора, проявляют образцы А4-1N и А4 (табл. 3). С учетом литературных данных [42, 43] более высокая удельная активность этих образцов в РВК в сравнении с другими платиномедными катализаторами может быть обусловлена позитивным влиянием атомов меди, преимущественно локализованных во внутренних слоях биметаллических наночастиц. Именно в этих катализаторах остаточная (на момент проведения измерений) концентрация меди наиболее высока (табл. 3).
Важно отметить, что в ходе стандартизации электродов и проведения последующих электрохимических измерений, на всех PtCu/C-катализаторах происходит селективное растворение меди, однако для образцов, предварительно подвергнутых кислотной обработке, изменение состава при этом выражено значительно меньше, чем для исходного PtCu2.2/C-катализатора (сравните составы катализаторов до начала (табл. 2) и после завершения (табл. 3) электрохимических измерений). Это подтверждает сделанное нами предположение о возможном использовании “кислотной” обработки для вымывания из платиномедных катализаторов “слабо связанной” меди11, наличие которой делает проблематичным их использование в МЭБ. Оптимизация условий такой предобработки (образец А4-1N) позволяет получить de-alloyed образец, активность которого, как минимум, не уступает таковой у образца в исходном (необработанном) состоянии (образец А4).
Известно, что катализаторы, проявляющие в электрохимической ячейке высокую активность в РВК, далеко не всегда демонстрируют аналогичные результаты при испытаниях в МЭБ [6, 7]. В случае платиномедных катализаторов негативный эффект может быть также связан и с отравлением Нафиона катионами меди, образующимися в результате ее селективного растворения из биметаллических наночастиц. Для проведения сравнительного испытания катализаторов в МЭБ топливного элемента, были выбраны два предобработанных образца A4-1N и A4-1S, продемонстрировавшие, соответственно, большую и меньшую масс-активность при исследовании в трехэлектродной ячейке с жидким электролитом (табл. 3). В качестве образца сравнения использовали МЭБ, содержащий коммерческий Pt/C-катализатор.
Результаты испытания электрокатализаторов в МЭБ (рис. 7) хорошо коррелируют с результатами исследования их поведения в электрохимической ячейке (табл. 3). Катализатор А4-1N, имеющий, как и другие de-alloyed образцы, пониженное содержание платины в сравнении с коммерческим Pt/C, продемонстрировал в МЭБ характеристики, не уступающие таковым для коммерческого образца HiSPEC 3000. А4-1S оказался наихудшим из трех испытанных катализаторов (рис. 7). Негативных эффектов, связанных с отравлением Нафиона катионами меди, за время эксперимента не обнаружено.
ЗАКЛЮЧЕНИЕ
Синтезирован PtCu2.2/C (13.6 мас. % Pt)-катализатор, содержащий биметаллические наночастицы, в которых концентрация платины увеличивается в направлении от ядра к поверхности наночастиц [43]. Посредством обработки порций этого материала в растворах кислот разной природы и концентрации получены de-alloyed PtCuх/C-катализаторы (13.8–14.4 мас. % Pt) с пониженным содержанием меди (х = 0.58–0.76), площадь электрохимически активной поверхности которых составила от 88 до 110 м2/г(Pt). Столь высокие значения ЭХАП для обработанных в кислотах платиномедных катализаторов, содержащих более крупные наночастицы, чем коммерческий Pt/C-катализатор, в значительной степени связаны с развитием поверхности наночастиц, обусловленным ее реорганизацией в процессе растворения меди. Селективное растворение меди происходит как в ходе “кислотной” предобработки катализаторов, так и в процессе их последующей стандартизации и изучения электрохимического поведения. При этом состав de-alloyed образцов после проведения электрохимических исследований меняется меньше, чем состав исходного PtCu2.2/C-катализатора после аналогичного исследования или обработки в кислотах.
Условия “кислотной” обработки PtCu2.2/C-катализатора (природа и концентрация кислоты) оказывают влияние не только на состав образующихся частично деметаллированных катализаторов, но, по-видимому, и на их активность в РВК. Наибольшую масс-активность в этой реакции проявил катализатор А4-1N, полученный в результате обработки в 1 М азотной кислоте, наименьшую – образец A4-1S, полученный после обработки в 1 М серной кислоте. Результаты сравнительного измерения активности катализаторов в электрохимической ячейке коррелируют с результатами испытаний катализаторов в МЭБ, где образец А4-1N, содержащий около 14 мас. % платины, продемонстрировал активность, не уступающую 20% коммерческому Pt/C (HiSPEC3000), и превышающую активность A4-1S.
Процессы селективного растворения меди из de-alloyed катализаторов, происходящие в ходе их тестирования, не оказали заметного негативного влияния на вольт-амперные характеристики МЭБ. Этот факт подтверждает предположение о том, что “кислотная” предобработка PtCuy/C-материалов позволяет получить достаточно стабильные de-alloyed PtCuy – x/C-катализаторы, эксплуатация которых не должна приводить к существенному отравлению нафиона катионами меди. Следует отметить, что окончательно подтвердить безопасность таких катализаторов по отношению к Нафиону могут только их длительные ресурсные испытания в МЭБ. Тем не менее, значительно более высокая стабильность платиномедных катализаторов по сравнению с Pt/C [42, 43, 52] позволяет ожидать от подобных испытаний благоприятного результата.
Список литературы
Crawley, G., Proton exchange membrane (PEM) fuel cells: opening doors to fuel cell commercialization, Fuel Cell Today, 2006, p. 1.
O’Hayre, R.P., Fuel cell fundamentals, 2nd ed., N. Y., 2009, p. 576.
Kongkanand, A. and Mathias, M.F., The Priority and Challenge of High-Power Performance of Low-Platinum Proton-Exchange Membrane Fuel Cells, The Journal of Physical Chemistry Letters 2016, vol. 7, p. 1127.
Ярославцев, А.Б., Добровольский, Ю.А., Шаглаева, Н.С., Фролова, Л.А., Герасимова, Е.В., Сангинов, Е.А. Наноструктурированные материалы для низкотемпературных топливных элементов. Успехи химии. 2012. Т. 81. С. 191. [Yaroslavtsev, A.B., Dobrovolsky, Yu.A., Shaglaeva, N.S., Frolova, L.A., Gerasimova, E.V., and Sanginov, E.A., Nanostructured materials for low-temperature fuel cells, Russ. Chem. Rev., 2012, vol. 81, p. 191.]
Sui, Sh., Wang, X., Su, Y., Zhou, S., and Riffat, Ch., A comprehensive review of Pt electrocatalysts for the oxygen reduction reaction: Nanostructure, activity, mechanism and carbon support in PEM fuel cells, J. Mater. Chem. A, 2017, vol. 5, p. 1808.
Thompsett, D., Catalysts for the proton exchange membrane fuel cell in Handbook of Fuel Cells. Fundamentals, Technology and Applications, N. Y., 2003.
Holton, O.T. and Stevenson, J.W., The Role of Platinum in Proton Exchange Membrane Fuel Cells, Platinum Met. Rev., 2013, vol. 57, p. 259.
Banham, D.W.H. and Ye, S., Current Status and Future Development of Catalyst Materials and Catalyst Layers for Proton Exchange Membrane Fuel Cells: An Industrial Perspective, ACS Energy Lett., 2017, vol. 2, p. 628.
Shao, M., Chang, Q., Dodelet, J-P., Chenitz R. Recent Advances in Electrocatalysts for Oxygen Reduction Reaction, Chem. Rev., 2016, vol. 116, p. 3594.
Lv, H., Li, D., Strmcnik, D., Paulikas, A.P., Markovic, N.M., and Stamenkovic, V.R. Recent advances in the design of tailored nanomaterials for efficient oxygen reduction reaction, Nano Energy, 2016, vol. 29, p. 149.
Wang, J., Li, B., Yang, D., Lv, H., Zhang, C. Preparation optimization and single cell application of PtNi/C octahedral catalyst with enhanced ORR performance, Electrochimica Acta, 2018, vol. 288, p. 126.
Litster, S., PEM fuel cell electrodes, J. Power Sources, 2004, vol. 130, p. 61.
Gasteiger, H.A. Fuel cell related catalysis in Handbook of heterogeneous catalysis, N.Y., 2008, p. 3081.
Hoogers, G., Fuel cell technology handbook, CRC Press LLC, 2003, p. 335.
Xu, Zh., Zhang, H., Liu, S., Zhang, B., Zhong, H., Su, D. Facile synthesis of supported Pt-Cu nanoparticles with surface enriched Pt as highly active cathode catalyst for proton exchange membrane fuel cells, Int. J. of Hydrogen Energy, 2012, vol. 37, p. 17978.
Guterman, V.E., Lastovina, T.A., Belenov, S.V., et al., PtM/C (M = Ni, Cu, or Ag) Electrocatalysts: Effects of Alloying Components on Morphology and Electrochemically Active Surface Areas, J. of Solid State Electrochemistry, 2014, vol. 18, p. 1307.
Singh, R.N., Awasthi, R., and Sharma, C.S., Review: An overview of recent development of platinum based cathode materials for direct methanol fuel cells, Int. J. Electrochem. Sci., 2014, vol. 9, p. 5607.
Neergat, M. and Rahul, R., Unsupported Cu–Pt Core–Shell Nanoparticles: Oxygen Reduction Reaction (ORR) Catalyst with Better Activity and Reduced Precious Metal Content, J. of The Electrochem. Society, 2012, vol. 159, p. F234.
Antolini, E., Platinum-based ternary catalysts for low temperature fuel cells Part II. Electrochemical properties, Applied Catalysis B: Environmental, 2007, vol. 87, p. 337.
Stamenkovic, V.R., Mun, B.S., Arenz, M., Mayrhofer, K.J.J., Lucas, C.A., Wang, G., Ross, P.N., Markovic, N.M., Trends in electrocatalysis on extended and nanoscale Pt-bimetallic alloy surfaces, Nature Materials, 2007, vol. 6, p. 241.
Jung, N., Chung, D.Y., Ryu, J., Yoo, S.J., and Sung, Y., Pt-based nanoarchitecture and catalyst design for fuel cell applications, Nano Today, 2014, vol. 9, p. 433.
Paulus, U.A., Wokaun, A., and Scherer, G.G., Oxygen Reduction on Carbon-Supported Pt–Ni and Pt–Co Alloy Catalysts, J. Phys. Chem. B, 2002, vol. 106, p. 4181.
Stamenkovic, V., Schmidt, T.J., Ross, P.N., and Markovic, N.M., Surface Composition Effects in Electrocatalysis: Kinetics of Oxygen Reduction on Well-Defined Pt3Ni and Pt3Co Alloy Surfaces, J. Phys. Chem. B, 2002, vol. 106, p. 11970.
Travitsky, N., Ripenbein, T., Golodnitsky, D., Rosenberg, Y., Burshtei, L., and Peled, E., Pt-, PtNi- and PtCo-supported catalysts for oxygen reduction in PEM fuel cells, J. Power Sources, 2006, vol. 161, p. 782.
Strasser, P., Free Electrons to Molecular Bonds and Back: Closing the Energetic Oxygen Reduction (ORR)–Oxygen Evolution (OER) Cycle Using Core–Shell Nanoelectrocatalysts, Acc. Chem. Res., 2016, vol. 49, p. 2658.
Mani, P., Srivastava, R., and Strasser, P., Dealloyed binary PtM3 (M = Cu Co, Ni) and ternary PtNi3M (M = Cu, Co, Fe, Cr), J. Power Sources, 2011, vol. 196, p. 666.
Oezaslan, M. and Strasser, P., Activity of dealloyed PtCo3 and PtCu3 nanoparticle electrocatalyst for oxygen reduction reaction in polymer electrolyte membrane fuel cell, J. Power Sources, 2011, vol. 196, p. 5240.
Nguyen, M.T., Wakabayashi, R.H., Yang, M., Abruna, H.D., and Di Salvo, F.J., Synthesis of carbon supported ordered tetragonal pseudo-ternary Pt2M'M'' (M = Fe Co, Ni) nanoparticles and their activity for oxygen reduction reaction, J. Power Sources, 2015, vol. 280, p. 459.
Hyun, K., Lee, J.H., Yoon, C.W., and Kwon, Y., The effect of platinum based bimetallic electrocatalysts on oxygen reduction reaction of proton exchange membrane fuel cells, Int. J. Electrochem. Sci., 2013, vol. 8, p. 11752.
Gasteiger, H.A., Kocha, Sh.S., Sompalli, B., and Wagner, F.T., Activity benchmarks and requirements for Pt, Pt-alloy, and non-Pt oxygen reduction catalysts for PEMFCs, Appl. Catal. B: Environmental, 2005, vol. 56, p. 9.
Oezaslan, M., Hasche, F., and Strasser, P., PtCu3, PtCu and Pt3Cu alloy nanoparticle electrocatalysts for oxygen reduction reaction in alkaline and acidic media, J. Electrochem. Soc., 2012, vol. 159, p. B444.
Neyerlin, K.C., Srivastava, R., Yu, Ch., and Strasser, P., Electrochemical activity and stability of dealloyed Pt‒Cu and Pt–Cu–Co electrocatalysts for the oxygen reduction reaction (ORR), J. Power Sources, 2009, vol. 186, p. 261.
Antolini, E., Alloy intermetallic compounds: Effect of the ordering on the electrocatalytic activity for oxygen reduction and the stability of low temperature fuel cell catalysts, Applied Catalysis B: Environmental, 2017, vol. 217, p. 201.
Sarkar, A. and Manthiram, A., Synthesis of Pt@Cu Core–Shell Nanoparticles by Galvanic Displacement of Cu by Pt4+ Ions and Their Application as Electrocatalysts for Oxygen Reduction Reaction in Fuel Cells, J. Phys. Chem. C, 2010, vol. 114, p. 4725.
Гутерман, В.Е., Беленов, С.В., Алексеенко, А.А., Табачкова, Н.Ю., Волочаев, В.А. О связи активности и стабильности нанесенных платиноуглеродных электрокатализаторов. Электрохимия. 2017. Т. 53. С. 602. [Guterman, V.E., Belenov, S.V., Alekseenko, A.A., Tabachkova, N.Yu., and Volochaev, V.A., The relationship between activity and stability of deposited platinum-carbon electrocatalysts, Russ. J. Electrochem., 2017, vol. 53, p. 531.]
Zhu, H., Li, X., and Wang, F., Synthesis and characterization of Cu@Pt/C core–shell structured catalysts for proton exchange membrane fuel cell, Int. J. Hydrogen Energy, 2011, vol. 36, p. 9151.
Yu, Z., Zhang, J., and Liu, Z., Comparison between Dealloyed PtCo3 and PtCu3 Cathode Catalysts for Proton Exchange Membrane Fuel Cells, J. Phys. Chem. C, 2012, vol. 116, p. 19877.
Koh, S., Toney, M.F., and Strasser, P., Activity–stability relationships of ordered and disordered alloy phases of Pt3Co electrocatalysts for the oxygen reduction reaction (ORR), Electrochim. Acta, 2007, vol. 52, p. 2765.
Stamenkovic, V.R., Mun, S.B., Mayrhofer, K.J.J. Ross, Ph.N., and Markovic, N.M., Effect of surface composition on electronic structure, stability, and electrocatalytic properties of Pt-transition metal alloys: pt-skin versus pt-skeleton surfaces, J. Am. Chem. Soc., 2006, vol. 128, p. 8813.
Oezaslan, M., Hasché, F., and Strasser, P., Pt-based core–shell catalyst architectures for oxygen fuel cell electrodes, J. Phys. Chem. Lett., 2013, vol. 4, p. 3273.
Kuhl, S. and Strasser, P. Oxygen Electrocatalysis on Dealloyed Pt Nanocatalysts, Top Catal., 2016, vol. 59, p. 1628.
Алексеенко, А.А., Беленов, С.В., Меньщиков, В.С., Гутерман, В.Е. Pt(Cu)/C электрокатализаторы с пониженным содержанием платины. Электрохимия. 2018. Т. 54. С. 477. [Alekseenko, A.A., Belenov, S.V., Men’shchikov, V.S., and Guterman, V.E., Pt(Cu)/C Electrocatalysts with Low Platinum Content // Russian Journal of Electrochemistry, 2018, vol. 54, p. 415.]
Alekseenko, A.A., Guterman, V.E., Belenov, S.V., Menshikov, V.S., Tabachkova, N.Yu., Safronenko, O.I., and Moguchikh, E.A., Pt/C electrocatalysts based on the nanoparticles with the gradient structure, Int. J. of Hydrogen Energy, 2018, vol. 43, p. 3676.
Волочаев, В.А., Беленов, С.В., Алексеенко, А.А., Гутерман, В.Е. О возможности распознавания структуры оболочка–ядро в нанесенных биметаллических наночастицах методом порошковой дифракции. Российские нанотехнологии. 2017. Т. 12. № 5–6. С. 5. [Volochaev, V.A., Belenov, S.V., Alekseenko, A.A., and Guterman, V.E., On the possibilities of recognizing the architecture of binary Pt–M nanoparticles, Nanotechnologies in Russia, 2017, vol. 12, № 5–6, с. 227.]
Киракосян, С.А., Алексеенко, А.А., Гутерман, В.Е., Волочаев, В.А., Табачкова, Н.Ю. Влияние атмосферы СО на морфологию и электрохимически активную площадь поверхности в ходе синтеза Pt/C и Pt–Ag/C электрокатализаторов. Российские нанотехнологии. 2016. Т. 11. С. 23. [Kirakosyan, S.A., Alekseenko, A.A., Guterman, V.E., Volochaev, V.A., and Tabachkova, N.Yu., Effect of co atmosphere on morphology and electrochemically active surface area in the synthesis of Pt/C and PtAg/C electrocatalysts, Nanotechnologies in Russia, 2016, vol. 11, p. 287.]
Shinozaki, K., Zack, J.W., Pylypenko, S., Pivovar, B.S., and Kocha, S.S., Oxygen reduction reaction measurements on platinum electrocatalysts utilizing rotating disk electrode technique: II. Influence of ink formulation, catalyst layer uniformity and thickness, J. Electrochem. Soc., 2015, vol. 162, p. F1384.
Гусев, А.И. Наноматериалы, наноструктуры, нанотехнологии, М.: ФИЗМАТЛИТ, 2009, 416 с.
Guterman, V.E., Belenov, S.V., Krikov, V.V., Vysochina, L.L., Yohannes, W., Tabachkova, N.Yu., and Balakshina, E.N., Reasons for the differences in the kinetics of thermal oxidation of Pt/C nanostructured materials, J. Phys. Chem., C, 2014, vol. 118, p. 23835.
Leontyev, I.N., Leontyeva, D.V., Kuriganova, A.B., Popov, Y.V., Maslova, O.A., Glebova, N.V., and Smirnova, N.V., Characterization of the electrocatalytic activity of carbon-supported platinum-based catalysts by thermal gravimetric analysis, Mendeleev Communications, 2015, vol. 25, p. 468.
Van der Vliet, D., Strmcnik, D.S., Wang, C., Stamenkovic, V.R., Markovic, N.M., and Koper, M.T.M., On the importance of correcting for the uncompensated Ohmic resistance in model experiments of the oxygen reduction reaction, J. Electroanal. Chem., 2010, vol. 647, p. 29.
Wang, Y., Zhou, H., Sun, P., and Chen, T., Exceptional methanol electro-oxidation activity by bimetallic concave and dendritic Pt–Cu nanocrystals catalysts, J. Power Sources, 2014, vol. 245, p. 663.
Могучих, Е.А., Алексеенко, А.А., Гутерман, В.Е., Новиковский, Н.М., Табачкова, Н.Ю., Меньщиков, В.С. Влияние состава и структуры PtCu электрокатализаторов на их стабильность при различных условиях стресс-тестирования. Электрохимия. 2018. Т. 54. С. 976. [Moguchikh, E.A., Alekseenko, A.A., Guterman, V.E., Novikovsky, N.M., Tabachkova, N.Yu., and Menshchikov, V.S., Effect of the Composition and Structure of Pt(Cu)/C Electrocatalysts on Their Stability under Different Stress Test Conditions, Russian Journal of Electrochemistry, 2018, vol. 54, p. 979.]
Дополнительные материалы отсутствуют.



