Электрохимия, 2019, T. 55, № 12, стр. 1411-1423
Определение парацетамола методом анодной квадратно-волновой вольтамперометрии на стеклоуглеродном электроде, модифицированном полилюминолом и функционализированными многостенными углеродными нанотрубками
М. Б. Гхоливанд a, *, Э. Ахмади a
a Университет Рази
Керманшах, Иран
* E-mail: mbgholivand2013@gmail.com
Поступила в редакцию 04.05.2018
После доработки 28.02.2019
Принята к публикации 17.04.2019
Аннотация
Разработан электрохимический сенсор на основе стеклоуглеродного электрода, модифицированного полилюминолом и функционализированными многостенными углеродными нанотрубками, для определения парацетамола. Модифицированный электрод готовили, наливая раствор функционализированных многостенных углеродных нанотрубок на стеклоуглеродный электрод и подвергая люминол электрополимеризации на полученной поверхности. Морфологию поверхности исследовали методами сканирующей электронной микроскопии, а также спектроскопии электрохимического импеданса. Был измерен эффективный параметр и оптимизирован отклик модифицированного электрода. Для определения лекарственного препарата использовали метод анодной квадратно-волновой вольтамперометрии. В оптимальных условиях существуют два линейных динамических диапазона (0.04–32.2 и 32.2–172.2 мкM) зависимости анодного пикового тока и концентрации парацетамола. Наименьшая определяемая концентрация составляет 25 нM. Предложенный электрод успешно опробован при определении парацетамола в фармацевтических препаратах и образцах мочи и сыворотки крови.
ВВЕДЕНИЕ
Парацетамол (ацетаминофен, N-ацетил-п-аминофенол, 4-ацетамидофенол) – это эффективный анальгетик, который обычно используют для облегчения слабых и умеренных болей головы, спины, болей связанных с артритом, и послеоперационных болей; он также действует как жаропонижающее и болеутоляющее средство. Его активность аналогична активности аспирина, так что парацетамол представляет собой хорошую альтернативу для пациентов с повышенной чувствительностью к ацетилсалициловой кислоте [1]. Его также применяют для лечения лихорадочного состояния бактериального или вирусного происхождения [2–4]. Этот лекарственный препарат существует в различных формах – таблеток, капсул, суспензии и суппозиториев. Однако в больших концентрациях парацетамол повреждает печень и почки [5, 6]. Таким образом, для медицинского контроля важно иметь эффективный, чувствительный и простой аналитический метод для быстрого определения парацетамола. Для этой цели были разработаны многочисленныые аналитические методы, такие как спектрофотометрия [7], флуоресцентная спектроскопия [8], жидкостная хроматография высокого разрешения [9], титриметрия [10], капиллярный электрофорез [11] и хемилюминесценция [12]. Электрохимические методы, благодаря их простоте, скорости определений и экономичности, широко применяются в качестве альтернативы перечисленным выше для определения электроактивных соединений, таких как парацетамол, в фармацевтических препаратах и физиологических жидкостях [13–23].
Химики переключили свое внимание на наноразмерные материалы, такие как углеродные нанотрубки, используя их в аналитической химии из-за их уникальных физико-химических свойств. Благодаря своему особенному трубчатому строению углеродные нанотрубки отличаются рядом уникальных свойств, например хорошей электропроводностью, высокой химической стойкостью и экстремальной механической прочностью [24]. Помимо этого их необычное электронное поведение указывает на то, что они могут способствовать протеканию реакций электронного переноса и оказывать сильное электрокаталитическое воздействие, будучи использованы в качестве электродного материала [25]. Все это делает углеродные нанотрубки подходящими кандидатами для модифицирования электродов [26].
Люминол – это важный хемилюминесцентный реактив, который широко используется в аналитической химии и биохимии [27, 28]. В дополнение к его электрохимически генерированным хемилюминесцентным свойствам, его используют и для модифицирования электродов. Недавно электроды, модифицированные пленкой заполимеризованного люминола, были использоваы для определения нескольких аналитов электроаналитическими методами [29–34]. В настоящей работе мы ставим своей задачей разработать избирательный и чувствительный модифицированный электрод для определения парацетамола путем полимеризации люминола на функционализированных многостенных углеродных нанотрубках на поверхности стеклоуглеродного электрода. Как следствие уникальных свойств пленки полилюминола на функционализированных многостенных углеродных нанотрубках, было установлено, что на этом электроде заметно повышена избирательность и чувствительность измерений парацетамола. Насколько нам известно, здесь мы впервые описываем применение стеклоуглеродного электрода, модифицированного полилюминолом и функционализированными многостенными углеродными нанотрубками, для определения парацетамола в присутствии допамина, тирозина, цистеина, лимонной кислоты, сорбитола и глюкозы в фармацевтических препаратах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Люминол был приобретен у компании Aldrich (Милуоки, США) и использован без дополнительной очистки. Карбоксилированные многостенные углеродные нанотрубки (чистота >98%) были приобретены у компании Sigma-Aldrich (Германия). Парацетамол (таблетки и капли) приобретены у компаний, соответственно, Jalinous Co. (Тегеран, Иран) и Shahre Daru Pharmaceutical Co. (Тегеран, Иран). Другие использованные реактивы имели квалификацию “ч. д. а.” и были приобретены у компании Merckor Aldrich. Водные растворы готовили на дважды перегнанной воде. Буферные растворы Бриттона–Робинсона готовили из H3BO3, H3PO4, подгоняли значение рН с помощью CH3COOH (0.04 M) и NaOH (0.2 M); эти растворы использовали, как индифферентные электролиты. Раствор парацетамола (1 мM) готовили ежедневно, растворяя подходящее количество парацетамола в мерной колбе на 10 мл в буферном растворе Бриттона–Робинсона (pH 7.0).
Оборудование
Электрохимические измерения проводили в стандартной трехэлектродной ячейке с помощью потенциостата/гальваностата Autolab, модель PGSTAT 302N, управляемого персональным компьютером с программным обеспечением NOVA 1.8. Электродом сравнения служил Ag/AgCl (насыщ. KCl)-электрод, а противоэлектродом – платиновая проволочка. Рабочие электроды – это стеклоуглеродные электроды либо с чистой поверхностью, либо модифицированные пленкой полилюминола на функционализированных многостенных углеродных нанотрубках. Ячейка с неразделенными электродными пространствами имела объем 10 мл. Все эксперименты проводили при комнатной температуре. Величину pH измеряли рН-метром Metrohm (модель 827). В вольтамперометрических измерениях использовали мешалку-нагреватель IKA, C-MAG HS 7 и ячейку Metrohmcell, представлявшую собой контейнер конической формы объемом 50 мл. Морфологию рабочих электродов изучали методом автоэмиссионной сканирующей электронной микроскопии (SEM) с прибором TSCAN Company (Чешская Республика).
Модифицирование электродов
Перед модифицированием стеклоуглеродный электрод полировали пастой оксида алюминия (зерно 0.05 мкм). Затем его очищали в ультразвуковой ванне с ацетоном, этанолом и дистиллированной водой (по 10 мин в каждой) для удаления адсорбированных частиц. После промывки дважды перегнанной водой проводилась предподготовка электрода путем циклирования его потенциала от 0.1 до 1 В в 0.5 M растворе H2SO4 при скорости развертки потенциала 50 мВ/с до установления устойчивой вольтамперограммы. Затем на чистую поверхность электрода наливали 5 мкл функционализированных многостенных углеродных нанотрубок, диспергированных в диметилформамиде (1 мг/мл), и сушили его при комнатной температуре. Стеклоуглеродный электрод с функционализированными многостенными углеродными нанотрубками погружали в 0.5 M раствор H2SO4, содержащий 1 мM люминола. Далее проводили электрополимеризацию пленки люминола, циклируя потенциал электрода от +0.1 до +1 В со скоростью развертки потенциала 50 мВ/с (10 циклов).
Приготовление реальных образцов
Содержимое 10 таблеток, содержавших по 500 мг парацетамола (Jalinous Pharmaceutical Co., Иран), взвешивали и растирали в ступке до получения тонкого гомогенного порошка. Затем 1 мг этого порошка растворяли в 100 мл буферного раствора Бриттона–Робинсона (pH 7.0), получив окончательную концентрацию 55 мкM. После 20‑минутной ультразвуковой обработки смесь фильтровали и доводили до метки буферным раствором. Такую же методику применяли по отношению к таблеткам, содержавшим по 325 мг парацетамола. Образец капель без какой-либо предобработки просто разбавляли в 1000 раз буферным раствором Бриттона–Робинсона (pH 7.0).
Образцы мочи и сыворотки крови брали у здоровых волонтеров. Из сыворотки крови удаляли белки добавлением 1.5 мл метанола к 1.0 мл сыворотки. После 5-минутного интенсивного перемешивания раствора белковый осадок отделяли центрифугированием в течение 5 мин при 10 000 об/мин. Один миллилитр прозрачного надосадочного раствора, полученного фильтрованием, разбавляли в 10 раз.
Один миллилитр образца мочи центрифугировали и разбавляли в 10 раз без какой-либо дальнейшей обработки. В оба реальных образца добавляли известное количество парацетамола.
Электрохимические измерения
В вольтамперометрическую ячейку помещали 10 мл буферного раствора Бриттона–Робинсона (pH 7.0), и к электроду прикладывали потенциал накопления, равный 0.25 В, на 120 с при перемешивании раствора со скоростью 400 об/мин. перемешивание останавливали на период 10 с (время уравновешивания системы), а затем потенциал сканировали от 0.2 до 0.5 В и снимали квадратно-волновую вольтамперограмму при оптимальных условиях (частота 25 Гц, высота ступени потенциала 5 мВ, амплитуда волны 70 мВ). Полученные вольтамперограммы исправляли на фоновый ток. Затем в вольтамперометрическую ячейку добавляли необходимый объем раствора образца и вновь снимали квадратно-волновую вольтамперограмму, как указано выше; ее использовали для построения калибровочной кривой. После каждого эксперимента электрод промывали дважды перегнанной водой и буферным раствором Бриттона–Робинсона (pH 7.0). Все электрохимические эксперименты проводили при комнатной температуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика морфологии электродов
На рис. 1 приведены SEM-микрофотографии стеклоуглеродного электрода с чистой поверхностью (a), стеклоуглеродного электрода, модифицированного только функционализированными многостенными углеродными нанотрубками (f‑MWCNTs/GCE) (б), и того же электрода, модифицированного полилюминолом и функционализированными многостенными углеродными нанотрубками (PLum/f-MWCNTs) (в). Такое “ступенчатое” модифицирование электрода ясно прослеживается на этих SEM-микрофотографиях. SEM-микрофотография стеклоуглеродного электрода с чистой поверхностью демонстрирует морфологию, лишенную характерных черт (рис. 1a). После модифицирования стеклоуглеродного электрода функционализированными многостенными углеродными нанотрубками (рис. 1б) можно ясно видеть трубчатую структуру этих нанотрубок (средний диаметр 45 нм). Однако, после электрополимеризации люминола на поверхности многостенных углеродных нанотрубок эти нанотрубки все еще видны, но их диаметры слегка увеличены по сравнению с диаметром нанотрубок на электроде (рис. 1б). Это указывает на образование полимера люминола на поверхности функционализированных многостенных углеродных нанотрубок (рис. 1в).
Рис. 1.
SEM-микрофотографии модифицированных стеклоуглеродных электродов, масштабная полоска = 500 нм, (a) стеклоуглеродный электрод с чистой поверхностью, (б) f-MWCTs/GCE, (в) PLum/f-MWCNTs/GCE.

Спектроскопия электрохимического импеданса – это эффективный метод исследования особенностей электродов с модифицированной поверхностью. В спектре импеданса диаметр полуокружности равняется сопротивлению переноса заряда (Ret). На рис. 2 показан типичный годограф электрода PLum/f-MWCNTs/GCE на различных стадиях модифицирования, снятый в 0.1 M растворе KCl, содержащем 2.0 мM Fe$\left( {{\text{CN}}} \right)_{6}^{{{{3 - } \mathord{\left/ {\vphantom {{3 - } {4 - }}} \right. \kern-0em} {4 - }}}}$ в качестве модельной электрохимической окислительно-восстановительной системы. Как видно из рис. 2 (кривая б), после модифицирования стеклоуглеродного электрода функционализированными многостенными углеродными нанотрубками величина Ret уменьшилась (с 860 до 27.3 Ом), и появилась почти прямая линия, представляющая сопротивление Варбурга и замедленную стадию диффузии в электрохимическом процессе. Электрополимеризация люминола на поверхности электрода вызвала некоторое увеличение межфазного сопротивления (кривая в). Это говорит о том, что проводимость PLum/f-MWCNTs/GCE меньше, чем у f-MWCNTs/GCE, и перенос электрона в системе [Fe(CN)6]3–/4– слегка заблокирован. После иммобилизации полилюминола на поверхности электрода f‑MWCNTs/GCE величина Ret выросла до 475 Ом (кривая в). Эти результаты к тому же подтверждают успешную иммобилизацию функционализированных многостенных углеродных нанотрубок и полилюминола на поверхности стеклоуглеродного электрода.
Электрополимеризация люминола
Как видно из рис. 3, полимеризация люминола на f-MWCNTs/GCE проводилась методом циклической вольтамперометрии в водном 0.5 M растворе H2SO4, содержащем 1 мM люминола (10 циклов, скорость развертки потенциала 50 мВ/с). На первом анодном скане виден один анодный пик тока (A1) приблизительно при 0.8 В, который может быть связан с окислением первичной аминогруппы мономера люминола [31], а на обратном скане – катодный пик (C1) при 0.52 В, который может быть аналогом дополнительного анодного пика A2, появляющегося на втором и последующих сканах при 0.56 В. При повторном сканировании потенциала эти два пика тока (C1 и A2) появляются и начинают расти, свидетельствуя об осаждении и росте электроактивного слоя на поверхности электрода. Реакция полимеризации люминола, которая протекает с участием остатка NH2, приводит к димеризации и, в конце концов, к образованию полимера в результате все более и более облегченного окисления димера, тримера, тетрамера и т.д. и последующих реакций сочетания и депротонирования [34, 35]; результатом этого процесса является образование однородного полимерного слоя с адгезией к поверхности стеклоуглеродного электрода (см. SEM-микрофотографии). Химический состав пленки полилюминола, возможно, подобен случаю полианилина (PANI) [29–32, 34, 35]. Окислительно-восстановительная реакция полилюминола аналогична окислительно-восстановительной реакции полианилина, представленной на схеме 1 [31].
Рис. 3.
Циклические вольтамперограммы процесса полимеризации люминола. Вольтамперограммы сняты в 0.5 M растворе H2SO4, содержащем 1 мM люминола, на электроде f-MWCNTs/GCE при скорости развертки потенциала 50 мВ/с, число сканов – 10.

Схема 1 . Окислительно-восстановительная реакция полилюминола.
Электрохимическое окисление парацетамола на стеклоуглеродном электроде, модифицированном полилюминолом и функционализированными многостенными углеродными нанотрубками
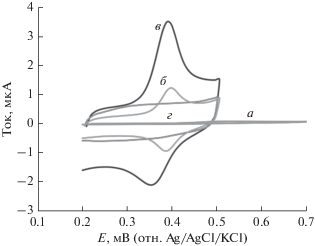
На рис. 4 даны циклические вольтамперограммы буферного раствора Бриттона–Робинсона (pH 7.0), содержащего 40 мкM парацетамола на стеклоуглеродных электродах с чистой поверхностью и модифицированных: f-MWCNTs/GCE и PLum/f-MWCNTs/GCE. Видно, что циклические вольтамперограммы лекарственного препарата, записанные в интервале 0.2–0.7 В на электроде с чистой поверхностью, демонстрируют плохо выраженный окислительно-восстановительный пик тока при 0.55 В (кривая a). Напротив, на f‑MWCNTs/GCE наблюдается пара хорошо выраженных анодного и катодного пиков тока парацетамола (кривая б), что указывает на роль функционализированных многостенных углеродных нанотрубок в ускорении реакции переноса электрона и увеличении площади поверхности электрода f-MWCNTs/GCE. Потенциалы катодного (Epc) и анодного пиков (Epa) лежат вблизи 0.5 В, разность этих потенциалов (ΔEp) составляет около 10.0 мВ, а отношение пиковых токов (ipa/ipc) близко к 1, что указывает на адсорбционную природу реакции парацетамола на поверхности электрода f-MWCNTs/GCE. Мы показали, что после модифицирования электрода f-MWCNTs/GCE полилюминолом не только заметно повышается плотность тока парацетамола, но и потенциалы анодного и катодного пиков тока сдвигаются к менее положительным значениям, показывая, что гибридная пленка PLum/f-MWCNTs на электроде способна эффективно катализировать окисление парацетамола (Ipa/Ipc > 1). Несомненно, парацетамол диффундирует к поверхности электрода и реагирует с гибридной пленкой PLum/f-MWCNTs. Таким образом, наблюдаемый существенный прирост анодного тока есть результат электрокаталитического окисления парацетамола на электроде, модифицированном гибридной пленкой (кривая в). По сравнению со стеклоуглеродным электродом с чистой поверхностью, на котором потенциал окисления парацетамола равняется 0.55 В, на электроде с гибридной пленкой PLum/f-MWCNTs анодное перенапряжение окисления парацетамола понижено больше, чем на 150 мВ. Электрокаталитическое окисление парацетамола на электроде, модифицированном PLum/f-MWCNTs, можно представить следующими уравнениями реакций [29, 32, 36]:
Рис. 4.
Циклические вольтамперограммы, снятые в 40 мкM растворе парацетамола в буферном растворе Бриттона–Робинсона (pH 7.0) при скорости развертки потенциала 50 мВ/с на: a – стеклоуглеродном электроде с чистой поверхностью, б – f-MWCNTs/GCE, в – PLum/f-MWCNTs/GCE, (г) как (в), но в отсутствие парацетамола.
С другой стороны, образование однородного полимерного слоя с адгезией к поверхности стеклоуглеродного электрода, модифицированного функционализированными многостенными углеродными нанотрубками, улучшает перенос электрона, а также оказывает электрокаталитическое действие на окисление парацетамола. В соответствии с механизмом электрохимической полимеризации люминола, окислительно-восстановительная реакция полилюминола аналогична реакции полианилина в том, что касается числа участвующих в ней электронов и протонов. Более того, с учетом опубликованных результатов [37, 38], эти полимерные пленки содержат распределение окисленных и восстановленных участков. Восстановленные участки более гидрофобны по своей природе; таким образом, повышение пиковых токов есть результат накопления парацетамола на восстановленных участках поверхности полимера посредством гидрофобного взаимодействия.
На поверхности электрода PLum/f-MWCNTs/GC отношение пиковых токов (Ipa/Ipc) выше, чем то значение, которое можно было бы объяснить гидратированием окисленной формы лекарства [39]. Поэтому анодный пик тока парацетамола и был выбран для его определения.
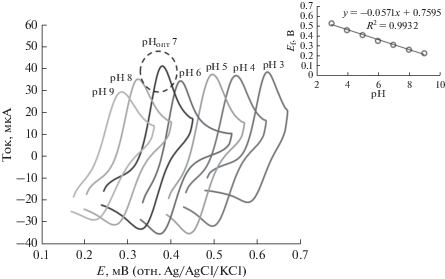
Как показывают уравнения реакций (I) и (II), окислительно-восстановительная реакция зависит от pH. Поэтому было исследовано влияние pH в интервале от 3 до 9 на окислительно-восстановительные токи в пиках и потенциалы этих пиков в 50 мкM растворе парацетамола; результаты представлены на рис. 5. Видно, что наивысший отклик электрода наблюдается при нейтральном pH; поэтому в настоящей работе и было выбрао значение pH 7.0. Более того, как показано на врезке к рис. 5, с ростом pH формальный потенциал [Ef = (Epc + Epa)/2] сдвигается по линейному закону к более отрицательным значениям в соответствии с уравнением линейной регрессии Ef (В) = −0.057pH + 0.759, R = 0.993. Для электрода PLum/f-MWCNTs/GCE получен наклон равный −57.0 мВ/ед. pH, очень близкий к нернстовскому наклону, что указывает на то, что в реакции участвует равное число электронов и протонов. Поэтому для окисления парацетамола принят механизм “два протона, два электрона”, в полном согласии с ранее предложенным механизмом [20, 40, 41].
Рис. 5.
Циклические вольтамперограммы, снятые в 50 мкM растворе парацетамола в 0.1 M буферном растворе Бриттона–Робинсона при различных pH (3–9) на модифицированом электроде при скорости развертки потенциала: 50 мВ/с. Врезка: график зависимости потенциала анодного пика тока от pH раствора.
Методом циклической вольтамперометрии было исследовано влияние скорости развертки потенциала на окислительно-восстановительный процесс с участием парацетамола на модифицированном электроде. На рис. 6 даны циклические вольтамперограммы, снятые в 40 мкM растворе парацетамола в буфере Бриттона–Робинсона (pH 7.0) на электроде PLum/f-MWCNTs/GCE при скоростях развертки потенциала от 10 до 100 мВ/с. С ростом скорости развертки потенциала анодный и катодный пиковые токи увеличиваются по линейному закону (см. врезку (а) на рис. 6):
(1)
${{I}_{{{\text{pa}}}}}\,({\text{мкА}}) = 0.848v\,({{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}) - 5.724,\,\,\,\,\,\,\,{{R}^{2}} = 0.998,$(2)
${{I}_{{{\text{pc}}}}}\,({\text{мкА}}) = - 0.567v\,({{{\text{мВ}}} \mathord{\left/ {\vphantom {{{\text{мВ}}} {\text{с}}}} \right. \kern-0em} {\text{с}}}) + 4.964,\,\,\,\,{{R}^{2}} = 0.991.$Рис. 6.
Циклические вольтамперограммы, снятые в 40 мкM растворе парацетамола в буферном растворе Бриттона–Робинсона (pH 7) при различной скорости развертки потенциала (10–100 мВ/с). На врезках показаны: (a) график зависимости пикового тока от скорости развертки потенциала (10–100 мВ/с), (б) зависимость логарифма анодного пикового тока от логарифма скорости развертки потенциала и (в) зависимость отношения пиковых токов Ipa/Ipc от скорости развертки потенциала v.

Далее, график зависимости lg Ipa от lg v носит линейный характер, с наклоном 1.059 (врезка (б) на рис. 6). Эти результаты показывают, что процесс находится под адсорбционным контролем. Наклон графика для пикового тока окисления парацетамола (0.848 мкA на 1 мВ/с) в 1.5 раза больше, чем для пикового тока восстановления (0.567 мкA на 1 мВ/с); это указывает на то, что пленка PLum/f-MWCNTs демонстрирует более высокую электрокаталитическую активность по отношению к процессу окисления, чем к процессу восстановления. При повышении скорости развертки потенциала потенциал пика тока окисления становится положительнее, что может быть связано с накоплением парацетамола на поверхности электрода. Кроме того, при скорости развертки потенциала 50 мВ/с наблюдается расщепление анодного и катодного пиков приблизительно на 36 мВ. Это значение близко к предсказанному для обратимой двухэлектронной реакции. Таким образом, окислительно-восстановительный процесс с участием парацетамола – обратимый, он сопровождается потерей двух электронов и двух протонов.
Кривая на врезке (в) к рис. 6 показывает зависимость отношения анодного и катодного пиковых токов (Ipa/Ipc) от скорости развертки потенциала (мВ/с). При относительно невысоких скоростях развертки значения Ipa/Ipc превышают 1. С ростом скорости развертки потенциала величина Ipa/Ipc приближается к 1, показывая, что электродной реакции предшествует химическая (гидратация окисленной формы лекарственного препарата), которая снижает ток в катодном пике при низкой скорости развертки потенциала [39].
Влияние потенциала и времени накопления
Для улучшения чувствительности предложенного метода и снижения наименьшей определяемой концентрации, в качестве чувствительного метода для мониторинга парацетамола мы выбрали квадратно-волновую анодную вольтамперометрию. Соответственно, были исследованы параметры анодного окисления. Потенциал накопления Eacc, весьма значимый параметр в методах с анодным окислением, оказывает заметное влияние на чувствительность определения. Влияние потенциала накопления на анодный пиковый ток парацетамола изучали в области потенциалов от –0.30 до 0.5 В. Этот анодный пиковый ток возрастает при сдвиге потенциала накопления с –0.30 до +0.25 В, а при Eacc более положительном, чем 0.25 В, он уменьшается. Таким образом, для последующих экспериментов был выбран потенциал накопления, равный 0.25 В. Мы изучали также влияние времени накопления (tacc) на анодный пиковый ток парацетамола. Варьирование времени накопления показало, что с ростом tacc вплоть до 2 мин в 50 мкM растворе парацетамола анодный пиковый ток постепенно возрастал, а при tacc больше 2 выходил на постоянное значение, что можно объяснить насыщением поверхности электрода. Поэтому мы выбрали время накопления, равное 120 с, для последующих экспериментов. Дополнительно было исследовано влияние скорости перемешивания во время предварительного концентрирования (в интервале от 50 до 1000 об/мин) на анодный пиковый ток. Наилучший результат был получен при скорости 400 об/мин, которая и была выбрана как оптимальная скорость перемешивания.
Аналитические применения
На рис. 7а показан квадратно-волновой анодный вольтамперометрический отклик PLum/f-MWCNTs/GC-электрода при последовательных добавках парацетамола в буферный раствор Бриттона–Робинсона (pH 7.0). Анодный пиковый ток возрастал по линейному закону с ростом концентрации парацетамола в интервале 0.04–172.2 мкM с двумя разными наклонами (см. рис. 7б). Уравнения линейной регрессии для электрода PLum/f-MWCNTs/GCE в интервале концентраций от 0.04 до 32.2 мкM таково: Ipa (мкA) = = 1.1808 cпарацетамол (мкM) – 0.1617 (r2 = 0.999), а в интервале концентраций от 32.2 до 172.2 мкM – таково: Ipa (мкA) = 0.3991 cпарацетамол (мкM) + 25.024 (r2 = = 0.998).
Рис. 7.
(а) Анодные квадратно-волновые вольтамперограммы и (б) калибровочные кривые в двух областях линейности электродной функции для PLum/f-MWCNTs/GCE при последовательном добавлении парацетамола от 0.04 до 172 мкM в буферном растворе Бриттона–Робинсона (pH 7.0) при оптимальных условиях: Eacc = 0.25 В, tacc = 120 с, скорость перемешивания 400 об/мин (рис. 7в, 7г относится к очень низким концентрациям парацетамола, которые недостаточно хорошо видны на рис. 7a, 7б).
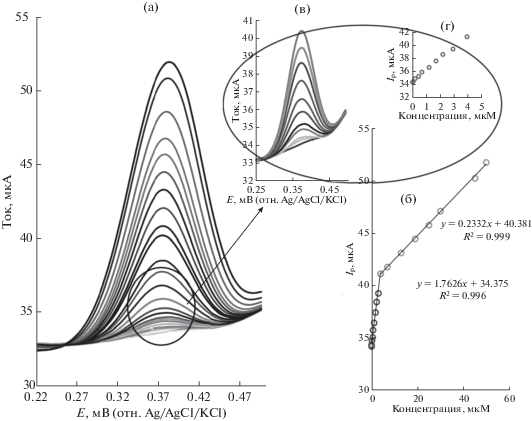
Наименьшая определяемая концентрация (LOD, при отношении сигнал : шум равном 3) и предел количественного определения (LOQ, при отношении сигнал : шум равном 10) таковы: соответственно, 0.025 и 0.085 мкM. Эти величины характеризуют чувствительность предложенного метода.
Высокая чувствительность 37.605 мкA/(мкM cм2) и низкая наименьшая определяемая концентрация, полученные на электроде PLum/f-MWCNTs/GCE, говорят о том, что нанокомпозит PLum/f-MWCNTs подходит для определения парацетамола. Наименьшая определяемая концентрация и линейная калибровочная кривая предложенного электрода сравнимы с соответствующими параметрами описанных ранее методов [41–56], как это следует из сводки данных в табл. 1. Видно, что аналитические характеристики предложенного модифицированного электрода, такие как область линейности, сравнимы с результатами, ранее описанными для определения парацетамола на поверхности других модифицированных электродов [43–58], или превосходят их.
Таблица 1.
Сравнение эксплуатационных характеристик предложенного сенсора и некоторых модифицированных электродов в определении парацетамола
| Электрод | Метод | Область линейности, мкM | Наименьшая определяемая концентрация, мкM | Ссылка |
|---|---|---|---|---|
| Электрод на основе композита графит/полиуретан, полученный методом шелкографии | CVа | 1.00–100 | 0.818 | [42] |
| Нано-TiO2/ионная жидкость [гексафторфосфат 1-бутил-3-метилимидазолия]BF4/ стеклоуглеродный электрод | SWVб | 0.05–50 | 0.01 | [43] |
| Нанокомпозит графен–хитозан/стеклоуглеродный электрод | DPVв | 1.0–100 | 0.3 | [44] |
| Поли(4-аминобензойная кислота)/электрохимически восстановленный оксид графена/стеклоуглеродный электрод | DPVв | 0.1–65 | 0.01 | [45] |
| Композит поли(3,4-этилендиокситиофен)/оксид графена/стеклоуглеродный электрод | CVа | 10–60 | 0.57 | [46] |
| Угольно-пастовый электрод, модифицированный графеном | SWVб | 2.5–143 | 0.6 | [47] |
| Нанокомпозит поли(таурин)/TiO2-графен/стеклоуглеродный электрод | DPVв | 0.1–90 | 0.5 | [48] |
| Нанокомпозит поли(кофеиновая кислота)/стеклоуглеродный электрод | SWVб | 0.2–10 | 0.026 | [49] |
| Наночастицы Fe3O4@SiO2–покрытие из поли(хлорид диаллилдиметиламмония)-углеродные нанотрубки/стеклоуглеродный электрод | DPVв | 10–110 | 0.039 | [50] |
| Композитная пленка TiO2–графен/поли(Метиловыйl Красный)/стеклоуглеродный электрод | DPVв | 0.25–50 | 0.025 | [51] |
| Нанокомпозит многостенные углеродные нанотрубки–SiO2 c покрытием из Al2O3/GCE | SWVб | 0.05–2 | 0.05 | [52] |
| Нафион/TiO2–графен/стеклоуглеродный электрод | DPVв | 1–100 | 0.21 | [53] |
| Графен/стеклоуглеродный электрод | SWVб | 0.1–20 | 0.032 | [54] |
| Электрод из электрохимически обработанного карандашного графита | ATSDPVг | 0.05–2.5 | 0.025 | [55] |
| Наночастицы оксида никеля с покрытием из электрохимически восстановленного графена/стеклоуглеродный электрод | DPVв | 0.04–100 | 0.02 | [56] |
| Нанолистовой гибрид одностенные углеродные нанотрубки–графен/стеклоуглеродный электрод | DPVв | 0.05–64.5 | 0.038 | [57] |
| Одностенные углеродные нанотрубки/ углерод–керамический электрод | DPVв | 0.04–85 | 0.025 | [58] |
| Полилюминол/функционализированные многостенные углеродные нанотрубки/стеклоуглеродный электрод | SWASVд | 0.04–172.2 | 0.025 | Настоящая работа |
Влияние помех
Была проведена оценка сенсора при оптимизированных экспериментальных условиях. Аналитический сигнал лекарственного препарата в реальных образцах подвергается существенному влиянию со стороны присутствующих соединений-помех. Поэтому мы изучили влияние на определение парацетамол (в концентрации 20 и 50 мкM) некоторых посторонних веществ, таких как тирозин, цистеин, лимонная кислота, сорбитол, мочевина, глюкоза и некоторые обыкновенные ионы: ${\text{NO}}_{3}^{ - },$ Cl−, Cu2+, Ca2+, Fe3+, Al3+, ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - },$ ${\text{HPO}}_{4}^{{2 - }},$ ${\text{CO}}_{3}^{{2 - }}$ и ${\text{SO}}_{4}^{{2 - }}.$ Предельно допустимое вредное воздействие мы определили, как максимальную концентрацию, которая вызывает ошибку в определении парацетамола, не превышающую 6%. Экспериментальные результаты показали, что присутствие 200-кратного избытка ${\text{NO}}_{3}^{ - },$ Cl−, Ca2+, Fe3+, Al3+, мочевины, ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - },$ ${\text{HPO}}_{4}^{{2 - }},$ ${\text{CO}}_{3}^{{2 - }},$ 100-кратного избытка Cu2+, ${\text{SO}}_{4}^{{2 - }},$ тирозина, цистеина, лимонной кислоты, сорбитола и 50‑кратного избытка глюкозы не создает помех определению. В присутствии 200-кратного избытка аскорбиновой кислоты наблюдалось приблизительно 4.1%-ное изменение первоначального тока в 20 мкM растворе парацетамола. Исследовали помеху со стороны поверхностно-активного вещества Triton X-100; было показано, что присутствие этого соединения даже в равной концентрации оказывает значительное влияние на определение лекарства, что может быть вызвано сродством Triton X-100 к адсорбции на поверхности электрода и связанным с этим загрязнением электрода. Эти результаты показывают, что предложенный электрод нечувствителен к помехам, вызванным посторонними соединениями, и метод анализа избирателен к парацетамолу.
Воспроизводимость и повторяемость модифицированного электрода
Для того, чтобы исследовать повторяемость отклика модифицированного электрода, мы провели 10 одинаковых измерений пикового тока в 10 мкM растворе парацетамола. Относительное стандартное отклонение (RSD) составило 2.1%. Дополнительно мы протестировали долговременную стабильность электрода PLum/f-MWCNTs/GCE, поставив его на хранение в сухой атмосфере при комнатной температуре на один месяц. Токовый отклик после этого уменьшился меньше, чем на 5% от своего первоначального значения в том же растворе парацетамола, что доказывает хорошую стабильность модифицированного электрода. Для оценки воспроизводимости предложенного сенсора были изготовлены пять электродов PLum/f-MWCNTs /GCE в одних и тех же условиях. Их использовали для определения парацетамола в его 10 мкM растворе в оптимизированных условиях. Относительное стандартное отклонение составило меньше 5%. Этот результат показывает, что электрод PLum/f-MWCNTs/GCE отличается прекрасными стабильностью, повторяемостью и воспроизводимостью при определении парацетамола.
Анализ реальных образцов
Предложенный метод был использован для определения парацетамола в фармацевтических препаратах, таких как таблетки (Jalinous Co., Тегеран, Иран) и капли (Shahre Daru Co., Тегеран, Иран), и образцах мочи и сыворотки крови при оптимальных условиях. Содержание парацетамола в фармацевтических препаратах и биологических образцах определяли методом анодной квадратно-волновой вольтамперометрии, используя методику стандартных добавок. Как показано в табл. 2, при использовании электрода PLum/f-MWCNTs /GCE процент обратного извлечения парацетамола лежит между 96 и 106%. Эти результаты демонстрируют возможности предложенного сенсора для вольтамперометрического определения парацетамола в фармацевтических препаратах и биологических образцах с различными матриксами.
Таблица 2.
Определение парацетамола в реальных образцах
| Образец | Определено данным методом, мкM | Добавлено, мкM | Процент обратного извлечения, % | Относительное стандартное отклонение, % |
|---|---|---|---|---|
| Таблетка 325 мг | 4.95 | 5 | 99 | 2.10 |
| 7.68 | 7.5 | 102.4 | 2.84 | |
| Таблетка 500 мг | 13.03 | 13.2 | 98.71 | 2.54 |
| 6.70 | 6.6 | 101.5 | 3.23 | |
| Капли | 6.49 | 6.6 | 98.33 | 1.89 |
| Сыворотка крови | 5.3 | 5 | 106 | 3.4 |
| 9.85 | 10 | 98.5 | 2.1 | |
| Моча | 4.8 | 5 | 96 | 2.8 |
| 10.2 | 10 | 102 | 2.2 |
ЗАКЛЮЧЕНИЕ
В настоящей работе предложен стеклоуглеродный электрод, модифицированный полилюминолом и функционализированными многостенными углеродными нанотрубками, который успешно использован для определения парацетамола в фармацевтических препаратах и образцах мочи и сыворотки крови. Повышение пикового тока на модифицированном электроде связано, по-видимому, с тонкими электронными свойствами, сильной адсорбируемостью и электрокаталитическим действием гибридной пленки PLum/MWNTs (полилюминола и функционализированных многостенных углеродных нанотрубок) на стеклоуглеродном электроде. В результате был разработан очень чувствительный и простой электрохимический метод, который привел к желаемым результатам. Точность и повторяемость предложенного метода иллюстрируются удовлетворительной величиной процента обратного извлечения и низким относительным стандартным отклонением. Показано, что этот электрохимический сенсор, использущий пленку полилюминола и функционализированных многостенных углеродных нанотрубок, дает быстрый, устойчивый и хорошо выраженный отклик на окисление парацетамола.
Список литературы
Wade, M.A., The Extra Pharmacopoeia, London: The Pharmaceutical Press, 1979, p. 32.
Aghababian, R., Essentials of Emergency Medicine: Massachusetts, Jones & Bartlett, 2010.
Carvalho, R.M., Freire, R.S., and Rath, S., Effects of EDTA on signal stability during electrochemical detection of acetaminophen, J. Pharmaceut. Biomed. Anal., 2004, vol. 34, p. 871.
Nikles, C.J., Yelland, M., and Del Mar, C., The role of paracetamol in chronic pain: an evidence-based approach, Amer. J. Therapeutics, 2005, vol. 12, p. 80.
Clayton, B.D. and Stock, Y.N., Basic Pharmacol. for Nurses, St. Louis: Mosby, Harcourt Health Sciences Company, 2001.
Trounce, J.R. and Gould,D., Clinical Pharmacol. for Nurses, London: Churchill Livingstone, 1997.
Filik, H., Aksu, D., and Apak, R., An optical fibre reflectance sensor for p-aminophenol determination based on tetrahydroxycalix [4] arene as sensing reagent, Sensors Actuators B: Chemical, 2009, vol. 136, p. 105.
Moreira, A.B., Oliveira,H.P., and Atvars,T.D., Direct determination of paracetamol in powdered pharmaceutical samples by fluorescence spectroscopy, Anal. Chim. Acta, 2005, vol. 539, p. 257.
Nebot, C., Gibb, S.W., and Boyd, K.G., Quantification of human pharmaceuticals in water samples by high performance liquid chromatography–tandem mass spectrometry, Anal. Chim. Acta, 2007, vol. 598, p. 87.
Srivastava, M.K., Ahmad,S., and Singh, D., Titrimetric determination of dipyrone and paracetamol with potassium hexacyanoferrate(III) in an acidic medium, Anal., 1985, vol. 110, p. 735.
Pérez-Ruiz, T., Martínez-Lozano, C., and Tomás, V., Migration behaviour and separation of acetaminophen and p-aminophenol in capillary zone electrophoresis: Analysis of drugs based on acetaminophen, J. Pharmaceut. Biomed. Analysis, 2005, vol. 38, p. 87.
Ruengsitagoon, W., Liawruangrath, S., and Townshend, A., Flow injection chemiluminescence determination of paracetamol, Talanta, 2006, vol. 69, p. 976.
Miner, D.J.,Rice, J.R. and Riggin, R.M., Voltammetry of acetaminophen and its metabolites, Anal. Chem., 1981, vol. 53, p. 2258.
Zen, J.-M. and Ting, Y.-S., Simultaneous determination of caffeine and acetaminophen in drug formulations by square-wave voltammetry using a chemically modified electrode, Anal. Chim. Acta, 1997, vol. 342, p. 175.
Curulli, A., Valentini, F., and Padeletti, G., Smart (Nano) materials: TiO2 nanostructured films to modify electrodes for assembling of new electrochemical probes, Sensors Actuators B: Chemical, 2005, vol. 111, p. 441.
Gómez-Caballero, A., Goicolea, M.A., and Barrio, R.J., Paracetamol voltammetric microsensors based on electrocopolymerized–molecularly imprinted film modified carbon fiber microelectrodes, Analyst, 2005, vol. 130, p. 1012.
Goyal, R.N., Gupta, V.K., and Oyama, M., Differential pulse voltammetric determination of paracetamol at nanogold modified indium tin oxide electrode, Electrochem. Commun., 2005, vol. 7, p. 803.
Felix, F.S., Brett,C.M., and Angnes, L.,Carbon film resistor electrode for amperometric determination of acetaminophen in pharmaceutical formulations, J. Pharmaceut. Biomed. Anal., 2007, vol. 43, p. 1622.
Özcan, L. and Şahin, Y., Determination of paracetamol based on electropolymerized-molecularly imprinted polypyrrole modified pencil graphite electrode, Sensors Actuators B: Chemical, 2007, vol. 127, p. 362.
Wang, S.-F., Xie, F., and Hu, R.-F., Carbon-coated nickel magnetic nanoparticles modified electrodes as a sensor for determination of acetaminophen, Sensors Actuators B: Chemical, 2007, vol. 123, p. 495.
Atta, N.F. and El-Kady, M.F., Poly (3-methylthiophene)/palladium sub-micro-modified sensor electrode. Part II: Voltammetric and EIS studies, and analysis of catecholamine neurotransmitters, ascorbic acid and acetaminophen, Talanta, 2009, vol. 79, p. 639.
Atta, N.F., El-Kady, M.F., and Galal, A., Palladium nanoclusters-coated polyfuran as a novel sensor for catecholamine neurotransmitters and paracetamol, Sensors Actuators B: Chemical, 2009, vol. 141, p. 566.
Nematollahi, D., Shayani-Jam, H., and Alimoradi, M., Electrochemical oxidation of acetaminophen in aqueous solutions: kinetic evaluation of hydrolysis, hydroxylation and dimerization processes,Electrochim. Acta, 2009, vol. 54, p. 7407.
Jorio, A., Dresselhaus, G., and Dresselhaus, M.S., Carbon Nanotubes: Advanced Topics in the Synthesis, structure, Properties and Applications, Berlin: Springer Science & Business Media, 2007.
Wang, J., Carbon-nanotube based electrochemical biosensors: a review, Electroanalysis, 2005, vol. 17, p. 7.
Shen, Q. and Wang, X., Simultaneous determination of adenine, guanine and thymine based on β-cyclodextrin/MWNTs modified electrode, J. Electroanal. Chem., 2009, vol. 632, p. 149.
Knight, A.W., A review of recent trends in analytical applications of electrogenerated chemiluminescence, TrAC Trends Anal. Chem., 1999, vol. 18, p. 47.
Richter, M.M., Electrochemiluminescence (ecl), Chem. Rev., 2004, vol. 104, p. 3003.
Chen, S.-M. and Lin, K.-C., The electrocatalytic properties of biological molecules using polymerized luminol film-modified electrodes, J. Electroanal. Chem., 2002, vol. 523, p. 93.
Kumar, S.A., Cheng, H.W., and Chen, S.M., Selective detection of uric acid in the presence of ascorbic acid and dopamine using polymerized luminol film modified glassy carbon electrode, Electroanalysis, 2009, vol. 21, p. 2281.
Kumar, S.A., Cheng, H.-W., and Chen, S.-M., Electroanalysis of ascorbic acid (vitamin C) using nano-ZnO/poly (luminol) hybrid film modified electrode, Reactive Functional Polymers, 2009, vol. 69, p. 364.
Lin, K.-C. and Chen, S.-M., Reversible cyclic voltammetry of the NADH/NAD+ redox system on hybrid poly (luminol)/FAD film modified electrodes, J. Electroanal. Chem., 2006, vol. 589, p. 52.
Sassolas, A., Blum, L.J., and Leca-Bouvier, B.D., New electrochemiluminescent biosensors combining polyluminol and an enzymatic matrix, Anal. Bioanal. Chem., 2009, vol. 394, p. 971.
Zhang, G.-F. and Chen, H.-Y., Studies of polyluminol modified electrode and its application in electrochemiluminescence analysis with flow system, Anal. Chim. Acta, 2000, vol. 419, p. 25.
Ferreira, V., Cascalheira, A., and Abrantes, L., Electrochemical copolymerisation of luminol with aniline: A new route for the preparation of self-doped polyanilines, Electrochim. Acta, 2008, vol. 53, p. 3803.
Chang, Y.-T., Lin, K.-C., and Chen, S.-M., Preparation, characterization and electrocatalytic properties of poly (luminol) and polyoxometalate hybrid film modified electrodes, Electrochim. Acta, 2005, vol. 51, p. 450.
Martin, L.S.V.D.C.R. and Murray R.W. (Eds.), Mass and Charge Transport in Electronically Conductive Polymers, in Molecular Design of Electrode Surfaces, New York: Wiley, 1992, p. 403.
Kumar, S.S., Mathiyarasu, J., and Phani, K. L., Determination of Uric Acid in the Presence of Ascorbic Acid Using Poly (3, 4-ethylenedioxythiophene)-Modified Electrodes, Electroanalysis, 2005, vol. 17, p. 2281.
Van Benschoten, J.J., Lewis, J.Y., and Heineman, W.R., Cyclic voltammetry experiment, J. Chem. Educ., 1983, vol. 60, p. 772.
Kumar, S.A., Tang, C.-F., and Chen, S.-M., Electroanalytical determination of acetaminophen using nano-TiO2/polymer coated electrode in the presence of dopamine, Talanta, 2008, vol. 76, p. 997.
Manjunatha, R., Nagaraju, D.H., and Suresh, G.S., Electrochemical detection of acetaminophen on the functionalized MWCNTs modified electrode using layer-by-layer technique, Electrochim. Acta, 2011, vol. 56, p. 6619.
Saciloto, T.R., Cervini, P., and Gomes Cavalheiro, E.T., New screen printed electrode based on graphite and polyurethane composite for the determination of acetaminophen, Anal. Lett., 2013, vol. 46, p. 312.
Wang, B., Li, Y., and Qin, X., Electrochemical fabrication of TiO2 nanoparticles/[BMIM] BF4 ionic liquid hybrid film electrode and its application in determination of p-acetaminophen, Mater. Sci. Eng.: C, 2012, vol. 32, p. 2280.
Zheng, M., Gao, F., and Wang, Q., Electrocatalytical oxidation and sensitive determination of acetaminophen on glassy carbon electrode modified with graphene–chitosan composite, Mater. Sci. Eng.: C, 2013, vol. 33, p. 1514.
Zhu, W., Huang, H., and Gao, X., Electrochemical behavior and voltammetric determination of acetaminophen based on glassy carbon electrodes modified with poly (4-aminobenzoic acid)/electrochemically reduced graphene oxide composite films, Mater. Sci. Eng.: C, 2014, vol. 45, p. 21.
Catt, K., Li, H., and Cui, X.T., Poly (3,4-ethylenedioxythiophene) graphene oxide composite coatings for controlling magnesium implant corrosion,Acta Biomater., 2017, vol. 48, p. 530.
Bahramipur, H. and Jalali, F., Sensitive determination of paracetamol using a graphene-modified carbon-paste electrode, African J. Pharmacy Pharmacol., 2012, vol. 6, p. 1298.
Xiong, X.-Q., Huang, K.-J., and Xu, C.-X., Glassy carbon electrode modified with poly (taurine)/TiO2-graphene composite film for determination of acetaminophen and caffeine, Chem. Industry and Chem. Eng. Quarterly/CICEQ, 2013, vol. 19, p. 359.
Filik, H., Avan, A.A., and Aydar, S., Determination of acetaminophen in the presence of ascorbic acid using a glassy carbon electrode modified with poly (caffeic acid), Int. J. Electrochem. Sci, 2014, vol. 9, p. 148.
Zalani Sofla, S., Moradi, M., and Mohammadnezhad, S., Design of a Novel Nano-Sensor for Determination of Acetaminophen, J. Appl. Environ. Biological Sci., 2014, vol. 4, p. 51.
Xu, C.-X., Huang, K.-J., and Fan, Y., Electrochemical determination of acetaminophen based on TiO2–graphene/poly (methyl red) composite film modified electrode, J. Molecular Liquids, 2012, vol. 165, p. 32.
Lu, T.-L. and Tsai, Y.-C.,Sensitive electrochemical determination of acetaminophen in pharmaceutical formulations at multiwalled carbon nanotube-alumina-coated silica nanocomposite modified electrode, Sensors Actuators B: Chemical, 2011, vol. 153, p. 439.
Fan, Y., Liu, J.-H., and Lu, H.-T., Electrochemical behavior and voltammetric determination of paracetamol on Nafion/TiO2–graphene modified glassy carbon electrode," Colloids Surf. B: Biointerfaces, 2011, vol. 85, p. 289.
Kang, X., Wang, J., and Wu, H., A graphene-based electrochemical sensor for sensitive detection of paracetamol, Talanta, 2010, vol. 81, p. 754.
Özcan, A. and Şahin, Y., A novel approach for the determination of paracetamol based on the reduction of N-acetyl-p-benzoquinoneimine formed on the electrochemically treated pencil graphite electrode, Anal. Chim. Acta, 2011, vol. 685, p. 9.
Liu, G.-T., Chen, H.-F., and Lin, G.-M., One-step electrodeposition of graphene loaded nickel oxides nanoparticles for acetaminophen detection, Biosensors Bioelectronics, 2014, vol. 56, p. 26.
Chen, X., Zhu, J., and Xi, Q., A high performance electrochemical sensor for acetaminophen based on single-walled carbon nanotube–graphene nanosheet hybrid films, Sensors Actuators B: Chemical, 2012, vol. 161, p. 648.
Habibi, B., Jahanbakhshi, M., and Pournaghiazar, M.H., Electrochemical oxidation and nanomolar detection of acetaminophen at a carbon-ceramic electrode modified by carbon nanotubes: a comparison between multi walled and single walled carbon nanotubes, Microchim. Acta, 2011, vol. 172, p. 147.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия




