Электрохимия, 2019, T. 55, № 12, стр. 1424-1434
Угольно-пастовый электрод, модифицированный нанокомпозитом оксид графена/Fe3O4@SiO2/ионная жидкость, для вольтамперометрического определения ацетаминофена в присутствии тирозина
Х. Бейтоллахи a, *, Ф. Г. Нежад a, **
a Университет последипломного образования
Керман, Иран
* E-mail: h.beitollahi@yahoo.com
** E-mail: f.garkani95@gmail.com
Поступила в редакцию 17.10.2018
После доработки 21.12.2018
Принята к публикации 26.04.2019
Аннотация
Предложен новый процесс модифицирования угольно-пастового электрода с помощью магнитного нанокомпозита со структурой core–shell оксид графена/Fe3O4@SiO2/ионная жидкость (гексафторфосфат н-гексил-3-метилимидазолия). Исследованы электрохимические свойства такого модифицированного угольно-пастового электрода и оценивается его поведение при одновременном определении ацетаминофена и тирозина путем их вольтамперометрического окисления. Дополнительно были использованы такие диагностические методы, как циклическая вольтамперометрия, квадратно-волновая вольтамперометрия и хроноамперометрия, с целью изучения особенностей электрохимического окисления ацетаминофена при работе сенсора. Согласно данным квадратно-волновой вольтамперометрии, линейный динамический интервал при определении ацетаминофена составляет 1.0 × 10−6–1.0 × 10−3 M. Модифицированный электрод удовлетворительно ведет себя при анализе реальных образцов, содержащих ацетаминофен и тирозин.
ВВЕДЕНИЕ
N-ацетил-p-аминофенол, известный как ацетаминофен, – это одно из самых распространенных обезболивающих в мировой практике [1]. Ацетаминофен обычно используют в качестве жаропонижающего и болеутоляющего лекарства [2]. В качестве болеутоляющего его применяют для облегчения как сильной головной и зубной боли, так и болей при онкологических заболеваниях и послеоперационных болей. Будучи жаропонижающим средством, он облегчает лихорадочное состояние бактериальной или вирусной природы [3, 4].
Ацетаминофен не проявляет канцерогенной активности, он является подходящей альтернативой аспирину для пациентов, испытывающих аллергию к аспирину [5]. Метаболизм ацетаминофена состоит главным образом в генерировании токсичных метаболитов в печени [6]. В рекомендованных дозах он безопасен и не вызывает опасного побочного эффекта. Однако передозировка ацетаминофена повреждает печень и почки в результате накопления токсичных метаболитов [7].
Тирозин входит в число 20 стандартных аминокислот, рассматриваемых, как “строительные блоки” белков. Это – вторичная аминокислота, поскольку она может быть получена из фениламина – другой аминокислоты в человеческом организме [8]. Организм использует тирозин для “изготовления” мессенджеров (посредников), таких как допамин, l-допа и эпинефрин. Он также входит в тироидные гормоны, пигмент меланин и несколько опиатных пептидов – боковых цепочек (тирозил) в последовательностях аминокислот. Его находят в высокобелковой пище, однако некоторые лекарственные формы включают тирозин для восполнения его недостатка в вегетарианских диетах. С недостатком тирозина связаны некоторые психические заболевания, такие как депрессия, альбинизм (отсутствие нормальной пигментации) и алкаптонурия, в то время как его избыток также ведет к психическим нарушениям и болезни Паркинсона [9–13].
Окисление ацетаминофена и тирозина на различных электродах дает хорошо различимый электрохимический сигнал. Однако их окисление на обычных электродах сопровождается весьма высоким перенапряжением [14]. Поэтому все больше затрачивается усилий для разработки соответствующих сенсоров, уменьшения перенапряжения и повышения их чувствительности, точности и простоты устройства, с одновременным учетом их стоимости.
До настоящего времени для определения ацетаминофена и тирозина как по-отдельности, так и в их смесях используют различные аналитические методики, такие как спектрофотометрия [15], хроматография [16], флуорометрия [17] и капиллярный электрофорез [18]. Все эти методы страдают такими недостатками, как длительные и дорогие процедуры измерений, а также необходимость подготовительных стадий.
В то же время за последние 20 лет большое внимание привлекли электрохимические сенсоры, благодаря своему быстрому отклику, низкой наименьшей определяемой концентрации, дешевизне, простоте обращения и отсутствию подготовительных операций [19].
Начиная с 1958 г., когда Адамс (Adams) ввел в практику эксперимента угольно-пастовые электроды, последние привлекли большее внимание, чем другие электроды на основе углерода, и широко используются в электрохимии и ее электроаналитических приложениях. Угольно-пастовые электроды демонстрируют такие преимущества, как легкость изготовления и обновления поверхности, экономичность, низкое омическое сопротивление, устойчивый отклик, нечувствительность по отношению к химическим реактивам, устойчивость конструкции, работа в отсутствие внутреннего раствора и способность к модифицированию с помощью различных модификаторов. Это делает их эффективными сенсорами для определения широкого круга целевых аналитов. К тому же они не токсичны и экологически безвредны. Угольно-пастовый электрод представляет собой трубочку, заполненную графитовой пастой; ее легко приготовить диспергированием графита в гидрофобном связующем (биндере) [20–24].
Для того чтобы повысить эффективность обыкновенного электрода для его использования в сенсоре, применяется общепринятый метод модифицирования. Модифицированные электроды демонстрируют не только более высокие электрохимическую активность, чувствительность и избирательность, но и более низкую наименьшую определяемую концентрацию, чем традиционные электроды [25–39].
Недавно в конструкции электрохимических сенсоров расширилось применение наночастиц [40]. Наноматериалы – это “сконструированные” частицы с большим отношением поверхности к объему и размером менее 100 нм.
При модифицировании электродов часто используют наночастицы Fe3O4, потому что они обеспечивают большую площадь поверхности электрода, повышают его электропроводность и улучшают кинетику переноса электрона между поверхностью электрода и разнообразными электроактивными аналитами [41, 42].
Покрытие поверхности наночастиц магнетита инертными наночастицами оксида кремния помогает предотвратить агрегирование наночастиц магнетита и улучшить их химическую устойчивость.
Стабилизация наночастиц магнетита с помощью покрытия оксидом кремния протекает через два различных процесса. Фактически оболочка из оксида кремния действует как экран по отношению к взаимодействию диполей магнетита. Более того, будучи заряженными отрицательно на поверхности, наночастицы оксида кремния способны усиливать кулоновское отталкивание между наночастицами магнетита [43].
Графен – это монослой углерода со структурой графита с двумя размерными сетевыми углеродными структурами с sp2-связями. Структура оксида графена, важного производного графена, имеет в своей структуре оконечные группы COOH, связи C–OH и C–O–C. Оксид графена демонстрирует особые свойства – такие, как большая площадь поверхности, высокая проводимость и прекрасная механическая прочность [44].
Наночастицы магнитного оксида железа используют для декорирования оксида графена с целью улучшить магнитные, оптические или электрохимические свойства оксида графена. Такая комбинация, ведущая к улучшению характеристик оксида графена, создает много возможных вариантов для модифицирования электродов [45].
Ионные жидкости демонстрируют многообещающие и эффективные электрохимические особенности, такие как хорошая проводимость и широкая область идеальной поляризуемости. Это делает их привлекательными для применения в электрохимических сенсорах. Поэтому наноструктурированные электроды, модифицированные ионными жидкостями, хорошо приспособлены для анализа биологических и фармацевтических препаратов [46–49].
В настоящей работе описано модифицирование угольно-пастового электрода с помощью ионной жидкости и магнитного нанокомпозита со структурой core–shell оксид графена/Fe3O4@SiO2. Работу такого модифицированного электрода исследовали при одновременном определении ацетаминофена и тирозина в водных растворах и в реальных образцах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и реактивы
Электрохимические измерения проводили с помощью потенциостата/гальваностата Autolab (PGSTAT 302N, Eco Chemie, Нидерланды). Условия эксперимента контролировались с помощью программного обеспечения General Purpose Electrochemical System (GPES), предназначенного для решения широкого круга задач. Использовали стандартную трехэлектродную ячейку с Ag/AgCl/KCl (3.0 M)-электродом сравнения, вспомогательным электродом – платиновой проволочкой и рабочим электродом оксид графена/Fe3O4@SiO2. Измерения проводили при 25 ± ± 1°C. Измерения pH вели с помощью pH-метра Metrohm 710.
Ацетаминофен, тирозин и все остальные реактивы имели квалификацию “ч. д. а.” и были приобретены у компании Merck (Дармштадт, Германия). Для приготовления буферных растворов в области pH 2.0–9.0 использовали ортофосфорную кислоту и ее соли.
Ионная жидкость (гексафторфосфат н-гексил-3-метилимидазолия) была приобретена у компании Sigma Aldrich Co.
Синтез нанокомпозита оксид графена/Fe3O4@SiO2
Превращение групп –OH оксида графена в группы –COOH обычно проводили по следующей методике:
50 мл водной суспензии оксида графена (2 мг мл−1) обрабатывали в ультразвуковой ванне в течение 1 ч до получения прозрачного раствора. Затем добавляли 12 г NaOH и 10 г хлоруксусной кислоты и снова обрабатывали в ультразвуковой ванне в течение 2 ч. Наконец, полученный продукт графен–COOH нейтрализовали и очищали [50].
Однородную суспензию оксида графена–COOH получали, растворяя 0.06 г карбоксилированного оксида графена в 42 мл воды при облучении ультразвуком в течение 20 мин. Далее, продолжали интенсивное перемешивание при 60°C в течение 30 мин. Затем добавляли 106.2 мг FeCl3 · 6H2O при интенсивном перемешивании в атмосфере N2 в течение 30 мин. К полученному раствору добавляли 57 мг FeSO4 · 7H2O и перемешивали еще 30 мин. В течение 1 ч добавляли капельками по 18 мл NH4OH (6%) при 60°C. Через два часа реакция полностью закончилась. Все этапы процесса проводили в атмосфере N2 для того, чтобы предотвратить критическое окисление. В конце концов был получен продукт – черный осадок наночастиц оксида графена/Fe3O4, который отделяли центрифугированием, промывали дважды перегнанной водой и сушили.
Нанокомпозит оксид графена/Fe3O4@SiO2 готовили, выращивая пленки оксида кремния на поверхности оксида графена/Fe3O4 по следующей методике, описанной в работе [26]:
В трехгорлую склянку объемом 250 мл помещали 90 мкл тетраэтилортосиликата, 15 мл этанола, 0.6 мл гидроксида аммония и 0.6 мл воды при температуре 40°C (водяная баня). К этому раствору добавляли оксид графена/Fe3O4 при механическом перемешивании. Через 12 ч приготовленный нанокомпозит отделяли центрифугированием, промывали и сушили в вакууме при 60°C в течение ночи [51].
Приготовление электрода
Для приготовления электродов из магнитных нанокомпозитов со структурой core–shell оксид графена/Fe3O4@SiO2 с ионной жидкостью (ILGFSCPE) смешивали в ступке 0.04 г нанокомпозита оксид графена/Fe3O4@SiO2, 0.96 г порошка графита и приблизительно 0.8 мл ионной жидкости. Полученную пасту вмазывали в конец стеклянной трубки длиной 15 см и диаметром 3.4 мм. Электрический контакт выполнялся с помощью медной проволочки, помещенной в углеродную пасту.
По той же методике были изготовлены аналогичные электроды: угольно-пастовый электрод с ионной жидкостью (ILCPE), электрод из порошка нанокомпозита со структурой core–shell оксид графена/Fe3O4@SiO2 плюс парафиновое масло (GFSCPE), и угольно-пастовый электрод с чистой поверхностью.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристики, полученные методами ИК-спектроскопии с преобразованием Фурье и SEM-микроскопии
На рис. 1 показаны ИК-спектры с преобразованием Фурье: a – оксида графена–COOH, б – оксида графена/Fe3O4 и в – оксида графена/Fe3O4@SiO2. Пики при 1629.92 и 1455.80 cм−1 на рис. 1 (кривая a) отвечают валентным колебаниям связей, соответственно, C=O и C–O. Пики, наблюдаемые при 2923.25 и 3423.85 cм−1, отвечают, соответственно, валентным колебаниям с растяжением связи –CH и группам COOH на поверхности оксида. Дополнительно, на рис. 1 (кривая б) пик при 565.50 cм−1 соответствует валентным колебаниям, отвечающим взаимодействиям Fe–O–Fe в Fe3O4. Из сравнения спектров б и в следует, что характеристический пик Si–O–Si при 1077.29 cм−1 на рис. 1 (кривая в) доказывает образование оболочки из оксида кремния.
Рис. 1.
ИК-спектры с преобразованием Фурье: a – оксид графена–COOH, б – оксид графена/Fe3O4 и в – оксид графена/Fe3O4@SiO2.

На рис. 2 даны SEM-микрофотографии: (a) оксида графена–COOH, (б) оксида графена/Fe3O4 и (в) оксида графена/Fe3O4@SiO2, иллюстрирующие морфологию поверхности этих материалов.
Электрохимическое поведение ацетаминофена на различных электродах
Электрохимическое поведение ацетаминофена исследовали на поверхности электродов ILGFSCPE (рис. 3, кривая г), ILCPE (кривая в), GFSCPE (кривая б) и угольно-пастового электрода с чистой поверхностью (кривая a). Циклические вольтамперограммы (рис. 3) демонстрируют электрохимическое окисление 400.0 мкM ацетаминофена. Окисление ацетаминофена на угольно-пастовом электроде с чистой поверхностью дает очень слабый пик тока, в то время как в присутствии ионной жидкости наблюдается повышение пикового тока и уменьшение перенапряжения. Окисление же ацетаминофена на ILGFSCPE (кривая г) и ILCPE (кривая в) сопровождается значительным ростом тока и заметным сдвигом потенциалов пика.
Рис. 3.
Циклические вольтамперограммы электродов: a – угольно-пастового с чистой поверхностью, б – GFSCPE, в – ILCPE и г – ILGFSCPE в присутствии 400.0 мкM ацетаминофена в 0.1 M фосфатном буферном растворе (pH 7.0).

Наблюдаемый заметный сдвиг потенциала пика тока ацетаминофена в сторону отрицательных значений и существенный рост величины тока уже указывает на каталитическую активность электродов ILGFSCPE (кривая г) и ILCPE (криваяe в) по отношению к окислению ацетаминофена. Однако, гораздо более высокий пик тока – лучший результат в поведении электродов по отношению к окислению ацетаминофена, достигается, если используется нанокомпозит со структурой core–shell оксид графена/Fe3O4@SiO2. Величины электрохимического отклика на различных электродах в растворе с pH 7.0 приводятся в табл. 1.
Влияние скорости развертки потенциала
На рис. 4 показано, как ток окисления ацетаминофена на циклических вольтамперограммах меняется в зависимости от скорости развертки потенциала. Видно, что ускорение развертки потенциала увеличивает ток в пике. Более того, анодный пиковый (Ip) изменяется по линейному закону в зависимости от корня квадратного из скорости развертки потенциала (v1/2), указывая на то, что процесс окисления находится под диффузионным контролем.
Рис. 4.
Циклические вольтамперограммы электрода ILGFSCPE в 0.1 M фосфатном буферном растворе (pH 7.0), содержащем 150.0 мкM ацетаминофена, при различной скорости развертки потенциала; кривые 1–11 соответствуют 10, 20, 40, 60, 80, 100, 200, 400, 600, 800 и 1000 мВ с–1. Врезка: зависимость анодного пикового тока от корня квадратного из скорости развертки потенциала.

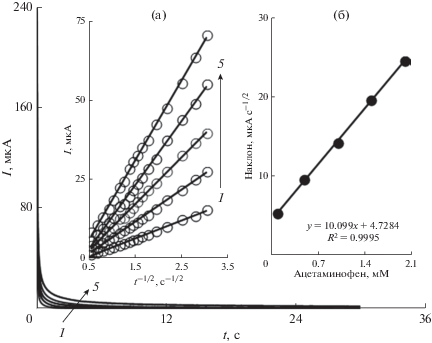
Хроноамперометрические измерения
Хроноамперометрические измерения на электроде ILGFSCPE (рис. 5) проводили при потенциале рабочего электрода равном 0.4 В отн. Ag/AgCl/KCl (3.0 M)-электрода сравнения при различных концентрациях ацетаминофена. Для описания тока электрохимической реакции электроактивного вещества (ацетаминофена) в условиях контроля массопереносом было использовано уравнение Коттрелла [52]:
Рис. 5.
Хроноамперограммы, снятые на электроде ILGFSCPE в 0.1 M фосфатном буферном растворе (pH 7.0) при различных концентрациях ацетаминофена. Кривые 1–5 соответствуют 0.1, 0.5, 1.0, 1.5 и 2.0 мM ацетаминофена. Врезки: (a) зависимости I от t–1/2, полученные из хроноамперограмм 1–5. (б) Зависимость наклона прямых от концентрации ацетаминофена.
Калибровочная кривая и наименьшая определяемая концентрация
Концентрацию ацетаминофена в растворе определяли по пиковому току его окисления на поверхности модифицированного электрода (рис. 6). В этих измерениях мы использовали метод квадратно-волновой вольтамперометрии на поверхности модифицированного электрода с варьированием концентрации целевого аналита. Согласно результатам квадратно-волновой вольтамперометрии, пиковый ток окисления ацетаминофена пропорционален его концентрации в области от 1.0 × 10−6 до 1.0 × 10−3 M, а наименьшая определяемая концентрация (3σ) составляет 4.0 × × 10–7 M ацетаминофена.
Рис. 6.
Квадратно-волновые вольтамперограммы, снятые на электроде ILGFSCPE в 0.1 M фосфатном буферном растворе (pH 7.0) при различных концентрациях ацетаминофена. Кривые 1–13 соответствуют 1.0, 5.0, 10.0, 20.0, 40.0, 60.0, 80.0, 100.0, 200.0, 400.0, 600.0, 800.0 и 1000.0 мкM ацетаминофена. Врезка: графики зависимости пикового тока от концентрации ацетаминофена в интервале 1.0–1000.0 мкM.

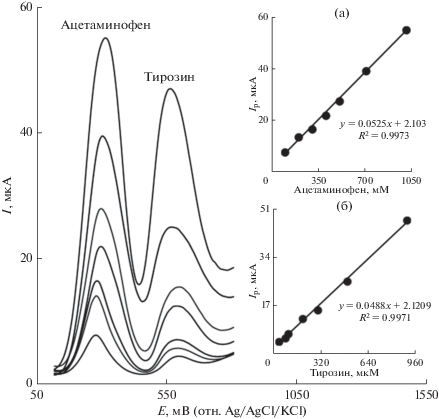
Одновременное определение ацетаминофена и тирозина
Одновременное определение ацетаминофена и тирозина с использованием электрода ILGFSCPE до сих пор не было описано. С этой целью одновременно меняли концентрации обоих аналитов и записывали квадратно-волновые вольтамперограммы (рис. 7). Согласно вольтамперометрическим результатам, на вольтамперограммах наблюдаются хорошо выраженные пики тока при потенциалах 330 и 630 мВ, относящиеся к окислению, соответственно, ацетаминофена и тирозина. Результаты, представленные на рис. 7, доказывают эффективность электрода ILGFSCPE в одновременном определении ацетаминофена и тирозина.
Рис. 7.
Квадратно-волновые вольтамперограммы, снятые на электроде ILGFSCPE в 0.1 M фосфатном буферном растворе (pH 7.0), содержащем различные концентрации ацетаминофена и тирозина (мкM), изнутри наружу, соответственно: 40.0 + 100.0, 80.0 + 200.0, 100.0 + 300.0, 200.0 + 400.0, 300.0 + 500.0, 500.0 + 700.0 и 900.0 + 1000.0. Врезки: (a) зависимость Ip от концентрации ацетаминофена, (б) зависимость Ip от концентрации тирозина.
Повторяемость и стабильность электрода оксид графена/Fe3O4@SiO2/ионная жидкость
Стабильность модифицированного электрода ILGFSCPE исследовали после его хранения на воздухе при комнатной температуре в течение 3 недель. Согласно результатам циклической вольтамперометрии, по сравнению с первоначальным откликом потенциал пика тока окисления ацетаминофена не изменился, а сигнал тока уменьшился незначительно (на 2.6%). Для того чтобы исследовать свойства электрода, предохраняющие от загрязнения ацетаминофеном и продуктом его окисления, мы записывали циклические вольтамперограммы модифицированного электрода до и после его использования в растворе ацетаминофена. При записи циклических вольтамперограмм в присутствии ацетаминофена снимали 20 циклов при скорости развертки потенциала 50 мВ с−1. Не было отмечено какого-либо изменения потенциала пика тока и уменьшения тока больше, чем на 2.1%. Соответственно, электрод ILGFSCPE продемонстрировал приращение чувствительности и снижение загрязнения определяемым аналитом и продуктом его окисления.
Анализ реальных образцов
Применимость разработанного модифицированного сенсора для анализа оценивали, определяя ацетаминофен в таблетках, ацетаминофен в сиропе и образцах мочи (табл. 2). Экспериментальные результаты одновременного определения ацетаминофена и тирозина оказались удовлетворительными. Воспроизводимость анализа характеризовали величиной относительного стандартного отклонения (RSD).
Таблица 2.
Определение ацетаминофена и тирозина в реальных образцах. Все концентрации даны в мкM (n = 5)
| Образец | Добавлено | Найдено | Обратное извлечение, % | Относительное стандартное отклонение, % | ||||
|---|---|---|---|---|---|---|---|---|
| ацетами-нофен | тирозин | ацетами-нофен | тирозин | ацетами-нофен | тирозин | ацетами-нофен | тирозин | |
| Ацетаминофен в таблетках | 0 | 0 | 10.0 | Не обнаружен | – | – | 3.3 | – |
| 5.0 | 10.0 | 14.9 | 10.2 | 99.3 | 102.0 | 2.7 | 1.9 | |
| 10.0 | 15.0 | 20.7 | 14.8 | 103.5 | 98.7 | 1.9 | 3.2 | |
| 15.0 | 20.0 | 24.3 | 20.3 | 97.2 | 101.5 | 1.7 | 2.2 | |
| 20.0 | 30.0 | 30.3 | 29.3 | 101.0 | 97.7 | 3.1 | 2.3 | |
| Ацетаминофен в сиропе | 0 | 0 | 12.0 | Не обнаружен | – | – | 2.4 | – |
| 5.0 | 12.5 | 17.3 | 12.2 | 101.8 | 97.6 | 1.9 | 3.1 | |
| 10.0 | 17.5 | 21.5 | 17.8 | 97.7 | 101.7 | 2.8 | 2.7 | |
| 15.0 | 22.5 | 27.9 | 22.4 | 103.3 | 99.5 | 2.2 | 2.1 | |
| 20.0 | 27.5 | 31.8 | 28.2 | 99.4 | 102.5 | 3.4 | 1.9 | |
| Ацетаминофен в моче |
0 | 0 | Не обнаружен | Не обнаружен | – | – | – | – |
| 5.0 | 10.0 | 4.9 | 10.1 | 98.0 | 101.0 | 1.7 | 2.9 | |
| 10.0 | 15.0 | 10.2 | 14.7 | 102.0 | 98.0 | 1.9 | 2.3 | |
| 15.0 | 20.0 | 14.8 | 20.7 | 98.7 | 103.5 | 3.2 | 1.8 | |
| 20.0 | 30.0 | 20.4 | 29.7 | 102.0 | 99.0 | 2.4 | 1.7 | |
ЗАКЛЮЧЕНИЕ
В настоящей работе изготовлен модифицированный угольно-пастовый электрод с использованием ионной жидкости и магнитного нанокомпозита со структурой core–shell оксид графена/Fe3O4@SiO2. Этот модифицированный электрод демонстрирует прекрасные свойства, в частности, низкую наименьшую определяемую концентрацию, широкую область линейности, долговременную стабильность, хорошую воспроизводимость и повторяемость. Этот электрохимический сенсор с успехом использован для определения ацетаминофена и тирозина при их совместном присутствии.
Список литературы
Moghadam, Z., Ghoreishi, S.M., Behpour, M., and Motaghedifard, M., A Highly Sensitive Nanostructure-Based Surface Covalently Modification of Gold for Electrochemical Sensing of Epinephrine in Presence of Uric Acid and Acetaminophen, J. Electrochem. Soc., 2013, vol. 160, p. H126.
Cernat, A., Tertis¸ M., Sandulescu, R., Bedioui, F., Cristea, A., and Cristea, C., Electrochemical sensors based on carbon nanomaterials for Acetaminophen detection: A review, Anal. Chim. Acta, 2015, vol. 886, p. 16.
Sharifian, S. and Nezamzadeh-Ejhieh, A., Modification of carbon paste electrode with Fe(III)-clinoptilolite nano-particles for simultaneous voltammetric determination of aцeтaминoфeн and ascorbic acid, Mater. Sci. Eng. C, 2016, vol. 58, p. 510.
Karimi-Maleh, H., Moazampour, M., Ahmar, H., Beitollahi, H., and Ensafi, A.A., A sensitive nanocomposite-based electrochemical sensor for voltammetric simultaneous determination of isoproterenol, acetaminophen and tryptophan, Measurement, 2014, vol. 51, p. 91.
Shahrokhian, S. and Asadian, E., Simultaneous voltammetric determination of ascorbic acid, acetaminophen and isoniazid using thionine immobilized multi-walled carbon nanotube modified carbon paste electrode, Electrochim. Acta, 2010, vol. 55, p. 666.
Chiavazza, E., Berto, S., Giacomino, A., Malandrino, M., Barolo, C., Prenesti, E., Vione, D., and Abollino, O., Electrocatalysis in the oxidation of acetaminophen with an electrochemically activated glassy carbon electrode, Electrochim. Acta, 2016, vol. 192, p. 139.
Beitollahi, H. and Nekooei, S., Application of a Modified CuO Nanoparticles Carbon Paste Electrode for Simultaneous Determination of Isoperenaline, Acetaminophen and N-acetyl-L-cysteine, Electroanalysis, 2016, vol. 28, p. 645.
Bhakta, A.K., Mascarenhas, R.J., D’Souza, O.J., Satpati, A.K., Detriche, S., Mekhalif, Z., and Dalhalle, J., Iron nanoparticles decorated multi-wall carbon nanotubes modified carbon paste electrode as an electrochemical sensor for the simultaneous determination of uric acid in the presence of ascorbic acid, dopamine and L-tyrosine, Mater. Sci. Eng., C 2015, vol. 57, p. 328.
Brillians-Revin, S. and Abraham-John, S., Selective determination of L-tyrosine in the presence of ascorbic and uric acids at physiological pH using the electropolymerized film of 3-amino-5-mercapto-1,2,4-triazole, Sens. Actuators B-Chem., 2012, vol. 161, p. 1059.
Mahbubur-Rahman, M., Siraj-Lopa, N., Kim, K., and Lee, J., Selective detection of L-tyrosine in the presence of ascorbic acid, dopamine, and uric acid at poly(thionine)-modified glassy carbon electrode, J. Electroanal. Chem., 2015, vol. 754, p. 87.
Taei, M. and Ramazani, G., Simultaneous determination of norepinephrine, acetaminophen and tyrosine by differential pulse voltammetry using Au-nanoparticles/poly(2-amino-2-hydroxymethyl-propane-1,3-diol) film modified glassy carbon electrode, Colloids Surf. B, 2014, vol. 123, p. 23.
Tahernejad-Javazmi, F., Shabani-Nooshabadi, M., and Karimi-Maleh, H., Analysis of glutathione in the presence of acetaminophen and tyrosine via an amplified electrode with MgO/SWCNTs as a sensor in the hemolyzed erythrocyte, Talanta, 2018, vol. 176, p. 208.
Meyer, J.S., Welch, K.M.A., and Deshmuckh, V.D., Neurotransmitter Precursor Amino Acids in the Treatment of Multi-Infarct Dementia and Alzheimer’s Disease, J. Am. Geriatr. Soc., 1977, vol. 25, p. 289.
Kemmegne-Mbouguen, J.C., Toma, H.E., Araki, K., Constantino, V.R., Ngameni, E., and Angnes, L., Simultaneous determination of acetaminophen and tyrosine using a glassy carbon electrode modified with a tetraruthenated cobalt(II) porphyrin intercalated into a smectite clay, Microchim. Acta, 2016, vol. 183, p. 3243.
Sirajuddin, A.R., Khaskheli, A., Shah, M.I., Bhanger, A., and Mahesar, S.N., Simpler spectrophotometric assay of paracetamol in tablets and urine samples, Spectrochem. Acta A, 2007, vol. 68, p. 747.
Gioia, M.G., Andreatta, P., Boschetti, S., and Gatti, R., Development and validation of a liquid chromatographic method for the determination of ascorbic acid, dehydroascorbic acid and acetaminophen in pharmaceuticals, J. Pharm. Biomed. Anal., 2008, vol. 48, p. 331.
Wang, F., Wu, K.Z., Qing, Y., and Ci, Y.X., Spectrofluorimetric Determination of the Substrates Based on the Fluorescence Formation With the Peroxidase-Like Conjugates of Hemie with Proteins, Anal. Lett., 1992, vol. 25, p. 1469.
Huang, Y., Jiang, X., Wang, W., Duan, J., and Chen, G., Separation and determination of L-tyrosine and its metabolites by capillary zone electrophoresis with a wall-jet amperometric detection, Talanta, 2006, vol. 70, p. 1157.
Li, X. and Xu, G., Simultaneous determination of ranitidine and metronidazole in pharmaceutical formulations at poly(chromotrope 2B) modified activated glassy carbon electrodes, J. Food. Drug Anal., 2014, vol. 22, p. 345.
Beitollahi, H., Ghofrani Ivari, S., and Torkzadeh-Mahani, M., Application of antibody nanogold–ionic liquid–carbon paste electrode for sensitive electrochemical immunoassay of thyroid-stimulating hormone, Biosens. Bioelectron., 2018, vol. 110, p. 97.
Fouladgar, M., Application of ZnO Nanoparticle/Ion Liquid Modified Carbon Paste Electrode for Determination of Isoproterenol in Pharmaceutical and Biological Samples, J. Electrochem. Soc., 2016, vol. 163, p. B38.
Beitollahi, H. and Sheikhshoaie, I., Electrochemical behavior of carbon nanotube/Mn(III) salen doped carbon paste electrode and its application for sensitive determination of N-acetylcysteine in the presence of folic acid, Int. J. Electrochem. Sci., 2012, vol. 7, p. 7684.
Ganjali, M.R., Khoshsafar, H., Shirzadmehi, A., Javanbakht, M., and Faridbod, F., Improvement of Carbon Paste Ion Selective Electrode Response by Using Room Temperature Ionic Liquids (RTILs) and Multi-Walled Carbon Nanotubes (MWCNTs), Int. J. Electrochem. Sci., 2009, vol. 4, p. 435.
Beitollahi, H., Nekooei, S., and Torkzadeh-Mahani, M., Amperometric immunosensor for prolactin hormone measurement using antibodies loaded on a nano-Au monolayer modified ionic liquid carbon paste electrode, Talanta, 2018, vol. 188, p. 701.
Beitollahi, H., Karimi-Maleh, H., and Khabazzadeh, H., Nanomolar and selective determination of epinephrine in the presence of norepinephrine using carbon paste electrode modified with carbon nanotubes and novel 2‑(4-oxo-3-phenyl-3, 4-dihydro-quinazolinyl)-N′-phenyl-hydrazinecarbothioamide, Anal. Chem., 2008, vol. 80, p. 9848.
Lu, X.C., Song, L., Ding, T.T., Lin, Y.L., and Xu, C.X., CuS–MWCNT based electrochemical sensor for sensitive detection of bisphenol A, Russ. J. Electrochem., 2017, vol. 53, p. 366.
Mazloum-Ardakani, M., Beitollahi, H., Taleat, Z., Naeimi, H., and Taghavinia, N., Selective voltammetric determination of D-penicillamine in the presence of tryptophan at a modified carbon paste electrode incorporating TiO2 nanoparticles and quinizarine, J. Electroanal. Chem., 2010, vol. 644, p. 1.
Hu, Y., Huang, Y., Tan, C., Zhang, X., Lu, Q., Sindoro, M., Huang, X., Huang, W., Wang, L., and Zhang, H., Two-dimensional transition metal dichalcogenide nanomaterials for biosensing applications, Mater. Chem. Front., 2017, vol. 1, p. 24.
Tajik, S., Taher, M.A., and Beitollahi, H., First report for electrochemical determination of levodopa and cabergoline: Application for determination of levodopa and cabergoline in human serum, urine and pharmaceutical formulations, Electroanalysis, 2014, vol. 26, p. 796.
Idris, A.O., Mafa, J.P., Mabuba, N., and Arotiba, O.A., Nanogold modified glassy carbon electrode for the electrochemical detection of arsenic in water, Russ. J. Electrochem., 2017, vol. 53, p. 170.
Azadbakht, A. and Abbasi, A.R., Fabrication of a Highly Sensitive Hydrazine Electro-chemical Sensor Based on Bimetallic Au-Pt Hybrid Nanocomposite onto Modified Electrode. Nano-Micro Lett., 2010, vol. 2, p. 296.
Ganesh, P.S. and Kumara-Swamy, B.E., Voltammetric resolution of catechol and hydroquinone at eosin Y film modified carbon paste electrode, J. Mol. Liq., 2016, vol. 220, p. 208.
Karimi-Maleh, H., Keyvanfard, M., Alizad, K., Fouladgar, M., Beitollahi, H., Mokhtari, A., and Gholami-Orimi, F., Voltammetric determination of N-actylcysteine using modified multiwall carbon nanotubes paste electrode, Int. J. Electrochem. Sci, 2011, vol. 6, p. 6141.
Wang, P., Xiao, J., Guo, M., Xia, Y., Li, Z., Jiang, X., and Huang, W., Voltammetric Determination of 4-Nitrophenol at Graphite Nanoflakes Modified Glassy Carbon Electrode, J. Electrochem. Soc., 2015, vol. 162, p. H72.
Han, L., Tao, H., Huang, M., Zhang, Y., Qiao, S., and Shi, R., A hydrogen peroxide biosensor based on multiwalled carbon nanotubes-polyvinyl butyral film modified electrode, Russ. J. Electrochem., 2016, vol. 52, p. 115.
Beitollahi, H., Movahedifar, F., Tajik, S., and Jahani, S., A Review on the Effects of Introducing CNTs in the Modification Process of Electrochemical Sensors, Electroanalysis, 2018. https://doi.org/10.1002/elan.201800370
Yalcıner, F., Cevik, E., Senel, M., and Baykal, A., Development of an Amperometric Hydrogen Peroxide Biosensor based on the Immobilization of Horseradish Peroxidase onto Nickel Ferrite Nanoparticle-Chitosan Composite, Nano-Micro Lett., 2011, vol. 3, p. 91.
Yukird, J., Kongsittikul, P., Qin, J., Chailapakul, O., and Rodthongkum, N., ZnO@graphene nanocomposite modified electrode for sensitive and simultaneous detection of Cd(II) and Pb(II), Synth. Met., 2018, vol. 245, p. 251.
Kalate-Bojdi, M., Mashhadizadeh, M.H., Behbahani, M., Farahani, A., Hossein-Davarani, S.S., and Bagheri, A., Synthesis, characterization and application of novel lead imprinted polymer nanoparticles as a high selective electrochemical sensor for ultra-trace determination of lead ions in complex matrixes, Electrochim. Acta, 2014, vol. 136, p. 59.
Beitollahi, H., Ghofrani-Ivari, S., and Torkzadeh-Mahani, M., Voltammetric determination of 6-thioguanine and folic acid using a carbon paste electrode modified with ZnO-CuO nanoplates and modifier, Mater. Sci. Eng. C, 2016, vol. 69, p. 128.
Kumar, N. and Goyal, R.N., Melamine/Fe3O4 Nanoparticles Based Molecular Imprinted Highly Sensitive Sensor for Determination of Hydrochlorothiazide: An Antihypertensive Drug, J. Electrochem. Soc., 2017, vol. 164, p. B240.
Yu, L., Wu, H., Wu, B., Wang, Z., Cao, H., Fu, C., and Jia, N., Magnetic Fe3O4 Reduced Graphene Oxide Nanocomposites-Based Electrochemical Biosensing, Nano-Micro Lett., 2014, vol. 6, p. 258.
Sun, Y., Duan, L., Guo, Z., Duan-Mu, Y., Ma, M., Xu, L., Zhang, Y., and Gu, N., An improved way to prepare superparamagnetic magnetite-silica core-shell nanoparticles for possible biological application, J. Magn. Magn. Mater., 2005, vol. 285, p. 65.
Beitollahi, H. and Garkani-Nejad, F., Graphene oxide/ZnO nano composite for sensitive and selective electrochemical sensing of levodopa and тиpoзин using modified graphite screen-printed electrode, Electroanalysis, 2016, vol. 28, p. 2237.
Huang, W., Xiao, X., Engelbrekt, C., Zhang, M., Li, S., Ulstrup, J., Ci, L., Feng, J., Si, P., and Chi, Q., Graphene encapsulated Fe3O4 nanorods assembled into a mesoporous hybrid composite used as a high-performance lithium-ion battery anode material, Mater. Chem. Front., 2017, vol. 1, p. 1185.
Bagheri, H., Shirzadmehr, A., Rezaei, M., and Khoshsafar, H., Determination of tramadol in pharmaceutical products and biological samples using a new nanocomposite carbon paste sensor based on decorated nanographene/tramadol-imprinted polymer nanoparticles/ionic liquid, Ionics, 2018, vol. 24, p. 833.
Gasbarri, C. and Angelini, G., Polarizability over dipolarity for the spectroscopic behavior of azobenzenes in room-temperature ionic liquids and organic solvents, J. Mol. Liq., 2017, vol. 229, p. 185.
Zhang, J., Wang, X., Zhang, S., Wang, W., Hojo, M., and Chen, Z., An Electrochemical Sensor for Simultaneous Determination of Ponceau 4R and Tartrazine Based on an Ionic Liquid Modified Expanded Graphite Paste Electrode, J. Electrochem. Soc., 2014, vol. 161, p. H453.
Fernández, E., Vidal, L., Iniesta, J., Metters, J.P., and Banks, C.E., Screen-printed electrode-based electrochemical detector coupled with in-situ ionic-liquid-assisted dispersive liquid–liquid microextraction for determination of 2,4,6-trinitrotoluene, Anal. Bioanal. Chem., 2014, vol. 406, p. 2197.
Park, K.W. and Hwa-Jung, J., Spectroscopic and electrochemical characteristics of a carboxylated graphene–ZnO composites, J. Power Sources, 2012, vol. 199, p. 379.
Arvand, M. and Hassannezhad, M., Magnetic core–shell Fe3O4@SiO2/MWCNT nanocomposite modified carbon paste electrode for amplified electrochemical sensing of uric acid, Mater. Sci. Eng. C, 2014, vol. 36, p. 160.
Bard, A.J. and Faulkner, L.R., Electrochemical Methods: Fundamentals and Applications, 2nd ed., New York: Wiley, 2001.
Дополнительные материалы отсутствуют.



