Электрохимия, 2019, T. 55, № 12, стр. 1524-1531
Электрохимическая активность металл-ионообменных нанокомпозитов
Т. А. Кравченко a, *, Д. Д. Вахнин a, В. Е. Придорогина a, М. Ф. Шафрова a
a Воронежский государственный университет, Химический факультет
394018 Воронеж, Университетская площадь, 1, Россия
* E-mail: krav280937@yandex.ru
Поступила в редакцию 28.03.2019
После доработки 28.03.2019
Принята к публикации 04.07.2019
Аннотация
Исследован процесс электровосстановления кислорода на тонкопленочных металл-полимерных нанокомпозитах, различающихся природой (Ag, Cu, Pd), содержанием, размером частиц металлического компонента и ионной формой матрицы Lewatit K2620 (Н+, Na+). Определены предельный диффузионный ток по кислороду и эффективное число электронов, участвующих в реакции электровосстановления кислорода. Обнаружено возрастание предельного тока и числа электронов с увеличением содержания наночастиц металла и переходом к более крупным наночастицам. Установлен четырехэлектронный механизм электровосстановления кислорода, согласно которому пероксид водорода как промежуточный продукт не накапливается, а кислород восстанавливается непосредственно до молекул воды. В зависимости от ионной формы матрицы наряду с кислородом может наблюдаться электрохимическое восстановление образующихся продуктов окисления металла и выделение водорода.
ВВЕДЕНИЕ
Наночастицы металлов, стабилизированные в порах ионообменных полимерных матриц, проявляют повышенную химическую и электрохимическую активность за счет развитой и дефектной структуры поверхности [1–3]. Одновременно поры ионообменной матрицы способны выполнять транспортные и сорбционные функции за счет канальной системы и фиксированных заряженных центров, являющихся источниками электронов и стоками продуктов для участников реакции.
Значительный интерес вызывает ионообменный способ внедрения наночастиц металлов [4‒10]. Он обеспечивает объемное введение ионов металла и их последующее химическое или электрохимическое восстановление в макропористых полимерных матрицах. Базовые размеры наночастиц металла меньше размеров макропор, поэтому к ним открыт доступ реагентов. Для микропористых мембран характерно бимодальное по размеру распределение металла [11]. Наночастицы меди и серебра в порах сульфокатионообменной мембраны Nafion достигают размера пор, а более крупные частицы агломерируют на поверхности мембраны.
Металл-ионообменные нанокомпозиты (НК) являются эффективными катализаторами химического и электрохимического восстановления кислорода [1, 2, 12–16]. Известно [17], что для компактных металлов в большинстве случаях характерен четырехэлектронный путь электровосстановления кислорода, в то время как углеродным материалам свойственен двухэлектронный процесс с накоплением пероксида водорода. На тонкопленочных электродах с наночастицами металлов и полимер-углеродными матрицами доминирует тот или иной маршрут, меняется каталитическая активность и коррозионная устойчивость. На наночастицах металлов в катионообменных матрицах обнаруживается возрастание вклада четырехэлектронного процесса по сравнению с двухэлектронным, характерным для углеродных материалов, отмечается повышенная плотность тока обмена кислородной реакции [16]. Sleightholme и соавторы [15] обнаружили более высокую плотность тока обмена кислородной реакции на серебре в анионообменной мембране. В то же время в ряде работ выявлена довольно важная роль ионообменных матриц. Selvaraju и др. [13], обнаружив повышенную каталитическую активность наноструктурированных частиц меди, осажденных в мембрану Nafion, связывают ее с накоплением кислорода в порах мембраны и участием противоионов водорода в реакции электровосстановления кислорода. Авторы работ [16, 18] показали, что высокая концентрация противоионов водорода, обеспечиваемая сульфокатионообменными матрицами КУ-23 и МФ-4СК, приводит к участию ионов Н+ в стадии присоединения первого электрона к молекуле кислорода на наночастицах серебра и меди.
Открытыми остаются вопросы о морфологических особенностях НК. В связи с возможностью многократного внедрения металла в ионообменные матрицы вероятны структурные изменения, связанные с проявлением индивидуальных и коллективных свойств наночастиц металла. Процессам на таких материалах свойственен не только первичный размерный эффект индивидуальных малых частиц, но и вторичный размерный эффект коллективного взаимодействия электронно-связанных металлических частиц [19]. Для бифункциональных материалов принципиально важным является вопрос о влиянии размерного по металлическому компоненту и ионообменного по матрице факторов в совокупности на скорость и механизм электрохимических процессов.
Цель настоящего исследования состоит в характеристике электрохимической активности полученных металл (Ag, Cu, Pd)-ионообменных (Lewatit К2620) материалов как бифункциональных нанокомпозитных структур в реакции электровосстановления кислорода.
МЕТОДИКА ЭКСПЕРИМЕНТА
Химическим осаждением металлов (Ag, Cu, Pd) в сульфокатионообменную матрицу Lewatit К2620 в виде сферических гранул получены нанокомпозиты с различным содержанием металла в Н+- и Na+-ионных формах. Матрица характеризуется макро- и монопористостью (однородное распределение, характерный размер пор 41 нм [20]).
Химическое импрегнирование металлами проводилось согласно [1]. Особенностью синтеза данных образцов был перевод матрицы нанокомпозита в Н+-форму не только на конечном этапе, но и дополнительно после каждого N-го цикла внедрения металла с тем, чтобы исходной была одна и та же ионная форма. Это обусловливает единообразие процедуры осаждения металла в каждом цикле. Физические характеристики полученных медь-, серебро- и палладийсодержащих нанокомпозитов на основе Lewatit K2620 приведены в табл. 1.
Таблица 1.
Емкость ${{\varepsilon }_{{{\text{M}}{{{\text{e}}}^{0}}}}},$ диаметр d наночастиц металла и радиальное распределение m металла. R0 – радиус зерна НК
| Число циклов осаждения N |
Емкость ${{\varepsilon }_{{{\text{M}}{{{\text{e}}}^{0}}}}},$ мэкв/см3 | Средний диаметр частиц d, нм |
Масса металла m, мас. % | |||
|---|---|---|---|---|---|---|
| РФА | СЭМ | ЭДА | ||||
| центр R0 = 0 |
середина R = 1/2R0 |
периферия R = R0 |
||||
| Cu0 · Lewatit K2620. Восстановитель Na2S2O4 | ||||||
| 1 | 1.28 ± 0.01 | 10 ± 5 | 50–120 | 7.3 | 8.8 | 13.7 |
| 3 | 3.20 ± 0.01 | 12 ± 7 | 50–120 | 2.9 | 14.3 | 18.9 |
| 5 | 5.58 ± 0.03 | 13 ± 7 | 100–200 | 2.2 | 8.1 | 14.6 |
| 10 | 9.60 ± 0.03 | 16 ± 9 | 120–180 | 4.4 | 13.9 | 30.6 |
| Ag0 · Lewatit K2620. Восстановитель NaBH4 | ||||||
| 3 | 2.20 ± 0.01 | 16 ± 9 | 75–110 | 16.2 | 18.1 | 34.4 |
| Pd0 ∙ Lewatit К2620. Восстановитель NaBH4 | ||||||
| 3 | 3.22 ± 0.23 | 6 ± 4 | 80–120 | 1.9 | 6.3 | 9.9 |
Размеры частиц металлов в макропористых матрицах определяли методами рентгенофазового анализа (РФА) и сканирующей электронной микроскопии (СЭМ), радиальное распределение – методом энергодисперсионного анализа (ЭДА). Видно, что базовые частицы металла имеют нанометровый размер с некоторым снижением их количества от периферии к центру зерна НК (табл. 1).
Характерными достоинствами НК на основе ионообменной матрицы с макро- и монопористой структурой являются узкое распределение частиц металла по размерам, распределение по объему гранулы и их доступность для реагентов.
На тонкопленочных нанокомпозитных электродах получали потенциодинамические кривые электровосстановления кислорода. Для этого синтезировали углерод-полимерную пасту, которую допировали нанокомпозитом и наносили в виде тонкой пленки на стеклоуглеродную подложку. Углерод-полимерная паста выполняла роль электронопроводящего компонента. Выбор тонкопленочного нанокомпозитного электрода обусловлен необходимостью дать оценку электрохимической активности данных металлов, выявить влияние размерного и ионообменного факторов на кинетические закономерности исследуемой электрохимической реакции.
Первоначально была приготовлена углерод-полимерная композитная паста (С,Р). К 10% раствору полимерного связующего фторопласт-2 (Ф-2) в N-метилпирролидоне (NMP) прибавляли технический углерод марки Vulcan XC 72 и тщательно перемешивали. Соотношение твердых компонентов смеси (Vulcan XC 72 : Ф-2) составляло 4 : 1. В полученную смесь добавляли раствор NMP–ацетон, отдельно приготовленный в объемном соотношении 1 : 1. Полученную смесь подвергали ультразвуковому диспергированию в течение 10 мин. Для установления влияния металла на механизм электровосстановления O2 целесообразно использование нанокомпозита c содержанием металлического компонента 20% от массы сажи, что отвечает наиболее высокой активности подобных систем в исследуемой реакции [21, 22]. Предварительно восстановленный металл-ионообменный НК тонко измельчали и добавляли в углерод-полимерную пасту в необходимом количестве.
Нанокомпозитную пасту в виде тонкого слоя (высотой ~1 мкм) наносили на вращающийся дисковый стеклоуглеродный электрод, сушили на воздухе в течение 2 ч и помещали в термостатируемую трехэлектродную ячейку с 0.1 M раствором H2SO4. Объем рабочего раствора составлял 30 см3. Насыщение кислородом проводили в течение 30 мин при атмосферном давлении. Постоянство концентрации в течение опыта поддерживали небольшим протоком кислорода. Содержание кислорода в растворе составляло 1.3 моль/м3 [23, 24]. В качестве вспомогательного электрода использовали графитовый электрод, электрод сравнения – хлоридсеребряный. Регистрируемый ток отнесен к геометрической площади поверхности стеклоуглеродного (GC) электрода S = = 0.07 см2. Согласно [25] при достаточно тонкой дисперсности и сравнительно равномерной сосредоточенности микрокатодов по поверхности даже при относительно небольшой суммарной поверхности катодов практически весь возможный объем электролита будет использован для диффузии кислорода к данной поверхности. Таким образом, дальнейшее увеличение площади катодов не вызовет ускорения диффузии и, следовательно, не сможет заметно увеличить предельный ток. Поляризация осуществлялась при помощи потенциостата ПИ-50-Pro (Elins, Россия) с компьютерным управлением. Потенциалы были пересчитаны по отношению к нормальному водородному электроду. Измерения проводили при скорости развертки потенциала v = 2 мВ/с, скорости вращения электрода ω = 600 об/мин и температуре 20–24°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При исследовании кинетических закономерностей электровосстановления кислорода на металл-ионообменных нанокомпозитных пленках в качестве основных электрохимических характеристик были взяты плотность предельного тока ilim и эффективное число электронов n, участвующих в реакции, поскольку предельный ток определяет максимальную скорость процесса, а число электронов характеризует механизм реакции.
Размерный фактор. Для установления влияния размерного фактора на процесс электровосстановления кислорода была выбрана система Ag0 · Lewatit K2620,C,P с различным размером металлических наночастиц. Данный размерный параметр варьировался путем применения различных восстановителей NaBH4 и N2H4 (табл. 2). Вследствие большей разницы редокс-потенциалов восстановления ионов металла и окисления ионов восстановителя в случае применения борогидрида натрия можно ожидать меньшего размера частиц серебра [26].
Таблица 2.
Размер частиц серебра в нанокомпозитах Ag0 (N = 3) · Lewatit K2620, полученных разными восстановителями. Прекурсор AgOH
| Восстановитель | Полуреакция [27] | Стандартный потенциал Е0, В [26] |
Емкость по серебру ${{\varepsilon }_{{{\text{A}}{{{\text{g}}}^{0}}}}},$ мэкв/см3 | Размер наночастиц серебра d, нм |
|---|---|---|---|---|
| Гидразин | ${{N}_{2}}{{H}_{4}}\,\, + 4O{{H}^{ - }} = {{N}_{2}}\,\, + 4{{H}_{2}}O\,\, + 4e$ | –0.31–0.06pH | 1.8 ± 0.10 | 29 ± 7 |
| Борогидрид натрия | $BH_{4}^{ - }\,\, + 8O{{H}^{ - }} = BO_{2}^{ - }\,\, + 6{{H}_{2}}O\,\, + 8e$ | –0.45–0.06pH | 2.2 ± 0.01 | 16 ± 9 |
| $BH_{4}^{ - }\,\, + 8O{{H}^{ - }} = {{H}_{2}}BO_{3}^{ - }\,\, + 5{{H}_{2}}O\,\, + 8e$ | –0.40–0.06pH |
Выбор наночастиц серебра в качестве исследуемой системы обусловлен, прежде всего, достаточно высокой устойчивостью. При этом немаловажной особенностью является и то, что углеродный компонент способствует стабилизации металлических наночастиц, компенсируя часть избыточной поверхностной энергии.
Из циклических вольт-амперных кривых (ЦВА), полученных при разных скоростях вращения электрода, построены зависимости плотности предельного тока ilim от корня квадратного из скорости вращения ω (рис. 1). Если электродный процесс не осложнен иными стадиями, кроме внешнедиффузионной, то кривая идет из начала координат, а ее наклон характеризует число электронов, участвующих в процессе. Линии 3 и 4 не экстраполируются в начало координат, что свидетельствует о смешанном диффузионно-кинетическом контроле протекания процесса соответственно уравнению Коутецкого–Левича [27]. Судя по отрезкам, отсекаемым на оси ординат, кинетический вклад для обеих систем (Lewatit K2620,С,Р/GC и Ag0 · Lewatit K2620,C,P/GC) практически одинаков.
Рис. 1.
Зависимость предельной плотности тока ilim электровосстановления кислорода от корня квадратного из скорости вращения электрода ω: 1 – теоретический четырехэлектронный механизм; 2 – теоретический двухэлектронный механизм; 3 – Lewatit K2620,С,Р/GC; 4 – Ag0 (N = 3) · Lewatit K2620,C,P/GC (восстановитель N2H4).
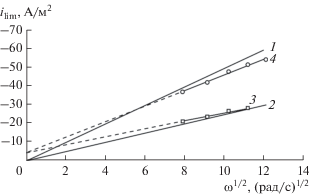
Исходя из полученных значений предельных плотностей тока (табл. 3), можно выделить следующую закономерность: при переходе от полимер-углеродной пленки Lewatit K2620,С,Р к Ag0 · Lewatit K2620,C,P наблюдается существенный рост плотности предельного катодного тока. Последнее свидетельствует о возрастании числа электронов, участвующих в электрохимической реакции. Расчет числа электронов выполнен по уравнению Левича [17]
(1)
${{i}_{{\lim }}} = 0.62nF{{D}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}{{\nu }^{{ - {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}}}}{{c}_{0}}{{\omega }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Таблица 3.
Предельный ток по кислороду ilim и эффективное число электронов n при электровосстановлении кислорода на тонкопленочном электроде Ag0 · Lewatit K2620,C,P/GC в 0.1 М растворе H2SO4. Скорость вращения электрода ω = 600 об/мин
| Тонкопленочный электрод (восстановитель) | –ilim, А/м2 | n |
|---|---|---|
| Lewatit K2620,С,Р/GC | 21.5 ± 0.5 | 2.2 |
| Ag0 · Lewatit K2620,C,P/GC (N2H4) | 38.1 ± 0.6 | 3.9 |
| Ag0 · Lewatit K2620,C,P/GC (NaBH4) | 36.3 ± 0.6 | 3.7 |
Наблюдаемое некоторое повышение эффективного числа электронов при переходе к более крупным наночастицам может быть связано с увеличением количества атомов на гранях кристалла, что благоприятствует четырехэлектронному процессу. Как известно [29], реакционными центрами для восстановления молекулярного кислорода могут быть грани, ребра или углы. Грани кристалла способствуют четырехэлектронному восстановлению, ребра и углы – двухэлектронному.
Природа наночастиц металла (Cu, Ag, Pd). Влияние природы металла иллюстрируется на рис. 2. Для медьсодержащего пастового электрода наблюдается пик восстановления продуктов окисления наночастиц меди кислородом, возникших в процессе приготовления пасты, несмотря на предварительную регенерацию нанокомпозита. Судя по потенциалам, он принадлежит электровосстановлению ионов двухвалентной меди, фиксированных в ионообменной матрице в качестве противоионов [18].
Рис. 2.
Циклические вольт-амперные кривые электровосстановления кислорода на углерод-полимерном пастовом электроде, модифицированном нанокомпозитом, содержащим металлические частицы: (а) Cu, (б) Ag, (в) Pd на основе Lewatit K2620. Число циклов осаждения металла N = 3. Температура 20–24°С. Дублирующие опыты 1,2. Скорость вращения электрода ω = 600 об/мин.

Предельный ток имеет значение 25.7 А/м2, которому отвечает эффективное число электронов n = 2.6 (табл. 4). Присутствие наночастиц меди увеличивает вклад четырехэлектронного пути в общий механизм процесса, повышая тем самым предельный ток. Однако процесс электровосстановления кислорода осложнен химической активностью наночастиц меди в кислой кислородсодержащей среде [18], что не позволяет предельному току существенно возрасти по сравнению с предельным током по двухэлектронному механизму.
Таблица 4.
Предельный ток по кислороду ilim и эффективное число электронов n при электровосстановлении кислорода на Me0 (N = 3) · Lewatit К2620,C,P/GC в 0.1 М растворе H2SO4. Скорость вращения электрода ω = = 600 об/мин
| Металлический компонент тонкопленочного электрода | Область потенциалов получения ЦВА Е, мВ |
Область потенциалов предельного тока Е, мВ | –ilim, А/м2 | n |
|---|---|---|---|---|
| Cu | 200…–600 | –350…–550 | 25.7 ± 0.2 | 2.6 |
| Ag | 200…–700 | –350…–550 | 34.9 ± 0.6 | 3.6 |
| Pd | 1600…–400 | 400…100 | 10.9 ± 2.0 | – |
В противоположность меди наночастицы серебра гораздо стабильнее в кислородсодержащей среде. При электровосстановлении кислорода на внедренных в ионообменную матрицу наночастицах Ag существенно повышается предельный ток (ilim = –34.9 А/м2), свидетельствуя о переходе от двух- к четырехэлектронному механизму (n = 3.6), т.е. процесс электровосстановления кислорода идет без накопления пероксида водорода.
Для пастового электрода, модифицированного частицами палладия, характерно наиболее низкое значение предельного тока по кислороду. Палладий как металл с довольно положительным равновесным потенциалом, казалось бы, должен вести себя подобно серебру. Однако с увеличением каталитической активности металлов в ряду Ag, Cu, Pd снижается перенапряжение выделения водорода [30]. Данное обстоятельство хорошо заметно для пастового электрода, модифицированного частицами палладия. Малое перенапряжение выделения водорода облегчает его адсорбцию уже при довольно положительных потенциалах. Адсорбируясь, проникая в поровое пространство матрицы, водород может изменять электрохимически активную площадь поверхности электрода, что влияет на эффективное значение предельного тока по кислороду. Кроме того, наличие водорода на поверхности металла служит препятствием для диффузии кислорода и способствует удалению молекул кислорода от поверхности катода за счет газовыделения [31].
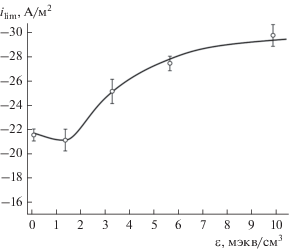
Состав нанокомпозита. Важным является вопрос о том, в каком количестве должен быть осажден металлический компонент в ионообменную матрицу, т.е. вопрос о емкости нанокомпозита по металлу. Плотность предельного тока несколько возрастает в зависимости от содержания меди в НК, и только при количестве циклов ионообменного насыщения – химического восстановления N = 5–6, что соответствует емкости по меди 5.58 ± 0.03, этот рост замедляется, что иллюстрируется на рис. 3. Наблюдаемая зависимость сходна с аналогичной для количества поглощенного кислорода в отсутствие электрохимической поляризации нанокомпозита и обусловлена перколяционным переходом к электронной проводимости образца в целом [19].
Рис. 3.
Зависимость предельного тока восстановления кислорода ilim от емкости по металлу ε в углерод-полимерной пасте Cu0 · Lewatit К2620,С,Р/GC. Скорость вращения электрода ω = 600 об/мин.
Ионная форма матрицы (Н+, Na+). Влияние ионной формы матрицы (Н+, Na+) на реакцию электровосстановления кислорода было изучено на углерод-полимерном пастовом электроде, модифицированном медьсодержащим нанокомпозитом, в 0.1 М растворах H2SO4 и Na2SO4 соответственно. Для пастового электрода в растворе сульфата натрия не наблюдался пик восстановления меди, что связано с меньшей химической активностью нанокомпозита в нейтральной среде в сравнении с кислой. В обоих случаях ионной формы значения предельного диффузионного тока и эффективного числа электронов близки между собой (табл. 5).
Таблица 5.
Предельный ток по кислороду ilim и эффективное число электронов n при электровосстановлении кислорода на Cu0 (N = 3) · Lewatit К2620,C,P/GC в Н+-форме в 0.1 М растворе H2SO4 и Na+-форме в 0.1 М растворе Na2SO4
| Ионная форма матрицы | Область потенциалов получения ЦВА Е, мВ |
Область потенциалов предельного тока Е, мВ | –ilim, А/м2 | n |
|---|---|---|---|---|
| Н+ | 200…–600 | –350…–550 | 25.7 ± 0.2 | 2.6 |
| Na+ | 400…–900 | –550…–800 | 22.9 ± 1.3 | 2.3 |
Следует отметить слабое влияние размера наночастиц металлического компонента на предельный ток по кислороду. Некоторые различия можно обнаружить при малых циклах осаждения металла. В области перколяции ключевую роль играют природа, содержание металлического компонента и ионная форма полимерной матрицы.
ЗАКЛЮЧЕНИЕ
Наночастицы серебра, осажденные в ионообменные матрицы, способствуют электровосстановлению кислорода по четырехэлектронному механизму до молекул воды, без накопления промежуточного продукта – пероксида водорода, что принципиально важно, например, в целях обескислороживания воды. Для медьсодержащего электрода сравнительно низкое значение предельного диффузионного тока по кислороду связано с повышенной химической активностью меди и саморастворением в кислой среде. Для палладийсодержащих нанокомпозитных электродов критичным является выделение водорода, что сказывается на предельном диффузионном токе.
Предельный ток по кислороду проявляет зависимость от размера и количества наночастиц металла, ионной формы полимерной матрицы. Зависимость предельного тока от различных внутренних факторов связана главным образом с различной степенью молекулярной сорбции кислорода макропористыми металл-ионообменными нанокомпозитами. Возрастание предельного тока и числа электронов в реакции электровосстановления кислорода при переходе к более крупным наночастицам связано с повышением количества атомов на гранях кристалла и переходом к свехрперколяционной проводимости материала.
Список литературы
Кравченко, Т.А., Полянский, Л.Н., Калиничев, А.И., Конев, Д.В. Нанокомпозиты металл-ионообменник, М.: Наука, 2009. 391 с. [Kravchenko, T.A, Polyansky, L.N, Kalinichev, A.I, and Konev, D.V., Metal-ion exchanger nanocomposites (in Russian), Moscow: Nauka, 2009. 391 p.]
Кравченко, Т.А., Золотухина, Е.В., Чайка, М.Ю., Ярославцев, А.Б. Электрохимия нанокомпозитов металл-ионообменник, М.: Наука, 2013. 365 с. [Kravchenko, T.A., Zolotukhina, E.V., Chaika, M.Yu., and Yaroslavtsev, A.B., Electrochemistry of Metal-Ion Exchangers (in Russian), Moscow: Nauka, 2013. 365 p.]
Kravchenko, T.A., Khorolskaya, S.V., Polyanskiy, L.N., and Kipriyanova, E.S., Investigation of the mass transfer process in metal–ion exchanger nanocomposites. In book “Nanocomposites: Synthesis, Characterization and Application, Ed. X. Wang, New York: Nova Science Publishers, 2013. p. 329–348.
Zolotukhina, E.V. and Kravchenko, T.A., Synthesis and kinetics of growth of metal nanoparticles inside ion-exchange polymers, Electrochim. Acta, 2011, vol. 56, p. 3597.
Macanás, J., Ruiz, P., Alonso, A., Muñoz, M., and Muraviev, D.N., Ion Exchange-Assisted Synthesis of Polymer Stabilized Metal Nanoparticles, Ion exchange and solvent extraction. A series of advances, Ed. A.K. Sengupta, London, New York: CRC Press, 2011, vol. 20, p. 1.
Подловченко, Б.И., Андреев, В.Н. Электрокатализ на модифицированных полимерами электродах. Успехи химии. 2002. Т. 71. № 10. С. 950. [Podlovchenko, B.I. and Andreev, V.N., Electrocatalysis on polymer-modified electrodes, Russ. Chem. Rev., 2002, vol. 71, № 10, p. 837.]
Sun, Y.-P., Atorngitjawat, P., Lin, Y., Liu, P., Pathak, P., Bandara, J., Elgin, D., and Zhang, M., Nanoscale cavities in ionomer membrane for the formation of nanoparticles, J. Memb. Sci., 2004, vol. 245, p. 211.
Corain, B., Zecca, M., Canton, P., and Centomo, P., Synthesis and catalytic activity of metal nanoclusters inside functional resins: an endeavour lasting 15 years, Phil. Trans. R. Soc. A, 2010, vol. 368, p. 1495.
Patra, S., Sen, D., Pandey, A.K., Agarwal, Ch., Ramagiri, Sh.V., Bellare, J.R., Mazumder, S., and Goswami, A., Local conditions influencing in situ formation of different shaped silver nanostructures and subsequent reorganizations in ionomer membrane, J. Phys. Chem. C., 2013, vol. 117, p. 12026.
Bastos-Arrieta, J., Muñoz, M., Ruiz, P., and Muraviev, D.N., Morphological changes of gel-type functional polymers after intermatrix synthesis of polymer stabilized silver nanoparticles, Nanoscale Research Letters, 2013, vol. 8, p. 255.
Novikova, S.A., Yurkov, G.Yu., and Yaroslavtsev, A.B., Synthesis and transport properties of membrane materials with incorporated metal nanoparticles, Mendeleev Commun., 2010, vol. 20, p. 89.
Волков, В.В., Кравченко, Т.А., Ролдугин, В.И. Наночастицы металлов в полимерных каталитических мембранах и ионообменных системах для глубокой очистки воды от молекулярного кислорода. Успехи химии. 2013. Т. 82. № 5. С. 465. [Volkov, V.V., Kravchenko, T.A., and Roldughin, V.I., Metal nanoparticles in catalytic polymer membranes and ion-exchange systems for advanced purification of water from molecular oxygen, Russ. Chem. Rev., 2013, vol. 82, no. 5, p. 465.]
Selvaraju, T. and Ramaraj R., Nanostructured copper particles-incorporated Nafion-modified electrode for oxygen reduction, J. Phys. Indian Acad Sci., 2005, vol. 65, no. 4, p. 713.
Chabi, S. and Kheirmand, M., Electrocatalysis of oxygen reduction reaction on Nafion/platinum/gas diffusion layer electrode for PEM fuel cell, Appl. Surf. Sci., 2011, vol. 257, p. 10408.
Sleightholme, A.E.S., Varcoe, J.R., and Kucernak, A.R., Oxygen reduction at the silver/hydroxide-exchange membrane interface, Electrochem. Communic., 2008, vol. 10, p. 151.
Горшков, В.С., Захаров, П.Н., Полянский, Л.Н., Чайка, М.Ю., Кравченко, Т.А., Крысанов, В.А. Композиты ионообменной мембраны МФ-4СК с наночастицами металлов и активным углем Norit 30 в реакции электровосстановления кислорода. Сорбционные и хроматографические процессы. 2014. Т. 14. № 4. С. 601. [Gorshkov, V.S., Zakharov, P.N., Polyanskii, L.N., Chayka, M.Yu., Kravchenko, T.A., and Krysanov, V.A., Composites of the ion-exchange membrane MF-4SC with metal nanoparticles and activated carbon Norit 30 in the oxygen electroreduction reaction, Sorbcionnye i hromatograficheskie processi (in Russian), 2014, vol. 14, no. 4, p. 601.]
Дамаскин, Б.Б., Петрий, О.А., Цирлина, Г.А. Электрохимия: Учебное пособие, СПб.: Лань. 2015. 672 с. [Damaskin, B.B., Petriy, O.A., and Tsirlina, G.A., Electrochemistry: Study Guide (in Russian), St. Petersburg, Lan, 2015, 672 p.]
Чайка, М.Ю., Кравченко, Т.А., Полянский, Л.Н., Крысанов, В.А. Электровосстановление молекулярного кислорода на дисперсной меди в ионообменной матрице. Электрохимия. 2008. Т. 44. № 11. С. 1337. [Chaika, M.Y., Kravchenko, T.A., Polyanskii, L.N., and Krysanov, V.A., Electroreduction of molecular oxygen on dispersed copper in an ion-exchange matrix, Russ. J. of Electrochem., 2008, vol. 44, no. 11, p. 1244.]
Хорольская, С.В., Полянский, Л.Н., Кравченко, Т.А., Конев, Д.В. Кооперативные взаимодействия наночастиц металла в ионообменной матрице с растворенным в воде кислородом. Журн. физич. химии. 2014. Т. 88. № 6. С. 1002. [Khorolskaya, S.V., Polyanskii, L.N., Kravchenko, T.A., and Konev, D.V., Cooperative interactions of metal nanoparticles in the ion-exchange matrix with oxygen dissolved in water, Russ. J. of Physical Chemistry A., 2014, vol. 88, no. 6, p. 1000.]
Информация о продукте Lewatit K 2620 (https://www.lenntech.com/Data-sheets/Lewatit-K-2620- L.pdf).
Fernandez, J.L., Walsh, D.A., and Bard, A.J., Thermodynamic guidelines for the design of bimetallic catalysts for oxygen electroreduction and rapid screening by scanning electrochemical microscopy M–Co (M: Pd, Ag, Au), J. Amer. Chem. Soc., 2005, vol. 127, no. 1, p. 357.
Pech-Pech, I.E., Dominic, F.G., and Perez-Robles, J.F., Nanoparticles of Ag with a Pt and Pd rich surface supported on carbon as a new catalyst for the oxygen electroreduction reaction (ORR) in acid electrolytes: Part 2, J. Power Sources, 2015, vol. 276, p. 374.
Das, T.N., Saturation concentration of dissolved O2 in highly acidic aqueous solutions of H2SO4, Ind. Eng. Chem. Res., 2005, vol. 44, p. 1660.
Gara, M. and Compton, R.G., Activity of carbon electrodes towards oxygen reduction in acid: A comparative study, New J. Chem., 2011, vol. 35, p. 2647.
Томашов, Н.Д. Коррозия металлов с кислородной деполяризацией, М.: Изд. АН, 1947. 250 с. [Tomashov, N.D., Corrosion of metals with oxygen depolarization (in Russian), Moscow, Izd. AN, 1947. 250 p.]
Химическое осаждение металлов из водных растворов / Под ред. В.В. Свиридова, Минск: Университетское, 1987. 270 с. [Chemical deposition of metals from aqueous solutions (in Russian) / Ed. by V.V. Sviridov, Minsk: University, 1987. 270 p.]
Demarconnay, L., Coutanceau, C., and Leger, J.-M., Electroreduction of dioxygen (ORR) in alkaline medium on Ag/C and Pt/C nanostructured catalysts – effect of the presence of methanol, Electrochim. Acta, 2004, vol. 49, p. 4513.
Sarapuu, A., Kallip, S., Kasikov, A., Matisen, L., and Tammeveski, K., Electroreduction of oxygen on gold-supported thin Pt films in acid solutions, J. Electroanal. Chem., 2008, vol. 624, p. 144.
Yang, Y. and Zhou, Y., Particle size effects for oxygen reduction on dispersed silver + carbon electrodes in alkaline solution, Electroanalytic. Chemistry, 1995, vol. 397, p. 271.
Антропов, Л.И. Теоретическая электрохимия, М.: Высш. шк., 1984. 519 с. [Antropov, L.I., Theoretical Electrochemistry (in Russian), Moscow: Vyssh. shk., 1984. 519 p.]
Томашов, Н.Д. Коррозия и защита металлов. Часть 1. Теория коррозии металлов, М.: Металлургиздат, 1952. 200 с. [Tomashov, N.D., Corrosion and protection of metals. Part 1. Theory of metal corrosion (in Russian), Moscow, Metallurgizdat, 1952. 200 p.]
Дополнительные материалы отсутствуют.


