Электрохимия, 2019, T. 55, № 12, стр. 1499-1507
Новый электрохимический сенсор на основе нанолистов оксида графена и ионной жидкости (в качестве связующего) для определения дроксидопы в фармацевтических препаратах и образцах мочи методом дифференциальной импульсной вольтамперометрии
С. З. Мохаммади a, *, Х. Бейтоллахи b, **, М. Кайкхайи c, Н. Мохаммадизадех c
a Университет Пайаме Нур
Тегеран, Иран
b Педагогический Университет передовых технологий
Керман, Иран
c Университет Систана и Белуджистана
Захедан, Иран
* E-mail: szmohammadi@yahoo.com
** E-mail: h.beitollahi@yahoo.com
Поступила в редакцию 23.12.2018
После доработки 25.03.2019
Принята к публикации 10.05.2019
Аннотация
Дроксидопа – это синтетическая аминокислота, которая в присутствии ароматической аминокислоты декарбоксилазы и пиридоксальфосфата преобразуется в мощный вазоконстриктор (сосудосужающее средство) норэпинефрин. Это эффективное лекарство для лечения “застывания” при ходьбе и головокружения при вставании, связанных с болезнью Паркинсона, и ортостатической гипотензии. В настоящей работе исследовано анодное окисление дроксидопы на поверхности нового угольно-пастового электрода, модифицированного ионной жидкостью (гексафторфосфат н-гексил-3-метилимидазолия) и оксидом графена. Структуру этого модифицированного электрода изучали методом сканирующей электронной микроскопии. Электрохимическое исследование модифицированного электрода проводили методами циклической вольтамперометрии, хроноамперометрии и дифференциальной импульсной вольтамперометрии. Метод дифференциальной импульсной вольтамперометрии демонстрирует линейный отклик в интервале концентраций дроксидопы от 1.0 × 10–7 до 6.0 × 10−4 M. Наименьшая определяемая концентрация составляет 3.0 × 10–8 M. Модифицированный электрод успешно использован для точного определения содержания дроксидопы в реальных образцах.
ВВЕДЕНИЕ
Анализ лекарств и биологически важных веществ играет ключевую роль в контроле качества лекарств и таким образом существенно вовлечен в здравоохранение [1–4]. Поэтому так жизненно важно иметь легкий, быстрый, чувствительный, избирательный и точный способ определения биологически активных соединений и лекарств.
Дроксидопа (L-трео-3,4-дигидроксифенилсерин) – это “предлекарство”, трансформирующееся в норэпинефрин и эпинефрин; она повышает кровяное давление и позволяет оценить симптомы нейрогенной ортостатической гипотензии. Она выдержала проверку в Японии при лечении ортостатической гипотензии с 1989 г. В 2014 г. Управление по контролю над продуктами и лекарствами США утвердило дроксидопу, как средство для лечения ортостатической гипотензии. Получение еще одного лекарства для лечения ортостатической гипотензии – это важный момент в противодействии этому редкому заболеванию [5].
Дроксидопа – это синтетическая катехол-аминокислота, которая при оральном приеме естественным путем преобразуется в метастатический нейротрансмиттер норэпинефрин. дроксидопа способна обходить защитную фиксацию кровеносной системы мозга, в то время как норэпинефрин и эпинефрин к этому не способны [6, 7]. В ее метаболизме принимает участие ароматическая L-аминокислота – фермент декарбоксилаза, повышающий уровень норэпинефрина и эпинефрина в периферической нервной системе, что вызывает тахикардию и повышенное кровяное давление, позволяя таким образом сохранять кровоток в теле в положении стоя [8]. Поэтому ключевой момент – контроль содержания этого лекарства в фармацевтических препаратах для достижения положительного медицинского эффекта и снижения токсичности.
Электрохимические подходы хорошо себя зарекомендовали в мониторинге окружающей среды, биотехнологии, медицине и технологическом контроле [9–13]. Углеродистые электроды широко применяются в вольтамперометрии, благодаря их дешевизне, низкому электрическому сопротивлению, широкой области идеальной поляризуемости и разносторонним возможностям химического модифицирования. Эти химически “отрегулированные” электроды благоприятствуют анализу многочисленных веществ в следовых количествах, протекающему по чувствительному электроаналитическому механизму.
Исследование электрохимических сенсоров на основе наноматериалов постоянно продолжается [14–17]. Многочисленные преимущества использования наноматериалов в качестве электродов позволили проанализировать различные химические реактивы при изучении рака, качества пищи, в клинических исследованиях, в изучении окружающей среды и в фармацевтике [9–21].
Модифицированные сенсоры демонстрируют низкую наименьшую определяемую концентрацию и быстрый отклик, как результат усиления сигнала, благодаря большой площади поверхности, быстрой электродной кинетике и низкому перенапряжению [22–25].
Двумерный sp2-гибридизованный кристаллический монослой из углеродных атомов, называемый графеном, находится в фокусе внимания в физике конденсированных систем и в материаловедении [26, 27]. Его ярко выраженная структура обеспечивает такие характеристики, как существенная механическая прочность, большая подвижность электронов при комнатной температуре, в дополнение к многочисленным другим выдающимся чертам [28]. Такие выдающиеся свойства позволяют использовать его в ряде областей технологии, прежде всего в охране окружающей среды и энергетике [29], запасании энергии и сенсорах [30], в частности в биосенсорах [31, 32]. В работе [33] дан полный обзор электрохимических применений графена.
В последнее время “низкотемпературные” ионные жидкости, пригодные для работы при комнатной температуре, получили распространение в качестве модификаторов электродов. Такие ионные жидкости состоят полностью из ионов и существуют в жидком состоянии при комнатной температуре; у них пренебрежимо низкое давление паров, хорошая растворимость и химическая устойчивость. “Низкотемпературные” ионные жидкости, как новые экологичные среды, демонстрируют многочисленные выдающиеся электрохимические характеристики, например, высокую ионную проводимость и широкую область идеальной поляризуемости [34–36].
В настоящей работе мы описываем семейство угольно-пастовых электродов, модифицированных с помощью нанолистов оксида графена и ионной жидкости (гексафторфосфат н-гексил-3-метилимидазолия) (GOILCPE), и их эксплуатационные характеристики при определении дроксидопы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приборы и реактивы
Все электрохимические измерения проводили на потенциостате/гальваностате Autolab (PGSTAT 302N, Eco Chemie, Нидерланды) в обычной трехэлектродной ячейке при 25 ± 1°C. Вспомогательным электродом служила платиновая проволочка, рабочим – угольно-пастовый электрод, модифицированный с помощью нанолистов оксида графена и ионной жидкости, а электродом сравнения – Ag/AgCl/KCl (3.0 M)-электрод. Величину pH измеряли pH-метром Metrohm (модель 692, Херизау, Швейцария).
Дроксидопа, как и все остальные реактивы, имела квалификацию “ч. д. а.” (Merck, Дармштадт, Германия). Фосфатный буферный раствор готовили из концентрированной фосфорной кислоты и ее солей. Как и в наших предшествующих работах, нанолисты оксида графена были синтезированы в нашей лаборатории [37]. Вкратце: 1 г порошка графита добавляли к 23 мл концентрированной H2SO4 и перемешивали при комнатной температуре в течение 24 ч. Затем добавляли 0.1 г NaNO3, перемешивали в течение 30 мин и охлаждали до 5°C во льду. Далее, медленно вливали в эту смесь раствор 3 г KMnO4, нагревали до 35–40°C и перемешивали в течение 30 мин. После этого добавляли 46 мл воды в течение 25 мин. Останавливали реакцию добавлением 140 мл воды и 10 мл 30%-ной H2O2. После этого удаляли избыток не прореагировавшего графита центрифугированием смеси при 3200 об/мин в течение 15 мин. Наконец, продукт промывали деионизованной водой до тех пор, пока промывная вода не освобождалась от кислоты, и сушили под вакуумом при 50°C.
Приготовление электрода GOILCPE
С этой целью 0.1 г оксида графена и 0.9 г порошка графита смешивали в ступке, добавляли 0.2 мл ионной жидкости и 0.5 мл парафинового масла и перемешивали в течение 15 мин. Полученную пасту вмазывали в стеклянную трубку (внутренний диаметр 3.4 мм, длина 10 см) и утрамбовывали. Далее, вмуровывали в электрод медную проволочку для создания электрического контакта. Поверхность обновляли, выдавливая из трубки порцию пасты и полируя электрод на бумаге для взвешивания.
По той же методике готовили угольно-пастовый электрод с ионной жидкостью без оксида графена (ILCPE), угольно-пастовый электрод, модифицированный только оксидом графена (GOCPE) без ионной жидкости, и угольно-пастовый электрод с чистой поверхностью, без оксида графена и без ионной жидкости для того, чтобы сравнивать их между собой. На рис. 1 показаны типичные SEM-микрофотографии (Cam Scan MV2300, Кембридж, Великобритания) электрода GOILCPE.
Приготовление реальных образцов
Образцы мочи хранили в холодильнике сразу после отбора. Образец (10 мл) центрифугировали при 3000 об./мин в течение 10 мин. Надосадочную жидкость отфильтровывали с помощью фильтра 0.45 мкм. На следующей стадии различные объемы раствора помещали в мерную колбу на 25 мл и доводили до метки фосфатным буферным раствором (pH 7.0). В эти разбавленные образцы мочи намеренно добавляли различные количества дроксидопы и карбидопы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электрокаталитическое окисление дроксидопы на электроде GOILCPE
Электрохимическая активность дроксидопы зависит от величины pH водного раствора. Таким образом, для того, чтобы наблюдать электрокаталитическое окисление дроксидопы, требуется оптимизация pH раствора. Поэтому электрохимическую активность дроксидопы на GOILCPE-электроде изучали в 0.1 M фосфатном буферном растворе с различными значениями pH (2.0 < pH < 9.0) методом циклической вольтамперометрии. Было показано, что электрокаталитическое окисление дроксидопы на поверхности этого электрода в нейтральном растворе протекает лучше, чем в более кислом или щелочном. Поэтому в качестве оптимального pH для окисления дроксидопы на GOILCPE было выбрано значение равное 7.0.
На рис. 2 приведены циклические вольтамперограммы электрохимического окисления 200.0 мкM дроксидопы на угольно-пастовом электроде с чистой поверхностью (кривая a), GOCPE (кривая б), ILCPE (кривая в) и GOILCPE (кривая г).
Рис. 2.
Циклические вольтамперограммы немодифицированного угольно-пастового электрода (кривая a), GOCPE (кривая б), ILCPE (кривая в) и GOILCPE (кривая г) в присутствии 200.0 мкM дроксидопы в 0.1 M фосфатном буферном растворе (pH 7.0). Скорости развертки потенциала всюду 50 мВ/с.

Видно, что потенциалы анодных пиков тока окисления дроксидопы на GOILCPE и угольно-пастовом электроде с чистой поверхностью равняются, соответственно, 510 и 645 мВ; это указывает на то, что оксид графена и ионная жидкость – это подходящий медиатор. По сравнению с угольно-пастовым электродом с чистой поверхностью, потенциал пика тока окисления дроксидопы на электроде GOILCPE сдвинут приблизительно на 135 мВ в сторону отрицательных значений. При этом, по сравнению с угольно-пастовым электродом с чистой поверхностью, наблюдается чрезвычайно сильное увеличение анодного пикового тока в 100.0 мкM растворе дроксидопы (кривая г) – это результат сильнейшего электрокаталитического воздействия GOILCPE на окисление дроксидопы [38].
Для оценки влияния скорости развертки потенциала на окисление дроксидопы на электроде GOILCPE мы использовали метод вольтамперометрии с линейной разверткой потенциала (рис. 3). Полученные результаты показывают, что увеличение скорости развертки потенциала сдвигает потенциал пика тока в сторону положительных значений. Это означает кинетические ограничения в электрохимической реакции. К тому же график зависимости пикового тока (Ip) от корня квадратного из скорости развертки потенциала (v1/2) в интервале 10–200 (мВ с−1)1/2 имеет линейный характер с коэффициентом корреляции 0.999 [Y = 1.4x – 1.4, где Y – это Ip (мкA), а x – это v1/2 (мВ с−1)1/2]. Это означает, что процесс контролируется диффузией [38].
Рис. 3.
Вольтамперограммы с линейной разверткой потенциала электрода GOILCPE в 0.1 M фосфатном буферном растворе (pH 7.0), содержащем 105.0 мкM дроксидопы, снятые при различной скорости развертки потенциала: кривые 1–5 соответствуют 10, 30, 70, 100 и 200 мВ/с.

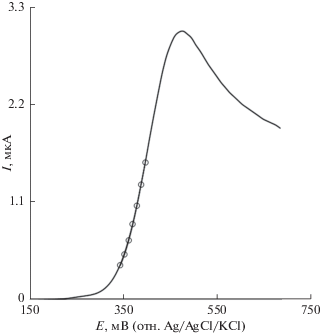
На рис. 4 показана вольтамперограмма с линейной разверткой потенциала, снятая на электроде GOILCPE в 0.1 M фосфатном буферном растворе (pH 7.0), содержащем 100.0 мкM дроксидопы, при скорости развертки потенциала 10 мВ с−1. Возрастающая ветвь вольтамперограммы – это тафелевская область, отражающая кинетику переноса электрона от дроксидопы на GOILCPE-электрод. В случае, если депротонирование дроксидопы – это достаточно быстрая стадия, то число электронов, принимающих участие в скорость-определяющей стадии, можно найти из наклона тафелевской области. По точкам на вольтамперограмме с линейной разверткой потенциала был построен тафелевский график (Y = 0.1x + 0.4, с R2 = 0.998, где Y – это E (В), а x – lg I (мкA)). Этот тафелевский наклон (0.096 В) говорит о том, что в скоростьопределяющей стадии на электроде участвует один электрон, а коэффициент переноса равняется α = 0.38.
Хроноамперометрические измерения
При снятии хроноамперограмм дроксидопы на GOILCPE-электроде потенциал рабочего электрода устанавливали равным 0.56 В отн. Ag/AgCl/KCl (3.0 M)-электрода сравнения, при различных концентрациях дроксидопы в 0.1 M фосфатном буферном растворе (pH 7.0) (рис. 5). Для определения коэффициента диффузии может быть использовано уравнение Котрелла [38]:
Калибровочная кривая и наименьшая определяемая концентрация
При использоваиии дифференциальной импульсной вольтамперометрии был получен линейный отклик пикового тока окисления дроксидопы на электроде GOILCPE от ее концентрации (рис. 6). Калибровочная кривая линейна в области концентраций от 0.1 до 600.0 мкM, с коэффициентом корреляции 0.999 [Y = 0.05c + 2.3, где Y – это пиковый ток (мкA), а c – концентрация дроксидопы (мкM)]. Наименьшая определяемая концентрация при трехкратном стандартном отклонении (3σ) в глухом опыте равняется 3.0 × 10−8 M. В табл. 1 дано сравнение аналитических характеристик, полученных в настоящей работе, с альтернативными модифицированными электродами [1, 8, 39–41]. Как видно из табл. 1, линейный динамический диапазон (LDR) и наименьшая определяемая концентрация (LOD) в настоящей работе соизмеримы с таковыми, опубликованными другими исследовательскими группами для электрокаталитического окисления дроксидопы на поверхности электродов, модифицированных альтернативными медиаторами.
Рис. 6.
Дифференциальные импульсные вольтамперограммы электрода GOILCPE в 0.1 M фосфатном буферном растворе (pH 7.0), содержащем различные концентрации дроксидопы: кривые 1–12 соответствуют 0.1, 1.0, 5.0, 10.0, 30.0, 70.0, 100.0, 200.0, 300.0, 400.0, 500.0 и 600.0 мкM дроксидопы.
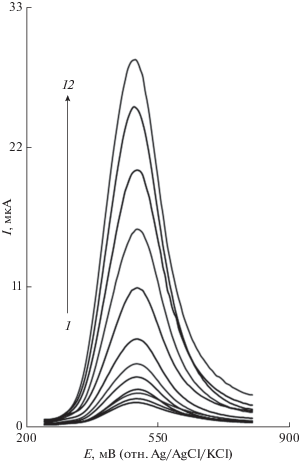
Таблица 1.
Сравнение эффективности электрохимических методов, применяемых для определения дроксидопы
| Метод | Модификатор | LOD, нM | LDR, мкM | Ссылка |
|---|---|---|---|---|
| Вольтамперометрия | Наночастицы ZnO (Zn/NPs) и гексафторфосфат 1-бутил-3-метилимидазолия | 150 | 0.4–5.0 | [1] |
| То же | Нанокомпозит восстановленный оксид графена/наночастицы Pt | 31.0 | 0.084–200 | [8] |
| То же | Углеродные нанотрубки и 5-амино-2'-этилбифенил-2-ол | 60.0 | 0.12–225 | [39] |
| То же | Графен и этил-2-(4-ферроценил-[1,2,3]триазол-1-ил) ацетат | 90 | 2–400 | [40] |
| То же | Нанокомпозиты оксид графена/ZnO | 45 | 0.075–800 | [41] |
| То же | Наностержни ZnO и 2-(4-оксо-3-фенил-3,4-дигидрохиназолинил)-N′-фенилгидразинкарботиоамид | 45 | 0.007–300 | [42] |
| То же | Оксид графена и ионная жидкость | 60.0 | 0.25–500 | Настоящая работа |
Стабильность и воспроизводимость модифицированного электрода
Воспроизводимость GOILCPE при определении дроксидопы оценивали в 50.0 мкM растворе дроксидопы (n = 10). Наши результаты показали, что определение хорошо воспроизводимо: относительное стандартное отклонение (RSD) равняется 3.1%. После каждого измерения модифицированный электрод полировали. Далее, электрод GOILCPE хранили на воздухе в течение 2 недель. После этого его электрохимическая активность в определении дроксидопы осталась практически на прежнем уровне, что подтверждает адекватную воспроизводимость и стабильность GOILCPE.
Дополнительно, долговременную стабильность GOILCPE проверяли экспериментально в течение 3 недель. После хранения модифицированного электрода в лабораторных условиях при комнатной температуре снимали циклические вольтамперограммы, которые не показали каких-либо изменений потенциала пика тока окисления дроксидопы; сигнал же тока снизился на 3.4% по сравнению с первоначальным значением. Способность модифицированного электрода противостоять загрязнению его поверхности продуктами окисления дроксидопы проверяли с помощью циклических вольтамперограмм, снятых на этом электроде до и после реакции дроксидопы. Эти циклические вольтамперограммы записывали в растворе дроксидопы, проводя 15 циклов при скорости развертки потенциала 50 мВ/с. При этом потенциал пика тока оставался неизменным, в то время как ток снизился меньше, чем на 3.2%. Таким образом, электрод GOILCPE обладает повышенной чувствительностью, а загрязнение его поверхности аналитом и продуктами его окисления несущественно.
Дополнительно, мы исследовали способность электрода воспроизводить чистую поверхность, снимая циклические вольтамперограммы в оптимизированных условиях, т.е. при pH 7.0, на пяти отдельно приготовленных электродах. Критерием адекватности воспроизводимости поверхности служило относительное стандартное отклонение (RSD) для различных факторов (приблизительно 2–4%), которое почти не отличалось от того, что обычно наблюдается при обновлении поверхности традиционных угольно-пастовых электродов.
Исследование влияния возможных помех
Влияние различных соединений на определение дроксидопы исследовали в оптимизированных условиях: в 50.0 мкM растворе дроксидопы при pH 7.0. Возможные соединения-помехи выбирали из числа соединений, обычно находящихся вместе с дроксидопой в фармацевтических препаратах или биологических жидкостях. Предельно допустимое вредное воздействие мы определили, как наивысшую концентрацию соединения-помехи, вызывающую ошибку в определении дроксидопы не более 5%. Мы показали, что l‑лизин, глюкоза, l-серин, l-аспарагин, глицин, l‑цистин, метионин, l-треонин, лимонная кислота, фруктоза, l-цистеин, метанол, N-ацетилцистеин, триптофан, этанол, лактоза, гистидин, l‑пролин, сахароза, фенилаланин, бензойная кислота, мочевина, глутатион, Mg2+, Fe2+, ${\text{SO}}_{4}^{{2 - }},$ Fe3+, Al3+, ${\text{NH}}_{4}^{ + },$ ${\text{CO}}_{3}^{{2 - }},$ Ca2+, F– и S2– не мешают определению дроксидопы. В то же время норэпинефрин, аскорбиновая кислота, эпинефрин и леводопа являются помехами в определении. Но если даже аскорбиновая кислота мешает определению, ее мешающее воздействие можно уменьшить, если требуется, используя фермент оксидаза аскорбиновой кислоты, обладающий высокой избирательностью по отношению к окислению аскорбиновой кислоты.
Анализ реальных образцов
Электрод GOILCPE был использован для определения дроксидопы в образцах мочи. С этой целью дроксидопу определяли в реальных образцах (табл. 2). В эти образцы намеренно вводили различные количества дроксидопы и определяли этот компонент, используя метод стандартных добавок, исключающий воздействие собственно матрицы. Количество исходной дроксидопы в образцах можно определить, экстраполируя полученный график. Полученные результаты показывают, что добавленный аналит может быть количественно обратно извлечен из реальных образцов. Эти результаты демонстрируют возможность проведения анализа реальных образцов на дроксидопу с использованием электрода GOILCPE. Средняя величина относительного стандартного отклонения подтверждает воспроизводимость метода.
ЗАКЛЮЧЕНИЕ
В настоящей работе исследована электрохимическая активность дроксидопы на поверхности угольно-пастового электрода с модификатором “нанолисты оксида графена/ионная жидкость”. Сконструированный электрод предоставляет недорогой и простой для понимания подход к определению концентрации дроксидопы в образцах мочи с вполне удовлетворительными аналитическими характеристиками. Благодаря особым свойствам нанолистов оксида графена, этот сенсор демонстрирует прекрасное электрохимическое поведение при окислении дроксидопы. В оптимальных условиях метод дифференциальной импульсной вольтамперометрии дает линейный динамический диапазон 0.1–600 мкM; наименьшая определяемая концентрация равняется 0.03 мкM.
Список литературы
Kumar Gupta, V., Sadeghi, R., and Karimi, F., A novel electrochemical sensor based on ZnO nanoparticle and ionic liquid binder for square wave voltammetric determination of droxidopa in pharmaceutical and urine samples, Sens. Actuators B, 2013, vol. 186, p. 603.
Goyal, R.N., Gupta, V.K., and Chatterjee, S., A sensitive voltammetric sensor for determination of synthetic corticosteroid triamcinolone, abused for doping, Biosens. Bioelectron., 2009, vol. 24, p. 3562.
Ensafi, A.A., Dadkhah-Tehrani, S., and Karimi-Maleh, H., Voltammetric determination of glutathione in haemolysed erythrocyte and tablet samples using modifiedmultiwall carbon nanotubes paste electrode, Drug Test. Anal., 2012, vol. 4, p. 978.
Beitollahi, H., Ghofrani Ivari, S., and Torkzadeh-Mahani, M., Application of antibody nanogold–ionic liquid–carbon paste electrode for sensitive electrochemical immunoassay of thyroid-stimulating hormone, Biosens. Bioelectron., 2018, vol. 110, p. 97.
Kaufmann, H., Norcliffe-Kaufmann, L., and Palma, J.-A., Droxidopa in neurogenic orthostatic hypotension, Expert. Rev. Cardiovasc. Ther., 2015, vol. 13, p. 875.
Özdokur, K.V., Engin, E., Yengin, Ç., Ertaş H., and Nil Ertaş, F. Determination of Carbidopa, Levodopa, and Droxidopa by High-Performance Liquid Chromatography–Tandem Mass Spectrometry, Anal. Letter., 2018, vol. 51, p. 73.
Goldstein, D.S., Kopin, I.J., and Sharabi, Y., Catecholamine autotoxicity. Implications for pharmacology and therapeutics of Parkinson disease and related disorders, Pharmacol. Therapeut., 2014, vol. 144, p. 268.
Baghayeri, M., Pt nanoparticles/reduced graphene oxide nanosheets as a sensing platform: Application to determination of droxidopa in presence of phenobarbital, Sens. Actuators B, 2017, vol. 240, p. 255.
Mohammadi, S.Z., Beitollahi, H., Nikpour, N., and Hosseinzadeh, R., Electrochemical Sensor for Determination of Ascorbic Acid Using a 2Chlorobenzoyl Ferrocene/Carbon Nanotube Paste Electrode, Anal. Bioanal. Chem. Res., 2016, vol. 3, p. 187.
Rohani, T., Mohammadi, S.Z., Karimi, M.A., and Amini, S., Green synthesized silver nanoparticles@zeolite type A hybridized with carbon ceramic, AgZA-CCE, as a new nano-electrocatalyst for detection of ultra-trace amounts of rutin, Chem. Phy. Lett., 2018, vol. 713, p. 259.
Mohammadi, S.Z., Beitollahi, H., and Hassanzadeh, M., Voltammetric Determination of Tryptophan Using a Carbon Paste Electrode Modified with Magnesium Core Shell Nanocomposite and Ionic Liquids, Anal. Bioanal. Chem. Res., 2018, vol. 5, p. 55.
Baghbamidi, S.E., Beitollahi, H., and Tajik, S., Graphene oxide Nano-Sheets/Ferrocene derivative modified carbon paste electrode as an electrochemical sensor for determination of hydrazine, Anal. Bioanal. Electrochem., 2014, vol. 6, p. 634.
Mohammadi, S.Z., Beitollahi, H., and Fadaeian, H., Voltammetric Determination of Isoproterenol using a Graphene Oxide Nano Sheets Paste Electrode, J. Analyt. Chem., 2018, vol. 73, p. 705.
Mosazadeh, F., Mohammadi, S.Z., and Sarhadi, A.H., Electrochemical Determination of Acetaminophen by using Modified Screen Printed Carbon Electrode, Anal. Bioanal. Electrochem., 2018, vol. 10, p. 1163.
Goyal, R.N., Oyama, M., Gupta, V.K., Singh, S.P., and Chatterjee, S., Sensors for 5-hydroxytryptamine and 5-hydroxyindole acetic acid based on nanomaterial modified electrodes, Sens. Actuators B, 2008, vol. 134, p. 816.
Beitollahi, H. and Tajik, S., Construction of a nanostructure-based electrochemical sensor for voltammetric determination of bisphenol A, Environ. Monit. Assess., 2015, vol. 187, p. 1.
Mohammadi, S.Z., Reiahipour, E., and Mosazadeh, F., Screen-printed Electrodes Modified with Magnetic Core–Shell Nanoparticles Film for the Development of a Sensor for Imipramine Detection, Anal. Bioanal. Electrochem., 2018, vol. 10, p. 383.
Mohammadizadeh, N., Mohammadi, S.Z., and Kaykhaii, M., Carbon Paste Electrode Modified with ZrO2 Nanoparticles and Ionic Liquid for Sensing of Dopamine in the Presence of Uric Acid, J. Anal. Chem., 2018, vol. 73, p. 685.
Mohammadi, S.Z., Beitollahi, H., and Mousavi, M., Determination of Hydroxylamine Using a Carbon Paste Electrode Modified with Graphene Oxide Nano Sheets, Rus. J. Electrochem., 2017, vol. 53, p. 374.
Beitollahi, H., Karimi-Maleh, H., and Khabazzadeh, H., Nanomolar and selective determination of epinephrine in the presence of norepinephrine using carbon paste electrode modified with carbon nanotubes and novel 2-(4-oxo-3-phenyl-3,4-dihydroquinazolinyl)-N-phenyl- hydrazinecarbothioamide, Anal. Chem., 2008, vol. 80, p. 9848.
Mohammadi, S.Z., Sarhadi, A.H., and Mosazadeh, F., Screen-printed Electrode Modified with Magnetic Core–shell Nanoparticles for Detection of Chlorpromazine, Anal. Bioanal. Chem. Res., 2018, vol. 5, p. 363.
Beitollahi, H., Nekooei, S., and Torkzadeh-Mahani, M., Amperometric immunosensor for prolactin hormone measurement using antibodies loaded on a nano-Au monolayer modified ionic liquid carbon paste electrode, Talanta, 2018, vol. 188, p. 701.
Mohammadi, S.Z., Beitollahi, H., and Tajik, S., Nonenzymatic coated screen‑printed electrode for electrochemical determination of acetylcholine, Micro and Nano Syst. Lett., 2018, vol. 6, p. 9. https://doi.org/10.1186/s40486-018-0070-5
Mohammadi, S.Z., Beitollahi, H., and Bani Asadi, E., Electrochemical determination of hydrazine using a ZrO2 nanoparticles-modified carbon paste electrode, Environ Monit Assess, 2015, vol. 187, p. 122.
Zhang, J., Tan, X., Zhao, D., Tan, S., Huang, Z., Mi, Y., and Huang, Z., Study of nimesulide and its determination using multiwalled carbon nanotubes modified glassy carbon electrodes, Electrochim. Acta, 2010, vol. 55, p. 2522.
Ding, M., Zhou, Y., Liang, X., Zou H., Wang, Z., Wang, M., and Ma, J., An electrochemical sensor based on graphene/poly(brilliant cresyl blue) nanocomposite for determination of epinephrine, J. Electroanal. Chem., 2016, vol. 763, p. 25.
Geim, A.K. and Novoselov, K.S., The rise of graphene, Nat. Mater., 2007, vol. 6, p. 183.
Novoselov, K.S., Fal’ko, V.I., Colombo, L., Gellert, P.R., Schwab, M.G., and Kim, K., A roadmap for graphene, Nature, 2012, vol. 490, p. 192.
Chabot, V., Higgins, D., Yu, A., Xiao, X., Chen, Z., and Zhang, J., A review of graphene and graphene oxide sponge: material synthesis and applications to energy and the environment, Energy Environ. Sci., 2014, vol. 7, p. 1564.
Zhu, J., Yang, D., Yin, Z., Yan, Q., and Zhang, H., Graphene and graphene-based materials for energy storage applications, Small, 2014, vol. 10, p. 3480.
Zhang, Y., Zeng, G.M., Tang, L., Chen, J., Zhu, Y., He, X.X., and He, Y., Electrochemical sensor based on electrodeposited graphene-Au modified electrode and nanoAu carrier amplified signal strategy for attomolar mercury detection, Anal. Chem., 2015, vol. 87, p. 989.
Xie, Y., Yuan, J., Ye, H., Song, P., and Hu, S., Facile ultrasonic synthesis of graphene/SnO2 nanocomposite and its application to the simultaneous electrochemical determination of dopamine, ascorbic acid, and uric acid, J. Electroanal. Chem., 2015, vol. 749, p. 26.
Vashist, S.K. and Luong, J.H.T., Recent advances in electrochemical biosensing schemes using graphene and graphene-based nanocomposites, Carbon, 2015, vol. 84, p. 519.
Halab Shaeli Iessa, K., Zhang, Y., Zhang, G., Xiao, F., and Wang, S., Conductive porous sponge-like ionic liquid-graphene assembly decorated with nanosized polyaniline as active electrode material for supercapacitor, J. Power Sources, 2016, vol. 302, p. 92.
Absalan, G., Akhond, M., Soleimani, M., and Ershadifar, H., Efficient electrocatalytic oxidation and determination of isoniazid on carbon ionic liquid electrode modified with electrodeposited palladium nanoparticles, J. Electroanal. Chem., 2016, vol. 761, p. 1.
Yang, J., Wang, Q., Zhang, M, Zhang, S., and Zhang, L., An electrochemical fungicide pyrimethanil sensor based on carbon nanotubes/ionic-liquid construction modified electrode, Food Chem., 2015, vol. 187, p. 1.
Mohammadi, S.Z., Karimi, M.A., and Mofidinasab, N., Rapid preconcentration of palladium and rhodium using magnetic graphene oxide/silicon dioxide nanocomposite prior to FAAS determination, Anal. Methods, Anal. Methods, 2019, vol. 11, p. 454.
Bard, A.J. and Faulkner, L.R., Electrochemical Methods: Fundamentals and Applications, Second ed., New York: Wiley, 2001.
Tajik, S., Taher, M.A., and Beitollahi, H., Simultaneous determination of droxidopa and carbidopa using a carbon nanotubes paste electrode, Sens. Actuators B, 2013, vol. 188, p. 923.
Movlaee, K., Beitollahi, H., Ganjali, M.R., and Norouzi, P., Strategy for Simultaneous Determination of Droxidopa, Acetaminophen and Tyrosine Using Carbon Paste Electrode Modified with Graphene and Ethyl 2-(4-ferrocenyl-[1,2,3]triazol-1-yl) Acetate, J. Electrochem. Soc., 2017, vol. 164, p. H407.
Beitollahi, H., Salimi, H., and Ganjali, M.R., Simultaneous voltammetric determination of droxidopa, acetaminophen, and tyrosine on hematoxylin and graphene oxide/ZnO nanocomposite-modified glassy carbon electrode, Ionics, 2018, vol. 24, p. 1487.
Moghaddam, H.M., Beitollahi, H., Tajik, S., Jahani, Sh., Khabazzadeh, H., and Alizadeh, R., Voltammetric determination of droxidopa in the presence of carbidopa using a nanostructured base electrochemical sensor, Russ. J. Electrochem., 2017, vol. 53, p. 452.
Дополнительные материалы отсутствуют.