Электрохимия, 2019, T. 55, № 12, стр. 1508-1517
Особенности электропроводности водных молекулярных растворов
В. А. Севрюгин a, *, В. В. Лоскутов b, **, Г. Н. Косова c
a Казанский (приволжский) федеральный университет, Институт физики, кафедра физики молекулярных систем
420008 Республика Татарстан, Казань, ул. Кремлевская, 18, Россия
b Марийский государственный университет, кафедра физики и материаловедения
424000 Республика Марий Эл, Йошкар-Ола, пл. Ленина, 1, Россия
c Поволжский государственный технологический университет, кафедра физики
424000 Республика Марий Эл, Йошкар-Ола, пл. Ленина, 3, Россия
* E-mail: ssevriugin@mail.ru
** E-mail: val_losk@rambler.ru
Поступила в редакцию 05.02.2019
После доработки 25.03.2019
Принята к публикации 25.06.2019
Аннотация
В работе представлены результаты измерений удельной электропроводности водных растворов низкомолекулярных спиртов: моно-, ди-, три- и нонаэтилен гликолей, глицерина, этанола, сорбита и ацетона в полном диапазоне концентраций. Показано, что в качестве донорно-активных центров носителей заряда в исследуемых системах следует рассматривать не только гидроксильные группы, но и атомы кислорода, что иллюстрируется линейной зависимостью максимума электропроводности от числа гидратационных центров. Предложен новый способ нормировки удельной электропроводности, позволяющий выделить компоненту, являющуюся донором носителей заряда.
ВВЕДЕНИЕ
Процессам, связанным с переносом протона уделяется большое внимание во многих областях науки: физики, химии, биологии. В последние десятилетия к явлению протонной проводимости проявляется огромный интерес в области материаловедения, поскольку основная мотивация заключается в разработке новых протон-проводящих материалов, пригодных для применения в электрохимических ячейках (топливных элементах, батареях, датчиках) [1, 2]. Мобильность протона обнаруживается не только в специальных системах или в растворах сильных кислот, но также хорошо известны явления протонного обмена в молекулярных водных растворах, регистрируемых методами ЯМР [3–5]. Водномолекулярные растворы, в частности растворы спиртов, являясь основой биологических систем, часто используются как компоненты модельных систем в научных исследованиях [6–9]. Спирты могут выступать в роли как донора протонов, так и акцептора, что приводит к самоассоциации спиртов в чистом состоянии и взаимной ассоциации в бинарных растворах [10].
Следствием практической значимости данных систем является значительное количество исследований с акцентом на анализ физических свойств растворов низкомолекулярных спиртов, таких как метанол, этанол, этиленгликоли, глицерин и др., с помощью ряда методов молекулярной динамики [11], измерений диэлектрической релаксации [12, 13], ЯМР [14, 15] и ИК-спектроскопии [16]. Эти свойства включают в себя способность сорбироваться на поверхности или на границе раздела фаз и протонную проводимость [17, 18].
Способность образовывать водородные связи дает широкий спектр применения спиртов как в электрохомических преобразованиях энергии в качестве дополнения к протон-обменным мембранам [19], а также в фармацевтике для развития методик трандермального переноса [20].
Проводимость различных ионов в водно-спиртовых растворах, в частности в растворах двухатомных спиртов, представляет отдельный интерес. В последние годы был опубликован ряд работ, посвященных проводимости различных ионов в водных растворах этиленгликолей [21‒23]. Так в работе [22] исследовались транспортные свойства симметричных 1 : 1 и 2 : 2 электролитов, а также сульфата цинка в бинарной системе этиленгликоль–вода (ЭГВ). Применительно к фармацевтическим задачам в [24] исследовали транспортные свойства NaCl в смесях гликоль–вода для определения совокупного эффекта взаимодействия гликоля и соли в водном растворе. В [25] использовали гибридное моделирование методом Монте-Карло и классическую молекулярную динамику для определения индуцированных зарядом конформационных изменений и механизмов высвобождения ионов в водных заряженных нанокаплях для применений в атмосферных аэрозолях и экспериментах по масс-спектроскопии с электрораспылением.
Классическая молекулярная динамика была использована для изучения структуры, сольватации и диффузии протонов с целью определения влияния атомарного уровня цепей этиленгликолей и групп сульфоновой кислоты на протонную проводимость с различным содержанием воды [26].
При этом необходимо отметить, что результаты прямых измерений электропроводности водных растворов низкомолекулярных спиртов в литературе практически отсутствуют, либо носят несистемный характер. Например, в работе [27] представлены результаты измерений концентрационной зависимости удельной электропроводности смеси ЭГВ в диапазоне концентраций от 0.3 до 1.0. Эта зависимость показывает монотонное убывание удельной электропроводности с увеличением содержания ЭГ. Однако, как показывают измерения, концентрационная зависимость электропроводности носит экстремальный характер. В работе [28] представлены значения энергии активации электропроводности бинарной смеси ЭГВ для трех значений концентрации, что очевидно, не позволяет сделать какие-либо выводы относительно влияния состава на энергию активации.
При интерпретации экспериментальных результатов исследования процессов электропроводности различных растворов, растворитель обычно рассматривается как некая среда, обладающая параметрами объема, диэлектрической проницаемости и вязкости. Такое представление о растворителе заложено как в теории электролитической диссоциации электролитов, так и в классическом описании процессов переноса заряда в пространстве с градиентом электрического потенциала [29, 30]. Наиболее полно эти представления реализованы в теории электропроводности растворов электролитов Дебая–Хюккеля. В случае растворов сильных электролитов исключение из рассмотрения свойств растворителя отчасти может быть оправдано, поскольку в области разбавленных растворов эффекты от изменения концентрации раствора определяются изменением количества ионов в системе без существенного изменения структуры раствора, а в области концентрированных растворов контролирующим фактором являются межионные и ион-молекулярные взаимодействия, определяющие структуру системы.
Однако в случае водных растворов, в частности растворов кислот и оснований, для объяснения их высокой проводимости приходится привлекать представления о переносе протона ${{\operatorname{H} }^{ + }}$ и гидроксила $\operatorname{O} {{\operatorname{H} }^{ - }}$ по сетке водородных связей. Следовательно, исключение из рассмотрения свойств растворителя существенно осложняет интерпретацию концентрационных и температурных зависимостей проводимости таких растворов. Для преодоления этих трудностей приходится вводить предположение о зависимости степени диссоциации слабых электролитов от их концентрации и/или многоэтапный процесс диссоциации. С другой стороны, открытой остается проблема объяснения проводимости водных молекулярных растворов, которые не являются электролитами.
Ранее при исследовании водных растворов этиленгликолей, сахаридов и спиртов [31, 32] было показано, что электрическая проводимость этих растворов носит экстремальный характер и сложным образом зависит от концентрации. В данной работе предпринята попытка интерпретации полученных результатов измерений концентрационных зависимостей удельной электропроводности с учетом явлений гидратации компонентов водного раствора. В свою очередь, молекулярно-кинетические представления явлений гидратации [33, 34], не укладываясь в рамки традиционных подходов к описанию проводимости проводников второго рода, потребовали модификации этих подходов с учетом взаимодействия молекул воды в гидратных оболочках с атомами гидратационных центров молекул растворенной компоненты водных растворов.
Водные растворы низкомолекулярных спиртов представляют собой простейшие системы, которые можно рассматривать как модельные и, в то же время, как системы, на основании которых разрабатываются новые материалы, имеющие проводимость, сравнимую (и даже выше) с проводимостью электролитов, но при этом гораздо менее химически агрессивные. Целью данной работы является анализ влияния гидратационных центров молекул спирта на образование свободных зарядов и величину удельной электропроводности. При этом необходимо отметить, что поскольку все транспортные явления, включая электропроводность, в сильно ассоциированных жидкостях связаны со структурой жидкости, представленные результаты могут быть интересны с точки зрения анализа динамики водородных связей и процессов образования ассоциатов или комплексов в подобных системах.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследований явились водные растворы этиленгликолей различных молекулярных масс: моно- (МЭГ, С2Н6О2), ди- (ДЭГ, С4Н10О3), три- (ТЭГ, С6Н14О4) и нонаэтилен гликоль (НЭГ, С18Н38О10); а также водные растворы этанола (С2Н5ОH), глицерина (С3Н8О3), сорбита (С6Н14О6) и ацетона (С3Н6О). Все реактивы имели класс ХЧ. В отдельных случаях, перед приготовлением растворов, вещества высушивались в стеклянных бюксах, под давлением 0.1 торр при комнатной температуре.
Водные бинарные смеси различной концентрации готовились весовым методом с помощью электронных весов (точность измерения $ \pm $0.0001 г). Для приготовления растворов использовалась бидистилированная вода. Чистота воды контролировалась измерением удельной электропроводности, значение которой не превышало 1.0 мкСм/см при 20°С.
Для измерения удельной электропроводности $\sigma $ растворов использовался кондуктометр “Hanna HI2300” (Hanna Instruments, USA) с четырехэлектродным погружным датчиком HI 76310. Абсолютная погрешность измерений $\sigma $ составляла $ \pm 0.01$ мкСм/см. Термостатирование ячейки кондуктометра в диапазоне от 0 до 80°С осуществлялось жидкостным термостатом с точностью не хуже 0.1°С.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
На рис. 1 представлены концентрационные зависимости электропроводности водных растворов различных спиртов. Двойной логарифмический масштаб на рис. 1 выбран для удобства представления полученных зависимостей $\sigma \left( с \right),$ где концентрация $с = {{{{N}_{{{\text{Alc}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{Alc}}}}}} {{{N}_{{{\text{aq}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{aq}}}}}}}$ – это мольное отношение компонентов раствора: ${{N}_{{{\text{Alc}}}}}$ – количество молей спирта, ${{N}_{{{\text{aq}}}}}$ – количество молей воды. Выбор в качестве концентрации $c$ величины мольного отношения компонентов раствора обусловлен тем, что такая концентрационная шкала позволяет выявить особенности, обусловленные гидратацией компонентов раствора [5, 34, 35].
Рис. 1.
Концентрационные зависимости удельной электропроводности водных растворов (а) двухатомных спиртов (этиленгликолей), (б) глицерина и сорбита, (в) ацетона и (г) этанола при температуре 25°С. На рисунках показаны значения максимума электропроводности ${{\sigma }_{{\max }}}$ и соответствующие им концентрации ${{\left( {{{{{N}_{{{\text{Alc}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{Alc}}}}}} {{{N}_{{{\text{aq}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{aq}}}}}}}} \right)}_{{\max }}}.$ Логарифмический масштаб и сплошные линии показаны для удобства представления.
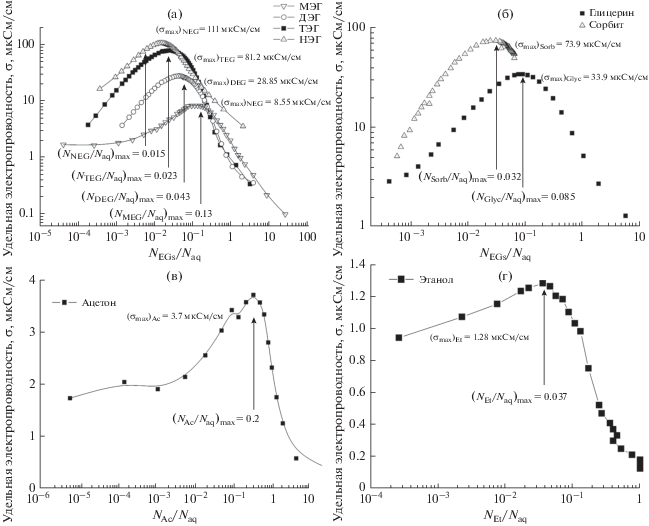
Важной особенностью представленных на рис. 1 зависимостей является наличие максимума проводимости ${{\sigma }_{{\max }}},$ величина которого существенно превышает как значение проводимости чистой воды, так и собственную проводимость растворенной компоненты. Наличие максимума на зависимостях $\sigma \left( c \right)$ можно объяснить, если предположить возможность процесса, порождающего мобильные носители заряда при взаимодействии молекул растворителя с гидратационными центрами молекул растворенной компоненты. Очевидно, что роль таких центров могут играть гидроксильные группы молекул растворенной компоненты. Однако если принимать во внимание только диссоциацию гидроксильных групп, то невозможно объяснить рост значения максимума проводимости при увеличении молекулярной массы в ряду гликолей (рис. 1а) и очень близкие значения максимума электропроводности ТЭГ (${{\left( {{{\sigma }_{{\max }}}} \right)}_{{{\text{TEG}}}}} = 81.2$ мкСм/см), обладающего двумя гидроксильными группами, и сорбита (${{\left( {{{\sigma }_{{\max }}}} \right)}_{{{\text{Sorb}}}}} = 73.9$ мкСм/см) с шестью гидроксильными группами. Поэтому можно предположить, что в качестве донорно-активных гидратационных центров следует рассматривать не только гидроксильные группы, но и атомы кислорода в молекулах гликолей.
Последнее утверждение иллюстрирует рис. 2, на котором представлена зависимость величин максимума электропроводности ${{\sigma }_{{\max }}}$ от числа ${{n}_{{\text{g}}}}$ гидратационных центров в молекулах растворенной компоненты.
Рис. 2.
Зависимость величин максимума электропроводности ${{\sigma }_{{\max }}}$ от числа ${{n}_{{\text{g}}}}$ гидратационных центров молекул: 1 – МЭГ, 2 – ДЭГ, 3 – глицерин, 4 – ТЭГ, 5 – сорбит; 6 – НЭГ, 7 – этанол.

Представленные на рис. 2 значения ${{\sigma }_{{\max }}}$ хорошо описываются линейной зависимостью, что подтверждает предположение о роли атомов кислорода как гидратационных центров и об их участии в процессе переноса заряда. Тогда, полагая, что взаимодействие молекул воды с гидратационными центрами является причиной возникновения мобильных носителей заряда, можно утверждать, что количество таких носителей будет однозначно определяться молярной концентрацией, нормированной на число гидратационных центров, т.е. ${{n}_{{\text{g}}}}\frac{{{{N}_{{{\text{Alc}}}}}}}{{{{N}_{{{\text{aq}}}}}}}.$ Рисунок 3 представляет зависимость нормированной электропроводности $\frac{{\sigma \left( n \right)}}{{{{\sigma }_{{\max }}}}}$ от нормированной концентрации ${{n}_{{\text{g}}}}\frac{{{{N}_{{{\text{Alc}}}}}}}{{{{N}_{{{\text{aq}}}}}}}.$
Рис. 3.
Нормированные концентрационные зависимости $\sigma (n){\text{/}}{{\sigma }_{{\max }}}$ удельной электропроводности водных растворов этиленгликолей, глицерина и сорбита как функция нормированной концентрации ${{n}_{{\text{g}}}}{{N}_{{{\text{Alc}}}}}{\text{/}}{{N}_{{{\text{aq}}}}}.$
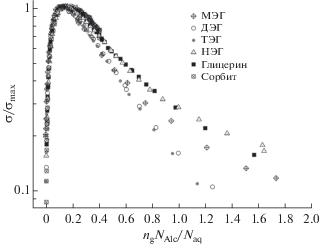
Таким образом, учет в качестве активных гидратационных центров как гидроксильных групп, так и атомов кислорода, приводит к единообразию концентрационные зависимости проводимости исследуемых растворов. Некоторое расхождение зависимостей ${{\sigma (n)} \mathord{\left/ {\vphantom {{\sigma (n)} {{{\sigma }_{{\max }}}}}} \right. \kern-0em} {{{\sigma }_{{\max }}}}}$ в области концентрированных растворов может определяться специфическими особенностями структуры концентрированных растворов.
Предположение о том, что атомы кислорода молекул растворенной компоненты в водных растворах проявляют себя как донорно-активные центры, не является однозначным и требует дополнительного подтверждения. Однако в отношении проводимости растворов ряда этиленгликолей, отличающихся количеством атомов кислорода в молекулярной цепи, это предположение является вполне логичным. Экспериментальным подтверждением этого предположения может являться наличие электрической проводимости водных растворов ацетона CH3–CO–CH3, имеющего атом кислорода как единственный гидрофильный центр гидратации.
Электропроводность системы ацетон–вода
На рис. 1в представлена концентрационная зависимость электропроводности водных растворов ацетона как функция мольного отношения ${{{{N}_{{{\text{Ac}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{Ac}}}}}} {{{N}_{{{\text{aq}}}}},}}} \right. \kern-0em} {{{N}_{{{\text{aq}}}}},}}$ где ${{N}_{{{\text{Ac}}}}}$ – количество молей ацетона в растворе. В зависимости от содержания ацетона в системе ее проводимость заметно меняется, достигая максимального значения ${{\sigma }_{{\max }}} = 3.7$ мкСм/см при значении концентрации ${{{{N}_{{{\text{Ac}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{Ac}}}}}} {{{N}_{{{\text{aq}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{aq}}}}}}} = 0.2,$ что соответствует примерно 5 молекул воды на одну молекулу ацетона.
Если предполагать, что молекулы воды в гидратных оболочках атомов кислорода ацетона являются донорами мобильных носителей заряда за счет диссоциации на ${{{\text{H}}}^{ + }}$ и ${\text{O}}{{{\text{H}}}^{ - }}$, то ацетон, в традиционных терминах описания процессов диссоциации, следует рассматривать как растворитель. В связи с этим в качестве концентрации, определяющей количество носителей заряда в растворе и проводимость раствора воды в ацетоне, следует использовать величину ${{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{Ac}}}}},}}} \right. \kern-0em} {{{N}_{{{\text{Ac}}}}},}}$ что представлено на рис. 4.
Рис. 4.
Концентрационная зависимость удельной электропроводности водного раствора ацетона как функция относительного содержания воды ${{N}_{{{\text{aq}}}}}{\text{/}}{{N}_{{{\text{Ac}}}}}.$
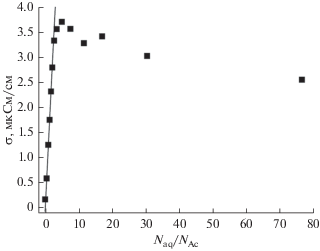
Как видно из рис. 4, в области концентраций $\left( {{{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{Ac}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{Ac}}}}}}}} \right) < 5$ наблюдается линейная зависимость, показанная прямой линией, что может служить подтверждением предположения о кислороде ацетона как о центре диссоциации.
Электропроводность системы этанол–вода
Поскольку в одноатомных спиртах единственными гидратационными центрами являются гидроксильные группы, то их роль в проводимости водных растворов спиртов можно выявить на примере водных растворов этанола (рис. 1г). Как и для рассмотренной выше системы ацетон–вода, на зависимости $\sigma \left( {{{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{Et}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{Et}}}}}}}} \right)$ растворов этанола, представленной на рис. 5, при концентрации ${{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{Et}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{Et}}}}}}} < 10$ наблюдается линейная зависимость, что по аналогии с предыдущим предположением о роли атомов кислорода позволяет предполагать диссоциацию молекул воды при взаимодействии с гидроксильными группами этанола.
Рис. 5.
Концентрационная зависимость удельной электропроводности водного раствора этанола как функция относительного содержания воды ${{N}_{{{\text{aq}}}}}{\text{/}}{{N}_{{{\text{Et}}}}}.$
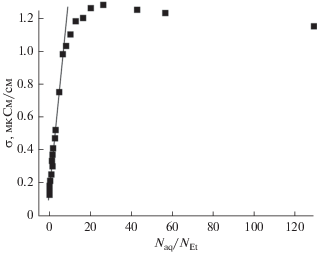
Однако необходимо отметить, что значение максимума электропроводности смеси вода–ацетон практически в три раза превосходит максимум электропроводности раствора этанола. Такое различие проводимости, обусловленное атомами кислорода и гидроксильными группами в качестве гидратационных центров, позволяет на качественном уровне объяснить отмеченное ранее практическое равенство максимумов проводимости ТЭГ и сорбита, поскольку в молекуле ТЭГ кроме двух концевых гидроксильных групп имеются три более активных атома кислорода. Это утверждение не является бесспорным, поскольку протонная проводимость в водных растворах этанола достаточно сложный процесс, сопровождающийся обменом протонами гидроксильных групп и молекул воды [5] и структурными изменениями раствора в зависимости от концентрации [35].
АНАЛИЗ РЕЗУЛЬТАТОВ
Исходя из существующих представлений об электропроводности растворов электролитов, удельная проводимость $\sigma \left( {c,T} \right)$ растворов в случае диссоциации электролитов на анионы и катионы с одинаковой величиной заряда $\left| q \right|$ обычно определяется выражениями вида
и Здесь $c = {\nu \mathord{\left/ {\vphantom {\nu V}} \right. \kern-0em} V}$ – концентрация растворенной компоненты раствора (М); $\left| {zF} \right|$ – величина заряда моля ионов, $F$ – число Фарадея; ${{u}^{ + }},$ ${{u}^{ - }}$ и ${{D}^{ + }}$ и ${{D}^{ - }}$ параметры подвижности носителей зарядов, которые связаны соотношением ${{D}^{ \pm }} = RT{{u}^{ \pm }}.$ Эти уравнения связывают подвижность ионов ${{u}^{ \pm }}$ в электрическом поле и их трансляционную подвижность, характеризующуюся коэффициентами самодиффузии ${{D}^{ \pm }}$ носителей заряда.Простота физического смысла этих выражений является следствием использования газокинетических представлений, лежащих в их основе. В частности, величина $ac$ определяет число носителей зарядов в единице объема пространства между электродами кондуктометрической ячейки, подвижность ${{u}^{ \pm }}$ имеет смысл скорости движения, усредненной для моля носителей заряда в единичном градиенте потенциала электрического поля. Наделение электропроводящего пространства ячейки некими свойствами и придание самим носителям заряда специфических свойств приводят к усложнению выражений для удельной электропроводности, которые приобретают различный вид в зависимости от моделей рассматриваемой системы. Однако величину удельной проводимости всегда можно представить как произведение двух функций
где $f(c,T)$ имеет смысл функции, определяющей количество носителей заряда в растворе, а $\varphi (u,T)$ определяет их подвижность при наличии градиента электрического потенциала.В рамках таких представлений для обоснованной интерпретации концентрационных и температурных зависимостей $\sigma (c,T)$ необходима методика разделения вкладов этих функций. Для определения вкладов $f(c,T)$ и $\varphi (u,T)$ в концентрационные зависимости $\sigma (c,T)$ можно использовать нормировку $\sigma (c,T)$ на известную (или предполагаемую) функцию $f(c,T)$ или $\varphi (u,T).$
Традиционно для растворов электролитов применяется нормировка на функцию $f(c,T),$ которая для разбавленных растворов полагается как $f(c,T) = \frac{\nu }{V}.$ Такая нормировка удельной проводимости приводит к эквивалентной (молярной) проводимости $\lambda (c,T) = \frac{{\sigma (c,T)}}{{f\left( {c,T} \right)}} = \frac{V}{\nu }\sigma (c,T),$ которая позволяет определить подвижности носителей заряда. Однако, как уже отмечалось, величина $\nu {\text{/}}V,$ как мера числа носителей заряда, имеет очевидный смысл только для растворов сильных электролитов с единичной степенью диссоциации a.
Если предполагать, что для растворов неэлектролитов удельная проводимость пропорциональна мольному отношению компонент системы, что мы наблюдаем на примере водных растворов ацетона и этанола (рис. 4 и 5), то нормировка концентрационных зависимостей электропроводности на функцию, пропорциональную мольному отношению, позволит выявить компоненту, являющуюся донором носителей заряда, и сделать предположения об их подвижности.
На рис. 6а представлена концентрационная зависимость удельной электропроводности $\sigma \left( {{{N}_{{{\text{aq}}}}}{\text{/}}{{N}_{{{\text{Ac}}}}}} \right)$ системы ацетон–вода, нормированной на величину
Рис. 6.
Концентрационная зависимость нормированной электропроводности $\sigma {\text{*}}$ от отношения $\frac{{{{N}_{{{\text{aq}}}}}}}{{{{N}_{{{\text{Ac}}}}}}}$ (а) и $\frac{{{{N}_{{{\text{Ac}}}}}}}{{{{N}_{{{\text{aq}}}}}}}$ (б) системы вода–ацетон.

Как видно из рис. 6а, в области с малым содержанием воды наблюдается независимость величины $\sigma {\text{*}}$ от состава раствора (горизонтальная линия $\sigma * = 1.34$). Эта закономерность наблюдается в области концентраций ${{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{Ac}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{Ac}}}}}}} < 2,$ что соответствует числу молекул воды в первой гидратной оболочке атомов кислорода [36]. При концентрациях раствора ${{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{Ac}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{Ac}}}}}}} > 6$ концентрационная зависимость $\sigma {\text{*}}$ хорошо аппроксимируется обратно пропорциональной зависимостью (на рис. 6а показано пунктирной линией), что является вполне ожидаемым, поскольку такое поведение проводимости соответствует уменьшению числа гидратационных центров в системе.
Наравне с концентрационной зависимостью электропроводности часто анализируются ее зависимость от разбавления, т.е. от обратной концентрации, что в нашем рассмотрении соответствует зависимости $\sigma {\text{*}}$ от величины ${{N}_{{{\text{Ac}}}}}{\text{/}}{{N}_{{{\text{aq}}}}},$ представленной на рис. 6б. Такое представление однозначно определяет предельную концентрацию воды, которая ограничивает область прямой пропорциональности $\sigma {\text{*}}\sim \frac{{{{N}_{{{\text{aq}}}}}}}{{{{N}_{{{\text{Ac}}}}}}},$ равную 2 молекулам воды на молекулу ацетона (показано вертикальными стрелками). В области больших содержаний воды ${{N}_{{{\text{Ac}}}}}{\text{/}}{{N}_{{{\text{aq}}}}} < 0.3$ зависимость электропроводности $\sigma {\text{*}}$ аппроксимируется линейной зависимостью $\sigma {\text{*}} = 3.6\frac{{{{N}_{{{\text{Ac}}}}}}}{{{{N}_{{{\text{aq}}}}}}}$ (пунктирная линия на рис. 6а, 6б). Величина $\sigma _{{\max }}^{*},$ соответствующая максимальному значению ${{\sigma }_{{\max }}}$ проводимости раствора, показанная горизонтальной стрелкой, соответствует, как уже отмечалось, концентрации 5–6 молекул воды на молекулу ацетона.
Таким образом, можно утверждать, что атомы кислорода молекул ацетона являются активными гидратационными центрами, активирующими диссоциацию молекул воды в их первых гидратных оболочках. При малых содержаниях воды ${{N}_{{{\text{aq}}}}}{\text{/}}{{N}_{{{\text{Ac}}}}} \leqslant 2$ в системе ацетон–вода подвижность носителей заряда постоянна, при большом содержании воды ${{N}_{{{\text{aq}}}}}{\text{/}}{{N}_{{{\text{Ac}}}}} \geqslant 6$ проводимость уменьшается как следствие относительного уменьшения числа активных гидратационных центров до значения проводимости чистой воды.
Аналогичный анализ можно провести для растворов вода–этанол. На рис. 7а, 7б представлена концентрационная зависимость величины $\sigma {\text{*}}{\text{.}}$ Полученные зависимости $\sigma {\text{*}}$ для водно-этанольных растворов аналогичны зависимостям, полученным для растворов вода–ацетон, и отличаются только численными параметрами. Так граничная концентрация пропорциональности $\sigma {\text{*}}\sim \frac{{{{N}_{{{\text{aq}}}}}}}{{{{N}_{{{\text{Et}}}}}}}$ в водно-этанольном растворе, отмеченная на рис. 7а стрелкой, соответствует 7–8 молекулам воды на молекулу этанола. Это количество молекул воды вполне согласуется с оценкой в 10–12 молекул воды в гидратной оболочке молекулы этанола [35].
Рис. 7.
Концентрационная зависимость величины $\sigma {\text{*}}$ от ${{N}_{{{\text{aq}}}}}{\text{/}}{{N}_{{{\text{Et}}}}}$ (а) и от ${{{{N}_{{{\text{Et}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{Et}}}}}} {{{N}_{{{\text{aq}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{aq}}}}}}}$ (б) водно-этанольных растворов.

Проведенный анализ позволяет сделать вывод, что носителями заряда в водных растворах неэлектролитов являются продукты диссоциации молекул воды гидратных оболочек гидратационных центров молекул растворенной компоненты.
Проводимость растворов многоатомных спиртов и гликолей
В качестве примера, характерного для взаимодействия молекул воды с гидроксильными группами многоатомных спиртов, наиболее наглядным, на наш взгляд, является рассмотрение проводимости в водных растворах глицерина. На рис. 8 представлены концентрационные зависимости нормированной электропроводности $\sigma {\text{*}} = \frac{{{{N}_{{{\text{Gl}}}}}}}{{{{N}_{{{\text{aq}}}}}}}\sigma \left( {\frac{{{{N}_{{{\text{aq}}}}}}}{{{{N}_{{{\text{Gl}}}}}}}} \right)$ растворов глицерина при нескольких температурах.
Рис. 8.
Зависимость проводимости $\sigma {\text{*}}$ системы вода–глицерин при температурах 25, 33 и 40°С.
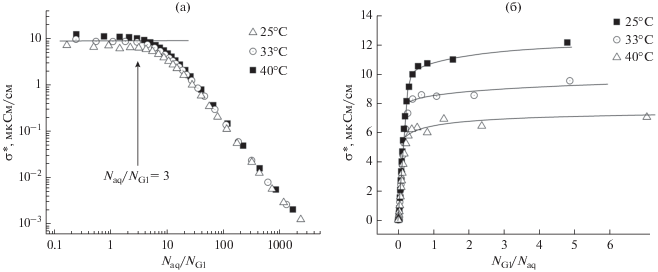
Концентрационные зависимости величины $\sigma {\text{*}}$ в водных растворах глицерина аналогичны зависимостям $\sigma {\text{*}}$ для растворов этанола. Однако, в отличие от растворов этанола, граничная концентрация равна 3, что соответствует известному числу молекул воды в первой гидратной оболочке гидроксильной группы, равному единице [36].
Более сложным оказывается поведение зависимости $\sigma {\text{*}}$ от концентрации для раствора триэтиленгликоля (ТЭГ), имеющего в качестве гидратационных центров две концевые гидроксильные группы и три атома кислорода в скелетной цепи молекулы. На рис. 9 представлена концентрационная зависимость $\sigma {\text{*}}$ водного раствора ТЭГ.
Рис. 9.
Зависимость величины $\sigma {\text{*}}$ от концентрации ${{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{TEG}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{TEG}}}}}}}$ в водном растворе триэтиленгликоля при температуре 25°С.
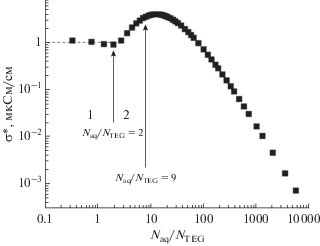
Полученную концентрационную зависимость $\sigma {\text{*}}$ для раствора ТЭГ можно разделить на два характерных участка. Первый – это концентрационный интервал с концентрацией ${{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{TEG}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{TEG}}}}}}} < 2.$ Примечательно, что величина граничной концентрации этой концентрационной области соответствует числу молекул воды в первых гидратных оболочках двух концевых гидроксилов молекулы ТЭГ. На втором концентрационном участке в интервале концентраций $2 < {{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{TEG}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{TEG}}}}}}} < 9$ величина $\sigma {\text{*}}$ довольно резко возрастает от 1 до 4. Примечательно, что граничная концентрация этого интервала, равная 8, вполне соответствует числу молекул воды в гидратных оболочках двух гидроксилов и трех атомов кислорода молекулы ТЭГ (2 и 6 молекул воды, соответственно). Если принять, что проводимость водных растворов, обусловленная взаимодействием молекул воды с атомами кислорода (рис. 6), заметно больше проводимости, обусловленной взаимодействием молекул воды с гидроксильными группами молекул растворенной компоненты (рис. 7), то возрастание величины $\sigma {\text{*}}$ в диапазоне концентраций $2 < {{{{N}_{{{\text{aq}}}}}} \mathord{\left/ {\vphantom {{{{N}_{{{\text{aq}}}}}} {{{N}_{{{\text{TEG}}}}}}}} \right. \kern-0em} {{{N}_{{{\text{TEG}}}}}}} < 9$ логично объяснить включением в процесс проводимости дополнительно к молекулам воды гидратных оболочек гидроксильных групп, молекул воды гидратных оболочек атомов кислорода. Кроме этого можно полагать и возрастание подвижности носителей заряда при формировании в этом концентрационном интервале полной гидратной оболочки молекулы ТЭГ.
ЗАКЛЮЧЕНИЕ
В водно-молекулярных системах атомы кислорода и гидроксильные группы, являющиеся гидратационными центрами, инициируют диссоциацию молекул воды. Этот механизм возникновения носителей заряда в водных растворах объясняет как однотипность концентрационных зависимостей проводимости молекулярных водных растворов, так и зависимость величины максимальной проводимости ${{\sigma }_{{\max }}}$ от числа гидратационных центров. С другой стороны, приведенные экспериментальные результаты и их интерпретация не позволяют однозначно полагать как о самих носителях заряда, обуславливающих проводимость рассмотренных водных растворов, так и о механизме их переноса под действием приложенной разницы потенциала.
Список литературы
Yaroslavtsev, A.B., Proton conductivity of inorganic hydrates, Rus. Chem. Rev., 1994, vol. 63, p. 429.
Tarasevich, M.R. and Korchagin, O.V., Rapid diagnostics of characteristics and stability of fuel cells with proton-conducting electrolyte, Russ. J. Electrochem., 2014, vol. 50, p. 737.
Hu, N., Wu, D., Cross, K.J., and Schaefer, D.W., Structural Basis of the 1H-Nuclear Magnetic Resonance Spectra of Ethanol–Water Solutions Based on Multivariate Curve Resolution Analysis of Mid-Infrared Spectra, Appl. Spectrosc., 2010, vol. 64, p. 337.
Volkov, V.I., Sanginov, E.A., Pavlov, A.A., Dobrovol’skii, Yu.A., Rebrov, A.I., Anokhin, E.M., Shestakov, S.L., and Maksimychev, A.V., Mechanism of proton conductivity in polyvinyl alcohol-phenolsulfonic acid membranes from 1H and 13C NMR data, Russ. J. Electrochem., 2009, vol. 45, p. 374.
Sevryugin, V.A., Skirda, V.D., and Skirda, M.V., Exchange processes in aqueous solutions of saccharides, Russ. J. Phys. Chem. A, 1998, vol. 72, p. 766.
Billard, R., Cosson, J., Noveiri, S.B., and Pourkazemi, M., Cryopreservation and short-term storage of sturgeon sperm, Aquaculture, 2009, vol. 236, p. 1.
Boryshpolets, S., Dzyuba, B., Rodina, M., Alavi, S.M.H., Gela, D., and Linhart, O., Cryopreservation of sterlet (Acipenser ruthenus) spermatozoa using different cryoprotectants, J. Appl. Ichthyol., 2011, vol. 27, p. 1147.
Seki, S., Kouya, T., Tsuchiya, R., Valdez Jr., D.M., Jin, B., Koshimoto, C., Kasai, M., and Edashige, K., Cryobiological properties of immature zebrafish oocytes assessed by their ability to be fertilized and develop into hatching embryos, Cryobiology, 2011, vol. 62, p. 8.
Zachariassen, K.E. and Kristiansen, E., Ice Nucleation and Antinucleation in Nature, Cryobiology, 2000, vol. 41, p. 257
Oswal, S.L. and Desai, H.S., Studies of viscosity and excess molar volume of binary mixtures: 2. Butylamine+1-alkanol mixtures at 303.15 and 313.15 K, Fluid Phase Equilib., 1999, vol. 161, p. 191.
Chen, C., Li, W., Song, Y., and Yang, J., Molecular dynamics simulation studies of cryoprotective agent solutions: the relation between melting temperature and the ratio of hydrogen bonding acceptor to donor number, Mol. Phys., 2009, vol. 107, p. 673.
Murthy, S.S.N., Experimental Study of the Dynamics of Water and the Phase behavior of the Supercooled Aqueous Solutions of Propylene Glycol, Glycerol, Poly(ethylene glycol)s, and Poly(vinylpyrrolidone), J. Phys. Chem. B, 2000, vol. 104, p. 6955.
Artemkina, Y.M., Shcherbakov, V.V., and Korotkova, E.N., High-frequency conductivity of mixtures of water with methanol, ethanol, and propanol. Russ. J. Electrochem., 2015, vol. 51, p. 180.
Petterson, K.A., Stein, R.S., Drake, M.D., and Roberts, J.D., An NMR investigation of the importance of intramolecular hydrogen bonding in determining the conformational equilibrium of ethylene glycol in solution. Magn. Reson. Chem., 2005, vol. 43, p. 225.
Price, W.S., Ide, H., and Arata, Y., Solution Dynamics in Aqueous Monohydric Alcohol Systems, J. Phys. Chem. A, 2003, vol. 107, p. 4784.
Oldenhof, H., Friedel, K., Sieme, H., Glasmacher B., and Wolkers, W.F., Membrane permeability parameters for freezing of stallion sperm as determined by Fourier transform infrared spectroscopy, Cryobiology, 2010, vol. 61, p. 115.
Ghosh, B.D. and Ritchie, J.E., Effect of Polymer Structure on Ion Transport in an Anhydrous Proton Conducting Electrolyte, Chem. Mater., 2010, vol. 22, p. 1483.
Sun, C. and Ritchie, J.E., Star-Shaped MePEGn Polymers as H+ Conducting Electrolytes, J. Phys. Chem. B, 2011, vol. 115, p. 8381.
Chang, H.Y. and Lin, C.W., Proton Conducting Membranes Based on PEG/SiO2 Nanocomposites for Direct Methanol Fuel Cells, J. Membr. Sci., 2003, vol. 218, p. 295.
Harris, J.M. and Chess, R.B., Effect of Pegylation on Pharmaceuticals, Nat. Rev. Drug Discov., 2003, vol. 2, p. 214.
Kirillov, A.D., Kakurkin, N.P., and Shcherbakov, V.V., Electroconductivity of the calcium oxide-ethylene glycol–water system, Russ. J. Electrochem., 2007, vol. 43, p. 114.
Tsierkezos, N.G. and Molinou, I.E., Transference Numbers, Conductance and Viscosity Studies of Copper Sulfate in Ethylene Glycol–Water Mixtures at 20°C, Z. Phys. Chem., 2006, vol. 216, p. 961.
Fosbol, P.L., Thomsen, K., and Stenby, E.H., Modeling of the Mixed Solvent Electrolyte System CO2−Na2CO3−NaHCO3−Monoethylene Glycol–Water, Ind. Eng. Chem. Res., 2009, vol. 48, p. 4565.
Capuano, F., Vergara, A., Paduano, L., Annunziata, O., and Sartorio, R., Electrostatic and Excluded Volume Effects on the Transport of Electrolytes in Poly(Ethylene Glycol)–Water Mixed Solvents, J. Phys. Chem. B, 2003, vol. 107, 12363.
Chung, J.K. and Consta, S., Release Mechanisms of Poly(Ethylene Glycol) Macroions from Aqueous Charged Nanodroplets. J. Phys. Chem. B, 2012, vol. 116, p. 5777.
Ennari, J., Neelov, I., and Sunholm, F., Modelling of Gas Transport Properties of Polymer Electrolytes Containing Various Amounts of Water, Polymer, 2004, vol. 45, 4171.
Sesta, B. and Berardelli, M.L., Alkali-Nitrate Interactions in Water–Ethylene–Glycol Mixtures. Conductometric Measurements at 25°C, Electrochim. Acta, 1972, vol. 17, p. 915.
Nowak-Woźny, D. and Maczka, T., The DC conduction mechanism of Ethylene Glycol Water solutions, J. Electr. Eng., 2007, vol. 58, p. 55.
Erdey-Gruz, T. Transport phenomena in aqueous solutions; Wiley, New York, 1974. 512 p.
Измайлов Н.А. Электрохимия растворов. М.: Химия, 1976. 488 с. (Izmailov, N.A., Electrochemistry of solutions (in Russian), Moscow, Khimiya, 1976. 488 p.)
Севрюгин, В.А., Лоскутов, В.В., Косова, Г.Н. Особенности электропроводности водных растворов глицерина. Известия УНЦ РАН. 2014. № 3. С. 40.
Davletbaeva, I.M., Emelina, O.Yu., Vorotyntsev, I.V., Davletbaev, R.S., Grebennikova, E.S., Petukhov, A.N., Akhmetshina, A.I., Sazanova, T.S., and Loskutov, V.V., Synthesis and properties of novel polyurethanes based on amino ethers of boric acid for gas separation membranes. RSC Adv., 2015, vol. 5, p. 65674.
Самойлов, О.Я. Структура водных растворов электролитов и гидратация ионов. М.: Из-во АН СССР. 1957. 182 с. (Samoilov, O.Ya., Structure of Aqueous Electrolyte Solutions and the Hydration of Ions, Consultants Bureau, New York, 1965, 185 p.).
Sevriugin, V.A., Loskutov, V.V., and Zhuravlyova, N.E., Concentration Dependences of Solvent Self-Diffusion Coefficients in Solutions and Heterogeneous Systems, Appl. Magn. Reson., 2005, vol. 29, p. 523.
Sevryugin, V.A., Azancheev, N.M., and Kosova, G.N., Translational Mobility of Components and Structure of Water–Ethanol Solutions, Appl. Magn. Reson., 2018, vol. 49, p. 357.
Ohtaki, H. and Radnai, T., Structure and Dynamics of Hydrated Ions, Chem. Rev., 1993, vol. 93, p. 1157.
Дополнительные материалы отсутствуют.


