Электрохимия, 2019, T. 55, № 2, стр. 245-249
Влияние растворенного кислорода на скорость коррозии нержавеющей стали в растворе хлорида натрия
К. В. Рыбалка a, *, Л. А. Бекетаева a, А. Д. Давыдов a
a Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
11907 Москва, Ленинский просп., 31, к. 4, Россия
* E-mail: mamaison2000@yandex.ru
Поступила в редакцию 13.04.2018
После доработки 28.06.2018
Принята к публикации 25.07.2018
Аннотация
Методом тафелевской экстраполяции получены значения коррозионного тока нержавеющей стали 17-4РН в растворе NaCl при разных содержаниях растворенного кислорода. Показано, что зависимости коррозионного тока от концентрации растворенного кислорода принципиально различаются на пассивном и катодно активированном образце, но близки после предварительной катодной активации и после анодной активации хлорид-ионами.
ВВЕДЕНИЕ
Нержавеющая сталь 17-4 РН – одна из сталей, применяемых для изготовления турбинных лопаток и других целей [1], имеет следующий химический состав (мас. %)
| C | Nb + Ta | Cr | Cu | Mn | Ni | P | S | Si | Fe |
|---|---|---|---|---|---|---|---|---|---|
| Не более 0.07 | 0.15–0.45 | 15.50– 17.50 | 3.00–5.50 | Не более 1.00 | 3.00–5.00 | Не более 0.04 | Не более 0.03 | Не более 1.00 | Остальное |
В литературе имеется ряд статей, посвященных некоторым вопросам коррозии этой стали, например, влиянию микроструктуры на стойкость против питтинговой коррозии [2], влиянию скорости потока морской воды на скорость общей коррозии [3]. Наши предварительные исследования привели к заключению, что во многих случаях эта сталь весьма устойчива к питтинговой коррозии и даже в тех случаях, когда локальная коррозия может возникнуть, ей предшествует период общей коррозии. В настоящей работе проведены электрохимические исследования, результаты которых позволили сделать оценки величин коррозионных токов в 0.1 М растворе NaCl с различным содержанием растворенного кислорода. Эти результаты относятся к условиям общей коррозии стали.
Работа посвящена именно влиянию содержания растворенного кислорода на коррозию стали, так как работ в этом направлении значительно меньше, чем работ по влиянию других условий на коррозию различных материалов.
Можно выделить два основных направления влияния растворенного кислорода на коррозионный процесс. В одних случаях, при катодном контроле, скорость коррозии лимитируется скоростью реакции катодного восстановления растворенного кислорода, как правило, в диффузионном режиме. Кислород потребляется в катодной реакции как деполяризующий агент. В этом случае увеличение концентрации растворенного кислорода должно увеличивать коррозионный ток. Такое влияние растворенного кислорода хорошо известно [4, 5].
В других случаях кислород может влиять на состав коррозионных продуктов, на состав и свойства поверхностных пленок, часто оксидных, и снижать скорость коррозии.
Насыщение воды кислородом в системах горячего водоснабжения снижает скорость коррозии углеродистой стали, из которой изготовлены трубы. Растворенный кислород при достаточном его содержании в воде стабилизирует защитную оксидную пленку на стали, замедляет коррозию [6, 7].
Скорость коррозии малоуглеродистой стали в 0.1 M NaHCO3 увеличивается при увеличении концентрации растворенного кислорода [8].
Влияние растворенного кислорода на коррозионное поведение трубной стали API-X80 в растворе, моделирующем почвенную среду (слабокислый водный раствор, содержащий ряд солей в небольших концентрациях, в первую очередь NaCl 0.0468 г/л, pH 4.5) исследовано в работе [9]. Найдено, что скорость коррозии контролируется содержанием растворенного кислорода при его концентрации в растворе 0.85 м. д.; присутствие кислорода влияет на катодный процесс и при снижении концентрации кислорода скорость коррозии уменьшается. При содержании кислорода больше 1.90 м. д. скорость коррозии контролировалась анодным процессом. Наличие растворенного кислорода влияло также на состав продуктов коррозии.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
Исследуемые образцы имели форму цилиндра диаметром 2 мм и высотой 15 мм. Перед опытом поверхность образцов шлифовалась стеклянным порошком и тщательно промывалась дистиллированной водой. В процессе экспериментов растворы в электрохимической ячейке перемешивались магнитной мешалкой. Эксперименты проводились при нескольких заданных парциальных давления кислорода от 1 до 100% (насыщенный раствор). С этой целью через ячейку пропускали смесь гелия и кислорода в заданном соотношении. Для этого использовался смеситель газов – стеклянный сосуд, заполненный большим количеством стеклянных шариков. Кислород и гелий подавались в смеситель через специальные капиллярные трубки одинакового диаметра с определенной скоростью. Для каждой трубки скорость подачи газа определялась ее длиной и разницей давления на ее концах. Задавая разницу давлений (она измерялась двумя U-образными жидкостными манометрами) и при необходимости длину капиллярной трубки, можно обеспечить необходимое соотношение скоростей подачи кислорода и гелия в электрохимическую ячейку и, следовательно, соотношения парциальных давлений газов в ячейке, т.е. нужную концентрацию растворенного кислорода.
При проведении экспериментов применялся 0.1 М раствор NaCl без буферных добавок. Температура раствора поддерживалась равной 25°С в электрохимической ячейке и в сосуде для электрода сравнения.
В одной, главной, серии опытов катодные и анодные потенциодинамические кривые при скорости развертки потенциала 0.2 мВ/с снимали после предварительной выдержки исследуемых образцов в том же растворе в течение 4 ч для стабилизации состояния поверхности образцов. Катодные кривые снимали от установившегося за 4 ч значения потенциала разомкнутой цепи до ‒0.6 В. Анодные кривые снимали от того же потенциала разомкнутой цепи до потенциала немного меньшего потенциала питтингообразования, чтобы ограничиться условиями общей коррозии.
В другой, дополнительной серии опытов, потенциодинамические кривые снимали после выдержки образцов при потенциале –0.66 В в течение 1 ч. Кривые снимали при смещении потенциала от –0.66 В в сторону более положительных значений.
Коррозионные токи и потенциалы определялись по координатам точки пересечения тафелевских участков катодных и анодных поляризационных кривых.
Анодные кривые в ряде случаев не имеют прямолинейных участков в тафелевских координатах. В этих случаях плотность коррозионного тока определялась экстраполяцией катодного участка до потенциала коррозии, как это рекомендуется в работах [10–12] и ряде других.
Потенциалы были измерены относительно насыщенного хлорид-серебряного электрода сравнения. В тексте и на рисунках значения потенциалов даны относительно стандартного водородного электрода.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ И ИХ ОБСУЖДЕНИЕ
Влияние концентрации растворенного кислорода на коррозионный потенциал Eкор и коррозионный ток iкор стали 17-4PH показано на рис. 1 и 2.
Рис. 1.
Зависимости Eкор (а) и iкор (б) от концентрации растворенного кислорода в 0.1 М растворе NaCl, полученные методом тафелевской экстраполяции, после выдержки образца при потенциале разомкнутой цепи в течение 4 ч.

Рис. 2.
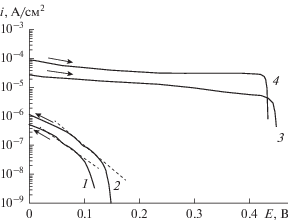
Катодные вольт-амперные кривые, полученные в 0.1 М растворе NaCl при содержании растворенного кислорода 20% (кривые 1 и 3) и 100% (кривые 2 и 4). Кривые 1 и 2 получены после предварительной выдержки электродов в течение 4 ч при потенциале разомкнутой цепи. Кривые 3 и 4 регистрировали после выдержки электродов в течение 1 ч при потенциале –0.66 В. Направление развертки потенциала при регистрации кривых показано стрелками.
Как следует из рис. 1а, при концентрации кислорода в растворе, не превышающей 20%, небольшое увеличение содержания кислорода в растворе приводит к существенному сдвигу коррозионного потенциала в сторону положительных значений. В этой же области концентраций коррозионный ток быстро уменьшается. При более высоких концентрациях растворенного кислорода и Eкор, и iкор почти не изменяются. Эти результаты свидетельствуют о решающей роли растворенного кислорода в анодной реакции, кислород способствует пассивации стали. Следует отметить также низкие скорости коррозии стали 17-4PH в растворе NaCl.
В специальной серии опытов потенциодинамические кривые снимали после предварительной катодной поляризации образцов при –0.66 В в течение 1 ч (рис. 2 и 3). Такой метод стабилизации начального состояния поверхности для получения хорошей воспроизводимости результатов применяется во многих работах. Результаты показали существенное отличие от полученных при предварительной выдержке образцов при потенциале разомкнутой цепи. Примеры приведены на рис. 2. После предварительной катодной поляризации скорость восстановления кислорода значительно выше, чем после выдержки электрода при потенциале разомкнутой цепи. Очевидно, что катодная обработка приводила к значительной активации поверхности за счет восстановления естественного оксида, образующегося на поверхности образца при взаимодействии с содержащей кислород средой.
Рис. 3.
Катодная и анодная поляризационные кривые, полученные в 0.1 M расттворе NaCl при концентрации кислорода 50% после предварительной катодной поляризации исследуемого образца при потенциале –0.66 В в течение 1 ч.

Полученные результаты показали, что катодная предобработка привела не только к изменению токов, но и к кардинальному изменению характера зависимости коррозионного тока от содержания растворенного кислорода в растворе.
На рис. 3 для примера приведены анодная и катодная поляризационные кривые, полученные после предварительной катодной поляризации исследуемого образца при потенциале –0.66 В в течение 1 ч при концентрации растворенного кислорода 50%.
На рис. 4 приведена (кривая 1) зависимость коррозионного тока от концентрации растворенного кислорода на катодно активированном электроде.
Рис. 4.
Зависимости коррозионного тока от содержания растворенного кислорода, полученные после предварительной катодной обработки в течение 1 ч при потенциале –0.66 В (1) и после анодной активации хлорид-ионами (2).

В отличие от образцов, покрытых естественной оксидной пленкой, для катодно активированной поверхности скорость коррозии повышается с увеличением концентрации кислорода (сравнение рис. 1б и 4).
Проведенные нами опыты на предварительно анодно активированной анионами Cl– поверхности стали 17-4РН (методика проведения таких опытов описана в [13]), дали близкие результаты по коррозионным токам к полученным после предварительной катодной обработки (кривая 2 на рис. 4).
Таким образом, результаты экспериментов на образцах, покрытых естественной оксидной пленкой, существенно отличаются от результатов, полученных на активированной поверхности. Причем, по крайней мере в рассматриваемом здесь случае, нет существенной разницы в том, каким образом проведена активация поверхности: катодным восстановлением или анодным удалением оксидной пленки под действием агрессивных по отношению к ней ионов Cl–.
Такой результат может представлять интерес для различных практически важных случаев. Например, в различных режимах эксплуатации паровой турбины среда имеет различное содержание кислорода, что может оказывать различное влияние кислорода на коррозионное поведение стальной конструкции в различные периоды эксплуатации.
При питтинговой коррозии сталей одна часть поверхности изделия находится в пассивном состоянии, а другая – в активированном. Влияние растворенного кислорода на активированную и запассивированную части поверхности различно.
ЗАКЛЮЧЕНИЕ
Приведенные результаты свидетельствуют о различном влиянии концентрации растворенного кислорода на скорость общей коррозии нержавеющей стали 17-4РН в растворе NaCl при различном состоянии повехности стали: выдержанной при потенциале разомкнутой цепи (состояние естественной пассивности), выдержанной при катодном потенциале (поверхность, активированная катодной обработкой) и выдержанной при потенциале, несколько превышающем потенциал питтингообразования (поверхность, анодно активированная анионами Cl–). На пассивной поверхности увеличение концентрации растворенного кислорода усиливает пассивность и снижает скорость коррозии. На активированной поверхности увеличение концентрации растворенного кислорода облегчает катодную реакцию и увеличивает скорость коррозии.
Полученные результаты свидетельствую о высокой стойкости нержавеющей стали 17-4РН против общей коррозии в растворе NaCl. Коррозионные токи имеют низкие значения (десятки нА/см2).
Список литературы
McCloskey, T.H., Dooley, R.B., and McNaughton, W.P., Turbine Steam Path Damage. Palo Alto, CA: EPRI, Inc. 1999.
Syrett, B.C., Viswanathan, R., Wing, S.S., and Wittig, J.E., Effect of microstructure on pitting and corrosion fatigue of 17-4 PH turbine blade steel in chloride environments, Corrosion, 1982, vol. 38 (5), p. 273.
Davis, J.A. and Gehring, G.A., Effect of Velocity on the Seawater Corrosion Behavior of High-Performance Ship Materials, Mater. Perform., 1975, vol. 14 (4), p. 32.
Скорчеллетти, В.В. Теоретические основы коррозии металлов. Л.: Химия, 1973. [Skortcheletti, V.V., Theoretical aspects of metals corrosion, L.: KHIMIYA, 1973].
Ангал, Р. Коррозия и защита от коррозии. Долгопрудный: ИНТЕЛЛЕКТ, 2013. [Angal, R.D., Principles and Prevention of Corrosion, Alpha Science International Ltd., Oxford U.K., 2010.]
Kim, H.T., Paik, C.H., Cho, W.I., Cho, B.W., Yun, K.S., Kim, Y.H., Ju, J.B., Kim, J.S., Kang, M.S., Ha, J.S., and Kim, K.Y., Effect of dissolved oxygen and hydrogen ion on corrosion rate and passivation of carbon steel boiler tube, J. Ind. & Eng. Chemistry, 1997, vol. 3, p. 51.
Kawai, N., Wada, K., Hirano, H., Naganuma, T., Sueyoshi, M., Nakui, H., Saito, I., and Asakura, S., Critical concentration of dissolved oxygen to form protective iron oxides under combined water treatment conditions, Corrog. Eng., Sci. and Techn., 2003, vol. 38, p. 286.
Xue, F., Wei, X., Dong, J., Nabuk Etim, I.-I., and Wang, C., Effect of residual dissolved oxygen on the corrosion behavior of low carbon steel in 0.1 M NaHCO3 solution, J. Mater. Sci. Technol., 2018, vol. 34, p. 1349.
Wang, S., Liu, D., Du, N., Zhao, Q., Liu, S., and Xiao, J., Relationship between dissolved oxygen and corrosion characterization of X80 steel in acidic soil simulated solution, Int. J. Electrochem. Sci., 2015, vol. 10, p. 4393.
Stansbury, E.E. and Buchanan, R.A., Fundamentals of the Electrochemical Corrosion, Materials Park, Ohio, ASM International, 2000, Ch. 6.
McCafferty, E., Introduction to Corrosion Science. N.Y., Springer, 2010, Ch. 7.
Mansfeld, F., Advances in Corrosion Science and Technology, vol. 6. Eds. Fontana G., Staehle R.W. N.Y., L., Plenum Press, 1976, Ch. 2
Давыдов, А.Д., Шалдаев, В.С., Энгельгардт, Г.Р. Закономерности процесса питтингообразования на стали 20Х13 в хлоридных растворах. Электрохимия. 2006. Т. 42. С. 142 [Davydov, A.D., Shaldaev, V.S., and Engel’gardt, G.R., Pitting on the 20 Kh13 steel in chloride solutions, 2006, Russ. J. Electrochem., vol. 42, p. 121.]
Дополнительные материалы отсутствуют.


