Электрохимия, 2019, T. 55, № 2, стр. 150-160
Применимость пленки альгинатa с иммобилизованными дрожжевыми клетками для использования в микробных топливных элементах
У. Мардиана a, b, c, *, Х. Инносент a, М. Кретин a, Бучари b, Г. Сетиянто b, Р. Нурпалах c, М. Кусмиати c
a Университет Монпелье 2
34293 Монпелье, Франция
b Бандунгский Технологический Институт
40132 Бандунг, Индонезия
c STIKEs Bakti Tunas Husada Tasikmalaya
46115 Tasikmalaya, Индонезия
* E-mail: mardiana.ramdan@gmail.com
Поступила в редакцию 13.07.2017
После доработки 01.10.2017
Принята к публикации 09.12.2017
Аннотация
Предложены новые подходы для модифицирования анода микробного топливного элемента. Описана иммобилизация дрожжевых клеток с использованием альгината в качестве электрогенного микроорганизма в микробном топливном элементе. Захват дрожжевых клеток внутри альгинатной матрицы производится путем осаждения пленки на поверхность электрода из углеткани; полученные аноды охарактеризованы методом хроноамперометрии. Дрожжевые клетки, захваченные в альгинатной пленке на углеткани, окисляют глюкозу и генерируют ток в результате как прямого, так и медиаторного переноса электронов от дрожжевых клеток к углеродному электроду. Полученный результат указывает на то, что иммобилизация дрожжевых клеток в микробном топливном элементе может быть перспективным способом производства электричества.
ВВЕДЕНИЕ
Микробный топливный элемент (МТЭ) можно рассматривать как новую биоэлектрохимическую систему, способную преобразовывать химическую энергию непосредственно в электрическую [1, 2]. Микроорганизмы в качестве биокатализаторов окисляют органические соединения и создают поток электронов (т.е., электрический ток). В настоящее время широко исследуются возможности улучшения эксплуатационных характеристик микробных топливных элементов [3–7]. Ранее Saccharomyces cerevisiae (род дрожжевых грибов) уже применяли в качестве биокатализатора в микробном топливном элементе [8‒10]. В настоящее время исследования сталкиваются с решением следующей проблемы: энергия, производимая дрожжевыми клетками, все еще слишком мала, главным образом из-за того, что прямой переход электронов на электрод микробного топливного элемента замедлен. Ранее было показано, что присутствие искусственно введенного медиатора облегчает перенос электронов на твердый электрод. В присутствии подходящего переносчика электронов (медиатора) можно реализовать перенос электрона от дрожжевых клеток к электроду [8–11]. Было показано [1], что с применением медиатора Saccharomyces cerevisiae и E. coli обеспечивают установление анодного потенциала до 100 мВ, чего не происходит в отсутствие медиатора. Искусственно введенный электронный медиатор позволяет генерировать электричество микроорганизмам, которые иначе не способны к непосредственной коммуникации либо обеспечивают низкую плотность энергии [12]. Существенно, что медиаторы – это липофильные химические переносчики электрона, способные проникать сквозь стенки клеток микроорганизмов и таким образом перемещаться между межклеточным пространством и внеклеточным окружением. Они могут способствовать метаболизму микроорганизмов, действуя в качестве терминального акцептора электрона. Желательные характеристики окислительно-восстановительного медиатора – это хорошая электрохимическая обратимость и подходящий для данного субстрата окислительно-восстановительный потенциал, например пара NAD+/NADH – основной переносчик электрона в метаболизме дыхания микробов. Одна из окислительно-восстановительных молекул с такими свойствами – это нейтральный красный (Neutral red, NR) [13, 14].
Исследование генерации электричества в безмедиаторных МТЭ с помощью некоторых микроорганизмов, таких как Shewanella putrefaciens, Geobacter sulfurreducens или Rhodeferax ferrireducens, важно потому, что они обеспечивают непосредственный переход электрона на электрод [15–17]. Сообщалось, что при физическом контакте между электродом и цитохромами во внешней мембране или проводящими фимбриями бактерий возможно непосредственное соединение. Некоторые бактерии также содержат эндогенный электронный медиатор и способны облегчать быстрый переход электрона при псевдопрямом электронном переносе между электродом и бактерией [18].
В то же время дрожжевые грибки нуждаются в некоторых средствах для того, чтобы поддерживать электронный перенос. В качестве подготовки, в работе [19] исследовали возможность непосредственной электрической связи между дрожжевыми грибками Hansenula anomala в безмедиаторном МТЭ на их основе и окислительно-восстановительным белком, присутствующим в клеточной мембране и генерирующим мощность 2.9 Вт/м3. Каталитическую активность Saccharomyces cerevisiae исследовали в безмедиаторном МТЭ с целью установить механизм электронного переноса от клетки дрожжевого грибка на анод: либо посредством частиц, находящихся строго на поверхности, либо через раствор; производимая мощность равняется 3 мВт/м2 [20]. Однако относительно низкая плотность тока и низкий КПД преобразования энергии предполагают использование электронного медиатора в МТЭ на основе дрожжевых грибков в качестве биокатализатора.
Исследования иммобилизации электродных медиаторов дали интересные результаты [12, 13]. В стандартном методе применение растворимого электронного медиатора может улучшить эксплуатационные характеристики МТЭ, но в то же время вызвать загрязнение окружающей среды, не говоря уже о непрерывном промышленном процессе. Предшествующие исследования показали, что медиатор, физически адсорбированный на электроде, менее эффективен, поскольку он легче удаляется с поверхности анода, непосредственно на поверхности которого нелегко физически иммобилизовать медиатор в большом количестве [12, 19–21].
Наряду с иммобилизацией медиатора, в настоящее время хорошо известна иммобилизация дрожжевых грибков [22–28], но лишь в нескольких работах они использованы в качестве биокатализатора в МТЭ. Клетки дрожжевых грибков могут быть иммобилизованы в альгинате (Alg) – полимерном гидрогеле – для повышения электроактивности [29]. В работе [30] проведена иммобилизация биокатализатора с целью улучшения характеристик МТЭ. Полученные результаты показывают, что иммобилизация клеток может быть перспективным способом и мощной стратегией для увеличения продолжительности жизни и устойчивости микроорганизмов. Более того, была также исследована иммобилизация биокатализаторов [7, 23, 31].
Иммобилизацию клеток можно классифицировать в соответствии с использованной для этого методикой. Существует физическая иммобилизация в пористой матрице (т.е., инкапсулирование), адсорбция и химическое прикрепление. Широко практикуется иммобилизация клеток дрожжевых грибков. Она заключается в простом внесении раствора дрожжей и альгината по каплям в ретикулярный раствор двухвалентного катиона, чтобы путем перекрестного связывания получить микросферы (microbeads) [25, 26, 32, 33]. В работах [24, 34] достигнут прогресс в инкапсулировании дрожжевых грибков в Alg-матрицу; изучено также использование различных агентов, образующих сетчатую структуру [35, 36]. Было доказано, что процесс желирования альгината зависит от “емкости” полисахаридов в процессе связывания двухвалентных катионов с образованием различных структур. Использование хлорида кальция в качестве агента, образующего сетчатую структуру, есть наиболее эффективный способ получить подобную матрицу с высокой емкостью к загрузке. В литературе также описаны и другие способы использования с этой целью природных и синтетических полимеров [23, 33, 37, 38], но альгинат используется чаще благодаря своей высокой стабильности.
Однако есть и другая методика иммобилизации с образованием полимера, содержащего дрожжевые грибки и медиатор, которая может быть перспективной в качестве альтернативы при модифицировании электродов. Более того, применение физико-химической иммобилизации одновременно электронного медиатора и биокатализатора может снизить стоимость активирования и очистить сточные воды, содержащие красители, [39, 40], а также стать эффективным методом улучшения биоанодного поведения МТЭ.
В настоящей работе предложены два способа приготовления анодной части МТЭ, работающего на основе Saccharomyces cereviceae. Первый – это синтез микросфер для захвата клеток дрожжевых грибков. Микросферы будут работать в суспензии анолита в контакте с исходной углетканью (CF). Второй способ – осадить на поверхность углеткани пленку альгината, содержащую клетки дрожжевых грибков. Цель нашего исследования – разработать эффективный метод иммобилизации клеток дрожжевых грибков. В качестве основного электрохимического метода мы использовали хроноамперометрию. Для идентификации электродных поверхностей с дрожжевыми грибками применялся метод сканирующей электронной микроскопии. В качестве электронных медиаторов для применения в МТЭ использовали метиленовый голубой (MB) и нейтральный красный [5]. Далее, одновременное применение иммобилизованных медиатора и биокатализатора позволило создать автономный МТЭ, способный к долговременной работе.
МАТЕРИАЛЫ И МЕТОДЫ
Все реактивы имели квалификацию “ч. д. а.”.
Приготовление электродов
Анодным и катодным материалами служили, соответственно, углеткань (Alfa Caesar, толщина 1.27 см) и никель. Их предварительно выдерживали в 1 M HCl в течение 48 ч, а затем очищали от загрязнений в сверхчистой воде.
Методика иммобилизации клеток дрожжевых грибков
Методика иммобилизации в альгинате описана в работе [41]. В качестве желирующего агента использовали CaCl2 (Sigma). Раствор Saccharomyces cereviceae (хлебопекарные дрожжи) в концентрации 2% (в весовом отношении) готовили в 0.85% (в весовом отношении) растворе NaCl (Sigma). Раствор нейтрального красного в концентрации 0.3% (в весовом отношении) в качестве медиатора готовили в фосфатном буферном растворе (pH 7). Порошок альгината Na (Sigma) (2 мас. %) растворяли в сверхчистой воде при 75–80°C в течение 30 мин. Растворы альгината Na и дрожжевых грибков смешивали в отношении 1 : 1, а затем к этому раствору добавляли нейтральный красный. Микросферы из дрожжевых грибков–нейтрального красного–альгината Ca получали, прикапывая 0.05 M раствор CaCl2 с помощью шприца. При этом образовывались сферы красного цвета диаметром 2 (±0.3) мм.
С другой стороны, при погружении углеткани в раствор дрожжевых грибков–альгината–нейтрального красного (CF–Alg–NR) (0.3 мас. %) образуются пленки. Углеткань погружали в этот раствор на 1 ч, а затем на 1 ч в 0.05 M раствор CaCl2, после чего вынимали и оставляли на 12 ч в эксикаторе для того, чтобы гель сформировался полностью. В результате получали два типа иммобилизованных дрожжевых грибков – микросферы и в форме осажденной пленки. Их промывали сверхчистой водой для того, чтобы удалить избыток ионов кальция, а затем хранили при 4°C, а перед использованием активировали при 30°C в течение 30 мин. Как было описано в предшествующей работе [8], мы продемонстрировали биологический топливный элемент с применением обычных дрожжей без необходимости стерилизовать их, чтобы работали живые культуры.
Конструкция микробного топливного элемента и методика эксперимента
Двухкамерный МТЭ (2 по 100 мл) состоит из анодной и катодной камер, разделенных протонообменной мембраной Nafion® 117 (DuPont, США). Перед использованием мембрану Нафион кипятили в H2O2 (30%), затем промывали сверхчистой водой, H2SO4 и снова сверхчистой водой. Электродами – анодом и катодом – служили, соответственно, углеткань (углеродный фетр, 5 × × 1.3 × 0.5 см) и никелевая пластинка (5 × 1.5 см). На рис. 1 представлена схема микробного топливного элемента. Все использованные камеры были закрыты крышкой.
Приготовление анодной и катодной камер
Анодная камера содержала раствор моногидрата глюкозы (Sigma Aldrich), приготовленный из 1.98 г глюкозы, растворенной в 100 мл буферного раствора с pH 7, после чего раствор перемешивали в течение 24 ч для получения гомогенного раствора. Фосфатный буферный раствор был приготовлен из смеси Na2HPO4 и NaH2PO4 (Sigma Aldrich) в отношении 4.08 : 3.28 г, растворенной в 1 л сверхчистой воды. В анодной же камере находились и дрожжи Saccharomyces cerevisiae в качестве биокатализатора, иммобилизованные как в микросферах, так и в осажденной пленке. Все количество микросфер, произведенных по вышеописанной методике, переносили в анодную камеру. Осажденная пленка была получена из того же количества клеток дрожжей, что и микросферы; пленка альгината, осажденная на углеткань, использовалась без дополнительной обработки. Биокатализатор окисляет глюкозу и в качестве продукта он высвобождает электрон на аноде. Эксперименты проводили с нейтральным красным, захваченным в альгинатно-дрожжевом растворе в качестве молекулы, облегчающей переход электрона (т.е., медиатора). Катодная камера содержала 0.02 M раствор феррицианида калия (Sigma Aldrich) в фосфатном буферном растворе (pH 7), как это было описано в предшествующей работе [9]. Феррицианид калия получает электрон из внешней цепи. При этом он восстанавливается до ферроцианида на электроде – никелевой пластинке. Кислород в катодной камере окисляет Fe(II) до Fe(III). Ре-окисление железа необходимо для функционирования МТЭ.
Характеристизация
Для определения электрохимических эксплуатационных характеристик анода была использована хроноамперометрия с применением потенциостата VERSASTAT 3 (PAR AMETEK, Великобритания). Этот полуэлемент содержал 100 мл испытуемого раствора, углеткань в качестве рабочего электрода, насыщенный каломельный электрод (нас. к. э.) в качестве электрода сравнения и платиновый вспомогательный электрод. Все потенциалы, за исключением редокс-потенциалов медиаторов, приведены относительно нас. к. э. чтобы охарактеризовать анод, на электрохимический полуэлемент накладывали потенциал 0.3 В (нас. к. э.) с целью обеспечить окисление медиатора. В контрольном опыте без клеток дрожжей фоновый ток на аноде электрохимического полуэлемента равнялся 5 мкА м–2 при поляризации 0.3 В. Характеристики клеток дрожжей, иммобилизованных на углеткани, определяли с помощью сканирующего электронного микроскопа (СЭМ) Hitachi S-4800 (Япония). Методика приготовления образцов для СЭМ-измерений такова: тщательно вырезали кусок модифицированной углеткани размером 1 × 1 см и выдерживали его в 4%‑ном растворе глутаральдегида не менее 4 ч, чтобы стабилизировать иммобилизованные микроорганизмы. После двукратной промывки фосфатным буферным раствором (pH 7) образцы обезвоживали в серии этанольных растворов 40, 60, 80, 100% в течение 30 мин. Последняя стадия – сушка образцов в эксикаторе в течение 3 ч.
При окончательной характеристике МТЭ использовали различные сопротивления (100 Ом–3 кОм) в качестве внешней нагрузки для того, чтобы определить максимальную мощность на выходе, как описано в работе [9]. МТЭ работал при температуре окружающего воздуха 25 ± 1°C. Генерируемое напряжение (E) записывали с помощью цифрового миллиамперметра Voltcraft (модель VC 850, Германия), а ток (I) вычисляли по формуле I = E/R.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Альгинат-дрожжевая пленка на углеткани как продукт иммобилизации дрожжей и влияние растворенного медиатора
Мы показали, что толщина альгинат-дрожжевой пленки составляет около 15 мкм; шероховатость ее велика из-за присутствия клеток дрожжей (рис. 2). Клетки дрожжей хорошо идентифицируются как сферы диаметром 4 мкм. Они утоплены в альгинатной матрице с равномерным размещением на ее поверхности, что благоприятно для электрокатализа.
Рис. 2.
СЭМ-микрофотографии иммобилизованных дрожжевых клеток в пленке альгината, осажденной на углеткань.

Чтобы исследовать влияние природы электрохимического медиатора на каталитическое поведение, к раствору глюкозы добавляли метиленовый голубой и нейтральный красный. Анодом служила углеткань, модифицированная иммобилизованной альгинат-дрожжевой пленкой. Результаты представлены на рис. 3.
Рис. 3.
Плотность тока окисления глюкозы при поляризации 0.3 В (нас. к. э.) как функция времени. В качестве рабочего электрода был использован CF/Immob Y–Alg и апробирован в следующих условиях: в присутствии метиленового голубого в качестве медиатора (треугольники); в присутствии нейтрального красного в качестве медиатора (кружочки); без медиатора (квадраты).
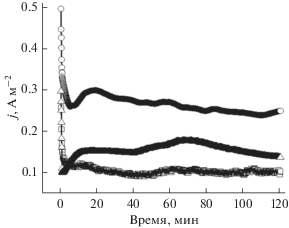
Рисунок 3 ясно показывает, что метиленовый голубой и нейтральный красный облегчают переход электрона на анод, так как плотность тока увеличивается из-за электрокаталитического окисления глюкозы клетками дрожжей. В иммобилизованной форме этих клеток их дыхание ограничено из-за ограничения содержания кислорода внутри матрицы. Дрожжевые клетки способны переключать метаболизм от дыхательного в присутствии кислорода на ферментативный в бескислородной среде [23, 41]. Добавление нейтрального красного промотирует восстановление окислительно-восстановительного центра клетки микроорганизма, т.е. восстановление никотинамидадениндинуклеотида NADH [18, 21, 42]. Исследования проводили при рН 7, где редокс-потенциалы NADH/NAD+ ближе к редокс-потенциалам NR, чем MB (табл. 1). Этим можно объяснить более высокий электрокаталитический ток, наблюдающийся в присутствии нейтрального красного.
Таблица 1.
Редокс-потенциалы молекул медиатора (отн. стандартного водородного электрода, НВЭ)
| pH | Редокс-потенциалы молекул медиатора (отн. НВЭ), В | ||
|---|---|---|---|
| NR | MB | NADH | |
| 7 | –0.325 | +0.011 | –0.320 |
(1)
${\text{NR }}\left( {{\text{в о с с т а н о в л е н н ы й }}} \right) \to {\text{NR (о к и с л е н н ы й ) }} + {\text{ }}2{\text{e }} + {\text{ }}{{{\text{H}}}^{ + }}.$Экспериментально исследовали много различных медиаторов [9, 11, 12], но о немногих из них известно, почему они действуют лучше других. В нашем предшествующем исследовании [5] сообщалось, что метиленовый голубой был выбран в качестве подходящего электронного медиатора для МТЭ на основе суспензии дрожжевых клеток. Однако в настоящей работе дрожжевые клетки используются, будучи иммобилизованными в альгинатной матрице; в этих условиях в качестве подходящего электронного медиатора выбран нейтральный красный.
В других исследованиях некоторые медиаторы показали невысокую эффективность, вероятно, из-за условий, связанных с микробной культурой [42–44]. В работе [12] наблюдали, что метиленовый голубой может сильнее адсорбироваться на поверхности анода, чем нейтральный красный, в результате простого сдвига pH. Вероятно, это объясняется тем, что при высоких pH (например, pH 12) NR легче взаимодействует с поверхностью углерода, чем MB+, поскольку заряженный ион MB+, полученный из хлорида метиленового голубого, хорошо растворим при pH 12. Однако различие в величине pH анодного раствора может эффективно повлиять на кинетику электронного медиатора, тип которого следует выбрать. В нашей системе нейтральный красный больше подходит как медиатор, вероятно, потому что было выбрано более низкое значение рН (а именно, рН 7), поскольку при более высоких pH эффект не наблюдался; рН мог подействовать на работу дрожжевых клеток – биокатализатора.
S. cerevisiae, подобно многим другим микроорганизмам, может работать в анаэробных условиях. Это – легко доступный микроорганизм с хорошо исследованным метаболизмом. Присутствие кислорода в анодной камере не является благоприятным для работы топливного элемента в целом, так как это нарушает течение электронов через внешнюю цепь [8].
Иммобилизация дрожжевых клеток с альгинатом и влияние захвата нейтрального красного
Способность дрожжевых клеток сообщаться напрямую с поверхностью электрода продемонстрирована в работе [20]. Следующая ступень настоящего исследования – сравнить электроактивность микросфер и осажденной пленки альгинат–дрожжевые клетки–нейтральный красный. На рис. 4 представлены плотности тока окисления глюкозы на иммобилизованной системе альгинат–дрожжевые клетки с захваченным NR.
Рис. 4.
Плотность тока окисления глюкозы при поляризации 0.3 В (нас. к. э.) как функция времени: a – микросферы, б – осажденная пленка на поверхности углеткани, в 0.1 M растворе глюкозы; фосфатный буферный раствор, pH 7.

Фоновые токи, полученные с углетканью и с электродом из углеткани с микросферами альгината (CF@Alg-microbeads), измеряли в течение 2 ч после 30-минутной выдержки для стабилизации электродов. Полученный результат показывает, что электрод в форме микросфер (CF@Alg-microbeads) и осажденной пленки (CF/immob Alg) также способен генерировать электрический ток: соответственно, 0.01 и 0.06 A м–2. Отсюда ясно следует необходимость использования медиатора, потому что измеряемые плотности тока очень малы. Получаемый ток мог бы относиться к дрожжевым клеткам, прилегающим к поверхности анода, если бы имелся активный биокатализатор окисления глюкозы, и перенос электронов происходил с участием частиц, сосредоточенных на поверхности. Было предположено, что в случае иммобилизации клеток на поверхности имеется химическая утечка от этих клеток к электрохимически активным молекулам. NAD+ и другие активные соединения диффундируют наружу и являются внеклеточными медиаторами, в то время как частицы в растворе анолита, включая диспергированные дрожжевые клетки, не принимают участия в переносе электронов и генерировании тока [20]. Этот результат также подтверждает, что улучшение работы элемента путем введения медиатора добавляет, соответственно, 90 и 82% в случае микросфер и осажденной пленки. Роль нейтрального красного в переносе электронов ясно доказывает необходимость использования медиатора.
Помимо этого, результат, полученный с осажденной пленкой, показывает улучшение на 71% по сравнению с микросферами. Электрод из углеткани с пленкой дрожжевых клеток, альгината и нейтрального красного (CF@Y–Alg–NR) демонстрирует, что иммобилизация дрожжевых клеток и NR внутри пленки альгината, осажденной на поверхности электрода, является эффективным методом приготовления электрокаталитической пленки для МТЭ. Поскольку медиатор иммобилизован вне клетки, то окисленный нейтральный красный должен проникнуть в клетку, подвергнуться внутриклеточному восстановлению, после чего восстановленный медиатор диффундирует из клетки наружу, чтобы вновь окислиться на поверхности электрода. Альгинат удерживает клетки дрожжей и медиатор вблизи поверхности электрода, и это, по-видимому, и есть причина того, что осажденная пленка генерирует бόльшую плотность тока по сравнению с микросферами.
Использование нейтрального красного в растворе 10 мM в течение 2 ч работы после 30-минутной выдержки для стабилизации позволяет получить перенос электрона, который дает на электроде CF(Y–NR) плотность тока 0.185 A м–2. Более того, как показано ранее (рис. 5) хроноамперометрическими измерениями, пленка CF/Immob Y–NR–Alg film работает в качестве электрода лучше, чем микросферы или суспензия, потому что генерируется более высокий ток (соответственно, 0.326–0.095 и 0.185 A м–2).
Рис. 5.
Плотность тока, генерированного на электродах из углеткани в 0.1 M растворе глюкозы; фосфатный буферный раствор, pH 7. Приложенный потенциал: 0.3 В (нас. к. э.); Pt-противоэлектрод. Концентрации дрожжевых клеток и нейтрального красного, соответственно, 2 г/100 и 10 мM.

Далее, ясно, что если клетки дрожжей захвачены внутри микросфер альгината и нейтрального красного (CF(Y–Alg–NR microbeads)), то ток ограничен из-за затруднения движения восстановленной формы нейтрального красного из слоя геля-матрицы к поверхности электрода. Результаты показывают, что электрод с осажденной пленкой CF/Immob Y–NR–Alg film может обладать улучшенными стабильностью и эксплуатационными характеристиками по сравнению с таким же электродом с микросферами CF(Y–Alg-NR microbeads), а также электродом CF(Y–NR) с суспензией: он демонстрирует наивысшую плотность тока, возможно, из-за более легкого доступа восстановленной формы нейтрального красного к поверхности электрода.
Эксплуатационные характеристики МТЭ
На основе полученных выше результатов мы применили иммобилизованные дрожжевые клетки при изготовлении анода МТЭ. Цель этого этапа работы – приготовить МТЭ и определить его базовые электрохимические свойства путем мониторинга разрядного тока (на сопротивлении 1 кОм) во времени в течение 44 дней. В нашей работе мы наблюдали наилучшие характеристики (максимальную генерируемую мощность) на нагрузке 1000 Ом (данные здесь не приводятся). Анодная камера содержала суспензию дрожжевых клеток CF(Y–NR) (без иммобилизации) либо пленку дрожжевые клетки–альгинат в нейтральном красном (CF/ImmobY–NR–Alg). Результаты приведены на рис. 6.
Рис. 6.
Изменение тока МТЭ (а) с суспензией дрожжевых клеток в анодной камере (квадраты) и с пленкой CF/immob Y–Alg–NR (треугольники) в 0.1 M растворе глюкозы. Стрелками показаны добавки глюкозы и замена K3Fe(CN)6 в католите; СЭМ-микрофотографии анода модели C после использования в МТЭ (б).
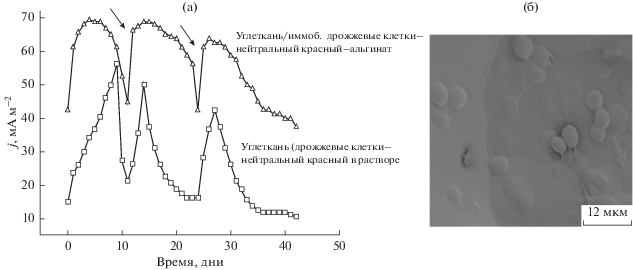
МТЭ, модифицированный иммобилизованными дрожжевыми клетками и медиатором, дает значительный электрический отклик в пакетном режиме, в котором МТЭ проработал 44 дня. Поскольку иммобилизация обычно влечет за собой частичную потерю жизнеспособности или активности микроорганизмов [45], наблюдаемое небольшое снижение плотности тока можно считать объяснимым.
После пополнения запаса глюкозы (на 12-й день), разрядная емкость модельного МТЭ возросла на ~105% (с 1.9 до 3.9 Вт м–2), а ток стабилизировался на значении, показанном в первом рабочем цикле. Наблюдается большое отличие от тока МТЭ, работающего без суспензии дрожжевых клеток. Этот результат показывает, что у МТЭ с иммобилизованными дрожжевыми клетками и медиатором более стабильная электрическая отдача. Далее, после повторной добавки глюкозы в то же электродное отделение МТЭ, в котором была проведена иммобилизация дрожжевых клеток, была подтверждена хорошая стабильность пленки дрожжевые клетки–альгинат, в особенности с захваченным нейтральным красным. При поддержании тех же условий в заключительных циклах мощность элемента с суспензией быстро снизилась до 0.2 Вт м–2 и оставалась стабильной до самого конца наблюдений. Тем не менее, при добавлении глюкозы на 36-й день не наблюдалось увеличения тока.
Явно имеются два различных типа изменений при использовании дрожжевых клеток и нейтрального красного в растворе (CF(Y–NR)) или в модельной системе CF/Immob Y–NR–Alg (иммобилизация дрожжевых клеток и нейтрального красного в пленке альгината). МТЭ, работающий с иммобилизованными дрожжевыми клетками, демонстрирует быструю стабилизацию тока. Плотность тока в особенности стабильна при использовании в качестве медиатора нейтрального красного, иммобилизованного в пленке. Такие результаты подтверждают найденные ранее электрохимические характеристики по вышеследующей причине. Напротив, ток на выходе МТЭ на основе суспензии дрожжевых клеток растет во времени после добавления глюкозы и затем снижается, начиная с более высокого значения.
В системе CF/Immob Y–NR принимается, что перенос электрона происходит внутри полимера-альгината с участием молекулы нейтрального красного и что поток электронов отличается высокой устойчивостью, потому что нейтральный красный и дрожжевые клетки заключены вблизи поверхности электрода в пленке альгината. Очень низкий ток, который измеряется в самом начале эксперимента для конфигурации на основе суспензии дрожжевых клеток, можно объяснить тем фактом, что контакт дрожжевых клеток с анодом вначале плохой, но со временем увеличивается из-за того, что дрожжевые клетки растут. Рециклинг NADH в NAD+ важен для поддержания непрерывного процесса гликолиза [46]. Поскольку реакция гликолиза протекает скорее в цитозоле клетки (цитоплазме, лишенной элементов эндоплазматической сети), а не в митохондрии, NADH легко связывается с молекулой медиатора, прикрепленной к мембране клетки. МТЭ на основе S. cerevisiae извлекает энергию с помощью окислительно-восстановительного цикла в паре NADH/NAD+. Организм может поддерживать жизнь так долго, пока не нарушен путь гликолиза. Когда медиатор восстанавливается, процесс извлечения энергии в топливном элементе не мешает гликолизу при окислении NADH обратно до NAD+.
ЗАКЛЮЧЕНИЕ
Дрожжевые клетки Saccharomyces cerevisiae были успешно иммобилизованы в качестве электрогенного микроорганизма в качестве анода микробного топливного элемента. Измерение электрохимических характеристик свежеприготовленного анода и МТЭ в целом показало, что осажденная пленка альгината, иммобилизованная дрожжевыми клетками, открывает эффективный путь к интенсификации окисления глюкозы и электронного переноса. Развитая методика позволяет осадить пленку на основе альгината толщиной 15 мкм на электроде из углеткани и использовать его как анод. Дрожжевые клетки представляют собой сферические частицы диаметром 4 мкм, иммобилизованные внутри альгинатной матрицы, в которой они равномерно распределены. Ток окисления глюкозы, измеряемый на аноде, зависит от присутствия молекул нейтрального красного (медиатор), переносящих электроны от топлива к аноду.
Эксплуатационные характеристики МТЭ оценивались как максимальная мощность, генерируемая на нагрузке 1 кОм. Показано, что можно создать эффективную электрохимическую систему, осаждая альгинатно-дрожжевую пленку, содержащую молекулы нейтрального красного в качестве медиатора, на анод из углеткани. Свежеприготовленный осадок имеет толщину несколько микрон; дрожжевые клетки диаметром 4 мкм равномерно распределены в нем. Легкий и надежный метод иммобилизации дрожжевых клеток, представленный в настоящей работе, открывает перспективный путь к созданию новой системы – поддерживаемого источника энергии. Следующая ступень – создание кислородного электрода в качестве катода на основе фермента, подобного лакказе, иммобилизованного на электроде [47]. Сочетание восстановления кислорода на катоде и окисления топлива дрожжевыми клетками на аноде даст самодостаточный микробный топливный элемент, пригодный для долговременной эксплуатации, например для обессоливания воды, как предлагалось ранее.
Список литературы
Potter, A.M.C., Character, B., and Sep, N., Electrical Effects Accompanying the Decomposition of Organic Compounds, Royal Soc. Publ., 2010, vol. 84, p. 260.
Loganm, B.E., Exoelectrogenic bacteria that power microbial fuel cell, Nat. Revs. Microbiol., 2009, vol. 7, p. 375.
Zou, Y., Xiang C, Yang L, Sun L, Xu F, and Cao Z., A mediatorless microbial fuel cell using polypyrrole coated carbon nanotubes composite as anode material, Hydrogen Energy, 2008, vol. 33, p. 4856.
Liu, J., Qiao, Y., Xian, C., Lim, Sample, Song, H., and Ming, C., Bioresource Technology Graphene / carbon cloth anode for high-performance mediatorless microbial fuel cells, Bioresource Tech., 2012, vol. 114, p. 275.
Mardiana, U., Innocent, C., Cretin, M., Buchari, B., and Gandasasmita, S., Yeast fuel cell: Application for desalination, IOP Conference Series: Materials Sci. Eng., 2016, vol. 107, p. 012049.
Zhang, Y.M., Mo, G.Q., Li, X.W., Zhang, W.D., Zhang, J.Q., Ye, J.S., Huang, X.D., and Yu, C.Z., A graphene modified anode to improve the performance of microbial fuel cell, J. Power sources, 2011, vol. 196, p. 5402.
Khrisnaraj, N.R., Karthikeyan, R., Berchmans, S., Chandran, S., and Pal, P., Functionalization of electrochemically deposited chitosan films with alginate and Prussian blue for enhanced performance of microbial fuel cells, Electrochim. Acta, 2013, vol. 112, p.465.
Walker, A.L. and Walker, C.W., Biological fuel cell and an application as a reserve power source, J. Power Sources, 2006, vol. 160, p. 123.
Mardiana, U., Innocent, C., Jarrar, H., Cretin, M., Buchari, B., and Gandasasmita, S., Electropolymerized neutral red as redox mediator for yeast fuel cell, Int. J. Electrochem. Sci., 2015, vol. 10, p. 8886.
Raghavulu, S.V., Goud, R.K., Sarma, P.N., and Mohan, S.V., Bioresource Technology Saccharomyces cerevisiae as anodic biocatalyst for power generation in biofuel cell: Influence of redox condition and substrate load, Bioresource Tech., 2011, vol. 102, p. 2751.
Babanova, S., Hubenova, Y., and Mitov, M., Influence of artificial mediators on yeast-based fuel cell performance, J. Bioscience Bioeng., 2011, vol. 112, p. 379.
Popov, A.L., Kim, J.R., Dinsdale, R.M., Esteves, S.R., Guwy, A.J., and Premier, G.C., The effect of physico-chemically immobilized methylene blue and neutral red on the anode of microbial fuel cell, Biotechn. Bioprocess Eng., 2012, vol. 17, p. 361.
Wang, K., Liu, Y., and Chen, S., Improved microbial electrocatalysis with neutral red immobilized electrode, J. Power Sources, 2011, vol. 196, p. 164.
Park, D.H., Laivenieks, M., Guettler, M.V., Jain, M.K., and Zeikus, J.G., Microbial utilization of electrically reduced neutral red as the sole electron donor for growth and metabolite production, Appl. Environ. Microbiol., 1999, vol. 65, p. 2912.
Watson, V.J. and Logan, B.E., Power production in MFCs inoculated with Shewanella oneidensis MR-1 or mixed cultures, Biotechnol. Bioeng., 2010, vol. 105, p. 489.
Ishii, S., Watanabe, K., Yabuki, S., Logan, B.E., and Sekiguchi, Y., Comparison of electrode reduction activities of Geobacter sulfurreducens and enriched consortium in air-cathode microbial fuel cell, Appl. Environ. Microbiol., 2008, vol. 74, p. 7348.
Liu, Z.D, Du, Z.W., Lian, J., Zhu, X.Y., Li, S.H., and Li, H.R., Improving energy accumulation using Rhodoferax ferrireducens as biocatalyst, Lett. Appl. Microbiol., 2007, vol. 44, p. 393.
Logan, B.E., Exoelectrogenic bacteria that power microbial fuel cell, Nat. Rev, Microbiol., 2009, vol. 7, p. 375.
Prasad, D., Arun, S., Murugesan, M., Padmanaban, S., Satyanarayanan, R.S, Berchmans, S., and Yegnaraman, V., Direct electron transfer with yeast cells and construction of a mediatorless microbial fuel cell, Biosens. Bioelectron., 2007, vol. 22, p. 2604.
Sayed, E.T., Tsujiguchi, T., and Nakagawa, N., Catalytic activity of baker’s yeast in a mediatorless microbial fuel cell, Bioelectrochem. (Amsterdam, Netherlands), 2012, vol. 86, p. 97.
Park, D.H. and Zeikus, J.G., Electricity generation in microbial fuel cell using neutral red as an electronophore, Appl. Environ. Microbiol., 2000, vol. 66, p. 1292.
Stolarzewicz, I., Bialecka-Florjancyk, E., Majewska, E., and Krzyczkowska, J., Immobilization of yeast on polimeric supports, Chem. Biochem. Eng., 2011, vol. 25, p. 135.
Zhou, Z.D., Li, G.Y., and Li, Y.J., Immobilization of Saccharomyces cereviceae alcohol dehydrogenase on hybrid alginate chitosan beads, Int. J. Biological Macromol., 2010, vol. 47, p. 21.
Panesar, R., Panesar, P.S., Singh, R.S., and Bera, M.B., Applicability of alginate entrapped yeast cells for the production of lactose hydrolyzed milk, Food Process Eng., 2007, vol. 30, p. 472.
Liu, R., Li J., and Shen, F., Refining bioethanol from stalk juice of sweet sorghum by immobilized yeast fermentation, Renew Energ, 2008, vol. 33, p. 1130.
Cha, C., Kim, S.R., Jin, Y.-S., and Kong, H., Tuning structural durability of yeast-encapsulating alginate gel beads with interpenetrating networks for sustained bioethanol production, Biotechnol. Bioeng., 2012, vol. 109, p. 63.
Qun, J., Shanjing, Y., and Lehe, M., Tolerance of immobilized baker’s yeast in organic solvents, Enzyme Microb. Technol., 2002, vol. 30, p. 721.
Cordona, C.A. and Sanchez, O.J., Fuel ethanol production: process design trends and integration opportunities, Bioresour. Technol., 2007, vol. 98, p. 2415.
Kregiel, D., Berlowska, J., and Ambroziak, W., Growth and metabolic activity of conventional and non-conventional yeasts immobilized in foamed alginate, Enzyme Microbial Technol., 2013, vol. 53, p. 229.
Yong, Y.-C., Liao, Z.-H., Sun, J.-Z., Zheng, T., Jiang, R.-R., and Song, H., Enhancement of coulombic efficiency and salt tolerance in microbial fuel cells by graphite/alginate granules immobilization of Shewanella oneidensis MR-1., Process Biochem., 2013, vol. 48, p. 1947.
Tuncagil, S., Odaci, D., Varis, S., Timur, S., and Toppare, L., Electrochemical polymerization of 1-(4-nitrophenyl)-2,5-di(2-thienyl)-1 H-pyrrole as a novel immobilization platform for microbial sensing, Bioelectrochem., (Amsterdam, Netherlands), 2009, vol. 76, p. 169.
Kuhn, S.P. and Pfister, R.M., Adsorption of mixed metals and cadmium by calcium-alginate immobilized Zoogloearamigera, Appl. Microbiol. Biotechnol., 1989, vol. 31, p. 612.
Huguet, M.L., Calcium-Alginate Beads Coated with Polycationic Polymers: Comparison of Chitosan and DEAE Dextran, Process Biochem., 1996, vol. 31, p. 347.
Pajic-Lijakovic, I., Playsic, M., Bugarski, B., and Nedovic, V., Ca-alginate hydrogel mechanical transformations- the influence on yeast cell growth dynamics, J. Biotechnol., 2007, vol. 129, p. 446.
Meena, K. and Raja, T.K., Immobilization of Saccharomyces Cerevisiae Cells by Gel Entrapment Using Various Metal Alginates, World J. Microbiol. Biotechnol., 2006, vol. 22, p. 651.
Gombotz, W.R. and Wee S.F., Protein release from alginate matrices, Adv. Drug Delivery Rev., 1998, vol. 31, p. 267.
Călinescu, I., Chipurici, P., Trifan, A., and Bădoiu, C., Immobilization of Saccharomyces cereviceae for the production of bioethanol, U.P.B. Sci. Bull. Ser. B, 2012, vol. 74, p. 34.
Balci, Z., Akbulut, U., Toppare, L., Alkan, S., Bakir, U., and Yagci, Y., Immobilization of yeast cells in several conducting polymer matrices, Macromol. Sci.-Pure Appl. Chem., 2002, vol. 39, p. 183.
Abdelkader, E., Nadjia, L., and Ahmed, B., Degradation study of phenazin Neutral red from aqueous suspension by paper sludge, Chem. Eng. Process Technol., 2011, vol. 2, p. 1.
Iram, M., Guo, C., Guan, Y., Ishfaq, A., and Liu, H., Adsorption and magnetic removal of neutral red dye from aqueous solution using Fe3O4 hollow nanospheres, Hazard Materials, 2010, vol. 181, p. 1039.
Liu, R., Li, J., and Shen, F., Refining bioethanol from stalk juice of sweet sorghum by immobilized yeast fermentation, Renew Energ., 2008, vol. 33, p. 1130.
Stuart, W., Jason, K., and Shawn, A., Optimizing biofuel cell performance using a targeted mixed mediator combination, Electroanal., 2006, vol. 18, p. 2001.
Park, D.H., Kim, S.K., Shin, I.H., and Jeong, Y.J., Electricity production in biofuel cell using modified graphite electrode with Neutral Red, Biotechnol. Lett., 2000, vol. 22, p. 1301.
Park, D.H. and Zeikus, J.G., utilization of electrically reduced neutral red by Actinobacillus succinogens: Physiological function of neutral red in membrane driven fumarate reduction and energy concervation, Bacteriol., 1999, vol. 181, p. 2403.
Rehn, G., Grey, C., Branneby, C., Lindberg, L., and Adlercreutz, P., Activity and stability of different immobilized preparations of recombinant E. coli cells containing omega-transaminase, Process Biochem., 2012, vol. 47, p. 1129.
Feldmann, H., Yeast Molecular Biology—A Short Compendium on Basic Features and Novel Aspects; Adolf-Butenandt-Inst., Munich: Univ. Munich, 2005.
Zebda, A., Gondranm, C., Cinguin, P., and Cosnier, S., Glucose biofuel cell construction based on enzyme, graphite particle and redox mediator compression, Sensor and Actuators, 2012, vol. 173, p. 760.
Дополнительные материалы отсутствуют.



