Электрохимия, 2019, T. 55, № 3, стр. 300-307
Синтез, исследование и электрохимический анализ фазы FeNbO4 со структурой α-PbO2
Д. Саритха *
Химический факультет, Университет К.Л.,
50007 Хайдарабад, Индия
* E-mail: sarithaiitm@gmail.com
Поступила в редакцию 09.04.2018
После доработки 09.04.2018
Принята к публикации 25.07.2018
Аннотация
Образцы FeNbO4 нанометровых и микрометровых размеров получали золь-гель методом из полимерного прекурсора, а также твердофазным методом. Электрохимическое внедрение лития осуществляли для образцов обоих типов. Структурные изменения в процессе внедрения лития наблюдали методом внешнего РФА. Электрохимические кривые заряда–разряда показали внедрение 0.3 Li в получаемых образцах микрометрового размера при разряде до 1.0 В, причем в процессе заряда наблюдали экстракцию 0.1 Li. С другой стороны, в наноструктурированном образце внедрение 3 Li/FeNbO4 наблюдали в процессе первого разряда, а 2.2 Li экстрагировалось при заряде до 3 В. Обратимую емкость 120 мА ч/г наблюдали после 20 циклов.
ВВЕДЕНИЕ
Применение FeNbO4 подробно исследовано в газовых датчиках [1], катализаторах и фотодетекторах [2, 3]. Электрические свойства FeNbO4 описаны в литературе в отношении его потенциального применения в качестве анода в фотоэлектрохимических ячейках [3, 4]. Полиморфизм FeNbO4 исследовали Рот и Варинг [5]. Структурные и магнитные свойства хорошо описаны в литературе [6]. FeNbO4 проявляет полиморфизм в широком диапазоне. Известны три полиморфные модификации FeNbO4, относящиеся к типам α-PbO2, вольфрамита и рутила. Фазовая диаграмма Fe2O3–Nb2O5 показывает три модификации с определенным составом FeNbO4 [7]. Fe и Nb случайным образом распределены в одной кристаллографической позиции в двух модификациях. Структура типа рутила существует при температуре выше 1380°C, структура типа α-PbO2 – при температурах от 1085 до 1380°C, и структура типа вольфрамита существует при температурах ниже 1085°C. FeNbO4, кристаллизующийся в структуре типа рутила с тетрагональной симметрией (пространственная группа P42/mnm), синтезирован при повышенной температуре. FeNbO4 со структурным типом α-PbO2 образуется при менее высокой температуре. Условия синтеза влияют на степень упорядочения катионов. Ионы Fe и Nb находятся в упорядоченном состоянии в структуре вольфрамита, в то время как эти ионы находятся в разупорядоченном состоянии в структуре α‑PbO2 [7]. При превращении одной полиморфной модификации в другую происходит изменение физических и химических свойств.
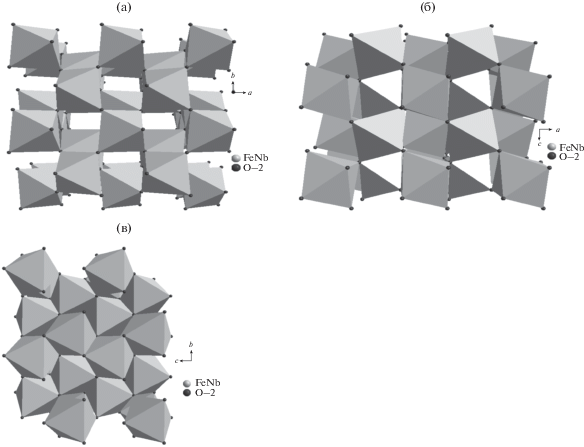
FeNbO4 со структурой типа α-PbO2 кристаллизуется в орторомбической симметрии с пространственной группой Pbcn. Структуру составляют имеющие общие ребра октаэдры, которые образуют зигзагообразные цепи в направлении c. Каждая цепь содержит атомы Fe и Nb [7]. В данной структуре присутствуют две различные октаэдрические позиции, а именно A (4c) и B (8d). Атомы Fe и Nb случайным образом занимают октаэдрические позиции B (рис. 1). Остальные позиции A остаются вакантными. FeNbO4 со структурой типа вольфрамита кристаллизуется в моноклинной симметрии с пространственной группой P2/C. Ее образуют зигзагообразные цепи из имеющих общие ребра октаэдров NbO6 и FeO6, причем каждая цепь содержит Fe или Nb [8, 9]. FeNbO4 со структурой типа рутила кристаллизуется в тетрагональной симметрии с пространственной группой P42/mnm. В структуре рутила имеющие общие ребра октаэдры образуют прямые цепи в направлении c. Атомы Fe и Nb случайным образом занимают половину из доступных октаэдрических позиций [10].
Рис. 1.
Изображение кристаллической структуры FeNbO4 типа α-PbO2: a – в плоскости ab, б – в плоскости ac, в – в плоскости bc (построено с помощью программного обеспечения Diamond).
Как описано выше, α-PbO2 представляет собой интересный структурный тип. Эту структуру образуют упорядоченные октаэдры MO6, что создает одномерный канал. В одномерный канал может быть внедрен Li. Это мотивировало настоящее исследование электрохимического поведения FeNbO4 при внедрении–экстракции Li. FeNbO4 может проявлять высокую удельную емкость, поскольку Fe3+ и Nb5+ могут одновременно подвергаться восстановлению. Имеются два сообщения в отношении применения FeNbO4 для литий-ионных аккумуляторов. Шим и др. описали хорошие электрохимические характеристики наночастиц орторомбического FeNbO4, полученных гидротермальным методом [11]. FeNbO4 синтезировали твердофазным методом и использовали в качестве анодного материала [12]. В настоящей работе орторомбический FeNbO4 синтезировали обоими методами, включая твердофазный и золь-гель, и сравнивали результаты.
Доказано, что применение нанокристаллических материалов в качестве электродов является более предпочтительным по сравнению с объемными материалами. Поведение при внедрении Li, подробно исследованное в случае рутила TiO2 и α-Fe2O3, зависит от размеров кристаллитов. В случае рутила TiO2 можно внедрить 0.06 Li/TiO2 в микроразмерные кристаллиты, в то время как в случае наноразмерных кристаллитов может быть достигнуто внедрение 1 Li/TiO2 [13, 14]. В кристаллиты α-Fe2O3 размером 0.5 мкм можно внедрить 0.1 Li/Fe2O3, в то время как достигнуто внедрение 1 Li/Fe2O3 в кристаллиты размером 20 нм [14]. Эти работы инициировали исследование внедрения Li в FeNbO4 типа α-PbO2, который был синтезирован золь-гель методом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез FeNbO4 со структурой α-PbO2
FeNbO4 получали твердофазным методом (ТФР) и золь-гель методом (ЗГ) для сравнения влияния размеров частиц на электрохимические характеристики.
Твердофазная реакция (ТФР)
Стехиометрические количества Fe2O3 и Nb2O5 измельчали в ацетоне и из порошка прессовали таблетки диаметром 10 мм. Таблетки помещали в тигель из оксида алюминия и покрывали порошком того же состава. Затем тигель помещали в печь и медленно нагревали до 1300°C, после чего выдерживали в течение 48 ч. После термической обработки продукт быстро охлаждали до комнатной температуры. Процесс повторяли до получения однофазного материала.
Золь-гель метод (ЗГ)
Исходные вещества, используемые для получения FeNbO4, представляли собой нитрат железа и Nb2O5 ⋅ xH2O. Nb2O5 ⋅ xH2O получали, осуществляя процесс, который описали Чжоу и др. (2007) [6, 15]. Прогнозируемое значение x составляло 4.25 согласно данным термогравиметрического анализа. Необходимое количество лимонной кислоты растворяли в дистиллированной воде, и полученный раствор выдерживали при 60°C. Nb2O5 ⋅ xH2O растворяли в данном растворе. Fe(NO3)3 ⋅ 9H2O добавляли в вышеупомянутый раствор и выдерживали при 60°C в течение нескольких часов, чтобы обеспечить образование комплекса металла. Затем добавляли этиленгликоль и повышали температуру до 90°C, чтобы ускорить стадию полиэтерификации. Полученный гель сушили при 120°C и подвергали разложению посредством нагревания на воздухе при 550°C в течение 3 ч. Полученный в результате порошок прокаливали при 700°C в течение 3 ч, чтобы получить FeNbO4 со структурой α-PbO2 [9].
Исследования
Порошковые рентгенограммы (ПРГ) снимали, используя рентгеновский дифрактометр Rigaku MiniFlex с источником излучения CuKα. Для определения морфологии образцов использовали сканирующий электронный микроскоп (СЭМ) Quanta 200 от компании FEI. Гальваностатические циклические исследования заряда–разряда осуществляли, используя устройство для циклических испытаний аккумуляторов Arbin BT 2000 от компании Arbin Instruments (США). Для электрохимических исследований использовали ячейки Swagelok от компании Swagelok (Бангалор, Индия). Для сборки ячеек использовали заполненный аргоном перчаточный бокс 120G от компании mBraun (Германия). Материал Teklon от компании Anatek (США) использовали в качестве сепаратора, и металлический литий чистоты 99.9% от компании Aldrich использовали в качестве противоэлектрода. Используемый электролит представлял собой 1 M LiPF6 в EC + DMC (1 : 1) от компании Chile Industries Ltd. (Корея). Внешнее исследование методом РФА осуществляли, используя рентгеновский дифрактометр Rigaku MiniFlex в диапазоне 2θ от 10° до 70° посредством покрытия электродов майларовой пленкой. Для внешних исследований методом РФА ячейки Swagelok разбирали в перчаточном боксе, электроды покрывали майларовой пленкой и получали порошковые дифрактограммы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фазообразование и анализ
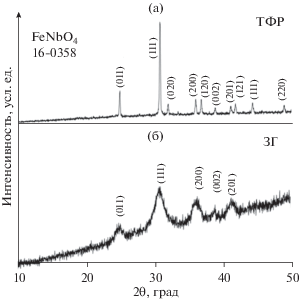
Порошковые дифрактограммы FeNbO4, синтезированного методами ТФР и ЗГ, представлены на рис. 2. Дифрактограмма образца ТФР содержит узкие пики, свидетельствующие о получении кристаллической фазы. Образец является однофазным, и дифрактограммы индицируются на основании карты JCPDS № 84-1981. Дифрактограмма (рис. 2) образца FeNbO4, полученного методом ЗГ (так называемого образца ЗГ) содержит широкие пики, свидетельствующие об образовании нанофазы. Рисунок 3 представляет снятые методом СЭМ фотографии образцов, полученных методами ТФР и ЗГ. Размер частиц в образце ТФР находится в диапазоне от 4 до 10 мкм, в то время как размер частиц в образце ЗГ находится в диапазоне от 400 до 500 нм.
Электрохимическое внедрение лития в FeNbO4 типа α-PbO2
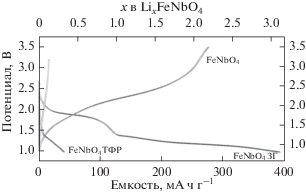
Электрохимические характеристики FeNbO4 типа α-PbO2, синтезированного методами ТФР и ЗГ, представлены на рис. 4. Кривые заряда–разряда получали в гальваностатическом режиме при скорости C/10 (реакция 1 Li в течение 10 ч). Потенциал уменьшается от потенциала разомкнутой цепи (ПРЦ) от 3.0 до 2.3 В в процессе разряда. Образование трех областей на профилях потенциал–состав четко видно на графиках дифференциальной емкости для наноразмерного FeNbO4 типа α-PbO2. Пик на производной кривой соответствует плато на профиле заряда–разряда. Эти плато четко видны на графике дифференциальной емкости (рис. 5б). Потенциал плавно изменяется в зависимости от содержания Li, проявляя поведение твердого раствора, и соответствует внедрению 0.16 Li, причем 0.54 Li вводится при среднем потенциале 1.90 В. Потенциал плавно изменяется в зависимости от содержания Li, проявляя поведение твердого раствора, и соответствует внедрению 0.4 Li в диапазоне от 1.8 до 1.45 В. 1.0 Li вводится при 1.35 В и 1.0 Li вводится при 1.18 В. Выше трех областей около 1.90, 1.35, 1.18 В на кривой появляются плато, которые соответствуют двухфазной природе процесса внедрения. Полная начальная разрядная емкость FeNbO4 относительно Li+/Li составляет 390 мА ч/г, что соответствует внедрению 3.0 Li в предположении восстановления Fe3+/Fe2+, Nb5+/Nb4+ и Nb4+/Nb3+ соответственно [11, 12]. Начальная зарядная емкость составляет 274 мА ч/г, что соответствует экстракции 2.2 Li. Следовательно, остаток 0.8 Li необратимо вводится в течение первого цикла. Необратимая потеря емкости может быть обусловлена небольшими структурными изменениями, которые происходят в процессе внедрение лития. Настоящее исследование показывает, что в FeNbO4 со структурой α-PbO2 может происходить обратимая интеркаляция лития с образованием фазы Li2.2FeNbO4. В случае образцов, синтезированных методом ТФР, интеркалируется 0.3 Li/FeNbO4.
Рис. 5.
Разрядные и зарядные кривые FeNbO4 типа α-PbO2 (a) и график дифференциальной емкости (dQ/dV) для первых трех циклов вплоть до 1.0 В (б).
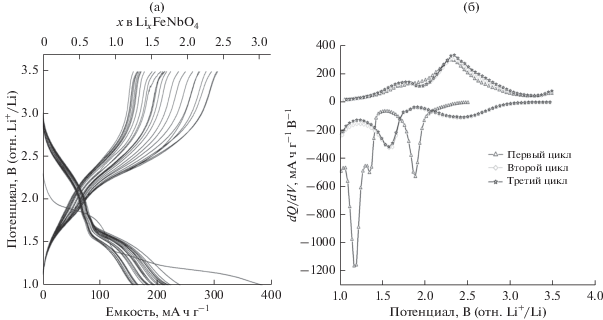
Наноразмерный образец FeNbO4 типа α-PbO2 проявляет высокую активность внедрения Li, но для объемного образца активность очень низкая. В микроразмерный FeNbO4 типа α-PbO2 вводится только 0.3 Li/FeNbO4, и получаемая в результате емкость составляет 40 мА ч г–1. Низкая активность внедрения Li у объемного FeNbO4 типа α‑PbO2 при комнатной температуре согласуется с предшествующими сообщениями в отношении рутила TiO2 [14]. Как очевидно следует из профилей потенциал–состав, количество Li, вводимого в образцы, зависит от размера кристаллитов.
Дифрактограммы, полученные ex situ, снимали для электродов, синтезированных методом ТФР, чтобы исследовать структурные изменения, происходящие в процессе внедрения лития. Рисунок 6 представляет дифрактограммы микроразмерного FeNbO4 типа α-PbO2, полученные ex situ. При заряде до 3.0 В (экстракция 0.1 Li) наблюдается такая же дифрактограмма, как для исходного электрода.
Рис. 6.
Внешние рентгеновские дифрактограммы FeNbO4 типа α-PbO2, синтезированного твердофазным методом (a) в исходном состоянии, (б) после заряда.
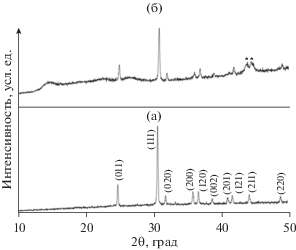
Рисунок 7 представляет разрядные и зарядные кривые и соответствующий график дифференциальной емкости для FeNbO4 типа α-PbO2, синтезированного методом ЗГ в диапазоне потенциалов от 3.2 до 1.3 В. Рисунок 8 показывает, что при задании потенциала отсечения на уровне 1.3 вместо 1.0 В вводится 2.0 Li, а при заряде экстрагируется 1.16 Li. При последующем циклическом исследовании обратимо вводится 1.16 Li. Между процессами разряда и заряда наблюдается относительно небольшая поляризация по сравнению с циклическим исследованием в диапазоне от 3.0 до 1.0 В (рис. 6).
Рис. 7.
Разрядные и зарядные кривые FeNbO4 типа α-PbO2 и график дифференциальной емкости (dQ/dV) для первых трех циклов вплоть до 1.3 В.
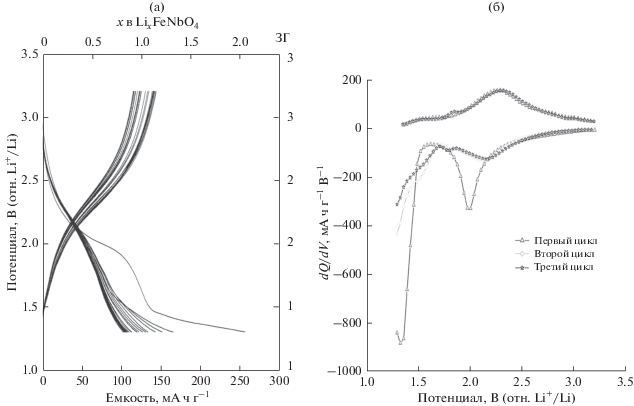
Рис. 8.
Разрядные и зарядные кривые FeNbO4 типа α-PbO2 и график дифференциальной емкости (dQ/dV) для первых трех циклов вплоть до 1.5 В.
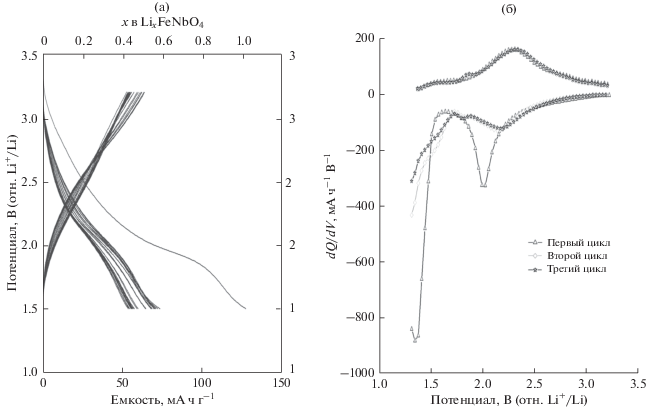
Внешние исследования РФА осуществляли для FeNbO4 со структурой α-PbO2, синтезированного методом ЗГ, диапазон потенциала циклических испытаний составлял от 3.2 до 1.3 В. Дифрактограммы представлены на рис. 9. Дифрактограммы четко показывают, что в процессе внедрения лития пики становятся шире (рис. 9б, 9в), согласно предположению для реакции внедрения при комнатной температуре. В процессе экстракции пики сужаются по сравнению с фазой, содержащей введенный Li, свидетельствуя о восстановлении кристалличности фазы. Результаты РФА показывают, что структура α-PbO2 является устойчивой для обратимого внедрения и экстракции лития, и что существенные структурные изменения не происходят.
Рис. 9.
Внешняя дифрактограмма FeNbO4 типа α‑PbO2, синтезированного золь-гель методом: a – в исходном состоянии, б – после разряда до 1.5 В, в – после разряда до 1.0 В, г – после заряда до 3.0 В (* соответствует пику стальной фольги).
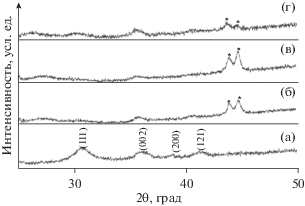
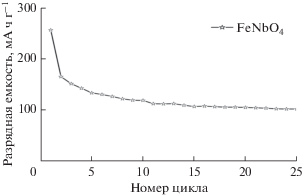
Рисунок 10 представляет циклические характеристики FeNbO4 типа α-PbO2, полученного методом ЗГ, при скоростях заряда–разряда, составляющих C/10. При скорости C/10 после первого цикла образец ЗГ проявляет высокую емкость вследствие улучшенной кинетики внедрения Li и большей площади поверхности образцов ЗГ по сравнению с образцом ТФР. Количество лития, вводимого в FeNbO4, уменьшается при увеличении размера кристаллитов. Такое поведение аналогично поведению формы брукита [16]. FeNbO4 типа α-PbO2, полученный методом ЗГ, проявляет меньшее снижение емкости по сравнению с образцом ТФР.
КРАТКИЕ ИТОГИ И ВЫВОДЫ
В настоящей работе фаза FeNbO4, которая кристаллизуется со структурой α-PbO2, синтезирована методами ТФР и ЗГ. В случае образцов, синтезированных методом ТФР, внедряется 0.3 Li/FeNbO4, в то время как в случае образцов, синтезированных методом ЗГ, может внедряться 3 Li/FeNbO4. Частицы меньших размеров могут приспосабливаться к повышенной деформации, сопровождающей реакции внедрения–экстракции Li, и могут выдерживать высокие скорости заряда–разряда за счет создания коротких путей для диффузии Li+, а также для переноса электронов. Таким образом, значительное изменение реакционной способности по отношению к литию наблюдается при уменьшении размера частиц до нескольких нанометров в случае FeNbO4 типа α‑PbO2, при этом наблюдается хорошее сохранение емкости.
Список литературы
Dawson, D.H. and Williams, D.E., As-sensitive resistors: surface interaction of chlorine with semiconducting oxides, J. Mater. Chem., 1996, vol. 6, p. 409.
Leiva, H., Sieber, B., Khazai, K., and Dwight., A structural and electronic relationships between conducting iron niobates and iron tungstates, J. Solid State Chem.,1982, vol. 44, p. 113.
Ehrenberg, H., Wltschek, G., and Theissmann, R., The Magnetic structure of FeNbO4, J. Magn. Mater., 2000, vol. 218, p. 261.
Schmidbauer, E., Electrical conductivity, thermopower, and 57Fe Mossbauer spectroscopy of solid solutions Fe(Nb1–xWx)O4, 0 ≤ x ≤ 0.4, J. Phys. Condens. matter., 1998, vol. 10, p. 8279.
Roth, R.S. and Waring, J.L., Ixiolite and other polymorphic types of FeNbO4, Amer. Miner., 1964, vol. 49, p. 140.
Harrison, W.T.A. and Cheetham, A.K., Structural and Magnetic Properties of FeNbO4-II, Mater. Res. Bull., 1989, vol. 24, p. 523.
Koenitzer, J., Khazai, B., and Hormadaly, J., Preparation and photoelectronic properties of FeNbO4, J. Solid State Chem., 1980, vol. 35, p. 128.
Noda, Y., Shimada, M., and Koizumi, Magnetic and Electrical Properties and Mossbauer Effect in the Solid Solution Fe(Nb1–xWx)O4 (0 ≤ x ≤ 1), J. Solid State Chem., 1979, vol. 28, p. 379.
Theissmann, R., Ehrenberg, H., Weitzel, H., Fuess, H., Nanostructured cation distribution in FeNbO4: A synchrotron powder diffraction and transmission electron microscopy investigation, J. Materials Science., 2002, vol. 37, p. 4431.
Schmidbauer, E. and Schneider, J., Electrical Resistivity, Thermo power, and 57Fe Mossbauer Study of FeNbO4, J. Solid State Chem., 1997, vol. 134, p. 253.
Shim, H.W., Cho, I.S., and Hong, K.S., Hydrothermal synthesis and electrochemical properties of FeNbO4 nano spheres, J. Ceram. Soc. Jpn., 2012, vol. 120, p. 82.
Sri Devi Kumari, T., Vinith Gandhi, R., and Rahul, G., Electrochemical lithium insertion behavior of FeNbO4: Structural relations and in situ conversion into FeNb2O6 during carbon coating, Materials Chemistry and Physics, 2014, vol. 145, p. 425.
Larcher, D., Masquelier, C., and Bonnin, D., Effect of Particle Size on Lithium Intercalation into α-Fe2O3, J. Electrochem. Soc., 2003, vol. 150, p. A133.
Anji Reddy, M., Satya Kishore, M., and Pralong, V., Room temperature synthesis and Li insertion into nanocrystalline rutile TiO2, Electrochem. Commun., 2006, vol. 8, p. 1299.
Zhou,Y., Zifeng, Qiu., and Mengkai, Lu., Preparation and characterization of porous Nb2O5 nanoparticles, Mater. Res. Bull., 2008, vol. 43, p. 1363.
Anji Reddy, M., Pralong, V., and Varadaraju, U.V., Crystallite Size Constraints on Lithium Insertion into Brookite TiO2, Electrochem. Solid State Lett., 2008, vol. 11 (8), p. A132.
Дополнительные материалы отсутствуют.