Электрохимия, 2019, T. 55, № 3, стр. 259-277
Механизм электрической поляризации контактного слоя воды на границе с поверхностью ионного кристалла
С. В. Шевкунов *
Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Политехническая, 29, Россия
* E-mail: shevk54@mail.ru
Поступила в редакцию 09.07.2018
После доработки 14.09.2018
Принята к публикации 21.09.2018
Аннотация
Компьютерным моделированием исследованы молекулярные механизмы электрической поляризации переохлажденной воды на границе раздела с базовой гранью кристалла β-AgI. На фоне термических флуктуаций при 260 K воспроизведен последовательный рост молекулярной пленки из пара от субмономолекулярной стадии до объемной жидкости, детально проанализирован механизм образования двойного электрического слоя. Поляризация контактного слоя воды обусловлена локальными полями на границе с кристаллической поверхностью. Разность потенциалов в формирующемся двойном электрическом слое на базовой грани монокристалла достигает 0.88 В, но на различных гранях она различна по величине и знаку. Асимметрия в пространственном распределении заряда в молекуле H2O является причиной различной прочности сцепления воды с поверхностью на гранях с ионами в поверхностном кристаллографическом слое, несущими положительный и отрицательный электрический заряд. В водном электролите, содержащем ионные примеси, поле двойного электрического слоя вызывает компенсирующее перемещение подвижных носителей зарядов к поверхности кристалла и их адсорбцию. Из-за поляризации контактного слоя микрокристалл, погруженный в микрокаплю электролита, оказывает на него дистиллирующее действие, а адсорбция подвижных ионов на поверхности твердокристаллической частицы может влиять на ее активность в качестве центра гетерогенной нуклеации атмосферной влаги.
ВВЕДЕНИЕ
Структура переохлажденной воды в контакте с кристаллическими поверхностями остается одной из наиболее интенсивно изучаемой методами компьютерного моделирования проблем [1–11]. Полученные данные свидетельствуют о значительных трансформациях, которым подвергается структура воды на расстояниях до 1 нм от твердой поверхности. Разнообразие кристаллических поверхностей делает отыскание универсальных закономерностей трудноразрешимой задачей. Тем не менее, в полученных данных можно различить некоторые общие черты и основу для систематизации. Все рассчитанные профили плотности воды около стенок еще до замерзаний имеют форму затухающих осциллирующих кривых с периодом примерно в 0.3 нм, свидетельствующую о слоистой структуре жидкости в контактной области [12–14]. В ориентационном молекулярном порядке около стенок выделяются молекулы воды, плоскости которых параллельны, либо перпендикулярны плоскости стенки, а промежуточные ориентации оказываются маловероятными.
Ориентация дипольных моментов молекул кардинально зависит от кристаллической структуры поверхности и не сводится к ориентации точечных диполей: существенную роль на контактных расстояниях играют высшие мультиполи, а также взаимодействия, не сводящиеся к чисто электростатическим. В [15] в ближайшем к поверхности (001) кристалла макинавит (mackinawite, (Fe)1 +xS) слое воды плоскости большинства молекул найдены параллельными поверхности кристалла. Наряду с параллельной ориентацией плоскостей и связей OH, в первом слое обнаруживается небольшая фракция молекул со связью OH, направленной по нормали к поверхности кристалла. Ориентации, промежуточные между этими предельными ориентациями, практически отсутствуют.
Структурирование жидкостей, обладающих относительно большими дипольными моментами молекул, к которым относится вода, с неизбежностью сопровождается их электрической поляризацией. Если поляризация происходит в узкой области около твердой поверхности, образуется двойной электрический слой толщиной, не превышающей одного нанометра. Электрическое поле такого двойного слоя может достигать значений, сравнимых с локальными электрическими полями в электролите, а его потенциал – со стандартными значениями электрохимических потенциалов электродов в воде [16].
В неоднородное поле двойного слоя втягиваются подвижные ионы, вызывая в зоне электрохимических реакций на поверхности электродов их разделение и адсорбцию [17–20]. Выяснение механизмов и последствий поляризации растворителей из-за их структурирования в контакте с твердокристаллическими поверхностями необходимо для понимания фундаментальных явлений, лежащих в основе работы электрохимических источников тока. Наряду с этим, поле двойного электрического слоя в контактной области может достигать значений, достаточных для использования и в качестве самостоятельных накопителей энергии [21].
Структурирование водного растворителя около поверхности кристалла приводит не только к его поляризации, но с неизбежностью влияет на диэлектрические свойства водного растворителя. Из экспериментальных данных хорошо известен факт аномально высокой электрической поляризуемости жидкой воды ${\kern 1pt} \chi $ ее электрической проницаемости $\varepsilon = 1 + 4\pi \chi \approx $ 70–90 [22]. В свою очередь, фундаментальные соотношения равновесной статистической механики связывают статическую электрическую восприимчивость с флуктуациями дипольного момента [23], через которые и производятся расчеты последней.
Флуктуации вообще и связанные с ними коэффициенты линейной реакции на внешние возмущения, являются тонкими статистическими характеристиками, для теоретического расчета которых требуется применение достаточно точных методов. По-видимому, это обстоятельство является главной причиной того, что общепризнанного объяснения причин аномально высокой диэлектрической проницаемости воды до сих пор не найдено. С одной стороны, большие значения времен релаксации поляризуемости, измеряемые в воде, и особенно во льду [24], указывают на скоррелированные движения больших ансамблей молекул как главную причину аномально высокой поляризуемости. С другой стороны, причину ищут в квантовых эффектах, развивающихся в относительно небольших молекулярных ансамблях – коллективных движениях электронов в электронных оболочках и туннелировании протонов в водородных связях [25].
В [26] развивалась количественная теория, основанная на представлениях о доменной структуре воды. Согласно этим представлениям, поляризованные домены наподобие доменов спонтанной поляризации в ферроэлектриках образуются в воде под действием водородных связей в результате сильных корреляций в ориентациях дипольных моментов молекул, а квадратичная зависимость поляризуемости от величины дипольного момента в системах дипольных частиц и ферроэлектрический эффект обеспечивают наблюдаемые высокие значения диэлектрической проницаемости воды.
Ферроэлектрические свойства воды резко усиливаются после замерзания в лед [27, 28]. Вместе с ними увеличивается и диэлектрическая проницаемость льда, достигая с понижением температуры значений $\varepsilon \sim {{10}^{2}}{\kern 1pt} - {\kern 1pt} {{10}^{3}},$ а на низких частотах, <10 Гц, вероятно, растет еще выше [29]. Возможно, ферроэлектрические проявления в жидкой воде являются следами ферроэлектричества льда. В контактной области около кристаллической поверхности относительно слабые ферроэлектрические проявления жидкой воды могут вовсе исчезнуть под действием возмущений, которые вносит кристаллическая поверхность в ее молекулярную структуру.
УСЛОВИЯ МОДЕЛИРОВАНИЯ
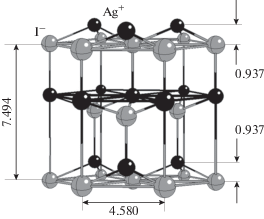
а. Структура кристаллической поверхности. В нормальных условиях устойчивой модификацией йодистого серебра является ионный кристалл β‑AgI. Кристаллическая структура этой модификации йодистого серебра близка к структуре льда Ih, как по пространственной симметрии, так и по межионным расстояниям, что, вероятно, является одной из причин аномально высокой активности данного материала в качестве агента гетерогенной нуклеации водяного пара при отрицательных температурах шкалы Цельсия. Решетка β-AgI обладает осью симметрии шестого порядка и представляет собой две гексагональные конструкции анионов йода и катионов серебра, вставленные одна в другую со сдвигом вдоль оси симметрии на 0.4684 нм. В направлении оси симметрии слои ионов йода чередуются со слоями ионов серебра. Период повторяемости в каждой из конструкций в направлении оси симметрии составляет 0.7494 нм [22, 30], а слои ионов в каждой из них с относительным параллельным сдвигом в плоскости базовой грани располагаются на расстоянии 0.7494/2 = 0.3747 нм друг от друга, так что расстояние между двумя соседними слоями ионов йода и ионов серебра оказывается здесь самым малым и составляет 0.4684–0.3747 = 0.0937 нм, рис. 1. Сцепление между ионами соседних слоев здесь наиболее сильное, и следует ожидать, что при случайном сколе именно такая пара окажется у поверхности кристалла.
В зависимости от того, с какой стороны относительно ячейки периодичности произведен скол (сверху или снизу на рис. 1), в поверхностном кристаллографическом слое оказываются либо положительно заряженные ионы серебра, либо отрицательно заряженные ионы йода. При этом ионы первых двух кристаллографических слоев располагаются не напротив друг друга, а в промежутках между ионами соседнего слоя. Это позволяет в случае, когда в поверхностном слое находятся катионы серебра, атомам водорода молекул воды проникать к анионам второго кристаллографического слоя между катионами первого слоя и образовывать с ними относительно прочные водородные связи. За счет связей с ионами второго кристаллографического слоя и происходит удержание мономолекулярной пленки воды на бездефектной поверхности базовой грани кристалла. Взаимодействие с ионами первого кристаллографического слоя здесь не связующее, а, наоборот, разрыхляющее, но, примерно, на 10% более слабое, чем с ионами второго слоя. Благодаря этой разнице в пользу связующих взаимодействий и происходит удержание молекул воды на поверхности кристалла.
В случае, когда в поверхностном слое находятся анионы йода, механизм удержания похожий, с точностью до замены знаков зарядов на противоположные: удержание молекул воды тоже происходит за счет сцепления с ионами второго кристаллографического слоя, однако здесь в направление к катионам серебра проникают несущие отрицательный избыточный заряд атомы кислорода молекул. Из-за больших пространственных размеров атомов кислорода, по сравнению с атомами водорода, глубина проникновения в тело кристалла здесь меньшая, и связь, которую молекулам удается установить с ионами второго кристаллографического слоя, менее прочная. Поэтому адсорбционная способность грани с анионами йода на поверхности более низкая, чем грани с катионами серебра.
Компьютерные расчеты электрических характеристик контактного слоя на границе с твердокристаллической поверхностью выполнены с применением периодических граничных условий в плоскости раздела. Произведено моделирование контакта воды с базовой гранью кристалла β‑AgI для двух типов условий. В первом случае в области моделирования присутствовала только базовая грань кристалла с катионами Ag+ в поверхностном кристаллографическом слое, а во втором – две расположенные напротив друг друга на расстоянии 4.5 нм параллельные кристаллические поверхности: одна представляла собой базовую грань кристалла с катионами Ag+, а другая – базовую грань с анионами I– в поверхностном кристаллографическом слое, образующие таким образом плоскую нанопору с бесконечными (с учетом периодических граничных условий) стенками. Внутренность нанопоры заполнялась парами воды, находящимися в равновесии с адсорбированной на стенках молекулярной пленкой воды. Расстояние между стенками в несколько раз превышало радиус межмолекулярных корреляций в жидкой воде, так что взаимодействие между контактными слоями на стенках отсутствовало даже при полном заполнении нанопоры жидкой фазой. В то же время обе пленки гарантированно находились в парах одинакового давления и температуры, что позволяло в полностью идентичных условиях сопоставить адсорбционные способности каждой из стенок.
б. Термические флуктуации. Термический контакт с окружением моделировался методом Монте-Карло [31]. Количество молекул N в пределах ячейки периодичности внутри нанопоры флуктуировало в соответствии с функцией распределения биканонического статистического ансамбля между заданными значениями N = n–1 и N = n [32]. Для этого, кроме шагов по случайным сдвигам и поворотам случайным образом выбираемых молекул [33], совершались шаги по добавлению из виртуального термостата или изъятию из области моделирования одной случайно выбранной молекулы согласно алгоритму, описанному в [34]. Шаги разных типов совершались последовательно с заданным соотношением частот: на одну попытку сдвинуть и повернуть производилось шесть попыток вбросить в систему или удалить из нее одну молекулу. Для расчета равновесных средних для каждого термодинамического состояния системы генерировалась последовательность в 30 × 106 шагов, из которых первые 5 × 106 использовались для термализации системы и оценки оптимального значения химического потенциала виртуального термостата, которое осуществлялось методом итераций с применением самонастраивающегося алгоритма [35]. Частота принятия попыток сдвигов молекул составляла 50–60%, а попыток вбросить или изъять молекулу – 0.05–0.1%. Применялась процедура последовательно наращивания количества молекул в пределах ячейки периодичности N [36].
Применение биканонического статистического ансамбля [36] существенно улучшает эффективность стохастических расчетов как таковых: с одной стороны, шаги по вбрасыванию и удалению из системы молекул позволяют обойти естественные барьеры, сдерживающие перемешивание молекул, особенно в плотных системах при низких температурах, и этим ускоряют получение представительной случайной выборки, а с другой стороны, ограничения флуктуаций числа молекул двумя значениями предоставляет возможность стабилизировать неустойчивые к испарению или лавинообразному росту состояния и получить таким образом полную картину, без пропусков. Получаемые в биканоническом статистическом ансамбле равновесные средние отвечают среднему значению 〈N〉, находящемуся между n–1 и n, и являются результатом интерполяции между двумя каноническими средними, в состояниях с N = n–1 и N = n.
в. Модель взаимодействий. Элементарные взаимодействия между молекулами и молекул с ионами кристалла описывались моделью [37, 38], являющейся развитием модели [39]. В данной модели, кроме парных электростатических, дисперсионных и обменных взаимодействий, в явном виде учитываются непарные поляризационные взаимодействия молекул в поле ионов кристалла и ионов в поле молекул. В [40, 41] продемонстрировано, насколько важен детальный учет непарных взаимодействий воды с ионами. Пренебрежение непарными взаимодействиями может привести к существенным искажениям в поведении системы. Взаимодействия молекул, обусловленные поляризацией молекул в поле других молекул учтены в неявной форме согласованием с экспериментальными данными по корреляционным функциям в жидкой воде. В примененную модель в явной форме включены взаимодействия диполей ${\mathbf{p}}_{i}^{{{\text{ind}}}},$ индуцированных на молекулах полем подложки:
(1)
$U_{{{\text{ind,ind}}}}^{{{\text{W--W}}}} = \sum\limits_{i < j} {\left[ {\frac{{\left( {{\mathbf{p}}_{i}^{{{\text{ind}}}},{\mathbf{p}}_{j}^{{{\text{ind}}}}} \right)}}{{{{{\left( {{{r}_{{ij}}}} \right)}}^{3}}}} - 3\frac{{\left( {{\mathbf{p}}_{i}^{{{\text{ind}}}},{{{\mathbf{r}}}_{{ij}}}} \right)\left( {{\mathbf{p}}_{j}^{{{\text{ind}}}},{{{\mathbf{r}}}_{{ij}}}} \right)}}{{{{{\left( {{{r}_{{ij}}}} \right)}}^{5}}}}} \right]} ,$В явной форме учитывались взаимодействия молекул с двенадцатью кристаллографическими слоями вглубь кристалла – шестью слоями катионов серебра и шестью слоями анионом йода. Чтобы избежать краевых эффектов, в плоскости подложки применялись периодические граничные условия [42]. Размер ячейки периодичности составлял 7.933 × 9.160 нм, что соответствует прямоугольной области на поверхности базовой грани кристалла β-AgI размером 20 × 20 ионов и примерно на порядок превышает радиус межмолекулярных корреляций в жидкой воде. В пределах ячейки периодичности все взаимодействия рассчитывались методом ближайшего образа [42]. Все электростатические взаимодействия молекул с подложкой и между молекулами за пределами собственной ячейки периодичности рассчитывались двумерным методом Эвальда, представляющим собой разложение электрического поля в ряд Фурье и его суммирование в длинноволновой части спектра [43]. Метод Эвальда позволяет просуммировать взаимодействия на любых, сколь угодно больших расстояниях.
В развитие модели [39] примененная в представленном исследовании модель дополнена учетом методом Эвальда также поляризационных взаимодействий молекул с кристаллом [44], а также в виде поправок и дисперсионные взаимодействия с кристаллической подложкой в пределах шести слоев ячеек периодичности вокруг основной ячейки [44]. Несмотря на относительно быстрое убывание дисперсионных взаимодействий с расстоянием, за счет суммирования эта компонента в расчете на одну молекулу может достигать величины 0.1 kBT.
Произведен расчет поперечной (нормальной к поверхности кристалла) составляющей дипольного момента молекулярной пленки воды на базовой грани кристалла с катионами серебра в поверхностном слое при температурах 260 и 320 K в зависимости от количества молекул в пленке. Учитывалась поляризация пленки на фоне термических флуктуаций вследствие ориентации молекул в поле подложки и за счет их электронной поляризации. Вектор дипольного момента пленки в границах основной ячейки периодичности включает сумму всех перманентных дипольных моментов молекул и всех индуцированных на молекулах дипольных моментов в электрическом поле кристалла:
(2)
${\mathbf{P}}\left( {\left\langle N \right\rangle } \right) = \left\langle {\sum\limits_{i = 1}^N {\sum\limits_{k = 1}^4 {{{q}_{k}}{\mathbf{r}}_{k}^{i}} } } \right\rangle + \left\langle {\sum\limits_{i = 1}^N {{{\alpha }_{{\text{w}}}}{\mathbf{E}}({\mathbf{r}}_{0}^{i})} } \right\rangle ,$(3)
${\mathbf{E}}\left( {{\mathbf{r}}_{0}^{i}} \right) = \sum\limits_l {\frac{{{{Q}^{ + }}\left( {{\mathbf{r}}_{0}^{i} - {\mathbf{x}}_{0}^{l}} \right)}}{{{{{\left| {{\mathbf{r}}_{0}^{i} - {\mathbf{x}}_{0}^{l}} \right|}}^{3}}}}} + \sum\limits_m {\frac{{{{Q}^{ - }}\left( {{\mathbf{r}}_{0}^{i} - {\mathbf{x}}_{0}^{m}} \right)}}{{{{{\left| {{\mathbf{r}}_{0}^{i} - {\mathbf{x}}_{0}^{m}} \right|}}^{3}}}}} + {{{\mathbf{E}}}_{\infty }}\left( {{\mathbf{r}}_{0}^{i}} \right)$Алгоритмы суммирования электрических полей, использованные для расчета взаимодействий и поляризации контактного слоя, тщательно тестировались. Корректность работы компьютерных программ контролировалась сопоставлением результатов прямого суммирования электрического поля ионов в ячейках периодичности экстремально большого размера и расчетов методом Эвальда с применением ячеек малого размера.
РЕЗУЛЬТАТЫ КОМПЬЮТЕРНОГО МОДЕЛИРОВАНИЯ
а. Молекулярная структура воды в плоскости контакта с кристаллом. На рис. 2 представлен контактный мономолекулярный слой на границе раздела базовой грани кристалл β-AgI и жидкой воды. На рис. 2а изображена базовая грань с анионами I–, а на рис. 2б с катионами Ag+ в поверхностном кристаллографическом слое. Контакт между кристаллом и объемной жидкой фазой моделировался заполнением жидкой водой плоской нанопоры со стенками, представляющими собой поверхности соответствующих базовых граней. Чтобы получить изображение контактного слоя, на компьютерном изображении рис. 2 удалены все не принадлежащие первому слою молекулы – произведены плоские срезы на заданном расстоянии от поверхности стенок.
Рис. 2.
Контактный слой на границе раздела переохлажденной воды при температуре 260 K и базовой грани кристалла β-AgI с анионами I– (а) и катионами Ag+ (б) в поверхностном кристаллографическом слое. Молекулы, не принадлежащие контактному мономолекулярному слою, на рисунке не изображены.

При температуре 260 K вода во внутренности нанопоры оставалась в жидком состоянии, не демонстрируя признаков дальнего порядка, характерного для льда. При этом молекулы контактного слоя организуются в плоскую гексагональную структуру, напоминающую пчелиные соты, с признаками дальнего порядка рис. 2. В обоих случаях – на гранях с анионами йода и катионами серебра на поверхности молекулы контактного слоя образуют шестизвенные циклы, располагающиеся вокруг ионов поверхностного кристаллографического слоя. В случае анионов йода на поверхности удержание контактного слоя осуществляется за счет взаимодействия атомов кислорода молекул с катионами серебра второго кристаллографического слоя, при этом энергия взаимодействия с анионами йода первого кристаллографического слоя положительна, и взаимодействие с ними носит разрыхляющий характер.
В случае катионов серебра на поверхности, удержание контактного слоя тоже осуществляется за счет взаимодействий с ионами второго кристаллографического слоя, но здесь все происходит с точностью до изменения знаков зарядов на противоположные – несущие положительный заряд атомы водорода молекул проникают вглубь кристалла и устанавливают водородные связи с анионами йода второго кристаллографического слоя. При идеальном расположении молекул, отвечающем минимуму энергии, в каждом шестизвенном цикле три атома водорода задействованы в сцеплении со вторым кристаллографическим слоем подложки под ним, еще шесть атомов водорода образуют водородные связи с соседними по циклу молекулами, и оставшиеся три из двенадцати атомов водорода обеспечивают сцепление с соседними циклами. Таким образом, свободных атомов водорода, с помощью которых контактный слой выступал бы в качестве доноров водородных связей по отношению к следующим молекулярным слоям в жидкой воде, не остается. Дефицит молекул-доноров водородных связей в контактном слое является, по моему мнению, главной причиной наблюдаемой гидрофобности мономолекулярной пленки воды на поверхности с комплементарной кристаллической структурой [45].
Термические флуктуации вносят нарушения в идеально правильную структуру контактного слоя: дефекты в его структуре мигрируют, атомы водорода временно меняются ролями, при этом соотношения между долями атомов, выполняющих различные функции, остаются примерно постоянными. На фоне этой динамичной картины признаки гексагонального дальнего порядка в контактном слое сохраняются в широком диапазоне температур, вплоть до точки кипения воды.
б. Механизм сцепления с поверхностью. Молекулярные механизмы взаимодействия воды с базовой гранью, несущей катионы Ag+ в поверхностном слое (гранью первого типа), отличается от взаимодействий с базовой гранью, несущей анионы I– (гранью второго типа) тем, что в первом случае сцепление контактного слоя воды с подложкой осуществляется за счет атомов водорода молекул, а во втором – за счет атомов кислорода, проникающим к ионам второго кристаллографического слоя. С одной стороны, асимметрия распределения заряда в молекуле воды и большие размеры ионов йода, по сравнению с ионами серебра, дают основания ожидать, что в первом случае атомы водорода имеют большие шансы проникнуть глубже в тело кристалла и установить более прочные водородные связи с ионами, чем большие по размеру атомы кислорода. С другой стороны, атом кислорода молекулы воды несет избыточный заряд, в два раза больший, чем атом водорода, что обеспечивает его более сильное электростатическое взаимодействие с положительными ионами серебра кристаллической решетки. Играет здесь свою роль и энтропийный фактор. Без количественных статистических расчетов определить, какой из перечисленных факторов превалирует, невозможно.
Моделирование последовательного роста пленки из пара позволяет выделить контактный мономолекулярный слой и исследовать его электрические свойства отдельно от остального объема жидкости. Для выяснения, какая из базовых граней кристалла обладает более высокой адсорбционной способностью, отдельно выполнено статистико-механическое моделирование одновременного поглощения паров воды из одного и того же резервуара гранями обоих типов. Для обеспечения идентичных условий над гранями, они размещались одна напротив другой на расстоянии 4.5 нм, образуя плоскую нанопору с кристаллическими стенками. Нанопора заполнялась парами воды при фиксированной температуре 260 K. В процессе термических флуктуаций происходило осаждение молекул воды на стенках – между адсорбированной компонентой и паром устанавливалось термодинамическое равновесие.
На полученных таким образом компьютерных изображениях отчетливо видно, что по мере наращивания общего количества молекул внутри нанопоры адсорбция начинается сначала на грани первого типа (с катионами Ag+ в поверхностном слое), рис. 3а, 3б. По мере заполнения поверхности стенок сплошной молекулярной пленкой разница в адсорбционной способности между гранями двух типов нивелируется (рис. 3в, 3г). На заключительной стадии заполнения нанопоры жидкой водой между растущими на стенках пленками образуются “стяжки”, напоминающие по форме сталактиты. Образование таких структур в пространстве между пленками способствует на заключительной стадии заполнения нанопоры уменьшению площади поверхности раздела между конденсированной фазой и паром и с учетом положительного поверхностного натяжения на границе раздела понижению свободной энергии системы в целом.
Рис. 3.
Молекулярные пленки, растущие на противоположных стенках плоской нанопоры шириной 4.5 нм из заполняющего ее водяного пара, при температуре 260 K. Стенки представляют собой базовые грани кристалла β-AgI с анионами I– (верхняя стенка) и катионами Ag+ (нижняя стенка) в поверхностном кристаллографическом слое. Суммарное, на обеих стенках количество молекул N в расчете на ячейку периодичности размером 7.933 × 9.160 нм на различных стадиях роста: (а) 403, (б) 1223, (в) 2857, (г) 6728.

Формирование контактного слоя на гранях обоих типов происходит похожим образом, хотя и при различных давлениях пара над поверхностью. В обоих случаях наблюдается высокая степень кластеризации молекул. На субмономолекулярной стадии формирующаяся пленка выглядит как сильно кластеризованный двумерный газ: прежде всего на поверхности появляются пятизвенные молекулярные циклы, которые сливаются в пятна мономолекулярной пленки с ячеистой структурой, причем после слияния превалирующими элементами становятся не пятизвенные, а шестизвенные циклы, рис. 4а, 4б, рис. 5а, 5б. Рост пленки в толщину на грани первого типа начинается только после полного покрытия поверхности кристалла мономолекулярной пленкой (рис. 4в). На грани второго типа это правило выдерживается менее строго, и пленка выглядит несколько более “рыхлой” (рис. 5в). На следующих стадиях эта разница нивелируется (рис. 4г, рис. 5г).
Рис. 4.
Молекулярная пленка воды, растущая из пара при температуре 260 K на нижней стенке нанопоры шириной 4.5 нм, с катионами Ag+ в поверхностном кристаллографическом слое, на стадиях, отвечающих различным количествам молекул N в целом на обеих стенках, в пределах ячейки периодичности: (а) 403, (б) 700, (в) 1223, (г) 2857. Вид в направлении, перпендикулярном к стенке.

Рис. 5.
То же, что на рис. 3, на противоположной стенке нанопоры. Количество молекул N в пределах ячейки периодичности на обеих стенках: (а) 700, (б) 1223, (в) 2151, (г) 2857.

В представленном исследовании адсорбционные кривые для каждой из граней в отдельности не вычислялись, так как целью сравнительных расчетов было выбрать грань с наиболее высокой адсорбционной способностью и для нее выполнить подробное исследование ее электрических свойств. Для решения задачи оказалось достаточно компьютерных изображений, представленных на рис. 4 и 5, на которых ясно видно, что на грани с катионами Ag+ в поверхностном слое поглощение молекул воды начинается при меньшем давлении пара. Только для этой грани и были выполнены расчеты электрических характеристик, которые приводятся ниже.
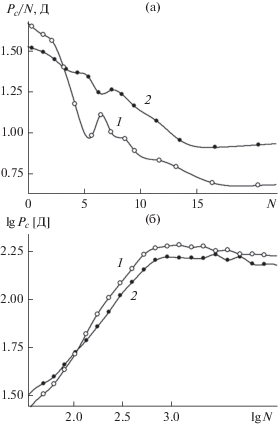
в. Поляризация контактного слоя. На рис. 6 представлены зависимости поперечной составляющей дипольного момента молекулярной пленки воды, растущей на базовой грани кристалла β-AgI с катионами серебра в поверхностном слое. Приведены зависимости от количества молекул в пленке в пределах ячейки периодичности площадью ${{S}_{c}}$ = 7.933 × 9.160 нм = 72.7 нм2. Вектор дипольного момента, независимо от толщины пленки, оказывается направленным в сторону к кристаллической подложке. На рис. 6а представлены данные, полученные в области субмономолекулярного режима, задолго до образования сплошной пленки. Кривая 1, отвечающая более низкой температуре, имеет в точке N = 6 локальный минимум, отвечающий образованию в границах ячейки периодичности шестизвенного цикла молекул. Причиной образования этого минимума является усиление пространственных корреляций между молекулами, собранными в единый кластер: дипольные моменты молекул частично взаимно компенсируются. Хотя наиболее устойчивыми в этой области условий являются пятизвенные циклы, минимальное значение дипольного момента отвечает шестизвенному циклу как содержащему четное количество молекул.
Рис. 6.
Поперечная составляющая дипольного момента молекулярной пленки воды на поверхности базовой грани кристалла β-AgI с катионами Ag+ в поверхностном кристаллографическом слое при температуре 260 K (1) и 320 K (2) как функция количества молекул в пленке в пределах ячейки периодичности размером 7.933 × 9.160 нм: (а) – в области субмономолекулярной поверхностной плотности молекул, в расчете на одну молекулу, (б) – в области образования мономолекулярной и многослойной пленки, в расчете на ячейку периодичности. Вектор дипольного момента направлен в сторону к кристаллу. Дипольный момент выражен в Дебаях.
г. Двойной электрический слой. Наличие дипольного момента в пограничном слое свидетельствует о поляризации пленки: около базовой грани первого типа избыточный положительный заряд расположен ближе, а избыточный отрицательный заряд дальше от границы раздела. Таким образом, у границы раздела образуется двойной электрический слой с вектором напряженности электрического поля, направленным в сторону от подложки.
Объемная плотность зарядов ρ(x, y, z) двойного слоя около границы раздела, вообще говоря, неоднородна как в направлении, перпендикулярном к границе раздела (оси z), так и в плоскости, параллельной к границе (осей x и y). Пространственные масштабы неоднородности заряда и поля в плоскости раздела определяются структурой кристаллической поверхности и имеют порядок межионных расстояний в ее кристаллической решетке. От координат x, y зависит, в частности, и поверхностная плотность нормальной составляющей (z-компоненты) дипольного момента двойного слоя:
(4)
${{P}_{s}}(x,y) = \int\limits_{ - \infty }^{ + \infty } {z{\kern 1pt} {\kern 1pt} \rho (x,y,z)dz} .$В анализе нормальной по отношению к границе раздела составляющей поля будем оперировать усредненными в плоскости раздела величинами, не интересуясь мелкомасштабной неоднородностью поля в плоскости подложки. В результате процедуры “сглаживания” в плоскости двойного слоя эквипотенциальные поверхности поля становятся плоскими, и обретает смысл понятие потенциала на заданных расстояниях от границы раздела.
В терминах одномерного сглаженного распределения $\bar {\rho }(z) = \mathop {\lim }\limits_{l \to \infty } \frac{1}{{{{l}^{2}}}}\int_{ - l}^l {\int_{ - l}^l {\rho (x,y,z)dxdy} } $ сглаженная поверхностная плотность заряда в элементарном слое толщиной $dz$ равна $d\bar {\sigma }(z) = \bar {\rho }(z)dz,$ а сглаженная поверхностная плотность дипольного момента жидкости около границы раздела выражается, с учетом (4), через сглаженное объемное распределение заряда:
(5)
$\begin{gathered} {{{\bar {P}}}_{s}} = \mathop {\lim }\limits_{l \to \infty } \frac{1}{{{{l}^{2}}}}\int\limits_{ - l}^l {\int\limits_{ - l}^l {{{P}_{s}}(x,y)} } dxdy = \\ = \mathop {\lim }\limits_{l \to \infty } \frac{1}{{{{l}^{2}}}}\int\limits_{ - l}^l {\int\limits_{ - l}^l {\int\limits_{ - \infty }^{ + \infty } {z{\kern 1pt} {\kern 1pt} \rho (x,y,z)dz} } } {\kern 1pt} {\kern 1pt} dx{\kern 1pt} dy = \int\limits_{ - \infty }^{ + \infty } {z{\kern 1pt} \bar {\rho }(z){\kern 1pt} dz} . \\ \end{gathered} $Потенциал равномерно заряженного элементарного плоского слоя толщиной $d{\kern 1pt} z$ равен $d\bar {\varphi }(z) = 4\pi zd\bar {\sigma }(z) = 4\pi z\bar {\rho }(z)dz.$ Если отсчитывать потенциал от точек в жидкой объемной фазе, отстоящих от поверхности кристалла на макроскопически больших расстояниях, то потенциал твердокристаллической поверхности, с учетом (5), выражается через поверхностную плотность нормальной составляющей дипольного момента:
(6)
${{\bar {\varphi }}_{s}} = \int {d\bar {\varphi }(z) = 4\pi \int\limits_{ - \infty }^{ + \infty } {z\bar {\rho }(z)dz} {\kern 1pt} } = 4\pi {{\bar {P}}_{s}}.$Таким образом, представленные на рис. 6 зависимости нормальной составляющей ${{P}_{z}}$ дипольного момента двойного слоя в пределах ячейки периодичности ${{P}_{c}} = \left\langle {{{P}_{z}}} \right\rangle = \int_{{{S}_{c}}} {{{P}_{s}}(x,y)dxdy} = {{S}_{c}}{{\bar {P}}_{s}}$ с точностью до коэффициента являются также и зависимостями разности потенциалов между жидкой водой и поверхностью кристалла, возникающей вследствие поляризации на границе раздела. Потенциал электрического поля по направлению к базовой грани с катионами серебра в поверхностном слое растет. Около базовой грани с анионами йода на поверхности поле двойного электрического слоя направлено в противоположную сторону, и потенциал при движении к поверхности, наоборот, падает.
При наличии в воде свободных носителей зарядов в виде ионных примесей поле двойного электрического слоя вызовет их разделение: отрицательные электрические заряды в водном электролите будут смещаться в сторону базовой грани с катионами серебра в поверхностном кристаллографическом слое, а положительные – в сторону базовой грани с анионами йода. Смещение будет продолжаться до тех пор, пока поле свободных носителей не скомпенсирует поле, вызванное поляризацией на границе раздела воды и кристалла. В равновесном состоянии электролита в наноскопически тонком слое около твердокристаллической поверхности сформируется объемное распределением заряда примесей, противоположное тому, которое индуцируется из-за поляризации водного растворителя в его взаимодействии с кристаллической поверхностью.
д. Электрический потенциал. Формула (6) и данные, представленные на рис. 6, позволяют оценить электрический потенциал базовой грани ${{\bar {\varphi }}_{1}},$ обусловленный поляризацией воды около границы раздела. Дипольный момент зависит от толщины пленки и увеличивается с ростом последней. Вместе с дипольным моментом, согласно соотношению (6), меняется и потенциал. Как можно видеть из графика, представленного на рис. 6б, дипольный момент с ростом толщины пленки выходит на насыщение. Это происходит около точки N = 800, отвечающей количеству молекул в пределах ячейки периодичности в сплошной мономолекулярной пленке идеальной гексагональной структуры. Дальнейшее наращивание количества молекул в пленке не сопровождается ростом ее дипольного момента.
Если уровень насыщения величины нормальной составляющей дипольного момента на рис. 6б $\lg ({{P}_{c}}) \approx 2.23$ (${{P}_{c}} = 170$ Д11) считать значением, соответствующим погружению в объемную жидкость, 22то потенциал электрического поля на поверхности кристалла в этих условиях равен
(7)
$\begin{gathered} {{{\bar {\varphi }}}_{1}} = 4\pi {{P}_{s}} = 4\pi {{{{P}_{c}}} \mathord{\left/ {\vphantom {{{{P}_{c}}} {{{S}_{c}}}}} \right. \kern-0em} {{{S}_{c}}}} = \\ = 2.94 \times {{10}^{{ - 3}}}{\text{С Г }}{{{\text{С }}}_{\varphi }}^{2} = 0.88{\kern 1pt} \,\,{\text{В }}{\text{.}} \\ \end{gathered} $Согласно оценке (7), электрический потенциал грани первого типа за счет поляризации воды у поверхности раздела может достигать значения около одного вольта. Величина (7) является оценкой снизу, так как с увеличением толщины пленки ее поляризация может только расти. В то же время, возможность превышения уровня насыщения на рис. 6б при продолжении кривой в область макроскопической толщины пленки маловероятна, так как сам выход на насыщающее значение дипольного момента свидетельствует об ограничении ориентирующего действия кристаллической поверхности, в основном, первым молекулярным слоем.
Если ориентирующее действие кристалла и распространяется на следующие слои молекул, то это действие может передаваться только через молекулы первого слоя, которые выступают здесь в качестве посредника. При этом, молекулы следующих слоев могут оказывать на молекулы первого слоя обратное, дезориентирующее действие. Этот компенсирующий эффект препятствует росту дипольного момента системы выше насыщающего значения. В пользу этого реактивного механизма со стороны следующих слоев в воде свидетельствует небольшое снижение дипольного момента с ростом пленки в области N > 800, которое можно различить при детальном рассмотрении кривой на рис. 6б.
В представленной работе расчеты поляризации выполнены только для базовой грани с катионами серебра в поверхностном слое. Обратная по знаку поляризация контактного слоя произойдет также около базовой грани с анионами йода на поверхности. С учетом представленных выше аргументов в отношении молекулярных механизмов взаимодействия, здесь следует ожидать несколько более слабую поляризацию и более низкий по абсолютной величине потенциал ${{\bar {\varphi }}_{2}}.$ Ожидаемая разность потенциалов между базовыми гранями кристалла двух типов за счет поляризации в контактных слоях составит примерно ${{\bar {\varphi }}_{1}} - {{\bar {\varphi }}_{2}} \approx 1.4{\text{--}}1.6$ В. При погружении в воду поликристалла йодистого серебра, образуется контакт жидкости с различными гранями его кристаллической решетки и различными потенциалами электрического поля на его поверхности. Компенсирующее перераспределение зарядов приводит к выравниванию потенциалов в различных точках кристалла и микроскопически неоднородному распределению адсорбированных на его поверхности ионов.
е. Поперечная структура контактного слоя. Поляризация системы около границы раздела определяется ориентацией дипольных моментов молекул. Ориентация молекул на различных расстояниях от поверхности кристалла анализировалась в терминах углов Ейлера $\theta $ и $\psi .$ Угол $\theta $ образован вектором дипольного момента молекулы воды (биссектрисой угла H–O–H в молекуле) и внешней нормалью к поверхности кристалла (осью z). При $\theta = 0$ молекула ориентирована своими атомами водорода в сторону от поверхности кристалла. Угол $\psi $ ― это угол поворота молекулы вокруг своей оси вращательной симметрии (вокруг вектора собственного дипольного момента). Он отсчитывается от положения, при котором плоскость H–O–H молекулы совпадает с плоскостью, в которой лежат нормаль к поверхности кристалла и ось вращательной симметрии молекулы. В частности, при $\psi = 0$ плоскость H–O–H молекулы перпендикулярна поверхности кристалла, а при $\psi = {\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}$ и одновременно $\theta = {\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}$ она ей параллельна.
На рис. 7а представлены в логарифмическом масштабе распределения локальной объемной плотности молекул по расстояниям от поверхности, а на рис. 7б – равновесных средних значений углов $\theta $ и $\psi $ в пределах мономолекулярного контактного слоя. Сплошной мономолекулярной пленке на поверхности кристалла соответствует поверхностная плотность молекул 11.0 нм–2. В соответствие с этим, данные на рис. 7 получены для двух предельных случаев: первые две кривые (1 и 2) на рис. 7а отвечают глубокой субмономолекулярной стадии адсорбции, а последняя кривая (3) – контакту кристалла с переохлажденной объемной жидкой фазой. Кривые 1, 2 с максимумом в точке z = 0.225 нм на рис. 7а представляют профиль плотности контактного мономолекулярного слоя, а ближайший минимум на кривой 1, z = = 0.425 нм, отвечает границе между первым и вторым слоями в объемной жидкости. Такому же уровню плотности слева от максимума на кривых 1, 2 соответствует точка z = 0.125 нм. В соответствии с положениями этих границ, толщина контактного слоя оценивается величиной в 0.425–0.125 = 0.3 нм, хотя, с учетом размытости границ, такая оценка весьма условна.
Рис. 7.
(а) Локальная объемная плотность воды около поверхности базовой грани кристалла β-AgI с катионами Ag+ в поверхностном кристаллографическом слое как функция расстояния z от поверхности на различных стадиях адсорбции при 260 K: (1) – интегральная поверхностная плотность 0.129 нм–2, (2) – 1.14 нм–2, (3) – контакт с объемной жидкой фазой, пунктир – интегральная объемная плотность воды при нормальных условиях; (б) равновесные средние значения угла θ между вектором дипольного момента молекул воды и нормалью к поверхности кристалла (1–3), а также отклонения от π/2 угла поворота молекулы φ вокруг ее оси симметрии (4–6) как функции расстояния от поверхности на различных стадиях адсорбции: (1, 4) – поверхностная плотность 0.129 нм–2, (2, 5) – 3.21 нм–2, (3, 6) – контакт с объемной жидкой фазой.
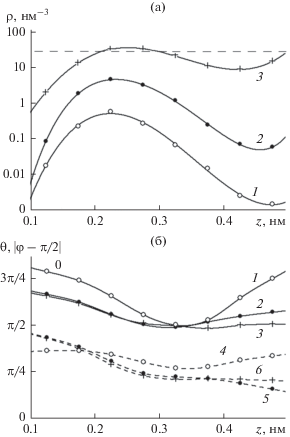
Указанная толщина контактного слоя определяется не только термическими флуктуациями: при детальном рассмотрении выясняется, что контактный слой состоит из двух типов молекул, различающихся ориентацией и расстоянием до поверхности кристалла. Фактически контактный слой сам представляет собой двухэтажную конструкцию: на нижнем уровне располагаются молекулы, сцепленные водородными связями с анионами I– второго кристаллографического слоя подложки, в плоскости выше находятся молекулы, сцепленные водородными связями исключительно с соседними молекулами. Разница в расстояниях до подложки у этих молекул измеряется сотыми долями нанометра, поэтому их вклады в распределения на рис. 7а сливаются в единый максимум. Однако, различить эти молекулы можно по их ориентациям. На рис. 7б представлены зависимости средних значений углов $\theta $ и $\psi $ от расстояния до поверхности кристалла. Согласно кривым 1–3, в пределах контактного слоя, по мере удаления от поверхности подложки вектор дипольного момента молекулы, оставаясь направленным в сторону от поверхности подложки, приближается к ориентации, параллельной подложке. Такая ориентация дипольных моментов молекул определяет поляризацию контактного слоя в целом, причем поляризация слоя неоднородна – ближе к поверхности контактный слой поляризован сильнее. Согласно кривым 2–4, угол между плоскостью молекулы и плоскостью подложки с увеличением расстояния до последней тоже уменьшается.
ж. Ориентационный порядок в контактном слое. Чтобы различить в интегральных значениях вклады различным образом ориентированных молекул, необходим более детальный анализ, на основе функций распределения. Рассчитанные функции распределения по ориентациям ${{W}_{\theta }}\sin (\theta {\kern 1pt} ){\kern 1pt} {\kern 1pt} $ и ${{W}_{\psi }}$ пропорциональны вероятности обнаружения молекулы в конфигурации с соответствующими значениями углов в расчете на единичный угловой интервал. Функции нормированы следующим образом:
При такой нормировке безразличному распределению по ориентациям соответствуют постоянные значения ${{W}_{\theta }} = {{W}_{\psi }} = 1,$ а степень отклонения функций от единицы служит количественной мерой ориентационной упорядоченности в системе. Угловые функции рассчитаны в пленке воды, растущей на поверхности базовой грани кристалла β-AgI, на различных расстояниях от нее. Расстояния отсчитывались от плоскости, проходящей через центры катионов серебра поверхностного кристаллографического слоя.
На рис. 8 представлены результаты расчетов угловых распределений на двух расстояниях от поверхности кристалла – 1.75 нм (кривые 1, 3) и 3.25 нм (кривые 2, 4) – в нижней и верхней части контактного слоя. Представлены данные, полученные для двух крайних случаев: на рис. 8а изображены результаты для субмономолекулярной стадии, в самом начале формирования пленки, а на рис. 8б – для границы раздела между кристаллом и объемной фазой переохлажденной воды.
Рис. 8.
Функции распределения по ориентациям молекул воды при температуре 260 K на базовой грани кристалла β-AgI с катионами Ag+ в поверхностном кристаллографическом слое, на различных расстояниях от него: 0.175 нм (1, 3) и 0.325 нм (2, 4). Сплошная линия (1, 2) – Wθ , пунктир (3, 4) – Wψ: (а) для адсорбированных молекул с поверхностной плотностью 0.351 нм–2 (субмономолекулярная стадия), (б) в условиях контакта с объемной жидкой фазой.
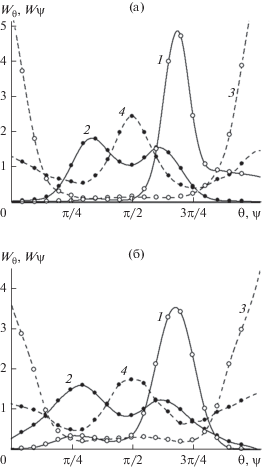
Как видно из формы угловых распределений, молекулы в разных частях контактного слоя ориентированы различным образом. В нижней части дипольные моменты молекул направлены преимущественно в сторону к подложке. Об этом свидетельствует максимум на кривой 1, расположенный в области $\theta > {\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}.$ При этом распределение по углу $\psi $ для этих молекул на кривой 3 имеет два острых пика в точках $\psi = 0$ и $\psi = \pi ,$ указывающих на преимущественную ориентацию плоскостей молекул перпендикулярно плоскости подложки. Так ориентированы молекулы, один из атомов водорода которых проник в кристаллическую решетку подложки и установил водородную связь с анионам йода второго кристаллографического слоя, при этом задействованная связь O–H молекулы оказалась направленной перпендикулярно к плоскости подложки вглубь кристалла.
Распределение по углу $\theta $ молекул в верхней части контактного слоя (кривая 2) качественно иное: максимум правее точки ${\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}$ понижается и смещается в сторону меньших углов, а вместо него растет максимум левее точки ${\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}.$ Одновременно в распределении по углу $\psi $ (кривая 4) появляется максимум в точке ${\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2},$ отвечающий ориентации молекул при которой атомы водорода молекулы расположены на одинаковых расстояниях от подложки. Такие молекулы связаны водородными связями с соседними молекулами, находящимися на одном уровне над подложкой, а не с ионами внутреннего кристаллографического слоя подложки, как в нижней части слоя.
Таким образом, в распределения 1, 3 на рис. 8а вносят вклад молекулы, непосредственно сцепленные с анионами подложки (молекулы нижней части контактного слоя), а в распределения 2, 4 – молекулы, связанные с подложкой через молекулы-посредники и поэтому локализованные дальше от нее (молекулы верхней части контактного слоя). Плоскости первых молекул ориентированы под максимальным углом – перпендикулярно к плоскости подложки, а ориентация вторых, напротив, характеризуется малыми величинами углов между их плоскостями и плоскостью подложки. На это указывает максимум в точке $\psi = {\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}$ на кривой 4. Эти молекулы являются акцепторами водородных связей по отношению к молекулам нижней части контактного слоя. Поэтому их атомы кислорода находятся немного ближе к подложке, чем их атомы водорода – дипольный момент таких молекул направлен под углом в сторону от подложки. Вследствие этого на кривой 2 формируется максимум в области $\psi < {\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}.$
Кроме таких молекул, в угловые распределения (кривые 2, 4) молекул верхней части контактного слоя на рис. 8а вносит вклад относительно небольшая фракция молекул, плоскости которых ориентированы перпендикулярно к плоскости подложки – как и у молекул нижней части. Об этом свидетельствуют умеренные максимумы на краях кривой 4. К этим молекулам относятся те, которые в результате флуктуаций потеряли водородную связь с анионами йода второго кристаллографического слоя, и переместившись из нижней в верхнюю часть контактного слоя, продолжают удерживаются там за счет электростатического притяжения своего атома кислорода к катиону серебра первого слоя. Хотя эта связь слабее водородной связи с анионом йода, молекулы некоторое время пребывают в этом положении, а их ориентация остается близкой к ориентации молекул нижней части контактного слоя. Именно эти молекулы вносят свой вклад в максимум на кривой 2 в области $\theta > {\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2}.$
Ориентационный молекулярный порядок в контактном слое устойчив к действию следующих молекулярных слоев. На рис. 8б представлены те же функции распределения по ориентациям молекул, что и на рис. 8а, но полученные в условиях контакта с объемной конденсированной фазой воды. Сравнение не выявляет качественных различий. Механизмы формирования ориентационного порядка и поляризации в контактном слое остаются теми же.
Высокая степень устойчивости контактной мономолекулярной пленки обусловлена эффектом высокой гидрофобности ее внешней поверхности, которая подтверждалась расчетами свободной энергии послойной адсорбции пара [46], а также независимо методом молекулярно-динамического моделирования, в котором удалось наблюдать долгоживущее состояние нерастекающейся микрокапли, лежащей на поверхности мономолекулярной подстилающей пленки воды, стабилизированной на поверхности кристалла со структурой, близкой к кристаллу β-AgI [45].
Из приведенных данных видно, что контактный слой на поверхности кристалла β-AgI не является однородным, но обладает сложной структурой, выражающейся прежде всего в специфическом ориентационном молекулярном порядке и тонком пространственном разделении молекул в поперечном направлении на два уровня таким образом, что контактный слой следует классифицировать как двойной слой.
Электрическая поляризация в системе определяется распределением по углу $\theta .$ Вариации угла $\varphi $ не сопровождаются изменениями направления дипольного момента и поляризации системы. Влияние угла $\psi $ на поляризацию может быть только апосредованным, за счет корреляций между углами $\theta $ и $\psi .$ Максимум на кривой 1 на рис. 8а в районе $\theta \approx 0.7\pi $ указывает на преимущественную ориентацию дипольных моментов молекул нижнего уровня контактного слоя в сторону к поверхности кристалла. Именно эта ориентация молекул обеспечивает поляризацию жидкости у границы раздела. Молекулы верхнего уровня контактного слоя могут ориентироваться как в сторону к поверхности кристалла, так и от нее и, следовательно, не оказывают существенного влияния на электрическую поляризацию контактного слоя. Ориентирующее действие подложки не распространяется на следующие молекулярные слои вглубь жидкости. В силу эффекта гидрофобности мономолекулярной пленка воды фактически блокирует влияние подложки на ориентационный порядок в следующих молекулярных слоях, в том числе и их электрическую поляризацию.
з. Поляризующее действие поверхности. Механизм ориентирующего действия кристаллической поверхности в отношении молекул контактного слоя не сводится к чисто электростатическим силам. Здесь задействованы и водородные связи, и ковалентные и дисперсионные взаимодействия. Оценим величину эффективного электростатического поля, которое вызвало бы такую же по величине поляризацию воды, как и действие сил со стороны поверхности кристалла. Равновесная вращательная поляризация, которую вызывает однородное электростатическое поле напряженностью $E$ в идеальном газе полярных молекул, обладающих дипольным моментом ${{p}_{0}},$ в расчете на одну молекулу равна
(8)
$\begin{gathered} \left\langle {{{p}_{z}}} \right\rangle = \\ = \frac{{\int\limits_{ - \pi }^\pi {{{p}_{0}}\cos (\theta )\exp (E} {{p}_{0}}{{\cos (\theta )} \mathord{\left/ {\vphantom {{\cos (\theta )} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}})\sin (\theta )d\theta }}{{\int\limits_{ - \pi }^\pi {\exp (E} {{p}_{0}}{{\cos (\theta )} \mathord{\left/ {\vphantom {{\cos (\theta )} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}})d\theta }} = \\ = {{p}_{0}}\left[ {\frac{{\exp ({{E{{p}_{0}}} \mathord{\left/ {\vphantom {{E{{p}_{0}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}) + \exp ( - {{E{{p}_{0}}} \mathord{\left/ {\vphantom {{E{{p}_{0}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}})}}{{\exp ({{E{{p}_{0}}} \mathord{\left/ {\vphantom {{E{{p}_{0}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}}) - \exp ( - {{E{{p}_{0}}} \mathord{\left/ {\vphantom {{E{{p}_{0}}} {{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {{{k}_{{\text{B}}}}T}})}} - \frac{{{{k}_{{\text{B}}}}T}}{{E{{p}_{0}}}}} \right]. \\ \end{gathered} $Подставляя значение $\left\langle {{{p}_{z}}} \right\rangle = {{P}_{c}}{\text{/}}N = $ = 170/800 = 0.21 Д, отвечающее, согласно данным на рис. 6б, дипольному моменту мономолекулярной пленки воды, в пределах ячейки периодичности ${{P}_{c}} = 170$ Д в левую часть уравнения (8), а также в качестве ${{p}_{0}}$ величину дипольного момента молекулы воды ${{p}_{{\text{w}}}} = 1.84$ Д [22] и температуру T = 260 K в его правую часть, и методом последовательных приближений, разрешая уравнение относительно $E,$ получаем оценку величины однородного электрического поля, которое произвело бы такую же ориентационную поляризацию невзаимодействующих молекул воды, что и в результате контакта молекул с поверхностью базовой грани кристалла β-AgI в составе мономолекулярной пленки: ${{E}_{{{\text{eff}}}}} \approx 6.7 \times {{10}^{3}}\,\,{\text{С Г }}{{{\text{С }}}_{{\text{E}}}} = 2.0 \times {{10}^{6}}$ В/см. Для сравнения, электрическое поле такой напряженности производит точечный элементарный электрический заряд на расстоянии 2.7 нм – расстоянии примерно десяти атомных диаметров. Ориентирующее действие поверхности кристалла следует признать сильным.
В то же время анализ ориентационного молекулярного порядка свидетельствует об относительно малой толщине области поляризации. Толщина двойного электрического слоя на контакте с поверхностью кристалла не превышает толщину мономолекулярной пленки и оценивается примерно в $\bar {d} \approx 0.3$ нм. Исходя из полученного на основе компьютерного моделирования значения потенциала (7), напряженность локального поля в двойном электрическом слое такой толщины оценивается величиной в ${{{{{\bar {\varphi }}}_{1}}} \mathord{\left/ {\vphantom {{{{{\bar {\varphi }}}_{1}}} {\bar {d}}}} \right. \kern-0em} {\bar {d}}} = 0.88{\text{/}}0.3 \times {{10}^{{ - 7}}} \approx 3 \times {{10}^{7}}$ В/см, а поверхностная плотность зарядов на его границах составляет $\bar {\sigma } = {{{{{\bar {\varphi }}}_{1}}} \mathord{\left/ {\vphantom {{{{{\bar {\varphi }}}_{1}}} {\left( {4\pi \bar {d}} \right)}}} \right. \kern-0em} {\left( {4\pi \bar {d}} \right)}} = 0.780 \times {{10}^{4}}$ СГСq/см2 = = $0.26 \times {{10}^{{ - 5}}}$ Кл см2. Это равносильно поверхностной плотности однозарядных ионов, равной ${{\bar {\sigma }} \mathord{\left/ {\vphantom {{\bar {\sigma }} e}} \right. \kern-0em} e} = 0.17 \times {{10}^{{14}}}\,{\text{с }}{{{\text{м }}}^{{ - 2}}} = 0.17$ нм–2 – по одному иону примерно на каждые 6 нм2. Такую плотность осажденных отрицательных подвижных зарядов, втянутых в двойной электрический слой, следует ожидать в водном электролите на базовой грани первого типа (с катионами серебра на поверхности). На базовой грани второго типа (с анионами йода в поверхностном слое) следует ожидать осаждение подвижных зарядов противоположного знака. При погружении микрокристалла в электролит в контакте с водным растворителем оказываются его различные грани. На границе раздела происходит его поляризация, направление которой различно на различных гранях – в переходном слое, прилегающем к поверхности микрокристалла, образуется сильно неоднородное электрическое поле. В это поле втягиваются подвижные ионы. Если микрокристалл погружен в микрокаплю с ионными примесями, его поверхность адсорбирует подвижные ионы и таким образом оказывает на электролит в объеме микрокапли дистиллирующее действие.
При описании гетерогенного зародышеобразования в парах воды влияние ионных примесей как правило не учитывается. В то же время экспериментально установлено существенное влияние, которое оказывают различные газообразные загрязнения в атмосфере, в том числе антропогенного происхождения на активность твердокристаллических аэрозолей в качестве центров нуклеации атмосферной влаги [47]. Одно из возможных объяснений состоит в блокировке этими примесями точечных активных центров на поверхности аэрозольных частиц. Альтернативный механизм влияния может состоять в адсорбции ионных примесей поверхностью частиц вследствие поляризации водного растворителя на границе с кристаллом.
и. Поляризуемость воды в контактной области. Согласно флуктуационной теореме [23], равновесная электрическая поляризуемость однозначно связана с флуктуациями дипольного момента. Расчет поперечной ориентационной поляризуемости водной пленки, растущей на поверхности базовой грани кристалла β-AgI с катионами серебра в поверхностном слое, производился по флуктуациям нормальной составляющей ${{P}_{z}}$ дипольного момента $N$ молекул в пределах ячейки периодичности $\,{{\alpha }_{ \bot }} = {{\left( {\left\langle {P_{z}^{{2}}} \right\rangle - {{{\left\langle {{{P}_{z}}} \right\rangle }}^{2}}} \right)} \mathord{\left/ {\vphantom {{\left( {\left\langle {P_{z}^{{2}}} \right\rangle - {{{\left\langle {{{P}_{z}}} \right\rangle }}^{2}}} \right)} {N{{k}_{{\text{B}}}}T}}} \right. \kern-0em} {N{{k}_{{\text{B}}}}T}} - {{\alpha }_{{\text{w}}}}.$ С ростом пленки флуктуации и ориентационная поляризуемость в расчете на одну молекулу ${{\alpha }_{ \bot }}$ падают (рис. 9), в то время как ориентационная удельная поляризуемость невзаимодействующих диполей с дипольным моментом молекул воды ${{p}_{{\text{w}}}}$ во внешнем поле $E$ равна
(9)
$\begin{gathered} \alpha _{{\text{w}}}^{{\text{g}}} = {{k}_{{\text{B}}}}T\frac{{{{\partial }^{2}}}}{{\partial {{E}^{2}}}}\lg \left( {\int\limits_{ - 1}^1 {\exp (E} {{p}_{{\text{w}}}}x{\text{/}}{{k}_{{\text{B}}}}T)dx} \right) \approx \\ \approx \,\,\frac{{p_{{\text{w}}}^{2}}}{{3{{k}_{{\text{B}}}}T}} = 0.032\,\,{\text{н }}{{{\text{м }}}^{{\text{3}}}} \\ \end{gathered} $Рис. 9.
Электрическая восприимчивость в расчете на одну молекулу за вычетом электронной восприимчивости молекулы воды αw = 1.44 × 10–3 нм3 в поперечном направлении молекулярного слоя на поверхности базовой грани кристалла β-AgI с катионами Ag+ в поверхностном кристаллографическом слое в зависимости от количества молекул N в пределах ячейки периодичности размером 7.933 × 9.160 нм при температурах 260 K (1) и 320 K (2). Пунктир – удельная ориентационная электрическая поляризуемость идеального газа молекул воды при 260 K.
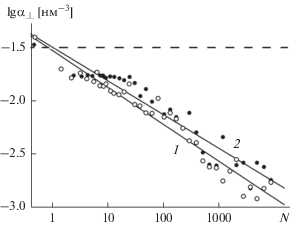
В двойном логарифмическом масштабе кривые удельной ориентационной поляризуемости в расчетном диапазоне размеров при 260 K удовлетворительно укладываются в линейную (рис. 9), а в линейном масштабе в степенную зависимость
Аппроксимационная формула (10) справедлива только в ограниченном диапазоне $N.$ В макроскопическим пределе $N \to \infty $ удельная поляризуемость должна выходить на фиксированное значение, отвечающее объемной жидкой фазе, равное
(11)
$\alpha _{{\text{w}}}^{l} = \frac{{\varepsilon _{{\text{w}}}^{l} - 1}}{{4\pi \rho _{{\text{w}}}^{l}}} \approx 2.07\,\,{\text{н }}{{{\text{м }}}^{{\text{3}}}},$Причины аномально высокой диэлектрической проницаемости воды до сих пор с определенностью не установлены. Нельзя с уверенностью утверждать, является ли измеряемое в экспериментах значение (11) чисто ориентационной поляризуемостью в ансамбле молекул со скоррелированным движением или основной вклад в нее дают квантово-механические механизмы, связанные с туннелированием протонов в водородных связях и коллективные трансформации в электронных оболочках взаимодействующих молекул.
В пользу решающей роли дальних пространственных ориентационных корреляций молекул в объемной конденсированной фазе свидетельствует чувствительность электрических свойств воды к пространственной неоднородности и частоте внешнего электрического поля в области, отвечающей характерным временам молекулярного движения, а также их неустойчивость к разрушительному действию термических возмущений: с повышением температуры на 200 K поляризуемость и диэлектрической проницаемость воды падают более чем в 2 раза [22]. С понижением температуры, усиление дальнего молекулярного порядка при кристаллизации сопровождаться для некоторых модификаций льда ускоренным ростом их поляризуемости и диэлектрической проницаемости. Чувствительность к температурным возмущениям указывает на относительно низкую энергию механизмов, обеспечивающих высокую поляризуемость воды – на порядок ниже, чем энергия внутримолекулярных связей в электронных оболочках и сравнимую с энергией межмолекулярных взаимодействий.
Из данных, приведенных на рис. 9, видно, что молекулярная пленка не обладает аномально высокой поляризуемостью, характерной для конденсированной воды. Наблюдаемая удельная поляризуемость пленки воды оказывается на порядки величины ниже $\alpha _{{\text{w}}}^{l},$ измеряемой в объемной жидкой фазе, причем с наращиванием толщины пленки она продолжает падать. Если причина высокой поляризуемости объемной фазы воды состоит в дальних корреляциях, этот результат является ожидаемым, так как в пленке нарушены соответствующие тонкие корреляционные механизмы. Присутствие твердой стенки кардинальным образом влияет на структуру воды в контактной области и является мощным возмущающим фактором.
В отличие от поляризуемости в объемной фазе, которая падает с повышением температуры, электрическая поляризуемость воды около твердой стенки с нагреванием, наоборот, растет, хотя чувствительность к вариациям температуры здесь более слабая (сравните кривые 1 и 2 на рис. 9). С учетом ослабления межмолекулярных корреляций при повышении температуры обратный температурный ход поляризуемости в контактной области, по сравнению с объемной фазой, является подтверждением того, что, в противоположность объемной фазе, межмолекулярные корреляции в контактной области оказывают на поляризуемость подавляющее, а не стимулирующее действие. Механизмы, ответственные за поляризуемость воды, здесь качественно иные.
ЗАКЛЮЧЕНИЕ
Как правило, при описании электрохимических взаимодействий кристаллических электродов с жидкими электролитами наноскопические неоднородности их поверхности в явной форме не учитывается. В то же время, при погружении поликристаллического образца в жидкость растворитель приходит в контакт не с одной, а одновременно со множеством обращенных к нему кристаллических граней. Каждая такая грань имеет свою структуру и различным образом взаимодействует с раствором, индуцируя свою молекулярную структуру и электрическую поляризацию в контактном слое. Поле формирующегося около поверхности кристалла двойного электрического слоя сильно неоднородно, а его потенциал меняет знак от одной точки на поверхности поликристалла к другой. Подвижные заряды электролита втягиваются в электрическое поле двойного слоя до тех пор, пока их электрическое поле не скомпенсирует электрическое поле двойного электрического слоя. В результате на поверхности кристалла образуется неоднородное распределение адсорбированных зарядов, которые могут вступать в соответствующие электрохимические реакции на электродах, если таковые возможны. Вследствие неоднородной поляризации растворителя различные участки электрода оказываются вовлеченными в электрохимические превращения в неравной степени: одни притягивают, а другие, наоборот, отталкивают подвижные ионы, замедляя этим их электрохимическое взаимодействие с поверхностью. Этот механизм делает работоспособность поверхности электрода зависимой от ее наноструктуры. Следует говорить об эффективной площади поверхности электрода, отличной от его геометрической поверхности.
В представленном исследовании на примере йодистого серебра, известного в качестве наиболее активного реагента, используемого для стимулирования нуклеации водяного пара при отрицательных температурах шкалы Цельсия, методом компьютерного моделирования изучены молекулярные механизмы поляризации воды в области контакта с базовой гранью кристалла и оценена величина электрического поля, возникающего вследствие поляризации водного растворителя. Прослежена эволюция электрических свойств молекулярной пленки воды на поверхности кристалла в процессе ее роста от субмонолекулярной стадии до объемной конденсированной фазы, вычислен дипольный момент и электрическая поляризуемость воды в контактной области.
Расчеты продемонстрировали возможность в классической модели жестких поляризующихся молекул воспроизвести в условиях термических флуктуаций образование в воде двойного электрического слоя с разностью потенциалов порядка одного вольта – сравнимой по величине со стандартными электрохимическими потенциалами электродов в воде. Поляризация контактного слоя происходит вследствие ориентирующего действия кристаллической поверхности на дипольные моменты молекул воды. Величина поляризации и ее направление определяются конкретной кристаллической гранью, с которой осуществляется контакт. Контактный слой представляет собой двухэтажную конструкцию. Молекулы, находящиеся в нижней и верхней плоскостях, различаются своей ориентацией. Направление поляризации контактного слоя в целом определяется молекулами, локализованными в плоскости, ближайшей к поверхности кристалла.
Пространственные ориентационные корреляции между молекулами в области контакта с кристаллом, по всей видимости, резко снижают электрическую поляризуемость воды: удельная ориентационная поляризуемость в области контакта воды с поверхностью кристалла на порядки величины меньше расчетной ориентационной поляризуемости невзаимодействующих молекул водяного пара и в расчетном диапазоне с ростом толщины пленки уменьшается. Повышение температуры сопровождается ослаблением корреляций и ростом поляризуемости.
Список литературы
Yan, J.Y. and Patey, G.N., Heterogeneous Ice Nucleation Induced by Electric Fields, J. Phys. Chem. Lett. 2011, vol. 2, no. 20, p. 2555.
Zielke, S.A., Bertram, A.K., and Patey, G.N., A Molecular Mechanism of Ice Nucleation on Model AgI Surfaces, J. Phys. Chem. B, 2015, vol. 119, no. 29, p. 9049.
Tunega, D., Gerzabek, M.H., and Lischka, H., Ab initio Molecular Dynamics Study of a Monomolecular Water Layer on Octahedral and Tetrahedral Kaolinite Surfaces, J. Phys. Chem. B, 2004, vol. 108, no. 19, p. 5930.
Zielke, S.A., Bertram, A.K., and Patey, G.N., Simulations of Ice Nucleation by Kaolinite (001) with Rigid and Flexible Surfaces, J. Phys. Chem. B, 2016, vol. 120, no. 8, p. 1726.
Lupi, L., Hudait, A., and Molinero, V., Heterogeneous Nucleation of Ice on Carbon Surfaces, J. Am. Chem. Soc., 2014, vol. 136, no. 8, p. 3156.
Singh, J. and Muller-Plathe, F., On the Characterization of Crystallization and Ice Adhesion on Smooth and Rough Surfaces Using Molecular Dynamics, Appl. Phys. Lett., 2014, vol. 104, p. 021603.
Zhang, X.X., Lu, Y.J., and Chen, M., Crystallisation of Ice in Charged Pt Nanochannel, Mol. Phys. 2013, vol. 111, no. 24, p. 3808.
Lupi, L. and Molinero, V., Does Hydrophilicity of Carbon Particles Improve Their Ice Nucleation Ability? J. Phys. Chem. A, 2014, vol. 118, no. 35, p. 7330.
Moore, E.B., de la Llave, E., Welke, K., Scherlis, D.A., and Molinero V., Freezing, Melting and Structure of Ice in a Hydrophilic Nanopore, Phys.Chem. Chem. Phys., 2010, vol. 12, no. 16, p. 4124.
Bi, Y., Cabriolu, R., and Li, T., Heterogeneous Ice Nucleation Controlled by the Coupling of Surface Crystallinity and Surface Hydrophilicity, J. Phys. Chem. C, 2016, vol. 120, no. 3, p. 1507.
Zielke, S.A., Bertram, A.K., and Patey, G.N., Simulations of Ice Nucleation by Model AgI Disks and Plates, J. Phys. Chem. B, 2016, vol. 120, no. 9, p. 2291.
Argyris, D., Tummala, N.R., Striolo, A., and Cole, D.R., Molecular Structure and Dynamics in Thin Water Films at the Silica and Graphite Surfaces, J. Phys. Chem. C, 2008, vol. 112, no. 35, p. 13587.
Wang, J., Kalinichev, A.G., and Kirkpatrick, R.J., Effects of Substrate Structure and Composition on the Structure, Dynamics, and Energetics of Water at Mineral Surfaces: A Molecular Dynamics Modeling Study, Geochim. Cosmochim. Acta, 2006, vol. 70, no. 3, p. 562.
Zeitler, T.R., Greathouse, J.A., and Cygan, R.T., Effects of Thermodynamic Ensembles and Mineral Surfaces on Interfacial Water Structure, Phys. Chem. Chem. Phys., 2012, vol. 14, no. 5, p. 1728.
Terranovaand, U. and de Leeuw, N.H. Structure and Dynamics of Water at the Mackinawite (001) Surface, J. Chem. Phys. 2016, vol. 144, p. 094706.
Краткий справочник физико-химических величин, под редакцией Мищенко, К.П. и Равделя, А.А., Седьмое издание. Л.: Химия, 1974, 200 с. [A brief guide to physico-chemical quantities, edited by Mi-shchenko, K.P. and Ravdel, A.A., Seventh Edition. Leningrad, Chemistry, 1974, 200 p.]
Дамаскин, Б.Б. О втягивании катионов в плотную часть двойного слоя на границе Hg/H2O из 1 М растворов KCl и KNO3. Электрохимия. 2011. Т. 47. № 3. С. 259. [Damaskin, B.B., Drawing Cations into the Dense Part of the Double Layer on the HG/H2O Interface in 1 M Solutions of KCl and KNO3, Russ. J. Electrochemistry, 2011, vol. 47, no. 3, p. 241.]
Алишахи, М., Камали, Р., Абуали, О. Исследование двойного электрического слоя в наноразмерных каналах методом молекулярной динамики. Электрохимия. 2015. Т. 51. № 1. С. 58. [Alishahi, M., Kamali, R., and Abouali, O., Molecular Dynamics Study of Electric Double Layer in Nanochannel, Russ. J. Electrochemistry, 2015, vol. 51, no. 1, p. 49.]
Емец, В.В., Мельников, А.А., Дамаскин, Б.Б. Двойной электрический слой в растворе поверхностно-неактивного электролита и адсорбция галогенид-ионов из 0.1 М растворов на жидких сплавах Cd–Ga и In–Ga в гамма-бутиролактоне. Электрохимия. 2016. Т. 52. № 1. С. 10. [Emets, V.V., Mel’nikov, A.A., and Damaskin, B.B., Electrical Double Layer in Surface-inactive Electrolyte Solution and Adsorption of Halide Ions From 0.1 M Solutions on Liquid Cd–Ga and In–Ga Alloys in Gamma-Butyrolactone, Russ. J. Electrochemistry, 2016, vol. 52, no. 1, p. 7.]
Емец, В.В., Мельников, А.А., Дамаскин, Б.Б. Двойной электрический слой на жидком обновляющемся (Cd–Ga)-электроде в диметилформамидных растворах. Электрохимия. 2017. Т. 53. № 2. С. 131. [Emets, V.V., Mel’nikov, A.A., and Damaskin, B.B. Electric Double Layer on Renewable Liquid (Cd–Ga) Electrode in Dimethylformamide Solutions, Russ. J. Electrochemistry, 2017, vol. 53, no. 2, С. 117.]
Компан, М.Е., Малышкин, В.Г., Кузнецов, В.П., Кривченко, В.А, Черник, Г.Г. О накоплении энергии в двойном слое на поверхности материалов с малой плотностью электронных состояний. Электрохимия. 2017. Т. 53. № 6. С. 636. [Kompan, M.E., Malyshkin, V.G., Kuznetsov, V.P., Krivchenko, V.A., and Chernik, G.G., On Energy Accumulation in Double Layer on the Surface of Materials With Low Electron State Density, Russ. J. Electrochemistry, 2017, vol. 53, no. 6, p. 561.]
Справочник химика, т. 1, Из-во “Химия”, Москва–Ленинград, под ред. Никольского, Б.П., 1966, 1071 с. [Chemist Handbook, v.1, Chemistry, Moscow–Leningrad, ed. Nikolsky, B.P., 1966, 1071 p.]
Хилл, Т. Статистическая механика. М.: ИЛ. 1960. 432 с. [Hill, T.L., Statistical Mechanics: Principles and Selected Applications, New-York, McGraw-Hill, 1956, 420 p.]
Aragones, J.L., MacDowell, L.G., and Vega, C., Dielectric Constant of Ices and Water: A Lesson about Water Interactions, J. Phys. Chem. A, 2011, vol. 115, no. 23, p. 5745.
Schoenherr, M., Slater, B., Hutter, J., and Vande Vondele, J., Dielectric Properties of Water Ice, the Ice Ih/XI Phase Transition, and an Assessment of Density Functional Theory, J. Phys. Chem. B, 2014, vol. 118, no. 2, p. 590.
Hobbs, M.E., Jhon, M.Sh., and Eyring, H., The Dielectric Constant of Liquid Water and Various Forms of Ice According to Significant Structure Theory, Proceedings of the National Academy of Sciences of the USA, 1966, vol. 56, no. 1, p. 31.
Dengel, O., Eckener U., Plitz H., and Riehl N., Ferroelectric Behaviour of Ice, Phys. Letters, 1964, vol. 9, no. 4, p. 291.
Jackson, S.M. and Whitworth, R.W., Evidence for Ferroelectric Ordering of Ice Ih, J. Chem. Phys. 1995, vol. 103, no. 17, p. 7647.
Rusiniak, L., Electric properties of Ice near Solidification and Melting Temperature, Acta Geophysica Polonica, 2004, vol. 52, no. 3, p. 363.
Wyckoff, R.W.G., Crystal structures, New York, Intersc. publ., 1965, vol. 1, p. 110.
Биндер, К., Хеерман, Д.В. Моделирование методом Монте-Карло в статистической физике, М.: Наука. Физматлит. 1995. 144 с. [Binder, K. and Heermann, D., Monte Carlo Simulation in Statistical Physics, Springer-Verlag Berlin Heidelberg, 1997, 202 p.]
Шевкунов, С.В. Гидратная оболочка иона Cl– в плоской нанопоре. Термодинамическая устойчивость. Электрохимия. 2014. Т. 50. № 12. С. 1260. [Shevkunov, S.V., The Hydrate Shell of a Cl– Ion in a Planar Nanopore, Structure, Russ. J. Electrochemistry, 2014, vol. 50, no. 12, p. 1118.]
Шевкунов, С.В. Структурный переход в кластере OH–(H2O)n в парах воды. Коллоид. журн. 2008. Т. 70. № 6. С. 837. [Shevkunov, S.V., Structural Transition in the OH–(H2O)n Cluster in Water Vapors, Colloid J., 2008, vol. 70, no. 6, p. 784.]
Шевкунов, С.В. Разделение зарядов в кластерах молекул воды в условиях термических флуктуаций. 2. Ионизационно-рекомбинационное равновесие. Коллоид. журн. 2008. Т. 70. № 5. С. 694. [Shevkunov, S.V., Charge Separation in Water Molecule Clusters under Thermal Fluctuations: 2. Ionization-Recombination Equilibrium, Colloid J., 2008, vol. 70, no. 5, p. 646.]
Шевкунов, С.В. Гидратация иона Сl– в плоской нанопоре с гидрофильными стенками. 2. Термодинамическая устойчивость. Коллоид. журн. 2016. Т. 78. № 1. С. 124. [Shevkunov, S.V., Hydration of Cl– Ion in a Planar Nanopore with Hydrophilic Walls.1. Molecular Structure, Colloid J., 2016, vol. 78, no. 1, p. 121.].
Шевкунов, С.В. Компьютерное моделирование нуклеации паров воды на электронейтральных наночастицах. Журнал экспериментальной и теоретической физики. 2009. Т. 135. № 3. С. 510. [Shevkunov, S.V., Numerical Simulation of Water Vapor Nucleation on Electrically Neutral Nanoparticles, J. Experimental and Theoretical Physics, 2009, vol. 108, no. 3, p. 447.]
Шевкунов, С.В. Компьютерное моделирование начальной стадии нуклеации водяного пара на кристаллической поверхности йодистого серебра. 1. Микроструктура. Коллоид. журн. 2005. Т. 67. № 4. С. 548. [Shevkunov, S.V., Computer Simulation of the Initial Stage of the Nucleation of Water Vapors on the Silver Iodide Crystal Surface: 1.Microstructure, 2005, Colloid J., vol. 67, no. 4, p. 497.]
Шевкунов, С.В. Формирование переходного слоя на границе пара с кристаллом. Доклады РАН. 2005. Т. 402. № 1. С. 41. [Shevkunov, S.V., Formation of the Transition Layer at the Vapor-Crystal Interface, Doklady Physics, 2005, vol. 50, no. 5, p. 234.]
Hale, B.N. and Kiefer, J., Studies of H2O on β-AgI surfaces: An Effective Pair Potential Model, J. Chem. Phys. 1980, vol. 73, no. 2, p. 923.
Шевкунов, С.В. Компьютерное моделирование диссоциативного равновесия в водном электролите NaCl с учетом поляризации и перезарядки ионов. 1. Модель взаимодействий. Электрохимия. 2013. Т. 49. № 3. С. 255. [Shevkunov, S.V., Computer Simulation of Dissociative Equilibrium in Aqueous NaCl Electrolyte with Account for Polarization and Ion Recharging. Model of Interactions, Russ. J. Electrochemistry, 2013, vol. 49, no. 3, p. 228.]
Шевкунов, С.В. Компьютерное моделирование диссоциативного равновесия в водном электролите NaCl с учетом поляризации и перезарядки ионов. 2. Механизм ионизации. Электрохимия. 2013. Т. 49. № 3. С. 266. [Shevkunov, S.V., Computer Simulation of Dissociative Equilibrium in Aqueous NaCl electrolyte with Account for Polarization and Ion Recharging. Ionization Mechanism, Russ. J. Electrochemistry, 2013, vol. 49, no. 3, p. 238.]
Замалин, В.М., Норман, Г.Э., Филинов, В.С. Метод Монте-Карло в статистической термодинамике, М.: Наука, 1977. [Zamalin, V.M., Norman, G.E., Filinov, V.S., Monte-Carlo Method in Statistical Thermodynamics, Moscow, Nauka, 1977.]
Шевкунов, С.В. Взаимодействие молекул воды с электрическим полем поверхности ионного кристалла. Электрохимия. 2006. Т. 42. № 1. С. 10. [Shevkunov, S.V., Interaction of Water Molecules with the Electric Field of an Ionic-Crystal Surface, Russ. J. Electrochemistry, 2006, vol. 42, no. 1, p. 8.]
Шевкунов, С.В. Стимулирование нуклеации пара на идеальной и дефектной кристаллических поверхностях с гексагональной структурой. Журнал экспериментальной и теоретической физики. 2008. Т. 134. № 6. С. 1130. [Shevkunov, S.V., Stimulation of Vapor Nucleation on Perfect and Imperfect Hexagonal Lattice Surfaces, J. Experimental and Theoretical Physics, 2008, vol. 107, no. 6, p. 965.]
Wang, Ch., Lu, H., Wang, Zh., Xiu, P., Zhou, B., Zuo, G., Wan, R., Hu, J., and Fang, H., Stable Liquid Water Droplet on a Water Monolayer Formed at Room Temperature on Ionic Model Substrates, Phys. Rev. Lett. 2009, vol. 103, p. 137801.
Шевкунов, С.В. Компьютерное моделирование послойной адсорбции молекул воды на поверхности кристалла йодида серебра. Журн. физ. химии. 2006. Т. 80. № 5. С. 884. [Shevkunov, S.V., Layer-by-Layer Adsorption of Water Molecules on the Surface of a Silver iodide Crystal, Russ. J. Phys. Chem., 2006, vol. 80, no. 5, p. 769.]
Паршуткина, И.П., Чурилова, И.Л., Плауде, Н.О., Гришина, Н.П. Исследование влияния некоторых промышленных газов на эффективность штатного льдообразующего пиросостава с йодистым серебром, Физика облаков и активных воздействий, под ред. Плауде, Н.О., Труды Центральной аэрологической обсерватории, вып. 181, С. 69, Санкт-Петербург, Гидрометеоиздат, 1996. [Parshutkina, I.P., Churilova, I.L., Plaude, N.O., and Grishina, NP, Investigation of the Effect of Certain Industrial Gases on the Efficiency of the Regular Ice-Forming Pyrodynamic Compound with Silver Iodide, Cloud Physics and Active Impacts, ed. Plaude, N.O., Proceedings of the Central Aerological Observatory, vol. 181, p. 69, St. Petersburg, Gidrometeoizdat, 1996.]
Шевкунов, С.В. Структура и электрические свойства гидратной оболочки однозарядного иона хлора в нанопоре с гидрофильными стенками. Электрохимия. 2016. Т. 52. № 5. С. 451. [Shevkunov, S.V., Structure and Electric Properties of the Hydration Shell of a Singly Charged Chloride Ion in a Nanopore with Hydrophilic Walls, Russ. J. Electrochemistry, 2016, vol. 52, no. 5, p. 397.]
Шевкунов, С.В. Структура и электрические свойства гидратной оболочки однозарядного иона натрия в нанопоре с гидрофильными стенками. Электрохимия. 2016. Т. 52. № 9. С. 1022. [Shevkunov, S.V., Structure and Electric Properties of Sodium Ion Hydrate Shell in Nanopore with Hydrophilic Walls, Russ. J. Electrochemistry, 2016, vol. 92, no. 9, p. 910.]
Шевкунов, С.В. Ионные пары в микрокаплях водного электролита в условиях плоской нанопоры. Электрохимия. 2016. Т. 52. № 11. С. 1193. [Shevku-nov, S.V., Ion Pairs in Aqueous Electrolyte Microdrops under Conditions of a Flat Nanopore, Russ. J. Electrochemistry, 2016, vol. 52, no. 11, p. 1064.]
Шевкунов, С.В. Устойчивость гидратированных ионных пар Na + Cl–(H2O)n к высоким температурам в условиях плоской нанопоры. Электрохимия. 2018. Т. 54. № 2. С. 175. [Shevkunov, S.V., High Temperature Stability of Hydrated Ion Pairs Na + Cl–(H2O)n under Conditions of a Flat Nanopore, Russ. J. Electrochemistry, 2018, vol. 54, no. 2, p. 153.]
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия