Электрохимия, 2019, T. 55, № 3, стр. 373-378
Обнаружение образования капель воды в масле в межфазной области на границе раздела воды и 1,2-дихлорэтана с применением измерений переходного импеданса в ячейке на одной высокой частоте
Барри Р. Силвер *
Отделение биофизической химии, Институт физической химии им. Я. Гейровского
Чешской Академии наук (государственное научно-исследовательское учреждение)
182 23 Прага 8, Долейшкова 2155/3, Чехия
* E-mail: barry.silver@jh-inst.cas.cz
Поступила в редакцию 16.07.2018
После доработки 10.10.2018
Принята к публикации 20.10.2018
Аннотация
Исследовано обнаружение образования капель воды в масле (в/м) в межфазной области на границе раздела воды и 1,2-DCE с применением измерения переходного импеданса в нетрадиционной электрохимической ячейке. Образование капель вызывает значительное пикообразное увеличение действительной составляющей импеданса ячейки. Вероятной причиной пиков является существенное уменьшение концентрации ионов в межфазной области за счет образования содержащих электролит капель в/м. Образование капель и сопровождающую межфазную устойчивость наблюдали при смешивании антагонистических солей (содержащих гидрофобный ион, у которого $\Delta G_{{{\text{п е р }}}}^{{^\circ ,\,{\text{в о д а }} \to {\text{1,2 - DCE}}}}$ ≤ TBA+) с традиционными водными электролитами в водной фазе. Неустойчивость проявляется как конвекция Марангони, вызывая быстрый массоперенос в прилегающей жидкости по обеим сторонам границы раздела двух жидких фаз.
ВВЕДЕНИЕ
В недавней статье автором продемонстрировано, что границы раздела двух жидких фаз с общим ионом, распределенным между обеими фазами, может претерпевать самопроизвольное эмульгирование [1]. Эмульгирование производит в больших количествах субмикронные капли воды, содержащие водную фазу электролита внутри масляной фазы (в/м). Растворимые в воде электролиты, содержащие как гидрофобные, так и гидрофильные ионы, такие как, например, хлорид тетрафениларсония (TPhAsCl), называются “антагонистическими солями”. Структурообразование на границе раздела двух жидких фаз за счет антагонистических солей в последнее время вызывает определенный интерес [2–4].
Измерение переходного импеданса в нетрадиционной электрохимической ячейке, содержащей две жидкости, на одной высокой частоте демонстрирует образование капель в/м в межфазной области между двумя несмешивающимися жидкостями, состоящими из водной фазы (содержащей электролит) и органической фазой 1,2‑дихлорэтана (1,2-DCE), в которой первоначально отсутствует электролит.
Образование капель в/м связано с явлением самопроизвольного эмульгирования, ранее описанного в литературе [1, 5]. По существу, при этом, вероятно, происходит внедрение электролита водной фазы в капли в/м. При этом наблюдается межфазная неустойчивость, сопровождающая образование капель в/м. Эта неустойчивость кратко обсуждается далее.
МАТЕРИАЛЫ И МЕТОДЫ
Химические реагенты
Высокочистая деионизированная (DI) вода, имеющая проводимость менее 0.1 мкСм/см и полученная с помощью системы от компании GORO (Чехия) была использована для приготовления водных растворов. 1,2-Дихлорэтан (1,2‑DCE, 99%) от компании Fluka Analytical (Чехия) использовали для приготовления органических растворов. Хлорид тетрафениларсония (TPhAsCl) полярографической чистоты получен от компании Fluka (Чехия). Хлорид лития (LiCl), хлорид цинка(II) (ZnCl2), хлорид кадмия(II) (CdCl2), хлорид меди(II) (CuCl2) и хлорид свинца(II) (PbCl2), имеющие чистоту более 99%, получены от компании Sigma Aldrich (Чехия). Хлорид тетрапентиламмония (TPentACl), имеющий чистоту более 98%, получен от компании Fluka (Чехия). Нитрат калия (KNO3) получен от компании LaChem (Чехия).
Измерения переходного импеданса
Равновесие между 1,2-DCE и деионизированной водой устанавливали в течение, по меньшей мере, 2 сут перед использованием в экспериментах. Порцию 1,2-DCE (1 мл), не содержащую электролита, помещали с помощью пипетки в чистую U-образную стеклянную пробирку (внутренний диаметр 6 мм). Равные объемы (860 мкл) деионизированной воды медленно наносили с помощью пипетки поверх и на каждую сторону органическую фазу в сосуде. Несколько лишних капель воды (помимо 860 мкл) добавляли с каждой стороны, позволяя водной фазе перетекать через края стеклянной ячейки.
Перетекание позволяет удалять в виде слива остаточный 1,2-DCE на поверхности водной фазы. Водную фазу доводили до ее первоначального объема посредством промокания уровня мениска на каждой стороне стеклянной ячейки. Половину объема (430 мкл) деионизированной воды затем удаляли с обеих сторон. После этого аликвоту электролита (объем 430 мкл) вводили с обеих сторон через 60 с после начала эксперимента.
Два провода Ag/AgCl использовали в качестве электродов в водной фазе. Экспериментальная конструкция представляла собой почти симметричную электрохимическую ячейку типа Ag/AgCl/водная фаза (с электролитом) // 1,2-DCE (без электролита) // водная фаза (с электролитом)/AgCl/Ag.
Состав водной фазы, используемой в экспериментах, приведен в тексте. Переходный импеданс ячейки при 0 В постоянного тока непрерывно измеряли при одной частоте (10 кГц), используя потенциостат CHI660C (CHI Instruments) с амплитудой возмущения 20 мВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При измерении переходных изменений в полном импедансе ячейки (ZT на рис. 1) значительное уменьшение ZT наблюдали только в том случае, когда в водную фазу вводили TPhAs+ (в форме TPhAsCl). Скорость уменьшения ZT возрастает при смешивании TPhAs+ в присутствии хлоридов различных двухвалентных металлов. Скорость уменьшения ZT зависит от катиона в присутствии TPhAs+. Все исследования с TPhAs, независимо от присутствия хлорида металла, продемонстрировали приблизительно одинаковое значение ZT примерно через 2 ч. Важно отметить, что контрольные эксперименты (где присутствовали только хлориды тяжелых металлов и/или щелочных металлов) не показали переходного уменьшения ZT. Переходное уменьшение ZT вызвано проводимостью в органической фазе за счет введения ионов через границу раздела двух жидких фаз из водной фазы. Отсутствие введения ионов в органическую фазу приводит к тому, что в ZT начинает доминировать значительная независимая от времени мнимая составляющая импеданса (приблизительно равная 7 МОм (рис. 1), согласно контрольным экспериментам).
Рис. 1.
Переходные изменения ZT для электрохимических ячеек типа Ag/AgCl/водная фаза//чистый 1,2‑DCE (без электролита) // водная фаза/AgCl/Ag. Водные фазы имеют обозначения (например, Zn, Cd, Pb, TPhAsCl), что соответствует 10 мМ TPhAsCl + + y мМ XCl2 во всех случаях. XCl2 означает присутствие хлорида двухвалентного металла при y = 2.5 мМ. Эксперимент, обозначенный “TPhAsCl”, представлял собой водную фазу, содержащую только 10 мМ TPhAsCl. Водные фазы в контрольных экспериментах обозначены как использованные. Экспериментальные условия представлены в тексте. Ось времени имеет логарифмический масштаб и ограничена моментом времени (60 с), первого введения электролита водной фазы в ячейку.
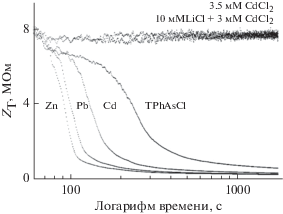
Данные показывают значительный пик действительной составляющей переходного импеданса (ZR) в начале экспериментов. Пик возникает через несколько сот секунд после введения электролита. Время до вершины пика зависит от состава введенной водной фазы, а также от катиона металла. Значение ZR увеличивалось от приблизительно 10 кОм (непосредственно после введения электролита) до приблизительно 3 МОм при вершине. После пика происходило значительное уменьшение ZR (до приблизительно 50 кОм). Контрольные эксперименты не показали пикообразного поведения ZR (рис. 2).
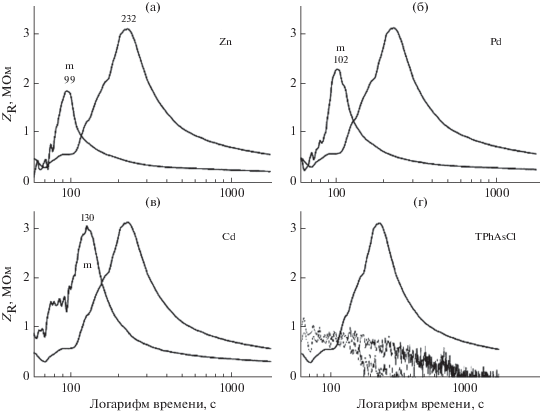
Рис. 2.
Переходная действительная составляющая (ZR) для того же эксперимента, который представлен на рис. 1. Добавка, обозначенная TPhAsCl, содержала только 10 мМ TPhAsCl. На каждом изображении сопоставлены эксперименты с содержанием металла (обозначенные нижним индексом “m” и верхним правым символом элемента) и отсутствием металла (чистый TPhAsCl). Числа, приведенные над пиками, обозначают время пиков в секундах от t = 0 с. Изображение (2 г) представляет добавку, не содержащую металла, в сопоставлении с контрольными экспериментами (3.5 мМ CdCl2 и 3.5 мМ CdCl2 + 10 мМ LiCl, согласно рис. 1). Ось времени имеет логарифмический масштаб и ограничена моментом времени (60 с) первого введения электролита в водную фазу. Значение ZR на изображении (4г) для контрольных экспериментов падает ниже нуля вследствие шкалы тока, начинающейся при t = 0 с. Графики сглажены для ясности с применением фильтра Савицкого–Голея.
Для доказательства того, что пик не представлял собой приборный артефакт, вызванный резонансом между электрохимической ячейкой и паразитной индуктивностью прибора, измеряли паразитную индуктивность всей установки. Последовательную паразитную индуктивность измеряли методом спектроскопии импеданса на испытательных цепях (приблизительно 1 мГн). Небольшая параллельная паразитная индуктивность, составляющая по оценке приблизительно 2 мкГн, была обусловлена близостью выводов рабочего электрода и противоэлектрода/электрода сравнения (приблизительно 3 см).
Последовательная паразитная индуктивность (реактивное сопротивление 63 Ом при 10 кГц) наблюдается только при низком импедансе ячейки (≈<20 кОм). Резонанс между приборной паразитной индуктивностью в последовательном соединении с электрохимической ячейкой должен приводить к нулевому фазовому углу (при резонансе). При резонансе можно также ожидать увеличения синфазного переменного тока внутри фазы. Однако пик ZR (эксперимент) возникает, когда фазовый угол составляет 45 град (без исключения). Кроме того, область до пика характеризуется значительным уменьшением синфазного переменного тока.
Переходный фазовый угол показывает плавный и непрерывный сигмоидальный переход от 90 град (в начале эксперимента) до 0 град (в конце эксперимента). В качестве альтернативы, параллельный резонанс между паразитной емкостью (8 пФ [6]), переходной емкостью ячейки и приборной паразитной индуктивностью не происходит при 10 кГц.
При проведении традиционной спектроскопии импеданса у фактического пика (или при совпадении ZR с фазовым сдвигом 45) в диапазоне частот от 100 кГц до 100 Гц (данные не показаны) получали плавный полукруг на диаграмме Найквиста. Мнимая составляющая импеданса не пересекает ось действительных значений во всем диапазоне частот. Искусственные пики ZR не могут быть воспроизведены с применением испытательных схем, состоящих из физических резисторов и конденсаторов (данные не показаны). Пики ZR также отсутствуют во всех контрольных экспериментах (см. дополнительный раздел). Таким образом, необходимо сделать вывод, что наблюдаемые пики ZR не представляют собой приборный артефакт.
Преобразование ZR в переменный ток дает переходный синфазный переменный ток в схеме. Рисунок 3 показывает, что переменный ток до и после пика линейно зависит от $\frac{1}{{\sqrt {\pi t} }},$ показывая, что процесс определяется диффузией. Градиенты прямолинейных аппроксимаций к эксперименту представлены в табл. 1. Область до пика показывает присутствие зависимого от катиона металла градиента, область после пика является приблизительно одинаковой (для всех добавок) и не зависит от катиона металла.
Рис. 3.
Преобразование ZR в переменный ток показывает управляемый диффузией режим до и после пика ZR. Изображение (3а) представляет части графика, которые наблюдаются после пика. Изображение (3б) представляет части графика до и после пика ZR для условий двух экспериментов. Обозначение элементов на изображениях относится к добавлению 2.5 мМ хлорида двухвалентного металла с 10 мМ TPhAsCl в водной фазе. “TPhAsCl” представляет собой водную фазу без добавления хлорида двухвалентного металла. Толстые линии на графиках представляют собой прямолинейные аппроксимации экспериментальных данных. Числа, приведенные сбоку графиков на изображении (4б), означают градиент линейной аппроксимации данных. Отрезок штриховой вертикальной линии, приблизительно разделяющий области графика на изображении (4б), представляет части графика, которые наблюдаются до или после пика ZR. По соображениям визуальной ясности на изображении (4б) представлены только два графика.
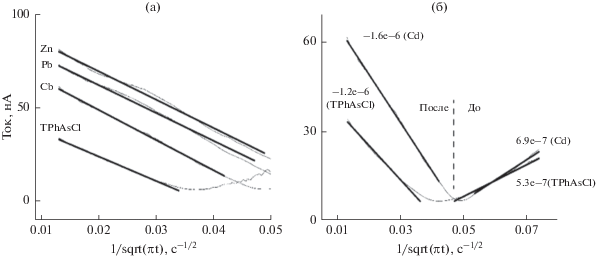
Таблица 1.
Градиенты прямолинейных аппроксимаций данных, представленных на рис. 3. Эксперименты, обозначенные символами элементов, относятся к экспериментам, в которых присутствовал хлорид двухвалентного металла в концентрации 2.5 мМ в сочетанием с 10 мМ TPhAsCl в водной фазе. “TPhAsCl” означает эксперимент, в котором водная фаза содержала только 10 мМ TPhAsCl
| Zn | Pb | Cd | TPhAsCl | |
|---|---|---|---|---|
| Градиент до пика | 6.2e–6 | 2.7e–6 | 6.9e–7 | 5.3e–7 |
| Градиент после пика | –1.5e–6 | –1.5e–6 | –1.6e–6 | –1.32e–6 |
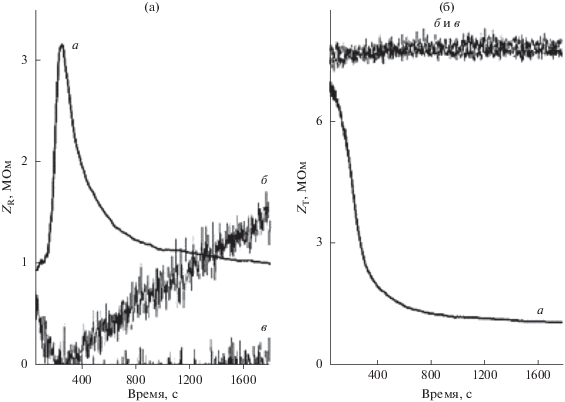
Пик ZR не является специфическим для сочетания TPhAs+ и хлорида двухвалентного металла (см. дополнительный раздел). Пик ZR также не является специфическим для TPhAs+. Пик может также возникать, когда TPhAs+ находится в присутствии других водных электролитов, таких как KCl (рис. 4). Пик ZR может быть также вызван сочетаниями 10 мМ хлорида тетрапентиламмония и переменной концентрации LiCl (см. дополнительный раздел). В этом случае пик проявляет зависимость от концентрации в том, что высота пика и положение пика во времени зависит от концентрации LiCl. Обнаружено, что пик возникает, когда в присутствии 10 мМ хлорида тетрапентиламмония находятся другие водные электролиты, такие как KNO3, K2SO4, Li2SO4 и MgSO4 (при 62.5 мМ). Важно отметить, что в контрольных экспериментах снова не продемонстрировано свидетельство переходного пикообразного поведения.
Рис. 4.
Пик ZR (рис. 4а) и значительное уменьшение переходного ZT (рис. 4б) наблюдаются, когда TPhAsCl находится в присутствии традиционного водного электролита. Состав водной фазы для a представлял собой 1.25 мМ TPhAsCl + + 62.5 мМ KCl. Изображения б и в представляют собой контрольные эксперименты с применением только 1.25 мМ TPhAsCl (б) и 62.5 мМ KCl (в) соответственно.
Для дополнительного доказательства того, что причиной пика ZR не являются нелинейные артефакты, возникающие от членов высшего порядка вследствие амплитуды сигнала возмущения, амплитуда возмущения снижалась до 5 и до 10 мВ. Однако пики ZR все же наблюдались при меньших амплитудах возмущения (данные не представлены).
Пики ZR могут также возникать в случае других сочетаний водного электролита, содержащего хлорид и катион тетраалкиламмония, такого как, например, катион тетрабутиламмония (TBA+)/KCl (см. дополнительный раздел).
Важно отметить, что четко определенный пик не был обнаружен, когда в водной фазе смешивали 10 мМ хлорида тетраэтиламмония и 62.5 мМ KCl. Это может свидетельствовать, что пик может возникать только в том случае, когда гидрофобные ионы антагонистической соли (стандартная энергия Гиббса ($\Delta G_{{{\text{п е р }}}}^{{^\circ ,\,{\text{в о д а }} \to {\text{1,2 - DCE}}}}$) переноса иона из воды в 1,2-DCE) являются равными или меньшими, чем в случае присутствия TBA+ в водном электролите (см. дополнительный раздел).
Хаотическую межфазную неустойчивость наблюдали (см. видеоматериалы в дополнительном разделе), когда антагонистическую соль (10 мМ TPhAsCl) смешивали с водным электролитом (62.5 мМ LiCl) в водной фазе. В этом случае на ячейку не воздействовал никакой внешний электрический сигнал. Неустойчивость проявляется как конвекция Марангони, вызывая быстрый массоперенос в окружающей жидкости по обеим сторонам границы раздела двух жидких фаз. Конвекцию Марангони вызывали большие, но локализованные изменения поверхностного натяжения. В свою очередь, локализованные изменения поверхностного натяжения были вызваны локализованными изменениями поверхностной концентрации при межфазном образовании капель в/м, содержащих электролит. Межфазная неустойчивость возникает немедленно после смешивания антагонистической соли и водного электролита в водной фазе.
Хорошо известно, что проводимость раствора зависит от двух основных факторов. Первый представляет собой способность ионов в растворе реагировать на приложенное электрическое поле. Второй представляет собой концентрацию ионов в растворе [7]. Капли в/м (содержащие электролит) должны иметь значительно меньшую подвижность (вследствие увеличенного размера [1]). Образование капель, приводящее к “поглощению ионов в каплях” может также существенно снижать концентрацию ионов в межфазной области. Таким образом, сочетание эффектов низкой подвижности и уменьшенной концентрации ионов в межфазной области может приводить к пикоообразному уменьшению проводимости или к пикоообразному увеличению действительной составляющей импеданса, наблюдаемой в экспериментах.
Независимые от природы металла наклоны, наблюдаемые после пика (рис. 3), могут быть вызваны медленным массопереносом электролита, содержащего капли в/м, в объем органической фазы, поскольку эти наклоны являются одинаковыми для всех добавок и показывают очень низкие скорости диффузии.
ВЫВОДЫ
Образование капель в/м в межфазной области на границе раздела между водной фазой и 1,2‑DCE обнаружено с применением измерений переходного импеданса, проводимых на одной высокой частоте в нетрадиционной электрохимической ячейке. Нетрадиционная ячейка содержит органическую фазу, в которой первоначально отсутствует электролиты. Результаты показывают, что образование содержащих электролит капель в/м вызывает значительный пик действительной составляющей переходного импеданса. Образование капель в межфазной области легко происходит, когда гидрофобные ионы антагонистической соли ($\Delta G_{{{\text{п е р }}}}^{{^\circ ,\,{\text{в о д а }} \to {\text{1,2 - DCE}}}}$ ≤ TBA+) смешивают с традиционными водными электролитами в водной фазе.
Межфазную неустойчивость, сопровождающую образование капель, наблюдали при смешивании антагонистической соли с водным электролитом в водной фазе ячейки. Неустойчивость проявляется как конвекция Марангони по обеим сторонам границы раздела двух жидких фаз, приводя к быстрому массопереносу в прилагающих жидкостях. Вероятной причиной межфазной неустойчивости является образование содержащих электролит капель в/м в межфазной области. В отношении этого важного аспекта требуются дополнительные исследования.
Список литературы
Silver, B.R., Holub, K., and Mareček, V., Spontaneous emulsification at surfactantless liquid/liquid interfaces, Electroanalyt. Chem. 2017, vol. 805, p. 91.
Sadakane, K., Onuki, A., Nishida, K., Koizumi, S., and Seto, H., Multilamellar structures induced by hydrophilic and hydrophobic ions added to a binary mixture of D2O and 3-methylpyridine. Phys. rev. letters, 2009, vol. 103 (16), p. 167803.
Sadakane, K. and Seto, H., Membrane formation in liquids by adding an antagonistic salt, Frontiers in Phys. 2018, vol. 6, p. 26.
Onuki, A., Yabunaka, S., Araki, T., and Okamoto, R., Structure formation due to antagonistic salts. Current Opinion in Colloid & Interface Science, 2016, vol. 22, p. 59.
Mareček, V., Electrochemical monitoring of the co-extraction of water with hydrated ions into an organic solvent. Electrochemistry Communications, 2018, vol. 88, p. 57.
Silver, B.R., Holub, K., and Mareček, V., Ion transfer kinetics at the micro-interface between two immiscible electrolyte solutions investigated by electrochemical impedance spectroscopy and steady-state voltammetry. J. Electroanal. Chemis., 2014, vol. 731, p. 107.
Bard, A.J., Faulkner, L.R., Leddy, J., and Zoski, C.G., Electrochemical methods: fundamentals and applications. N.Y. Wiley: 1980, Vol. 2.
Дополнительные материалы отсутствуют.


