Электрохимия, 2019, T. 55, № 4, стр. 406-413
Микро-мезопористый углеродный материал, полученный из стеблей борщевика (Heracleum), как электродный материал для суперконденсаторов
Ф. С. Табаров a, *, М. В. Астахов a, А. Т. Калашник a, А. А. Климонт a, **, И. С. Кречетов a, Н. В. Исаева b
a Национальный исследовательский технологический университет “МИСиС” НИТУ, Кафедра физической химии
119991 Москва, Ленинский просп., 6, Россия
b Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский просп., 49, Россия
* E-mail: fantotsi.0104@mail.ru
** E-mail: nklimont@gmail.com
Поступила в редакцию 06.08.2018
После доработки 12.10.2018
Принята к публикации 07.11.2018
Аннотация
В работе представлены данные по исследованию карбонизации и поверхностной активации борщевика (Heracleum). Изучены структурные и электрохимические свойства полученных углеродных материалов, которые могут быть использованы в качестве электродных материалов для суперконденсаторов. Образцы борщевика предварительно подвергали карбонизации при 400°С, а затем активировали гидроксидом калия (КОН) при температурах 700, 800 и 900°С в атмосфере аргона. Согласно данным изотерм адсорбции азота и уравнения БЭТ, удельные площади поверхности образцов, активированных при 700, 800 и 900°С, составляли 913 ± 22, 1215 ± 70 и 1929 ± 99 м2/г, соответственно. При увеличении температуры активации удельная площадь поверхности и объем мезопор образцов увеличивается, а доля микропор уменьшается. В качестве электролита использовали соль тетрафторборат 1,1-диметилпирролидиния в ацетонитриле. Величина удельной емкости образцов, активированных при 700, 800 и 900°C, при плотности тока 1 A/г, составляла 51 ± 4, 114 ± 2 и 108 ± 3 Ф/г, соответственно. Увеличение удельной поверхности на 40% и объема фракций мезопор до 35% приводило к увеличению удельной емкости. Дальнейшее увеличение удельной площади поверхности и объема фракций мезопор до 70% не приводило к росту удельной емкости.
ВВЕДЕНИЕ
На сегодняшний день основным направлением в области поиска электродных материалов для суперконденсаторов (СК) является получение дешевого высококачественного сырья для синтеза активного углерода как материала для суперконденсаторов. На данный момент в качестве материала для СК исследовано и применено огромное количество углеродных материалов как искусственного, так и природного происхождения [1, 2]. В силу сложности технологии и высокой стоимости углеродных материалов, получаемых путем синтеза, таких как графены, углеродные нанотрубки, карбиды, углеродные волокна, их использование пока остается на лабораторном уровне [3]. Наиболее интенсивно для получения активного углерода, используемого в качестве активной массы для электродных материалов, применяют уголь, древесину, другое природное сырье в силу их доступности и низкой стоимости [4–12].
В последние годы проведен ряд работ, направленных на поиск растительных материалов, с целью получить углеродный материал для электродов суперконденсаторов. Разными исследователями получено большое количество углеродных материалов из листьев кокосового дерева, косточек миндаля, скорлупы кокосового ореха и другого сырья [13–15]. В зависимости от типа исходного сырья получаются углеродные материалы различной морфологии с разными структурами пор, которые играют важную роль в электрохимических характеристиках суперконденсатора.
В последние годы произрастающее на территории России травянистое растение борщевик, занимающее большие площади, стало экологической проблемой. С целью избавления от борщевика его просто сжигают.
Целью настоящей работы является получение углеродного материала из высушенных стеблей борщевика, и его применение в качестве активного материала для электродов СК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Карбонизация и активация стеблей борщевика
Растительные материалы в своем составе имеют некоторое количество примесей. В борщевике (БЩ) количество примесей составило порядка 2.7 мас. %. Для их удаления образцы из высушенных стеблей борщевика в виде измельченных кусочков длиной 0.5–0.8 см обрабатывали раствором соляной кислоты (с концентрацией 18 мас. %) в течение 1 ч. Для удаления остатка кислоты образцы промывали дистиллированной водой. После обработки кислотой количество примесей уменьшалось до 0.5 мас. %. Далее полученные образцы сушили при комнатной температуре в течение 24 ч (рис. 1).
Рис. 1.
Внешний вид сушеного борщевика (а) и углеродная электродная лента (б), полученная из борщевика.

Для получения углеродного материала измельченные стебли борщевика карбонизовали при температуре 400°С. Полученный углеродный материал помещали в раствор KOH в соотношении 1 : 3 (БЩ/КОН) по массе, раствор нагревали до кипения и выдерживали до полного удаления воды из смеси. Частично карбонизованную массу подвергали сушке при 100°С на воздухе в течение 24 ч.
На следующей стадии проводили активацию полученного продукта в реакторе горизонтального типа в атмосфере аргона с нагревом до максимальных температур 700, 800 и 900°С, скорость нагрева при всех экспериментах составила 5°С/мин, при скорости подачи газа 400 мл/мин. После активации полученные материалы промывали дистилированной водой для удаления KOH. Контроль очистки от щелочи осуществляли с помощью pH-метра.
Полученные активированные материалы обозначили символами БЩ_700, БЩ_800, БЩ_900, где цифры означают максимальные температуры нагрева.
Характеристика образцов
Для расчета площади поверхности образцов использовали данные по адсорбции и десорбции азота образцами, которую измеряли на приборе TriStar 3000 – Micromeritics при температуре 77 К. Перед измерениями сорбционных характеристик проводили дегазацию образов при 300°С в течение 3 ч. Площадь поверхности рассчитывали по уравнению BET, используя данные адсорбции N2 в пределах относительного давления от 0.05 до 0.35 p/p0. Распределение пор по размерам определяли методом NLDFT. Общий объем пор рассчитывали исходя из количества адсорбированного N2 при p/p0 = 0.99. Морфологию образцов анализировали на растровом электронном микроскопе JMS-6700F фирмы JEOL (Япония).
Приготовление электродов и электрохимические измерения
Для измерения электрохимических свойств полученных активированных углеродных материалов использовали двухэлектродную ячейку. Материал для электродов формировали в виде ленты методом прокатки на вальцах. Материал состоял из смеси, содержащей 80% по массе активного углерода, измельченного в ступке, 10% по массе связующего материала, в качестве которого использовали фторопластовую суспензию марки Ф4Д ТУ 6-05-1246-81, а также 10% по массе углеродной сажи (марки CABOT® VULCAN® XC72) как электропроводящего компонента. Далее ленту сушили в вакуумном шкафу при 120°С в течение 72 ч. Из полученных лент в боксе с инертной атмосферой были приготовлены электроды и собраны симметричные ячейки, которые состояли из двух электродов и сепаратора. В качестве токосъемника использовали алюминиевую фольгу. Электрохимические характеристики электродов исследовали методами гальваностатического заряда-разряда на анализаторе ХИТ АСК2.5.10.8 и циклической вольтамперометрии на потенциостате Elins P20-X. Также были измерены спектры импеданса в диапазоне частот от 100 кГц до 10 мГц при потенциале разомкнутой цепи с амплитудой по напряжению 10 мВ на потенциостате-гальваностате Volta Master 4. В качестве электролита использовали 1 М раствор соли DMP ∙ BF4 (1,1-Dimethylpyrrolidinium tetrafluoroborate).
Вычисление удельной емкости ячейки с двумя электродами осуществляли по уравнению
где I – ток при разряде (А), t – время разряда (c), m – масса двух электродов (г), ΔV – изменение напряжения на ячейке за время разряда t (В).Удельную емкость электродного материала С0 рассчитывали согласно формуле ${{C}_{0}} = 4{{C}_{{{\text{я ч }}}}}.$
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 2 представлены изображения активированного угля из стеблей борщевика, полученные средствами растровой электронной микроскопии (РЭМ) при разных увеличениях.
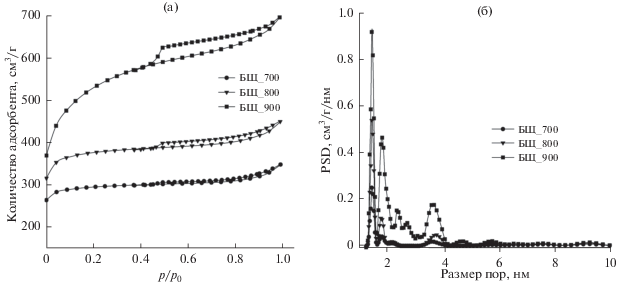
На рис. 3 приведены изотермы адсорбции и десорбции азота на поверхности образцов, а также распределение пор по размерам в этих образцах. Из кривых изотерм адсорбции и десорбции образцов, видно, что форма этих кривых соответствует изотермам I(b)-типа по классификации IUPAC, а петля гистерезиса соответствует типу H4 (рис. 3а) [16, 17]. Изотерма I(b)-типа соответствует материалам, имеющим широкое распределение пор с узким распределением мезопор и широким распределением микропор в районе ниже 2.5 нм [17]. По данным распределения пор по размерам, полученным методом NLDFT, видно, что образец, активированный при 700°С, дает ярко выраженный пик в районе 1.5 нм и два слабых пика в районе 1.8 и 3.8 нм. Активация образцов при температурах 800 и 900°С приводила к увеличению высоты, а также ширины пиков в районе 1.5, 1.8 и 3.8 нм, что указывало на прирост доли мезопор в этих образцах.
Рис. 3.
Изотермы адсорбции и десорбции при температуре 77 K (а) и кривые распределения пор по размерам (б), полученные по NLDFT-методу, для активированных углеродных материалов.
В табл. 1 приведены параметры удельных характеристик поверхности активированных углеродных материалов, полученных из борщевика. Приведены значения, рассчитанные как среднее по результатам трех независимых измерений с указанием среднего квадратичного отклонения. Как видно из таблицы, образцы имеют разную структуру пор; по мере увеличения температуры активации удельная поверхность образцов растет, также увеличивается объем мезопор, а доля объема микропор относительно общего объема снижается.
Таблица 1.
Удельные характеристики поверхности активированных углей из борщевика
| Образцы | SБЭТ, м2/г | Sмикро, м2/г | Sмезо, м2/г | Vмезо, см3/г | Vмикро, см3/г | Vобщ, см3/г | Доля микропор,% |
|---|---|---|---|---|---|---|---|
| БЩ_700 | 913 ± 22 | 826 ± 1 | 99 ± 7 | 0.132 ± 0.004 | 0.409 ± 0.001 | 0.528 ± 0.056 | 73 ± 4 |
| БЩ_800 | 1215 ± 70 | 1032 ± 66 | 211 ± 8 | 0.245 ± 0.056 | 0.512 ± 0.032 | 0.727 ± 0.081 | 68 ± 3 |
| БЩ_900 | 1929 ± 99 | 862 ± 32 | 1015 ± 23 | 0.822 ± 0.001 | 0.417 ± 0.027 | 1.183 ± 0.099 | 36 ± 2 |
Различие в структурах пор, влияющее на электрохимические свойства, в основном связано с температурой активации образцов. При различных температурах активации гидроксид калия проходит различные стадии преобразования [18]. При температуре около 700°С KOH полностью расходуется, превращаясь в K2CO3. Последний в дальнейшем при температуре выше 700°С разлагается на CO2 и K2O. В диапазоне температур 700–800°С разложение K2CO3 способствует дальнейшему развитию микропор. При температуре 800°C K2CO3 практически полностью расходуется. Образующийся при разложении K2CO3 углекислый газ в области более высоких температур, взаимодействуя с углеродом, восстанавливается до СО.
При температурах 800 и 900°C соединения K2O и K2CO3 также могут быть восстановлены углеродом до металлического K, который во время активации достаточно эффективно интеркалирует в межатомные плоскости графитовых структур. Этот процесс приводит к расширению и расщеплению плоскостей, давая дополнительную поверхность и изменяя пористость углеродного материала [19, 20].
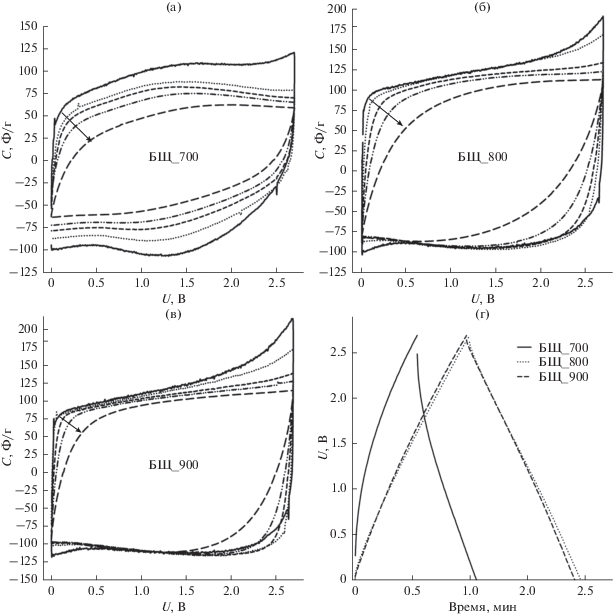
На рис. 4, представлены графики циклической вольтамперометрии при разных скоростях развертки напряжения, а также гальваностатического заряда–разряда активированных углеродных материалов из борщевика. Видно, что для образца БЩ_700 наблюдается несимметричная кривая ЦВА, которая в районе больших напряжений сужается. Такое поведение может быть обусловлено насыщением поверхности углеродного материала ионами электролита уже в пределах 1.3 В [21]. С увеличением скорости развертки напряжения наблюдается сильное падение емкости для образца БЩ_700, что связано c присутствием малого количества мезопор на поверхности образца. При увеличении температуры активации, которая приводит к возрастанию доли мезопор, скорость развертки напряжения практически мало влияет на емкость образцов, что связано с большим содержанием мезопор, легко доступных для ионов. Из графика гальваностатического заряда–разряда видно, что образцы БЩ_800 и БЩ_900 показывают более симметричные кривые, а образец БЩ_700 имеет очень большой омический скачок напряжения.
Рис. 4.
Циклическая вольтамперометрия (а)–(в) при скоростях развертки 5, 20, 60, 120 и 300 мВ/с, а также гальваностатический заряд–разряд (г) образцов активированного углеродного материала, где стрелки указывают (а)–(в) на направление снижения скорости развертки.
Удельную емкость электродов определяли с использованием данных гальваностатического заряда–разряда при разных плотностях тока. В табл. 2 представлены данные электрохимической емкости образцов при плотности тока 1 А/г. Значения рассчитывали как среднее по результатам пяти независимых измерений с указанием среднего квадратичного отклонения.
Таблица 2.
Электрохимические характеристики в 1 М растворе соли DMP BF4 в ацетонитриле, а также характеристики поверхности активированных углей из борщевика
| Образцы | SБЭТ, м2/г | Cуд, Ф/г | Vобщ, см3/г | Доля микропор, % |
|---|---|---|---|---|
| БЩ_700 | 913 ± 22 | 51 ± 4 | 0.528 ± 0.056 | 73 ± 4 |
| БЩ_800 | 1215 ± 70 | 114 ± 2 | 0.727 ± 0.081 | 68 ± 3 |
| БЩ_900 | 1929 ± 99 | 108 ± 3 | 1.183 ± 0.099 | 36 ± 2 |
Из таблицы видно, что емкость образца БЩ_900 ниже значения емкости образца активированного при 800°С, хотя удельная поверхность у первого практически на 70% больше по сравнению с образцом БЩ_800. Основной вклад в емкость вносит не поверхность как таковая, а соотношение объема доли микропор и мезопор на поверхности углеродного материала [22]. Как видно, увеличение объема мезопор до 35% у образца БЩ_800 приводит к увеличению удельной емкости, а дальнейшее увеличение доли объема мезопор, которая для образца БЩ_900 составляет 70% от общего удельного объема пор, не приводит к возрастанию удельной емкости. Это еще раз подтверждает, что емкость углеродных материалов с удельной поверхностью выше 1000 м2/г не зависит от удельной поверхности [23, 24].
Параллельно были также сняты спектры электрохимического импеданса образцов в диапазоне частот от 100 кГц до 10 мГц с амплитудой по напряжению 10 мВ. На рис. 5 показаны полученные диаграммы Найквиста (рис. 5a), также представлен ход изменения приведенной емкости в зависимости от частоты (рис. 5б) для образцов БЩ_700, БЩ_800, БЩ_900. Из приведенных данных видно, что по мере увеличения температуры активации наблюдается уменьшение эквивалентного последовательного сопротивления (ESR), что обусловлено хорошей проводимостью между токосъемником и электродным материалом (рис. 5а).
Рис. 5.
Диаграммы Найквиста (а) и изменения приведенной емкости образцов активированных материалов как функция частоты в диапазоне от 100 кГц до 10 мГц (б).
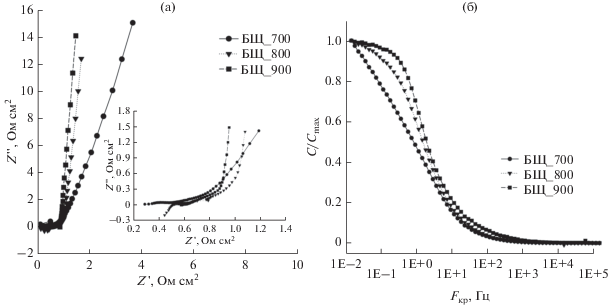
Ветвь, отвечающая за транспорт ионов электролита внутри пор, так называемая линия Варбурга, показывает, что угол наклона кривой по мере возрастания температуры активации увеличивается, что свидетельствует об улучшении подвижности ионов внутри пор [24, 25]. В области малых частот для образов БЩ_800 и БЩ_900 наблюдается почти вертикальная линия относительно мнимой части импеданса, что объясняется большой доступностью пор из-за высокого содержания доли мезопор.
График изменения приведенной емкости в зависимости от частоты показывает переход между областями, где ячейка ведет себя как резистор (область низких частот) или как конденсатор (область высоких частот) [26–28]. В случае образцов БЩ_800 и БЩ_900 наблюдается идеальное поведение конденсатора, а у образца БЩ_700 емкость растет с уменьшением частоты.
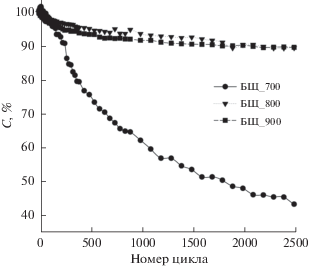
Кривые зависимости стабильности емкости образцов от количества циклов гальваностатического заряда-разряда при комнатной температуре приведены на рис. 6. Из рисунка видно, что на протяжении 2500 циклов образцы, активированные при температурах 800 и 900°C, показывают постоянство емкости. У образца БЩ_700 наблюдается очевидный спад емкости уже при начальных циклах заряда–разряда с продолжением падения на протяжении всего времени наблюдения.
ЗАКЛЮЧЕНИЕ
Получены активированные углеродные материалы из стеблей борщевика с мезо-микропористой фракцией. Активация при температурах 700, 800 и 900°C позволила получить материалы с удельной площадью поверхности 913 ± 22, 1215 ± ± 70 и 1929 ± 99 м2/г соответственно. Также, при увеличении температуры активации, объем мезопор увеличивается, а доля фракции микропор уменьшается. Увеличение удельной площади поверхности и объема мезопор до 35% приводит к увеличению удельной емкости. Дальнейшее увеличение удельной поверхности и фракции мезопор до 70%, не приводит к увеличению удельной емкости. При плотности тока 1 A/г для образцов, активированных при 700, 800 и 900°C, были получены величины удельной емкости 51 ± 4, 114 ± 2 и 108 ± 3 Ф/г, соответственно.
Список литературы
Lu, M., Beguin, F., and Frackowiak, E., Supercapacitors: Materials, Systems, and Applications, Wiley VCH, Weinheim, 2013. 568 p.
Gu, W. and Yushin, G., Review of nanostructured carbon materials for electrochemical capacitor applications: advantages and limitations of activated carbon, carbide-derived carbon, zeolite-templated carbon, carbon aerogels, carbon nanotubes, onion-like carbon, and graphene, Energy and Environment, 2014, vol. 3, p. 424.
Portet, C., Yushin, G., and Gogotsi, Y., Electrochemical performance of carbon onions, nanodiamonds, carbon black and multiwalled nanotubes in electrical double layer capacitors, Carbon, 2007, vol. 45, p. 2511.
Li, X., Xing, W., Zhuo, S., Zhou, J., Li, F., Qiao, S.Z., and Lu, G.Q., Preparation of capacitor’s electrode from sunflower seed shell, Bioresource Technology, 2011, vol. 102, p. 1118.
Elmouwahidi, A., Zapata-Benabithe, Z., Carrasco-Marín, F., and Moreno-Castilla, C., Activated carbons from KOH-activation of argan (Argania spinosa) seed shells as supercapacitor electrodes, Bioresource Technology, 2012, vol. 112, p. 185.
Jain, A. and Tripathi, S.K., Almond shell-based activated nanoporous carbon electrode for EDLCs, Ionics, 2015, vol. 21, p. 1391.
Teoh, K.H., Lim, C.S., Liew, C.W., Ramesh, S., and Ramesh, S., Electric double-layer capacitors with corn starch-based biopolymer electrolytes incorporating silica as filler, Ionics, 2015, vol. 21, p. 2061.
Chen, X., Wu, K., Gao, B., Xiao, Q., Kong, J., Xiong, Q., Peng, X., Zhang, X., and Fu, J., Three-Dimensional Activated Carbon Recycled from Rotten Potatoes for High-performance Supercapacitors, Waste and Biomass Valorization, 2016, vol. 7, p. 551.
Ramirez-Castro, C., Schütter, C., Passerini, S., and Balducci, A., Microporous carbonaceous materials prepared from biowaste for supercapacitor application, Electrochimica Acta, 2016, vol. 206, p. 452.
Shang, T.X. and Jin, X.J., Waste particleboard-derived nitrogen-containing activated carbon through KOH activation for supercapacitors, Journal of Solid State Electrochemistry, 2016, vol. 20, p. 2029.
Sulaiman, K.S, Mat, A., and Arof, A.K., Activated carbon from coconut leaves for electrical double-layer capacitor, Ionics, 2016, vol. 22, p. 911.
Tey, J.P., Careem, M.A., Yarmo, M.A., and Arof, A.K., Durian shell-based activated carbon electrode for EDLCs, Ionics, 2016, vol. 22, p. 1209.
Kubo, S., Uraki, Y., and Sano, Y., Preparation of carbon fibers from softwood lignin by atmospheric acetic acid pulping, Carbon, 1998, vol. 36, p. 1119.
Sarkar, S. and Adhikari, B., Synthesis and characterization of lignin–HTPB copolyurethane, European Polymer Journal, 2001, vol. 37, p. 1391.
Olivares-Marín, M., Fernández-González, C., Macías-García, A., and Gómez-Serrano, V., Preparation of activated carbon from cherry stones by chemical activation with ZnCl2, Applied Surface Science, 2006, vol. 252, p. 5967.
Sing, K.S.W, Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (Recommendations 1984), Pure and Applied Chemistry, 1985, p. 603.
Thommes, M., Kaneko, K., Neimark-Alexander, V., Olivier-James, P., Rodriguez-Reinoso, F., Rouquerol, J., and Sing-Kenneth, S.W., Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report), Pure and Applied Chemistry, 2015, p. 1051.
Marsh, H., Yan, D.S., O’Grady, T.M., and Wennerberg, A., Formation of active carbons from cokes using potassium hydroxide, Carbon, 1984, vol. 22, p. 603.
Yoon, S.H., Lim, S., Song, Y., Ota, Y., Qiao, W., Tanaka, A., and Mochida, I., KOH activation of carbon nanofibers, Carbon, 2004, vol. 42, p. 1723.
Wang, J. and Kaskel, S., KOH activation of carbon-based materials for energy storage, Journal of Materials Chemistry, 2012, vol. 22, p. 23710.
Mysyk, R., Raymundo-Piñero, E., and Béguin, F., Saturation of subnanometer pores in an electric double-layer capacitor, Electrochemistry Communications, 2009, vol. 11, p. 554.
Gryglewicz, G., Machnikowski, J., Lorenc-Grabowska, E., Lota, G., and Frackowiak, E., Effect of pore size distribution of coal-based activated carbons on double layer capacitance, Electrochimica Acta, 2005, vol. 50, p. 1197.
Barbieri, O., Hahn, M., Herzog, A., and Kötz, R., Capacitance limits of high surface area activated carbons for double layer capacitors, Carbon, 2005, vol. 43, p. 1303.
Chmiola, J., Yushin, G., Dash, R., and Gogotsi, Y., Effect of pore size and surface area of carbide derived carbons on specific capacitance, Journal of Power Sources, 2006, vol. 158, p. 765.
Brett, C.M.A. and Brett, A.M.O., Electrochemistry—Principles, methods and applications, Oxford University Press, Oxford, 1993, p. 427.
Taberna, P.L., Simon, P., and Fauvarque, J.F., Electrochemical Characteristics and Impedance Spectroscopy Studies of Carbon-Carbon Supercapacitors, Journal of The Electrochemical Society, 2003, vol. 150, p. A292.
Kierzek, K., Frackowiak, E., Lota, G., Gryglewicz, G., and Machnikowski, J., Electrochemical capacitors based on highly porous carbons prepared by KOH activation, Electrochimica Acta, 2004, vol. 49, p. 515.
Lust, E., Jänes, A., and Arulepp, M., Influence of solvent nature on the electrochemical parameters of electrical double layer capacitors, Journal of Electroanalytical Chemistry, 2004, vol. 562, p. 33.
Дополнительные материалы отсутствуют.