Электрохимия, 2019, T. 55, № 4, стр. 436-446
Анодное вольтамперометрическое определение атипичного антипсихотического средства амисульприда в лекарственных формах с применением электрохимического биодатчика на основе ДНК рыбьей спермы
Мустафа Чесме a, Дуйгу Полат a, Пелин Сенел b, Айсегуль Голчу b, *
a Университет Кахрамармараш Сютчю Имам, Факультет гуманитарных и естественных наук,
Отделение химии
46040 Кахрамармараш, Турция
b Стамбульский технический университет, Факультет гуманитарных и естественных наук,
Отделение химии
34469 Маслак, Стамбул, Турция
* E-mail: aysgolcu@itu.edu.tr
Поступила в редакцию 04.08.2018
После доработки 27.09.2018
Принята к публикации 20.10.2018
Аннотация
В данной работе применен новый биодатчик для определения амисульприда (АСП). Взаимодействие между АСП и двухспиральной ДНК рыбьей спермы (дсДНК РС) исследовано методом дифференциальной импульсной вольтамперометрии (ДИВ) с применением карандашного графитового электрода (КГЭ), модифицированного дсДНК РС. Чувствительное и надежное определение и обнаружение АСП осуществляли при pH 4.80 в ацетатном буферном растворе, содержащем 20% этанола, до и после взаимодействия АСП и дсДНК РС, используя изменение сигналов окисления гуанина из электроактивных оснований дсДНК РС. Кроме того, в данной работе проведены исследования достоверности аналитического метода. Данный модифицированный электрод применяли в интервале концентраций от 1 до 10 мкг/мл для количественного определения АСП в лекарственных формах, и найденный предел обнаружения (ПО) составлял 0.46 мкг/мл. Константы связывания (Kb) АСП с дсДНК РС также вычислены по данным УФ- и видимой спектроскопии и ДИВ.
ВВЕДЕНИЕ
Электрохимические биодатчики на основе ДНК представляют собой простой, быстрый надежный и дешевый метод, использующий взаимодействия лекарственных средств и ДНК для количественного определения лекарственных средств [1–3]. Эти датчики содержат слой распознавания нуклеиновой кислоты на электрохимическом преобразователе. Роль слоя распознавания нуклеиновой кислоты представляет собой обнаружение изменений структуры ДНК в процессе взаимодействия с молекулами, связывающими ДНК. Другими словами, эта роль представляет собой селективное определение специфической последовательности ДНК [4, 5]. Преобразователь сигнала обнаруживает изменение распознающей поверхности вследствие связывания молекул или гибридизации и преобразует его в электронный сигнал, который может быть передан конечному пользователю. Таким образом, наблюдение электрохимических сигналов взаимодействия лекарственного средства и ДНК до и после взаимодействия представляет собой достаточно совершенное свидетельство для выяснения механизма взаимодействия. Данное взаимодействие также используют для количественного определения рассматриваемых лекарственных средств, а также для идентификации и разработки новых лекарственных средств, предназначенных для взаимодействия с ДНК [4–6].
По сравнению с другими аналитическими методами электроаналитические методы анализа являются простыми, селективными, экономичными, быстрыми и имеют более высокую чувствительность. Помимо этих параметров, электрохимические методы анализа позволяют определить окислительно-восстановительный механизм взаимодействия в паре соединения лекарственного средства и ДНК [7, 8]. Анализ лекарственного средства представляет собой неотъемлемую и важную часть общего процесса разработки лекарственного средства. Вследствие широкого применения и возрастающей важности амисульприда весьма желательны быстрые и простые методы рутинного анализа и контроля качества промышленных композиций. Некоторые из этх методов проявляют низкую устойчивость и невысокую чувствительность; здесь также требуется трудоемкое и дорогостоящее оборудование. Электрохимические методы представляют собой мощные и гибкие аналитические методы, которые имеют широкий линейный динамический диапазон с высокой точностью, воспроизводимостью, чувствительностью и селективностью, а также используют относительно дешевые приборы. После разработки более точных импульсных методов электроаналитические исследования все чаще используют в отношении лекарственных форм и биологических образцов, в частности, для анализов лекарственных средств. Кроме того, согласно фармакопее Европы и США, рекомендовано подробное описание новых и точных методов с уменьшенным количеством реагентов и материалов, применяемых в процессе анализа. Это связано с воздействием используемых в настоящее время химических реагентов, которые загрязняют окружающую среду и наносят вред здоровью человека. В настоящей работе описаны чувствительные и простые вольтамперометрические методы определения АСП в соответствующих лекарственных композициях. Задачей настоящего исследования является разработка и валидация простого, быстрого, дешевого и чувствительного вольтамперометрического метода определения АСП.
Карандашные (графитовые) стержни, применяемые в качестве рабочих электродов, в настоящее время известны как карандашные графитовые электроды (КГЭ). Эти электроды дешевле и проще в применении и более удобны, чем другие. Здесь отсутствует стадия очистки/полировки поверхности электрода, которую осуществляют в случае других твердых электродов. Вполне могут быть получены воспроизводимые и четко определенные вольтамперометрические пики при применении КГЭ в различных методах для количественного анализа разнообразных анализируемых веществ в различных образцах.
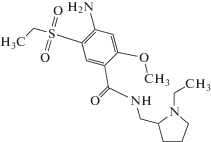
АСП (рис. 1) обычно относится к группе лекарственных средств, называемых “атипичные антипсихотические средства”, которые применяют для лечения пациентов, страдающих такими заболеваниями, как шизофрения или психоз. Клинические исследования обнаружили, что атипичные антипсихотические средства проявляют такую же эффективность, как классические антипсихотические средства, в лечении позитивных симптомов шизофрении, но производят меньшие экстрапирамидные побочные эффекты. Влияние негативных симптомов нуждается в доказательстве. АСП применяют для начального лечения пациентов, которым противопоказаны седативные, увеличивающие вес или антимускариновые побочные эффекты, или у которых ранее существовали подобные проблемы. Основная особенность АСП заключается в том, что с ним связана очень низкая частота кардиотоксичного, гипотензивного, седативного и антихолинергического симптомов и низкая частота побочных эффектов, таких как экстрапирамидные симптомы и увеличение веса. Однако он проявляет значительное воздействие на повышение уровня пролактина.
Авторы проанализировали приблизительно 1288 опубликованных до настоящего времени исследовательских работ, в которых встречалось ключевое слово “амисульприд”, по базе научной литературы “Web of Science”. Обнаруженные на основании этого анализа условия определения АСП в фармацевтических препаратах и биологических средах представлены в табл. 1. Кратко описаны разнообразные аналитические методы определения (электрохимические, спектрофотометрические и хроматографические) биоматериалов и активных веществ товарных лекарственных средств. В отличие от предшествующих исследований, в настоящей работе впервые предложен метод, в котором АСП может быть определен посредством взаимодействия с ДНК, с применением КГЭ. Исследование взаимодействией лекарственных средств и дсДНК обеспечивает испытание новых соединений в отношении воздействия на биохимическую мишень для разработки биодатчиков на основе ДНК, из которых далее получатся системы микрочипов на основе ДНК [9]. В настоящей работе взаимодействие между атипичным антипсихотическим средством амисульпридом и дсДНК впервые исследовано методом вольтамперометрии. В данных исследованиях электрохимический биодатчик на основе дсДНК получали посредством иммобилизации дсДНК на поверхности КГЭ. Сигнал окисления гуанина использовали в качестве зонда для исследования взаимодействия между амисульпридом и дсДНК.
Таблица 1.
Различные методы и валидационные параметры для определения АСП, описанные в литературе
| Метод | Диапазон концентраций | Предел обнаружения | Предел количественного определения | Применяемая среда | Литера-тура |
|---|---|---|---|---|---|
| СЭЖХ-МС/МС | 2.5–1000 нг/мл | 0.8 нг/мл | – | Сыворотка человека | [10] |
| ВЭЖХ-МС/МС | 5–200 нг/мл | – | 5 нг/мл | Плазма крысы | [11] |
| Спектрофлуориметрия | 5.0–60.0 нг/мл | 0.70 нг/мл | 2.0 нг/мл | Таблетки | [12] |
| СВЭЖХ-МС/МС | 1–1500 нг/мл | 1 нг/мл | 1500 нг/мл | Плазма человека | [13] |
| СВЭЖХ | 0.05 –10 нг/мкл | 0.33, 0.89, 0.86 нг/мкл | 0.99, 2.70, 2.61 нг/мкл | Образцы цельной крови, мочи и спинномозговой жидкости | [14] |
| ВЭЖХ | 50–1200 нг/мл | – | 50 нг/мл | Плазма человека | [15] |
| ЖХ-МС/МС | 0.50–500.5 нг/мл | – | 0.50 нг/мл | Плазма человека | [16] |
| ГХ-МС | 10–1000 мкг/л | 3 мкг/л | 10 мкг/л | Цельная кровь | [17] |
| Спектрофотометрия | [18] | ||||
| Метод A | 1.0–24 нг/мл | 0.19 нг/мл | 0.6 нг/мл | Таблетки | |
| Метод B | 1.0–24 нг/мл | 1.0–24 нг/мл | 1.1 нг/мл | ||
| Метод C | 1.0–20 нг/мл | 0.16 нг/мл | 0.5 нг/мл | ||
| ВЭЖХ | 1–20 мкг/мл | 0.06 мкг/мл | 0.20 мкг/мл | Таблетки | [19] |
| Водный КО | 5–50 мкг/мл | 0.87 мкг/мл | 2.90 мкг/мл | ||
| Неводный КО | 5–50 мкг/мл | 0.58 мкг/мл | 1.92 мкг/мл | ||
| НФ-ВЭТСХ | 100 мкг/мл | 0.06 мкг/мл | 0.19 мкг/мл | ||
| ОФ-ВЭТСХ | 100 мкг/мл | 0.06 мкг/мл | 0.19 мкг/мл | ||
| Прямая спектрофотометрия | 2–12 мкг/мл | 0.07 мкг/мл | 0.21 мкг/мл | ||
| Производная спектрофотометрия | 2–12 мкг/мл | 0.08 мкг/мл | 0.24 мкг/мл | ||
| ВЭЖХ | 100–1000 нг/мл | – | 20 нг/мл | Плазма человека | [20] |
| ВЭЖХ | 0.5–640 нг/мл | 5 нг/мл | 0.5 нг/мл | Сыворотка человека | [21] |
| ТФЭ-ЖХ | 2.5–320 нг/мл | – | 2.5 нг/мл | Таблетки | [22] |
| ТФЭ-ВЭЖХ | 0.5–160 нг/мл | – | 0.5 нг/мл | Плазма и моча человека | [22] |
| ЖЖЭ-ВЭЖХ | 0.5–640 нг/мл | – | 0.5 нг/мл | ||
| Вольтамперометрия | 4 × 10–6– 6 × 10–4 M | 2.2 × 10–8 M | 7.4 × 10–8 M | Сыворотка человека, плазма человека, таблетки | [23] |
| Вольтамперометрия | 1–10 мкг/мл | 0.46 мкг/мл | 0.72 мкг/мл | Таблетки и пероральный раствор | Настоящая работа |
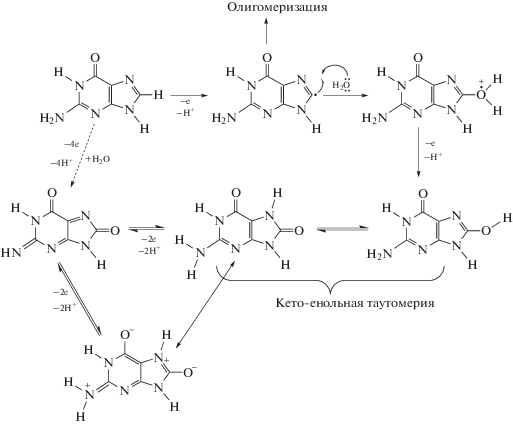
Как видно из табл. 1, электрохимическое окисление АСП исследовано в диапазоне pH 1.8 ± ± 11.0 на стационарном стеклоуглеродном электроде в работе Ozkan и др. [23]. Но электрохимическое обнаружение взаимодействия между АСП и дсДНК РС по изменению сигнала гуанина (схема 1) [24] в дсДНК РС ранее не было исследовано на поверхности какого-либо электрода. По этой причине разработан новый, быстрый, дешевый и чувствительный электрохимический биодатчик на основе дсДНК РС для определения АСП, а таблетки Solian® и растворы Solian® использованы в качестве реальных образцов для определения АСП.
Схема 1. Механизм пути электрохимического окисления гуанинового основания (представлен согласно литературе [24]).
Кроме того, константы связывания (Kb) АСП и дсДНК РС вычислены с применением методов УФ- и видимой спектрофотометрии и вольтамперометрии, и не обнаружены существенные различия между результатами, полученными этими двумя методами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ниже представлены все приборы, химические реагенты и методики, использованные в настоящих исследованиях.
Оборудование и исходные материалы
– Потенциостат/гальваностат: μAutolab типа III
– Спектрометр в УФ- и видимом диапазонах: T80 + UV/VIS
– Программное обеспечение: GPES 4.9 (EcoChemie, Нидерланды)
– Трехэлектродная система:
Электрод сравнения: Ag/AgCl/KCl (3.0 M, BAS)
Противоэлектрод: платиновая проволока
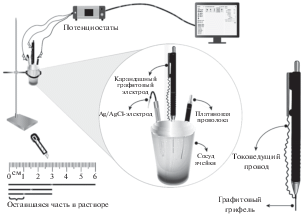
Рабочий электрод: КГЭ, карандаш Rotring® использовали в качестве держателя графитовых стержней Tombow® (0.5 мм). Данный электрод разработан для нового и однократного применения в каждом измерении. Причина активации КГЭ связана с тем, что стержни изготовлены из графита. Показано, что поверхность электрода активируется посредством изменения поверхностных и окислительно-восстановительных свойств при электрохимической предварительной обработке, в ходе которой ток пропускают через эти графитовые стержни. По сравнению с необработанным КГЭ после электрохимической предварительной обработки КГЭ проявлял улучшенную предрасположенность к повышенной электрокаталитической активности. КГЭ является предпочтительным, потому что использованные карандашные графитовые стержни дешевле и проще в применении. Кроме того, при работе с этим электродом отсутствует трудоемкая стадия очистки/полировки поверхности электрода. Применение вольтамперометрических методов различных типов для измерения разнообразных анализируемых веществ из широкого круга образцов показало воспроизводимые сигналы, дающие четко определенные вольтамперометрические пики на используемых КГЭ. Эти электроды проявили высокую точность и воспроизводимость, что делает их практичными, обновляемыми и экономичными инструментами [1, 25].
– Молекулярные схемы выполнены с помощью программного обеспечения Marvin Sketch 17.20.0 [26].
Во всех электрохимических измерениях, выполненных в экспериментальных исследованиях, использовали подключаемый к ячейке потенциостат/гальваностат μAutolab типа III. Пакет электрохимического программного обеспечения GPES 4.9 общего назначения (Eco Chemie, Нидерланды) использовали для регулирования экспериментальных условий. Как упомянуто выше, для получения вольтамперограмм использовали трехэлектродную систему. Измеритель pH Mettler Toledo MP 220 (стеклянный электрод – электрод сравнения, точность pH ± 0.03) использовали для определения pH. Все экспериментальные исследования проводили при комнатной температуре (25 ± ± 1°C), и ультрачистую воду использовали для приготовления всех исследуемых растворов. В процессе экспериментов графитовый стержень для КГЭ длиной 6 см разрезали на части длиной 3 см, чтобы соответствовать экспериментальным условиям. Эту часть длиной 3 см погружали на 1 см в исследуемый раствор и проводили электрохимические измерения. Одноразовую электродную систему получали, образуя различные графитовые поверхности для каждого эксперимента (рис. 2). Использовали следующие параметры ДИВ: амплитуда импульса 50 мВ, ширина импульса 60 мс, скорость развертки потенциала 15 мВ с–1, шаговый потенциал 500 мВ, продолжительность импульса 0.05 с; продолжительность интервала 0.5 с.
АСП в форме покрытых пленкой таблеток Solian® и пероральных растворов Solian® получали по запросу от компании Sanofi Aventis Pharmaceutical Co. (Стамбул, Турция). Ледяная уксусная кислота (99–100% CH3COOH), NaCl, NaOH, EtOH, MeOH были приобретены от компании Merck или Sigma. дсДНК РС получали от компании Sigma. Для приготовления буферных растворов использовали ультрачистую воду. Значения pH приготовленных буферных растворов определяли с помощью измерителя pH. После приготовления буферный раствор хранили в холодильнике при +4°C в мерной колбе. Концентрированный раствор 1000 мкг/мл дсДНК РС после приготовления хранили в морозильнике при –10°C для проведения экспериментов на следующий день. Для всех исследований использовали буферный раствор, содержащий уксусную кислоту, ацетат натрия и 0.02 M NaCl (pH 4.8).
Методика
Активация КГЭ. Для предварительной обработки поверхности электрода КГЭ активировали при потенциале 1.4 В в буферном растворе в течение 60 с. Для каждого измерения использовали новый активированный КГЭ.
Измерение
КГЭ с активированной поверхностью погружали в ацетат буферный раствор (pH 4.8), содержащий дсДНК РС в концентрации 2 мкг/мл. Потенциал +0.5 В прилагали в течение 1200 с (в перемешиваемом растворе), и дсДНК РС иммобилизовали на поверхности электрода. Чистый ацетатный буферный раствор использовали для удаления последовательностей дсДНК РС, которые не присоединились к поверхности электрода.
Исследования связывания дсДНК РС методом УФ- и видимой спектроскопии
Взаимодействие АСП с дсДНК РС исследовали методом УФ-спектроскопии для изучения возможных путей связывания и вычисления константы связывания. Подробное описание метода, используемого в экспериментах с УФ-титрованием, приведено в наших предшествующих работах [27–29].
Изготовление лекарственных форм для анализа
Покрытые пленкой таблетки. Эквивалентное количество раствора 1 мг/мл АСП взвешивали и помещали в мерную колбу объемом 10 мл, и метанол добавляли до метки. Данный раствор перемешивали в ультразвуковой ванне в течение 20 мин и фильтровали. Соответствующий объем прозрачного раствора помещали в мерную ячейку объемом 10 мл и доводили до метки буферным раствором (pH 4.8). Этот раствор, содержащий буфер, использовали для взаимодействий дсДНК РС.
Пероральные растворы. Достаточное количество перорального раствора Solian®, номинально содержащего 100.00 мг АСП на 1 мл раствора, растворяли в 10 мл метанола. Полученный раствор перемешивали в ультразвуковой ванне в течение 20 мин. Соответствующий объем данного раствора помещали в мерную колбу объемом 10 мл и объем доводили до метки, используя буферный раствор (pH 4.8). Полученный раствор, содержащий буфер, использовали для взаимодействия с дсДНК РС.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Применение биодатчиков в исследовании любого взаимодействия с молекулой ДНК позволяет предотвратить нежелательные токсические побочные эффекты и повреждение ДНК под действием лекарственных средств [30]. До настоящего времени отсутствовали публикации, описывающие электрохимические исследования поведения АСП на электродах с применением КГЭ, модифицированных дсДНК РС. В настоящей работе электрохимическое исследование связывание АСП и дсДНК РС проводили методом ДИВ на КГЭ, модифицированном дсДНК РС, с применением простого спектрофотометрического измерения в УФ- и видимом диапазонах.
Оптимизация иммобилизации дсДНК РС на поверхности КГЭ
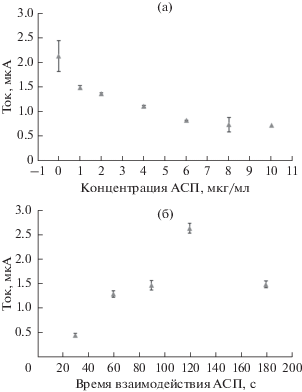
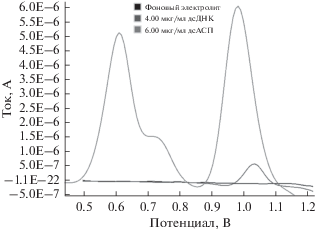
Оптимизация фаз для прикрепления дсДНК РС к поверхности карандашного графитового электрода представлена на рис. 3 в зависимости от времени и концентрации. Измерения дсДНК РС осуществляли методом дифференциальной импульсной вольтамперометрии по изменению сигнала окисления гуанина. Гуанин окисляется около +1 В. В экспериментах исследовали семь различных уровней от 0.10 до 8.00 мкг/мл, чтобы определить оптимальную концентрацию дсДНК РС. Для каждой концентрации проводили три последовательных измерения методом ДИВ, чтобы получить максимальное покрытие на поверхности КГЭ до взаимодействия с АСП. В исследованиях по оптимизации в зависимости от концентрации иммобилизацию дсДНК РС осуществляли при +0.5 В с применением времени накопления 120 с, текущее значение непрерывно повышали на 2.00 мкг/мл, и значения тока уравновешивали друг с другом при следующих концентрациях. Таким образом, было определено, что наиболее подходящая концентрация для иммобилизации составляет 4.00 мкг/мл (рис. 3a). Поэтому данную концентрацию исследовали при оптимизации времени накопления.
Рис. 3.
Влияние концентрации дсДНК РС (a) и времени (б) на сигнал окисления на поверхности КГЭ для определения оптимальной иммобилизации дсДНК РС.
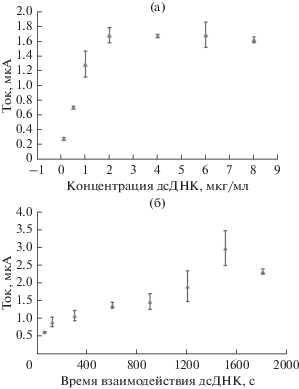
На второй стадии исследования по оптимизации времени накопления проводили с использованием концентрации 4.00 мкг/мл в течение 11 различных периодов времени, составляющих от 60 до 1800 с (рис. 3б). Ток пика гуанина увеличивался до времени накопления 1500 с. Эти оптимизированные условия использовали в последующих экспериментах. Для получения точного воспроизводимого сигнала дсДНК РС рекомендованным методом сигнал измеряли при уровне концентрации дсДНК РС 4.00 мкг/мл. Чтобы обеспечить соответствие и воспроизводимость времени и концентрации дсДНК РС в процессах иммобилизации на поверхности электрода, эксперименты повторяли по меньшей мере три раза.
Оптимизация взаимодействия АСП с КГЭ, модифицированным дсДНК РС
Влияние экспериментальных параметров на взаимодействие между АСП и дсДНК РС исследовали для обеспечения оптимальных условий анализа. Связывание АСП с КГЭ, модифицированным дсДНК РС, оптимизировали в ацетатном буферном растворе методом ДИВ (рис. 4) в зависимости от времени взаимодействия и концентрации. В исследованиях концентрационной зависимости были исследованы различные концентрации АСП, составляющие от 0.00 до 10.00 мкг/мл, как представлено на рис. 4a. Для нахождения соответствующей концентрации АСП используемые параметры иммобилизации АСП представляли собой начальный потенциал и время, составляющие 0 В и 120 с, соответственно. После взаимодействия КГЭ, модифицированного дсДНК РС, с АСП наблюдалось линейное уменьшение сигнала тока гуанина. Однако это уменьшение значения тока оставалось устойчивым после 6.00 мкг/мл АСП. Согласно графику, оптимальная концентрация амисульприда составляет 6.00 мкг/мл. Исследования оптимального времени накопления осуществляли в интервале от 0 до 180 с, используя концентрации 4.00 мкг/мл дсДНК РС и 6.00 мкг/мл АСП в изучении зависимости от времени взаимодействия КГЭ, содержащего иммобилизованную дсДНК РС, с амисульпридом. В течение этих измерений в качестве параметра иммобилизации АСП использовали начальный потенциал, составляющий 0 В. Как представлено на рис. 4б, ток пика гуанина возрастал при увеличении времени взаимодействия. Данное увеличение тока достигало максимального уровня при 120 с, а затем ток уменьшался и стабилизировался. По этой причине в качестве времени взаимодействия АСП было выбрано время, составляющее 120 с.
Исследование взаимодействия АСП с КГЭ, модифицированным дсДНК РС
Метод ДИВ представляет собой важный метод, обеспечивающий высокую чувствительность тока и оптимальное разрешение пиков, что требуется для исследования электрохимического взаимодействия между дсДНК РС и АСП. Электрохимическое взаимодействие между АСП и дсДНК РС подробно исследовано на основе оптимизационных параметров, упомянутых в предшествующем разделе. Ток пиков амисульприда и гуанина измеряли методом ДИВ до и после взаимодействия. Сначала выбирали концентрацию амисульприда, составляющую 6.00 мкг/мл, при которой наблюдается максимальное уменьшение тока пика гуанина в дсДНК РС (рис. 5). Затем при этой концентрации выбирали оптимальное время накопления, составляющее 120 с, при котором максимально уменьшается сигнал гуанина.
Электроаналитическое определение АСП с применением КГЭ, модифицированного дсДНК РС
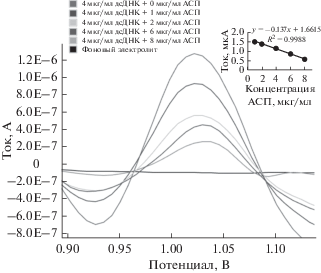
Рисунок 6 представляет вольтамперограммы в условиях, в которых АСП в различных концентрациях взаимодействует с 4 мкг/мл дсДНК РС, и АСП не присутствует на поверхности электрода. При изучении вольтамперограмм сила тока сигнала гуанина, наблюдаемого при +1.032 В, линейно уменьшается. Согласно этим данным, существует линейная корреляция между концентрацией и током пика в диапазоне концентраций от 1.00 до 10.00 мкг/мл, и коэффициент корреляции r составляет 0.999 для метода ДИВ согласно уравнению ip (мкА) = –0.137c (M) + 1.6615. На основании этих результатов сделан вывод, что может быть осуществлено количественное определение амисульприда в товарных формах с применением КГЭ и метода ДИВ. Вольтамперограммы на рис. 6 показывают, что сигнал окисления гуанинового основания уменьшается при увеличении концентраций АСП. Уменьшение сигнала окисления гуанинового основания обусловлено связыванием АСП с этим электроактивным основанием дсДНК РС. Такую ситуацию можно объяснить защитой окисляющихся групп электроактивных оснований ДНК, таких как гуанин, или взаимодействием дсДНК РС с АСП на поверхности электрода или в фазе раствора. Это уменьшение сигнала тока гуанина объясняется изменениями, которые могут вызывать мутацию, в частности, возможное повреждение окисляющейся гуаниновой группы в гуаниновых основаниях. Такие исследования чрезвычайно важны при обнаружении областей ДНК для применения в лечении и изучении различных заболеваний, включая рак, а также в создании рациональной конструкции новых молекул для мишени ДНК. Наши результаты показали, что КГЭ можно использовать непосредственно для обнаружения взаимодействия дсДНК и РС-АСП. Кроме того, данный одноразовый КГЭ является воспроизводимым и пригодным для исследования дсДНК РС.
Результаты и данные, полученные для окисления АСП с использованием биодатчика на основе КГЭ, модифицированного дсДНК РСЮ, продемонстрировали, что может быть разработан метод электроаналитического анализа для обнаружения и определения АСП в среде раствора. После взаимодействия с АСП значения тока, которые проявляли линейное уменьшение в случае тока пика гуанина, демонстрировали линейную зависимость при уменьшении концентрации АСП.
Для взаимодействия АСП и дсДНК РС результаты регрессионного анализа калибровочной кривой, полученной методом ДИВ, и требуемые валидационные параметры вычислены согласно значениям тока пика гуанина, и соответствующие данные представлены в табл. 2.
Таблица 2.
Результаты регрессионного анализа калибровочной кривой, полученной методом ДИВ, для гуанина при взаимодействии АСП и дсДНК РС и соответствующие валидационные параметры
| ДИВ | |
|---|---|
| Измеренный потенциал, В | 1.032 |
| Диапазон линейности, мкг/мл | 1.00–10.00 |
| Число точек | 5 |
| Наклон, мкА/М | –0.137 |
| Точка пересечения, мкА | 1.6615 |
| Среднеквадратическая погрешность наклона, мкА/М | 1.32 × 10–2 |
| Среднеквадратическая погрешность точки пересечения, мкА | 7.99 × 10–2 |
| Коэффициент корреляции | 0.999 |
| Предел обнаружения, мкг/мл | 0.46 |
| Предел количественного определения, мкг/мл | 0.72 |
| Внутрисуточная воспроизводимость тока пика, ОСО, % | 0.88 |
| Межсуточная воспроизводимость тока пика, ОСО, % | 2.64 |
| Внутрисуточная воспроизводимость потенциала пика, ОСО, % | 0.55 |
| Межсуточная воспроизводимость потенциала пика, ОСО, % | 0.55 |
Чувствительность разработанного вольтамперометрического метода оценивали по пределу обнаружения и количественного определения на основании руководства Eurachem [31]. Предел обнаружения (ПО) представляет собой минимальное количество анализируемого вещества, которое может быть обнаружено в образце, в то время как предел количественного определения (ПКО) представляет собой минимальное количество анализируемого вещества, которое может быть количественно определено как точное и воспроизводимое. Предел обнаружения и предел количественного определения вычисляли по уравнениям для ПО = 3.3s и ПКО = 10s помощью среднеквадратического отклонения отклика (s). Вычисленные значения ПО и ПКО также отражали чувствительность предложенного метода, как представлено в табл. 2. Как можно видеть по представленным в таблице данным, значение ПО составляет 0.46 мкг/мл, и значение ПКО составляет 0.72 мкг/мл, что демонстрирует чувствительность рекомендованного метода. Значения внутрисуточной и межсуточной воспроизводимости, определенные как относительные среднеквадратические отклонения (ОСО, %), также подтверждают валидность предложенной процедуры.
Применение разработанных методов к лекарственным формам и результаты исследований извлечения
В результате проведенных исследований извлечения было показано, что могут быть осуществлены количественные аналитические исследования лекарственных форм, содержащих амисульприд в качестве активного ингредиента. Образцы изготавливали согласно описанию в разделе “Приготовление лекарственных форм для анализа”, и кривые регистрировали для чистого амисульприда в целях количественного определения содержания амисульприда в лекарственных средствах, включая таблетки и пероральный раствор. Количества активных веществ, которые содержались в таблетках и растворе, вычисляли, подставляя значения тока пика с этих кривых в соответствующее калибровочное уравнение. Исследования извлечения осуществляли для определения влияния добавок в таблетке и пероральном растворе на представленные методы. В исследованиях извлечения определяли валидность предложенного метода для обеих лекарственных форм, и среднее извлечение определяли, используя значения ОСО (%) и относительной погрешности (%). Стандартные параметры для исследования извлечения кратко представлены в табл. 3.
Таблица 3.
Анализ результатов, полученных разработанным методом ДИВ для лекарственных форм, содержащих АСП, и результаты извлечения
| Таблетка | Пероральный раствор | |
|---|---|---|
| Номинальное количество, мг | 400.00 | 60.00 |
| Обнаруженное количествоa, мг | 399.89 | 60.06 |
| ОСО, % | 0.08 | 0.47 |
| Погрешность, % | 0.02 | –0.1 |
| Добавлено, мг | 10.00 | 10.00 |
| Найдено, мг | 9.46 | 10.01 |
| ОСО, % | 0.48 | 0.131 |
| Погрешность, % | 0.27 | –0.1 |
Константы связывания при взаимодействии АСП и дсДНК РС по данным УФ- и видимой спектроскопии и электрохимических методов
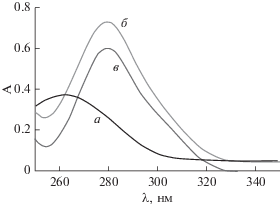
Абсорбционная спектроскопия в УФ- и видимом диапазонах может быть использована для исследования взаимодействия лекарственного средства и ДНК по изменениям параметров поглощения молекул лекарственного средства или ДНК [32]. УФ- и видимую спектрофотометрию использовали для исследования влияния связывания АСП и дсДНК РС. Когда раствор 50 мкМ дсДНК РС добавляли в раствор 20 мкМ АСП при комнатной температуре (25°C), наблюдали уменьшение значения поглощения лекарственного средства (гипохромный эффект) и увеличение значения длины волны максимума поглощения (красный сдвиг или батохромный эффект) (рис. 7). Эти результаты демонстрируют, что лекарственное средство связывается с дсДНК РС, и что связывание происходит в форме интеркаляции (гипохромный эффект (%) = A – A0/A0 = 17.47) [33]. Результаты ДИВ подтверждают данные спектроскопии в УФ и видимом и демонстрируют интеркаляцию между АСП и дсДНК РС.
Рис. 7.
УФ- и видимые спектры 50 мкМ дсДНК РС (a) и 20 мкМ АСП до (б) и после (в) реакции с 50 мкМ дсДНК РС.
Для вычисления константы связывания взаимодействия дсДНК РС с АСП методами УФ- и видимой спектроскопии (Psomas et al. [33]) и электрохимическими методами (Bogdan et al. [34]) использованы соответствующие уравнения, предложенные в указанных работах. Значения константы связывания дсДНК РС (Kb) для обоих методов представлены в табл. 4.
ВЫВОДЫ
В настоящее время постоянно развивается концепция конструирования лекарственных средств. Исследование взаимодействий лекарственных средств и дсДНК может способствовать появлению новых соединений для анализа их возможного воздействия на биомолекулярную мишень. Благодаря скорости обнаружения и чувствительности методов дсДНК можно использовать для демонстрации перспективных разработок конструкции биодатчиков, содержащих ДНК, которые превращаются в системы на основе микрочипов [9].
В настоящей работе взаимодействие между антипсихотическим лекарственным средством АСП и дсДНК РС впервые исследовано с помощью КГЭ. Электрохимический биодатчик на основе КГЭ, модифицированного дсДНК РС, изготовлен посредством иммобилизации дсДНК РС на поверхности КГЭ. Сигнал окисления гуанина выступает в качестве зонда для изучения взаимодействия между АСП и дсДНК РС, и проведены исследования изменений тока пика. Метод дифференциальной импульсной вольтамперометрии использовали для предложения механизма окисления молекул в присутствии антипсихотического лекарственного средства амисульприда и его взаимодействия с дсДНК РС. Кроме того, разработаны новые и чувствительные методы с применением вольтамперометрии в экспериментах, проводимых в рамках исследований, которые могут быть использованы для количественного определения АСП. Разработан чувствительный и селективный биодатчик на основе ДНК для определения АСП в лабораторных условиях. В результате взаимодействия АСП с дсДНК РС в различных концентрациях наблюдали уменьшение отклика, обусловленного сигналом гуанина. Вероятная причина этого может представлять собой повреждение окисляющейся группы электроактивного гуанина за счет адсорбции АСП. Условия, в которых осуществляется наилучшее возможное различие, определены как наилучшие условия анализа.
Список литературы
Kurbanoglu, S., Dogan-Topal, B., Rodriguez, E.P., Bozal-Palabiyik, B., Ozkan, S.A., and Uslu, B., Advances in electrochemical DNA biosensors and their interaction mechanism with pharmaceuticals, J. Electroanal. Chem., 2016, vol. 775, p. 8.
Diculescu, V.C., Chiorcea-Paquim, A.M., and Oliveira-Brett, A.M., Applications of a DNA-electrochemical biosensor, TrAC—Trends Anal. Chem., 2016, vol. 79, p. 23.
Marrazza, G., Chianella, I., and Mascini, M., Disposable DNA electrochemical sensor for hybridization detection, Biosens. Bioelectron., 1999, vol. 14, p. 43.
Bohunicky, B. and Mousa, S., Biosensors: the new wave in cancer diagnosis, Nanotechnol. Sci. Appl., 2011, vol. 4, p. 1.
Wang, J., From DNA biosensors to gene chips., Nucleic Acids Res., 2000, vol. 28, p. 3011.
Mehrotra, P., Biosensors and their applications—A review, J. Oral Biol. Craniofacial Res., 2016, vol. 6, p. 153.
Liu, A., Wang, K., Weng, S., Lei, Y., Lin, L., Chen, W., et al., Development of electrochemical DNA biosensors, TrAC—Trends Anal. Chem., 2012, vol. 37, p. 101.
Erdem, A. and Ozsoz, M., Interaction of the anticancer drug epirubicin with DNA, Anal. Chim. Acta, 2001, vol. 437, p. 107.
Erdem, A. and Ozsoz, M., Electrochemical DNA Biosensors Based on DNA-Drug Interactions, Electroanalysis, 2002, vol. 14, p. 965.
Sistik, P., Urinovska, R., Brozmanova, H., Kacirova, I., Silhan, P., and Lemr, K., Fast simultaneous LC/MS/MS determination of 10 active compounds in human serum for therapeutic drug monitoring in psychiatric medication, Biomed. Chromatogr., 2016, vol. 30, p. 217.
Noh, K., Jang, Y.J., Kwon, K. il, Kim, E., Jeong, T.C. heo., Yun, H. yeol, et al., Quantitative determination of amisulpride in rat plasma by HPLC-MS/MS, Arch. Pharm. Res., 2015, vol. 38, p. 63.
Walash, M.I., Belal, F., Tolba, M.M., and Halawa, M.I., Spectrofluorimetric determination of amisulpride and bumidazone in raw materials and tablets, Luminescence, 2014, vol. 29, p. 1202.
Ansermot, N., Brawand-Amey, M., Kottelat, A., and Eap, C.B., Fast quantification of ten psychotropic drugs and metabolites in human plasma by ultra-high performance liquid chromatography tandem mass spectrometry for therapeutic drug monitoring, J. Chromatogr. A, 2013, vol. 1292, p. 160.
Kovatsi, L., Redifis, K., Mihailidou, K., Pavlidis, P., and Samanidou, V., A validated UHPLC–diode array detector method for the bioanalysis of atypical antipsychotics in whole blood, urine and cerebrospinal fluid following SPE, Bioanalysis, 2012, vol. 4, p. 2929.
Das, A., Bhaumik, U., Chakrabarty, U., Sarkar, A., Ghosh, A., Bose, A., et al., Comparative Bioavailability Study of Amisulpride Tablets in Healthy Indian Volunteers, Arzneimittelforschung, 2011, vol. 59, p. 166.
Gschwend, M.H., Arnold, P., Ring, J., and Martin, W., Selective and sensitive determination of amisulpride in human plasma by liquid chromatography-tandem mass spectrometry with positive electrospray ionisation and multiple reaction monitoring, J. Chromatogr. B Anal. Technol. Biomed. Life Sci., 2006, vol. 831, p. 132.
Papoutsis, I., Rizopoulou, A., Nikolaou, P., Pistos, C., Spiliopoulou, C., and Athanaselis, S., A validated GC/MS method for the determination of amisulpride in whole blood, J. Chromatogr. B Anal. Technol. Biomed. Life Sci., 2014, vol. 947–948, p. 111.
Satyanarayana, V.K., Ramesh, T., and Nageswara, P., Simple and Facile Spectrophotometric methods for the Determination of Amisupride by Diazo Coupling reaction in Pharmaceutical Formulations, Farmacia, 2012, vol. 60, p. 206.
Skibiński, R., Komsta, Ł., Hopkała, H., and Suchodolska, I., Comparative validation of amisulpride determination in pharmaceuticals by several chromatographic, electrophoretic and spectrophotometric methods, Anal. Chim. Acta, 2007, vol. 590, p. 195.
Péhourcq, F., Ouariki, S., and Bégaud, B., Rapid high-performance liquid chromatographic measurement of amisulpride in human plasma: Application to manage acute intoxication, J. Chromatogr. B Anal. Technol. Biomed. Life Sci., 2003, vol. 789, p. 101.
Malavasi, B., Locatelli, M., Ripamonti, M., and Ascalone, V., Determination of amisulpride, a new benzamide derivative, in human plasma and urine by liquid-liquid extraction or solid-phase extraction in combination with high-performance liquid chromatography and fluorescence detection application to pharmacokinetics, J. Chromatogr. B Biomed. Appl., 1996, vol. 676, p. 107.
Ascalone, V., Ripamonti, M., and Malavasi, B., Stereospecific determination of amisulpride, a new benzamide derivative, in human plasma and urine by automated solid-phase extraction and liquid chromatography on a chiral column Application to pharmacokinetics, J. Chromatogr. B Biomed. Appl., 1996, vol. 676, p. 95.
Özkan, S.A., Uslu, B., and Sentürk, Z., Electroanalytical Characteristics of Amisulpride and Voltammetric Determination of the Drug in Pharmaceuticals and Biological Media, Electroanalysis, 2004, vol. 16, p. 231.
Li, Q., Batchelor-Mcauley, C., and Compton, R.G., Electrochemical oxidation of guanine: Electrode reaction mechanism and tailoring carbon electrode surfaces to switch between adsorptive and diffusional responses, J. Phys. Chem. B, 2010, vol. 114, p. 7423.
David, I.G., Popa, D.E., and Buleandra, M., Pencil graphite electrodes: A versatile tool in electroanalysis, J. Anal. Methods Chem., 2017, vol. 2017.
https://chemaxon.com/products/marvin, Marvin Sketch (17.20.0), 2017 ChemAxon (http://www.chemaxon.com), 2017
Muslu, H., and Gölcü, A., New metal based drug as a therapeutic agent: Spectral, electrochemical, DNA-binding, surface morphology and photoluminescence properties, J. Mol. Struct., 2015, vol. 1092, p. 22.
Çeşme, M., Gölcü, A., and Demirtaş, I., New metal based drugs: Spectral, electrochemical, DNA-binding, surface morphology and anticancer activity properties, Spectrochim. Acta Part A Mol. Biomol. Spectrosc., 2015, vol. 135, p. 887.
Demirezen, N., Tarınç, D., Polat, D., Çeşme, M., Gölcü, A., and Tümer, M., Synthesis of trimethoprim metal complexes: Spectral, electrochemical, thermal, DNA-binding and surface morphology studies, Spectrochim. Acta Part A Mol. Biomol. Spectrosc., 2012, vol. 94, p. 243.
Karran, P., Mechanisms of tolerance to DNA damaging therapeutic drugs., Carcinogenesis, 2001, vol. 22, p. 1931.
Magnusson, B., Eurachem Guide: The Fitness for Purpose of Analytical Methods, Second Edi, ISBN 978-91-87461-59-0, 2014
R, S.G.K., Mathew, B.B., Sudhamani, C.N., and Naik, H.S.B., Mechanism of DNA Binding and Cleavage, Biomed. Biotechnol., 2014, vol. 2, p. 1.
Psomas, G., Mononuclear metal complexes with ciprofloxacin: Synthesis, characterization and DNA-binding properties, J. Inorg. Biochem., 2008, vol. 102, p. 1798.
Bogdan, M., Pirnau, A., Floare, C., and Bugeac, C., Binding interaction of indomethacin with human serum albumin, J. Pharm. Biomed. Anal., 2008, vol. 47, p. 981.
Дополнительные материалы отсутствуют.