Электрохимия, 2019, T. 55, № 4, стр. 494-499
NiO/пористый восстановленный оксид графена в качестве активного гибридного электрокатализатора для реакции выделения кислорода
Бабак Зарейи a, Ферештех Чекин a, *, Шахла Фатхи a
a Отделение химии, Филиал аятоллы Амоли, Исламский университет Азад
Амоль, Иран
* E-mail: fchekin@yahoo.com
Поступила в редакцию 10.02.2018
После доработки 30.10.2018
Принята к публикации 24.11.2018
Аннотация
В настоящее время гибридный материал на основе графена в качестве электродного материала демонстрирует характеристики эффективности в отношении реакции выделения кислорода (РВК). РВК влияет на некоторые важные технологии с применением возобновляемой чистой энергии, такие как разложение воды. В данном исследовании высокоактивная матрица на основе нанокомпозиционного материала, содержащего NiO и пористый восстановленный оксид графена (NiO-пвОГ), была получена в ходе простой и эффективной электрохимической процедуры, и результаты ее исследования представляют хорошие характеристики для РВК. Превосходные электрохимические свойства нанолистов пвОГ могут быть обусловлены их высокой площадью поверхности, что может эффективно увеличивать скорость всей электрохимической реакции и улучшать каталитическую активность в отношении РВК в щелочном растворе. Модифицированный NiO-пвОГ угольный пастовый электрод (NiO-пвОГ/УПЭ) проявляет более отрицательный начальный потенциал и высокую плотность тока в 0.1 M NaOH, чем модифицированный NiO и восстановленным оксидом графена УПЭ (NiO-вОГ/УПЭ), модифицированный NiO и оксидом графена УПЭ (NiO-ОГ/УПЭ) и модифицированный NiO УПЭ (NiO/УПЭ), доказывая, что поры могут значительно увеличивать содержание NiO и эффективность РВК. Электрокаталитическую активность и устойчивость катализаторов оценивали методами вольтамперометрии и хроноамперометрии с линейной разверткой, показывая, что NiO на пвОГ благоприятно воздействует на активность и устойчивость РВК. В настоящей работе представлен гибридный электрокатализатор, который может быть применен в процессах преобразования и аккумулирования энергии.
ВВЕДЕНИЕ
В последние годы широко исследуется электрохимия процесса выделения кислорода в качестве чистого и устойчивого источника энергии [1–3]. Процесс образования одного молекулярного кислорода с переносом 4 электронов в щелочной среде является очень медленным, и требуется высокое перенапряжение [4–8]. Таким образом, требуется электрокатализатор с высокой устойчивостью и эффективностью для уменьшения высокого перенапряжения и ускорения реакции выделения кислорода (РВК). В кислой и щелочной среде оксиды благородных металлов, таких как RuO2 и IrO2, представляют собой наиболее эффективные и активные электрокатализаторы РВК с низким перенапряжением и высокой плотностью тока [9, 10], но они не являются подходящими для применения во всемирном масштабе в щелочных растворах вследствие редкости, высокой стоимости и низкой химической устойчивости [11]. Таким образом, для РВК были исследованы другие металлооксидные электрокатализаторы, такие как оксиды кобальта [12–16] и оксиды никеля [17, 18], вследствие их низкой стоимости и перенапряжения, высокой доступности и быстрой кинетики.
Благодаря превосходной проводимости, высокой площади поверхности и хорошим механическим свойствам, пористые материалы являются подходящими для внедрения наноматериалов [19]. Кроме того, они обеспечивают диффузионные преимущества по сравнению с другими пористыми углеродными структурами, такие как высокая механическая прочность, которая может способствовать предотвращению разрушения пористых структур, превосходная химическая устойчивость и превосходные электрохимические свойства [20, 21]. Пористый восстановленный оксид графена обладает всеми преимуществами нанолистов вОГ для электрохимических датчиков [22–27], такими как увеличенная активная площадь и упрощенный массоперенос, что является благоприятным для чувствительного обнаружения. Структуры пвОГ широко применяются для изготовления высокоэффективных энергоаккумулирующих устройств [28, 29]. Графен имеет высокую проводимость и может представлять собой хороший выбор для изготовления композиционного материала с наночастицами NiO в качестве электрокатализатора для применения в РВК.
В настоящей работе синтезированный пористый восстановленный оксид графена использовали в качестве носителя для осаждения наночастиц NiO электрохимическим методом. Полученный нанокомпозиционный материал использовали в качестве электрокатализатора для РВК в щелочной среде. Результаты показали, что наночастицы NiO, нанесенные на пвОГ (NiO-пвОГ), проявляют превосходную активность и устойчивость в отношении РВК по сравнению с частицами, нанесенными на вОГ (NiO-вОГ), четко свидетельствуя, что поры пвОГ улучшают характеристики NiO.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Оксид графена (ОГ) был приобретен у компании Graphenia (Испания). Нитрат никеля (Ni(NO3)2), пероксид водорода (H2O2), серная кислота (H2SO4), гидрат гидразина (H4N2 · H2O), гидроксид натрия (NaOH), гексацианоферрат(II) калия ([K4Fe(CN)6]) и таблетки фосфатного буфера были приобретены у компании Aldrich и использованы в полученном виде.
Аппаратура
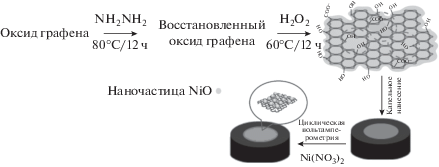
Электрохимические эксперименты осуществляли, используя потенциостат/гальваностат (электрохимическая аналитическая система Sama 500-c, Sama, Иран). Была использована традиционная трехэлектродная система, которую составляли Ag|AgCl|KCl (3 M) в качестве электрода сравнения, NiO-пвОГ/УПЭ в качестве рабочего электрода и платиновая проволока в качестве вспомогательного электрода. Морфологию поверхности и химический состав электрокатализатора исследовали, используя сканирующий электронный микроскоп (СЭМ) Philips XL-30 в сочетании с энергодисперсионным рентгеновским спектрометром (ЭДРС).
Получение пористого восстановленного оксида графена (пвОГ)
Восстановленный оксид графена (вОГ) получали согласно предыдущей работе [30]. Вкратце, 5 мг оксида графена (ОГ) и 5 мл воды смешивали и обрабатывали ультразвуком в течение 5 ч при 25°C, а затем в диспергированный раствор добавляли 1 мл гидрата гидразина (32 M) и нагревали на масляной бане в течение 24 ч при 80°C. Продукт отфильтровывали, промывали водой и высушивали в печи при 100°C. Синтез пвОГ осуществляли согласно работе Szunerits et al. [19]. Для этого 100 мг вОГ обрабатывали ультразвуком в 100 мл 30% H2O2 в течение 30 мин и нагревали с обратным холодильником в течение 12 ч при 60°C. Продукт отфильтровывали и промывали водой.
Нанесение наночастиц NiO на модифицированный пвОГ угольный пастовый электрод (NiO-пвОГ/УПЭ)
Угольный пастовый электрод (УПЭ) получали, смешивая вручную графитовый порошок и парафин до образования однородно смоченной пасты. Затем угольную пасту помещали в стеклянную трубку, имеющую внутренний радиус 2.5 мм. Электрический контакт обеспечивала медная проволока. Поверхность электрода обновляли, полируя ее бумагой для взвешивания. В течение 3 ч диспергировали 3 мг пвОГ в 3 мл воды. Угольный пастовый электрод модифицировали капельным нанесением 5 мкл пвОГ на поверхность УПЭ и высушивали в печи при 60°C. Затем пвОГ/УПЭ погружали в 0.1 M ФБР (pH 7.00), содержащий 0.1 M нитрата никеля и циклически обрабатывали в диапазоне от –0.2 до +1 В в течение 5 циклов при скорости развертки потенциала 0.1 В/с (рис. 1). Гидратированные оксиды никеля могут образовываться вследствие гидролиза частиц Ni(II) на поверхности электрода [31].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Электрохимические исследования
Для исследования модификации электрода в качестве классического электрохимического индикатора использовали [Fe(CN)6]3–/4–. Рисунок 2а представляет циклические вольтамперограммы пвОГ/УПЭ в растворе 5 мМ [Fe(CN)6]3–/4– при различных скоростях развертки потенциала. Было обнаружено, что значения Epa и Epc слегка сдвигаются в положительном и отрицательном направлениях, соответственно, и ΔEp увеличивается при увеличении скорости развертки потенциала. Токи анодного и катодного пиков прямо пропорциональны квадратному корню скорости развертки потенциала (рис. 2б), свидетельствуя, что реакция представляет собой контролируемый диффузией процесс.
Рис. 2.
(а) Циклические вольтамперограммы пвОГ/УПЭ в растворе [Fe(CN)6]3–/4– (5 мМ)/ФБР (0.1 M) при различных скоростях развертки потенциала (изнутри наружу): 5, 10, 25, 50, 100 и 150 мВ/с; (б) график тока катодного и анодного пика в зависимости от скорости развертки потенциала.
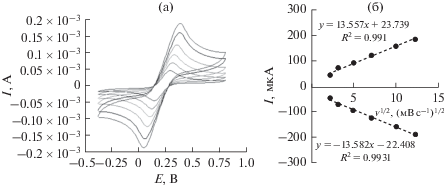
Рисунок 3а представляет циклические вольтамперограммы модифицированных электродов в растворе 5 мМ [Fe(CN)6]3–/4–. Усилены электрохимические отклики [Fe(CN)6]3–/4– на вОГ/УПЭ (кривая б) и пвОГ/УПЭ (кривая в) по сравнению с немодифицированным УПЭ (кривая a). Усиление тока связано с увеличением площади поверхности вОГ, и пвОГ обеспечивал увеличение доступа электрохимического раствора к поверхности электрода для переноса электронов.
Рис. 3.
(а) Циклические вольтамперограммы, снятые на УПЭ (a), вОГ/УПЭ (б) и пвОГ/УПЭ (в) в растворе [Fe(CN)6]3–/4– (5 мМ)/ФБР (0.1 M) при скорости развертки потенциала 50 мВ/с; (б) диаграммы Найквиста СЭИ на УПЭ (a), вОГ/УПЭ (б) и пвОГ/УПЭ (в) в растворе [Fe(CN)6]3–/4– (5 мМ) и KCl 0.1 M и (в) циклические вольтамперограммы, снятые на NiO/УПЭ (a), NiO-ОГ/УПЭ (б), NiO-вОГ/УПЭ (в) и NiO-пвОГ/УПЭ (г) в растворе 0.1 M NaOH при скорости развертки потенциала 20 мВ/с.
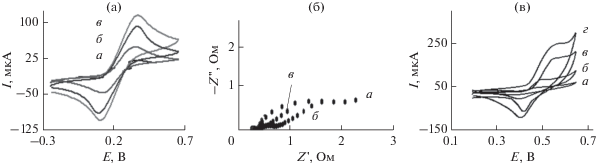
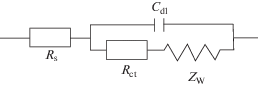
Спектроскопию электрохимического импеданса (СЭИ) использовали для более подробного исследования кинетики электродных реакций. Рисунок 3б представляет измерения методом СЭИ для УПЭ, вОГ/УПЭ и пвОГ/УПЭ в растворе 5 мМ [Fe(CN)6]3–/4–. Значение сопротивления переносу заряда (Rct) электродов вычисляли, используя диаметр полукруга. пвОГ/УПЭ проявляет меньшее значение Rct, чем вОГ/УПЭ и УПЭ, показывая более высокую эффективность переноса заряда пвОГ/УПЭ. Из этих графиков можно видеть, что пвОГ в качестве электрокатализатора проявляет меньший импеданс переноса заряда, чем электрокатализатор вОГ в данной работе. Схема 1 представляет собой эквивалентную схему системы. В данной схеме Rs и Cdl представляет собой сопротивление раствора и элемент постоянной фазы, соответствующий емкости двойного слоя. Член ZW представляет собой сопротивление Варбурга, связанное с Rct, которое обуславливает диффузию Нернста. В табл. 1 представлены полученные значения параметров аппроксимации Rct, Rs, ZW и Cdl.
Таблица 1.
Значения параметров для эквивалентной схемы с аппроксимированным импедансом
| Электрод | Rct, Ом | ZW, Ом | Cdl, Ф/г | Rs, Ом |
|---|---|---|---|---|
| УПЭ | 1.97 | 1.25 | 138 | 0.54 |
| вОГ/УПЭ | 0.53 | 1.62 | 389 | 0.49 |
| пвОГ/УПЭ | 0.26 | 1.89 | 462 | 0.51 |
Схема 1 . Эквивалентная схема системы.
Рисунок 3в представляет циклические вольтамперограммы, полученные на NiO/УПЭ, NiO-ОГ/УПЭ, NiO-вОГ/УПЭ и NiO-пвОГ/УПЭ в растворе 0.1 M NaOH. Общеизвестно, что никель в щелочной среде образует тонкий слой Ni(OH)2, который может окисляться до β-NiOOH. Таким образом, предполагается участие β-NiOOH согласно [32]:
(1)
$2\beta {\text{ - NiOOH}} + {{\left( {{{{\text{O}}}^{ - }}} \right)}_{{{\text{а д с }}}}} \to 2{\text{Ni}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{e}},$(2)
${\text{Ni}}{{{\text{O}}}_{2}} + {{\left( {{\text{OH}}} \right)}_{{{\text{а д с }}}}} \to { \beta - NiOOH} + {{\left( {\text{O}} \right)}_{{{\text{а д с }}}}}{\text{.}}$Хотя потенциалы катодного и анодного пиков модифицированных электродов являются приблизительно одинаковыми, токи пиков для NiO-пвОГ/УПЭ значительно увеличены, указывая на большую площадь поверхности пвОГ. Поверхностная концентрация электроактивного NiO на пвОГ/УПЭ может быть оценена с помощью уравнения [33]:
где Q представляет собой расход заряда в кулонах, полученный путем интегрирования площади анодного (или катодного) пика на циклических вольтамперограммах после коррекции фона. Вычисленное среднее значение составляет (1.24 ± ± 0.51) × 10–10 моль/см2.Характеристики материалов
Характеристики поверхности пвОГ и NiO-пвОГ наблюдали методом СЭМ, а элементный анализ осуществляли методом ЭДРС (рис. 4). Пористая поверхность пвОГ без примесей образует подложку электродного материала анода (рис. 4а). Высокая площадь поверхности пвОГ представляет собой преимущество для идеальной подложки. Рисунок 4б показывает, что тонкий слой NiO однородно покрывает поверхность пвОГ после электроокислительной предварительной обработки. Изменения морфологии поверхности обусловлены нанесением сферических частиц NiO на пвОГ. Кроме того, анализ методом ЭДРС свидетельствует, что NiO нанесен на пвОГ (рис. 4в).
Электрокаталитическое исследование
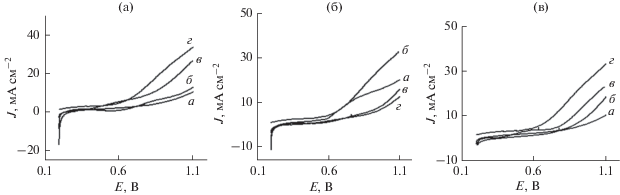
Для сравнения каталитических свойств электрокатализаторов РВК электроды, содержащие немодифицированную УП, NiO/УП, NiO-вОГ/УП и NiO-пвОГ/УП, исследовали методом вольтамперометрии с линейной разверткой (ВЛР) в растворе 0.1 M NaOH. Как представлено на рис. 5а, NiO-пвОГ/УПЭ проявляет наибольшую плотность тока при начальном потенциале РВК около 0.6 В. Значительное повышение активности в отношении РВК может быть обусловлено количеством наночастиц NiO, нанесенных на пвОГ в течение различного числа циклов циклической вольтамперометрии в ходе получения NiO-пвОГ/УПЭ. С другой стороны, повышенное содержание Ni2+ в NiO-пвОГ, как представлено на рис. 5б, обеспечивает увеличение количества активного Ni3+, что представляет собой повышение активности согласно прогнозам. Кроме того, увеличение pH (рис. 5в) усиливает тенденцию к окислению Ni2+ в Ni3+, что может увеличивать количество активных центров, повышая эффективность NiO-пвОГ/УПЭ в отношении РВК. В итоге, повышенное содержание Ni2+ и высокое значение pH может синергетически увеличивать количество активного Ni3+ и приводить к значительному повышению эффективности в отношении РВК.
Рис. 5.
(а) ВЛР для РВК на NiO/УПЭ (a), NiO-ОГ/УПЭ (б), NiO-вОГ/УПЭ (в) и NiO-пвОГ/УПЭ (г); (б) ВЛР NiO-пвОГ/УПЭ (a) 3, (б) 5, (в) 10 и (г) 20 циклов циклической вольтамперометрии в ходе получения; (в) ВЛРs NiO-пвОГ/УПЭ при pH (a) 8, (б) 10, (в) 11.5 и (г) 13 в растворе 0.1 M NaOH при скорости развертки потенциала 10 мВ/с.
Модификация электрода NiO-пвОГ уменьшает скорость расхода энергии на аноде и, следовательно, уменьшает расход энергии для всего процесса. Экономия энергии на аноде описана в [33]:
(4)
${{P}_{{{\text{(a)}}}}} = {{\Delta {{E}_{{{\text{(a)}}}}}F} \mathord{\left/ {\vphantom {{\Delta {{E}_{{{\text{(a)}}}}}F} {3600}}} \right. \kern-0em} {3600}},$ВЫВОДЫ
В итоге, пористый композиционный материал на основе NiO и пористого восстановленного оксида графена успешно получен и применен в качестве превосходного электрокатализатора для РВК в щелочной среде. Значительная каталитическая активность может быть обусловлена синергетическим эффектом между наночастицами NiO и пвОГ. Таким образом, разработка новых наноструктур на основе композиционного материала NiO-пвОГ может обеспечивать выбор для получения электрокатализаторов РВК с превосходными характеристиками.
Список литературы
Dau, H., Limberg, C., Reier, T., Risch, M., Roggan, S., and Strasser, P., Chem. Cat. Chem., 2010, vol. 2, p. 724.
Walter, M.G., Warren, E.L., Mc Kone, J.R., Boettcher, S.W., Mi, Q., Santori, E.A., and Lewis, N.S., Chemical Reviews, 2010, vol. 110, p. 6446.
Cook, T.R., Dogutan, D.K., Reece, S.Y., Surendranath, Y., Teets, T.S., and Nocera, D.G., Chemical Reviews, 2010, vol. 110, p. 6474.
Zhao, Y., Nakamura, R., Kamiya, K., Nakanishi, S., and Hashimoto, K., Nature communications, 2013, vol. 4, p. 1.
Chen, S., Duan, J., Jaroniec, M., and Qiao, S.Z., Angewandte Chemie International Edition, 2013, vol. 52, p. 13567.
Huynh, M.H.V. and Meyer, T.J., Chemical Reviews, 2007, vol. 107, p. 5004.
Betley, T.A., Wu, Q., Van Voorhis, T., and Nocera, D.G., Inorganic Chemistry, 2008, vol. 47, p. 1849.
Liao, M., Zeng, G., Luo, T., Jin, Zh., Wang, Y., Kou, X., and Xiao, D., Electrochim. Acta, 2016, vol. 194, p. 59.
Lee, Y., Suntivich, J., May, K.J., Perry, E.E., and Shao-Horn, Y., The J. Physical Chemistry Letters, 2012, vol. 3, p. 399.
Yagi, M., Tomita, E., Sakita, S., Kuwabara, T., and Nagai, K., The J. Physical Chemistry B, 2005, vol. 109, p. 21489.
Yeo, B.S., and Bell, A.T., J. American Chemistry Society, 2011, vol. 133, p. 5587.
Liu, Y.C., Koza, J.A., and Switzer, J.A., Electrochim. Acta, 2014, vol. 140, p. 359.
Fayette, M., Nelson, A., and Robinson, R.D., J. Mater. Chem. A, 2015, vol. 3, p. 4274.
Hutchings, G.S., Zhang, Y., Li, J., Yonemoto, B.T., Zhou, X.G., Zhu, K.K., and Jiao, F., J. Am. Chem. Soc., 2015, vol. 137, p. 4223.
Li, L.L., Tian, T., Jiang, J., and Ai, L.H., J. Power Sources, 2015, vol. 294, p. 103.
Shi, N., Cheng, W., Zhou, H., Fan, T.X., and Niederberger, M., Chem. Commun., 2015, vol. 51, p. 1338.
Stern, L.A. and Hu, X.L., Faraday Discuss., 2014, vol. 176, p. 363.
Cibrev, D., Jankulovska, M., Lana-Villarreal, T., and Gómez, R., Int. J. Hydrogen Energy, 2013, vol. 38, p. 2746.
Chekin, F., Singh, S.K., Vasilescu, A., Dhavale, V.M., Kurungot, S., Boukherroub, R., and Szunerits, S., ACS Sens., 2016, vol. 1, p. 1462.
Han, S., Wu, D., Li, S., Zhang, F., and Feng, X., Adv. Mater., 2014, vol. 26, p. 849.
Jiang, L. and Fan, Z., Nanoscale, 2014, vol. 6, p. 1922.
Chen, D., Feng, H., and Li, J., Chem. Rev., 2012, vol. 112, p. 6027.
He, L., Wang, Q., Mandler, D., Li, M., Boukherroub, R., and Szunerits, S., Biosens. Bioelectron., 2016, vol. 75, p. 389.
Wu, S., He, Q., Tan, C., Wang, Y., and Zhang, H., Small, 2013, vol. 9, p. 1160.
Ambrosi, A., Chua, C.K., Latiff, N.M., Loo, A.H., Wong, C.H.A., Eng, A.Y.S., Bonanni, A., and Pumera, M., Chem. Soc. Rev., 2016, vol. 45, p. 2458.
Joshi, R.K., Alwarappan, S., Yoshimura, M., Sahajwalla, V., and Nishina, Y., Appl. Mater. Today, 2015, vol. 1, p. 1.
Seah, T.H., Poh, H.L., Chua, C.K., Sofer, Z., and Pumera, M., Electroanalysis, 2014, vol. 26, p. 62.
Antink, W.H., Choi, Y., Seong, K.D., Kim, J.M., and Piao, Y., Adv. Mater. Interfaces, 2018, vol. 5, p. 1701212.
Yeon, S.H., Yoon, H., Lee, S.H., Kim, J.E., Lim, S., Shin, K.H., Park, H.S., Chang-Su Jin, Ch.S., Ahn, W., Cheong, H.W., Choi, Y., and Yu, H.R., Carbon, 2015, vol. 91, 241.
Chekin, F., Teodorescu, F., Coffinier, Y., Pan, G.H., Barras, A., Boukherroub, R., and Szunerits, S., Biosens. Bioelectron., 2016, vol. 85, p. 807.
Li, S.J., Xia, N., Lv, X.L., Zhao, M.M., Yuan, B.Q., and Pang, H., Sens. Actuators B: Chemical, 2014, vol. 190, p. 809.
Chekin, F., Tahermansouri, H., and Besharat, M.R., J. Solid State Electrochem., 2014, vol. 18, p. 747.
Bagheri, S., Chekin, F., and Abd Hamid, Sh.B., J. Chin. Chem. Soc., 2014, vol. 61, p. 702.
Zhang, J.H., Feng, J.Y., Zhu, T., Liu, Z.L., Li, Q.Y., Chen, Sh.Zh., and Xu, Ch.W., Electrochim. Acta, 2016, vol. 196, p. 661.
Zhao, J., Liu, Y., Quan, X., Chen, Sh., Zhao, H., and Yu, H., Electrochim. Acta, 2016, vol. 204, p. 169.
Li, X., Han, G.Q., Liu, Y.R., Dong, B., Shang, X., Hu, W.H., Chai, Y.M., Liu, Y.Q., and Liu, Ch.G., Electrochim. Acta, 2016, vol. 205, p. 77.
Fang, Y., Li, X., Hu, Y., Li, F., Lin, X., Tian, M., An, X., Fu, Y., Jin, J., and Ma, J., J. Power Sources, 2015, vol. 300, p. 285.
Li, Zh., Yu, X.Y., and Paik, U., J. Power Sources, 2016, vol. 310, p. 41.
Zhang, L., Li, H., Li, K., Li, L., Wei, J., Feng, L. and Fu, Q., J. Alloys and Compounds, 2016, vol. 680, p. 146.
Song, M.Y., Yang, D.S., Singh, K.P., Yuan, J. and Yu, J.S., Applied Catalysis B: Environmental, 2016, vol. 191, p. 202.
Дополнительные материалы отсутствуют.