Электрохимия, 2019, T. 55, № 4, стр. 482-493
Окисление цинка в условиях ограниченного объема щелочного электролита
А. Н. Москвичев a, Ю. Л. Гунько b, *, М. Г. Михаленко b, А. А. Слетов b, **, В. А. Козырин b, О. Л. Козина b
a Федеральное государственное бюджетное научное учреждение
“Федеральный исследовательский центр Институт прикладной физики Российской академии наук”,
Институт проблем машиностроения РАН (ИПМ РАН)
603024 Нижний Новгород, ул. Белинского, 85, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Нижегородский государственный технический университет им. Р.Е. Алексеева”,
Институт физико-химических технологий и материаловедения
603950 Нижний Новгород, ул. Минина, 24, Россия
* E-mail: cn-gunko2008@yandex.ru
** E-mail: Alexey180NN@mail.ru
Поступила в редакцию 27.03.2018
После доработки 01.11.2018
Принята к публикации 19.11.2018
Аннотация
Проведены исследования окисления цинкового электрода в условиях ограниченного объема щелочного электролита. Показано, что при анодной поляризации до 7–8 мВ на поверхности цинка присутствует фазовый слой, состоящий из оксидов или гидроксидов цинка, затрудняющих диффузию ионов, участвующих в электрохимических превращениях. В дальнейшем идет образование цинкатного комплекса $\left[ {{\text{Zn}}({\text{OH}})_{{\text{4}}}^{{{\text{2}} - }}} \right]$ с замедленной стадией диффузии гидроксид-ионов к поверхности анода. В области поляризаций от 0.08 до 0.12 В начинается образование пересыщенного цинкатного электролита и его разложение с образованием рыхлого слоя оксида цинка. При поляризации свыше 0.12 В на поверхности цинка образуется беспористая оксидная пленка, и процесс окисления цинка происходит по твердофазному механизму.
ВВЕДЕНИЕ
Среди источников тока с водным электролитом высокими удельной емкостью и разрядным напряжением обладают серебряно-цинковые и никель-цинковые аккумуляторы. Последние, хотя и имеют несколько меньшие удельные энергетические характеристики, более дешевы, так как изготавливаются без применения серебра, что обусловило значительный интерес к данной электрохимической системе.
Батарею системы серебро-цинк впервые собрал около 1800 г. Алессандро Вольта. В 1898 г. Вальдмар Юнгнер высказал идею превратить данную систему в перезаряжаемую, однако только в 1952 г. Анри Андре предложил способ изготовления серебряно-цинкового аккумулятора с полурастворимыми цинковыми электродами. Патент на перезаряжаемую батарею системы никель–цинк впервые получил в 1901 г. Томас Эдисон [1]. Позже она была усовершенствованна ирландским химиком Джеймсом Драммом [2] и использовалась в автомотрисах на линии Дублин–Брей с 1932 по 1948 г. В 60–70 гг. XX в. в Советском Союзе и за рубежом проводилось много исследований с целью улучшения емкостных характеристик системы Ni–Zn для использования в электромобилях, военных целях и замены никель-кадмиевых аккумуляторов. Но после массового появления на рынке литиевых источников тока интерес к никель-цинковым источникам угас. Тем не менее, исследования в области никель-цинковых источников тока до конца не были свернуты.
В последнее десятилетие в связи с развитием технологий изготовления оксидно-никелевых и цинковых электродов наблюдается рост интереса к системе никель–цинк. Крупные компании, такие как VARTA, PowerGenix, Acme Power, BPI начали производить никель-цинковые источники тока разнообразных видов и характеристик как альтернативу литиевым аккумуляторам: пальчиковые Acmepower 2500 mW h Ni–Zn 1.6ВV [3] и BPI Ni–Zn AA 2500 mW h Rechargeable Battery 1.6 V [4], таблеточные VARTA ZR Button Cells 33–130 mA h 1.65 V [5], моноблоки PowerGenix NiZn LN0 40 A h [6] и т.д. Работоспособность никель-цинковых аккумуляторов и элементов в большой степени зависит от характеристик отрицательного цинкового электрода. Поэтому создание высокоемких никель-цинковых источников тока с низким саморазрядом и большим сроком службы возможно лишь при знании процессов, происходящих на пористом цинковом электроде при разряде и хранении источника тока. В отличие от никель-цинковых, герметичные серебряно-цинковые источники тока до сих пор массово производятся как элементы питания часов, в компьютерном, промышленном, военном оборудовании и т.д.
Большинство исследований по механизму анодного окисления цинка в щелочных растворах проводилось в 60–80 гг. XX в., после чего количество их сократилось в связи с массовым появлением на рынке литий-ионных источников тока.
ЛИТЕРАТУРНЫЙ ОБЗОР
Анодные превращения цинка в условиях работы отрицательного электрода щелочного аккумулятора протекают в условиях малого объема электролита, насыщенного цинкатом калия, при поляризациях до 300 мВ. Эти условия существенно отличаются от большинства опубликованных исследований кинетики и механизма протекания соответствующих анодных процессов как по области поляризаций, так и по условиям их протекания: наличие свободного избытка щелочи практически во всех исследованиях.
Традиционно механизм анодного растворения цинка при разряде на отрицательном электроде при разряде щелочно-цинковых источников тока описывается следующими стадиями [7]:
(1.1)
${\text{Zn}} + {\text{4O}}{{{\text{H}}}^{--}} \to {\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{{{\text{2}}--}} + {\text{2e}},$(1.2)
${\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{{{\text{2}}--}} \to {\text{Zn}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}} + {\text{2O}}{{{\text{H}}}^{--}},$(1.3)
${\text{Zn}} + 2{\text{O}}{{{\text{H}}}^{--}} \to {\text{ZnO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{e}}.$Реакция (1.1) отвечает первичному процессу и сопровождается образованием пересыщенного цинкатного раствора. Реакция (1.2) характерна для вторичного процесса, который определяет работоспособность цинкового электрода. При недостатке в зоне реакции ионов OH– процессы могут протекать по уравнению (1.3) [7].
Фарр и Хэмпсон [8] полагают, что электрохимический процесс протекает двухстадийно, а образование иона [Zn(OH)4]2– происходит непосредственно при растворении активного гидроксида. Исследования импедансным методом выявили участие адсорбированных ионов гидроксила в анодном процессе. Полная стадийность процесса представлена следующей схемой:
(2.1)
${\text{Zn}} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {\text{Zn}}({\text{OH}})_{{{\text{adc}}}}^{--},$(2.2)
${\text{Zn}}\left( {{\text{OH}}} \right)_{{{\text{adc}}}}^{--}--{\text{ e}}\quad \to {\text{Zn}}\left( {{\text{OH}}} \right),$(2.3)
${\text{Zn}}\left( {{\text{OH}}} \right) + {\text{O}}{{{\text{H}}}^{--}}--{\text{e}} \to {\text{Zn}}{{\left( {{\text{OH}}} \right)}_{2}},$(2.4)
${\text{Zn}}{{\left( {{\text{OH}}} \right)}_{2}} + 2{\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {{\left[ {{\text{Zn}}{{{\left( {{\text{OH}}} \right)}}_{4}}} \right]}^{{2--}}}.$Чанг [9] рассматривал как адсорбированное промежуточное соединение Zn(OH)2, и его десорбция (растворение) должна была быть лимитирующей стадией.
В работах отечественной исследовательской группы под руководством В.Н. Флерова [10] показано, что на механизм анодного растворения цинка в значительной степени влияет концентрация цинка в щелочном растворе. В бесцинкатных растворах КОН конечным продуктом анодного окисления является ион [Zn(OH)4]2–, а наиболее медленной стадией процесса является перенос электрона с образованием иона ${\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--}.$ Схема процесса имеет следующий вид:
(3.2)
${\text{ZnOH}} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {\text{Zn}}({\text{OH}})_{{\text{2}}}^{--},$(3.3)
${\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{2}}}^{--} + {\text{O}}{{{\text{H}}}^{--}}--{\text{e}} \to {\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--}\,\,\left( {{\text{rds}}} \right),$(3.4)
${\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {{\left[ {{\text{Zn}}{{{\left( {{\text{OH}}} \right)}}_{{\text{4}}}}} \right]}^{{{\text{2}}--}}},$В насыщенных цинкатных растворах механизм процесса представлен следующими стадиями:
(4.2)
${\text{ZnOH}} + {\text{O}}{{{\text{H}}}^{--}}--{\text{e}} \to {\text{Zn}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}},$(4.3)
${\text{Zn}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}} + {\text{O}}{{{\text{H}}}^{--}} \to {\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--},$(4.4)
${\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {{\left[ {{\text{Zn}}{{{\left( {{\text{OH}}} \right)}}_{{\text{4}}}}} \right]}^{{{\text{2}}--}}}.$В пересыщенных цинкатных растворах конечным продуктом электродного процесса является ион ZnOH+, который образуется по схеме:
(5.3)
${\text{Z}}{{{\text{n}}}^{{2 + }}} + {\text{O}}{{{\text{H}}}^{--}} \to {\text{Zn(OH}}{{{\text{)}}}^{ + }}.$Однако наличие в цинкатных электролитах ионов цинката разного вида оспаривалось некоторыми исследователями. Ван Допне и Диркс [11] методами измерения рассеяния света и ЯМР не обнаружили различий между пересыщенными и ненасыщенными цинкатными растворами, предположив таким образом, что в обоих растворах присутствует только один вид цинкатного комплекса – $\left[ {{\text{Zn}}({\text{OH}})_{{\text{4}}}^{{{\text{2}} - }}} \right].$
Стоит отметить, что многие исследования проводились на вращающемся дисковом электроде, когда происходит быстрое обновление прианодного слоя раствора. При работе пористого цинкового электрода в щелочном источнике тока перемешивание электролита отсутствует. При этом наблюдается быстрое насыщение приэлектродного слоя цинкатом, поэтому в электролитах с различным содержанием цинката не должно проявляться заметной разницы в механизме анодного процесса. Последний, следовательно, должен приближаться к механизму, соответствующему насыщенному цинкатному раствору (реакции 4.1–4.2).
Исследованием механизма анодного окисления цинка в щелочных растворах занимались многие исследователи. Большинство исследователей сходятся на том, что растворение цинка на аноде сопровождается образованием оксидно-гидроксидных пленок цинка [12–17].
Халафалла и соавторы [13] исследовали кинетические возможности диффузионных процессов в предпассивационный период цинкового анода. Анализ результатов с помощью уравнения Санда привел к выводу, что на анодную пассивацию цинка решающее влияние оказывает затрудненность диффузии ионов ОН– через слой гидроксида цинка к поверхности металла. По мере накопления ионов цинката в прианодном слое становится возможным образование на электроде оксидной или гидроксидной пленки, которая может резко тормозить процесс окисления металла.
Вид образующегося пассивного слоя зависит от степени пересыщения цинкатом электролита и скорости выпадения гидроксида [16]. В работе [14] отмечается существование двух типов поверхностных фазовых пленок на цинке. Пленки первого типа – белые рыхлые хлопьевидные, которые образуются в отсутствие перемешивания осаждением из пересыщенного раствора цинката. При отсутствии пересыщения (при перемешивании) образуются пленки второго типа, которые более компактны и формируются непосредственно на поверхности электрода. Ответственными за пассивацию авторы считают пленки второго типа.
А.И. Левин и соавторы [18] определили, что пассивные пленки на цинке имеют толщину 20–40 Ǻ и не могут быть определены микроскопически. Авторы полагают, что оксид цинка покрывает металл сплошным плотно прилегающим слоем. По мере утолщения пленки напряженность электрического поля в ней уменьшается и проникновение ионов металла через решетку оксида затрудняется, вследствие чего скорость роста пассивной пленки уменьшается. О наличии под пористым слоем оксидной фазы цинка плотной беспористой оксидной пленки также сообщается в работах [19–21].
Современные исследования механизма анодного окисления цинка в щелочных растворах, в том числе строения пассивных пленок на поверхности электрода, провел M. Мокаддем с сотрудниками [22]. Методом атомно-эмиссионной спектроэлектрохимии авторами было установлено, что анодный процесс окисления цинка сопровождается формированием макроскопических оксидно-гидроксидных пленок на поверхности цинкового электрода. При этом замедленной стадией является не перенос электрона с образованием иона ${\text{Zn}}({\text{OH}})_{{\text{3}}}^{--},$ как говорится в работе [10], и не десорбция Zn(OH)2, как предложено в работе [9], а перенос электрона в адсорбционной пленке ZnOHадс. Поэтому был предложен следующий механизм анодного окисления цинка:
(6.1)
${\text{Zn}} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {\text{ZnO}}{{{\text{H}}}_{{{\text{а д с }}}}} + {\text{ e}},$(6.2)
${\text{ZnO}}{{{\text{H}}}_{{{\text{а д с }}}}} + {\text{O}}{{{\text{H}}}^{--}} \to {\text{Zn(OH}}{{{\text{)}}}_{{\text{2}}}}{\text{(s) }} + {\text{e}}\,\,\,({\text{rds}}),$(6.3)
${\text{Zn}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}}\left( {\text{s}} \right) + {\text{O}}{{{\text{H}}}^{--}} \to {\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--},$(6.4)
${\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{3}}}^{--} + {\text{O}}{{{\text{H}}}^{--}} \to \left[ {{\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{{{\text{2}}--}}} \right].$В результате проведенных исследований было обнаружено по крайней мере три формы оксидно-гидроксидных пленок на поверхности цинка при его анодном окислении. Оксидные образования первого типа появляются, когда поверхность металл/раствор становится локально насыщенной ионами Zn2+. Оксид второго типа формируется на металлической поверхности под пленкой оксида первого типа, но оказывает слабый ингибирующий эффект на растворение цинка. Оксид третьего типа образуется в гораздо меньших количествах и в результате переводит поверхность в пассивное состояние. Образование оксида второго типа под пористой пленкой первого типа подтверждает результаты исследований, проведенных в работах [19–21]. В целом представленный группой Мокаддема механизм образования оксидно-гидроксидных пленок дополняет и расширяет данные, представленные в работах [14] и [16].
Су-Мун Пак и сотрудники [23] исследовали процессы анодного окисления цинка в разбавленных растворах KOH (0.10–0.010 M). При проведении опытов применялся метод электрохимической импедансной спектроскопии. Результаты показали, что стадия переноса электрона протекает через тонкую оксидно-гидроксидную пленку, электрическое состояние которой подвергается сильным изменениям при потенциале, соответствующем стадии переноса электрона. Емкость этой пленки также сильно изменяется при переносе электрона, демонстрируя, что поверхность электрод/электролит сильно электризована во время переноса через нее электрона.
Однако в большинстве работ не указываются потенциальные области окисления цинка по различным механизмам и существования различных форм оксидных и гидроксидных слоев на поверхности металла. Особенно важно знание особенностей процесса окисления цинка в щелочных растворах для улучшения работоспособности пористых цинковых электродов щелочных источников тока, которые работают в широком диапазоне разрядных плотностей тока при минимальном количестве электролита, содержащемся только в пористом пространстве электродов и сепаратора. Кроме того, условия окисления активного вещества пористых цинковых электродов поверхностных и глубинных зон значительно различаются из-за омических потерь и диффузионных затруднений в поровом пространстве.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
В данной работе для исследования механизма физико-химических процессов, протекающих при анодной поляризации цинка в условиях ограниченного объема электролита, была применена специальная конструкция электрода (рис. 1) [24], в которой обеспечивался контакт рабочей поверхности электрода с минимально возможным количеством электролита ((3.5–3.8) × 10–5 см3/см2 геометрической поверхности электрода), что соответствует условиям работы пористого электрода в аккумуляторе.
Рис. 1.
Конструкция блока, применяемого для моделирования работы монолитного цинкового электрода в ограниченном объеме электролита: 1 – крышка из полимерного материала; 2 – стеклянный фильтр; 3 – гидратцеллюлозный сепаратор; 4 – тефлоновый корпус; 5 – цинковый электрод; 6 – цинковый электрод сравнения; 7 – эпоксидный изолятор; 8 – медный токоотвод.
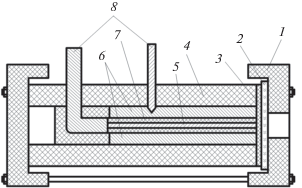
Исследования проводились при комнатной температуре. Для поляризационных исследований применялись потенциостаты Elins Potentiostat P-8, Elins Potentiostat P-30, электрод сравнения – цинковый.
Переменно-токовые измерения проводились с помощью специальной установки, принцип действия которой описан в [25] при величине амплитуды подаваемого переменного напряжения не более 1–2 мВ. Обработка результатов измерения производилась по методике, описанной в [26]. Теоретические основы переменнотокового метода исследования механизма и кинетики электрохимических реакций описаны в [27].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Анодные хроновольтамперограмы (рис. 2), снятые на цинковом электроде при поляризации до 300 мВ в ограниченном и свободном объеме калиевой щелочи, насыщенной ZnО, существенно различаются. Помимо значительного снижения максимальной величины тока анодного растворения цинка в условиях ограничения объема электролита, существенно изменился и внешний вид полученных зависимостей.
Рис. 2.
Анодные потенциодинамические кривые на монолитном цинковом электроде в ограниченном (1) и свободном (2) объеме раствора. Электролит: КОН 10 моль/л + ZnО насыщ. Скорость развертки потенциала 0.5 мВ/с.
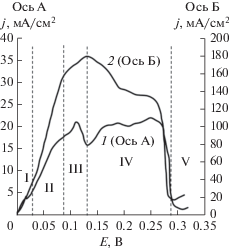
Анодные хроновольтамперограмы, снятые на цинковом электроде в большом объеме цинкатного электролита, имеют на кривой один максимум тока растворения в области поляризации 0.10–0.15 В, после которого наблюдается его плавное снижение и при поляризации 0.26–0.27 В происходит пассивация электрода. С ростом анодной поляризации цинкового электрода в ограниченном объеме электролита довольно быстрое начальное повышение тока замедляется в области поляризации 0.08–0.09 В, связанной, как показали дальнейшие исследования, с накоплением цинкатных ионов в приэлектродном слое.
Далее на хроновольтамперограме наблюдается повышение анодного тока в области поляризаций 0.10–0.12 В, связанное с образованием гидроксид-ионов при разложении пересыщенного цинкатного раствора. При дальнейшем увеличении потенциала наблюдается снижение анодной активности цинка. Это вызвано тем, что образующиеся при разложении пересыщенного цинкатного раствора оксидные и гидроксидные слои, как указано в [13], тормозят процесс окисления цинка. В области поляризации около 0.13–0.14 В начинается подъем тока, связанный с началом протекания процесса по твердофазному механизму. При поляризации 0.26–0.27 В происходит полная пассивация цинкового электрода, как и в случае растворения цинка в свободном объеме электролита.
Хронопотенциометрические измерения также показали существенное влияние уменьшения объема электролита на внешний вид регистрируемых кривых исследования (рис. 3) (значения плотности тока взяты выше максимальной плотности тока для каждой из кривых, представленных на рис. 2). На анодных хронопотенциограммах цинкового электрода в 10 М КОН, насыщенной ZnО, снятых в свободном объеме электролита, после включения тока и начального участка более быстрого роста наблюдается плавный рост поляризации вплоть до достижения потенциала пассивации и последующего резкого возрастания потенциала.
Рис. 3.
Хронопотенциометрические кривые монолитного цинкового электрода в растворе КОН 10 М + + 1 г-ион/л Zn2+: 1 – в свободном объеме электролита (j = 300 мА/см2 ); 2 – в ограниченном объеме электролита (j = 30 мА/см2).
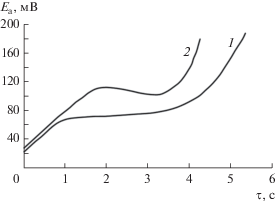
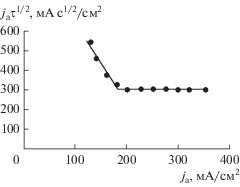
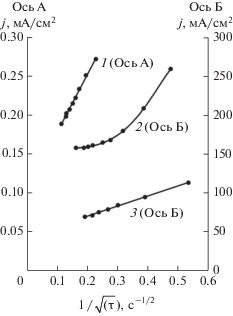
Графическим методом построения касательных было определено переходное время [28]. Анализ зависимости величины переходного времени от величины анодного тока в характеристических координатах jτ1/2 = f(j) (где j – величина плотности анодного тока, τ – величина переходного времени процесса) показал, что пассивация цинкового электрода при плотности тока более 200 мА/см2 связана с диффузионными процессами, о чем свидетельствует независимость произведения jτ1/2 от плотности тока при его дальнейшем росте. При плотностях тока ниже 200 мА/см2 процесс контролируется замедленной химической реакцией образования цинкатных комплексов (рис. 4), что хорошо согласуется с исследованиями других авторов, связывающих диффузионные затруднения с трудностью отвода анодных продуктов от реакционной поверхности [13, 15, 29].
Рис. 4.
Зависимость jaτ1/2 от плотности анодного тока ja в свободном объеме электролита КОН 10 М + + 1 г-ион/л Zn2+.
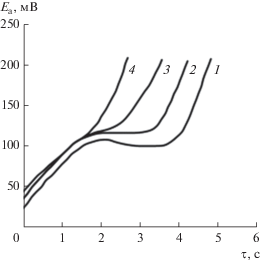
Анодные хронопотенциограммы, снятые в условиях ограничения объема электролита, имеют иную форму (рис. 3): на них наблюдается четкий максимум при достижении величины поляризации 100–120 мВ и после некоторого спада наблюдается ее резкий рост и пассивация электрода. Введение в насыщенный цинкатный раствор моногидрата лития, известного как замедлитель “старения” пересыщенных цинкатных растворов, приводит к уменьшению величины переходного времени пассивации цинка на хронопотенциограммах в условиях ограниченного объема электролита и его последующему исчезновению с ростом концентрации лития в растворе (рис. 5), что указывает на присутствие стадии разложения пересыщенного цинкатного раствора в общем механизме окисления цинка в щелочном электролите.
Рис. 5.
Хронопотенциометрические анодные кривые для цинкового электрода в ограниченном объеме электролита КОН 10 М+1 г-ион/л Zn2+ (j = 30 мА/см2). Присадка LiOH ⋅ H2O в электролите, г/л: 1 – без присадки; 2 – 3.0; 3 – 6.0; 4 – 12.0.
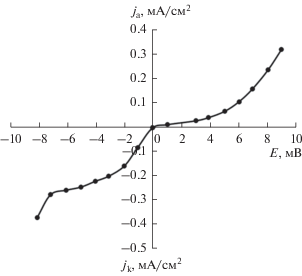
Поляризационные кривые (рис. 6), снятые на цинковом электроде в ограниченном объеме 10 М КОН, насыщенной ZnО, в области малых поляризаций имеют сложный нелинейный вид, что может говорить о малых затруднениях реакции переноса электронов при окислении цинка.
Рис. 6.
Поляризационная зависимость для монолитного цинкового электрода в области малых поляризаций в растворе КОН 10 моль/л + ZnОнасыщ.
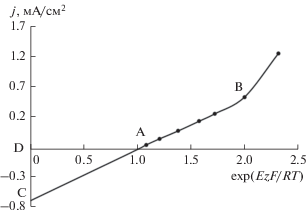
При построении поляризационных зависимостей в координатах j–exp(EzF/RT) (рис. 7) в области потенциалов около 7–8 мВ (отрезок AB) ток линейно возрастает с увеличением j–exp(EzF/RT), что характерно для электродных процессов, контролируемых диффузионной стадией [30]. Величина предельного диффузионного тока рассчитывается для этого диапазона поляризаций путем экстраполяции отрезка AB на ось j и отсечением на ней отрезка CD, что составляет (0.6–0.8) × 10–3 А/см2. Это на несколько порядков ниже соответствующей величины для анодного процесса, протекающего в избытке свободной щелочи. Это, по-видимому, связано с наличием на поверхности цинка в этих условиях фазового слоя, состоящего из оксидов или гидроксидов цинка, затрудняющих диффузию ионов, участвующих в электрохимических превращениях. В пользу такого предположения говорит величина ионной проводимости, рассчитанная из результатов хроноамперометрических измерений для этой области потенциалов по наклону прямолинейного участка в координатах j = f(τ–1/2).
Рис. 7.
Поляризационная зависимость для цинкового электрода в области малых поляризаций в растворе КОН 10 моль/л + 1 г-ион/л Zn2+.
В случае затрудненной диффузии ионов через поверхностную оксидную пленку при параболическом законе ее роста тангенс угла наклона хроноамперометрической зависимости в указанных координатах составляет по Крофту [31]:
(7)
${\text{tg}}\alpha = \frac{{KT\chi }}{{2eg_{{{\text{ZnO}}}}^{{\text{V}}}}}{{\left[ {1 - \exp \left( { - \frac{{eE}}{{KT}}} \right)} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Хроноамперометрические измерения, выполненные в ограниченном объеме электролита при поляризациях более 7–8 мВ и до потенциалов начала пассивации (рис. 8) свидетельствуют об усложнении механизма окисления цинка, вероятно связанном с изменением структуры и сплошности оксидно-гидроксидной пленки, а также с затруднениями образования и диффузии цинкатных комплексов вглубь раствора, гидроксил-ионов к поверхности металла и распада комплексного соединения. В пассивной области (при поляризациях свыше 300 мВ), как это было отмечено и в работах других исследователей [18–22], анодное окисление цинка лимитируется диффузионными затруднениями ионов металла или кислорода через фазовую оксидную пленку на поверхности электрода. Ионная проводимость этой пленки ниже, чем в области малых поляризаций и составляет (2–3) × 10–6 См см–1 что, по-видимому, связано с формированием пленки более стехиометрического состава и нейтрализацией носителей заряда за счет адсорбционных процессов. Образующийся на поверхности цинкового анода ион ${\text{Zn}}({\text{OH}})_{{{\text{adc}}}}^{--}$ по реакции (2.1) может нейтрализовать одновалентные ионы цинка Zn+, отвечающие за ионную проводимость оксида цинка [33].
Рис. 8.
Хроноамперометрические зависимости для монолитного цинкового анода в растворе КОН 10 моль/л + 1 г-ион/л Zn2+ при поляризациях, мВ: 1 – 3.0; 2 – 45.0; 3 – 600.
Хроноамперометрические зависимости, полученные на цинковом электроде в ограниченном объеме электролита, в координатах j–(τ–1/2) не экстраполируются в начало координат (рис. 8). Это, по-видимому, связано с тем, что только часть тока тратится на увеличение фазового оксидного слоя, как это было обнаружено Б.Н. Кабановым с сотрудниками [34] при изучении растворения цинка в пассивной области.
Косвенно образование и лимитирующее действие поверхностной оксидной пленки на диффузионные процессы при анодном окислении цинка в области малых поляризаций подтверждается следующими наблюдениями:
– снижение расчетной величины предельного диффузионного тока со временем выдержки бездействующего электрода;
– существенное снижение анодного тока после предварительной анодной поляризации цинкового электрода малым током и последующей длительной выдержки без нагрузки перед измерениями;
– снижение предельного диффузионного тока анодного растворения цинка при насыщении цинкатного электролита кислородом и его рост при обескислороживании;
– независимость тока растворения от перемешивания раствора;
– зависимость анодного тока от степени насыщения щелочи цинкатами;
– влияние температуры на предельную растворимость цинкатов, в свою очередь влияющих на растворимость образующейся фазовой пленки в свободной щелочи.
Исследование частотной зависимости составляющих комплексной проводимости цинкового электрода в насыщенных цинкатных растворах при анодных поляризациях 6 и 12 мВ позволило предположить следующие наиболее вероятные эквивалентные электрические схемы изучаемых процессов, представленные на рис. 9.
Рис. 9.
Эквивалентные электрические схемы процесса окисления цинка при различных поляризациях. Cадс1, Cадс2, Cадс – емкость адсорбции; Rадс – сопротивление адсорбции; Rw – сопротивление диффузии; Сдэс – емкость двойного электрического слоя; Rр-ра – сопротивление раствора электролита; Rхим и Схим – сопротивление и емкость гетерогенной химической реакции.
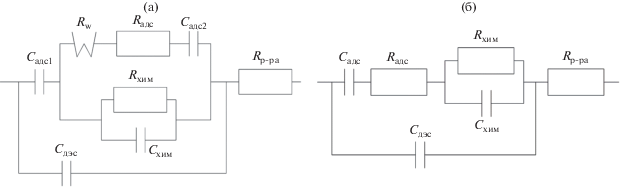
Схема 9a (на рис. 9) (поляризация 6 мВ) включает псевдоемкость адсорбции (Садс1 = 0.153 × 10–3 Ф). Величина емкости двойного электрического слоя Сдэс = (0.3–0.5) мФ/см2, (с учетом шероховатости поверхности) может свидетельствовать о наличии на поверхности цинкового электрода оксидной пленки с большим сопротивлением, которая приводит к увеличению расстояния между обкладками ДЭС. Наличие в схеме двух параллельных ветвей Rw, Rадс, Cадс2 и Rхим, Схим свидетельствует о протекании окислении цинка по двум параллельным процессам с соизмеримой величиной затруднений. Величина рассчитанного из Rw коэффициента диффузии, равная 10–14–10–15см2/с, характерна для твердофазной диффузии. Согласно данным, приводимым в [33], диффундирующими частицами являются одновалентные ионы Zn+. Наличие емкости Cадс2 и сопротивления Rадс в верхней ветви эквивалентной схемы связано с адсорбцией реагирующих веществ и их последующей диффузией через пленку. Процесс, характеризующийся элементами нижней ветви Rхим, Схим эквивалентной схемы, связан, по нашему мнению, с окислением цинка на поверхности, не занятой оксидом. Таким образом, при поляризации менее 10 мВ, окисление цинка идет с различными скоростями на участках, покрытых оксидом цинка и свободным от него. Как показали расчеты, доля поверхности, покрытой оксидной пленкой, составляет 96–97%. Однако, учитывая величины элементов эквивалентной электрической схемы, лишь только 1/3 тока идет на окисление цинка по твердофазному механизму. Остальной ток тратится на окисление цинка через жидкую фазу и приводит к образованию пересыщенного по цинкату раствора.
При поляризации 12 мВ эквивалентная электрическая схема уже не содержит параллельных цепей (схема 9б , рис. 9), что указывает на протекание анодного окисления цинка по жидкофазному механизму по всей поверхности электрода. Лимитирующей стадией в этих условиях является химическая реакция (элементы схемы Rхим и Схим), следующая за стадией ионизации, в которой участвуют адсорбированные ионы ОН– (элементы схемы Садс и Rадс). Доля поверхности, покрытая оксидной пленкой в этих условиях, значительно уменьшается вследствие образования пленки с высокими внутренними механическими напряжениями, что приводит к частичному нарушению ее механической целостности и отслаиванию от поверхности электрода.
Таким образом, в области малых поляризаций (до 10 мВ) анодное окисление цинка идет через образование не сплошной оксидной пленки. На закрытых пленкой участках процесс окисления цинка идет по твердофазному механизму, а на открытых – по жидкофазному. При поляризациях свыше 10 мВ процесс окисления цинка идет только по жидкофазному механизму.
Исследования изменения потенциала цинкового электрода в ограниченном объеме электролита после его предварительной анодной поляризации в области поляризаций 0.12–0.13 В и отключения тока показали, что в этой области потенциалов процесс протекает с диффузионным контролем: о чем свидетельствует, согласно [35], линейная зависимость изменения потенциала электрода после отключения тока от логарифма времени (рис. 10).
Рис. 10.
Влияние величины начальной поляризации цинка в ограниченном объеме электролита на скорость спада потенциала: 1 – η = +0.06 В; 2 – η = +0.12 В.
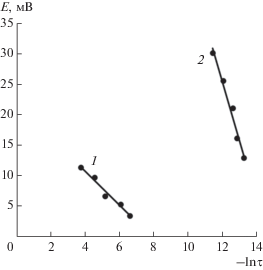
Исходя из наклона прямых Е–lnτ (рис. 10) по уравнениям:
(8б)
${{E}_{1}} = {{E}_{0}} + \frac{{RT}}{{zF\sqrt \pi }} - \frac{{RT}}{{2zF}}\ln {{j}_{{\text{a}}}}$Количество диффундирующих ионов может быть определено по [27] из наклона начального участка поляризационной кривой. Фарадеевское сопротивление Rф в случае диффузионной поляризации равно:
(9)
${{R}_{{\text{ф }}}} = {{\left. {\frac{{dE}}{{dj}}} \right|}_{{E \to 0}}} = \frac{{RT\nu }}{{nF{{j}_{{{\text{п р }}}}}}},$Во второй потенциальной области (E = 30–80 мВ) (рис. 2) число диффундирующих ионов равно 4. Таким образом, наиболее вероятная реакция, протекающая в этой области потенциалов, может быть записана в виде:
(10)
${\text{Zn}} + {\text{4O}}{{{\text{H}}}^{--}} \to \left[ {{\text{Zn}}\left( {{\text{OH}}} \right)_{{\text{4}}}^{{{\text{2}}--}}} \right] + {\text{2e}}.$Ионом, вызывающим появление при этом перенапряжения диффузии, является гидроксил-ион. Подобные реакции описывались в [29] и характеризуют протекание электрохимического процесса окисления цинка по первичному механизму без образования твердой фазы.
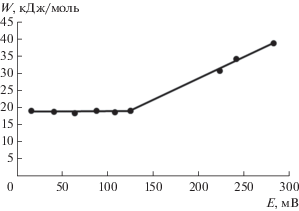
Исследование зависимости составляющих комплексного сопротивления цинкового электрода от частоты переменного тока показало, что в этой области потенциалов процесс контролируется диффузионными затруднениями в жидкой фазе, связанными, по-видимому, с затрудненностью доставки гидроксил-ионов к поверхности электрода. Кроме того величина энергии активации, в этой области поляризаций, не зависит от потенциала и составляет примерно 20 кДж/моль (рис. 11).
Рис. 11.
Зависимость энергии активации процесса окисления Zn-электрода от поляризации в растворе КОН, 7 моль/л.
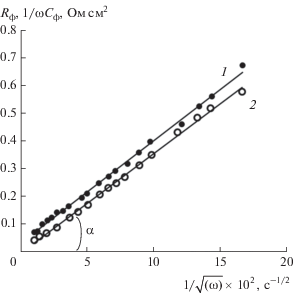
Подтверждением диффузионного характера процесса ионизации цинка во второй потенциальной области могут служить импедансные зависимости (рис. 12), которые имеют прямолинейный характер и экстраполируются в начало координат. Коэффициент диффузии ионов, участвующих в электрохимической реакции, определенный по тангенсу угла наклона α импедансных зависимостей, составляет (2–3) × 10$^{{ - 6}}$ см2/с и хорошо согласуется с величиной коэффициента диффузии гидроксильных ионов в гидратцеллюлозном сепараторе [36].
Рис. 12.
Импеданс цинкового анода в ограниченном объеме электролита КОН 10 моль/л + 1 г-ион/л Zn2+. Поляризация цинкового анода +25 мВ: 1 – Rф; 2 – 1/ωCф.
В третьей потенциальной области поляризационной кривой (E = 0.08–0.12 В) (рис. 2) число диффундирующих ионов в суммарной электрохимической реакции равно 2 при общем заряде –2. И в данной области процесса наиболее вероятна суммарная реакция вида:
(11)
${\text{Zn}} + {\text{2O}}{{{\text{H}}}^{--}} \to {\text{ZnO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{2e}}$Таким образом, учитывая результаты исследований спада потенциала после предварительной поляризации и результаты работ других исследователей, наиболее вероятная реакция (10), протекающая в области поляризаций от 12 до 80 мВ. Подобная реакция описана в работах З.П. Архангельской [29] и характеризует электрохимическое окисление цинка по первичному механизму без образования твердой фазы. В области поляризаций от 0.08 до 0.12 В наиболее вероятна реакция (11), которая лимитируется замедленной диффузией OH– ионов.
Подтверждением протекания этих реакций при анодном окислении цинка в ограниченном объеме электролита является фиксация нами продуктов указанных реакций в сепараторе. До поляризации 0.07–0.08 В продуктом электрохимического процесса являются цинкатные ионы, образующиеся по реакции (10) и накапливающиеся из-за своей малой подвижности в сепараторе. При поляризации свыше 0.08 В на поверхности цинкового анода наблюдается образование оксида цинка по реакции (11). Его количество постоянно увеличивается вплоть до пассивации электрода. Рост концентрации цинката в сепараторе наблюдается до поляризации электрода 0.14–0.15 В. При дальнейшем увеличении поляризации концентрация цинка в растворе остается постоянной. Полученные результаты свидетельствуют о 2.5–3-кратном пересыщении раствора по цинкат-иону и хорошо согласуются с данными работы [29].
При поляризации свыше 0.1–0.12 В наблюдается снижение скорости анодного растворения цинка (рис. 2), которое в работе [37] получило название “псевдопассивация”. Согласно химическому анализу, конечными продуктами окисления в этой области является оксид и гидроксид цинка. Величина энергии активации процесса, рассчитанная из результатов температурно‑кинетических измерений, линейно возрастает с увеличением поляризации электрода более 0.1–0.12 В (рис. 10). Это, очевидно, связано с фиксируемым ростом толщины оксидной пленки на поверхности цинка. На появление изолирующей оксидной пленки указывают и хроновольтамперометрические зависимости, полученные с автоматической компенсацией омической составляющей (рис. 13). Рассчитанная из этих измерений величина сопротивления поверхностных пленок, образованных при поляризации свыше 0.11–0.12 В, равна 0.8–1.0 Ом/см2. С учетом коэффициента шероховатости поверхности электрода, значения омического сопротивления оксидных или гидроксидных слоев близки к величинам сопротивления плотных, беспористых пленок, приводимых в работе [14]. Если бы образующаяся пленка оксида цинка являлась пористой и процесс окисления проходил по жидкофазному механизму, то величина омического падения напряжения составила бы всего несколько милливольт, как это происходит в области поляризаций до 0.1–0.11 В, где омическая составляющая менее 5 мВ.
Рис. 13.
Анодные потенциодинамические кривые для монолитного цинкового электрода в ограниченном объеме щелочи без учета (1) и с учетом (2) омической составляющей. Vразв = 20 мВ/мин.
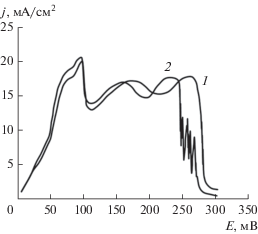
Подтверждением окисления цинка в этих условиях по твердофазному механизму может являться схожий характер хроноамперометрических зависимостей, полученных нами (рис. 14), и приведенных в работе [38] по исследованию окисления цинка в пассивном состоянии. Согласно данным работы [38] скорость окисления определяется диффузией ионов металла или кислорода через плотную оксидную пленку.
Рис. 14.
Хроноамперометрические кривые монолитного цинкового анода в ограниченном объеме электролита КОН, 10 моль/л + 1 г-ион/л Zn2+. Поляризация электрода, мВ: 1 – 40, 2 – 220, 3 – 640.
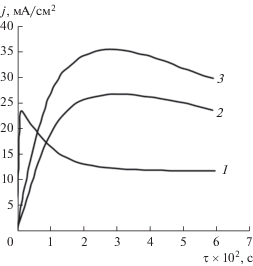
При поляризациях цинкового электрода до 0.1 В наблюдается практически мгновенное повышение анодного тока, после которого начинается его постепенный спад, обусловленный концентрационными изменениями у поверхности анода. При поляризации цинкового анода более 0.1 В, в том числе и при потенциалах пассивного состояния, наблюдается относительно медленный подъем тока, максимум которого достигается через (2–3) × 10–2 с. С меньшей скоростью происходит и последующий спад анодных токов. Появление максимума на j–τ-кривых при больших анодных поляризациях можно трактовать на основании кинетики твердофазной реакции, в соответствии с которой прохождение скорости реакции через максимум обусловлено симбатным характером изменения площади реакционной зоны. Доля активной поверхности цинкового анода при небольших поляризациях составляет по данным [39] 20–25%. При поляризации свыше 0.1 В вероятно становится возможным трансформация поверхностного оксида, образующегося в ходе анодного процесса, в оксид или гидроксид, обладающий большей ионной проводимостью. Это приводит к более равномерному распределению тока по поверхности цинкового анода. Подобное саморегулирование скорости анодного окисления цинка наблюдалось также В.Н. Флеровым [40] в области транспассивного состояния и было объяснено изменением толщины и степени окисленности оксидной пленки.
Таким образом, в области поляризаций 0.08–0.12 В сначала идет образование пересыщенного цинкатного электролита по реакции (10). При достаточно высокой концентрации цинката начинается процесс разложения пересыщенного (в 2–3 раза) цинкатного электролита, содержащего нестабильные цинкатные ионы ZnOH+ [10].
Суммарная анодная реакция при поляризации 0.8–0.12 В может быть записана в виде реакции (11).
Перекрытие поверхности металла фазовым слоем оксида или гидроксида цинка приводит к затруднению анодного процесса, увеличивает градиент потенциала в оксидной пленке до величин, при которых становятся возможными твердофазные превращения на поверхности цинкового анода. Окисление цинка в этом случае также может быть описано реакцией (11). Однако в этих условиях скорость процесса уже не зависит от концентрации щелочного электролита, а определяется величиной ионной проводимости образующегося оксида. При поляризации 270–300 мВ наступает полная пассивация электрода.
Проведенные исследования позволяют обоснованно подойти к выбору активирующих добавок, улучшающих работоспособность пористых цинковых электродов при различных режимах эксплуатации щелочно-цинковых источников тока.
Список литературы
Thomas A. Edison. Reversible galvanic battery. Patent US684204 A (U.S.A.). 1901.
James, J., Drumm. Storage battery. Patent US1955115 A (U.S.A.). 1934.
Acmepower. URL: http://acmepower.ru/.
Shenzhen BetterPower Battery Co., LTD. URL: http://en.betterpower.com.cn/.
VARTA Microbattery – Website. URL: http://www.varta-microbattery.com/en.html.
PowerGenix Batteries – Cleaner, More Powerful Batteries. URL: http://powergenix.com/.
Коровин, Н.В., Скудин, А.М. Химические источники тока, М.: Издательство МЭИ, 2003. 740 с. [Korovin N.V. and Skudin A.M. Electrochemical cells (in Russian), Moscow: Izdatelstvo MEI, 2003. 740 p.]
Farr, G.P.G. and Hampson, M.A., Evolution of characteristics of exchange reactions. 1. Exchange reactions at a solid zinc electrode in alkaline, J. Electroanal. Chem., 1967, vol. 13, no. 4, p. 433.
Chang, Y.-C., A kinetic model for the anodic dissolution of zinc in alkaline electrolyte with sodium metasilicate additions, Electrochim. Acta, 1996, vol. 41, p. 2425.
Элькинд, К.М., Михаленко, М.Г., Флеров, В.Н. О механизме анодного растворения цинка в концентрированных растворах КОН. Известия ВУЗов СССР. Сер. Химия и хим. технология. 1978. Т. 21. № 6. С. 849. [Elkind, K.M., Mikhalenko, M.G., and Flerov, V.N., About mechanism of anodic zinc dissolution in concentrated solutions KOH, Izvestiya Visshikh Uchebnikh Zavedenij USSR. Seria Khimiya i khimicheskaya tekhnologiya (in Russian), 1978, vol. 21, no. 6, p. 849.]
Van Doopne, W., Dirkse, T.P., Supersaturated Zincate Solutions, J. Electrochem. Soc., 1975, vol. 122, no. 1, p. 1.
Воздвиженский, Г.Ф., Кочман, Э.Д. Вольтамперометрическое иследование анодного растворения и пассивации цинка в щелочных растворах. Журн. физической химии. 1965. Т. 39. № 3. С. 657. [Vozdvizhenskii, G.F. and Kochman, E.D., Voltammetric research of anodic dissolution and zinc passivation in alkaline solutions, Russian J. Physical Chemistry A, 1965, vol. 39, no. 3, p. 657.]
Khalafalla, S.E., Shams, El.-Din, A.M., and El-Tantawy, J.K., Study anodic and catodic polarization zinc amalgam, J. Phys. Chem., 1959, vol. 63, no. 8, p. 1252.
Huber, K., Anodic formation of coating a magnesium zinc and cadmium, J. Electrochem. Soc., 1953, vol. 100, p. 376.
Dirkse, T.P., A comparison of amalgamated and non- amalgamated zinc electrodes, Power Sources Z. – Oxford et al., 1970, p. 411.
Никитина, З.Я. Пассивация цинкового электрода в гальванических элементах со щелочным электролитом. Журн. прикл. химии. 1958. Т. 31. № 2. С. 218. [Nikitina, Z.Y., Zinc electrode passivation in galvanic elements with alkaline electrolyte, J. applied chemistry of the USSR, 1958, vol. 31, no. 2, p. 218.]
Powers, R.W. and Breiter, M.W., The anodic dissolution and passivation Zn in concentrated solution KOH, J. Electrochem. Soc., 1969, vol. 116, no. 6, p. 719.
Левин, А.И., Простаков, Г.Д., Суслопаров, М.Е. Исследование пассивирующих слоев на цинке рентгенографическим методом. Докл. А.Н. СССР. 1959. Т. 129. № 3. С. 617. [Levin. A.I., Prostakov. G.D., and Susloparov, M.E. Research of passivating layers on zinc by radiographic method, Doklady Akademii Nauk USSR (in Russian), 1959, vol. 129, no. 3, p. 617.]
Huber, K., The structure of passivating layers, Zeitschrift für Elektrochemie, 1958, vol. 62, p. 675.
Powers, R.W., Anodic films on zinc and the formation of cobuebs, J. Electrochem. Soc., 1969, vol. 116, no. 12, p. 1652.
Оше, Е.К., Розенфельд, И.А. Новый метод исследования поверхностных окислов на металлах в растворах. Электрохимия. 1968. Т. 4. № 10. С. 1200. [Oshe, E.K. and Rozenfeld, I.A., New research method of surface oxides on metals in solutions, Soviet Electrochemistry, 1968, vol. 4, no. 10, p. 1200.]
Mokaddem, M., Volovitch, P., and Ogle, K., The anodic dissolution of zinc and zinc alloys in alkaline solution. I. Oxide formation on electrogalvanized steel, Electrochim. Acta, 2010, vol. 55, p. 7867.
Younghoon, Ko and Su-Moon, Park., Zinc Oxidation in Dilute Alkaline Solutions Studied by Real-Time Electrochemical Impedance Spectroscopy, The J. Physical Chemistry C, 2012, vol. 116, no. 13, p. 7260.
Гунько, Ю.Л., Шишов, В.И., Михаленко, М.Г., Флеров, В.Н. Об особенностях анодного окисления цинка в щелочных растворах на интенсивных режимах процесса. Журн. прикл. химии. 1986. № 1. С. 196. [Gunko, Y.L., Shishov, V.I., Mikhalenko, M.G., and Flerov, V.N., About features of anodic zinc oxidation in alkaline solutions at intensive process modes, J. applied chemistry of the USSR, 1986, no. 1, p. 196.]
Афанасьев, А.В., Москвичев, А.Н., Москвичев, А.А., Односевцев, В.А., Орлов, И.Я. Низкочастотный комплекс импедансных измерений характеристик проводящих сред. Вестник Нижегородского университета им. Н.И. Лобачевского. 2008. № 3. С. 60. [Afanasiev, A.V., Moskvichev, A.N., Moskvichev, A.A., Odnosevtsev, V.A., and Orlov, B.Y., Low-frequency complex of impedance measurment of conducting medium characteristics, Vestnik Nizhegorodskogo universiteta im. N.I. Lobachevskogo, 2008, no. 3, p. 60.]
Москвичев, А.Н., Москвичев, А.А. Исследование свойств и кинетики полимеризации анаэробных герметиков методом импедансных измерений. Известия ВУЗов. Серия Химия и химическая технология. № 3. 2007. С. 69. [Moskvichev, A.N., Moskvichev, A.A., Research of properties and kinetics of anaerobic sealants polymerization by impedance measurement method, Izvestiya Visshikh Uchebnikh Zavedenij. Seria Khimiya i khimicheskaya tekhnologiya (in Russian), no. 3, 2007, p. 69.]
Феттер, К. Электрохимическая кинетика. М.: Мир, 1967. 856 с. [Fetter, K., Electrochemical kinetics (in Russian), Moscow: Mir, 1967. 856 p.]
Захаров, М.С., Баканов, В.И., Пнев, В.В. Хронопотенциометрия. Москва: Химия, 1978. 200 с. [Zakharov, M.S., Bakanov, V.I., and Pnev, V.V., Chronopotentiometry (in Russian), Moscow: Khimia, 1978. 200 p.]
Архангельская, З.П., Машевич, М.Н., Андреева, Г.Г. Особенности протекания вторичного процесса при поляризации цинковых электродов с плотной и пористой активной массой в щелочном электролите. Журн. прикл. химии. 1970. Т. 43. № 6. С. 1248. [Arkhangelskaya, Z.P., Mashevich, M.N., and Andreeva, G.G., Features of secondary process course at zinc electrodes polarization with solid and porous active mass in alkaline electrolyte, J. applied chemistry of the USSR, 1970, vol. 43, no. 6, p. 1248.]
Дамаскин, Б.Б., Петрий, О.А. Введение в электрохимическую кинетику. М.: Высшая школа, 1975. 416 с. [Damaskin, B.B. and Petriy, O.A., Introduction to electrochemical kinetics (in Russian), M.: Visshaya Shkola, 1975. 416 p.]
Croft, G.T. and Tuomi, D., A model for electrochemical reaction kinetic of solid-state phase transformations in reversible, J. Electrochem. Soc., 1961, vol. 108, no. 10, p. 915.
Чеботин, В.Н., Перфильев, М.В. Электрохимия твердых электролитов. М.: Химия, 1978. 312 с. [Chebotin, V.N. and Perfilev, M.V., Electrochemistry of solid electrolytes (in Russian), Moscow: Khimiya, 1978. 312 p.]
Болтакс, Б.И. Диффузия в полупроводниках. М.: Физматгиз, 1961, 462 с. [Boltaks B.I. Diffusion in Semiconductors (in Russian), M.: Fizmatgiz, 1961, 462 p.]
Попова, Т.И., Симонова, Н.А., Кабанов, Б.Н. Анодное растворение пассивного цинка в цинкатных растворах щелочи. Электрохимия. 1967. Т. 3. № 12. С. 1419. [Popova, T.I., Simonova, N.A., and Kabanov, B.N., Anodic dissolution of passive zinc in zincate alkaline solutions, Soviet Electrochemistry, 1967, vol. 3, no. 12, p. 1419.]
Барабошкин, А.Н., Салтыкова, Н.А. Электрохимия расплавов солевых и твердых электролитов. Труды института электрохимии. Уральский филиал АН. СССР. 1962. № 3. С. 44. [Baraboshkin, A.N. and Saltykova, N.A., Electrochemistry of salt and solid electrolyte melts, Trudy instituta elektrokhimii. Uralskiy filial Akademii Nauk USSR (in Russian), 1962, no. 3, p. 44.]
Михаленко, М.Г., Флеров, В.Н. Электрохимическое определение скорости диффузии цинката через гидратцеллюлозную сепарацию. Электрохимия. 1972. Т. 8. № 1. С. 81. [Mikhalenko, M.G. and Flerov, V.N., Electrochemical determination of zincate diffusion rate through hydratecellulose separation, Soviet Electrochemistry, 1972, vol. 8, no. 1, p. 81.]
Usano, T. and Charito, K., Passivation zinc in alkaline electrolyte, J. Metall. Finish. Soc. Japan, 1970, vol. 21, no. 2, p. 60.
Попова, Т.И., Видович, Г.А., Симонова, Н.А., Кабанов, Б.Н. Анодное растворение глубоко пассивного цинка в щелочных пересыщенных растворах цинката. Электрохимия. 1967. Т. 3. № 8. С. 970. [Popova, T.I., Vidovich, G.A., Simonova, N.A., and Kabanov, B.N., Anodic dissolution of deep passivated zinc in alkaline supersaturated zincate solutions, Soviet Electrochemistry, 1967, vol. 3, no. 8, p. 970.]
Landsberg, H., Zum anodischen Verhalten der Zinks in Natronlaude, Z. Phys. Chem., 1957, vol. 200, no. 3/4, p. 291.
Бакаев, В.В., Флеров, В.Н. О формировании пассивной пленки на транспассивных цинковых анодах в цинкатных растворах. Электрохимия. 1972. Т. 8. № 9. С. 1315. [Bakaev, V.V. and Flerov, V.N., About formation of passive layer on transpassive zinc anodes in zincate solutions, Soviet Electrochemistry, 1972, vol. 8, no. 9, p. 1315.]
Дополнительные материалы отсутствуют.


