Электрохимия, 2019, T. 55, № 5, стр. 629-636
Термодинамическое исследование селенидов серебра–олова методом ЭДС с твердым электролитом Ag4RbI5
И. Дж. Алвердиев a, С. З. Имамалиева b, Д. М. Бабанлы b, Ю. А. Юсибов a, Д. Б. Тагиев b, М. Б. Бабанлы b, *
a Гянджинский государственный университет
AZ-2000 Гянджа, пр. Г. Алиева, 187, Азербайджан
b Институт катализа и неорганической химии НАН Азербайджана
AZ-1143 Баку, пр. Г. Джавида, 113, Азербайджан
* E-mail: Babanlymb@gmail.com
Поступила в редакцию 01.11.2018
После доработки 27.11.2018
Принята к публикации 24.12.2018
Аннотация
Измерением ЭДС концентрационных относительно серебряного электрода цепей с твердым электролитом Ag4RbI5 в интервале температур 300–450 К изучена система Ag–Sn–Se в области составов Ag2Se–SnSe–Se. Из данных измерений ЭДС определена температура полиморфного перехода Ag8SnSe6 (355 К) и вычислены парциальные молярные функции серебра в некоторых фазовых областях указанной системы. Рассчитаны стандартные термодинамические функции образования и стандартные энтропии тройных фаз AgSnSe2. Ag0.84Sn1.16Se2 и двух модификаций Ag8SnSe6, а также термодинамические функции его полиморфного перехода.
1. ВВЕДЕНИЕ
Серебросодержащие сложные халькогениды относятся к числу важных функциональных материалов. Многие из них обладают термоэлектрическими, фотоэлектрическими, оптическими, магнитными и др. свойствами [1–5]. Кроме того, некоторые из них проявляют ионную проводимость по катиону Ag+ и могут быть использованы в качестве электрохимических сенсоров, электродных материалов, составных элементов аналоговых интеграторов, твердотельных топливных элементов, ионистров, электрохромных визуализаторов, функциональных датчиков и т.д. [6–9].
Халькогениды серебра-олова имеют смешанную ионно-электронную проводимость в сочетании с высокими термоэлектрическими [10, 11], фотовольтаическими [12] и оптическими [13] характеристиками.
Наличие униполярных суперионных проводников с Ag+ проводимостью открыло возможность их использования в качестве твердых электролитов в электрохимических концентрационных цепях. Подобные электрохимические ячейки успешно применяются для термодинамического исследования сложных систем на основе серебра [9, 14–28].
Результаты работ [19–24] показали, что катионпроводящие твердые электролиты могут быть успешно применены для термодинамического исследования тройных серебросодержащих систем методом электродвижущих сил (ЭДС), даже в тех случаях, когда они содержат менее благородный компонент, чем серебро. Это связано с тем, что твердый электролит, в отличие от жидкого, предотвращает протекание побочных процессов, связанных с взаимодействием электродов с электролитом и через электролит между собой. Тем самым метод ЭДС с твердым электролитом позволяет получить воспроизводимые данные для необратимых в классическом понимании концентрационных цепей, что существенно расширяет круг исследуемых систем.
В данной работе представлены результаты исследования подсистемы Ag2Se–SnSe–Se методом ЭДС с твердым электролитом Ag4RbI5 в интервале температур 290–450 К.
Фазовые равновесия в системе Ag–Sn–Se изучены в ряде работ [2, 29–31]. В работе [31] представлена полная Т–х–у-диаграмма системы, согласно которой она характеризуется образованием двух промежуточных фаз: Ag8SnSe6 и AgSnSe2. Первое плавится конгруэнтно при 1015 К и претерпевает полиморфный переход при 355 К. Соединение AgSnSe2 плавится инконгруэнтно по перитектической реакции при 860 К и обладает широкой областью (47–58 мол. % SnSe) гомогенности по разрезу “AgSe”–SnSe [30, 31].
Низкотемпературная модификация Ag8SnSe6 кристаллизуется в орторомбической (Пр. гр. Pmn21, a = 0.79168, b = 0.78219, c = 1.10453 нм) [32], а высокотемпературная – в кубической решетке (Пр. гр. F-43m, a = 1.112 нм) [29]. Соединение AgSnSe2 имеет кубическую структуру типа NaCl (a = 0.5627 нм) [33].
Термодинамические свойства насыщенных твердых растворов на основе тройных фаз системы Ag–Sn–Se изучены измерением ЭДС концентрационных цепей с жидким электролитом относительно оловянного электрода [2] и со стеклообразным электролитом относительно серебряного электрода [14, 34].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для термодинамического исследования селенидов серебра-олова нами были составлены концентрационные цепи типа
(1)
$\left( {\text{--}} \right){\text{Ag}}\left( {{\text{т в }}} \right){\text{/A}}{{{\text{g}}}_{{\text{4}}}}{\text{Rb}}{{{\text{I}}}_{{\text{5}}}}\left( {{\text{т в }}} \right){\text{/}}\left( {{\text{Ag в с п л а в е }}} \right)\left( {{\text{т в }}} \right)\left( {\text{ + }} \right){\text{.}}$В цепях типа (1) электролитом служил твердый суперионный проводник Ag4RbI5. обладающий высокой ионной проводимостью (0.25 Ом–1 см–1) уже при комнатной температуре. При этом уровень его электронной проводимости пренебрежимо мал и составляет 10–9 Ом–1см–1 [6].
Твердый электролит Ag4RbI5 получали по методике, описанной в [9, 19]. Синтез проводили сплавлением химически чистых RbI и AgI в кварцевой ампуле в вакууме (~10–2 Па) с последующим быстрым охлаждением расплава до комнатной температуры. При этом расплав кристаллизуется в мелкозернистое и микроскопически однородное тело. Его последующий отжиг при 400 К в течение 200 ч приводит к полной гомогенизации Ag4RbI5. Данные дифференциального-термического (ДТА) и рентгенфазового (РФА) анализов подтвердили однофазность синтезированного Ag4RbI5 [19]: оно плавится с разложением по перитектической реакции при 505 К и кристаллизуется в кубической решетке (Пр. гр. P4132, a = 1.1238 нм, z = 4), что находится в соответствии с литературными данными [6]. Из полученного цилиндрического слитка диаметром ~1 см были вырезаны таблетки толщиной 4–6 мм, которые использовали как твердый электролит в цепях типа (1). Приготовленные таким образом образцы твердого электролита Ag4RbI5 ранее были успешно использованы в термодинамических исследованиях методом ЭДС [19–27].
Электродом сравнения служило металлическое серебро, а правыми электродами − сплавы из фазовых областей Ag2Se–Ag8SnSe6–Se, Ag2Se–Ag8SnSe6–SnSe, Ag8SnSe6–SnSe2–Se, AgSnSe2–SnSe2 и Ag0.84Sn1.16Se2–SnSe2–SnSe (Ag0.84Sn1.16Se2-состав γ-фазы, насыщенной SnSe), которые выбирали согласно фазовой диаграмме Ag–Sn–Se [31]. Сплавы получали из предварительно синтезированных и идентифицированных соединений Ag2Se, SnSe, SnSe2 и Ag8SnSe6, а также элементарного селена высокой степени чистоты сплавлением в вакуумированных (∼10–2 Па) кварцевых ампулах при температурах, на 30–50° превышающих температуры ликвидуса. Учитывая, что состояние электрод-сплавов должно быть максимально близко к равновесному, литые негомогенизированные образцы подвергали длительному ступенчатому термическому отжигу при 600 К (500 ч) и 450 К (200 ч). Фазовые составы отожженных сплавов контролировали методом РФА (порошковый дифрактометр D8 ADVANCE фирмы Bruker, CuK${{\alpha }_{1}}$) [31]. Затем отожженные сплавы перетирали в порошок, запрессовывали в таблетки массой 0.5–1 г и использовали в качестве анодов в цепях типа (1).
Собранную электрохимическую ячейку конструкции [9, 27] вакуумировали, наполнили аргоном и поместили в специально изготовленную трубчатую печь сопротивления, где она термостатировалась при температуре ~380 К в течение 40–50 ч. Температуру ячейки измеряли хромель-алюмелевыми термопарами и ртутными термометрами с точностью ±0.5°С.
ЭДС измеряли с помощью высокоомного цифрового вольтметра марки В7-34А в интервале температур 300–450 К. Измерения ЭДС сплавов из фазовой области Ag8SnSe6–SnSe2–Se сначала проводили в температурном интервале существования высокотемпературной модификации Ag8SnSe6, а затем – низкотемпературной [31]. Первые равновесные значения были получены после термостатирования ячейки в вышеуказанных условиях, а последующие – через каждые 3 ч после установления определенной температуры. Значения ЭДС, которые при повторных измерениях при данной температуре отличались друг от друга не более, чем на 0.5 мВ независимо от направления изменения температуры, были приняты за равновесные.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Измерения показали, что характер концентрационной зависимости ЭДС цепей типа (1) находится в соответствии с диаграммой твердофазных равновесий системы Ag2Se–SnSe–Se (рис. 1) [31]. При постоянной температуре в пределах каждой трехфазной области значения ЭДС были постоянны независимо от валового состава сплава – анода, а при переходе из одной области в другую менялись скачкообразно. Согласно условию термодинамического равновесия, значения ЭДС цепей типа (1) не могут уменьшаться при уменьшении содержания серебра по лучевым линиям от Ag вершины концентрационного треугольника [28]. Наши экспериментальные данные удовлетворяют этому требованию. Кроме того, значения ЭДС в трехфазных областях Ag2Se–Ag8SnSe6–Se и Ag2Se–Ag8SnSe6–SnSe в пределах погрешности ±3 мВ совпадают с термодинамическими данными [35, 36] для соединения Ag2Se.
Рис. 1.
Диаграмма твердофазных равновесий системы Ag–Sn–Se [31]. Треугольники – составы изученных образцов, пунктиры – коннода AgSnSe2–SnSe2. Цифры в некоторых трехфазных областях – значения ЭДС (мВ) концентрационных цепей типа (1) при 300 К.

Для исследования термодинамических свойств соединений Ag8SnSe6, AgSnSe2 и γ-фазы предельного состава Ag0.84Sn1.16Se2 нами использованы результаты измерений ЭДС для сплавов из фазовых областей Ag8SnSe6–SnSe2–Se, AgSnSe2–SnSe2 и Ag0.84Sn1.16Se2–SnSe–SnSe2
На рис.2 приведены температурные зависимости ЭДС концентрационных цепей типа (1) для сплавов из вышеуказанных фазовых областей. Как видно, все эти зависимости линейны. Для трехфазной области Ag8SnSe6–SnSe2–Se она имеет вид прямой с изломом при 355 К, соответствующим температуре полиморфного превращения Ag8SnSe6 [2, 31].
Рис. 2.
Температурные зависимости ЭДС в некоторых фазовых областях системы Ag–Sn–Se. I–III – данные настоящей работы для областей Ag8SnSe6–SnSe2–Se (I), Ag0.84Sn1.16Se2–SnSe–SnSe2 (II) и AgSnSe2–SnSe2 (III). Прямые IV и V – данные [14] для областей Ag8SnSe6–SnSe2–Se и AgSnSe2–SnSe2, соответственно.
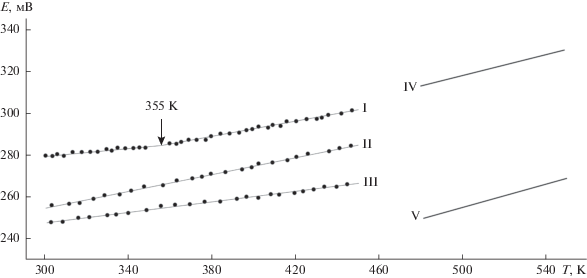
Сопоставление наших результатов с данными [14], полученными методом ЭДС со стеклообразным Ag+-проводящим электролитом, показывает (рис. 2), что для трехфазной области Ag8SnSe6–SnSe2–Se практически совпадают (прямые I и IV), а для области AgSnSe2–SnSe2 (прямые III и V) заметно отличаются (∼25–30 мВ). Возможно, это расхождение связано с отклонением состава AgSnSe2 от стехиометрического в температурном интервале измерений в работе [14].
Для проведения термодинамических расчетов данные измерений ЭДС были обработаны методом наименьших квадратов и получены линейные уравнения типа [28, 37]
(2)
$E = a + bT \pm t{{\left[ {\frac{{S_{{\text{E}}}^{{\text{2}}}}}{n} + \frac{{S_{{\text{E}}}^{{\text{2}}}{{{{\text{(}}T - \bar {T}{\text{)}}}}^{{\text{2}}}}}}{{\sum {{{{{\text{(}}{{T}_{i}} - \bar {T}{\text{)}}}}^{{\text{2}}}}} }}} \right]}^{{\frac{{\text{1}}}{{\text{2}}}}}},$Таблица 1.
Расчет постоянных a и b, а также погрешностей из измерений ЭДС для фазовой области AgSnSe2–SnSe2
| Ti, K | Ei, мВ | ${{T}_{i}} - \bar {T}$ | Ei(${{T}_{i}} - \bar {T}$) | ${{({{T}_{i}} - \bar {T})}^{2}}$ | $\tilde {E}$ | ${{E}_{i}} - \tilde {E}$ | ${{({{E}_{i}} - \tilde {E})}^{2}}$ |
|---|---|---|---|---|---|---|---|
| 302.1 | 219.5 | –79.56 | –17 463.97 | 6330.19 | 218.52 | 0.98 | 0.96 |
| 307.5 | 219.8 | –74.16 | –16 300.92 | 5500.08 | 219.21 | 0.59 | 0.35 |
| 313.7 | 220.9 | –67.96 | –15 012.92 | 4618.90 | 219.99 | 0.91 | 0.82 |
| 321.8 | 221.9 | –59.86 | –13 283.49 | 3583.52 | 221.02 | 0.88 | 0.77 |
| 338.4 | 222.8 | –43.26 | –9638.89 | 1871.64 | 223.13 | –0.33 | 0.11 |
| 343.7 | 221.7 | –37.96 | –8416.29 | 1441.15 | 223.81 | –2.11 | 4.43 |
| 347.3 | 224.1 | –34.36 | –7700.64 | 1180.78 | 224.26 | –0.16 | 0.03 |
| 356.2 | 225 | –25.46 | –5729.06 | 648.34 | 225.39 | –0.39 | 0.15 |
| 361.5 | 226.7 | –20.16 | –4570.84 | 406.53 | 226.07 | 0.63 | 0.40 |
| 367.3 | 226.3 | –14.36 | –3250.23 | 206.28 | 226.80 | –0.50 | 0.25 |
| 373.2 | 228 | –8.46 | –1929.45 | 71.61 | 227.55 | 0.45 | 0.20 |
| 379.9 | 227.8 | –1.76 | –401.50 | 3.11 | 228.41 | –0.61 | 0.37 |
| 388.6 | 226.6 | 6.94 | 1572.04 | 48.13 | 229.51 | –2.91 | 8.47 |
| 395.1 | 230 | 13.44 | 3090.63 | 180.57 | 230.34 | –0.34 | 0.11 |
| 400.5 | 230.5 | 18.84 | 4342.04 | 354.85 | 231.02 | –0.52 | 0.27 |
| 406.7 | 231.2 | 25.04 | 5788.67 | 626.88 | 231.81 | –0.61 | 0.37 |
| 410.1 | 233.5 | 28.44 | 6640.16 | 808.69 | 232.24 | 1.26 | 1.58 |
| 417.4 | 233.7 | 35.74 | 8351.85 | 1277.17 | 233.17 | 0.53 | 0.28 |
| 424.2 | 233.5 | 42.54 | 9932.51 | 1809.44 | 234.03 | –0.53 | 0.29 |
| 432.3 | 237.1 | 50.64 | 12 006.15 | 2564.16 | 235.06 | 2.04 | 4.15 |
| 436.5 | 235.5 | 54.84 | 12 914.23 | 3007.15 | 235.60 | –0.10 | 0.01 |
| 441.8 | 236.8 | 60.14 | 14 240.56 | 3616.52 | 236.27 | 0.53 | 0.28 |
| 445.7 | 236.2 | 64.04 | 15 125.66 | 4100.80 | 236.77 | –0.57 | 0.32 |
| 448.4 | 238 | 66.74 | 15 883.53 | 4453.89 | 237.11 | 0.89 | 0.79 |
| $\bar {T} = 381.66$ | $\bar {E} = 228.63$ | $\sum {E\left( {{{T}_{i}} - \bar {T}} \right)} $ = 6189.84 | $\sum {{{{({{T}_{i}} - \bar {T})}}^{2}}} $=48710.38 | $\sum {{{{({{E}_{i}} - \tilde {E})}}^{2}}} $ = 25.78 |
Из полученных уравнений температурных зависимостей ЭДС (табл. 2) по соотношениям [37]
(4)
$\Delta {{\bar {H}}_{{{\text{Ag}}}}} = - z\left[ {E - T{{{\left( {\frac{{\partial E}}{{\partial T}}} \right)}}_{{\text{P}}}}} \right] = - {\text{zF}}a,$(5)
$\Delta {{\bar {S}}_{{{\text{Ag}}}}} = zF{{\left( {\frac{{\partial E}}{{\partial T}}} \right)}_{{\text{P}}}} = zFb,$Таблица 2.
Зависимости ЭДС концентрационных цепей типа (1) для соединения Ag8SnSe6
| Фазовая область | Температурный интервал, K | $E,\,{\text{м В }} = a + bT \pm t{{S}_{{\text{E}}}}(T)$ |
|---|---|---|
| α-Ag8SnSe6–SnSe2–Se | 300–350 | $253.5 + 0.089T \pm 2.2{{\left[ {\frac{{0.58}}{{15}} + 1.1 \times {{{10}}^{{ - 5}}}{{{(T - 328.2)}}^{2}}} \right]}^{{1/2}}}$ |
| β-Ag8SnSe6–SnSe2–Se | 360–450 | $233.6 + 0.145T \pm 2{{\left[ {\frac{{0.66}}{{24}} + 1.3 \times {{{10}}^{{ - 5}}}{{{(T - 397.5)}}^{2}}} \right]}^{{1/2}}}$ |
| AgSnSe2–SnSe2 | 300–450 | $210.1 + 0.127T \pm 2{{\left[ {\frac{{1.07}}{{24}} + 2.2 \times {{{10}}^{{ - 5}}}{{{(T - 381.7)}}^{2}}} \right]}^{{1/2}}}$ |
| Ag0.84Sn1.16Se2–SnSe2–SnSe | 300–450 | $209.8 + 0.168T \pm 2{{\left[ {\frac{{0.89}}{{24}} + 1.8 \times {{{10}}^{{ - 5}}}{{{(T - 377.2)}}^{2}}} \right]}^{{1/2}}}$ |
Таблица 3.
Парциальные молярные термодинамические функции серебра в Ag8SnSe6 и AgSnSe2
| Фазовая область | T, K | $ - \Delta {{\bar {G}}_{{{\text{Ag}}}}}$ | $ - \Delta {{\bar {H}}_{{{\text{Ag}}}}}$ | $\Delta {{\bar {S}}_{{{\text{Ag}}}}},$ Дж К–1 моль–1 |
|---|---|---|---|---|
| кДж моль–1 | ||||
| α-Ag8SnSe6–SnSe2–Se | 298 | 27.01 ± 0.05 | 24.46 ± 0.24 | 8.57 ± 0.70 |
| β-Ag8SnSe6–SnSe2–Se | 400 | 28.14 ± 0.08 | 22.54 ± 0.30 | 13.99 ± 0.71 |
| AgSnSe2–SnSe2 | 298 | 23.93 ± 0.09 | 20.27 ± 0.35 | 12.25 ± 9.91 |
| Ag0.84Sn1.16Se2–SnSe2–SnSe | 298 | 25.08 ± 0.07 | 20.24 ± 0.31 | 16.21 ± 0.82 |
Согласно диаграмме твердофазных равновесий (рис. 1), парциальные молярные функции серебра в равновесных сплавах из исследуемых трехфазных областей (табл. 2, 3, области 1–3) относятся к следующим потенциалобразующим реакциям (все вещества находятся в кристаллическом состоянии):
(6)
${\text{Ag}} + 0.125{\text{SnS}}{{{\text{e}}}_{2}} + 0.5{\text{Se}} = 0.125{\text{ A}}{{{\text{g}}}_{8}}{\text{SnS}}{{{\text{e}}}_{6}},$(8)
${\text{Ag}} + 0.38{\text{SnSe}} + {\text{SnS}}{{{\text{e}}}_{2}} = 1.19{\text{A}}{{{\text{g}}}_{{{\text{0}}{\text{.84}}}}}{\text{S}}{{{\text{n}}}_{{1.16}}}{\text{S}}{{{\text{e}}}_{2}}.$Согласно реакции (6), свободную энергию Гиббса и энтальпию образования соединения Ag8SnSe6 можно вычислить по соотношению
(9)
${{\Delta }_{f}}Z({\text{A}}{{{\text{g}}}_{8}}{\text{SnS}}{{{\text{e}}}_{6}}) = 8\Delta {{\bar {Z}}_{{{\text{Ag}}}}} + {{\Delta }_{f}}Z({\text{SnS}}{{{\text{e}}}_{2}}),$(10)
$\begin{gathered} {{S}^{0}}({\text{A}}{{{\text{g}}}_{8}}{\text{SnS}}{{{\text{e}}}_{6}}) = 8\left[ {\Delta {{{\bar {S}}}_{{{\text{Ag}}}}} + {{S}^{0}}({\text{Ag}})} \right] + \\ + \,\,4{{S}^{0}}({\text{Se}}) + {{S}^{0}}({\text{SnS}}{{{\text{e}}}_{2}}). \\ \end{gathered} $Аналогичным путем были рассчитаны стандартные интегральные термодинамические функции для AgSnSe2 и Ag0.84Sn1.16Se2. Результаты расчетов приведены в табл. 4. Погрешности вычислены методом накопления ошибок.
Таблица 4.
Стандартные интегральные термодинамические функции селенидов серебра-олова
| Фаза | ${{\Delta }_{f}}{{G}^{0}}$ | ${{\Delta }_{f}}{{H}^{0}}$ | ${{S}^{0}},$ Дж К–1 моль–1 |
|---|---|---|---|
| кДж моль–1 | |||
| SnSe2 | 119.2 ± 2.5 [39] | 124.7 ± 4.2 [39] | 118.0 ± 3.0 [39] |
| SnSe | 96.3 ± 0.4 [39] | 94.6 ± 2.1 [39] | 106.8 ± 8.4 [39] |
| α-Ag8SnSe6 | 335.3 ± 2.9 | 320.4 ± 6.4 | 695.5 ± 10.5 |
| β-Ag8SnSe6 | 342.4 ± 3.2* | 305.0 ± 6.8 | 738.8 ± 10.6 |
| 350.3 ± 1.8 [2] | 320.4 ± 8.1 [2] | 736.6 ± 23.8 [2] | |
| 352.5 ± 1.9 [14] | 323.1 ± 1.6 [14] | – | |
| 347.6 ± 27.2 [34] | 336.2 ± 19.2 [34] | – | |
| AgSnSe2 | 144.1 ± 2.6 | 145.0 ± 4.8 | 172.8 ± 4.1 |
| 146.4 ± 0.5 [2] | 148.0 ± 3.0 [2] | – | |
| 133.9 ± 1.6 [14] | 124.9 ± 1.3 [14] | – | |
| Ag0.84Sn1.16Se2 | 152.0 ± 2.3 | 152.0 ± 4.7 | 182.7 ± 6.0 |
При расчетах использованы значения стандартных энтропий серебра и селена (S0(Ag) = = 42.55 ± 0.50 Дж моль–1 K–1; S0(Se) = 42.44 ± ± 0.50 Дж моль–1 K–1) [38], а также стандартных термодинамических функций SnSe и SnSe2 (табл. 4), полученные методом ЭДС [39]. Данные этой работы по энтальпии образования обоих соединений хорошо согласуются с калориметрическими данными, рекомендованными в справочниках [38, 40, 41]. Кроме того, значения свободных энергий Гиббса образования этих соединений, рассчитанные из энтальпии образования и стандартной энтропии, рекомендованных в этих справочниках, практически совпадают с данными работы [39]. Это показывает достоверность термодинамических данных для SnSe и SnSe2, использованных нами при расчетах.
В табл. 4 также приведены значения стандартных интегральных термодинамических функций β-Ag8SnSe6 и AgSnSe2 по данным работ [2, 14, 34]. Анализ данных табл.4 показывает, что имеющиеся данные, включая наши, находятся в хорошем соответствии. Только для энтальпии образования AgSnSe2 наблюдается наибольшее расхождение (14%) между нашими результатами и данными [14].
Из полученных термодинамических данных двух модификаций Ag8SnSe6 нами рассчитаны термодинамические функции полиморфного превращения этого соединения. Поскольку в температурном интервале измерений ЭДС теплота образования Ag8SnSe6 практически постоянна, можно написать
(11)
$\Delta {{H}_{{{\text{п }}.п {\text{.}}}}} = {{\Delta }_{f}}{{H}^{0}}(\beta ) - {{\Delta }_{f}}{{H}^{0}}(\alpha ).$(12)
$\Delta {{H}_{{{\text{п }}{\text{.п }}{\text{.}}}}} = 8[\Delta {{\bar {H}}_{{{\text{Ag}}}}}(\beta ) - \Delta {{\bar {H}}_{{{\text{Ag}}}}}(\alpha )],$Энтропия полиморфного превращения вычислена по соотношению
Получены следующие значения термодинамических функций фазового перехода Ag8SnSe6
Относительно высокие погрешности полученных данных связаны с тем, что в методе ЭДС парциальные энтальпия и энтропия рассчитываются косвенно из коэффициента температурной зависимости [28, 37].
ЗАКЛЮЧЕНИЕ
Методом ЭДС с твердым электролитом Ag4RbI5 получены новые комплексы взаимосогласованных термодинамических данных для тройных фаз AgSnSe2, Ag0.84Sn1.16Se2 и двух модификаций Ag8SnSe6. Результаты настоящей работы дополняют и уточняют имеющиеся в литературе термодинамические данные для AgSnSe2 и высокотемпературной модификации Ag8SnSe6. Термодинамические данные для фазы Ag0.84Sn1.16Se2, низкотемпературной модификации соединения Ag8SnSe6 и его полиморфного перехода получены впервые.
Список литературы
Applications of Chalcogenides: S, Se, and Te. Ed. by Gurinder Kaur Ahluwalia. Springer. 2016, 461 p.
Бабанлы, М.Б., Юсибов, Ю.А., Абишев, В.Т. Трехкомпонентные халькогениды на основе меди и серебра. Баку: изд. БГУ. 1993, 342 с.
Шевельков, А.В. Химические аспекты создания термоэлектрических материалов. Успехи химии. 2008. Т. 77. № 1. С. 3.
Hu, W.Q., Shi, Y.F., and Wu, L.M., Synthesis and Shape Control of Ag8SnS6 Submicropyramids with High Surface Energy, Cryst. Growth Des., 2012, vol. 12, p. 3458.
Guin, S.N., Srihari, V., and Biswas, K., Promising thermoelectric performance in n-type AgBiSe2: Effect of aliovalent anion dopin, J. Mat. Chem. A., 2015, vol. 3, p. 648.
Иванов-Щиц, А.К., Мурин, И.В. Ионика твердого тела. Т. 1. изд. С.-Петерб. ун-та: 2000, 616 с.
Березин В.М., Вяткин Г.П. Суперионные полупроводниковые халькогениды. Челябинск.: Изд. Ю. УрГУ, 2001, 135 с.
Qiu, P., Agne, M.T., Liu Y., Zhu Y., Chen, H., Mao, T., Yang, J., Zhang, W., Haile, S.M., Zeier, W.G., Janek, J., Uher, C., Shi, X., Chen, L., and Snyder, G.F., Suppression of atom motion and metal deposition in mixed ionic electronic conductors, Nat Commun., 2018, vol. 9, p. 2910.
Babanly, M.B., Yusibov, Y.A., and Babanly, N.B., The EMF method with solid-state electrolyte in the thermodynamic investigation of ternary Copper and Silver Chalcogenides / Electromotive force and measurement in several systems. Ed. Kara S. Intechweb.Org. 2011, p. 57.
Li, L., Liu, Y., Dai, J., Hong, A., Zeng, M., Yan, Z., Xu, J., Zhang, D., Shan, D., Liu, Sh., Ren, Z., and Liu, J-M., High thermoelectric performance of superionic argyrodite compound Ag8SnSe6, J. Mater. Chem. C., 2016, vol. 4, p. 5806.
Li, W., Lin, S., Ge, B., Yang, J., Zhang, W., and Pei, Y., Low sound velocity contributing to the high thermoelectric performance of Ag8SnSe6, Adv. Sci., 2016, vol. 3, p. 1600196.
Hull, S., Berastegui, P., and Grippa, A., Ag+ diffusion within the rock-salt structured superionic conductor Ag4Sn3S8, J. Phys.: Condens. Matter., 2005, vol. 17, p. 1067.
Semkiv, I., Ilchuk, H., Pawlowski, M., and Kusnezh, V., Ag8SnSe6 argyrodite synthesis and optical properties, Opto-Electronics Review, 2017, vol. 25, p. 37.
Мороз, Н.В., Прохоренко, М.В. Определение методом ЭДС термодинамических свойств насыщенных твердых растворов соединений системы Ag–Sn–Se. Журн. Физ. химии. 2015. Т. 89. № 8. С. 1199.
Мороз, Н.В., Прокопенко, М.В., Рудык, Б.П. Термодинамические свойства фаз в системе Ag–Ge–Te. Электрохимия. 2014. Т. 50. № 12. С. 1314 [Moroz, M.V., Prokhorenko, M.V., and Rudyk, B.P, Thermodynamic Properties of Phases of the Ag–Ge–Te System, Russ.J. Electrochem. 2014, vol. 50, no. 12, p. 1177].
Мороз, Н.В., Прокопенко, М.В. Определение термодинамических свойств насыщенных твердых растворов системы Ag–Ge–Se методом ЭДС. Электрохимия. 2015. Т. 51. С. 784. [Moroz, M.V. and Prokhopenko, M.V., Determination of Thermodynamic Properties of Saturated Solid Solutions of the Ag–Ge–Se System Using EMF Technique, Russ. J. Electrochem, 2015, vol. 51, p. 697].
Tesfaye, F. and Taskinen, P., Experimental thermodynamic study of the equilibrium phase AgBi3S5 by an improved EMF method, Thermochim. Acta, 2013, vol. 562. p. 75.
Aspiala, M., Tesfaye, F., and Taskinen, P., Thermodynamic study in the Ag–Sb–S system by the EMF method, J. Chem. Thermodyn., 2016, vol. 98, p. 361.
Babanly, N.B., Orujlu, E.N., Imamaliyeva, S.Z., Yusibov, Y.A., and Babanly, M.B., Thermodynamic investigation of silver-thallium tellurides by EMF method with solid electrolyte Ag4RbI5, The Journal of Chemical Thermodynamics, 2019, vol. 128, p. 78.
Babanly, N.B., Imamaliyeva, S.Z., Yusibov, Y.A., Taghiyev, D.B., and Babanly, M.B. Thermodynamic study of the Ag–Tl–Se system using the EMF method with Ag4RbI5 as a solid electrolyte, J. Sol. State Electrochem., 2018, vol. 22, p. 1143.
Машадиева, Д.Ф., МАнсимова, Ш.Г., Юсиов Ю.А., Бабанлы, М.Б. Термодинамическое исследование системы 2PbTe–AgSbTe2 методом ЭДС с твердым электролитом Ag4RbI5. Электрохимия. 2018. Т. 54. С. 122 [Mashadieva, L. F., Mansimova, Sh. G., Yusibov, Yu. A., and Babanly, M. B., Thermodynamic Study of the 2PbTe–AgSbTe2 System Using EMF Technique with the Ag4RbI5 Solid Electrolyte, Russ. J. Electrochem., 2018, vol. 54, p. 106].
Babanly, M.B., Mashadieva, L.F., Aliev, Z.S., Shevelkov, A.V., and Yusibov, Y.A., Phase Diagram and Thermodynamic Properties of Compounds of the AgI–TlI–I System, J. Alloys Compd. 2012, vol. 524, p. 38.
Mashadieva, L.F., Aliev, Z.S., Shevelkov, A.V., and Babanly, M.B., Experimental investigation of the Ag–Bi–I ternary system and thermodynamic properties of the ternary phases, J. Alloys Compd., 2013, vol. 551, p. 512.
Mashadiyeva, L.F., Kevser, J.O., Aliev, I.I., Yusibov, Y.A., Taghiyev, D.B., Aliev, Z.S., and Babanlı, M.B., The Ag2Te–SnTe–Bi2Te3 system and thermodynamic properties of the (2SnTe)1 –x(AgBiTe2)x solid solutions series, J. Alloys. Compd., 2017, vol. 724, p. 641.
Mashadiyeva, L.F., Kevser, J.O., Aliev, I.I., Yusibov, Y.A., Taghiyev, D.B., Aliev, Z.S., and Babanlı, M.B., Phase Equilibria in the Ag2Te–SnTe–Sb2Te3 System and Thermodynamic Properties of the (2SnTe)12x(AgSbTe2)x Solid Solution, Phase equilibria and diffusion, 2017, vol. 38, p. 603.
Алвердиев, И.Дж., Багхери, С.М., Имамалиева, С.З., Юсибов, Ю.А., Бабанлы, М.Б. Термодинамическое исследование соединения Ag8GeSe6 методом ЭДС с твердым электролитом Ag4RbI5. Электрохимия. 2017. Т. 53. С. 622 [Alverdiev, I.Dzh., Bagkheri, S.M., Imamalieva, S.Z., Yusibov, Yu.A., and Babanly, M.B., Thermodynamic Study of Ag8GeSe6 by EMF with an Ag4RbI5 Solid Electrolyte, Russ. J. Electrochem, 2017, vol. 53, p. 551].
Бабанлы, М.Б., Машадиева, Л.Ф., Велиева, Г.М., Имамалиева, С.З., Шыхыев, Ю.М. Термодинамическое исследование систем Ag–As–Se и Ag–S–I методом ЭДС с твердым электролитом Ag4RbI5. Электрохимия. 2009. Т.45, С. 424. [Babanly, M.B., Mashadiyeva, L.F., Veliyeva, G.M., Imamalieva, and S.Z., Shykhyev, Y.M., Thermodynamic Study of the Ag–As–Se and Ag–S–I Systems Using the EMF Method with a Solid Ag4RbI5 Electrolyte, Russ. J. Electrochem., 2015, vol. 45, p. 399].
Бабанлы, М.Б., Юсибов, Ю.А. Электрохимические методы в термодинамике неорганических систем. Баку. ЭЛМ. 2011. 306 с.
Gorochov, O., Les composés Ag8MX6 (M = Si. Ge. Sn et X = S, Se, Te), Bull. Soc. Chim.Fr. 1968. p. 2263.
Ollitrault-Fitchet, R., Rivet, J., and Flahaut, J., Description du systeme ternaire Ag–Sn–Se, J.Less-Common. Met., 1988, vol. 138, p. 241.
Yusibov, Yu. A., Alverdiev, I. Dzh., Mashadieva, L.F., Babanly D.M., Mamedov A.N., and Babanly, M.B., Experimental Study and 3D Modeling of the Phase Diagram of the Ag–Sn–Se System, Russ. J. Inorg. Chem., 2018, vol. 63, no. 12, p. 1622.
Gulay, L.D., Olekseyuk, I.D., and Parasyuk, O.V., Crystal structure of β-Ag8SnSe6, J. Alloys Compd., 2002, vol. 339, p. 113.
Wold, A. and Brec, R., Structure NaCl des phases AgxSn1 –xX (X = S. Se). Mater. Res. Bull. 1976, vol. 11, p. 761.
Moroz, M.V., Prokhorenko, M.V., Demchenko, P.Yu., and Reshetnyak, O.V., Thermodynamic properties of saturated solid solutions of Ag7SnSe5Br and Ag8SnSe6 compounds in the Ag–Sn–Se–Br system measured by the EMF method, J. Chem. Thermodyn., 2017, vol. 106, p. 228.
Аббасов, А.С. Термодинамические свойства некоторых полупроводниковых веществ. Баку: Элм. 1981. 87 с.
Feng, D., Taskinen, P., Tesfaye, F., Thermodynamic stability of Ag2Se from 350 to 500 K by a solid state galvanic cell, Sol. State Ionics, 2013, vol. 231, p. 1.
Морачевский, А.Г., Воронин, Г.Ф., Гейдерих, В.А., Куценок И.Б. “Электрохимические методы исследования в термодинамике металлических систем” М.: ИЦК “Академкнига”, 2003, 334 с.
База данных термические константы веществ. Электронная версия под. ред. Юнгмана В.С. 2006 г. http://www.chem.msu.su/cgi-bin/tkv.
Мелех, Б.Т., Степанова, Н.Б., Фомина, Т.А. Термодинамические свойства соединений в системе Sn–Se. Журн. физ. химии. 1971. Т. 45. С. 2018.
Герасимов, Я.И., Крестовников, А.Н., Горбов, С.И. Химическая термодинамика в цветной металлургии. Справочник. Т. 6. М.: Металлургия, 1974, 312 с.
Kubaschewski, O., Alcock, C.B., and Spenser P.J., Materials Thermochemistry. Pergamon Press. 1993. 350 p.
Дополнительные материалы отсутствуют.


