Электрохимия, 2019, T. 55, № 5, стр. 535-545
Электрохимическое окисление катехола в присутствии L-лизина при различных pH
М. А. Хафиз Миа a, Абдул Мотин a, *, Энтазул М. Юк b
a Факультет химии, Университет инженерного дела и технологии Хулны (KUET)
9203 Хулна, Бангладеш
b Факультет химии, Университет Раджшани
Раджшани, Бангладеш
* E-mail: abdulmotin75@yahoo.com
Поступила в редакцию 21.09.2017
После доработки 28.05.2018
Принята к публикации 25.07.2018
Аннотация
Электрохимическая реакция синтеза о-бензохинона при окислении катехола как акцептора Михаэля нуклеофилом–L-лизином была исследована в водном растворе с различными значения pH, на различных электродах и при различной концентрации L-лизина с применением циклической вольтамперометрии, кулонометрии с контролируемым потенциалом и дифференциальной импульсной вольтамперометрии. На втором цикле развертки потенциала была отмечена реакция о‑бензохинона с L-лизином при высоких концентрациях нуклеофила. Считается, что формирующиеся продукты – 2-амино-6-((3,4-дигидроксифенил)амино)гексановая кислота, участвующая в электронном переносе при более отрицательных потенциалах, нежели катехол. Влияние pH на катехол в присутствии L-лизина было изучено для pH в интервале от 5 до 11. На реакцию заметно влияли как значение pH, так и концентрация L-лизина. Реакция протекала наиболее быстро в случае 2 мМ катехола и 70 мМ L-лизина при pH 7. Механизм реакции включал перенос электрона, химическую реакцию и перенос электрона (ECE).
ВВЕДЕНИЕ
Катехол – один из наиболее важных компонентов органического синтеза; его производят в промышленных масштабах в качестве прекурсора для производства пестицидов, духов и лекарств [1]. Остов катехола также имеется в ряде природных продуктов, в особенности антиоксидантов [2]. Наиболее хорошо известное свойство катехолов заключается в том, что их можно легко окислить, главным образом, благодаря их антиоксидантной активности и низким потенциалам окисления [3]. Продукты окисления – соответствующие реакционноспособные электронодефицитные o-хиноны. Один из наиболее успешных вариантов in situ применения реакционноспособных o-хинонов – их электрохимическое окисление [4]. Имеется множество сообщений об электроокислении катехолов с формированием o-хинонов как активных интермедиатов многих полезных гомогенных реакций [5].
Лизин является 2,6-диаминогексановой кислотой. ε‑Аминогруппа обладает значительно большим значением pKa, чем α-аминогруппа. Аминогруппа очень активна и часто участвует в реакции с активными центрами ферментов. Благодаря привлекательным свойствам лизина, включая гидрофильность, отличную биосовместимость и биоразлагаемость, поли-L-лизин широко применяется для получения биоматериалов, таких как поверхностные покрытия, средства доставки лекарств, генов и белков и подложки гидрогелей. Он участвует в процессах протеазного расщепления, поглощения кальция, сохранения эндоплазматической сети, хелатирования ионов и производства организмом гормонов, ферментов и антител [6, 7].
Было исследовано электрохимическое окисление катехолов в присутствии некоторых других нуклеофилов, таких как аспарагиновая кислота, глутамин, сульфаниловая кислота, этанол, 2-тиобарбитуровая кислота, β-дикетоны, 4-гидрокси-6-метил-2-пирон, 2-тиоурацил, димедон, 4,7-дигидроксикумарин, 4,5,7-тригидроксикумарин, 4‑гидрокси-6-бромкумарин, 3-гидроксикумарин, 4-гидрокси-6-метил-α-пирон, 4-гидрокси-6-метил-2-пиридон и 4-гидроксикарбостирил [8–17]. Катехин включает катехол и резорцин. Вольтамперометрические эксперименты показывают, что первый пик окисления соединения связан с окислением катехольной группы, а второй пик окисления соединения соответствует резорциновой группе [18–20]. Структура катехина относительно сложная и громоздкая по сравнению с чистым катехолом, поэтому реакция электрохимического нуклеофильного замещения в случае катехина может проходить не проще, чем в случае катехола. Поэтому об электроокислении катехина в присутствии нуклеофилов опубликовано очень немного статей [20]. С учетом этих фактов мы изучили реакции катехола в присутствии систем на основе лизина, которые не были исследованы ранее. В этой статье мы изучили электрохимические свойства катехола в присутствии L-лизина на трех различных электродах, в широком диапазоне концентраций L‑лизина и при различных pH.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Катехол, L-лизин, уксусная кислота, ацетат натрия, хлорид калия, дигидроортофосфат натрия и гидроортофосфат натрия были квалификации для анализа (E-Merck). Растворы катехола и катехола с различными концентрациями L-лизина готовили при различных pH (5–11) с применением ацетатных или фосфатных буферных растворов. Целевые значения pH рассчитывали по уравнению Гендерсона–Гассельбаха; соответственно, готовили буферный раствор. Значения pKa лизина составляют: 2.2 (α-CO2H ${\text{p}}K_{{\text{a}}}^{1}$), 9.0 (α‑NH3${\text{p}}K_{{\text{a}}}^{2}$), 10.5 (R – ${\text{p}}K_{{\text{a}}}^{3}$) и 9.8 (pI) [21].
В качестве рабочих электродов для вольтамперометрии использовали платиновый и золотой диск диаметром 1.6 мм (Bioanalytical Systems, Inc.) и стеклоуглеродные диски диаметром 3 мм (Bioanalytical Systems, Inc.). Рабочий электрод, применяемый в кулонометрии с контролируемым потенциалом, представлял собой набор из трех углеродных стержней (диаметром 6 мм и длиной 4 см). Поверхность электрода полировали порошком оксида алюминия с размерами частиц 0.05 мкм перед каждым и использованием. Вспомогательный электрод представлял собой платиновую спираль (Bioanalytical Systems, Inc.). Электрод сравнения представлял собой хлорсеребряный электрод (Bioanalytical Systems, Inc.). Рабочий электрод полировали на данной поверхности путем осторожного прижимания конца электрода к полировальной поверхности на 5–10 мин. Затем электрод тщательно промывали деионизированной водой. В этот момент поверхность электрода является зеркальной. Использовали потенциостат/гальваностат µStat 400 (Drop Sens, Испания). Через однокамерную ячейку перед электрохимическими измерениями продували газообразный азот.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электрохимическое поведение катехола и L-лизина
Электрохимические свойства катехола в отсутствие и в присутствии L-лизина изучали при помощи циклической вольтамперометрии, дифференциальной импульсной вольтамперометрии и кулонометрии с контролируемым потенциалом. На рис. 1 (пунктирная линия) показана циклическая вольтамперограмма 2 мМ катехола на стеклоуглеродном электроде (3 мм) в буферном растворе с pH 7 и скоростью развертки 0.1 В/с. Циклическая вольтамперограмма катехола демонстрирует один анодный пик при 0.44 В и соответствующий катодный пик при 0.12 В, связанный с трансформацией катехола в o-хинон и обратно. Чистый L-лизин электрохимически неактивен в исследуемом интервале потенциалов (рис. 1, сплошная линия). На рис. 1 (жирная сплошная линия) показана циклическая вольтамперометрия катехола (2 мМ) в присутствии L-лизина (70 мМ) на втором цикле развертки в тех же условиях. На втором цикле развертки катехол с L-лизином демонстрируют два анодных пика при 0.03 и 0.32 В и соответствующие им два катодных пика при –0.32 и 0.05 В. При добавлении L-лизина к раствору катехола снижается катодный пик C1 и появляется новый катодный пик C0. Также на втором цикле развертки появляется новый анодный пик A0 и снижается анодный пик A1. Появление пиков A0 и C0 и снижение пиков A1 и C1, а также сдвиг пиков A1 и C1 в присутствии L-лизина указывает на то, что это связано с протекающей реакцией катехола с L-лизином. Это явление можно объяснить нуклеофильной атакой L‑лизина на о-бензохинон. Нуклеофильная атака L‑лизина на о-бензохинон снижает концентрацию о-бензохинона в реакционном слое, в результате чего снижаются пики A1 и C1, и одновременно формируется аддукт катехол-L-лизин и появляются пики A0 и C0. На первом цикле развертки анодный пик катехола в присутствии L-лизина очень похож на пик катехола в растворе без добавки. Но на втором цикле развертки ток в пике A1 (жирная сплошная линия) заметно снижается по сравнению с пиком в растворе чистого катехола (пунктирная линия). Соотношение токов в пиках для пиков A1 и C1 (Ipa1/IPc1) заметно снижалось, что указывало на химическую реакцию между L-лизином (2) и o‑хиноном (1a), формирующимся на поверхности электрода. Эти явления можно приписать образованию 2-амино-6-((3,4-дигидроксифенил)амино)гексановой кислоты или 2-амино-6‑(бис(3,4-диоксоциклогекса-1,5-диен-1-ил)амино)гексановой кислоты путем в реакции нуклеофильного замещения (схема 1 ). Такое поведение согласуется с отмеченным в случае электрохимического окисления катехолов в присутствии аспарагиновой кислоты, глутамина и сульфаниловой кислоты [8–10]. Если исходное вещество таково, что потенциал окисления продукта ниже, то тогда и потенциал дальнейшего окисления продукта также ниже, и могут иметь место дальнейшее окисление и реакции присоединения [22]. В случае катехола в присутствии L-лизина окисление L-лизина, замещенного о-бензохиноном протекает легче, чем окисление исходного катехола. Этот продукт замещения также может подвергнуться атаке со стороны L-лизина; этого, однако, не наблюдалось в вольтамперометрических экспериментах вследствие низкой активности о-хинона 4 по сравнению с 2. Отмечены аналогичные полученные электрохимически соединения, такие как катехол и различные нуклеофилы [8–17, 22]. В отсутствие других нуклеофилов, к о‑бензохинону часто присоединяется вода или ион гидроксида [23].
Схема реакции 1:
Рис. 1.
Циклическая вольтамперограмма на стеклоуглеродном электроде в присутствии 2 мМ катехола и 70 мМ L-лизина и 2 мМ катехола и 70 мМ L-лизина в буферном растворе (pH 7) при скорости развертки 0.1 В/с (второй цикл). A0 и A1 – появляющийся анодный пик и исходный анодный пик, C0 и C1 – соответствующие появляющийся катодный пик и исходный катодный пик.

На рис. 2а показаны вторые циклы циклических вольтамперограмм в 2 мМ катехоле в присутствии 70 мМ L-лизина на стеклоуглеродном электроде в буферном растворе (pH 7) при различных скоростях развертки. Ток как в анодном, так и в катодном пике увеличивается с ростом скорости развертки. Катодные пики с ростом скорости развертки сдвигаются влево, а анодные пики – вправо. На рис. 2б показаны зависимости суммарных токов в анодных и катодных пиках в 2 мМ катехоле в присутствии 70 мМ L-лизина во втором цикле развертки от квадратного корня скорости развертки, где суммарный ток означает разность между током в первом и во втором пике методом остановки развертки [22]. Хотя ток в пике возрастает пропорционально увеличению квадратного корня из скорости развертки, но график не проходит сквозь начало координат, так что для тока в пике для реагента каждой из данных редокс–реакций отсутствует чисто диффузионный контроль процесса, т.е. процессы осложнены химическими реакциями, одновременно протекающими на поверхности. Как можно видеть на рис. 2а, катодный пик восстановления о-бензохинона исчезает при скорости развертки 0.05 В/с. При возрастании скорости развертки возникает и начинает расти катодный пик восстановления о-бензохинона. Соответствующая зависимость отношения токов в пиках (Ipa1/Ipc1) от скорости развертки для смеси катехола и L-лизина сначала снижается с возрастанием скорости развертки, а затем после 0.2 В/с остается почти неизменной (рис. 2в). Зависимость отношения токов в анодных пиках (Ipa1/Ipc1) от скорости развертки для смеси катехола и L-лизина сначала возрастает, а потом после 0.2 В/с остается почти неизменной (рис. 2в). С другой стороны, значение токовой функции снижается с возрастанием скорости развертки (рис. 2г). Экспоненциальная природа зависимости токовой функции от скорости развертки указывает на механизм электродного процесса, включающий перенос электрона, химическую реакцию и снова перенос электрона (ECE) [24]. Это подтверждается тем, что ток реакции о-бензохинона 1a с L-лизином 2 сначала увеличивается при низкой скорости развертки, а затем, при более высокой скорости развертки, снижается. Такое поведение согласуется с отмеченным другими исследовательскими группами для аналогичных полученных электрохимически соединений, таких как катехол и различные нуклеофилы [24, 25].
Рис. 2.
(а) Второй цикл циклической вольтамперограммы на стеклоуглеродном электроде в 2 мМ катехоле и 70 мМ L‑лизина в буферном растворе (pH 7) при скорости развертки 0.05–0.5 В/с. (б) Зависимость тока в пике от квадратного корня скорости развертки в тех же условиях. На легенде приведены символы пиков окисления и восстановления. (в) Зависимость отношения токов в пиках (Ipa1/Ipc1) и в анодных пиках (Ipa0/Ipa1) от скорости развертки в тех же условиях. (г) Зависимость токовой функции (Ip/${{v}^{{1/2}}}$) от скорости развертки в тех же условиях.

Существование последующей химической реакции между о-бензохиноном 1a и L-лизином 2 подтверждается следующими аргументами:
1. В присутствии L-лизина на втором цикле снижаются как Ipc1, так и Ipa1 (рис. 1), что может указывать на частичный расход электрохимически сформированного o-бензохинона 1a в химической реакции с L-лизином 2.
2. Соответствующее соотношение токов в пиках (Ipa1/Ipc1) зависит от скорости развертки потенциала. Для более низких скоростей развертки соотношение токов в пиках (Ipa1/Ipc1) сначала снижается с ростом скорости развертки. Это указывает на переход с ростом скорости развертки от промежуточного режима к диффузионному [22].
3. Соответствующее отношение токов в пике (Ipa0/Ipa1) сначала растет, а потом остается практически неизменным. Рост скорости развертки вызывает снижение в процессе химической реакции между 1a и 2 в процессе регистрации циклической вольтамперограммы [22].
4. Было обнаружено, что токовая функция Ip/${{\text{v}}^{{1/2}}}$ снижается экспоненциально с ростом скорости развертки. Это указывает на то, что механизм реакции в системе – электронный перенос, химическая реакция и снова электронный перенос (схема 1 ).
В соответствии с результатами представляется, что реакция 1,4-присоединения по Михаэлю L‑лизина 2 к о-бензохинону 1a приводит к формированию продукта 3. Окисление этого соединения 3 протекает легче, чем окисление исходной молекулы 1 благодаря присутствию электронодонорной аминогруппы.
3.2. Влияние pH
Электрохимическое поведение катехола как в отсутствие, так и в присутствии L-лизина изучали, регистрируя отклик электрода в буферном растворе при различных pH. Измеряли циклическую вольтамперограмму с окислением 2 мМ катехола при различных pH при скорости развертки 0.1 В/с. В буферном растворе с pH 7 катехол демонстрировал выраженную обратимую волну. Потенциал анодного пика катехола с возрастанием pH сдвигался влево. Электрохимическая реакция катехола при pH 7 – двухпротонный, двухэлектронный процесс (схема 1 ) [26, 27].
Циклические вольтамперограммы катехола в присутствии 70 мМ L-лизина на стеклоуглеродном электроде (3 мм) получали при pH от 5 до 11 (рис. 3а). На вольтамперограмме катехола при pH 5 в присутствии 70 мМ L-лизина после продолжительного циклирования отсутствуют новые анодные пики, что говорит о том, что отсутствует реакция между о-бензохиноном и L-лизином. Это может быть связано с тем, что при pH 5 нуклеофильные свойства аминогрупп снижаются при протонировании (рис. 3а). При pH 7 о-бензохинон подвергается атаке со стороны L-лизина по амину в реакции 1,4-присоединения по Михаэлю, в результате чего на вольтамперограмме при продолжительном циклировании появлялся новый анодный пик. В то же время, при более высоких pH (например, pH 9–11) циклические вольтамперограммы катехола демонстрируют необратимое поведение. Таким образом, можно предположить, что окисление катехола сопровождается необратимой химической реакций с гидроксил-ионом, особенно в щелочных растворах [27]. Однако амин в таких условиях также может играть роль нуклеофила.
Рис. 3.
(а) Циклическая вольтамперограмма стеклоуглеродного электрода (3 мМ) в растворе 2 мМ катехола с 70 мМ L‑лизина при различных pH (5, 7, 9 и 11) при скорости развертки 0.1 В/с. (б) Зависимость потенциала пика от pH в тех же условиях. (в) Зависимость тока в пике от pH в тех же условиях. Значение символа A0 аналогично рис. 1.
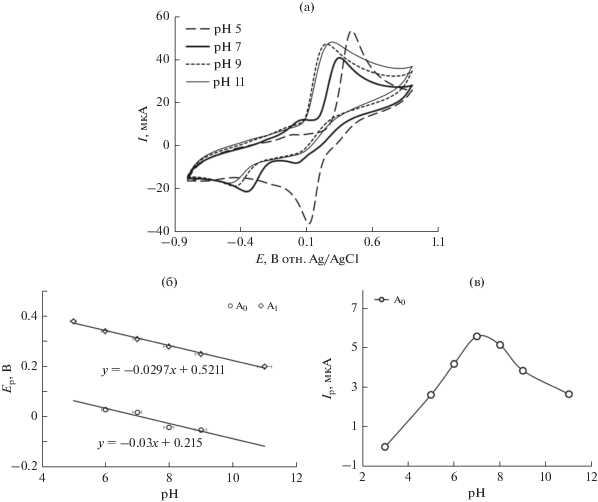
На рис. 3б показан график зависимости потенциала пика окисления Ep от pH. Наклон графика определяется графически для анодных пиков (29.7 и 30 мВ/pH для анодных пиков A1 и A0) при 0.1 В/с, что близко к теоретическому значению для двухэлектронного и двухпротонного процесса. Это указывает на то, что как окисление катехола и аддукта катехол–L-лизин проходило в рамках 2e−/2H+-процессов (схема 1 ). Это также говорит о том, что во время реакции из аддукта катехол–L-лизин высвобождается не только электрон, но и протон. Другие исследовательские группы также сообщали об аналогичном поведении катехола и его производных [28]. На рис. 3в показана зависимость пика окисления A0, обозначенного как Ip, от pH раствора. Из рис. 3в видно, что максимальный ток в пике получен при pH 7. При этом значении pH максимальна разность между отношением токов в пике (Ipa1/Ipc1) в присутствии и в отсутствие L-лизина. Это связано с тем, что электрохимическое окисление катехола в присутствии L-лизина облегчается в нейтральных средах, и, таким образом, скорость переноса электрона выше. Таким образом, в настоящем исследовании был выбран буферный раствор с pH 7 как подходящая среда для электрохимического исследования катехола в присутствии L-лизина.
Влияние концентрации L-лизина
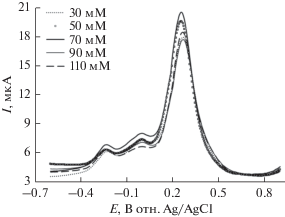
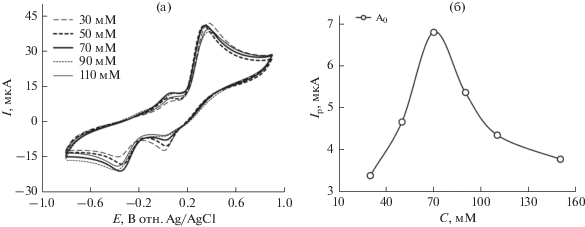
На рис. 4а показано изменение вольтамперограммы при добавлении различных концентраций L-лизина (30, 50, 70, 90 и 110 мМ) к заданной концентрации катехола (2 мМ) на стеклоуглеродном электроде при pH 7 и при скорости развертки 0.1 В/с. Общий ток в появившихся анодных и катодных пиках возрастает при содержании L-лизина до 70 мМ. При дальнейшем добавлении L‑лизина (>70 мМ) ток в анодном и катодном пике немного снижается (рис. 4а). При более высокой концентрации L-лизина (>70 мМ) избыток электрохимически неактивного L-лизина может осаждаться на поверхности электрода и, таким образом, снижается ток в пике.
Рис. 4.
(а) Циклическая вольтамперограмма на стеклоуглеродном электроде при различных содержаниях L-лизина (30, 50, 70, 90 и 110 мМ) при заданном содержании катехола (2 мМ) при pH 7 при скорости развертки 0.1 В/с. (б) Зависимость тока в анодном пике Ip от концентрации (30, 50, 70, 90 и 110 мМ) L-лизина при заданном содержании катехола (2 мМ) в тех же условиях. Значение символа A0 аналогично рис. 1.
Влияние материала электрода
Электрохимические свойства катехола в отсутствие и в присутствии L-лизина изучали на различных электродах, таких как стеклоуглерод, золото и платина, при различных pH. Циклические вольтамперограммы 2 мМ катехола при 70 мМ L‑лизина на стеклоуглеродном, золотом и платиновом электроде показаны на рис. 5.
Рис. 5.
Циклическая вольтамперограмма в растворе 2 мМ катехола и 70 мМ L-лизина на стеклоуглеродном электроде (3.0 мм), золотом электроде (1.6 мм) и платиновом электроде (1.6 мм) при pH 7 и скорости развертки 0.1 В/с.

Природа вольтамперограмм, положение пиков и величина токов для исследуемых систем отличались для разных электродов, хотя диаметр стеклоуглеродного электрода был больше, чем диаметр золотого и платинового электродов. Циклическая вольтамперограмма на золотом электроде немного отличается от кривых на стеклоуглеродном и платиновом электродах. На золотом электроде наблюдаются один анодный и два катодных пика на втором цикле развертки, тогда как на стеклоуглеродном и платиновом электроде на втором цикле развертки потенциала имеются два анодных и два катодных пика. В случае стеклоуглеродного и платинового электродов на втором цикле развертки потенциала появляется новый пик окисления и восстановления при меньшем потенциале окисления, что можно приписать окислению аддукта, формирующегося из o-бензохинона и L-лизина. Электрохимические свойства катехола и L-лизина при измерении, например, pH, концентрации, скорости развертки и т.д. изучали подробно с использованием платинового и золотого электродов. Однако из данных электродов вольтамперометрический отклик на стеклоуглеродном электроде в исследуемых системах был лучше, чем в случае платинового и золотого электродов. Таким образом, в настоящей статье обсуждаются в основном свойства катехола в присутствии L-лизина на стеклоуглеродном электроде.
Последующие циклы циклической вольтамперометрии катехола–L-лизина
На рис. 6а показаны циклические вольтамперограммы первых 15 циклов полученные на стеклоуглеродном электроде в 2 мМ катехоле в присутствии 70 мМ L-лизина в буферном растворе с pH 7 в диапазоне потенциалов между –0.8 и 0.9 В. Вольтамперограмма при скорости развертки 0.1 В/с демонстрирует на первом цикле один анодный пик при 0.35 В и два катодных пика при 0.02 и –0.35 В (пунктирная линия). В последующих циклах развертки появлялся новый анодный пик при 0.03 В, и ток в первом анодном пике постепенно возрастал в процессе циклирования, а ток во втором анодном пике снижался и в процессе циклирования смещался в положительную сторону. Это может быть связано с формированием аддукта катехол–L-лизин в реакции нуклеофильного замещения на поверхности электрода (схема 1 ). Постепенное снижение высоты пиков окисления и восстановления катехола в процессе циклирования можно связать с тем, что концентрации формирующегося аддукта катехол–L-лизин возрастали при циклировании при одновременном снижении концентрации катехола или хинона на поверхности электрода.
Рис. 6.
(а) Циклическая вольтамперограмма на стеклоуглеродном электроде (3.0 мм) в растворе 2 мМ катехола и 70 мМ L-лизина в буферном растворе при pH 7 при скорости развертки 0.1 В/с (15 циклов). Ток в появляющемся анодном пике (A0) возрастал от цикла к циклу. (б) Циклическая вольтамперограмма в 2 мМ катехоле в буферном растворе при pH 7 при скорости развертки 0.1 В/с (15 циклов). Первый цикл (пунктирная линия) и остальные циклы (сплошная линия).
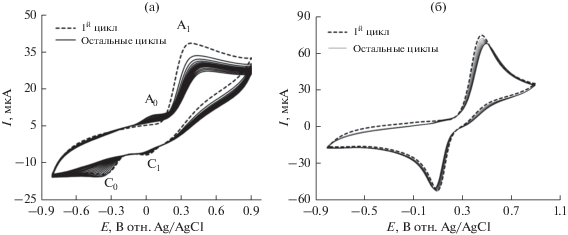
На рис. 6б показаны циклические вольтамперограммы для первых 15 циклов в 2 мМ катехоле в буферном растворе с pH 7 на стеклоуглеродном электроде. Вольтамперограмма при скорости развертки 0.1 В/с демонстрирует один анодный пик при 0.44 В и катодный пик при 0.11 В (пунктирная линия). В последующих циклах новые анодные пики не появляются. Это можно приписать тому, что катехол демонстрировал один анодный пик и соответствующий катодный пик, связанные с его превращением в о-хинон (схема 1 ). Во время дальнейшего циклирования потенциала соотношение токов в анодном и катодном пиках примерно равно единице (рис. 6б), что можно считать критерием стабильности о-хинона, формирующегося на поверхности электрода [25]. Иными словами, любые реакции гидроксилирования [29] или димеризации [28] слишком медленные для того, чтобы наблюдать их во временной шкале циклической вольтамперометрии [25].
Кулонограммы при контролируемом потенциале измеряли в водном растворе с 1 мМ катехола и 35 мМ L-лизина при 0.4 В с pH 7. Электролиз контролировали при помощи циклической вольтамперометрии и дифференциальной импульсной вольтамперометрии (рис. 7). Как показано на рис. 7, в процессе кулонометрии появлялись пики A0 и C0, однако высота пика A0 не возрастала пропорционально времени кулонометрии, параллельно снижению высоты анодного пика A1 и катодного пика C1. Все катодные и анодные пики пропадали после расхода 4 электронов на молекулу катехола.
Рис. 7.
(а) Циклические вольтамперограммы и (б) дифференциальные импульсные вольтамперограммы (через каждые 30 мин) на стеклоуглеродном электроде в 1 мМ катехоле в присутствии 35 мМ L-лизина в процессе кулонометрии при контролируемом потенциале при 0.4 В при pH 7 при скорости развертки 0.1 В/с.

Эти наблюдения позволяют предположить путь, показанный на схеме 1 , для электроокисления катехола 1 в присутствии L-лизина 2. В соответствии с нашими результатами представляется, что реакция 1,4-присоединения 2 к о-хинону 1a (реакция (2)) протекает быстрее, чем другие вторичные реакции, приводя к формированию интермедиата 3. Окисление этого соединения 3 протекает легче, чем окисление исходной молекулы 1 благодаря присутствию электронодонорной группы. Аналогично о-хинону 1a о-хинон 4 также может подвергнуться атаке со стороны L-лизина 2 по позиции C-5. Однако в вольтамперометрических экспериментах других реакций не отмечено вследствие низкой активности о-хинона 4 в реакции 1,4-присоединения по Михаэлю с L-лизином 2.
Дифференциальная импульсная вольтамперометрия
Был использован метод дифференциальной импульсной вольтамперометрии для более подробного изучения реакции замещения для катехола–L-лизина. На рис. 8 приведен второй цикл дифференциальной импульсной вольтамперограммы, полученной для 2 мМ катехола в присутствии 70 мМ L-лизина при различных pH (5–11). В буферном растворе с pH 5–7 катехол демонстрирует три выраженных волны в присутствии L-лизина (Рис. 8). При pH 7 были отмечены первый, второй и третий анодные пики при ~–0.25, –0.01 и 0.25 В, соответственно. Однако при pH 9 и pH 11 на втором цикле развертки ток в появившемся анодном пике очень мал. Можно видеть, что при pH 5 и pH 7 наблюдаются три хорошо разделенных высоких анодных пика, которые можно приписать окислению о-бензохинона, нового соединения с L-лизином и о-бензохинона, соответственно. Продукт замещения 3 также подвергается атаке со стороны лизина, однако его можно зарегистрировать в экспериментах методом дифференциальной импульсной вольтамперометрии.
Рис. 8.
Второй цикл дифференциальной импульсной вольтамперограммы стеклоуглеродного электрода в растворе 2 мМ катехола с 70 мМ L-лизина при различных pH (5, 7, 9 и 11) при скорости развертки 0.1 В/с.

На рис. 9 показана дифференциальная импульсная вольтамперограмма при изменении времени осаждения (0, 10, 60, 120, 150 и 240 с) в растворе 2 мМ катехола и 70 мМ L-лизина при pH 7. Из рис. 9 видно, что возрастание времени осаждения с 0 до 60 с приводит к появлению двух новых пиков при –0.22 и –0.02 В. При возрастании времени осаждения на 60 с протекает нуклеофильная атака и появляется большее количество аддукта катехол–L-лизин, что приводит к снижению концентрации о-бензохинона и повышению концентрации аддукта катехол–L-лизин на поверхности электрода. Для более долгих времен осаждения, от 60 с до 240 с, ток в появляющемся анодном пике возрастает, а второй анодный пик падает. Это связано с тем, что со временем снижается концентрация о-бензохинона и возрастает концентрация аддукта катехол–L-лизин на поверхности электрода.
Рис. 9.
Дифференциальная импульсная вольтамперограмма при времени осаждения (0, 10, 60, 120, 150 и 240 с) в растворе 2 мМ катехола и 70 мМ L-лизина при pH 7, Eимп = 0.02 В, tимп = 20 мс и скорости развертки 0.1 В/с.

Было изучено влияние концентрации L-лизина на дифференциальных импульсных вольтамперограммах катехола. На рис. 10 показана дифференциальная импульсная вольтамперограмма для 2 мМ катехола в буферном растворе (pH 7) в присутствии различных концентраций L-лизина от 30 до 110 мМ на поверхности стеклоуглеродного электрода. Как показано на этом рисунке, снова имеются три раздельных анодных пика, появляющихся после добавления L-лизина в катехол, аналогично рис. 8. В этом случае возрастание концентрации L-лизина от 30 до 70 мМ приводит к росту тока в первом анодном пике. При дальнейшем увеличении концентрации с 70 до 110 мМ постепенно снижается ток в первом и втором анодных пиках. При более низкой концентрации L-лизина (<70 мМ) в сравнимой степени протекает реакция нуклеофильного замещения, тогда как рост концентрации L-лизина (70 мМ) благоприятствует нуклеофильной атаке L-лизина в отношении о-бензохинона на поверхности электрода. При дальнейшем добавлении L-лизина (>70 мМ) в раствор катехола избыток электрохимически неактивного L-лизина может осаждаться на поверхности электрода и, таким образом, снижается ток в пике.
Спектральный анализ катехола с L-лизином
ИК фурье-спектр катехола, лизина и аддукта катехол–лизин был получен в аналогичных условиях. Изготавливали образцы с одинаковой массой катехола, лизина и аддукта катехол–лизин, смешивая соединения с KBr, а затем измеряли спектры в диапазоне волновых чисел 400–4000 см–1. ИК фурье-спектр аддукта катехол–лизин приведен на рис. 11. Для катехола наблюдаются валентные колебания O–H при 3450 см–1, тогда как L-лизин демонстрирует широкий спектр при 3464 см–1 благодаря перекрыванию валентных колебаний O–H и N–H. Для аддукта катехол–лизин интенсивность пика для колебаний N–H снижается, и наблюдаются значительные изменения в характерной области. Это также подтверждает формирование аддукта катехол–лизин.
Таким образом, из приведенного обсуждения ясно, что реакция нуклеофильного замещения катехола в присутствии L-лизина протекает наиболее быстро в присутствии 70 мМ L-лизина при pH 7, что согласуется с данными как циклической вольтамперометрии, так и дифференциальной импульсной вольтамперометрии.
ЗАКЛЮЧЕНИЕ
Электрохимическое поведение катехола в присутствии и в отсутствие L-лизина было исследовано при помощи циклической вольтамперометрии, дифференциальной импульсной вольтамперометрии, кулонометрии с контролируемым потенциалом и ИК–спектроскопии с Фурье-преобразованием. Анодное окисление катехола приводит к формированию o-бензохинона, который реагирует с L-лизином. Реакция переноса электрона происходит при более отрицательном потенциале, чем в случае катехола. Ток в пике для аддукта катехол–L-лизин для каждой редокс–реакции контролируется процессом диффузии. Реакция нуклеофильного замещения катехола в присутствии L-лизина на стеклоуглеродном электроде протекает наиболее быстро в присутствии 70 мМ L-лизина при pH 7. В таких условиях можно сделать вывод, что нуклеофильное присоединение L-лизина протекает посредством механизма включающего перенос электрона, химическую реакцию и перенос электрона.
Список литературы
Barner, B.A., “Catechol,” in Encyclopedia of Reagents for Organic Synthesis, L. Paquette, Ed., John Wiley & Sons, New York, NY, USA, 2004.
Khalafi, L. and Rafiee, M., Kinetic study of the oxidation and nitration of catechols in the presence of nitrous acid ionization equilibria, J. Hazardous Materials, 2010, vol. 174, p. 801.
Bisby, R.H., Brooke, R., and Navaratnam, S., Effect of antioxidant oxidation potential in the oxygen radical absorption capacity (ORAC) assay, Food Chem., 2008, vol. 108, p. 1002.
Rafiee, M., The Electron: The Simplest Chemical Reagent, Synlett, 2007, vol. 3, p. 503.
Nematollahi, D., Rafiee, M., and Fotouhi, L., Mechanistic study of homogeneous reactions coupled with electrochemical oxidation of catechols, J. Iranian Chemical Society, 2009, vol. 6, p. 448.
PDR for Nonprescription Drugs, Dietary Supplements, and Herbs. 31st Ed. PDR Network, LLC, Montvale, NJ. 2010 p. 596
Lysine, Review of Natural Products. Facts & Comparisons [database online]. St. Louis, MO: Wolters Kluwer Health Inc; February 2011.
Motin, M.A., Nazim Uddin, M., Dhar, P.K., Hafiz Mia, M.A., and Hashem, M.A., Voltammetric Electro-synthesis of Catechol-Aspartic Acid Adduct at Different pHs and Concentrations, Anal. Bioanal. Electrochem., 2016, vol. 8, p. 505.
Motin, M. A., Alim Uddin M., Nazim Uddin M., Dhar, P.K., Hafiz Mia M.A., and Hashem, M.A., Electrochemical Oxidation of Catechol in the Presence of Sulfanilic Acid at Different pH, Port. Electrochim Acta, 2017, vol. 35, p. 103.
Hafiz Mia, M.A., Motin, M.A., Huque, E.M., Nazim Uddin, M., Dhar, P.K., and Hashem, M.A., Electro-oxidation of catechol in the presence of L-glutamine at different pH and concentrations, Anal. Bioanal. Electrochem., 2017, vol. 9, p. 597.
Khalafi, L., Rafiee, M., Shahbak, M., and Shirmohammadi, Kinetic Study of the Oxidation of Catechols in the Presence of N-Methylaniline, J. Chemistry, 2013, Vol. 2013, p. 1.
Shahrokhian, S. and Hamzehloei, A., Electrochemical oxidation of catechol in the presence of 2-thiouracil: application to electro-organic synthesis, Electrochem. Commun., 2003, vol. 5, p. 706.
Nematollahi, D. and Golabi, S.M., Investigation of the Electromethoxylation Reaction Part 2: Electrochemical Study of 3-Methylcatechol and 2,3-Dihydroxybenzaldehyde in Methanol, Electroanalysis, 2001, vol. 13, p. 1008.
Nematollahi, D. and Goodarzi, H., Electrochemical study of catechol and some of 3-substituted catechols in the presence of 1,3-diethyl-2-thio-barbituric acid. Application to the electro-organic synthesis of new dispirothiopyrimidine derivatives, J. Electroanal. Chem. 2001, vol. 510, p. 108.
Tabakovic, I., Grujic, Z., and Bejtovic, Z., Electrochemical synthesis of heterocyclic compounds. XII. Anodic oxidation of catechol in the presence of nucleophiles, J. Heterocyclic Chem., 1983, vol. 20, p. 635.
Nematollahi, D. and Forooghi, Z., Electrochemical oxidation of catechols in the presence of 4-hydroxy-6-methyl-2-pyrone, Tetrahedron, 2002, vol. 58, p. 4949.
Golabi, S.M., Nourmohammadi, F., and Saadnia, A., Electrochemical synthesis of organic compounds: 1. Addition of sulfinic acids to electrochemically generated o- and p-benzoquinones, J. Electroanal. Chem. 2002, vol. 529, p. 12.
Janeiro, P., Maria, A., and Brett, O., Catechin electrochemical oxidation mechanisms, Analytica Chimica Acta, 2004, vol. 518, p. 109.
Masek, A., Chrzescijanska, E., and Zaborski, M., Electrochemical Properties of Catechin in Non-Aqueous Media, Int. J. Electrochem. Sci., 2015 vol. 10, p. 2504.
Khalafi, L., Rafiee, M., and Yadaei, F., Voltammetric study of the oxidation of quercetin and catechin in the presence of cyanide ion, Res Chem Intermed, 2011, vol. 37, p. 1047.
https://chem.libretexts.org/LibreTexts/Athabasca_University/Chemistry_360%3A_Organic_Chemistry_II/Chapter_26.
Kiani, A., Raoof, J.B., Nematollahi, D., and Ojania, R., Electrochemical Study of Catechol in the Presence of Dibuthylamine and Diethylamine in Aqueous Media: Part 1. Electrochemical Investigation, Electroanalysis, 2005, vol. 17, p. 1755.
Young, T.E., Griswold, J.R., and Hulbert, M.H., Kinetics of the oxidative cyclization of dopa to dopaquinone, J. Org. Chem., 1974, vol. 39, p. 1980.
Nematollahi, D. and Golabi, S.M., 2000, Investigation of the electro-methoxylation reaction: Part 1. Electrochemical study of 4-tert-butylcatechol and 3,4-dihydroxybenzaldehyde in methanol, J. Electroanal. Chem., vol. 481, p. 208.
Nematollahi, D., Afkhami, A., Mosaed, F., and Rafiee, M., Investigation of the electro-oxidation and oxidation of catechol in the presence of sulfanilic acid, Research on Chemical Intermediates, 2004, vol. 30, p. 299.
Belenky, P., Bogan, K.L, and Brenner, C., NAD+ metabolism in health and disease, Trends Biochem. Sci., 2007, vol. 32, p. 9.
Mazzini, S., Monderelli, R., Ragg, E., and Scaglioni, L., Interaction between metal ions and NAD(P) coenzymes. 1H, 31P, 13C and 59Co NMR Spectroscopy and conformational analysis, J. Chem. Soc. Perkin Trans.1995, vol. 2, p. 285.
Rayn, M.D., Yueh, A., and Wen-Yu, C., The Electrochemical Oxidation of Substituted Catechols, J. Electrochem. Soc.,1980, vol.127, p. 1489.
Pasta, M., Mantia, F.L., and Cui, Y., Mechanism of glucose electrochemical oxidation on gold surface, Electrochim. Acta, 2010, vol. 55, p. 5561.
Дополнительные материалы отсутствуют.