Электрохимия, 2019, T. 55, № 5, стр. 546-557
Исследование электрокаталитического окисления метанола на электроде состава функционализированный никелем оксид графена/графит, модифицированный p-проводящим полимером: экспериментальный и теоретический подход
Р. Сафари a, *, **, А. Эйсани a, Дж. Торабиан b, Амир Хоссейн Никхо a
a Кафедра химии, Факультет наук, Университет Кума
Кум, Иран
b Факультет химии, Технологический университет К.Н. Тоози
Тегеран, Иран
* E-mail: safari_physicalchemistry@yahoo.com
** E-mail: R.Safari@gom.ac.ir
Поступила в редакцию 13.02.2018
После доработки 24.06.2018
Принята к публикации 25.07.2018
Аннотация
Изготовлены композиты состава функционализированный Ni оксид графена/полиортоаминофенол (Ni–ФОГ/ПОАФ); композиты использованы в качестве модификатора графитового электрода для окисления метанола в NaOH. Никель накапливали посредством комплексообразования между Ni(II) в растворе и аминными участками в полимерном остове для получения электрода Ni–ФОГ–ПОАФ/графитовый электрод. Электрохимические характеристики композитных электродов Ni–ФОГ–ПОАФ исследовали при помощи традиционных электрохимических методов. На потенциодинамической кривой на электроде Ni–ФОГ–ПОАФ в щелочных растворах в метаноле наблюдался пик, который приписывали окислению метанола в щелочной среде. Кривые, измеренные в режиме хроноамперометрии, соответствовали уравнению Коттрелла. Полученные результаты обсуждены с точки зрения использования композитов Ni–ФОГ–ПОАФ в каталитических электродах в топливных элементах. Кроме того, использована теория атомов в молекулах (AIM) для изучения переноса заряда/энергии на атомном уровне в графеноподобной молекулярной системе.
ВВЕДЕНИЕ
Прямые метанольные топливные элементы обладают значительным преимуществом как источники питания для мобильных устройств благодаря простой конструкции, низкой рабочей температуре и удобным хранением и подачей топлива. Метанол также является привлекательным, дешевым жидким топливом, которое широко доступно, легко в обращении, хранении и дозаправке. Метанол обладает высокой удельной энергией, близкой к энергии бензина [1]. Метанол окисляется в рамках многоэлектронного процесса, в котором формируются несколько продуктов и/или промежуточных продуктов в зависимости от электролита и природы электрода. Значительные усилия были сосредоточены на механистических аспектах этой реакции на электродах из различных материалов [2]. Никель – наиболее привлекательный электрод для данной реакции [3]. Никель – эффективный и дешевый катализатор для окисления небольших органических соединений, включая глюкозу и глицин [3], углеводы [4], в особенности метанол [3, 5, 6] и этанол [7, 8]. Например, редокс–центры никеля, Ni(OH)2/NiOOH, образующиеся на поверхности никеля, демонстрируют высокую каталитическую активность в реакции окисления метанола в щелочных средах.
Органические–неорганические композиты привлекли значительное внимание, поскольку они сочетают преимущества обоих компонентов и могут обладать особыми свойствами благодаря взаимному усилению или изменению свойств. Полианилин (PANI) и его производные, такие как поли-о-аминофенол (ПОАФ) стали предметом многих исследований благодаря их стабильности в отношении кислорода и воды и потенциальному применению в различных областях [9–20].
Наноматериалы на основе углерода, благодаря своей высокой площади поверхности и хорошей электропроводности, привлекают внимание научного сообщества для разных приложений. Эти наноматериалы на основе углерода, а именно активированный уголь, углеродные нанотрубки и графен, применяются в качестве субстрата для металлооксидных наночастиц и проводящих полимеров для суперконденсаторов [21–23]. Эти проводящие углеродные материалы обеспечивают быстрый перенос электронов в процессе реакций фарадеевского переноса и, таким образом, вызывают увеличение емкости [21–23]. Нанокомпозиты полимер–углерод являются решением проблемы изолирующей природы проводящих полимеров в дедопированном состоянии благодаря использованию углеродных наноматериалов в качестве субстрата для выращивания наноструктурированных полимеров. Функционализация графена повышает емкость, а также обеспечивает центры фиксации для декорирования наночастицами оксида металла и проводящим полимером. Недавно был предложен функционализированный оксид графена (ФОГ) в виде нанолистов как привлекательный наполнитель для модификации электродов и мембран. Функциональные группы ФОГ могут облегчать диспергирование ФОГ в органических растворителях; таким образом, можно ожидать получения композитных мембран с улучшенным распределением нанонаполнителей в полимерной матрице [24], в то время как частицы ОГ с трудом диспергируются в некоторых органических растворителях, и могут возникать проблемы, связанные с агрегированием [25]. Кроме того, функциональные группы структуры ФОГ могут усиливать удерживание воды и протонную проводимость мембран [25].
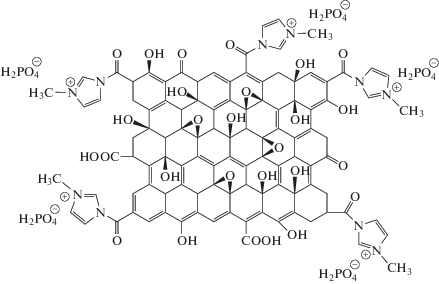
Мы использовали сочетание полезных особенностей модификации полимеров и диспергирования металлических частиц в органическом полимере. Все эти результаты позволили нам продолжать исследования в отношении новых полимерных материалов. В настоящей работе использовано сочетание указанных полезных свойств для электрокаталитического окисления метанола с использованием в качестве проводящего полимера ПОАФ. Наши цели в настоящей работе заключались в повышении электрокаталитической активности ПОАФ путем использования ФОГ (рис. 1) для формирования композитного электрода, а также увеличить электрокаталитическую активность в реакции электрохимического окисления метанола на графитовом электроде, модифицированном Ni–ПОАФ/ФОГ–ПОАФ в растворе 1 M NaOH для прояснения механизма, вычисления кинетических параметров и определения эффективности электрокаталитического процесса.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Реагенты и материалы
Все химические материалы, использованные в данной работе, были изготовлены компанией Merck Chemical Co., имели квалификацию для анализа, и их использовали без дальнейшей очистки. В экспериментах использовали дважды дистиллированную воду.
2.2. Характеризация
Все электрохимические эксперименты проводили при помощи потенциостата Autolab General Purpose System PGSTAT 30 Eco-chime, Нидерланды. Для электрополимеризации ПОАФ использовали стандартную трехэлектродную ячейку с электродом сравнения Ag/AgCl, 3 M KCl. В качестве противоэлектрода и рабочего электрода использовали платиновую проволоку и графитовые электроды, соответственно. Морфологические исследования полимерных пленок осуществляли при помощи анализа СЭМ.
2.3. Синтез ПОАФ и нанокомпозита ПОАФ/ФОГ
Функционализированный оксид графена синтезировали в соответствии с процессом, описанным в наших предыдущих работах [11, 16]. Композиты ПОАФ/ФОГ получали путем перемешивания раствора, содержащего 0.01 M мономера, 0.5 M HClO4, 0.1 M LiCO4 и 5.0 × 10–3 M додецилсульфата натрия (ДСН), на поверхности рабочего электрода. Для полимеризации ПОАФ/ФОГ дисперсию ФОГ получали следующим образом: 5 мг ФОГ добавляли в 1 мл водного раствора диметилформамида (ДМФ) при обработке ультразвуком в течение 2 ч и получали стабильную смесь. Затем ПОАФ наносили на электрод в рамках электрохимического процесса при циклировании в течение 10 циклов из водного раствора, содержащего 0.5 M HClO4, 0.01 M ОАФ и 5.0 × 10–3 M ДСН, где диапазон потенциалов составлял от –0.25 и 0.90 В, а скорость развертки была равна 50 мВ с−1. После полимеризации 5 мкл ФОГ, 0.05 вес. %, дисперсию немедленно наносили на электрод. После сушки рабочий электрод снова подвергали циклированию в указанном растворе ОАФ в течение 10 циклов [11, 26]. Для внедрения ионов Ni(II) в пленку ПОАФ свежие электрополимеризованные рабочие электроды помещали в условиях разомкнутой цепи в хорошо перемешиваемый водный раствор 0.1 М Ni(NO3)2. Никель накапливали посредством комплексообразования между Ni(II) в растворе и аминными участками в полимерном остове [27] в течение заданного периода времени.
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изображения СЭМ электросинтезированного ПОАФ/ФОГ приведены на рис. 2. Изображение СЭМ композита ПОАФ/ФОГ демонстрирует пористую структуру и наличие ФОГ в электросинтезированной композитной пленке. На изображении СЭМ ПОАФ/ФОГ можно видеть, что индивидуальные нанолисты ФОГ имеют чешуйчатую структуру и структуру типа мятой бумаги с расслоением по горизонтали между компактными слоями нанолистов оксида графена из природного графита.
На рис. 3 показаны циклические вольтамперограммы электродов Ni–ПОАФ и Ni–ПОАФ/ФОГ в щелочном растворе. Больший отклик Ni в случае Ni–ПОАФ/ФОГ по сравнению с электродом Ni–ПОАФ предположительно связан с тем, что Ni–ПОАФ/ФОГ вызывает увеличение электрохимической активности редокс–пары Ni2+/Ni3+ благодаря большей дисперсности частиц в матрице проводящего полимера, приводящей к резкому возрастанию площади поверхности [11].
Рис. 3.
Циклические вольтамперограммы на электродах (1) Ni–ПОАФ и (2) Ni–ПОАФ/ФОГ в растворе 1.0 M NaOH при скорости развертки потенциала 10 мВ с−1.

На рис. 4а представлены типичные циклические вольтамперограммы на электроде Ni–ПОАФ/ФОГ в растворе 1 M NaOH при различных скоростях развертки потенциала. При 380 и 230 мВ (НКЭ) наблюдается пара редокс-пиков, связанная с редокс-парой Ni2+/Ni3+ в щелочных средах [27–30]. Это может быть объяснением того, почему ΔE для пары Ni(II)/Ni(III), полученной в случае композитной пленки, меньше, чем в случае чистой пленки из оксида никеля, поскольку большая дисперсность частиц оксида никеля в сетке ПОАФ облегчает обмен электронов. Токи в пиках пропорциональны скоростям развертки в диапазоне 10–50 мВ с–1, рис. 4б, 4в, что указывает на электрохимическую активность поверхностной редокс-пары. Из наклона этих линий и с использованием [31]
где Г* – заполнение поверхности редокс-частицами, а $v$ – скорость развертки потенциала, при усреднении катодных и анодных результатов были получены значения Г* около 9.46 × 10–6 моль см–2. При более высоких скоростях развертки потенциала наблюдается линейная зависимость от квадратного корня из скорости развертки (рис. 4г, 4д), что говорит о преобладании диффузионно-контролируемых процессов.Рис. 4.
(а) Типичные циклические вольтамперограммы электрода Ni–ПОАФ/ФОГ в 1 M NaOH при различных скоростях развертки; зависимость тока в анодном (б) и катодном (в) пике от скорости развертки при меньших значениях, 10–50 мВ/с. Пропорциональность тока в (г) анодном и (д) катодном пике от квадратного корня скорости развертки при более высоких значениях.

После подтверждения высокой активности Ni–ПОАФ/ФОГ по сравнению с Ni–ПОАФ была использована композитная пленка для электрокаталитического окисления метанола в щелочной среде. На вставке на рис. 5 показаны циклические вольтамперограммы на электроде Ni–ПОАФ/ФОГ в растворе 1.2 M метанола при скорости развертки потенциала, равной 10 мВ с–1. Большие токи окисления метанола на электроде Ni–ПОАФ/ФОГ связаны с тем, что композитный материал усиливает свойства оксида никеля благодаря большей дисперсности частиц катализатора в проводящей полимерной матрице, что приводит к сильному увеличению площади поверхности. Электрокаталитическое поведение любого материала зависит от различных факторах, таких как: 1) положение энергетических уровней реакционноспособных частиц и материала электрода; 2) процесс переноса заряда на границе раздела электрод/электролит; 3) диффузия реагентов в/вблизи поверхности электрода и морфология поверхности электрода. Эти результаты можно объяснить электрохимическими реакциями на полупроводниковом электроде. Здесь ПОАФ рассматривается как полупроводник p-типа. Энергетический уровень примеси должен быть расположен над верхним валентным уровнем, поскольку ПОАФ – материал p-типа. Поскольку электрод находится в анодной области, электроны отбираются из электролита и реагируют с дырками в полупроводнике. Таки образом, в настоящем исследовании показано, что перенос заряда на границе раздела электрод/электролит оказывает наибольшее влияние на электроокисление метанола в случае полупроводникового полимерного электрода. Также следует отметить, что такие процессы переноса заряда также важны в процессах электрохромизма и фотоэлектрохимических явлениях. На первой стадии переноса заряда в пленках ПОАФ, которые считаются полупроводниками p-типа, где основными носителями являются дырки, имеются два значимых процесса: межцепочечный и внутрицепочечный транспорт. Внутрицепочечный транспорт заряда происходит вдоль основной цепи, что облегчается расширенным сопряжением. Межцепочечный транспорт заряда происходит, главным образом, от одной цепи к другой путем перескоков.
Рис. 5.
Циклические вольтамперограммы на электроде Ni–ПОАФ/ФОГ в присутствии 0.15–3.0 M метанола (а). Вставка: циклические вольтамперограммы электродов Ni–ПОАФ и Ni–ПОАФ/ФОГ в растворе 1 M NaOH в присутствии 1.2 M метанола при скорости развертки потенциала, равной 10 мВ с–1. Гистограммы активности различных катализаторов на основе Ni в реакции окисления метанола (б).
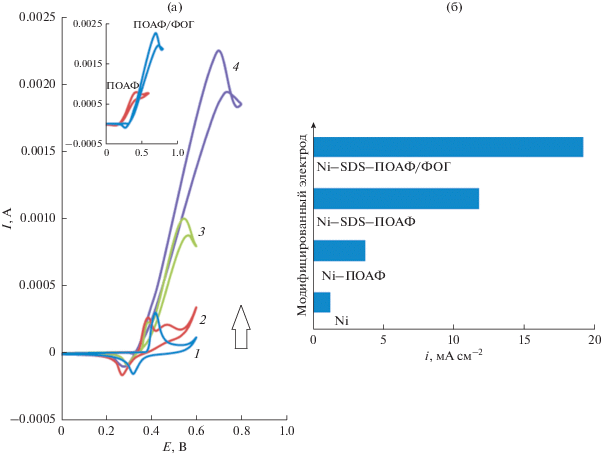
На рис. 5a показаны циклические вольтамперограммы на электроде Ni–ПОАФ/ФОГ в растворе 1 M NaOH в присутствии различных концентраций метанола при скорости развертки потенциала, равной 10 мВ с–1. На электроде Ni–ПОАФ/ФОГ как типичный электрокаталитический отклик наблюдалось окисление метанола. Анодный заряд возрастал по сравнению с наблюдаемым в случае модифицированной поверхности в отсутствие метанола; затем катодный заряд снижался при увеличении концентрации метанола в растворе.
Анодный ток при положительной развертке был пропорционален объемной концентрации метанола, и любой рост концентрации метанола вызывал почти пропорциональное возрастание анодного тока. Таким образом, представляется, что действительно протекает каталитическое электроокисление метанола на Ni–ПОАФ/ФОГ.
Циклические вольтамперограммы на Ni–ПОАФ/ФОГ в присутствии 1.2 М метанола при различных скоростях развертки потенциала и пропорциональность токов в анодных пиках квадратному корню из скорости развертки приведены на рис. 6а и 6б, соответственно. При низких скоростях развертки отсутствовал катодный пик, однако он появлялся при увеличении скорости развертки. Это явление указывает на то, что электроокисление частиц никеля до более высокой валентности протекает гораздо быстрее, чем каталитическое окисление метанола. Отсюда следует, что окисление метанола на Ni может быть медленным процессом. При более высоких скоростях развертки наблюдается новый пик окисления метанола при потенциалах гораздо положительнее потенциала окисления Ni(OH)2. В то же время токи в анодных пиках, пропорциональные квадратному корню из скорости развертки на рис. 6б говорят о том, что полное окисление метанола на этом электроде контролируется диффузией метанола из раствора к поверхностным редокс-центрам. Значение коэффициента переноса электрона для данной реакции, которая полностью необратима и контролируется диффузией, может быть получено из следующего уравнения [32]:
(2)
${{E}_{{\text{p}}}} = \left( {{{RT} \mathord{\left/ {\vphantom {{RT} {n\alpha F}}} \right. \kern-0em} {n\alpha F}}} \right)\ln v + {\text{const}}.$Рис. 6.
Типичная циклическая вольтамперограмма Ni–ПОАФ/ФОГ в 1.0 M NaOH в присутствии 1.2 M метанола при различных скоростях развертки потенциала (а). Зависимость анодного тока пика в процессе прямой развертки от квадратного корня скорости развертки (б).

На основании зависимости потенциала анодного пика от натурального логарифма скорости развертки потенциала было получено значение коэффициента переноса заряда, равное 0.32.
На рис. 7а приведены двухступенчатые хроноамперограммы (транзиенты ток–время), зарегистрированные для окисления метанола на Ni–ПОАФ/ФОГ в щелочной среде в диапазоне концентраций 0.15–3.0 М с импульсами потенциала 480 и 220 мВ, соответственно. Зависимость полного тока от обратного квадратного корня из времени после вычитания фонового тока отвечает линейной зависимости (рис. 7в). Очевидно преобладание процесса, контролируемого диффузией. По наклону этой линии из уравнения Коттрелла [33]
(3)
$I = nFADC{{\pi }^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}{{t}^{{ - {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$Рис. 7.
Сравнительные хроноамперограммы электродов Ni–ПОАФ и Ni–ПОАФ/ФГО в 1.2 M метаноле (а) и двухступенчатные хроноамперограммы электрода Ni–ПОАФ/ФОГ в растворе 1 M NaOH в отсутствие и в присутствии различных концентраций метанола: 0.15–3.0 М. Скачок потенциала составлял 480 и 220 мВ, соответственно (б). Зависимость транзиента тока от t1/2 для хроноамперограммы электрода Ni–ПОАФ/ФОГ (в).

Электрохимическая импедансная спектроскопия – один из наилучших методов для анализа свойств электродов на основе проводящих полимеров и механизма переноса заряда на границе раздела электролит/электрод. Он широко обсуждается в литературе с применением ряда теоретических моделей [34–37]. На рис. 8а показаны графики Найквиста для Ni–ПОАФ/ФОГ в присутствии одинаковой концентрации метанола. Более медленный перенос заряда при электроокислении метанола на электроде Ni–ПОАФ/ФОГ связан с более высокой каталитической активностью композитного материала. На рис. 8б показаны диаграммы Найквиста для Ni–ПОАФ/ФОГ при различных концентрациях метанола. В диапазоне концентраций метанола 0.15–3.0 М наблюдается стабильное снижение диаметра полуокружности. Диаграммы состоят из небольшой полуокружности, переходящей в депрессированные емкостные полуокружности в низкочастотной области спектра. На рис. 8б изображена эквивалентная схема, соответствующая диаграмме Найквиста, измеренной в присутствии метанола. Для получения удовлетворительной подгонки параметров импеданса в случае электроокисления метанола необходимо заменить емкость C в эквивалентной схеме элементом постоянной фазы CPE. Наиболее частое объяснение наличия CPE и депрессированных полуокружностей на твердых электродах – микрошероховатость, вызывающая неоднородное распределение сопротивления раствора, а также двойнослойной емкости [38–40]. Rct и CPE соответствуют окислению метанола. При росте концентраций метанола снижаются диаметры полуокружности, а перенос заряда для электроокисления метанола на поверхности Ni–ПОАФ/ФОГ медленнее, чем на Ni–ПОАФ. Иначе говоря, введение ФОГ в полимерную матрицу приводит к снижению сопротивления переноса заряда на графиках Найквиста.
Рис. 8.
Диаграммы Найквиста ПОАФ и ПОАФ/ФОГ при потенциале разомкнутой цепи (OCP) в щелочном растворе в присутствии одинаковой концентрации метанола (а). Диаграммы Найквиста для Ni–ПОАФ/ФОГ при различных концентрациях метанола (б).

Был предложен ряд механизмов электроокисления спиртов на Ni в щелочных растворах. Флайшман и соавторы [29] предполагали для NiOOH каталитическую/промежуточную роль в процессе анодной развертки потенциала. На основании нашего исследования и в соответствии с литературой [27] была предложена следующая формула для опосредованного электроокисления метанола на модифицированном рабочем электроде.
(4)
${{R}_{{ct}}} = {{\left( {\frac{{d{{i}_{f}}}}{{dE}}} \right)}^{{ - 1}}} = \frac{{{{{({{k}_{1}} + {{k}_{{ - 1}}} + 2{{k}_{2}}C*)}}^{2}}}}{{\left[ {2FA\Gamma {{k}_{2}}C{\text{*}}{{k}_{1}}\left( {\frac{{2\alpha F{{k}_{2}}C{\text{*}}}}{{RT}} + \frac{{{{k}_{{ - 1}}}F}}{{RT}}} \right)} \right]}}.$Согласно зависимости Rct от концентрации метанола на графиках Найквиста (рис. 8б), начальное резкое снижение заканчивается очень медленным изменением, когда концентрация метанола приближается к 3.0 M. Далее результаты подставляют в уравнение 4 для оценки значений констант скорости. Согласно этому уравнению были рассчитаны значения констант скорости: k1 = 1.95 с–1, k–1= 2.77 × 10–2 с–1 и k2= 7.89 × × 102 см3 моль–1 с–1.
4. ТЕОРЕТИЧЕСКИЙ ПОДХОД
В настоящем исследовании изучены локальный заряд и перенос энергии в ОГ-подобных молекулярных системах с применением квантовохимических методов. Для этого были изучены механизмы/эффекты внутримолекулярного электронного транспорта в системах на основе графита/ОГ-подобных системах под действием внешнего электрического поля (с интенсивностью ${{\varepsilon }_{F}}$) с использованием предложенной Ричардом Бейдером теории атомов-в-молекулах (AIM), которая является обобщением квантовой теории на собственно наноразмерные системы и описывает наносистемы в рамках топологии атомной электронной плотности ($\rho (r)$) и ее лапласиана (${{\nabla }^{2}}\rho (r)$), критических точек связей и порядка связей, атомной электронной энергии (${{E}_{{{\text{elec}}}}}$) и вириала силы (ν) [41, 42]. Типичные результаты приведены на рис. 9 и 10. Анализ результатов в атомной шкале показывает, что кислород играет основную роль во внутримолекулярном переносе заряда и энергии в ОГ-подобной системе. Как правило, при приложении внешнего поля к графитоподобным/ОГ-подобным системам заряд и энергия передаются между n-подобными и p-подобными внутримолекулярными участками, что приводит к распределению локальных $\rho (r)$ и ${{E}_{{{\text{elec}}}}}.$ Таким образом, данное локальное изменение атомного заряда и энергии может быть выбрано в качестве меры отклика атомного резервуара на внешнее поле. Также можно предсказать, что полученные здесь результаты могут быть использованы для исследования переноса заряда и энергии в атомных масштабах в любых системах с графеноподобной структурой или в графеноподобных молекулярных устройствах.
Рис. 9.
Влияние внешнего электрического поля (${{\varepsilon }_{F}} = 20 \times {{10}^{{ - 3}}}$ у.е.) на локальную контурную карту (в плоскости молекулы) электронной плотности (а), лапласиан электронной плотности (б), электронную кинетическую энергию (в) и вириал силы (г) ОГ-подобной молекулярной системы.

Рис. 10.
Влияние внешнего электрического поля (${{\varepsilon }_{{\text{F}}}} = 80 \times {{10}^{{ - 3}}}$ у.е.) на локальную контурную карту (в плоскости молекулы) электронной плотности (а), лапласиан электронной плотности (б), электронную кинетическую энергию (в) и вириальную силу (г) ОГ-подобной молекулярной системы.

ЗАКЛЮЧЕНИЕ
Для получения дешевого катализатора с большим ресурсом для прямых метанольных топливных элементов был электрохимически синтезирован Ni–ПОАФ/ФОГ на поверхности графита (рабочий электрод). Наличие в каталитическом слое функционализированного оксида графена и проводящего полимера улучшает механические и электрические свойства каталитического слоя. Фактически ПОАФ/ФОГ также играет роль связующего в каталитическом слое без серьезных ограничений в диффузии метанола к активным участкам катализатора. Таким образом, можно заключить, что Ni–ПОАФ/ФОГ может быть хорошей альтернативой анодным катализаторам в реакции электроокисления метанола по сравнению с графитом, не модифицированным Ni, для прямых метанольных топливных элементов. Кроме того, использована теория AIM для изучения влияния внешнего электрического поля на локальный/атомный заряд и перенос энергии в ОГ-подобной молекулярной системе.
Список литературы
SH, S. and CS, L., Impedance characteristics of the directmethanol fuel cell under various operating conditions, Energy Fuels, 2008, vol. 22, p. 1204–11.
Jarvi, T.D. and Stuve, E.M., Electrocatalysis (Edited for J. Lopkowski and P.N.Ross), Chapter. 3, Wiley-VCH, New York, 1998, p. 75.
NozadGolikand, A., Asgari, GhannadiMaragheh, M., and Shahrokhian, S., Methanol electrooxidation on a nickel electrode modified by nickel–dimethylglyoxime complex formed by electrochemical synthesis, J Electroanalytical Chemistry, 2006, vol. 588, p. 155.
Cataldi, T.R.I., Centoze, D., and Ricciardi, G., Electrode modification with a poly (NiII-tetramethyldibenzotetraaza[14]annulene) film. Electrochemical behavior and redox catalysis in alkaline solutions, Electroanalysis, 1995, vol. 7, p. 305.
Tammam, R.H., Fekry, A.M., and Saleh, M.M., Electrocatalytic oxidation of methanol on ordered binary catalyst of manganese and nickel oxide nanoparticles. Int. J. Hydrogen Energy. 2015, vol. 40, p. 275.
Carvalho, L.L., Colmati, F., and Tanaka, A.A., Nickel-palladiumelectrocatalysts for methanol, ethanol and glycerol oxidation reactions, Int. J. Hydrogen Energy, 2017, vol. 42, p. 16118.
Fiaccabrino, G.C. and Koudelka-Hep, M., Thin-Film Microfabrication of Electrochemical Transducers, Electroanalysis, 1998, vol. 10, p. 217.
Liao, Y.Y. and Chou, T.C., An Amperometric Alcohol Sensor by Using Electroless Nickel as Working Electrode, Electroanalysis, 2000, vol. 12, p. 55.
Gharibi, H., Zhiani, M., Mirzaie, R.A., Kheirmand, M., Entezami, A.A., Kakaei, K. et al., Investigation of polyaniline impregnation onthe performance of gas diffusion electrode (GDE) in PEMFC using binary of Nafion and polyaniline nanofiber, J. Power Sources, 2006, vol. 157(2), p. 703e8.
Shabani-Shayeh, J., Ehsani, A., Ganjali, M.R., Norouzi, P., and Jaleh, B., Conductive polymer/reduced graphene oxide/Au nano particles as efficient composite materials in electrochemical supercapacitors, Appl. Surf. Sci., 2015, vol. 353, p. 594.
Ehsani, A., Hadi, M. Kowsari, E. Doostikhahc, and S. Torabian, J., Electrocatalytic oxidation of ethanol on the surface of the POAP / phosphoric acid-doped ionic liquid-functionalized graphene oxide nanocomposite film, Iran. J. Cataly, 2017, vol. 7, p. 187.
Ehsani, A., Influence of counter ions in electrochemical properties and kinetic parameters of poly tyramine electroactive film, Progress in Organic Coating., 2015, vol. 78, p. 133.
Ehsani, A., Kowsari, E., Boorboor Ajdari, F., Safari, R., and Mohammad Shiri, H., Influence of newly synthesized geminaldicationic ionic liquid on electrochemical and pseudocapacitance performance of conductive polymer electroactive film, J. Colloid Interf. Sci., 2017, vol. 505, p. 1158.
Ehsani, A., Mohammad Shiri, H., Kowsari, E., Safari, R., ShabaniShayeh, J., and Barbary, M., Electrosynthesis, physioelectrochemical and Theoretical investigation of poly ortho aminophenol/magnetic functional graphene oxide nanocomposites as novel and hybrid electrodes for highly capacitive pseudocapacitors, J. Colloid Interf. Sci., 2017, vol. 490, p. 695.
Naseri, M., Fotouhi, L., Ehsani, A., and Dehghanpour, S., Facile electrosynthesis ofnano flower like metal-organic framework and its nanocomposite with conjugated polymeras a novel and hybrid electrode material for highly capacitive pseudocapacitors, J. Colloid Interf. Sci., 2016, vol. 484, p. 314.
Ehsani, A., Shiri, M.H., Kowsari, E., Safari, R., Torabian, J., and Kazemi, S., Nanocomposite of p-type conductive polymer/functionalized graphene oxide nanosheets as novel and hybrid electrodes for highly capacitive pseudocapacitors, J. Colloid Interf. Sci., 2016, vol. 478, p. 181.
Shiri, H.M. and Ehsani A., Pulse electrosynthesis of novel wormlike gadolinium oxide nanostructure and its nanocomposite with conjugated electroactive polymer as a hybrid and high efficient electrode material for energy storage device, J. Colloid interf. Sci., 2016, vol. 484, p. 70.
Ehsani, A., Khodayari, J., Hadi, M., Mohammad Shiri, H., and Mostaanzadeh, H., Nanocomposite of p‑type conductive polymer/Cu(II)-Based metal-organic frameworks as a novel and hybrid electrode material for highly capacitive pseudocapacitors, Ionics, 2017, vol. 23, p. 131.
Shiri, H.M. and Ehsani, A., A simple and innovative route to electrosynthesis of Eu2O3 nanoparticles and its nanocomposite with p-type conductive polymer: Characterization and electrochemical properties, J. Colloid Interf. Sci., 2016, vol. 473, p. 126.
Kowsari, E., Ehsani, A., Dashti Najafi, M., and Bigdeloo, M., Enhancement of pseudocapacitance performance of p-type conductive polymer in the presence of newly synthesized graphene oxide-hexamethylene tributylammonium iodide nanosheets, J. Colloid Interf. Sci., 2018, vol. 512, p. 346.
Wu, J.S. Pisula, W., and Mullen, K., Graphenes as potential material for electronics, Chem. Rev., 2007, vol. 107, p. 718.
Yoo, E., Kim, J., Hosono, E. Zhou, H.S. Kudo, and T. Honma, L., Large reversible Li storage of graphene nanosheet families for use in rechargeable lithium ion batteries, Nano Lett., 2008, vol. 8, p. 2277.
Wang, X. Zhi and L. Mullen, K., Transparent, conductive graphene electrodes for dye-sensitized solar cells, Nano Lett., 2008, vol. 8, p. 323.
Xu, C., Liu, X., Cheng, J., and Scott, K., A polybenzimidazole/ionic-liquid-graphite-oxide composite membrane for high temperature polymer electrolyte membrane fuel cells, J. Power Sources., 2015, vol. 274, p. 922.
Kowsari, E., Zare, A., and Ansari, V., Phosphoric acid-doped ionic liquid-functionalized graphene oxide/sulfonated polyimide composites as proton exchange membrane, Int. J. Hydrog. Energ., 2015, vol. 40, p. 13964.
Yang, Y., Diao, M., Gao, M., Sun, X. Liu, X., Zhang, G., Qi, Z., and Wang, S., Facile preparation of Graphene/Polyaniline composite and its application for electrocatalysis hexavalent Chromium reduction, Electrochim. Acta, 2014, vol. 132, p. 496.
Ehsani, A. Vaziri-Rad, A., Babaei, F., and Mohammad Shiri, H., Electrosynthesis, optical modeling and electrocatalytic activity of Ni-MWCNT-PT nanocomposite film, Electrochim. Acta, 2015, vol. 159, p. 140.
Berchmans, S., Gomathi, H., and Prabhakara Rao, G., Electrooxidationof alcohols and sugars catalysed on a nickel oxide modified glassy carbon electrode, J. Electroanal. Chem., 1995, vol. 394, p. 267.
Fleischmann, M., Korinek, K., and Pletcher. D., The oxidation of organic compounds at a nickel anode in alkaline solution, J. Electroanal. Chem., 1971, vol. 31, p. 39.
Taraszewska, J. and Roslonek, G., Electrocatalytic oxidation of methanol on a glassy carbon electrode modified by nickel hydroxide formed by ex situ chemical precipitation, J. Electroanal. Chem., 1994, vol. 364, p. 209.
Bard, A.J. and Faulkner, L.R., Electrochemical Methods, Wiley, New York, 2001. p. 591.
Harrison, J.A. and Khan, Z.A., The oxidation of hydrazine on platinum in acid solution, J. Electroanal. Chem., 1970, vol. 28, p. 131.
Bard, J.A. and Faulkner, L.R., Electrochemical methods, fundamentals and applications. In: Bard, J.A., Ed. Chap. 5. Wiley, New York, 2001. p. 209.
Ehsani, A., Mahjani, M.G., Bordbar, M., and Adeli, S., J. Electroanal. Chem., 2013, vol. 710, p. 29.
Shiri, H.M., Ehsani, A., and Shabani Shayeh, J., Synthesis and highly efficient supercapacitor behavior of a novel poly pyrrole/ceramic oxide nanocomposite film, RSC Advanc., 2015, vol. 110, p. 91062.
Shiri, H.M. and Ehsani, A., Electrosynthesis of neodymium oxide nanorods and its nanocomposite with conjugated conductive polymer as a hybrid electrode material for highly capacitive pseudocapacitors, J. Collo. Interf. Sci, 2017, vol. 495, p. 102.
Shiri, H.M. and Ehsani, A., A novel and facile route for the electrosynthesis of Ho2O3 nanoparticles and its nanocomposite with p-type conductive polymer: characterisation and electrochemical performance, Bull. Chem. Soc. Japan, 2016, vol. 89, p. 1201.
Naseri, M., Fotouhi, L., Ehsani, A., and Shiri, H.M., Novel electroactive nanocomposite of POAP for highly efficient energy storage and electrocatalyst: Electrosynthesis and electrochemical performance, J. Collo. Interf. Sci., 2016, vol. 484, p. 308.
Shiri, H.M., Ehsani, A., and Khales, M.J., Electrochemical synthesis of Sm2O3 nanoparticles: Application in conductive polymer composite films for supercapacitors, J. Collo. Interf. Sci., 2017, vol. 505, p. 940.
Kowsari, E., Ehsani, A., Dashti Najafi, M., and Bigdeloo, M., Enhancement of pseudocapacitance performance of p-type conductive polymer in the presence of newly synthesized graphene oxide-hexamethylene tributylammonium iodide nanosheets, J. Colloid Interf. Sci., 2018, vol. 512, p. 346.
Matta, C.F. and Boyd, R.J., The Quantum Theory of Atoms in Molecules, Wiley, Weinheim, 2007.
Matta, C.F. and Boyd, R.J., Quantum Biochemistry, Wiley, Weinheim, 2010.
Дополнительные материалы отсутствуют.