Электрохимия, 2019, T. 55, № 6, стр. 701-710
Особенности ионного транспорта в новых нанокомпозитных гель-электролитах на основе сетчатых полимеров и наночастиц оксида кремния
Г. Р. Баймуратова a, А. В. Черняк a, b, А. А. Слесаренко a, Г. З. Тулибаева a, В. И. Волков a, О. В. Ярмоленко a, *
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
b Научный центр РАН
142432 Московская обл., Черноголовка, ул. Лесная, 9, Россия
* E-mail: oyarm@icp.ac.ru
Поступила в редакцию 31.07.2018
После доработки 18.10.2018
Принята к публикации 22.01.2019
Аннотация
В данной работе исследованы особенности ионного транспорта нанокомпозитной системы на основе сетчатой матрицы, полученной по реакции радикальной полимеризации диакрилат полиэтиленгликоля в присутствии жидкого апротонного электролита 1 M LiBF4 в гамма-бутиролактоне и нанопорошка SiO2. Измеренные коэффициенты самодиффузии на ядрах 7Li методом ЯМР с импульсным градиентом магнитного поля показали максимум при содержании 2 мас. % наночастиц SiO2. Данный состав нанокомпозита имеет самые высокие числа переноса по катиону – 0.49 и максимальную проводимость в исследованном температурном интервале (от –70 до 100°С): 4 мСм/см при 20°С и 1 мСм при –70°С. Второй максимум проводимости при 6 мас. % характеризуется только низкой эффективной энергией активации проводимости. В работе предложены возможные механизмы повышения проводимости, первый из которых обусловлен увеличением числа подвижных носителей заряда, к которому может привести ионная диссоциация соли, второй – созданием большого количества благоприятных путей для ионного транспорта.
ВВЕДЕНИЕ
Нанокомпозитные полимерные электролиты (НПЭ) для литиевых источников тока являются перспективным классом электролитов для полностью твердотельных литиевых и литий-ионных аккумуляторов, имеющих повышенную безопасность при эксплуатации [1]. НПЭ обычно состоят из трех или четырех компонентов, таких как соль электролита, полимер, неорганические наночастицы, органический растворитель или ионная жидкость. В обзорах [2, 3] показан положительный вклад наночастиц как в механические, так и электрохимические свойства полимерных электролитов (увеличение проводимости, уменьшение сопротивления переноса заряда на границе электрод/электролит, расширение окна электрохимической стабильности электролита на границе с литиевым электродом). Но механизм ионной проводимости в таких системах изучен не до конца. Это связано со сложным взаимодействием внутри нанокомпозитной системы, так как ионы в ней могут взаимодействовать как с функциональными группами полимеров и молекулами апротонных растворителей, так и c поверхностью наночастиц неорганических оксидов. Такое неоднозначное окружение может вызвать немонотонную зависимость ионной проводимости от концентрации наночастиц, имеющую как один, так и два экстремума.
Рассмотрим вопрос о причинах повышения ионной проводимости в нанокомпозитах. В исследованиях НПЭ, опубликованных в литературе, был предложен ряд механизмов для увеличения ионной проводимости, таких как увеличение разупорядоченности системы [4, 5], взаимодействие нанонаполнителя с солью или полимером по типу кислота–основание Льюиса [6], увеличение ионной подвижности [7, 8], увеличение чисел переноса [9], увеличение сегментарного движения полимера [10], электростатические взаимодействия между ионами и частицами нанонаполнителя [11], образование пространственного заряда [12], создание новых благоприятных путей проводимости [7] и перколяционных эффектов [13–16]. В реальных системах повышение ионной проводимости может осуществляться по тому или иному механизму, а возможно проявление сразу нескольких механизмов из перечисленных выше. Вполне возможно, что комбинация двух и более механизмов будет более эффективна, чем один.
Обычно в работах по исследованию НПЭ все эти механизмы накладываются, и проявляется один пик на зависимости проводимости от концентрации наночастиц (SiO2, TiO2, ZrO2, глина и т.д.) [2, 17–21]. Очень редко встречаются нанокомпозитные системы, где при небольшом количестве нанопорошка проявляется еще один максимум [22–25]. Авторы относят этот пик к увеличению носителей заряда, вызванный ионной диссоциацией соли, а второй основной пик к созданию новых благоприятных путей проводимости и/или перколяционному эффекту. Эффект ионной диссоциации соли лития преимущественно проявляется на поверхности наночастиц SiO2. Данный эффект был отдельно изучен на примере полой наночастицы оксида кремния в работе Lee и др. [26]. Авторы [26] показали, что, чем меньше диаметр частиц, тем большее количество молекул соли лития будет вовлечено в процесс диссоциации, и тем выше будет количество подвижных ионов, которые вносят вклад в проводимость.
Ранее нами был разработан новый нанокомпозитный электролит на основе диакрилата полиэтиленгликоля c добавлением жидкого электролита 1 М LiBF4 в гамма-бутиролактоне и нанопорошка SiO2. Предыдущие исследования показали [27‒29], что зависимость проводимости от количества введенного нанопорошка SiO2 в данной системе имеет два максимума в отличие от похожей системы с нанодобавками TiO2 и Li2TiO3 [30, 31], где наблюдается только один. Почему в похожих по составу сетчатых полимерных электролитах на основе полиэфирдиакрилатов реализуется разный механизм проводимости? По-видимому, решающую роль здесь играет вид наночастиц. Чтобы выяснить это, необходимо, более детально изучить влияние наночастиц SiO2 на ионный транспорт в этой системе.
Таким образом, целью данной работы является исследование особенностей ионного транспорта в нанокомпозитной системе с введением SiO2 и определение механизмов повышения проводимости, которые реализуются в первом и втором максимуме. Для этого будут измерены коэффициенты самодиффузии на ядрах 7Li методом ЯМР с импульсным градиентом магнитного поля и с помощью спектроскопии электрохимического импеданса изучены числа переноса по катиону Li+, температурная зависимость проводимости от состава и рассчитаны эффективные энергии активации проводимости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Компоненты полимерных электролитов
Диакрилат полиэтиленгликоля ДАк-ПЭГ (Aldrich), Mn = 575
Жидкий электролит 1 М LiBF4 в гамма-бутиролактоне (ГБЛ) (производства ЗАО “Экотех”, Россия), содержание воды 0.008 мас. %. Наночастицы SiO2 марки Аэросил 380 (поверхность 380 м2/г, средний размер частиц 7 нм) имели гидрофильную пористую поверхность, pH (в 4%-ной водной дисперсии) = 3.6–4.3. Перекись бензоила (ПБ) (Aldrich) очищали перекристаллизацией из хлороформа с последующей осушкой при комнатной температуре сначала на воздухе, потом в вакууме.
Синтез образцов полимерного электролита. Навески олигомера ДАк-ПЭГ из расчета 15 мас. %, жидкого электролита и перекиси бензоила (1 мас. %) перемешивали на магнитной мешалке в течение 30–60 мин при 50°С до полного растворения кристаллов ПБ. Затем добавляли нанопорошок SiO2 (от 2 до 10 мас. %) и перемешивали в течение 1 ч. Подготовленную нанокомпозитную смесь помещали между двух стекол размером 90 × 115 мм, обработанных антиадгезивным раствором. Методика подготовки стеклянного реактора для синтеза полимерного электролита описана в работе [32]. Отверждение смеси проводили по выбранному в работе [27] ступенчатому режиму: 60°С – 3 ч, 70°С – 1 ч, 80°С – 1 ч, 120°С – 1 ч. При этом получались прозрачные пленки толщиной 0.1–0.2 мм.
Для измерения проводимости пленок электролита методом электрохимического импеданса использовали симметричные ячейки с блокирующими электродами из нержавеющей стали (НС) площадью 0.2 см2. Импеданс ячеек измеряли с помощью импедансметра Z-2000 фирмы Electrochemical Instruments – Elins (Россия) (интервал частот 1–2 × 106 Гц) с амплитудой сигнала 10 мВ. Изучение зависимости проводимости полимерных электролитов от температуры в интервале от –40 до 100°C проводили с помощью криотермостата ТЖ-ТС-01 (Россия), при –70°C использовали низкотемператрную баню с хладоагентом этанол/вода/жидкий азот. Образцы перед измерением выдерживали при каждой температуре не менее 1 ч.
Для измерения чисел переноса по ионам Li+ использовали метод хроноамперометрии в ячейках Li/электролит/Li. Ячейки пуговичного типа С2032 собирали в аргоновом боксе MBraun, в качестве электродов использовали кружки из фольги из металлического лития диаметром 16 мм, между которыми помещали пленку полимерного электролита такого же размера. Предварительно ячейки выдерживали при комнатной температуре в течение 1 мес. для образования твердоэлектролитного слоя аналогично работе [33]. Затем ячейки поляризовали при напряжении (ΔV) 10 мВ в течение 1 ч на приборе P-2X фирмы Elins (Россия). Измеряли первоначальный ток (I0) и ток равновесного (устойчивого) состояния (ISS). Импеданс ячеек до и после поляризации измеряли в интервале частот 1–2 × 106 Гц с амплитудой сигнала 10 мВ на приборе, указанным выше. Из годографов импеданса рассчитывали сопротивление на границе электрод/электролит до поляризации (R0) и после (RSS). Числа переноса по ионам Li+ (t+) рассчитывали по уравнению (1):
(1)
${{t}_{ + }} = \frac{{{{I}_{{SS}}}(\Delta V - {{I}_{0}}{{R}_{0}})}}{{{{I}_{0}}(\Delta V - {{I}_{{SS}}}{{R}_{{SS}}})}}.$Коэффициенты самодиффузии (КСД) на ядрах 7Li были определены методом ЯМР с импульсным градиентом магнитного поля (ЯМР с ИГМП) [34] на ЯМР спектрометре AVANCE III 400 MHz, фирмы “Bruker”, снабженным диффузионной системой Diff60, с рабочей частотой 156 МГц (7Li). Использовали импульсную последовательность “стимулированное эхо” со следующими параметрами: линейный рост амплитуды градиента магнитного поля g с количеством ступеней 32. Параметры импульсной последовательности составляли: δ = 1 мс, Δ = 20–30 мс, gmax = 1200–1500 Гс/см, длительность 7Li π/2-импульса 5 мкс, время повторения между прохождениями импульсной последовательности 3 с. Эксперименты проводили при температуре 24 ± 1°С. Пленки электролитов нарезали прямоугольными пластинками длиной 3–5 см и помещали в стандартные ЯМР-ампулы с внешним диаметром 5 мм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате синтеза образцов были получены 6 составов нанокомпозитных полимерных электролитов с массовым содержанием компонентов, представленных в табл. 1. Мольное соотношение основных компонентов электролитов было одинаково: на 1 моль соли LiBF4 приходилось 0.3 моля ДАк-ПЭГ575 и 10.5 моля растворителя гамма-бутиролактона.
Таблица 1.
Составы синтезированных полимерных электролитов
| Номер состава НПЭ | Исходные компоненты НПЭ, мас. % | |||
|---|---|---|---|---|
| ДАк-ПЭГ575 | 1 М LiBF4 в ГБЛ | SiO2 | ПБ | |
| 1 | 15 | 84 | 0 | 1 |
| 2 | 15 | 82 | 2 | 1 |
| 3 | 15 | 80 | 4 | 1 |
| 4 | 15 | 78 | 6 | 1 |
| 5 | 15 | 76 | 8 | 1 |
| 6 | 15 | 74 | 10 | 1 |
На первом этапе работы была исследована проводимость в широком интервале температур от –70 до 100°С.
На рис. 1а приведены типичные годографы импеданса ячеек НС/НПЭ/НС на примере состава электролита № 3. Они имеют вид прямых с углом наклона 75°–80° и описываются эквивалентной схемой (рис. 1а), где Re – сопротивление электролита, а элемент постоянного угла сдвига фаз (CPE) относится к емкости двойного электрического слоя.
Рис. 1.
(а) Годографы импеданса ячейки НС/НПЭ № 3/НС при –70, 20 и 100°С и эквивалентная схема, где Re – сопротивление электролита, СРЕ – элемент постоянного угла сдвига фаз; (б) вид аррениусовской зависимости проводимости для НПЭ № 3.
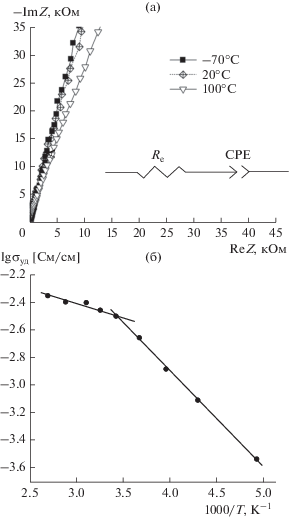
На температурных зависимостях проводимости в координатах Аррениуса для всех ячеек наблюдался излом при температуре 20°С. На рис. 1б приведен типичный вид аррениусовской зависимости на примере НПЭ № 3 с 4 мас. % SiO2. В связи с этим эффективные энергии активации были рассчитаны в двух температурных интервалах: от –70 до 20°С и от 20 до 100°С. Результаты приведены в табл. 2. Также в двух температурных интервалах приведен вид зависимости логарифма проводимости от количества добавки наночастиц SiO2: для температур от 35 до 100°С (рис. 2а), для температур от 20 до –70°С (рис. 2б).
Таблица 2.
Параметры ионного транспорта для разных составов НПЭ: проводимость (σуд) при 20°С, эффективные энергии активации проводимости ($E_{{\text{a}}}^{{{\text{э ф }}}}$(σуд)), коэффициенты самодиффузии лития (Ds) и числа переноса по катионам лития (t+)
| Номер состава | [SiO2], мас. % | t+ | Ds, 10–10 м2/c (24°C) | σуд, мСм/см (20°C) | $E_{{\text{a}}}^{{{\text{э ф }}}}$(σуд), кДж/моль | |
|---|---|---|---|---|---|---|
| –70…20°С | 20…100°С | |||||
| 1 | 0 | 0.44 | 1.10 | 3.24 | 7.8 ± 0.96 | 6.69 ± 1.72 |
| 2 | 2 | 0.49 | 1.20 | 3.76 | 7.8 ± 1.72 | 6.3 ± 1.15 |
| 3 | 4 | 0.34 | 0.83 | 3.35 | 13.19 ± 0.21 | 3.63 ± 0.59 |
| 4 | 6 | 0.32 | 0.76 | 4.52 | 6.50 ± 1.83 | 4.59 ± 0.69 |
| 5 | 8 | 0.29 | 0.73 | 2.61 | 20.45 ± 2.29 | 8.03 ± 0.96 |
| 6 | 10 | – | 0.61 | 2.34 | 14.72 ± 1.72 | 10.70 ± 2.48 |
Из рис. 2 видно, что проводимость данной многокомпонентной системы сильно зависит от количества введенного нанопорошка SiO2. При его минимальном содержании (2 мас. % SiO2) наблюдается максимум проводимости при всех температурах даже при –70°С (∼10–3 См/см). Таким образом, ускорение ионного транспорта в НПЭ № 2 мало зависит от температуры и носит общий характер для всех составов НПЭ.
Из табл. 2 видно, что значения эффективной энергии активации для НПЭ № 2 для обоих температурных диапазонов близки друг к другу и находятся в интервале 6.3–7.8 кДж/моль. Похожие значения у $E_{{\text{a}}}^{{{\text{э ф }}}}$(σуд) для исходного состава без наночастиц (№ 1), а самые низкие у НПЭ № 4 – 4.6–6.5 кДж/моль. Таким образом, состав с 6 мас. % SiO2 также выделяется среди остальных, и можно предполагать, что в нем также происходит улучшение ионного транспорта в системе, но уже по другому механизму.
В статье [24] для нанокомпозитной системы на основе полиметилметакрилата, соли NaClO4, этиленкарбоната, пропиленкарбоната найдено, что энергия активации состава с лучшей проводимостью (2.7 мСм/см при 20°С) при введении 10 мас. % SiO2 составляет 0.24 эВ, что в пересчете равно 23 кДж/моль. Это намного выше $E_{{\text{a}}}^{{{\text{э ф }}}},$ приведенной в табл. 2. Такое же значение $E_{{\text{a}}}^{{{\text{э ф }}}}$ было получено в гель-электролитной системе на основе сверхразветвленного полимера и 1 М LiClO4 в пропиленкарбонате [35]. Для гель-электролита состава 1 М LiClO4 в полиэфирдиакрилате–этиленкарбонате (1 : 1 моль) [36] значения эффективной энергии активации составили 34 кДж/моль (в диапазоне температур 20–50°С) и 15 кДж/моль (60–90°С), что в среднем имеет такое же значение. Только для сетчатого полимерного электролита на основе ДАк-ПЭГ (который используется в данной работе) и ионной жидкости тетрафторборат 1-этил-3-метилимидазолия были получены $E_{{\text{a}}}^{{{\text{э ф }}}}$(σуд) 4 кДж/моль [37].
Для понимания различий в механизмах ионного транспорта в нанокомпозитной электролитной системе был использован метод ЯМР с ИГМП. С целью определения влияния наночастиц SiO2 на подвижность катионов лития в НПЭ были определены коэффициенты самодиффузии ионов Li+ (Ds) для составов с различным содержанием SiO2.
Для определения КСД была использована стандартная импульсная последовательность “стимулированное эхо”, состоящая из π/2 радиочастотного импульса, двух одинаковых импульсов градиента магнитного поля, имеющих полусинусоидальную форму, разделенных двумя радиочастотными π/2 импульсами, идентичными первому радиочастотному импульсу (рис. 3).
Рис. 3.
Импульсная последовательность – стимулированное эхо: δ – длительность импульсного градиента магнитного поля, g – амплитуда импульсного градиента магнитного поля, τ и τ1 – расстояния между радиочастотными импульсами, Δ – расстояние между импульсами градиента магнитного поля.

После последнего радиочастотного импульса формируется сигнал спинового эхо. Результатом эксперимента является диффузионное затухание – зависимость интенсивности сигнала от g2. Затухание сигнала спинового эхо связано с коэффициентом самодиффузии Ds и параметрами импульсной последовательности, и для модели броуновской изотропной диффузии определяется выражением
(2)
$A = {{A}_{0}}\exp \left[ { - {{\gamma }^{2}}{{g}^{2}}\left( {\Delta - \frac{\delta }{3}} \right){{D}_{{\text{s}}}}} \right],$В ходе эксперимента ЯМР с ИГМП варьировалась амплитуда g от 37.5 до 1500 Гс/см, что позволяло анализировать сигналы диффузионного затухания в пределах двух порядков, при этом остальные параметры импульсной последовательности были фиксированы. Все полученные диффузионные затухания (рис. 4) носили экспоненциальный характер и аппроксимировались экспонентой (3) [38]:
(3)
$A(g) = \exp \left( { - {{\gamma }^{2}}{{g}^{2}}{{\delta }^{2}}{{t}_{{\text{d}}}}{{D}_{{\text{s}}}}} \right),$Рис. 4.
Зависимости амплитуд сигналов спинового эхо ядер 7Li от квадрата амплитуды импульсов градиента магнитного поля (диффузионные затухания). Цифры на графике обозначают номера составов электролитов (табл. 1).
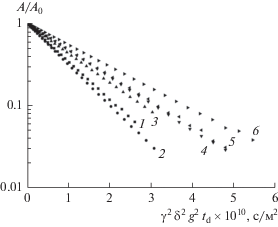
Рассчитанные из диффузионного затухания КСД – Ds представлены в табл. 2.
Из полученных значений КСД наблюдается максимум трансляционной подвижности ионов лития при содержании наночастиц SiO2 – 2% (рис. 5). На рис. 5 также приведена зависимость ионной проводимости от содержания наночастиц SiO2 при комнатной температуре, которая была получена путем измерения аналогичных образцов пленок НПЭ методом электрохимического импеданса в симметричных ячейках НС/НПЭ/НС.
Рис. 5.
Зависимость удельной ионной проводимости (σуд) (квадратики) и КСД (Ds) на ядрах 7Li (звездочки) от содержания частиц SiO2 в электролите.

Из рис. 5 видно, что пик при 2 мас. % SiO2 наблюдается как для зависимости ионной проводимости, так и для зависимости КСД на ядрах 7Li от содержания SiO2. Появление данного пика может быть вызвано ионной диссоциацией соли LiBF4, так как метод ЯМР с ИГМП фиксирует именно высокую подвижность ионов лития, что может быть вызвано увеличением количества свободных ионов Li+. Второй максимум при 6% SiO2 методом ЯМР с ИГМП не виден и может быть обусловлен формированием высокопроводящих путей на границе раздела фаз между частицами SiO2 и полимерного гель-электролита. Во втором случае количество заряженных частиц, вносящих вклад в проводимость, максимально, несмотря на то, что они имеют низкую КСД. Создание большого количества благоприятных путей для ионного транспорта также подтверждается самой минимальной эффективной энергией активации проводимости 4.6–6.5 кДж/моль у состава с 6 мас. % SiO2 (см. табл. 2).
В данной работе были измерены значения чисел переноса по ионам лития для всех составов НПЭ. На рис. 6 представлены типичные графики, по которым были рассчитаны параметры для уравнения (1), на примере НПЭ состава № 3 с 4 мас. % SiO2.
Рис. 6.
Графики, по которым были рассчитаны числа переноса t+, где (а) годограф импеданса ячейки Li/НПЭ № 3/Li: 1 – до пропускания электрического тока, 2 – после пропускания; (б) хроноамперограмма ячейки Li/НПЭ №3/Li.

Годографы импеданса были проанализированы с помощью эквивалентной схемы, представленной на рис. 7. Сопротивление на границе электрод/электролит до поляризации (R0) и после (RSS) рассчитывали как сумму R2 + R3, как в работе [39]. При использовании более упрощенной эквивалентной схемы, состоящей из R1, R2, CPE1, результаты не являются верными, так как при поляризации происходит изменение сопротивления на границе электрод/электролит и R2 не равно R3.
Рис. 7.
Эквивалентная схема ячейки, где R1 – сопротивление электролита, R2 – сопротивление первой границы электрод/электролит, R3 – сопротивление второй границы электрод/электролит, СРЕ1 и СРЕ2 – элементы постоянного угла сдвига фаз.

Результаты расчета чисел переноса t+ по уравнению (1) представлены в табл. 2. Из табл. 2 видно, что самое высокое значение чисел переноса катиона (0.49) у электролита с 2 мас. % SiO2, что может быть вызвано высокой диссоциацией соли и возникновением большого количества подвижных катионов лития. Дальнейшее добавление нанопорошка мешает ионному транспорту, и значение чисел переноса по катионам лития понижается, что влечет за собой снижение общей проводимости. В дальнейшем на первый план выходит другой механизм проводимости, а именно по поверхности наночастиц оксида кремния. Данный механизм максимально реализуется при 6 мас. % SiO2. При большей концентрации наночастицы начинают конгломерировать, и проводимость опять уменьшается.
Наглядно два вероятных механизма проводимости, реализуемых в нанокомпозитном электролите, можно представить на рис. 8. Для моделирования отдельных элементов схем были использованы квантовохимические расчеты, выполненные в работе [28], которая посвящена установлению природы двух максимумов проводимости с точки зрения состояния растворителя по данным дифференциальной сканирующей калориметрии. Результаты работы [28] согласуются с данными, полученными в этой работе.
Рис. 8.
Схема механизмов ионного транспорта в нанокомпозитном полимерном электролите, где (а) процесс ионной диссоциации соли LiBF4 с участием поверхностных групп SiO2; (б) ионный транспорт вдоль поверхности наночастиц. Сольватная оболочка ионов и ионных пар обозначена пунктирным овалом.
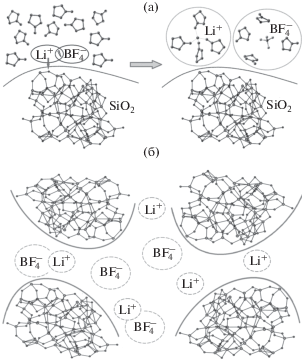
На рис. 8а представлена схема механизма ионного транспорта в нанокомпозитном полимерном электролите, который доминирует в первом максимуме проводимости (состав НПЭ с 2 мас. % SiO2), где происходит процесс ионной диссоциации соли LiBF4 с участием поверхностных групп наночастиц SiO2. На рис. 8б (во втором максимуме проводимости при 6 мас. % SiO2) ионный транспорт преимущественно реализуется вдоль поверхности наночастиц.
ЗАКЛЮЧЕНИЕ
Таким образом, были исследованы особенности ионного транспорта в новых нанокомпозитных электролитах на основе сетчатых полимеров и наночастиц оксида кремния. В качестве полимерной матрицы использовали сшитый по методу радикальной полимеризации диакрилат полиэтиленгликоля, в качестве жидкого электролита – 1 М LiBF4 в гамма-бутиролактоне. По мере наполнения сетчатого гель-электролита нанопорошком происходит “переключение” механизма ионного транспорта по типу “полимер в керамике”, “керамика в полимере”.
Методом ЯМР с ИГМП найдено, что самые высокие коэффициенты самодиффузии на ядрах 7Li (1.2 × 10–10 м2/c) у состава электролита с 2 мас. % SiO2. У данной системы также самые высокие показатели по числам переноса по катионам лития – 0.49. Этот факт свидетельствует о повышении числа подвижных носителей заряда, к которому может привести ионная диссоциация соли. Второй максимум на зависимости проводимости от содержания нанопорошка при 6 мас. % может быть вызван классическим вкладом упаковки наночастиц с созданием большого количества благоприятных путей для ионного транспорта.
Использование нанокомпозитных полимерных электролитов данного типа позволяет получить высокую проводимость до 1 мСм/см при сверхнизких температурах до –70°С, что делает их перспективными для использования в реальных источниках тока для условий крайнего севера и космических приложений.
Список литературы
Agrawal, R.C. and Pandey, G.P., Solid polymer electrolytes: materials designing and all-solid-state battery applications: an overview, J. Phys. D: Appl. Phys., 2008, vol. 41, p. 223001.
Keller, M., Varzi, A., and Passerini, S., Hybrid electrolytes for lithium metal batteries, J. Power Sources, 2018, vol. 392, p. 206.
Ярмоленко, О.В., Юдина, А.В., Хатмуллина, К.Г. Нанокомпозитные полимерные электролиты для литиевых источников тока (обзор). Электрохимия. 2018. Т. 54. С. 377. [Yarmolenko, O.V., Yudina, A.V., and Khatmullina, K.G., Nanocomposite polymer electrolytes for lithium power sources (review), Russ. J. Electrochem., 2018, vol. 54, p. 325.]
Capiglia, C., Mustarelli, P., Quartarone, E., Tomasi, C., and Magistris, A., Effects of nanoscale SiO2 on the thermal and transport properties of solvent-free, poly(ethylene oxide) (PEO)-based polymer electrolytes, Solid State Ionics, 1999, vol. 118, p. 73.
Mustarelli, P., Capiglia, C., Quartarone, E., Tomasi, C., Ferloni, P., and Linati, L., Cation dynamics and relaxation in nanoscale polymer electrolytes: a 7Li NMR study, Phys. Rev. B, 1999, vol. 60, p. 7228.
Croce, F., Persi, L., Scrosati, B., Serraino-Fiory, F., Plichta, E., and Hendrickson, M.A., Role of the ceramic fillers in enhancing the transport properties of composite polymer electrolytes, Electrochim. Acta, 2001, vol. 46, p. 2457.
Jayathilaka, P.A.R.D., Dissanayake, M.A.K.L., Albinsson, I., and Mellander, B.E., Effect of nano-porous Al2O3 on thermal, dielectric and transport properties of the (PEO)9LiTFSI polymer electrolyte system, Electrochim. Acta, 2002, vol. 47, p. 3257.
Chung, S.H., Wang, Y., Greenbaum, S.G., Marcinek, M., Persi, L., Croce, F., Wieczorek, W., and Scrosati, B., Nuclear magnetic resonance studies of nanocomposite polymer electrolytes, J. Phys.: Condens. Matter., 2001, vol. 13, p. 11763.
Croce, F., Appetecchi, G.B., Persi, L., and Scrosati, B., Nanocomposite polymer electrolytes for lithium batteries, Nature, 1998, vol. 394, p. 456.
Kim, Y.W., Lee, W., and Choi, B.K., Relation between glass transition and melting of PEO salt complexes, Electrochim. Acta, 2000, vol. 45, p. 1473.
Best, A.S., Adebahr, J., Jacobsson, P., MacFarlane, D.R., and Forsyth, M., Microscopic interactions in nanocomposite electrolytes, Macromolecules, 2001, vol. 34, p. 4549.
Tambelli, C.C., Bloise, A.C., Rosário, A.V., Pereira, E.C., Magon C.J., and Donoso, J.P., Characterisation of PEO-Al2O3 composite polymer electrolyte, Electrochim. Acta, 2002, vol. 47, p. 1677.
Binesh, N. and Bhat, S.V., Effects of a plasticiser on protonic conductivity of polymer electrolyte (PEG)100NH4ClO4, Solid State Ionics, 1999, vol. 122, p. 291.
Indris, S., Heitjans, P., Roman, H.E., and Bunde, A., Nanocrystalline versus microcrystalline Li2O:B2O3 composites: anomalous ionic conductivities and percolation theory, Phys. Rev. Lett., 2000, vol. 84, p. 2889.
Bunde, A. and Dieterich, W., Percolation in composites, J. Electroceramics, 2000, vol. 5, p. 81.
Indris, S., Heitjans, P., Ulrich, M., and Bunde, A., AC and DC conductivity in nano- and microcrystalline Li2O:B2O3 composites: experimental results and theoretical models, Z. Phys. Chem., 2005, vol. 219, p. 89.
Chilaka, N. and Ghosh, S., Solid-state poly(ethylene glycol)-polyurethane/ polymethylmethacrylate/ rutile TiO2 nanofiber composite electrolyte-correlation between morphology and conducting properties, Electrochim. Acta, 2012, vol. 62, p. 362.
Johan, M.R., Yasin, S.M., Ibrahim, M., and Bayesian, S., Neural networks model for ionic conductivity of nanocomposite solid polymer electrolyte system (PEO–LiCF3SO3–DBP–ZrO2), Int. J. Electrochem. Sci., 2012, vol. 7, p. 222.
Nimah, Y.L., Ming-Yao Cheng, M.Y., Cheng, J.H., Rick, J., and Hwang, B.-H., Solid-state polymer nanocomposite electrolyte of TiO2/PEO/NaClO4 for sodium ion batteries, J. Power Sources, 2015, vol. 278, p. 375.
Kim, S. and Park, S.-J., Preparation and ion-conducting behaviors of poly(ethylene oxide)-composite electrolytes containing lithium montmorillonite, Solid State Ionics, 2007, vol. 178, p. 973.
Zhou, R., Liu, W., Yao, X., Leong, Y.W., and Lu, X., Poly(vinylidene fluoride) nanofibrous mats with covalently attached SiO2 nanoparticles as an ionic liquid host: enhanced ion transport for electrochromic devices and lithium-ion batteries, J. Mater. Chem. A, 2015, vol. 3, p. 16040.
Boor, S., Rajiv, K., and Sekhon, S.S., Conductivity and Viscosity behavior of PMMA based gels and nano dispersed gels: Role of dielectric constant of solvent, Solid State Ionics, 2005, vol. 176, p. 1577.
Kumar, D. and Suleman, M, Hashmi, S.A., Studies on poly(vinylidene fluoride-co-hexafluoropropylene) based gel electrolyte nanocomposites for sodium-sulfur batteries, Solid State Ionics, 2011, vol. 202, p. 43.
Kumar, D. and Hashmi, S.A., Ion transport and ion-filler-polymer interaction in poly(methylmethacrylate)-based, sodium ion conducting, gel polymer electrolyte dispersed with silica nano-particles, J. Power Sources, 2010, vol. 195, p. 5101.
Ramesh, S. and Wen, L.C., Investigation on the effects of addition of SiO2 nanoparticles on ionic conductivity, FTIR, and thermal properties of nano-composite PMMA–LiCF3SO3–SiO2, Ionics, 2010, vol. 16, p. 255.
Lee, Y.-S., Shin, W.-K., Kim, J.S., and Kim, D.-W., High performance composite polymer electrolytes for lithium-ion polymer cells composed of a graphite negative electrode and LiFePO4 positive electrode, RSC Adv., 2015, vol. 5, p. 18359.
Юдина, А.В., Березин, М.П., Баймуратова, Г.Р., Шувалова, Н.И., Ярмоленко, О.В. Особенности синтеза и физико-химические свойства нанокомпозитных полимерных электролитов на основе диакрилата полиэтиленгликоля с введением SiO2. Изв. АН, cер. хим. 2017. Т. 66. С. 1278. [Yudina, A.V., Berezin, M.P., Baymuratova, G.R., Shuvalova, N.I., and Yarmolenko, O.V., Specific features of the synthesis and the physicochemical properties of nanocomposite polymer electrolytes based on poly(ethylene glycol) diacrylate with the introduction of SiO2, Russ. Chem. Bulletin, Int. Ed., 2017, vol. 66, p. 1278.]
Yarmolenko, O.V., Khatmullina, K.G., Baimuratova, G.R., Tulibaeva, G.Z., Bogdanova, L.M., and Shestakov, A.F., On the nature of the double maximum conductivity of nanocomposite polymer electrolytes for lithium power sources, Mendeleev Comm., 2018, vol. 28, p. 41.
Баймуратова, Г.Р., Слесаренко, А.А., Юдина, А.В., Ярмоленко, О.В. Проводящие свойства нанокомпозитных полимерных электролитов на основе диакрилата полиэтиленгликоля и наночастиц SiO2 на границе с литиевым электродом. Изв. АН, сер. хим. 2018. Т. 67. № 9. С. 1648. [Baymuratova, G.R., Slesarenko, A.A., Yudina, A.V., and Yarmolenko, O.V., Conducting properties of nanocomposite polymer electrolytes based on polyethylene glycol diacrylate and SiO2 at the interface with a lithium electrode, Russ. Chem.l Bull., Int. Ed., 2018, vol. 67, no. 9, p. -.]
Ярмоленко, О.В., Хатмуллина, К.Г., Богданова, Л.М., Шувалова, Н.И., Джавадян, Э.А., Маринин, А.А., Волков, В.И. Влияние добавки наночастиц TiO2 на проводимость сетчатых полимерных электролитов для литиевых источников тока. Электрохимия. 2014. Т. 50. С. 377. [Yarmolenko, O.V., Khatmullina, K.G., Bogdanova, L.M., Shuvalova, N.I., Dzhavadyan, E.A., Marinin, A.A., and Volkov, V.I., Effect of TiO2 nanoparticle additions on the conductivity of network polymer electrolytes for lithium power sources, Russ. J. Electrochem., 2014, vol. 50, p. 336.]
Ярмоленко, О.В., Юдина, А.В., Маринин, А.А., Черняк, А.В, Волков, В.И., Шувалова, Н.И., Шестаков, А.Ф. Нанокомпозитные сетчатые полимерные гель-электролиты. Влияние наночастиц TiO2 и Li2TiO3 на структуру и свойства. Электрохимия. 2015. Т. 51. С. 479. [Yarmolenko, O.V., Yudina, A.V., Marinin, A.A., Chernyak, A.V., Volkov, V.I., Shuvalova, N.I., and Shestakov, A.F., Nanocomposite network polymer gel-electrolytes: TiO2- and Li2TiO3-nanoparticle effects on their structure and properties, Russ. J. Electrochem., 2015, vol. 51, p. 412.]
Черняк, А.В., Березин, М.П., Слесаренко, Н.А., Забродин, В.А., Волков, В.И., Юдина, А.В., Шувалова, Н.И., Ярмоленко, О.В. Влияние структуры сетчатого полимерного гель-электролита на ионную и молекулярную подвижность электролитной системы соль LiBF4 – ионная жидкость 1-этил-3-метилимидазолий тетрафторборат. Изв. АН, cер. хим. 2016. Т. 65. С. 2053. [Chernyak, A.V., Berezin, M.P., Slesarenko, N.A., Zabrodin, V.A., Volkov, V.I., Yudina, A.V., Shuvalova, N.I., and Yarmolenko, O.V., Influence of the reticular polymeric gel-electrolyte structure on ionic and molecular mobility of an electrolyte system salt-ionic liquid: LiBF4-1-ethyl-3-methylimidazolium tetrafluoroborate, Russ. Chem.l Bull., Int. Ed., 2016, vol. 65, p. 2053.]
Evans, J., Vincent, C.A., and Bruce, P.G., Electrochemical measurement of transference numbers in polymer electrolytes, Polymer, 1987, vol. 28, p. 2324.
Волков, В.И., Маринин, А.А. Применение метода ЯМР для исследования ионного и молекулярного транспорта в полимерных электролитах. Успехи химии. 2013. Т. 83. С. 248. [Volkov, V.I. and Marinin, A.A., NMR methods for studying ion and molecular transport in polymer electrolytes, Russ. Chem. Rev., 2013, vol. 82, p. 248.]
Ярмоленко, О.В., Хатмуллина, К.Г., Курмаз, С.В., Батурина, А.А., Бубнова, М.Л., Шувалова, Н.И., Грачев, В.П., Ефимов, О.Н. Новые литийпроводящие гель-электролиты, содержащие сверхразветвленный полимер. Электрохимия. 2013. Т. 49. № 3. С. 281. [Yarmolenko, O.V., Khatmullina, K.G., Kurmaz, S.V., Baturina, A.A., Bubnova, M.L., Shuvalova, N.I., Grachev, V.P., and Efimov, O.N., New lithium-conducting gel electrolytes containing superbranched polymers Rus. J. Electrochem. (Int. Ed.), 2013, vol. 49, p. 252.]
Ярмоленко, О.В., Хатмуллина, К.Г., Тулибаева, Г.З., Богданова, Л.М., Шестаков, А.Ф. Полимерные электролиты на основе полиэфирдиакрилата, этиленкарбоната и LiClO4: взаимосвязь проводимости и структуры полимера по данным ИК-спектроскопии и квантово-химического моделирования. Известия АН. Сер. хим. 2012. Т. 61. № 3. С. 538. [Yarmolenko, O.V., Khatmullina, K.G., Tulibaeva, G.Z., Bogdanova, L.M., and Shestakov, A.F, Polymer electrolytes based on poly(ester diacrylate), ethylene carbonate, and LiClO4: a relationship of the conductivity and structure of the polymer according to IR spectroscopy and quantum chemical modeling data, Rus. Chem. Bull., 2012, vol. 61, p. 539.
Ярмоленко, О.В., Юдина, А.В., Игнатова, А.А., Шувалова, Н.И., Мартыненко, В.М., Богданова, Л.М., Черняк, А.В., Забродин, В.А., Волков, В.И. Новые полимерные электролиты состава диакрилат полиэтиленгликоля–LiBF4–тетрафторборат 1-этил-3-метилимидазолия с введением алкиленкарбонатов. Известия АН. Сер. хим. 2015. Т. 64. № 10. С. 2505. [Yarmolenko, O.V., Yudina, A.V., Ignatova, A.A., Shuvalova, N.I., Martynenko, V.M., Bogdanova, L.M., Chernyak, A.V., Zabrodin, V.A., and Volkov, V.I., New polymer electrolytes based on polyethylene glycol diacrylate–LiBF4–1-ethyl-3-methylimidazolium tetrafluoroborate with the introduction of alkylene carbonates, Russ. Chem. Bull. (Int. Ed.), 2015, vol. 64, p. 2505].
Маклаков, А.И., Скирда, В.Д., Фаткуллин, Н.Ф. Самодиффузия в растворах и расплавах полимеров. Казань: Изд-во Казан. ун-та. 1987. 225 с.
Zugmann, S., Fleischmann, M., Amereller, M. Gschwind, R.M., Wiemhöfer, H.D., and Gores, H.J., Measurements of transference numbers for lithium ion electrolytes via four different methods, a comparative study, Electrochim. Acta, 2011, vol. 56, p. 3926.
Дополнительные материалы отсутствуют.




