Электрохимия, 2019, T. 55, № 6, стр. 711-717
Влияние температуры и влагосодержания на свойства твердого протонного электролита тетракаликсарен сульфокислоты – исследование методом ЯМР
А. В. Черняк a, b, *, Н. А. Слесаренко a, **
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, просп. академика Семенова, 1, Россия
b Научный центр РАН
142432 Московская обл., Черноголовка, ул. Лесная, 9, Россия
* E-mail: sasha_cherniak@mail.ru
** E-mail: wownik007@mail.ru
Поступила в редакцию 09.08.2018
После доработки 07.12.2018
Принята к публикации 22.01.2019
Аннотация
Методом 1Н ЯМР и ЯМР с импульсным градиентом магнитного поля исследован протонный твердый электролит – каликс[4]арен-пара-сульфокислота в интервале температур от –15 до 24°С и влагосодержания λ от 1.6 до 5.7 молекул H2O на SO3H. Анализ интенсивности сигнала в 1Н ЯМР спектрах показал, что во всем исследуемом диапазоне температур и влагосодержания не образуется фаза льда. Из температурных зависимостей величин химического сдвига рассчитаны числа гидратации комплексов H+(H2O)h. Методом ЯМР с импульсным градиентом магнитного поля определены коэффициенты самодиффузии. Из температурных зависимостей коэффициентов самодиффузии рассчитаны энергии активации Еакт. Показано хорошее согласие данных по Еакт диффузии и протонной проводимости. На основании следствия из уравнения Нернста–Эйнштейна рассчитаны значения протонной проводимости из данных по самодиффузии. В интервале влагосодержания λ от 1.6 до 5.7 рассчитанные значения протонной проводимости согласуются с полученными экспериментально.
ВВЕДЕНИЕ
Развитие альтернативной энергетики вызывает интерес к исследованию электролитов, обладающих высокой протонной проводимостью. Протонные твердые электролиты интересны как с практической точки зрения, так и для понимания фундаментальных основ ионного транспорта в твердых телах. С практической точки зрения, они широко используются в таких электрохимических устройствах, как топливный элемент, водородный сенсор, суперконденсатор. Относительно недавно было показано, что каликс(n)арен сульфокислоты обладают высокой протонной проводимостью [1–5], которая реализуется за счет разветвленной сетки водородных связей, образованных молекулами воды и протонами сульфогруппы. С увеличением влагосодержания в таких структурах наблюдается увеличение протонной проводимости вплоть до 0.1 См/см. Отличительной особенностью подобных водорастворимых каликсаренов и их супрамолекулярных комплексов является образование 2D слоистых планарных структур [6–10]. Выделяют органический и неорганический слои. Первый состоит из бислоев, образованных анионной частью молекулы каликсарена, а второй содержит молекулы воды и катионы.
Благодаря меньшей внутренней полости и сильным водородным связям каликс[4]арен-пара-сульфокислота обладает стабильной конформацией “конус”, которая и способствует образованию бислойных структур, по сравнению с каликс[n]арен-пара-сульфокислотами (n = 6, 8).
Создание высокоэффективных материалов требует детального исследования механизма ионного и молекулярного транспорта, который во многом определяется структурой и подвижностью гидратированных комплексов H+(H2O)h, где h – число гидратации (количество молекул воды в первой гидратной оболочке катиона H+). Вследствие этого возникает необходимость в изучении состояния и подвижности воды и гидратированных ионов в каликс[4]арен-пара-сульфокислоте.
Одним из основных методов получения информации о процессах гидратации в электролитах является метод ЯМР. В частности, анализ зависимости протонных химических сдвигов от влагосодержания и температуры позволяет рассчитать числа гидратации катионов.
Целью данного исследования было определить числа гидратации h и коэффициенты диффузии гидратированных комплексов H+(H2O)h в каликс[4]арен-пара-сульфокислоте при различных влагосодержаниях и температурах методом ЯМР.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и их подготовка
Строение исследуемой каликс[4]арен-пара-сульфокислоты (КСК4) представлено на рис. 1. КСК4 синтезирована и предоставлена лабораторией “Ионики твердого тела” Института проблем химической физики РАН. Синтез осуществляли согласно методике [11, 12].
КСК4 сушили в эксикаторе над P2O5 (относительная влажность RH = 0%) до установления постоянной массы. Затем, для получения образцов с заданным влагосодержанием их помещали в эксикаторы с водными растворами соответствующих солей, отличающихся давлением насыщенных паров. Образцы выдерживались в эксикаторах в течение нескольких недель до достижения постоянной массы. КСК4 выдерживали в интервале относительных влажностей RH 10–78 отн. %. Во всем этом диапазоне влагосодержания КСК4 представляла собой белый сыпучий порошок. Весовым методом определяли количество абсорбированных молекул воды на SO3H-группу – λа.
Остаточное количество воды в образце λ0 (число молекул воды на сульфогруппу при RH = 0%), определенное методом ДСК [5], составляет 1 молекула H2O на SO3H-группу. Таким образом, было рассчитано общее число молекул H2O/SO3H – λ КСК4 в интервале относительных влажностей RH 10–78 отн. % (табл. 1). Полученные результаты хорошо согласуются с литературными данными [5].
ЯМР эксперименты
Все 1Н ЯМР спектры и диффузионные измерения исследуемых твердых порошков проводили на твердотельном спектрометре AVANCE III 400 MHz (“Bruker”) с широкой трубой, оснащенном диффузионным датчиком (diff 60 с максимальным градиентом магнитного поля 30 Т/м). Для калибровки шкалы химического сдвига перед контрольными измерениями устанавливали величину тока в field-катушке такую, чтобы сигнал Н2O в спектре 1Н был равен 4.3 м.д. Измерение коэффициентов самодиффузии (КСД) на ядрах 1Н осуществляли методом ЯМР с импульсным градиентом магнитного поля с использованием импульсной последовательности – “стимулированное эхо” (рис. 2). Методика определения КСД описана в [13–15]. Параметры импульсной последовательности: длительность 1H π/2 импульса 7.75 мкс, использовали линейный рост градиента магнитного поля с 32 ступенями, максимум градиента магнитного поля 20 Т/м, длительность градиентного импульса δ = 1–1.5 мс, время диффузии td 20 мс, время между циклами повторения последовательности d1 = 3 c. Математическую обработку полученных диффузионных затуханий проводили с помощью программ Topspin 2.1 и Dynamics Center 2.4.11 (фирмы “Bruker”). Температурные эксперименты по определению химического сдвига и коэффициентов самодиффузии проводили в интервале от –15 до 24°С ±1°С (для КСК4, выдержанной в интервале относительных влажностей RH 10–78 отн. %).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1H ЯМР спектроскопия
Во всем измеряемом диапазоне температур и влагосодержания 1H ЯМР спектры КСК4 представляют собой синглетную линию (рис. 3), химический сдвиг которой отражает суперпозицию атомов водорода в молекулах воды и гидратированных комплексах Н+(H2O)h. В течение мертвого времени (время от π/2 импульса до начала сбора данных de = 6.5 мкс) релаксация протонов ароматического кольца и мостиковой –CH2-группы практически полностью проходит, поэтому их сигналы в спектре ЯМР 1Н не проявляются. При понижении температуры за счет усиления водородных связей химический сдвиг смещается в область “слабых” полей. При повышении влагосодержания смещение сигнала происходит в область “сильных” полей, приближаясь к сигналу свободной воды (4.3 м.д.).
Рис. 3.
Спектры ЯМР 1H твердых образцов каликсаренов при разном влагосодержании (T = 24°C, на рис. указаны величины относительной влажности RH в %, интенсивности сигналов не нормированы и не подлежат сравнению).

Для корректного анализа процессов гидратации при температурах ниже 0°С проводили измерение интенсивности сигнала 1Н с целью отслеживания возможного образования фазы льда. Известно, что из-за малого времени релаксации Т2 (несколько микросекунд) атомов водорода во льду, сигнал 1Н ЯМР не регистрируется. В результате в 1Н ЯМР спектре регистрируются только сигналы “подвижных” протонов, исключая фазу льда. С этой целью был проведен анализ интенсивностей сигналов в 1Н ЯМР спектрах в интервале температур от –15 до 24°С. Интенсивность сигнала ЯМР А прямо пропорциональна мольному количеству “подвижных” протонов в исследуемом образце и обратно пропорциональна абсолютной температуре Т. Таким образом, зависимость АТ от Т, в отсутствие изменения количества “подвижных” протонов, будет представлять собой прямую, параллельную оси абсцисс (рис. 4). Для наглядности интенсивность A для образцов с разным влагосодержанием приведена как относительная в пересчете на количество молекул воды на сульфогруппу λ. Как можно видеть из рис. 3 во всем исследуемом интервале влагосодержания λ не наблюдается скачкообразного падения интенсивности и все точки ложатся на прямые, параллельные оси X. Это говорит о том, что вплоть до температуры –15°С вся входящая в КСК4 вода не замерзает во всем исследуемом диапазоне RH.
Гидратация катиона Н+(H2O)h
Информация о гидратации ионов получена из исследования температурной зависимости наблюдаемых протонных химических сдвигов КСК4. Обоснование, лежащее в основе определения числа гидратации, заключается в следующем: сигнал, наблюдаемый для раствора электролита, показывает средневзвешенную среду для молекул воды (молекула воды может существовать в нормальной водной решетке или в сфере гидратации иона) [16, 17].
В работе [18] было доказано, что в фазе ионита вода сильно отличается по своим физико-химическим свойствам от свободной воды. Для ионитов было показано, что взаимодействие противоионов с водой в смоле сходно с взаимодействием в растворе электролита. Зависимость величины химического сдвига (δ) от степени влажности λ обычно объясняется образованием различных комплексов типа H+(H2O)h. В случае быстрого, по сравнению с длительностью ЯМР эксперимента, обмена протонов между молекулами воды и комплексами наблюдаемый химический сдвиг δ есть усредненная величина между значениями химических сдвигов протонов в молекуле воды – δ1 и в комплексах H+(H2O)h – δ2.
где P1 и P2 – вероятности нахождения протонов в молекулах воды и комплексах соответственно. Так как для ионита характерны те же рассуждения, то число гидратации можно определить по формуле нахождения чисел гидратации h (количество молекул воды в первой гидратной оболочке) в растворе:(2)
$h = \lambda - \frac{{(0.5 + \lambda )({{d\delta } \mathord{\left/ {\vphantom {{d\delta } {dT}}} \right. \kern-0em} {dT}})}}{{{{d{{\delta }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{d{{\delta }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {dT}}} \right. \kern-0em} {dT}}}},$Для расчета чисел гидратации h были построены температурные зависимости химических сдвигов при различном влагосодержании λ (рис. 5). Из тангенса угла наклона прямых (коэффициенты b и ${{b}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$) h рассчитывается по формуле (2). Полученные результаты представлены в табл. 2. В результате рассчитано, что при увеличении общего числа молекул воды на SO3H-группу λ от 1.6 до 5.7 числа гидратации увеличиваются от ~1 до ~3.
Таблица 2.
Числа гидратации противоионов (h) в Н+(H2O)h КСК4 при различном влагосодержании
| RH% | λ | ${b \mathord{\left/ {\vphantom {b {{{b}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} \right. \kern-0em} {{{b}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}$ | h |
|---|---|---|---|
| 0 | 1 | – | – |
| 10 | 1.6 | 0.362 | 0.8 |
| 33 | 2.5 | 0.452 | 1.1 |
| 58 | 3.8 | 0.458 | 1.8 |
| 64 | 4.2 | 0.366 | 2.5 |
| 78 | 5.7 | 0.420 | 3.1 |
Температурные измерения КСД
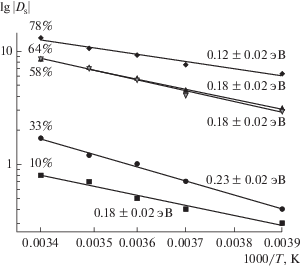
В интервале температур от –15 до 24°С методом ЯМР с импульсным градиентом магнитного поля (ЯМР с ИГМП) были измерены коэффициенты самодиффузии (КСД) исследуемой КСК4, выдержанной до постоянной массы при относительных влажностях RH = 10, 33, 58, 64, 78%. Результатом диффузионного эксперимента является зависимость интенсивности сигнала “спин-эхо” от квадрата амплитуды градиента магнитного поля (диффузионное затухание). Все диффузионные затухания имели сложную форму и были аппроксимированы суммой трех экспоненциальных компонент по формуле [14]:
(3)
$\begin{gathered} A(g) = {{p}_{1}}\exp \left( { - {{\gamma }^{2}}{{g}^{2}}{{\delta }^{2}}{{t}_{{\text{d}}}}{{D}_{{{\text{s}}1}}}} \right) + \\ + \,\,{{p}_{2}}\exp \left( { - {{\gamma }^{2}}{{g}^{2}}{{\delta }^{2}}{{t}_{{\text{d}}}}{{D}_{{{\text{s}}2}}}} \right) + {{p}_{3}}\exp \left( { - {{\gamma }^{2}}{{g}^{2}}{{\delta }^{2}}{{t}_{{\text{d}}}}{{D}_{{{\text{s}}3}}}} \right), \\ \end{gathered} $Так как сигнал “спин-эхо” формируют только протоны гидратных комплексов и молекул воды, то измеренные КСД фактически отражают подвижность катионов (Н+ в форме гидратированного комплекса) и молекул воды. Неэкспоненциальный характер диффузионного затухания свидетельствует о наличии неоднородных участков (фаз) в калликсаренах, в которых трансляционная подвижность комплексов Н+(Н2О)h отличается. Такого рода неоднородность может быть вызвана наличием одновременно кристаллических и аморфных фаз с разной ионной подвижностью в них. На рис. 6 показаны диффузионные затухания КСК4, выдержанной в атмосфере с RH 78%. Для дальнейшего анализа вычисляли средний КСД по формуле:
(4)
$D_{{\text{s}}}^{{{\text{cp}}}} = {{D}_{{{\text{s}}1}}}{{p}_{1}} + {{D}_{{{\text{s}}2}}}{{p}_{2}} + {{D}_{{{\text{s}}3}}}{{p}_{3}}.$В табл. 3 представлены средние КСД $D_{{\text{s}}}^{{{\text{cp}}}}$ исследуемой КСК4, выдержанной при относительных влажностях RH = 10–78 отн. % в интервале температур от –15 до 24°С.
Таблица 3.
Зависимость средних КСД $D_{{\text{s}}}^{{{\text{cp}}}}$ (м2/с) КСК4 от температуры при различных степенях гидратации
| RH, % | Т, К | ||||
|---|---|---|---|---|---|
| 297 | 288 | 278 | 268 | 258 | |
| 10 | 0.8 × 10–11 | 0.7 × 10–11 | 0.5 × 10–11 | 0.4 × 10–11 | 0.3 × 10–11 |
| 33 | 1.7 × 10–11 | 1.2 × 10–11 | 1.0 × 10–11 | 0.7 × 10–11 | 0.4 × 10–11 |
| 58 | 8.4 × 10–11 | 7.1 × 10–11 | 5.7 × 10–11 | 4.4 × 10–11 | 3.1 × 10–11 |
| 64 | 8.6 × 10–11 | 7.1 × 10–11 | 5.6 × 10–11 | 4.1 × 10–11 | 3.0 × 10–11 |
| 78 | 1.3 × 10–10 | 1.1 × 10–10 | 9.2 × 10–11 | 7.6 × 10–11 | 6.3 × 10–11 |
Полученные данные по диффузии были сопоставлены с протонной проводимостью при комнатной температуре, измеренной методом импедансной спектроскопии [5]. Были рассчитаны σрасч на основании соотношения Нернста–Эйнштейна:
где n – количество носителей заряда на единицу объема; е = 1.9 × 10–19 Кл – заряд электрона; D –коэффициент самодиффузии, м2/с; k = 1.38 × × 10–23 Дж/К – постоянная Больцмана; Т = 293 К – температура.Рассчитанные σрасч и экспериментальные величины протонной проводимости представлены в табл. 4. Во всем исследуемом диапазоне влагосодержания для КСК4 наблюдаем хорошее согласие экспериментальных и рассчитанных из $D_{{\text{s}}}^{{{\text{cp}}}}$ значений. Такое хорошее совпадение рассчитанных и экспериментальных данных говорит в пользу того, что для расчета σрасч использовали средневзвешенные КСД $D_{{\text{s}}}^{{{\text{cp}}}}.$
Таблица 4.
Рассчитанные согласно (5) из КСД значения протонной проводимости σрасч и полученные экспериментально σэксп [5]
| RH, % | $D_{{\text{s}}}^{{{\text{cp}}}},$ м2/c | σрасч, См/см | σэксп, См/см |
|---|---|---|---|
| 10 | 0.8 × 10–11 | 2.2 × 10–3 | 2.3 × 10–3 |
| 33 | 3.7 × 10–11 | 1.0 × 10–2 | 2.2 × 10–2 |
| 58 | 7.0 × 10–11 | 1.9 × 10–2 | 3.2 × 10–2 |
| 64 | 1.2 × 10–10 | 3.3 × 10–2 | 4.2 × 10–2 |
| 78 | 1.3 × 10–10 | 3.5 × 10–2 | 5.0 × 10–2 |
Из температурных зависимостей $D_{{\text{s}}}^{{{\text{cp}}}}$ были рассчитаны энергии активации Еа. Для этого в аррениусовских координатах были построены температурные зависимости КСД $D_{{\text{s}}}^{{{\text{cp}}}}$ при различном влагосодержании (рис. 7), из тангенса угла наклона которых были рассчитаны значения энергии активации самодиффузии Еа. Показано, что в интервале влагосодержания RH 10–64% – Еа составляет около 0.2 эВ, а при повышении до RH 78% Еа заметно уменьшается до 0.1 эВ. Это может быть вызвано переходом в новую область фазовой диаграммы, как это описано в [4, 5], с более разветвленной сеткой водородных связей и низким барьером переноса протона. Во всем исследуемом диапазоне влагосодержания полученные значения Еа самодиффузии хорошо согласуются с данными, полученными в [5] для Еа протонной проводимости.
ЗАКЛЮЧЕНИЕ
При температурах от –15 до 24°С зарегистрированы спектры ЯМР 1H твердых образцов КСК4, выдержанных при относительной влажности RH от 10 до 78%.
При понижении температуры из-за усиления водородных связей наблюдается смещение сигнала в область “слабых” полей. При увеличении влагосодержания химический сдвиг сигнала в спектре ЯМР 1Н смещается в “сильные” поля, приближаясь к сигналу свободной воды δ = 4.3 м.д.
Анализ интенсивностей сигналов позволил показать, что в исследуемом диапазоне влагосодержания (от λ 1.6 до 5.7 мол H2O/SO3H) и температуры (от –15 до 24°С) в КСК4 не образуется фаза льда.
В интервале λ от 1.6 до 5.7 рассчитаны числа гидратации H+ в гидратных комплексах Н+(H2O)h КСК4. При увеличении влагосодержания числа гидратации h увеличиваются от 1 до 3 мол. H2O/SO3H.
Из средних КСД, полученных методом ЯМР с ИГМП, рассчитаны значения протонной проводимости на основании соотношения Нернста–Эйнштейна. Результаты хорошо согласуются с экспериментально полученными методом спектроскопии электрохимического импеданса.
В интервале RH 10–78% Еа самодиффузии, рассчитанные из температурных зависимостей $D_{{\text{s}}}^{{{\text{cp}}}}{\text{,}}$ совпадают с Еа протонной проводимости.
БЛАГОДАРНОСТИ
Коллектив авторов выражает благодарность сотрудникам лаборатории “Ионика твердого тела” Института проблем химической физики РАН за предоставление каликс[4]арен-пара-сульфокислоты.
ЯМР эксперименты выполнены на оборудовании центра коллективного пользования ЦКП НЦЧ РАН (г. Черноголовка).
Работа выполнена в Центре компетенции НТИ при ИПХФ РАН.
Список литературы
Писарева, А.В., Писарев, Р.В., Карелин, А.И., Шмыглева, Л.В., Антипин, И.С., Коновалов, А.И., Соловьева, С.Е., Добровольский, Ю.А., Алдошин С.М. Протонная проводимость каликс[n]арен-пара-сульфокислот (n = 4, 8). Известия академии наук. Серия химическая. 2012. № 10. С. 1877. [Pisareva, A.V., Pisarev, R.V., Karelin, A.I., Shmygleva, L.V., Antipin, I.S., Konovalov, A.I., Solovieva, S.E., Dobrovolsky, Y.A., and Aldoshin, S.M., Proton conductivity of calix[n]arene-para-sulfonic acids (n = 4, 8). Russ. Chem. Bull., 2012, vol. 61, p. 1892.]
Шмыглева, Л.В., Писарева, А.В., Писарев, Р.В., Укше, А.Е., Добровольский, Ю.А. Протонная проводимость каликс[4]арен-пара-сульфокислот. Электрохимия. 2013. Т. 49. № 8. С. 893. [Shmygleva, L.V., Pisareva, A.V., Pisarev, R.V., Ukshe, A.E., and Dobrovol’skii Y.A., Proton conductivity of calix[4]arene-para-sulfonic acids, Russ. J. Electrochem., 2013, vol. 49, p. 801.]
Шмыглева, Л.В., Сангинов, Е.А., Каюмов, Р.Р., Укше, А.Е., Добровольский, Ю.А. Влияние строения каликс[4]арен-пара-сульфокислоты на ее транспортные свойства. Электрохимия. 2015. Т. 51. № 5. С. 540. [Shmygleva, L.V., Sanginov, E.A., Kayumov, R.R., Ukshe, A.E., and Dobrovol’skii, Y.A., Effect of the structure of calix[4]arene-para-sulfonic acid on its transport properties, Russ. J. Electrochem., 2015, vol. 51, p. 468]
Shmygleva, L.V., Sanginov, E.A., Slesarenko, N.A., Chernyak, A.V., Karelin, A.I., and Dobrovolsky, Y.A., Aspects of proton transport in calix[6]arene sulfonic acid, Ionics, 2017, vol. 23, p. 1793.
Shmygleva, L.V., Slesarenko, N.A., Chernyak, A.V., Sanginov, E.A., Karelin, A.I., Pisareva, A.V., Pisarev, R.V., and Dobrovolsky, Y.A., Effect of calixarene sulfonic acids hydration on their proton transport properties, Int. J. Electrochem. Sci., 2017, vol. 12, p. 4056.
Atwood, J.L., Hamada, F., Robinson, K.D., Orr, G.W., and Vincent, R.L., X-ray diffraction evidence for aromatic π hydrogen bonding to water, Nature, 1991, vol. 349, p. 683.
Coleman, A.W., Bott, S.G., Morley, S.D., Means, C.M., Robinson, K.D., Zhang, H., and Atwood, J.L., Novel Layer structure of sodium calix[4]arenesulfonate complexes—a class of organic clay mimics?, Angew. Chem. Int. Ed. Engl., 1988, vol. 10, p. 1361.
Dalgarno, S.J. and Raston, C.L., Rapid capture of 4,13-diaza-18-crown-6 molecules by p-sulfonatocalix[4]arene in the presence of trivalent lanthanide ions, Dalton Trans., 2003, I. 3, p. 287.
Martin, A.D. and Raston, C.L., Multifunctional p‑phosphonated calixarenes, Chem. Commun., 2011, vol. 47, p. 9764.
Dalgarno, S.J., Atwood, J.L., and Raston, C.L., Structural Versatility in Praseodymium Complexes of p-Sulfonatocalix[4]arene, Crystal Growth & Design, 2007, vol. 7, no. 9, p. 1762.
Tauran, Y., Brioude, A., Shahgaldian, P., Cumbo, A., Kim, B., Perret, F., Coleman, A.W., and Montasserf, I., Calix-arene silver nanoparticles interactions with surfactants are charge. size and critical micellar concentration dependent, Chem. Commun., 2012, vol. 48, p. 9483.
Scharff, J.-P. and Mahjoubi, M., Synthesis and acid-base properties of calix[4], calix[6] and calix[8]arene p‑Sulfonic Acids, New. J. Chem., 1991, vol. 15, p. 883.
Suh, K.J., Hong, Y.S., Skirda, V.D., Volkov, V.I., Lee, C.Y.J., and Lee, C.H., Water self-diffusion behavior in yeast cells studied by pulsed field gradient NMR. Biophys. Chem., 2003, vol. 104, p. 121.
Маклаков, А.И., Скирда, В.Д., Фаткуллин, Н.Ф. Самодиффузия в растворах и расплавах полимеров, Казань: Издательство Казанского университета, 1987. 224 с. [Maklakov, A.I., Skirda, V.D., and Fatkullin, N.F., Self-Diffusion in Polymer Solutions and Melts. (in Russian), Kazan: State University Press. Kazan, 1987. 224 p.]
Volkov, V.I., Korotchkova, S.A., Ohya, H., and Guo Q., Self-diffusion of water-ethanol mixtures in polyacrylic acid-polysulfone composite membranes obtained by pulsed-field gradient nuclear magnetic resonance spectroscopy, J. Membr Sci., 1995, vol. 100, p. 273.
Creekmore, R.W. and Reilley, C.N., Nuclear magnetic resonance determination of hydration numbers of electrolytes in concentrated aqueous solutions, The J. Phys. Chem., 1969, vol. 73, p. 1564.
Malinowski, E.R., Knapp, P.S., and Feuer, B., NMR studies of aqueous electrolyte solutions. I. Hydration number of NaCI determined from temperature effects on proton shift, The J. Chem. Phys., 1966, vol. 45, p. 4276
Хуцишвили, В.Г., Богачев, Ю.С., Волков, В.И. Изучение состояния воды в фазе сульфокатионита КУ-2 методом протонного магнитного резонанса. Журн. физической химии. 1983. Т. 57. № 10. С. 2524 [Hucishvili, V.G., Bogachev, Yu.S., and Volkov, V.I., The study of the state of water in the phase of sulphocathionite KU-2 by the method of proton magnetic resonance, Zhurnal fizicheskoy khimii, 1983, vol. 57 (10), p. 2524].
Дополнительные материалы отсутствуют.