Электрохимия, 2019, T. 55, № 7, стр. 771-807
Удаление органических соединений, присутствующих в сточной воде, в усовершенствованных процессах электрохимического окисления (обзор)
Дамодхар Гайм a, Прабир Гош a, *
a Отделение химической технологии, Национальный технологический институт
492010 Райпур (Чхаттисгарх), Индия
* E-mail: prabirg.che@nitrr.ac.in
Поступила в редакцию 23.02.2018
После доработки 23.10.2018
Принята к публикации 20.12.2018
Аннотация
Присутствие органических соединений, в частности, ароматических соединений в сточной воде рассматривается как возрастающая экологическая проблема вследствие их вредного воздействия на живые организмы даже при низкой концентрации. Традиционные процессы обработки сточной воды оказываются неэффективными для удаления устойчивых органических соединений. В настоящее время существует проблема уменьшения неблагоприятного воздействия этих опасных соединений на окружающую среду. Таким образом, в последние десятилетия повышенное внимание привлекают усовершенствованные процессы окисления (УПО) в целях удаления ароматических соединений. Среди УПО усовершенствованные процессы электрохимического окисления (УПЭО), в частности “анодное окисление” и “электрохимическая реакция Фентона”, проявили хороший потенциал для устранения загрязнения, вызванного присутствием водорастворимых органических соединений в сточной воде. Настоящий обзор представляет собой инновационное собрание современных знаний о процессах типа электрохимической реакции Фентона и анодного окисления. В нем подробно обсуждены основы указанных процессов, используемые электролизеры, механизмы реакций, экспериментальные параметры, влияющие на данные технологии электрохимической обработки в разнообразных приложениях. В настоящем обзоре также обсуждена эффективность УПЭО для устранения органических соединений в водных системах.
Содержание
1. Введение
2. Конструкции реакторов (электролизеров) для электрохимической обработки
3. Электродные материалы для процессов анодного окисления и электрохимической реакции Фентона
4. Кинетика усовершенствованных процессов электрохимического окисления
5. Факторы, влияющие на УПЭО:
5.1. pH
5.2. Температура
5.3. Применяемая плотность тока
5.4. Концентрация пероксида водорода
5.5. Расстояние между электродами
5.6. Концентрация Fe2+
5.7. Природа фонового электролита
6. Применения:
6.1. Красители
6.2. Фенольные соединения
6.3. Пестициды и инсектициды
6.4. Фармацевтические препараты
6.5 Другие вещества
7. Выводы
1. ВВЕДЕНИЕ
Окисление органических соединений в сточной воде в условиях УПО пероксидом водорода (H2O2) и ионами железа(II) (Fe2+) рассматривается в качестве перспективной и высокоэффективной технологии [1]. Основу этого процесса представляет собой получение на месте применения гидроксильных радикалов (●OH), имеющих высокий окислительный потенциал 2.80 В ((уравнение (1)). Присутствующие в воде загрязняющие органические вещества окисляются радикалами ●OH с образованием малых молекул или полностью разлагаются до диоксида углерода (CO2) и воды (H2O) [2]. В отношении УПО можно упомянуть несколько процессов обработки сточной воды для удаления органических соединений с использованием радикалов ●OH, таких как Fe(II)/H2O2 [3], Fe(II)/H2O2/УФ, H2O2/УФ и TiO2/УФ [4], озонирование, (O3) [5], O3/H2O2 [6], процессы типа реакции Фентона [7–12] и т.д.
(1)
${\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}} + {\text{ H}}{{{\text{O}}}^{{\text{--}}}} + {\text{ H}}{{{\text{O}}}^{\centerdot }}.$Среди этих различных типов усовершенствованных процессов окисления УПЭО (в частности, “анодное окисление’’ и ‘‘электрохимическая реакция Фентона’’) проявляют значительно улучшенные возможности для уменьшения загрязнения, вызванного присутствием органических соединений в сточной воде. Важность этих методов обуславливают их совместимость с окружающей средой, возможность автоматизации, высокая эффективность использования энергии, гибкость и безопасность эксплуатации в мягких условиях. Один из наиболее распространенных УПЭО представляет собой анодное окисление (АО). В этом процессе органические соединения реагируют непосредственно с гетерогенными гидроксильными радикалами M(●OH), которые образуются при окислении воды на поверхности анода (M) при высоком перенапряжении кислорода (уравнение (2)). В частности, легированный бором алмазный (ЛБА) анод имеет очень высокую каталитическую активность и позволяет производить гидроксильные радикалы в большом количестве. Другой распространенный УПЭО представляет собой процесс электрохимической реакции Фентона (ЭФ), в котором радикалы ●OH образуются гомогенно в объеме обрабатываемого раствора из электрохимически генерированного реагента Фентона (смесь H2O2 и Fe2+) (уравнение (3)). Электрогенерация H2O2 на месте применения осуществляется на катоде согласно уравнению (4) в процессе двухэлектронного восстановления растворенного O2. Каталитическое количество соли железа(II) является достаточным для осуществления процесса вследствие каталитической электрорегенерации железа(II) на катоде (уравнение (5)) [13].
(2)
${\text{А н о д }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{А н о д (H}}{{{\text{O}}}^{\centerdot }}{\text{)}} + {{{\text{H}}}^{{\text{ + }}}} + {\text{e}},$(3)
${\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}^{{\text{ + }}}} \to {\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}} + {\text{H}}{{{\text{O}}}^{--}} + {\text{H}}{{{\text{O}}}^{\centerdot }},$(4)
${{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{{\text{ + }}}} + 2{\text{e}} \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}},\quad\quad$(5)
${\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}} + {\text{e}} \to {\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}}{\text{.}}$Эти образующиеся гомогенные/гетерогенные радикалы ●OH могут затем реагировать с органическим материалом (R), окисляя его до достижения конечного состояния окисления т.е. минерализации (уравнение (6)).
(6)
$\begin{gathered} {\text{H}}{{{\text{O}}}^{\centerdot }}{\text{/А н о д }}\,{\text{ + }}\,\,{\text{(H}}{{{\text{O}}}^{\centerdot }}{\text{) + }}\,\,{\text{о р г а н и ч е с к и е с о е д и н е н и я в в о д е }} \to \\ \to {\text{А н о д + о к и с л е н н ы е п р о д у к т ы }}. \\ \end{gathered} $Как правило, электрохимическое окисление представляет собой один из ниболее признанных и экологичных развивающихся методов очистки сточной воды, содержащей устойчивые органические соединения. Механизм электрохимического окисления для электрогенерации активного окислителя, представляющего собой гидроксильный радикал (●OH), составляет несколько стадий:
1. Электрогенерация пероксида водорода (H2O2) на месте применения посредством катодного восстановления растворенного кислорода (O2), уравнение (4).
2. Генерация гидроксильных радикалов (●OH) посредством реакции Фентона между электрогенерированным H2O2 с введением извне соли железа(II) (Fe2+) в раствор (уравнение (3)).
3. Дальнейшая генерация радикалов ●OH на анодной поверхности электрода при использовании анодного материала, такого как ЛБА (уравнение (2)) и реакция электрогенерированных гидроксильных радикалов с содержащимися в воде устойчивыми органическими соединениями (R) в целях их окисления в более простые молекулы, такие как диоксид углерода, вода и окисленные продукты (уравнение (6)).
4. Регенерация Fe3+/Fe2+ путем непосредственного восстановления на поверхности катодного материала (уравнение (5)).
Этот механизм (согласно уравнениям (2)–(6)) представляет собой общую концепцию процессов УПЭО (относящихся к категориям анодного окисления и окисления в электрохимической реакции Фентона), которые происходят с использованием электродов, выбранных соответствующим образом. Процесс ЭФ предусматривает использование пористых материалов на углеродной основе (углеродной губки) в качестве катода, что обеспечивает быструю адсорбцию гидрофобных гуминовых кислот. K. Barbusinski (2009 г.) составил краткий обзор по процессу, автором которого является Генри Джон Хорстман Фентон. Эта система окислительного процесса Фентона полностью основана на генерации частиц, имеющих высокую реакционную способность, т.е. гидроксильных радикалов. Природа окисляющих частиц, получаемых в реакции Фентона, по-прежнему представляет собой тему для обсуждения и является предметом противоречий в литературе, опубликованной в прошлом и настоящем времени. Кроме того, процесс Фентона представляет собой процесс, хорошо известный в течение более чем одного столетия, но его применение для устранения устойчивых органических соединений, присутствующих в сточной воде, не было известно до конца 1960-х годов. После 1960-х годов исследования в более широкой сфере показали, что реагент Фентона является эффективным для очистки промышленной сточной воды от различных загрязняющих веществ, таких как разнообразные красители, пестициды, взрывчатые вещества и ароматические соединения, например, фенол и фенольные соединения. Таким образом, реагент Фентона применяется для очистки разнообразных видов сточной воды, такой как сточная вода, которая выделяется в ходе промышленного производства текстильных изделий, фармацевтических препаратов, пластмассы и целлюлозно-бумажных изделий. Процесс Фентона можно также эффективно использовать для удаления токсичных и бионеразлагаемых отходов [14]. Процесс электрохимической реакции Фентона может быть интегрирован с традиционным процессом, используемым в биологических методах. Это обеспечило весьма полезные результаты. В этом случае окисление может быть осуществлено посредством более дешевых биологических методов. Такой процесс сокращенно называется процессом Био-ЭФ. Сокращенное время протекания электрохимической реакции Фентона оказывается полезным для устойчивости электродного материала, применяемого в электролизе. Уменьшение продолжительности обработки может увеличивать срок эксплуатации электродных материалов. Второй процесс представляет собой новый электропероксонный процесс электрохимической обработки, который позволяет на месте применения генерировать окислитель, пероксид водорода (H2O2), в результате двухэлектронного восстановления растворенного кислорода (O2) на катоде в традиционном процессе озонирования. Электрогенерированный пероксид водорода может значительно ускорять превращение озона (O3) в гидроксильные радикалы (●OH) и, таким образом, в существенной степени усиливать окисление содержащихся в воде загрязняющих веществ. Электропероксонный процесс также сокращает продолжительность реакции и расход электроэнергии, требуемой для обработки сточной воды. Электропероксонный процесс не производит вторичные загрязняющие вещества какого-либо типа. Только озон, пероксид водорода и гидроксильные радикалы образуются с регулируемыми скоростями с использованием полученной экологичным способом электроэнергии и растворенного кислорода. Таким образом, этот процесс обеспечивает более удобный и эффективный способ, предположительно улучшающиий эффективность существующего процесса озонирования. Электропероксонный процесс все еще нуждается в значительных исследованиях, прежде чем его можно будет использовать в реальной системе очистки сточной воды [15]. Г.А. Колягин и В.И. Корниенко (2016 г.) исследовали влияние состава смеси технического углерода на структурные и электрохимические характеристики газодиффузионных электродов (ГДЭ) для электрохимического синтеза пероксида водорода (H2O2). ГДЭ делает перспективным значительное повышение суммарной плотности тока в ходе электрохимической обработки. Было обнаружено, что скорость генерации H2O2 при электровосстановлении O2 увеличивается при введении углеродных нанотрубок в ГДЭ [16]. Корниено и др. (2016 г.) использовали графитизированные углеродные материалы для электросинтеза пероксида водорода (H2O2) из кислорода в газодиффузионных электродах. На всех исследованных ГДЭ из углеродных материалов N220, C140 и CH85 восстановление O2 в щелочном электролите происходит через стадию образования гидропероксидного иона с высокой селективностью. Технический углерод N220 оказался наиболее благоприятным материалом в качестве катализатора для электросинтеза пероксида водорода из O2 на ГДЭ [17]. Корниенко и др. (2014 г.) проанализировали перспективы использования в водной среде H2O2, образующегося в процессе катодного восстановления O2 на содержащих технический углерод газодиффузионных и графитовых электродах для опосредованного окисления органических соединений и неорганических соединений. Высокоэффективный катодный синтез H2O2 из O2 и генерация частиц активного кислорода обеспечивают различную окислительную способность H2O2, что допускает использование электролизеров различных конструкций [18]. Г. А. Колягин и В. Л. Корниенко (2014 г.) обсудили возможность образования пероксида водорода при электровосстановлении O2 с помощью газодиффузионных электродов в растворах соли, которая образует пероксосольваты с H2O2. Пероксид водорода получали при концентрации от 2.3 до 3.6 М, используя плотности тока в диапазоне от 0.1 до 0.15 мА см–2 и эффективности тока от 75 до 92%. Растворы соли, которая образует молекулярные соединения с пероксидом, и одновременно растворы пероксида водорода могут быть получены при высокой концентрации и эффективности тока [19]. Колягин и др. (2013 г.) описали электросинтез пероксида водорода при значениях pH в диапазоне от 1 до 9 в водных растворах минерализованных жидких и твердых биоотходов для их переработки в замкнутых системах жизнеобеспечения. Пероксид водорода получали в этих растворах при электрохимическом восстановлении O2, используя содержащие технический углерод газодиффузионные электроды при концентрации выше 2 М и эффективности тока 80%. Растворы H2O2 можно далее концентрировать до 19 M. Это показывает, что электролитический метод представляет собой наиболее перспективный метод получения пероксида водорода для замкнутых систем жизнеобеспечения [20]. Корниенко и др. (2011 г.) исследовали окислительное разложение фенола на электроде ЛБА в кислых электролитах в разнообразных условиях образования активных форм кислорода. Активные радикалы, такие как гидроксильные и пергидроксильные радикалы, образуются на электроде ЛБА, что может разрушать субстрат, приводя к образованию органических радикалов. Образующиеся радикалы органических соединений взаимодействуют друг с другом и производят продукты конденсации. Непосредственное анодное окисление осуществляли с барботированием кислорода и введения H2O2 извне [21]. Настоящий обзор представляет экспериментальные исследования, недавно опубликованные в литературе и достижения в области технологий электрохимической обработки для очистки сточной воды, содержащей устойчивые органические соединения. Обзор представляет обновленное собрание современных знаний в отношении процессов тпа электрохимической реакции Фентона и анодного окисления. Здесь подробно обсуждаются основы этих процессов, используемые экспериментальные установки, основные реакции данных процессов, параметры, влияющие на указанные технологии электрохимической обработки и разнообразные приложения. В настоящем обзоре также представлены различные катодные и анодные материалы, используемые для процессов электроокисления в целях очистки сточной воды.
2. КОНСТРУКЦИИ РЕАКТОРОВ (ЭЛЕКТРОЛИЗЕРОВ) ДЛЯ ЭЛЕКТРОХИМИЧЕСКОЙ ОБРАБОТКИ
Конструкция реакторов, используемых в УПЭО, представляет собой неотъемлемую часть процесса. Она может представлять собой электролитическую ячейку/электролизер и применяться для обработки сточной воды или для удаления содержащихся в воде загрязняющих органических веществ. Полную конструкцию реактора составляют:
а) регулируемый источник электроэнергии постоянного тока, б) электролитическая ячейка, в) электроды (анод и катод), г) нагревательная плитка с магнитной мешалкой, д) кислородный баллон/воздушный компрессор, подающий сжатый воздух в систему.
Существуют разнообразные типы электролитических ячеек/электролизеров, используемых исследователями для обработки в целях удаления загрязняющих органических веществ, содержащихся в сточной воде, которые представляют собой диафрагменные двухэлектродные электрохимические ячейки (ДДЭЯ) и диафрагменные трехэлектродные электрохимические ячейки (ДТЭЯ). ДДЭЯ и ДТЭЯ представляют собой электролитические ячейки, использующие один отсек для обработки сточной воды. Некоторые исследователи также используют для УПО состоящие из двух отсеков ячейки. Система реактора этого типа содержит насыщенный каломельный электрод (НКЭ) в качестве электрода сравнения. Процесс электролиза с регулируемым потенциалом представляет собой основную цель использования данного электрода сравнения вместе с анодом в УПО. Электрическую схему системы реактора составляют регулируемый источник электроэнергии постоянного тока; ячейка, имеющая амперметр и вольтметр, соединенный параллельно с системой реактора или конструкцией реактора. Кроме того, электролизеры используют электроэнергию для разложения молекул воды на водород (H2) и кислород (O2). Существуют многочисленные пути разработки и конструирования электролизеров, в которых могут быть использованы разнообразные электролиты, как в топливных элементах. Конструкции электролизеров можно разделить на два основных класса: монополярные и биполярные. В монополярных конструкциях электролизеров обычно используют жидкий раствор электролита, такой как щелочной раствор, а в биполярных конструкциях используют твердый полимерный электролит, такой как протонообменные мембраны. В прошлом в качесте электролита обычно использовали гидроксид калия (KOH). Но протонообменные мембраны являются более распространенными. Кроме того, содержащий еще один тип электролита, т.е. твердооксидный электролизер (ТОЭ) может быть использован для получения газообразного водорода. Щелочные устройства и протонообменные мембраны (ПОМ) представляют собой хорошо разработанные технологические типы электролизеров, которые находятся в эксплуатации в количестве многих тысяч и используются в промышленном электролитическом производстве водорода [22, 23]. Твердооксидные электролизеры пока находятся на стадии разработки [24]. Водород рассматривается в качестве потенциального будущего энергоносителя. Его можно производить посредством электролиза воды, причем источник требуемой энергии представляет собой фотоэлектрический (ФЭ) модуль. Электролизеры могут быть соединены с разнообразными источниками возобновляемой энергии, такий как солнечная, ветровая, геотермальная и т.д. [25]. Такие электролизеры могут упоминаться как соединенные системы электролизеров. В табл. 1 представлена информация, описывающая различные электролизеры, применяемые в них источники энергии, эффективность и скорость производства водорода. Kim и др. (2013 г.) описали новый электрохимический метод с применением низкого тока и постоянного напряжения на возобновляемом медном электроде для обработки агропромышленной сточной воды. Исследовано одновременное разложение органических соединений и питательных веществ в агропромышленной сточной воде. Также проанализировано образование побочных продуктов в результате электролитической обработки с помощью медного электрода [36]. Gajda и др. (2017 г.) исследовали микробиологический топливный элемент, который представляет собой новый автономный электролизер сточной воды для электрокоагуляции тяжелых металлов в форме щелочного раствора. В таком автономном электролизере используется сточная вода, содержащая ацетат натрия в качестве источника углерода. Раствор католита активно синтезируется и обеспечивает осаждение тяжелых металлов [37]. В табл. 2 представлены литературные данные, полученные для обработки различных реальных видов промышленной сточной воды с помощью электрохимических процессов. В табл. 3 представлены недавние опубликованные в литературе работы с использованием систем реакторов обоих типов, включая типы диафрагменных и недиафрагменных ячеек. Zhang и др. (2015 г.) использовали реактор недиафрагменного типа с вращающимся дисковым электродом (ВДЭ) для удаления из водного раствора тетрациклина при начальной концентрации 50 мг/л [38].
Таблица 1.
Сравнение эффективности и скорость производства водорода в разнообразных системах соединенных электролизеров
| Описание системы | Используемый источник возобновляемой энергии | Эффективность использования энергии, % | Скорость производства водорода | Литература |
|---|---|---|---|---|
| Высокотемпературный электролизер, соединенный с модулями ФЭ | Солнечная энергия | 7 | 16.67 кг/ч | [26] |
| Высокотемпературный электролизер, соединенный с полем гелиостатов | Солнечная энергия | 10.6 | 16.87 кг/ч | [26] |
| Высокотемпературный электролизер, одновременно соединенный с полем гелиостатов и модулями ФЭ | Солнечная энергия | 9.9 | 17.45 кг/ч | [26] |
| Высокотемпературный электролизер, одновременно соединенный с модулем ФЭ и параболо-цилиндрическими концентраторами (ПЦК) | Гибридный источник солнечной и термальной энергии | 20 | 8.67 кг/ч | [27] |
| Процесс ФЭ/электролиза | Солнечная энергия | 9.34 | 42 кг/год | [28] |
| Водный электролизер ПОМ, питаемый геотермальной энергией | Геотермальная энергия | 11.4 | 0.0340 кг/с | [29] |
Таблица 2.
Опубликованные результаты обработки разнообразных реальных промышленных стоков с помощью процессов электрохимического окисления
| Промышленные стоки | Конфигурации реакторов | Начальный уровень потребляемого кислорода/общего кислорода | Анод/катод | Фоновый электролит | Плотность тока, мА/см2 | Уменьшение потребляемого кислорода, % | Литера-тура |
|---|---|---|---|---|---|---|---|
| Сточная вода от промышленного крашения текстиля | Периодическая рециркуляционная реакторная система | 560 ч/млн | Покрытая сетка Ti/нержавеющая сталь | Неочищенный сток | 5 | 95% в течение 360 мин продолжительности реакции | [30] |
| Сточная вода нефтяной промышленности | Изотермический реактор объемом 200 мл | 19 842 ч/млн | PbO2/решетка Pt | Неочищенный сток | 30 | 85% в течение 660 мин продолжительности реакции | [31] |
| Сточная вода текстильного производства | Бездиафрагменная электролитическая проточная ячейка | 650 ч/млн | ЛБА/Ti | Неочищенный сток | 40 | 100% в течение 1080 мин | [32] |
| Сточная вода миндального производства | Бездиафрагменный реактор типа фильтр-пресса | 2000 ч/млн | Ti-RuO2/сетка из нержавеющей стали | NaCl | 50 | 75% в течение 120 мин | [33] |
| Сточная вода фармацевтического производства | Однокамерная электрохимическая проточная ячейка | 1600 ч/млн (TOC) | ЛБА/нержавеющая сталь | Неочищенный сток | 157 | 100% в течение 70 мин | [34] |
| Сточная вода дубильного производства | Бездиафрагменный реактор типа резервуара с мешалкой | 1800 ч/млн (TOC) | ЛБА/железная пластина | Неочищенный сток | 65 | 48.5% в течение 180 мин | [35] |
Таблица 3.
Типы реакторных систем/конфигураций, используемых для усовершенствованных процессов электрохимического окисления, включая процессы электрохимической реакции Фентона и анодного окисления
| Номер | Тип реактора | Обрабаты-ваемый объем | Разлагающееся загрязняющее вещество | Используемый электролит/pH | Плотность/сила тока | Материал электрода | Литера-тура | |
|---|---|---|---|---|---|---|---|---|
| Анод | Катод | |||||||
| 1. | Бездиафрагменная цилиндрическая открытая ячейка | 200 мл | Раствор 0.2 мМ сульфаметазина | 0.05 М Na2SO4/6.1 | 100–1000 мА | Сетка Pt | Углеродный войлок | [39] |
| 2. | Однокамерная электролитическая ячейка | 400 мл | Сточная вода спиртового производства, химическое потребление кислорода 60 000–70 000 мг/л | /2.84 | 51.54 мА | Композит Fe2O3–графит | Композит Fe2O3–графит | [40] |
| 3. | Бездиафрагменная двухэлектродная ячейка | 500 мл | Раствор 200 мг/л левофлоксацина | /3 | 6.67 мА см−2 | Сетка RuO2/Ti | Войлок из активированных углеродных волокон (АУВ) | [41] |
| 4. | Открытый бездиафрагменный электрохимический реактор Фентона | 200 мл | Раствор 0.1 мМ кофеина | 0.05 M Na2SO4/3 | 50–400 мА | Тонкая пленка ЛБА | Тефлоновая сетка с углеродом | [42] |
| 5. | Двухкамерная ячейка, разделенная катионообменной мембраной Nafion 324 | Объем каждой камеры 100 мл | Непрерывная подача кислорода/воздуха | 0,01 M перхлората натрия/6.1 | 10–25 мА | Платиновый диск | Сетчатый стеклоуглерод | [43] |
| 6. | Цилиндрическая стеклянная ячейка | 175 мл | Раствор 0.25 мМ кислого красного 88 | 0.05 M сульфата натрия/3 | 500 мА | Платиновая сетка | Углеродный войлок | [44] |
| 7. | Открытая цилиндрическая однокамерная стеклянная ячейка | 250 мл | Раствор 0.1 мМ карбарила | 50 мМ Na2SO4/3 | 300 мА | Сетка Pt | Углеродный войлок | [45] |
| 8. | Цилиндрический плексигласовый реактор | 1.0 л | Сточная вода от газификации угля | /6.8 | 15 мА см−2 | Ti/SnO2 | Активированное углеродное волокно | [46] |
| 9. | Цилиндрическая однокамерная ячейка | 250 мл | Ципрофлоксацин | 0.05 M Na2SO4/3 | 60–500 мА | Сетка Pt | Углеродный войлок | [47] |
| 10. | Цилиндрический реактор, имеющий концентрические электроды | 4 л | Диметилсульфоксид (ДМСО) | 50 мМ NaClO4/3 | 1.5 A = = 11.3 мА/см2 | Титан, покрытый RuO2/IrO2 | Нержавеющая сталь | [48] |
| 11. | Бездиафрагменная и цилиндрическая двухэлектродная стеклянная ячейка | 250 мл | Раствор 0.30 мМ (41 мг/л) тирозола | 0.05 M Na2SO4/3 | 50–300 мА | Тонкая пленка ЛБА | Углеродный войлок | [49] |
| 12. | Бездиафрагменная двухэлектродная ячейка | 75 мл | Раствор 0.1 мМ парацетамола | 50 мМ NaClO4 / 3 | 20 мА/см2 | Платиновая фольга | Углеродный войлок | [50] |
| 13. | Однокамерная электрохимическая ячейка | 1.0 л | Сточная вода от газификации угля методом Лурги | 3 | 5–20 мА/см2 | Ti/SnO2 | Активированное углеродное волокно | [51] |
| 14. | Двухтрубный реактор с мембранными электродами | – | Разложение трициклазола без аэрации | 0.05 M Na2SO4/ 3–11 | 2.5–12.5 A/м2 | Ti, покрытый IrO2–Ta2O5 | Графит, покрытый C-ПТФЭ | [52] |
| 15. | Проточный электрохимический реактор Фентона | 150 мл | Раствор 50 мг/л метиленового синего | 0.05 M Na2SO4/3 | 50 мА | Перфорированный износостойкий анод (ИСА) | Модифицированный графит | [1] |
| 16. | Реактор бездиафрагменного типа с ВДЭ | 250 мл | Раствор 50 мг/л тетрациклина | 0.05 M Na2SO4/3 | – | Графитовый стержень | Графитовый лист | [38] |
| 17. | Новый электрохимический реактор Фентона с вертикальным потоком | 10 небольших камер | Раствор 100 мг/л тартразина | 0.05 M Na2SO4/3 | – | PbO2/Ti Сетка | Модифицированный графитовый войлок | [53] |
| 18. | Двухкамерная асимметричная электрохимическая ячейка | Объем каждой камеры 50 см3 | Хлорирование плавательных бассейнов | Анолит: солевой раствор (NaCl + HCl)/3 | – | Платиновый стержень | Пластина ИСА | [54] |
| 19. | Диафрагменный аппарат, состоящий из двух полуячеек | Объем каждой полуячейки 250 мл | 200 мл раствора оранжевого II | 50 мМ Na2SO4 /2–4 | 0.89– 2.67 мА/см2 | Стержень ИСА, покрытый RuO2–IrO2 | Углеродный войлок | [55] |
| 20. | Диафрагменный или бездиафрагменный реактор типа цилиндрического резервуара | Объем 150 см3 | Раствор 0.52– 6.34 ммоль дм−3 оранжевого G | 0.05 M Na2SO4 /3 | 100 мА см−2 | Тонкая пленка ЛБА | Нержавеющая стальная проволока и нержавеющий стальной лист | [56] |
| 21. | Бездиафрагменный цилиндрический стеклянный реактор | 250 мл | Тиаметоксам | 10 мМ Na2SO4/2.8 |
300 мА | ЛБА | Углеродный войлок | [57] |
| 22. | Открытая бездиафрагменная усеченно-коническая воздушно-диффузионная ячейка из стекла ЛБА | 100 мл, оборудована охлаждающей рубашкой | 100 мл раствора 290 мг/л азокрасителя желтый закат | 0.05 M Na2SO4 /3.0 | 100 мА см−2 | ЛБА | Катод с диффузией воздуха | [58] |
| 23. | Открытая цилиндрическая бездиафрагменная двухэлектродная ячейка | 250 мл | Раствор 0.167 ммоль/дм3 азокрасителя реакционного желтого 160 (РЖ160) | Безводный Na2SO4/3 | 100 мА/см2 | Тонкая пленка ЛБА | Углерод–ПТФЭ с диффузией воздуха | [59] |
В цитированной выше литературе для усовершенствованной электрохимической окислительной обработки отмечено, что максимальное предпочтение исследователи отдали открытым бездиафрагменным цилиндрическим двухэлектродным стеклянным ячейкам (согласно обсуждению в табл. 3) для удаления содержащихся в воде загрязняющих органических веществ. Используя реакторные системы, имеющие конфигурации такого типа, исследователи осуществляли некоторые модификации электродов. Xu и др. (2016 г.) использовали реакторную систему с двойными трубчатыми мембранными электродами для разложения трициклазола без аэрации с применением покрыой IrO2–Ta2O5 титановой мембраны в качестве анода и покрытой C-ПТФЭ графитовой мембраны в качестве катода [52]. Далее, существуют некоторые реакторные системы бездиафрагменного типа, такие как проточный электрохимический реактор Фентона, реактор типа ВДЭ и новый электрохимический реактор Фентона с вертикальным потоком, которые оказались более эффективными для удаление загрязняющих органических веществ, присутствующих в сточной воде [1, 38, 53]. Maryam и др. (2017 г.) использовали нанопоры на поверхности алюминиевого электрода, что было подтверждено методом сканирующей электронной микроскопии (СЭМ). Эффективность снижения ХПК составляла 65.03% при оптимальном pH 2.96, времени 89.51 мин, значении плотности тока 69.57 мА/см2, молярном соотношении окислитель/Fe2+ 3.42 и объемном содержании окислителя в нефтехимической сточной воде 1.93 (мл/л) [60]. Tzedakis и Assouan (2014 г.) использовали двухкамерный асимметричный электрохимический реактор, работающий без обращения полярности электродов, который был сконструирован и оптимизирован для хлорирования плавательных бассейнов [54]. Предложенный двухкамерный асимметричный электрохимический реактор обрабатывает концентрированный солевой раствор, производимый с деминерализованной водой; этот подкисленный солевой раствор поступает в анодную камеру и после электролиза раствор перемещается в катодную камеру, прооходя через керамическую диафрагму. Газообразный хлор, производимый на аноде и абсорбируемый в подщелоченном католите (на выпуске катодной камеры), образует раствор гипохлорита. Устройство имеет низкую суммарную стоимость, является простым и может эксплуатироваться в автоматическом режиме без специального обслуживания. Разложение оранжевого II осуществляли в диафрагменной электролитической ячейке Lin и др. (2014 г.), которые использовали солевой мостик для соединения анода и катода [55]. Стержень ИСА, покрытый RuO2–IrO2 и имеющий внешний диаметр 1.5 см, находился в центре анодной камеры. Кусок углеродного войлока (размеры 16 × 7 см) был покрыт внутренней стенкой катодной камеры ячейки. В катодной камере получали H2O2 при восстановлении O2, находящегося в растворе, во всех электролитических экспериментах. Постоянное насыщение O2 при атмосферном давление обеспечивало барботирование сжатого воздуха, которое начинали за 10 мин до процесса электролиза в электролитической ячейке. El-ghenymy и др. (2014 г.) исследовали процесс анодного окисления с использованием диафрагменного или бездиафрагменного резервуарного реактора, содержащего легированный бором алмаз в качестве анода и нержавеющий стальной катод, для обесцвечивания и минерализации растворов азокрасителя оранжевого G [56]. Полная минерализация в реакторе типа диафрагменной ячейки была достигнута менее чем за 330 мин работы при плотностях тока не менее 66.7 мА/см2, в то время как в реакторе типа бездиафрагменной ячейки это наблюдалось через 420 мин при 150 мА/см2. В процессах анодного окисления ЛБА в качестве анода и углеродный войлок/обеспечивающий диффузию воздуха материал или модифицированный материал в качестве катода были использованы для реакторной системы типа открытой цилиндрической и бездиафрагменной двухэлектродной ячейки в целях удаления красителей и содержащихся в воде устойчивых органических соединений [57–59]. Таким образом, выбор типа реактора для окисления содержащегося в воде загрязняющего органического вещества играет важную роль в усовершенствованных процессах электрохимического окисления. Наряду с выбором типа реактора, выбор материалов электродов (анода и катода) для электрохимического процесса представляет собой еще один существенный параметр в УПЭО. Если анодный материал оказывается неустойчивым для электролитической обработки, этот материал начинает разрушаться в электролитических ячейках. Baolin и др. (2017 г.) использовали новую трехмерную (3D) систему для гетерогенной электрохимической реакции Фентона, содержащую полученный из канализационного шлама активированный углерод и железный шлам (ШАУ-Fe) в качестве электродов из каталитических частиц (ЭКЧ), для окисления азотистых гетероциклических соединений (АГС). Повышенная эффективность катализатора была обнаружена в широком диапазоне pH от 3.0 до 9.0 [61].
3. ЭЛЕКТРОДНЫЕ МАТЕРИАЛЫ ДЛЯ ПРОЦЕССОВ АНОДНОГО ОКИСЛЕНИЯ И ЭЛЕКТРОХИМИЧЕСКОЙ РЕАКЦИИ ФЕНТОНА
Выбор материалов анода и катода (электродов) для процессов анодного окисления и электрохимической реакции Фентона также представляет собой серьезную задачу в целях получения желательной степени окисления содержащихся в воде загрязняющих органических веществ. Устойчивость анодного материала должна быть более высокой во избежание его разрушения в водной среде в процессах обработки методом анодного окисления. Исследователи пытались найти наилучший и наиболее подходящий материал для анода. В течение многих лет они использовали платину (Pt) вследствие ее хорошей электропроводности и химической устойчивости даже при высоких потенциалах и в вызывающих коррозию средах. (См. табл. 4, представляющую типы электродных материалов, которые используются для процессов электрохимического окисления (в частности, для процессов анодного окисления)). В работах Hicham и др. (2016 г.), Florenza и др. (2014 г.), Zhang и др. (2013 г.) и Fernandes и др. (2014 г.) представлено использование платины в качестве анода в УПЭО для удаления хлорбензола, кислого красного 1, хлорид-ионов и азота, а также органических примесей из стоков санитарно-технических полигонов, соответственно [61–65]. Платина может быть использована в форме листа/тонкой сетки/фольги/хлопьев/решетки/пластины или в форме сетки. Однако для практической цели использование металлической платины является ограниченным вследствие ее высокой стоимости.
Таблица 4.
Типы электродных материалов, используемых для процессов электрохимического окисления (в частности, анодного окисления)
| Номер | Загрязняющее вещество/Процесс | Материалы электродов и их размеры | Расстояние между электродами | Фоновый электролит/потенциал электрода (В) | Применяемая плотность/ сила тока | Эффективность удаления/pH | Литера-тура | |
|---|---|---|---|---|---|---|---|---|
| Анод | Катод | |||||||
| 1. | Гуминовая кислота/АО | ЛБА 24 см2 × 0.2 см | Нержавеющая сталь (НС) 24 см2 × 1.2 см | 3 см | (Na2SO4) 0.05 M/ 1.763 В | 1000 мА | Снижение общего потребления кислорода на 99%/3 | [13] |
| 2. | Рeактивный желтый 160/фотоэлектрохимическая реакция Фентона (ФЭФ) | Пленка ЛБА 3 см2 | Углерод-ПТФЭ с диффузией воздуха | 1 см | (Na2SO4) 0,05 M | 100 мА/см2 | Минимум 94%/3 | [98] |
| 3. | Тиаметоксам/ЭФ | ЛБА (3.5 × 2.0 × 0.2) см | Углеродный войлок (19.0 × 6.0 × × 0.6) см | Анод: внутренняя стенка ячейки | 10 мМ Na2SO4 | 300 мА/ 0.2 мМ Fe+2 | 100% через 10 минут/2.8 | [99] |
| 4. | Диклофенак и ацетаминофен/АО | Тонкая пленка ЛБА 5 см2 | Нержавеющий стальной лист 5 см2 | 0,5 см | 10 мМ Na2SO4 | 100– 300 мА/см2 | Эффективная минерализация/6.8 | [100] |
| 5. | Хлорбензол/ЭФ | Решетка Pt или пластина ЛБА 6 × 4 см | Углеродный войлок 70 см2 | Анод: внутренняя стенка ячейки | Na2SO4 (50 мМ)/NaCl (100 мМ) | 300 мА | Снижение общего потребления кислорода на на 90% в течение 4 часов/3 | [101] |
| 6. | Сточная вода коксовой печи/АО | Новый анод PbO2 41.8 см2 | Графит 41.8 см2 | – | NaCl (1 г/л)/5 В | 6.7 мА/см2 | Минимальное снижение на 99%/3.9 | [102] |
| 7. | Активированный шлам/АО | Графитовая щетка 25 × 80 мм | Графитовый стержень 7 мм × 80 мм | 50 мм | Разложение в анаэробных условиях/ 0.8 В | 0.6–1.2 В в течение 24 суток | Увеличение полной ХПК на 26% | [103] |
| 8. | Антибиотик оксациллин/АО | Ti/IrO2 4 см2 | Циркониевая спираль длиной 10 см | – | Концентрация NaCl 0.05–0.4 моль/л | 3.25– 30.25 мА/см2 | 70% начальной ХПК/3–9 | [104] |
| 9. | Ионные жидкости на основе пиридиния и имидазолия в воде/ФЭФ | Пленка ЛБА 3 см2 | Углерод-ПТФЭ с диффузией воздуха 3 см2 | 1 см | 0.05 моль/дм3 Na2SO4 | 100 мА/см2/ 180 мин | Минимум 97 и 94% для АО + H2O2 и ЭФ/3 | [105] |
| 10. | Кислый синий 29/АО | Анод из сплава Sn–Cu–Sb 6 см2 | Нержавеющая сталь 6 см2 | – | 0.05 моль/дм3 Na2SO4 | 10 мА/см2/ 300 мин | Полное удаление/7 | [68] |
| 11. | Фенол/АО | ЛБА с покрытием размера 2–3 мкм (5.0 × 2.5 × 0.2) см |
Нержавеющая стальная фольга (5.0 × 2.5 × × 0.05) см |
3.4 см (глубина 12.2 см) | NaCl/4.5 и 6 В | 12 мА/см2/ 700 мин | Десятикратное увеличение содержания хлорида приводит к удалению/4.7–7.1 | [106] |
| 12. | Циклические амиды/АО | Углеродный стержень 5 см2 | Платиновая фольга 5 см2 | – | N-азациклоалкан (1 ммоль), растворенный в метаноле (25 мл) | 20 мА/см2 | Соотношение продуктов в высокой степени зависит от природы фонового электролита | [70] |
| 13. | Кислый красный 1/ФЭФ | Тонкая пленка ЛБА/ лист Pt 3 см2 | Электрод углерод–ПТФЭ с диффузией воздуха 3 см2 | 1 см | 0.05 моль/дм3 Na2SO4 | 100 мА/см2/ 300 мин | АО–H2O2 < ЭФ < < ФЭФ/3 | [63] |
| 14. | Метиленовый синий/АО | ЛБА Слой ЛБА толщиной 2–3 мм 12.5 см2 | Нержавеющая сталь 50 × 25 мм | 3 мм | Na2SO4 | 40 мА/см2/ 360 мин | Снижение цвета на 98% и ХПК на 81%/3 | [72] |
| 15. | Азокраситель оранжевый G/АО | Тонкопленочный электрод ЛБА 3 см2 | Нержавеющая сталь для бездиафрагменной ячейки/нержавеющий стальной провод для для диафрагменной ячейки; 3 см2 | 1 см | 0.05 моль/дм3 Na2SO4 и максимум 30 В | 100 мА/см2/ 120 мин | Полное удаление в течение 330 минут для диафрагменной ячейки/3 | [107] |
| 16. | Аспирин/АО | PbO2, Ti/ЛБА и пористый Ti/ЛБА | Ti/RuO2–TiO2–SnO2 | 10 мм | 0.1 M Na2SO4 и 2 В | 20–40 мА/см2 | Пористый Ti/ЛБА представляет наилучшие результаты/3 | [11] |
| 17. | Азокраситель желтый закат FCF/СФЭФ | ЛБА 3 см2 | Катод углерод-ПТФЭ с диффузией воздуха/ 3 см2 | – | 0,05 M Na2SO4 | 16.7– 100 мА/см2 | Солнечная ФЭФ обеспечивает удаление на 100%/3 | [108] |
| 18. | Хлорид-ионы/АО | Платиновая фольга 5 ×10 мм | Серебряный провод в оплавленной стеклянной трубке 5 × 10 мм | Диаметр 10 мм | Хлорид 1-бутил-3-метил-имидазолия и тетрафторборат 1-бутил-3-метил-имидазолия/1.6 В | – | Анализ электродной реакции осуществлен с использованием циклической вольтамперометрии | [64] |
| 19. | Удаление азота и органических загрязняющих веществ из стоков санитарно-технических полигонов/АО | Ti/Pt/PbO2, Ti/Pt/SnO2–Sb2O4 и ЛБА/ 10 см2 | Нержавеющая сталь 10 см2 | 2.0 см | 6 V, 6.2 В и 7.1 В | 0.3 А | Ti/Pt/PbO2 – удаление 90% | [65] |
| 20. | Нитробензол/АО | ЛБА/PbO2 для сравнительной цели, имеющий площадь 42 см2 | Графитовая пластина 42 см2 | 3 см | Na2SO4 (раствор 0,05 M) | 60 мА/см2 | Разложение 88% нитробензола в течение 8 часов обработки/3 | [73] |
| 21. | o-Нитрофенол/АО | ЛБА/PbO2 для сравнительной цели, имеющий площадь 42 см2 | Графитовая пластина 42 см2 | 3 см | Используемые электролиты NaCl, KCl, Na3PO4 и Na2SO4 | 60 мА/см2 | Разложение 92% о-нитрофенола в течение 8 часов обработки/3 | [109] |
| 22. | Кислый красный 73/АО | Электроды Ti/SnO2–Sb 20 см2 | Титановая фольга 20 см2 | 2 см | 0,1 M Na2SO4 + NaCl (0–9 мМ)/0.288 В | 50 мА/см2 | Начальный pH проявляет лишь слабое воздействие/3 | [74] |
| 23. | Органические загрязняющие вещества из вторичный стоков/АО | ЛБА 40.8 см2 | Нержавеющая сталь 40.8 см2 | Разделяющая катионо-обменная мембрана | 0.1 M KNO3/7.5 В | 98 или 196 A/см2 | Полное удаление ХПК через 2 часа при 98 A м−2/3 | [110] |
| 24. | 2,4-Динитрофенол/АО | Диоксид свинца, электроосажденный на мягкой стали 3 см × 10 см | Графитовая пластина 3 × 10 см | 1.5 см | Доза NaCl 1.5 г/л и 0–15 В | 1.44 мА см−2 | Удаление 94.2% ХПК при pH 6,59 в течение 180 минут | [111] |
| 25. | 2, 4-Дихлорфенол/АО | Ti/IrO2/RuO2/ TiO2 1.20 см2 | Ti/IrO2/RuO2/ TiO2 1.20 см2 | 15 мм | Na2SO4 (раствор 0.05 M)/1.5 В | Меньшее значение | Усиление биоразложения увеличивается в ходе АО | [75] |
| 26. | Фенол/АО | IrO2–Ta2O5/Ti или PbO2/Ti (10 × 5 × 15) см | Титановая пластина (10 × 5 × 15) см | – | Na2SO4 (раствор 0.05 M) | 50 или 100 А/м2 | PbO2/Ti > IrO2–Ta2O5/Ti | [76] |
| 27. | Нитробензол/АО | TiO2–NTs/SnO2–Sb/PbO2 10 см2 | Нержавеющая сталь 10 см2 | – | 50 мМ Na2SO4/2 В | 30 мА/см2 | Повышение электрохимической устойчивости PbO2 | [77] |
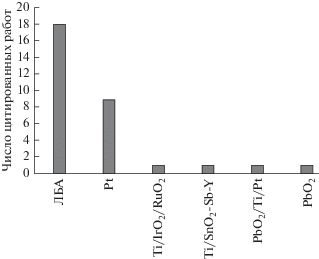
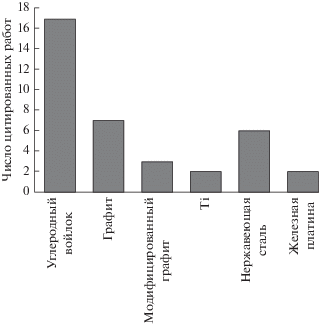
Электрод, содержащий ЛБА, синтезированный методом парофазного химического осаждения c горячего волокна на дырочные монокристаллические кремниевые (100) пластины, использовали Trellu и др. (2016 г.), Bedolla-Guzman и др. (2016 г.), Meijide & Pazos (2016 г.), Rosa-ju и др. (2016 г.) для УПЭО [13, 57, 59, 66 ]. На рис. 1 представлены различные типы анодов, используемых в последние годы исследователями-экологами в процессах электрохимической реакции Фентона. Пригодность титана (Ti), покрытого IrO2, в процессе анодного окисления исследовали Giraldo и др. (2015 г.) для удаления антибиотика оксациллина в водной среде [67]. Vale-Junior и др. (2016 г.) использовали сплав Sn–Cu–Sb в качестве анода в процессе анодного окисления для минерализации кислого синего 29 с использованием нержавеющей стали (НС) в качестве катодного материала [68]. На рис. 2 представлены разнообразные катоды, используемые в последние годы исследователями в процессах электрохимической реакции Фентона. В табл. 4 представлены разнообразные анодные материалы, используемые для электролитической обработки; ЛБА [69], платиновая фольга [70], тонкая пленка ЛБА/лист Pt [71], ЛБА тонкая пленка [72], ЛБА/PbO2 [73], электроды Ti/SnO2–Sb [74], Ti/IrO2/RuO2/TiO2 [75], IrO2–Ta2O5/Ti или PbO2/Ti [76] и TiO2-нанотрубки/SnO2–Sb/PbO2 [77], соответственно. Ю.В. Плесков (2002 г.) в своем обзоре по электрохимии алмаза утверждал, что алмаз представляет собой перспективный электродный материал для применения в электрохимической технологии. Алмаз является перспективным кандидатом среди всех электродных материалов вследствие своей превосходной химической устойчивости. Таким образом, в отличие от других углеродистых материалов, алмазный материал стал предметом электрохимических исследований значительно позже (лишь пятнадцать лет назад). Использование алмазного материала в электрохимических приложениях задерживали, в основном, два фактора. Во-первых, алмаз представляет собой труднодоступный материал, и, во-вторых, он является изолятором. Таким образом, он не может быть непосредственно использован в качестве электродного материала. Поэтому ЛБА стал предметом электрохимических исследований [78]. Плесков и др. (2002 г.) обратили внимание на синтетические полупроводниковые алмазные электроды для исследования электрохимических характеристик на отдельных гранях кристаллов, полученных в условиях высокой температуры и высокого давления. В обзоре [79 ] исследовано влияние кристаллических структур легированного бором алмаза, выращенного в условиях высокой температуры и высокого давления из расплава Ni–Fe–C–B. Плесков и др. (2004 г.) исследовали поведение электродного материала, представляющего собой гомоэпитаксиальные (монокристаллические) легированные бором алмазные пленки, осажденные на имеющие различные ориентации грани диэлектрических алмазных монокристаллов, методами электрохимического импеданса и потенциодинамических кривых. Поведение электродов обычно определяется концентрацией легирующей добавки (бора) в алмазном материале [80]. Плесков и др. (2005 г.) оценили свойства электродов (тонких пленок ЛБА), выращенных на титановых (Ti) подложках методом химического парофазного осаждения с горячих волокон. Условия, модифицирующие поверхность титановой подложки, планируются в соответствии с приданием шероховатости поверхности, затвердеванием и травлением, которые эффективно улучшают свойства электрода. Шероховатость поверхности подложки заметно улучшает адгезию алмазной пленки и уменьшают внутреннее напряжение [81 ] . Плесков и др. (2007 г.) исследовали электрохимическое поведение азотированных нанокристаллических тонкопленочных алмазных электродов. Электрохимическая активность нанокристаллических алмазных электродов, выращенных из микроволновой плазмы, может быть изменена в широких пределах посредством азотирования. Постепенный переход электрода от непроводящего до металлоподобного состояния происходит при увеличении содержания азота в реакционной газовой смеси CH4–Ar–H2–N2 [82]. Плесков и др. (2016 г.) впервые описали электрохимические свойства нового электродного материала, т.е. легированного бором алмазного компакта. Алмазные компакты значительно превосходят традиционные полученные методом химического парофазного осаждения (ХПФО) алмазные тонкопленочные электроды в отношении электродных характеристик. Электроды имеют широкое окно потенциалов, низкий фоновый ток в индифферентных электролитах и улучшенную воспроизводимость. Однако такой модифицированный электрод может быть успешно применен для электрохимической обработки [83]. Y. Dai и G. Swain (2016 г.) исследовали влияние морфологии пленки и определения поверхности на непосредственный перенос электрона в лошадином сердечном цитохроме C на легированных бором ультрананокристаллических и микрокристаллических алмазных тонкопленочных электродах. Константы скорости гетерогенного переноса электронов в диапазоне 2–4 × 10–3 см с–1 были обнаружены для обоих типов алмазных пленочных электродов при прекращении доступа кислорода. Контролируемое диффузией вольтамперометрическое поведение было обнаружено для обоих типов алмазных электродов при отсутствии O2 [84]. H. Zhao и G. Swain (2010 г.) описали электрохимические измерения разряда серотонина (5-гидрокситриптамина) из слизистой оболочки морской свинки методом непрерывной амперометрии с применением микроэлектрода ЛБА. Метод непрерывной амперометрии был применен для алмазного микроэлектрода в целях регистрации уровней серотонина в лабораторных условиях в слизистой оболочке подвздошной кишки по току окисления. Микроэлектрод ЛБА является вполне подходящим для такой цели вследствие его сниженного фонового сигнала, меньшей чувствительности к изменению pH раствора и превосходного сопротивления к загрязнению адсорбированными продуктами окисления серотонина [85]. Электрохимическая обработка содержащихся в воде загрязняющих веществ может быть осуществлена путем непосредственного и опосредованного окисления. В процессе анодного окисления загрязняющие органические вещества разрушаются на поверхности анода без участия других химических реагентов. Органические соединения в сточной воде разлагаются до более простых молекул меньших размеров, таких как диоксид углерода (CO2), под действием гидроксильных (●OH) радикалов, электрогенерированных при разряде воды. Кроме того, в опосредованном электрохимическом процессе содержащиеся в воде загрязняющие вещества могут быть также удалены путем опосредованного электролиза с производством на месте применения химических реагентов, которые превращают загрязняющие вещества в менее токсичные продукты. Kapalka и др. (2010 г.) исследовали непосредственное и опосредованное электрохимическое окисление свободного аммиака в воде на электроде ЛБА. Окисление аммиака в водной среде осуществлялось посредством активного свободного хлора. Электрохимическое окисление активным хлором привлекло особое внимание вследствие значительного присутствия хлоридов в сточной воде. Частицы активного хлора могут быть эффективно использованы для удаления аммиака в кислой среде [86]. He и др. (2015 г.) исследовали непосредственное и опосредованное электрохимическое окисление аммиака в водной среде на Ru-Ir/TiO2 при нейтральном pH с использованием непрерывного электрохимического четырехугольного реактора. Опосредованное окисление для удаления аммиака, которое вызывают свободные радикалы активного хлора, усиливается при увеличении концентрации хлоридов в сточной воде. Аммиак может превращаться в другие азотистые соединения путем непосредственного анодного окисления в течение электрохимической обработки. Непосредственное электрохимическое окисление аммиака создает многочисленные преимущества. Таким образом, крупномасштабные приложения были значительно задержаны вследствие недостаточной эффективности и высокой стоимости электродов [87].
Рис. 1.
Сравнение анодов, используемых в последнее время в процессах электрохимической реакции Фентона.

Рис. 2.
Сравнение катодов, используемых в последнее время в процессах электрохимической реакции Фентона.
Процессы анодного окисления в электрохимической технологии определяются как процессы, которые способны осуществлять окисление содержащихся в воде загрязняющих органических веществ в ходе непосредственных или опосредованных окислительных процессов, происходящих на поверхности анода в электрохимической ячейке. Это означает, что данные окислительные процессы не должны обязательно осуществляться на поверхности анода, но должны быть инициированы на его поверхности. В табл. 4 представлены данные для процессов электрохимической обработки сточной воды, включая размеры электродов, расстояние между электродами в электролитической ячейке, используемый фоновый электролитный раствор, плотность тока и эффективность удаления соответствующих содержащихся в воде загрязняющих органических веществ. Эти данные имеют очень большое значение для такой усовершенствованной обработки сточной воды вследствие их серьезного влияния на эффективность удаления загрязняющих органических веществ, содержащихся в сточной воде. Bounab и др. (2016 г.) попытались использовать пеноникель в качестве рабочего электрода для удаление фенольных производных, включая м-крезол и трет-бутилгидрохинон, в процессах электрохимической реакции Фентона [88].
Эффективность обработки в процессе электрохимической реакции Фентона полностью зависит от эффективности катодного материала, используемого в данном процессе. Таким образом, катодный материал также известен в качестве рабочего электрода. В табл. 5 представлены различные типы катодных материалов, используемых в процессах электрохимической реакции Фентона. Графитовый войлок, модифицированный техническим углеродом и PTFE [1], углеродный войлок [39], содержащий углеродный войлок и оксид железа электрод [89], электрод с диффузией воздуха (ЭДВ) [12], графитовый электрод, модифицированный наночастицами Fe2O3 [90], модифицированный стеклоуглеродный электрод [91], трехмерный углеродный войлочный катод [42], вращающийся графитовый диск [38], покрытый углеродом пеноникель [92], активированное углеродное волокно (АУВ) [46], нержавеющая сталь [48], графитовый войлок (ГВ), активированный KOH при высокой температуре [93], смешанные оксиды металлов на основе Ti (Ti/СОМ) [94], модифицированная техническим углеродом и политетрафторэтиленом (ТУ-ПТФЭ) графитовая мембрана [52], щетка из углеродного волокна на основе полиакрилонитрила представляют собой некоторые рабочие электроды (катодные материалы), используемые в последнее время в процессах электрохимической реакции Фентона для очистки сточной воды [95]. Разнообразные типы анодных и катодных материалов, которые используются в последнее время исследователями для процессов анодного окисления, представлены на рис. 3 и рис. 4 соответственно. В табл. 4 представлена подробная информация в отношении электродов, включая их размеры, плотности тока, используемые для процесса очистки воды от соответствующих загрязняющих веществ, эффективность процесса с использованием соответствующего фонового электролита. Paramo-Vargas и др. (2015 г.) использовали катодные материалы трех различных типов (TiRuO2/углеродный войлок, TiPdPtOx/CF и ЛБА/CF) для обработки стока от бойни в процессе электрохимической реакции Фентона, причем уменьшение ХПК составило 83.5, 77.9 и 74.3%, соответственно, при pH 3 [96]. Nauha и др. (2017 г.) использовали железные электроды, которые представляли собой два анода и два катода в форме четырех однополюсных параллельных пластин в электролитической ячейке [97].
Таблица 5.
Типы рабочих электродов, используемых для процессов электрохимического окисления (в частности, для процессов электрохимической реакции Фентона)
| Номер | Загрязняющее вещество/Процесс | Материал электрода и его размеры | Расстояние между электродами/ мМ Fe2+ | Фоновый электролит/ потенциал электрода, В | Применяемая плотность/ сила тока/ скорость потока воздуха/кислорода | Эффективность удаления/pH | Литера-тура | |
|---|---|---|---|---|---|---|---|---|
| Анод | Катод | |||||||
| 1. | Метиленовый синий (МС)/ЭФ | Износостойкий анод (ИСА) внешний диаметр 3 см | Графит войлок, модифицированный техническим углеродом и ПТФЭ 7.690 м2/г |
8 мм/0.3 мМ Fe2+ | 0.05 M Na2SO4 | 50 мА/7 мл/мин | Эффективность удаления МС 90%/3 | [1] |
| 2. | Сульфаметазин/ЭФ | Pt 25 см2 | Углеродный войлок (15 × 4 × 0.5) см | Пирит в качестве источника Fe2+ | 0.05 M Na2SO4 | 100–1000 мА/ 1 л/мин | Снижение полного потребления кислорода на 95% с помощью Pt/3 | [39] |
| 3. | Краситель малахитовый зеленый/ФЭФ | Тонкая пленка ЛБА 3 см2 | Электрод, содержащий углеродный войлок и оксид железа 3 см2 | 1 см/электроосаждение соли железа | 0.05 M Na2SO4/ –1.1 В | 100 мА/см2/ 20 мл/мин | Более высокая скорость процесса ФЭФ, чем ЭФ/3 | [89] |
| 4. | 2,4-Дихлорфенол/ЭФ | Ti/IrO2–RuO2 4 см × 2 см | Электрод с диффузией воздуха (ЭДВ) 3.14 см2 | Модифицированные частицы Fe–C | 0.05 M Na2SO4 | 100 мА/0.4 л/мин | Выше 95% в течение 120 минут/6.7 | [12] |
| 5. | Сточная вода спиртового производства/ЭФ | Графитовый электрод, модифицированный Fe2O3 1 см2 × × толщина 0.1 см | Графитовый электрод, модифицированный Fe2O3 1 см2 × толщина 0.1 см | Расстояние 3 см на 1 см выше дна ячейки | 2.65 V | 51.54 мА/0.2 мл/с | Снижение ХПК на 66.15% | [40] |
| 6. | Фенол/гетерогенный ЭФ | Платиновый провод | Модифицированный стеклоуглеродный электрод 32.3 см2 | Биметаллические аллофановые наноглины Fe–Cu | 0.05 M Na2SO4/ –0.6 В | – | Превращение на 100% в течение 2 часов/3 и 5.5 | [91] |
| 7. | Психоактивный фармацевтический кофеин из воды/ЭФ | Тонкая пленка ЛБА 8 см × 4 см | Трехмерный катод из углеродного войлока 18.5 см × 4.5 см | От 0.1 до 0.5 мМ Fe2+ | 0.05 M Na2SO4 | 100–1500 мА/ 0.2 л/мин | Минимум 93% в течение 2 часов/3 | [42] |
| 8. | Тетрациклин/ЭФ | Графитовый стержень ∅20 мм | Вращающийся графитовый диск ∅80 мм, толщина 8 мм | 2.0 см/ион Fe2+ (1.0 мМ) | Раствор 0.05 M Na2SO4 | – | Полное окисление в течение 2 часов/3 | [41] |
| 9. | Кислый красный 88/ЭФ | Платиновая сетка (99% Pt, 100 меш) |
Катод из углеродного войлока 5 × 10 см |
Ион Fe2+ (0.1 мМ) | Сульфат натрия | 500 мА | Уменьшение полной ХПК на 87% в течение 2 часов/3 | [44] |
| 10. | Обработка стока с бойни/ЭФ | ЛБА 15 × 5 см × × 1 мм |
TiRuO2/углеродный войлок 15 × 5 см × 1 мм |
Ион Fe2+ | – | 2.5 мА/см2 | Уменьшение ХПК на 83.5%/3 | [96] |
| 11. | Диметилфталат (ДМФ)/ЭФ | Платиновая фольга 2.0 × 1.0 см | Покрытый углеродом пеноникель 2.0 × 2.0 см | 0,5 ммоль/л Fe2+ | 0.1 моль/л Na2SO4/–0,5 В | Скорость потока O2 400 мл/мин | Уменьшение полной ХПК на 82.1% в течение 2 часов/3 | [92] |
| 12. | Инсектицид карбарил в воде/ЭФ | Pt или ЛБА Сетка Pt (диаметр 3 см, высота 5 см) | Катод из углеродного войлока, каждая сторона 14 × 5 см, ширина 0.5 см | 1 мМ FeSO4 ⋅ 7H2O | 50 мМ Na2SO4 | 300 мА | Уменьшение полной ХПК на 90% в течение 2 часов/3 | [45] |
| 13. | Сточная вода от газификации угля/ЭФ | Ti/SnO2 4 × 5 см |
Активированное углеродное волокно (АУВ) 4 × 5 см | 5 см/оксид железа, нанесенный на активированный углерод | – | 10–25 мА/см2/ 4 л/мин | Уменьшение ХПК и полной ХПК на 78.1% и 65.5%/6.8 | [46] |
| 14. | Фенольные производные: м-крезол и трет-бутилгидрохинон/ЭФ | ЛБА Площадь поверхности 11 см2 | Пеноникель 11 см2, толщина 1.6 мм | Расстояние 6 см на 1 см выше дна ячейки | 0.01 M Na2SO4/ от –0.3 до 1.5 В | 1 л/мин сжатого воздуха вблизи катода | Ускорение ЭФ в 4 раза за счет катализатора Fe-C/2 | [88] |
| 15. | Противомикробное средство ципрофлоксацин/ЭФ | Цилиндрическая платиновая сетка высота 5 см (внутренний диаметр 3 см) | Углеродный войлок (14 × 5 × 0,5) см | Анод находится в центре и окружен катодом/Fe2+ 0.1 мМ | 0.05 M Na2SO4 | 400 мА | Минимум 94% в течение 6 часов/3 | [47] |
| 16. | Содержание диметилсульфоксида (ДМСО)/ЭФ | Титан, покрытый RuO2/IrO2 Диаметр 7 см |
Нержавеющая сталь, диаметры 2 и 13 см, соответственно | FeSO4 ⋅ 7H2O в качестве источника иона Fe2+ (катализатор) | 50 мМ NaClO4 | 11.3 мА/см2/ 1.5 A эквивалент | Удаление 100% ДМСО/3 | [48] |
| 17. | Диметилфталат (ДМФ)/ЭФ | Платиновая фольга (2.0 × 1.0) см |
Графитовый войлок (ГВ), активированный KOH 2.0 см × 1.0 см |
FeSO4 ⋅ 7H2O | 0.1 моль/л Na2SO4/–0.7 В | – | Генерация H2O2 благоприятна посредством восстановления кислорода/3 | [93] |
| 18. | Тирозол/новый ЭФ | Тонкая пленка ЛБА 6 см2 |
Углеродный войлок 60 см2 |
Пирит | 0.05 M Na2SO4/ 8.1, 12 и 18.2 В | 50–300 мА/скорость потока воздуха 1 л/мин | Эффективность пирита ЭФ-пирит возрастает на 8.6% при 50 мА/3 | [112] |
| 19. | Парацетамол в водной среде/ЭФ | Платиновая фольга | Пористый углеродный катод (ПУВ) (5.0 × 1.0 × 1.27) см | FeSO4 ⋅ 7H2O в качестве источника иона Fe2+ | 0.05 M Na2SO4 | 20–40 мА/см2 | Наблюдаемое улучшение на 31% | [113] |
| 20. | Краситель метиловый оранжевый/ЭФ | Сетка Ti/IrOx–TiO2/IrO2 | Щетка из углеродного волокна на основе полиакрилонитрила | FeSO4 ⋅ 7H2O в качестве источника иона Fe2+ | 0.1 моль/л Na2SO4/–1.1 В | 200–800 мА/см2 | Быстрое удаление цвета в течение 5 минут/3 | [95] |
| 21. | Краситель 4-амино-3-гидрокси-2-п-толилазо-нафталин- 1-сульфоновая кислота/ЭФ | Тонкая пленка ЛБА 6 см2 | Куски углеродного войлока 60 см2 | Пирит | Безводный сульфат натрия | 100–450 мА/ 1 л/мин | 100% в течение часов | [114] |
| 22. | Катехин/ГЭФ | Платиновый лист 4 × 5 × 0.1 см | Активированное углеродное волокно 4 × 5 × 0.1 см | Наночастицы Fe3O4 | – | 10 мА/см2 | Полное разложение в течение 120 минут/3 | [115] |
| 23. | Трициклазол/ЭФ | Ti/IrO2–Ta2O5 L30 × ∅30 1.5 мм | Графитовая мембрана, модифицированная техническим углеродом и политетрафторэтиленом L30 × ∅55 × 2.5 мм | FeSO4 ⋅ 7H2O в качестве источника иона Fe2+ | 0.05 M Na2SO4/ 2.6–3.2 В | 2.5–12.5 А/м2 | Степень удаления 79%/3 | [52] |
| 24. | Удаление пестицидов из грунтовой воды/ЭФ | Лист ЛБА 11 см2 | Графитовый лист | Применение железа, нанесенного на цеолит Y | 0.01 M Na2SO4 | Скорость потока воздуха 1 л/мин | /3 | [116] |
| 25. | Краситель новакрон синий/ЭФ | Титан (Ti/Pt) | Углеродный войлок газодиффузионный O2 катод | FeSO4 · 7H2O | 0.5 M Na2SO4 | 100–800 мА | Уменьшение ХПК на 90%/3 | [117] |
| 26. | Ацетаминофен/ЭФ | Титан IrO2/RuO2 300 см2 | Нержавеющая сталь 300 см2 | (FeSO4 ⋅ 7H2O) | – | 1.5 A | Степень эффективности 74% | [118] |
| 27. | Бисфенол A/ЭФ | Смешанные оксиды металлов на основе Ti | Смешанные оксиды металлов на основе Ti (Ti/СОМ) 85 × 15 × 1.8 мм | (FeSO4 ⋅ 7H2O) | Na2SO4/1.12 В | 25 мА | Полное разложение в течение 20 минут/4 | [94] |
| 28. | Имидаклоприд/ЭФ | Тонкая пленка ЛБА, осажденная на кремниевый лист 4.5 см2 | Оксид железа, выращенный на объемном активированном углеродном аэорогеле (FeOx/АУА) 4.5 см2 | 2 см | 0.05 M Na2SO4 | 10 мА/см2/ 0.02 м3/час | Уменьшение полной ХПК на 93% в течение 150 минут/7 | [119] |
4. КИНЕТИКА УСОВЕРШЕНСТВОВАННЫХ ПРОЦЕССОВ ЭЛЕКТРОХИМИЧЕСКОГО ОКИСЛЕНИЯ
Разложение водных органических соединений, в частности, ароматических соединений посредством усовершенствованных процессов электрохимического окисления может быть представлено следующим образом:
Процессы окисления, включающие генерацию имеющих высокую реакционную способность и низкую селективность частиц, т.е. гидроксильных радикалов (•OH), в настоящее время представляют интерес для разложения содержащихся в воде органических соединений [120]. Концентрация гидроксильных радикалов принимает постоянное значение во время обработки сточной воды. Скорость разложения органических соединений в сточной воде может быть представлена следующим образом:
Поскольку концентрация гидроксильных радикалов в растворе находится в стационарном состоянии, kabs[HO●] равняется kapp, где kabs и kapp представляют собой абсолютную и кажущуюся константы скорости, соответственно. Значение kabs может быть определено методом кинетической конкуренции с использованием бензойной кислоты в качестве стандартного субстрата, у которого значение kabs составляет 4.3 × 109 л/моль с [121, 122]. Приведенное выше выражение может быть переписано следующим образом:
Интегрирование приведенного выше выражения дает следующее кинетическое уравнение первого порядка для электрохимического процесса Фентона:
5. ФАКТОРЫ, ВЛИЯЮЩИЕ НА УСОВЕРШЕНСТВОВАННЫЕ ПРОЦЕССЫ ЭЛЕКТРОХИМИЧЕСКОГО ОКИСЛЕНИЯ
5.1. pH
Все усовершенствованные процессы электрохимического окисления, включая процессы анодного окисления и электрохимической реакции Фентона, проявляют сильную зависимость от такого важного параметра, как pH. Согласно большинству опубликованных данных в отношении процесса Фентона, оптимальное значение pH составляет приблизительно 3 [110, 123, 124]. В существующем процессе Фентона частицы железа начинают осаждаться в форме гидроксидов железа(III) при более высоких значениях pH, что снижает активность реагента Фентона. Кроме того, в щелочной среде также ускоряется разложение H2O2. При этом частицы железа образуют устойчивые комплексы с окислителем (пероксидом водорода) при пониженных значениях pH, приводя к деактивации катализаторов. Это значительно уменьшает эффективность разложения содержащихся в воде загрязняющих органических веществ. Увеличение pH раствора не влияет существенно на скорость обесцвечивания в случае красителей. Maria и др. (2014 г.) исследовали разложение красителя новакрона синего при изменении начального значения pH, составлявшего 3.0, 4.0 и 6.0, в ходе процесса электрохимической реакции Фентона [117]. Максимальное уменьшение ХПК составляло 68 и 90% после электролиза в течение 4 ч током 200 и 400 мА при pH 3. При pH > 3.0 скорость обесцвечивания уменьшалась вследствие окислительного потенциала радикалов ●OH и уменьшения концентрации растворенных частиц железа при увеличении pH. При обработке в процессе анодного окисления влияние pH проявляет сильную зависимость от природы содержащихся в воде загрязняющих органических веществ и фонового электролита, используемого для электролиза. Таким образом, влияние pH на скорость обесцвечивания нитробензола (НБ) было исследовано в широком диапазоне значений pH от кислых до основных [73]. Разложение НБ при pH 3 является более эффективным, чем разложение в щелочной и нейтральной среде. Это происходит вследствие значительного окисления и/или химической модификации поверхности электрода (анода). Очень важно исследовать влияние pH на процентную эффективность удаления соответстувующего загрязняющего вещества, содержащегося в воде, потому что может изменяться значение pH в промышленной сточной воде. В табл. 6 представлены недавно опубликованные данные, включая оптимальные значения pH, соответствующие рабочие условия и показатели эффективности очистки.
Таблица 6.
Оптимальные значения pH для УПЭО в недавно опубликованных работах
| Номер | Загрязняющее вещество/процесс | Электроды | Оптимальное значение pH | Эффективность, % | Время | Литера-тура |
|---|---|---|---|---|---|---|
| 1. | Бытовая сточная вода/ЭФ | Железные пластины | 4 | Снижение ХПК 90% | 14 мин | [125] |
| 2. | Очистка сточной воды спиртового производства/ЭФ | Графитовые электроды, покрытые железом | 2.84 | Снижение ХПК 66.15% | 69.29 мин | [40] |
| 3. | 2,4-Дихлорфенол/ЭФ | Модифицированный железо–углеродный электрод | 6.7 | Эффективность удаления 95% | 120 мин | [126] |
| 4. | Метиленовый синий/АО | ЛБА–нержавеющая сталь | 6.2 | Снижение ХПК 81% | 6 ч | [72] |
| 5. | Нитробензол/АО | ЛБА/PbO2–графитовая пластина | 3 | Разложение 88% | 8 ч | [73] |
| 6. | o-Нитрофенол/АО | ЛБА/PbO2–графитовая пластина | 3 | Разложение 92% | 8 ч | [109] |
| 7. | Сточная вода от автомобильной мойки/ЭФ | Железные электроды | 3 | Снижение ХПК 80.8% | 20.3 мин | [127] |
5.2. Температура
По сравнению с другими факторами, температурный параметр производит положительное воздействие на процентную эффективность удаления содержащихся в воде органических соединений в процессах Фентона и подобных процессах. Может наблюдаться отрицательное воздействие температуры, если она является чрезмерно высокой или чрезмерно низкой. Температурный диапазон от 20 до 30°C (комнатная температура или мягкие условия) может рассматриватся в качестве оптимального диапазона для усовершенствованных процессов электрохимического окисления вследствие относительно высокой процентной эффективности удаления содежащегося в воде загрязняющего вещества в данном температурном диапазоне. Ammar и др. (2015 г.) использовали открытую бездиафрагменную цилиндрическую двухэлектродную стеклянную ячейку, имеющую объем 250 мл и двойную рубашку для циркуляции внешней термостатированной воды в целях регулирования температуры электролитической ячейки на уровне 25°C для разложения тирозола [49]. Тирозол представляет собой один из фенольных компонентов сточной воды от производства оливкового масла. При использовании пирита в качестве гетерогенного катализатора в процессе Фентона эффективность процесса увеличивалась на 8.6% при плотности тока 50 мА. Процесс был просто оптимизирован посредством использования пирита по отношению к гомогенному типу процесса Фентона. Garcia-Segura и др. (2016 г.) сделали попытку разложения ионных жидкостей на основе пиридиния и имидазолия в водной среде с использованием ячейки, имеющей аналогичную конфигурацию и объем 100 см3, при 35°C [105]. Разложение осуществляли различными путями усовершенствованных процессов электрохимического окисления, таких как анодное окисление, электрохимическая реакция Фентона и фотоэлектрохимическая реакция Фентона, используя ЛБА в качестве анода и катод с диффузией воздуха. Температура представляла собой постоянный параметр во всех процессах. В ходе фотоэлектрохимической реакции Фентона при высокой плотности тока обе ионные жидкости претерпевали полную минерализацию, которая была такой же или ниже в процессах АО–H2O2 и ЭФ. Было доказано, что скорость реакции разложения возрастала при увеличении значения температуры реакции. Hou и др. (2015 г.) варьировали температуру реакции от 10 до 35°C для гетерогенной электрохимической реакции Фентона (окисление катехина) с использованием нано-Fe3O4. Разложение катехина составляло 45% и более чем 90% в течение 120 мин при температурах 25 и 40°C соответственно [115]. Petrucci и др. (2016 г.) сравнивали три материала на основе углерода, включая графит, углеродный войлок и сетчатый стеклоуглерод (ССУ), в качестве катодов в процессе электрохимической реакции Фентона. Влияние температуры исследовали, осуществляя в гальваностатическом режиме электролиз в двухкамерном реакторе, имеюющим катионную мембрану, при наблюдении концентрации растворенного кислорода (РО) [43]. Уменьшение температуры влияло на концентрацию РО, которая составляла 23, 31 и 50 мг/л O2 при температуре 40, 25 и 10°C соответственно. Несмотря на результаты, полученные в диапазоне температур, для процессов были выбраны мягкие условия. В табл. 7 представлены оптимальные температуры и соответствующие эффективности удаления, полученные различными исследователями.
Таблица 7.
Оптимальные температуры усовершенствованных процессов электрохимического окисления согласно недавно опубликованным работам
| Номер | Загрязняющее вещество/процесс | Электроды | Экспериментальные условия | Темпера-тура | Эффектив-ность, % | Литера-тура |
|---|---|---|---|---|---|---|
| 1. | Тирозол/ЭФ | ЛБА–углеродный войлок | 0.3 мМ тирозола с 0.05 M Na2SO4, 1 г/л пирита, 0.2 мМ Fe2+, pH 3, 300 мА | 25°C | Снижение полной ХПК 89 | [112] |
| 2. | Сточная вода от газификации угля (СГУ)/ЭФ | Ti/SnO2–углеродное волокно | 1 л СГУ после биологической обработки с использованием оксида железа на активированном угле, полученном из канализационного ила | 25°C | Снижение ХПК 78.1 | [46] |
| 3. | Оранжевый G/АО | ЛБА–нержавеющая сталь | 100 см3 0.52 ммоль дм–3 красителя, 0,5 моль дм–3 Na2SO4, pH 3, 100 мА | 35°C | Удаление 100 | [56] |
| 4. | Сточная вода от производства вискозы/ЭФ | Железо–графиты | ХПК 2400 мг/л, доза H2O2 1530 мг/л, 0.90 A/дм2, pH 3 | 25°C | Снижение ХПК 88 | [128] |
5.3. Применяемая плотность тока
Lai и др. (2013 г.) использовали анодный материал Ti/RuO2–IrO2 для окислительного разложения ализарина красного S (АК-S) в водных растворах посредством УПЭО [129]. Указанное значение плотности тока (от 2.5 до 10 мА см–2) может повышать скорость образования пероксида водорода и, следовательно, гидроксильных радикалов (●OH) с использованием углеродного войлока в качестве рабочего электрода. На аноде Ti/RuO2–IrO2 могут образовываться радикалы двух типов, т.е. RuO2(•OH) и IrO2(•OH), согласно реакциям (7) и (8). Содержащиеся в воде органические соединения на аноде Ti/RuO2–IrO2 могут окисляться этими радикалами. Скорость электрогенерации этих радикалов на аноде может увеличиваться при увеличении значения плотности тока, что улучшает анодное окисление АК-S.
(7)
${\text{Ru}}{{{\text{O}}}_{{\text{2}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{Ru}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{H}}{{{\text{O}}}^{{ \bullet }}}} \right){\text{ + }}{{{\text{H}}}^{{\text{ + }}}}{\text{ + e,}}$(8)
${\text{Ir}}{{{\text{O}}}_{{\text{2}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{Ir}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{H}}{{{\text{O}}}^{{ \bullet }}}} \right){\text{ + }}{{{\text{H}}}^{{\text{ + }}}}\,{\text{ + e}}{.\;}$Значение плотности тока определяет анодное окисление и, таким образом, образование пероксида водорода, что представляет собой важный параметр УПЭО и, следовательно, влияет на эффективность обработки сточной воды [126]. Чтобы исследовать влияние плотности тока на разложение 2,4-дихлорфенола, ее значение варьировали от 50 до 200 мА. Результаты показывают, что эффективность разложения 2,4-дихлорфенола составляла только 79.9% в течение 120 мин при 50 мА, но увеличивалась почти до 100% при 100, 150 и 200 мА соответственно. В нескольких недавних исследованиях обнаружено, что значение плотности тока в УПЭО не должно составлять более чем 15 мА см–2, хотя некоторые исследователи указали, что верхнее предельное значение должно составлять более чем 15 мА см–2. В табл. 8 представлены оптимальные значения используемого тока или плотности тока и соответствующие эффективности удаления в усовершенствованных процессах электрохимического окисления.
Таблица 8.
Оптимальные значения тока/плотности тока усовершенствованных процессов электрохимического окисления в недавно опубликованных работах
| Номер | Загрязняющее вещество/процесс | Электроды | Экспериментальные условия | Используемая сила/плотность тока | Эффектив-ность удаления, % | Литера-тура |
|---|---|---|---|---|---|---|
| 1. | 2,4-дихлорфенол (2,4-ДХФ)/ЭФ | Катод с диффузией воздуха Ti/IrO2–RuO2 | 120 мг/л 2,4-ДХФ, Fe–C 6 г/л, pH 6.7 | 100 мА | 95 | [126] |
| 2. | Ализариновый красный S (АК-S)/ЭФ | Ti/RuO2–IrO2–углеродный войлок | 0.1 мМ Fe2+, 400 мл раствора АК-S, скорость аэрации 1000 мл/мин, pH 2.8 | 10 мА см–2 | 87 | [129] |
| 3. | Краситель малахитовый зеленый/ЭФ | ЛБА–чистый углеродный войлок | 100 мл 50 мг/л малахитового зеленого, pH 3 | 21.7 мА см–2 | 85 | [89] |
| 4. | Сточная вода от коксовой печи/АО | Новый PbO2– графит | 1 г/л NaCl, pH 3.95 | 6.7 мА см–2 | 87.8 для ХПК | [102] |
| 5. | Азокраситель реактивный желтый 160 (РЖ160)/ФЭФ | ЛБА–ЭДВ | 100 см3 0.167 ммоль дм–3 РЖ160, 0.5 ммоль дм–3 Fe2+, pH 3, 25°C | 100 мА см–2 | 94 | [59] |
5.4. Концентрация пероксида водорода
В процессе электрохимической реакции Фентона для обработки содержащихся в воде органических соединений окислитель представляет собой пероксид водорода (H2O2), электрогенерация которого происходит на рабочем электроде, т.е. на катоде. Как правило, в качестве катода используют углеродный войлок [45], электрод с диффузией воздуха [126]. Электрогенерация H2O2 усиливается на катоде, имеющем большую площадь поверхности, вследствие пористой структуры электрода, которая поддерживает массоперенос газа [119]. Maria и др. (2014 г.) провели ряд исследований для оценки начальной концентрации электрохимически генерированного пероксида водорода при различных значениях используемого тока [117]. Было обнаружено изменение значений концентрации H2O2 в зависимости от продолжительности реакции, а также используемого тока. Gong и др. (2016 г.) исследовали частичное разложение левофлоксацина (ЛЕВО) в процессе электрохимической реакции Фентона для улучшения биоразлагаемости с использованием катода из войлока на основе активированного углеродного волокна в качестве рабочего электрода [41]. Быстрое уменьшение полной ХПК наблюдалось при увеличении значения плотности тока от 2.22 до 6.67 мА см–2, что предполагало увеличение окислительной способности электролитической системы. Это может быть вполне обусловлено увеличением количества электрогенерированных ●OH в среде реакции Фентона (9) вследствие увеличения начальной концентрации пероксида водорода.
(9)
${\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{ + }}{{{\text{H}}}^{{\text{ + }}}} \to {\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O + H}}{{{\text{O}}}^{{ \bullet }}}.$Уменьшение полной ХПК было отмечено вследствие дальнейшего увеличения значения плотности тока до 6.67 мА см–2, что было обусловлено разложением H2O2 до O2 на аноде или в водной среде, а также промежуточным образованием радикалов ${\text{HO}}_{2}^{\centerdot }$ в процессе анодного окисления.
5.5. Концентрация Fe2+
Ион Fe2+ играет важную роль в инициировании разложения H2O2 с образованием •OH в процессе реакции Фентона согласно уравнению (3). Таким образом, высокие концентрации Fe2+ препятствуют процессу минерализации посредством расходования •OH при более высокой скорости согласно уравнению (10) [93].
(10)
${\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}}{\text{ + H}}{{{\text{O}}}^{{ \bullet }}} \to {\text{F}}{{{\text{e}}}^{{{\text{3 + }}}}}{\text{ + H}}{{{\text{O}}}^{ - }}.$Таким образом, существует необходимость соответствующего регулирования концентрации ионов Fe2+. Оптимальное значение концентрации ионов Fe2+ составило 0.5 ммоль/л для разложения диметилфталата (ДМФ). Наиболее часто соотношение H2O2/Fe2+ использовали для исследования процесса электрохимической реакции Фентона для удаления содержащихся в воде органических соединений. Снижение ХПК для обработки сточной воды от спиртового производства увеличивалось от 45.7 до 60.8%, когда молярное соотношение H2O2/Fe2+ изменялось от 0.5 до 3 мл/л при обработке в течение 1 ч. Это увеличивает концентрации H2O2 и Fe2+ в растворе [40]. Однако было четко отмечено, что на скорость окисления значительно влияет концентрация катализатора (Fe2+). Скорость разложение тиометоксама слегка повышается при увеличении значения концентрации железа вплоть до 0.2 мМ, а затем скорость резко уменьшается при концентрациях выше 0.3 мМ [57]. При обработке для удаления психоактивного кофеина из воды в процессе электрохимической реакции Фентона с использованием ЛБА в качестве анодного материала разложение кофеина происходило очень быстро для любого набора параметров, включающих плотность тока и концентрацию катализатора, т.е. Fe2+ [42]. В табл. 9 представлены оптимальные значения концентрации катализатора (Fe2+) и соответствующие эффективности удаления согласно недавно опубликованным данным.
Таблица 9.
Оптимальная концентрация ионов железа(II) (Fe2+) для усовершенствованных процессов электрохимического окисления согласно недавно опубликованным работам
| Номер | Загрязняющее вещество/процесс | Электроды | Экспериментальные условия | Концентрация Fe2+ | Эффектив-ность удаления, % | Литера-тура |
|---|---|---|---|---|---|---|
| 1. | Психоактивный фармацевтический кофеин из воды/ЭФ | ЛБА–углеродный войлок | 200 мл 0.1 мМ кофеина с 0.05 M Na2SO4, 300 мА | 0.2 мМ | >90 | [42] |
| 2. | Метиленовый синий (МС)/ЭФ | ИСА–модифицированный графитовый войлок | 50 мг/л НС, 0.05 M Na2SO4, I = 50 мА, pH 3 | 0.3 мМ | 90 | [1] |
| 3. | Краситель новакрон синий (НС)/ЭФ | Ti/Pt–газодиффузионный O2 | 190 мг/л красителя НС, 0.5 M Na2SO4, I = 400 мА, pH 3, T = 25°C | 1.0 мкм | 90 ХПК | [117] |
5.6. Расстояние между электродами
В усовершенствованных процессах электрохимического окисления расстояние между электродами представляет собой еще один существенный параметр, который может влиять на удаление содержащихся в воде загрязняющих органических веществ. Наблюдается уменьшение напряжения электролитической ячейки и расходуемой энергии при уменьшении сопротивления фонового электролита, когда уменьшается расстояние между электродами. Ионы, генерированные на рабочих электродах, проявляют повышенное взаимное электростатическое притяжение при минимальном расстоянии между электродами. Кроме того, они регулярно сталкиваются, соединяются с содержащимися в воде органическими соединениями, коагулируют, производят хлопья и осаждаются [123]. Генерация ионов уменьшается вследствие увеличения расстояния между электродами и, следовательно, увеличения сопротивления между электродами. Таким образом, минимальное расстояние между электродами всегда является предпочтительным для достижения максимального обесцвечивания. Каталитическое количество Fe2+ легко окисляется до Fe3+ на аноде при сокращении расстояния между электродами, и при этом увеличение расстояния между электродами создает ограничение для переноса ионов железа(III) на поверхность катода, что приводит к регенерации ионов железа(II). Xu и др. (2013 г.) провели эксперименты по обесцвечиванию и разложению кислого красного 73 (цветной индекс) в ходе анодного окисления в сочетании с нанофильтрацией, используя в качестве электродов титановую фольгу Ti/SnO2-Sb-Y при расстоянии между электродами, составляющем 2 см [74]. He и др. (2015 г.) исследовали электрохимическое удаление аспирина на электродах, включая PbO2, ЛБА и пористый Ti/ЛБА–Ti/RuO2–TiO2–SnO2, при расстоянии между электродами 10 мм в однокамерной ячейке без диафрагмы [11].
5.7. Природа фонового электролита
Фоновый электролит увеличивает проводимость, уменьшает сопротивление и, таким образом, сокращает стоимость процесса. По этим причинам электролит является важным для электролитической обработки, в частности, в растворах без достаточной проводимости [67]. При этом сульфатные, нитратные, бикарбонатные и хлоридные соли представляют собой фоновые электролиты, которые чаще используются для такой обработки. В усовершенствованных технологических процессах электрохимического окисления раствор 0.05 M сульфата натрия (Na2SO4) чаще используется в качестве фонового электролита в электролитических экспериментах [42]. Giraldo и др. (2015 г.) оценили влияние типа фонового электролита на разложение антибиотика оксациллина в воде в процессе анодного окисления с использованием анодов Ti/IrO2 [67]. NaCl оказался наилучшим фоновым электролитом для удаления антибиотика оксациллина. В реальности он снижает концентрацию до нуля при обработке в течение лишь 4 мин. Хлорсодержащие окислители ответственны за быстрое удаление содержащихся в воде органических соединений при электрохимической обработке. Тип и концентрация фонового электролита обычно ограничивают эффективность процесса анодного окисления. Таким образом, были проведены эксперименты по обработке 100 мл кислого синего (КС) 29 (60 мг/л) при pH 7.0 с применением тока 10 мА/см2 на аноде Sn–Cu–Sb для растворов 0.05 M фоновых электролитов различных типов (Na2SO4, NaNO3 и NaCl) [68]. Кинетика явления обесцвечивания зависит от используемого фонового электролита и ускоряется в последовательности: NaCl $ \gg $ Na2SO4 ~ NaNO3. Окисление аниона хлора на поверхности анода приводит к образованию молекулы хлора (уравнение 11), которая быстро гидролизуется с образованием HClO (уравнение 12), а также Cl– по реакции диспропорционирования. При этом хлорноватистая кислота находится в кислотно-основном равновесиии с гипохлоритными анионными частицами согласно уравнению (13), причем pKa составляет 7.55.
(11)
${\text{2C}}{{{\text{l}}}^{{\text{--}}}} \to {\text{C}}{{{\text{l}}}_{{\text{2}}}}\,\,{\text{ + 2e,}}$(12)
${\text{C}}{{{\text{l}}}_{{\text{2}}}}\,\,{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{HClO + C}}{{{\text{l}}}^{{\text{--}}}}{\text{ + }}{{{\text{H}}}^{{\text{ + }}}}{\text{,}}$(13)
${\text{HClO}} \leftrightarrow {{{\text{H}}}^{{\text{ + }}}}\,\,{\text{ + }}\,\,{\text{Cl}}{{{\text{O}}}^{{\text{--}}}}{\text{.}}$Частицы Cl2, HClO и ClO– имеют высокую окисляющую способность и несут ответственность за быстрое удаление содержащегося в воде органического вещества и обесцвечивание растворов КС 29 при pH 7.
6. ПРИМЕНЕНИЯ УСОВЕРШЕНСТВОВАННЫХ ПРОЦЕССОВ ЭЛЕКТРОХИМИЧЕСКОГО ОКИСЛЕНИЯ
В последнее время исследователи проявляют огромный интерес к улучшению и постоянной разработке практичских применений усовершенствованных процессов электрохимического окисления для удаления содержащихся в сточной воде органических соединений. Далее эти практические применения разъясняются подробно.
6.1. Красители
Синтетические красители широко используются для окраски текстильных материалов, бумаги, пищевых продуктов, напитков, фармацевтических препаратов и красок. Из числа красителей 70% промышленных красителей предствляют собой азокрасители. При этом азокрасители являются наиболее важным классом в классификации красителей [107]. Для текстильного производства расходуется большое количество воды и, таким образом, синтетических красителей для обработки, что означает образование большого количества промышленной сточной воды, содержащей красители [129]. Исследователи проявляют интерес к поиску альтернативных эффективных, экономичных и экологичных средств для удаления азокрасителей. Kourdali и др. (2014 г.) исследовали разложение азокрасителя прямого желтого 9 в процессе электрохимической реакции Фентона и оптимизированное снижение токсичности воды с использованием каталазы [130]. Моделирование поверхности отклика (МПО) было использовано для исследования оптимизации, причем были исследованы различные экспериментальные параметры в целях максимального разложения азокрасителя прямого желтого при минимальных затратах энергии. El-Ghenymy и др. (2015 г.) исследовали обесцвечивание и минерализацию трифенилметанового красителя малахитового зеленого посредством сравнительного использования процессов электрохимического окисления, включая анодное окисление, электрохимическую реакцию Фентона и фотоэлектрохимическую реакцию Фентона, и описали полное разложение в течение 6 минут и минерализацию на 97% в течение 240 мин в процессе фотоэлектрохимической реакции Фентона с применением ЛБА [131]. Процесс электрохимической реакции Фентона оказался мощным средством для весьма эффективного удаления красителей из сточной воды. Ozcan и др. (2016 г.) исследовали разложение кислого красного (КК) 88, используя метод электрохимической реакции Фентона для очистки воды, и сделали вывод, что данный процесс является эффективным для удаления (снижение на 87% полной ХПК для раствора 0.25 мМ КК88) при использовании тока 500 мА [44]. Moreira и др. (2013 г.) оценили скорость обесцвечивания и минерализации 100 мл раствора 290 мг/л азокрасителя желтый закат (ЖЗ) в процессах анодного окисления, электрохимической реакции Фентона, электрохимической реакции Фентона под действием ультрафиолетового излучения в диапазоне A (ФЭФ), а также электрохимической реакции Фентона под действием солнечного излучения (СФЭФ) [58]. Было обнаружено, что краситель ЖЗ полностью обесцвечивался с сопоставимой скоростью в процессах ЭФ, ФЭФ и СФЭФ соответственно. Florenza и др. (2014 г.) исследовали растворы 236 мг/дм3 азокрасителя кислого красного 1 (КК1) посредством анодного окисления с последующими опосредованными электрохимическими процессами на основе химической реакции Фентона. Эффективность обесцвечивания КК1 оказалась сопоставимой в процессах ЭФ и ФЭФ вследствие ускоренного разложения органических ароматических соединений гидроксильными радикалами, генерированными в объеме [63]. Для каждого анода, представляющего собой рабочий электрод, повышение окислительной способности наблюдалось в последовательности АО-H2O2 < ЭФ < ФЭФ. Akrout и др. (2015 г.) применили технологический процесс анодного окисления для улучшенного удаления метиленового синего, используя ЛБА в сочетании с адсорбцией на опилках и наблюдали обесцвечивание на 98% и снижение ХПК на 81% при использовании высокого содержания опилок (12 г/л) в течение 1 ч [72]. Обесцвечивание и разложение кислого красного 73 (КК 73) было исследовано в ходе процесса электрохимической обработки посредством анодного окисления и синергетической технологии анодного окисления в сочетании с нанофильтрацией с использованием электродов из легированного иттрием Ti/SnO2–Sb [74]. Был сделан вывод, что синергетическая технология анодного окисления в сочетании с нанофильтрацией представляет собой перспективную технологию для снижения расхода энергии анодного окисления. Удаление азокрасителя кислого красного 18 (AR18) из водной среды было исследовано с использованием реактора, имеющего объем 500 мл и содержащего внутри себя два железных электрода, расположенных параллельно. Почти полное обесцвечивание наблюдалось в следующих оптимальных условиях: pH 3, напряжение 30 В, концентрация окислителя 1 мл/л, концентрация фонового электролита 100 мг/л, расстояние между электродами 1 см [132]. Amanjit и др. (2017 г.) описали процессы катодной электрохимической реакции Фентона и электрохлорирования на аноде, которые были исследованы для окисления и обесцвечивания красителя реактивный черный 5 (РЧ 5). Таким образом, раздельно наблюдали реакции на поверхности катода и каталитическую активность анода с использованием графита в качестве электродного материала. Результаты показывают, что углеродный материал оказался чрезвычайно эффективным в качестве катода, в то время как в качестве анодного материала углерод проявляет менее высокую устойчивость вблизи соответствующего потенциала выделения кислорода [133]. Mousavi и др. (2017 г.) оценивали эффективность процесса Фентона для удаления красителя реактивного красного 2 из водной среды. Полученные результаты показывают, что концентрации окислителя (пероксид водорода) и ионов железа влияют на максимальное значение эффективности удаления красителя реактивного красного 2 [134]. Malak и др. (2017 г.) применили процесс анодного окисления для минерализации текстильного красителя бромтимолового синего (БТС) с использованием ЛБА в качестве анодного материала и углеродного войлока в качестве катода. Конечные результаты показывают разложение на 94%, а также снижение на 59 и 52% ХПК и полной ХПК, соответственно, в течение 360 мин [135]. Ghosh и др. (2012 г.) описали исследование обесцвечивания красителей метиленового синего и титанового желтого в водном растворе с использованием процесса электрохимической реакции Фентона с железом в качестве анода и графитом в качестве катода. В оптимальных условиях, включающих pH 3, 1 мМ окислителя и значение плотности тока 4.31 мА/см2 при продолжительности реакции, составляющей 60 мин, процентное обесцвечивание водных растворов 100 мг/л красителей метиленового синего и титанового желтого составляло приблизительно 98 и 96%, соответственно [136]. При использовании аналогичного типа реакционной системы для процесса электрохимической реакции Фентона в целях обесцвечивания диазокрасителя трипанового синего (ТС) приблизительно 86.08% обесцвечивание было получено в экспериментальных условиях, включающих pH 3, 35 мМ [H2O2] и плотность тока 22.32 мА см–2, в течение 30 мин. Кроме того, согласно наблюдениям, расход энергии в данных оптимальных условиях составлял 0.001939 × 10‒3 кВт ч/кг удаляемой ХПК при оптимальном токе 0.5 А. Это означает снижение ХПК на 55.4% для водного раствора ТС и окисление ТС в водном растворе согласно кинетике второго порядка [137].
6.2. Фенольные соединения
Удаление фенольных соединений и их производных представляет собой значительную проблему для окружающей среды вследствие легкости проникновения фенольных соединений через мембраны и оболочки растений, животных и людей и создания более серьезных токсических эффектов [88]. Управление по охране окружающей среды США определяет нитрофенолы как приоритетные антропогенные токсичные загрязняющие вещества, концентрация которых в природной воде не должна превышать 10 мг/л [111]. Pillai и др. (2015 г.) предприняли попытку электрохимического окисления 2,4-динитрофенола (2,4-ДНФ) с использованием нового электрода на основе PbO2. Кроме того, фенольные соединения второго класса, т.е. хлорфенолы, также вносят свой вклад в загрязнение окружающей среды вследствие своей высокой токсичности и устойчивости в окружающей среде. В течение двух последних десятилетий было исследовано множество технологий окисления этих фенольных соединений, т.е. нитрофенолов и хлорфенолов [75]. Chu и др. (2010 г.) исследовали разложение 2,4-дихлорфенолов в процессе анодного окисления в водном растворе, а также предприняли попытку усиления биоразлагаемости. Этому усилению способствовало применение процесса анодного окисления. Pillai и др. (2016 г.) осуществляли анодное окисление сточной воды из коксовой печи коксохимического производства, содержащей фенолы (900 мг/л), в бездиафрагменной электролитической ячейке объемом 250 мл в периодическом режиме. Эффективность удаления фенолов составляла 99.6% в оптимальных экспериментальных условиях, включающих pH 3, NaCl 1 г/л и плотность тока 6.7 мА см–2 [102]. Lizang и др. (2016 г.) исследовали влияние анодных материалов IrO2–TaO2/Ti и PbO2/Ti на кинетику окисления фенола посредством электрохимических измерений. Кроме того, было показано, что окислительная способность анода PbO2/Ti превышает окислительную способность электрода IrO2–TaO2/Ti, поскольку соответствующий анод может уменьшать выделение кислорода и, таким образом, эффективный ток в процессе [76]. Исследователи предпринимали попытки гетерогенного разложения 2,4-дихлорфенола (2,4-ДХФ) с использованием железоуглеродного материала в качестве твердого катализатора. Эффективность разложения 2,4-ДХФ поддерживалась на высоком уровне при уменьшении степени выщелачивания железа и при применяемой плотности тока 100 мА и pH 6.7 в процессе обработки в течение 120 мин [126]. Rabaaoui и др. (2013 г.) предприняли попытку электрохимического окисления пестицида o‑нитрофенола (тип пестицида, который является потенциально опасным и биоустойчивым) на ЛБА в качестве рабочего электрода. Процесс обработки занимал 8 ч для достижения разложения 92% o-нитрофенола при значении pH 3 и значении плотности тока 60 мА см–2 [73]. Исследователи также осуществляли разложение тирозола (наиболее распространенный фенольный компонент сточной воды от производства оливкового масла), чтобы наблюдать воздействие катализатора (порошка пирита) на эффективность удаления. Добавление 1 г/л порошка пирита легко поддерживало значение pH раствора, и соответствующее количество 0.2 мМ Fe2+ могло оптимизировать обработку ЭФ с помощью пирита [112]. Meijide и др. (2017 г.) предприняли попытку окисления фенольного соединения п-нитрофенола в процессе электрохимической реакции Фентона. Они использовали ЛБА в качестве анодного материала и углеродный войлок в качестве катодного материала в электролитической ячейке. Они также предприняли попытку идентификации продуктов реакции окисления, которые образовались в течение обработки водного раствора п-нитрофенола [138]. Bahadir и др. (2017 г.) исследовали электрохимическое окисление резорцина в водной среде с использованием ЛБА в качестве анодного материала и Na2SO4 в качестве фонового электролита. Полное удаление резорцина было достигнуто в оптимизированных экспериментальных условиях. Снижение ХПК на 89% наблюдалось после проведения реакции в течение 120 мин при начальной концентрации 300 мг/л резорцина в водном растворе [139]. Hongna и др. (2017 г.) исследовали электрохимическое окисление бисфенола A с использованием ЛБА в качестве анодного материала. Влияние рабочих параметров и хлорированные побочные продукты были количественно определены при электрохимическом окислении на ЛБА методом поверхности отклика [140]. Sarah и др. (2017 г.) описали явление анодного окисления для удаления окситетрациклина с использованием платинированного титана (Ti/Pt) в качестве анода. Было исследовано влияние рабочих параметров, таких как природа раствора электролита, доза фонового электролита и плотность тока, на эффективность удаления фенольного соединения. Результаты показывают, что электрохимическая обработка может быть эффективно применена для окисления для окситетрациклина в оптимальных условиях 40 мМ Na2SO4, pH 4.3 (естественное значение pH раствора) и сила тока 300 мА [141].
6.3. Пестициды и инсектициды
Загрязняющие вещества, включая промышленные химические реагенты, пестициды и инсектициды, красители, фармацевтические препараты и препараты для личной гигиены, в больших количествах выбрасываются в природные водоемы потоками сточной воды, что способствует их накоплению в водной среде. Среди них пестициды и инсектициды повсеместно создают проблемы для окружающей среды вследствие своего широкого применения [45]. Sonmez и др. (2015 г.) описали разложение карбарила, занимающего второе место среди инсектицидов, присутствующих в воде, в процессе электрохимической реакции Фентона с использованием ЛБА или Pt в качестве анода в сочетании с углеродным войлоком в качестве катода в открытой цилиндрической однокамерной электролитической ячейке [45]. Необходимо было снизить уровень загрязнения грунтовых вод, т.к. загрязняющие вещества пребывают в них длительное время и могут распространиться на большие расстояния. Кроме того, традиционная технология для обработки грунтовой воды в целях удаления пестицидов не оказалась достаточно эффективной. Описано разложение трициклазола (широко применяемый пестицид, проявляющий фунгицидную активность на залитых водой рисовых полях) посредством электрогенерации пероксида водорода с использованием анода Ti/IrO2–Ta2O5 в электрохимическом реакторе Фентона с двойными трубчатыми мембранами без аэрации [52]. Xu и др. (2016 г.) получили наибольшую степень удаления трициклазола, достигающую уровня 79% в течение 20 мин реакции. Эффективная минерализация имидаклоприда (один из наиболее часто используемых типов инсектицидов) была осуществлена посредством усовершенствованного процесса электросорбции в электрохимической реакции Фентона при pH 7 на основе композиционного катода, содержащего оксид железа в смешанной степени окисления [119]. Снижение полной ХПК на 93% было получено в течение 150 мин с использованием начальной концентрации имидаклоприда, составляющей 237 мг/л. Pape и др. (2017 г.) исследовали окислительное разложение фенилкарбамидного гербицида флуометурона в водной среде в процессе электрохимической реакции Фентона. Авторы использовали ЛБА и Pt в качестве анодного материала и углеродный войлок в качестве катодного материала. Процентное разложение гербицида зависит от значения силы тока и материала анода. Состояние практически полной минерализации (>98%) было получено с помощью ЛБА в качестве анода [142]. Najmeddine и др. (2017 г.) описали удаление пестицидов двух типов (1,2-дихлорбензол и 1,4-дихлорбензол) посредством усовершенствованных процессов электрохимического окисления, где были использованы легированный бором алмаз и свинец/оксид свинца (Pb/PbO2) в качестве анодных материалов. Анодные материалы значительно влияли на скорость разложения пестицидов. Скорость минерализации для данных пестицидов оказалась выше, когда использовали алмазный электрод, а не оксид свинца в качестве анода [143].
6.4. Фармацевтические препараты
В мире ежегодно расходуются разнообразные фармацевтические препараты в процессе разнообразной деятельности человека. Эти фармацевтические препараты (лекарственные средства) в последнее время были обнаружены в водных источниках. He и др. (2015 г.) исследовали электрохимическое разложение аспирина (примерное противовоспалительное лекарственное средство) при использовании PbO2, ЛБА и пористого Ti/ЛБА в качестве анода [11]. Было обнаружено, что электрохимическая активность пористого Ti/ЛБА оказалась выше, чем активность плоского ЛБА и PbO2. Среди всех фармацевтических препаратов необходимо обратить внимание на нестероидные противовоспалительные лекарственные средства (НПЛС) вследствие их широкого применения для терапевтических целей. Процесс непрерывного повышения концентраций фармацевтических препаратов в водной среде превращается в значительную проблему для окружающей среды, и требуется разработка мощных технологий для удаления лекарственных средств. Еще одно лекарственное средство представляет собой сульфаметазин (СМТ), средство для лечения людей и животных, которое обнаружено в поверхностных водах. Поэтому Barhoumi и др. (2016 г.) предприняли усилия в целях разработки электрохимического окисления СМТ с применением пирита в качестве устойчивого катализатора. Снижение полной ХПК удаление приблизительно на 95 и 87% было получено в катализируемом пиритом процессе ЭФ с применением ЛБА и Pt в качестве анода [39] по сравнению с 90 и 83% для классического процесса Фентона, также осуществляемого с применением ЛБА и Pt в качестве анода. Присутствие оксациллина (ОКСА), представляющего собой бета-лактамный антибиотик класса пенициллина с узким спектром действия, недавно обнаружено в водных источниках. Обработка такой воды, содержащей оксациллин, оказывается затруднительной. Таким образом, Giraldo и др. (2015 г.) описали разложение антибиотка оксациллина в воде в процессе анодного окисления с использованием анодов Ti/IrO2. При разложении оксациллина химическая потребность в кислороде снизилась приблизительно на 70% от начального уровня [67]. Исследователи снова сосредоточили свое внимание на удалении психоактивного кофеина из воды в процессе электрохимической реакции Фентона с использованием ЛБА в качестве анодного материала. Кофеин (который содержат в качестве компонента болеутоляющие средства, лекарства против мигрени, усталости и т.д.) представляет собой наиболее распространенное в мире психоактивное лекарственное средство [42]. В настоящее время исследования сосредоточены на удалении антибиотиков. Присутствие антибиотиков недавно привлекло внимание вследствие потенциального риска устойчивого сопротивления антибиотикам. Gong и др. (2016 г.) предприняли попытку частичного разложения фторхинолонового антибиотика левофлоксацина для улучшения биоразложимости в процессе электрохимической реакции Фентона с использованием войлока из активированных углеродных волокон в качестве катода [41]. Вследствие непрерывного использования противомикробного средства гидрохлорида ципрофлоксацина (ЦИП) в медицине и ветеринарии воздействие антибиотиков такого класса на окружающую среду представляет собой серьезную опасность для здравоохранения. Кроме того, существует такое широко используемое фармацевтическое средство, как парацетамол (N-(4-гидроксифенил)ацетамид), который является общеизвестным в качестве устойчивого соединения и удаляется из водоемов с большим трудом. Разнообразные усовершенствованные процессы окисления, включая процесс Фентона, являются наиболее подходящими для удаления данного соединения. Но процесс Фентона был модифицирован в целях его усовершенствования для удаления парацетамола [113]. Для его удаления был использован пористый катод. Результат минерализации улучшался на 31% по сравнению с процессом, в котором был использован немодифицированный катод, после электролиза в течение двух часов.
6.5. Другие вещества
Окисление других многочисленных содержащиеся в воде органических соединений было успешно осуществлено в целях устойчивого развития усовершенствованных процессов электрохимического окисления. Подробности представлены в табл. 10. Таблица 10 четко показывает, что УПЭО представляет собой весьма мощное и благоприятное для окружающей среды средство для обработки сточной воды.
Таблица 10.
Удаление содержащихся в воде загрязняющих веществ разнообразных типов в усовершенствованных процессах электрохимического окисления
| Номер | Загрязняющее вещество/цель | Основные результаты исследований | Литература |
|---|---|---|---|
| 1. | Синтетический краситель 4-амино-3-гидрокси-2-п-толилазо-нафталин-1-сульфоновая кислота (АГПС) | • Полная минерализация 175 мг л–1 красителя AHPS в течение 8 ч с использованием катализируемого пиритом процесса ЭФ • Данное исследование показывает, что катализируемый пиритом процесс ЭФ является более мощным, чем традиционный процесс электрохимической реакции Фентона |
[114] |
| 2. | Этанол | • Полное окисление этанола происходит посредством химических реакций между электрохимически
генерированным Pt–OH и этанолом • Вследствие устойчивости, сопротивления к ядам и способности производить более высокий ток Ni/Pt оказался наилучшим для использования в обработке сточной воды |
[144] |
| 3. | Фармацевтический ранидидин (РНТД) | • Минерализация, составляющая приблизительно 80%, была получена для 2.5 л растворов
РНТД при
pH 3.0 в процессах ЭФ и СФЭФ на предварительной экспериментальной проточной установке
с использованием ячейки типа Pt/электрод с диффузией воздуха • Оптимальное значение для катализатора: 0.5 мМ Fe2+ |
[145] |
| 4. | Реактивный бриллиантовый красный X-3B | • Эффективность реактора с орошаемым слоем повышена при разработке катода с орошаемым слоем | [146] |
| 5. | Эффективная генерация водорода под действием видимого света | • Фотоэлектрод с соотношением размеров 142.5, который был получен посредством анодного окисления при напряжении 60 В в течение 1 часа, проявлял замечательную способность производства H2 со скоростью выделения вплоть до 508.3 мкл мин–1 см–2 и эффективность фотопревращения η 2.3% | [147] |
| 6. | Полное окисление следов толуола | • Предпринята попытка исследования применимости осажденных на анодный оксид алюминия платиновых катализаторов в каталитическом сжигании летучих органических соединений (ЛОС) | [148] |
| 7. | Сточная вода от промышленного производства экранов типа тонкопленочного транзисторного жидкокристаллического дисплея (ТПТ-ЖКД) | • Затруднительное разложение вследствие присутствия бионеразлагающихся загрязняющих
органических веществ и высокоустойчивых соединений, содержащих азот и серу • Эта реальная сточная вода окислялась в процессе ЭФ всего лишь в течение 20 мин |
[149] |
| 8. | Концентраты обратного осмоса стоков санитарно-технических полигонов | • Начальная ХПК 42 г/л устранена с применением углеродного войлока в качестве катодного
материала
и ЛБА в качестве анодного материала • Конечные результаты показывают, что начальное значение pH представляет собой параметр, который существенно влияет на эффективность тока в процессе электрохимической реакции Фентона |
[150] |
7. ВЫВОДЫ
Осуществление усовершенствованных процессов электрохимического окисления для удаления содержащихся в воде загрязняющих органических веществ привлекло внимание в последнее десятилетие. Электрохимическая обработка для удаления загрязняющих органических веществ может быть осуществлена путем опосредованного и непосредственного окисления. Разнообразные типы реакторных установок были использованы для электролитических экспериментов по удалению соответствующих загрязняющих веществ, содержащихся в сточной воде. В настоящем обзоре обсуждаются разнообразные типы электролизеров, в том числе электролизеры, содержащие щелочи, полимерные электролитные мембраны (ПЭМ) и твердые оксиды. Эти электролизеры используются не только для обработки сточной воды, но также в других приложениях, таких как производство водорода, которое играет чрезвычайно важную роль в будущей энергетической системе. Авторы анализировали и сравнивали эффективность различных типов анодных и катодных материалов. Легированный бором алмаз в качестве анодного материала оказался наиболее перспективным для использования в электрохимической обработке сточной воды, содержащей загрязняющие органические вещества. Процессы УПЭО в очень высокой степени зависят от таких параметров, как pH, температура, применяемая плотность тока, концентрация пероксида водорода, расстояние между электродами, концентрация ионов железа(III) и природа фонового электролита в ячейке. В настоящем обзоре проанализировано устранение посредством УПЭО разнообразных содержащихся в воде загрязняющих веществ, включая красители, фенольные соединения, пестициды и инсектициды, фармацевтические препараты и т.д. Сделан вывод, что УПЭО представляет собой подходящую технологию для применения в обработке сточной воды.
Список литературы
Ma, L., Zhou, M., and Ren, G., A highly energy efficient flow-through electro-Fenton process for organic pollutants degradation, Electrochim. Acta., 2016, vol. 200, p. 222.
Wang, N., Zheng, T., and Zhang, G., A review on Fenton-like processes for organic wastewater treatment, J. Environ. Chem. Eng., 2016, vol. 4, p. 762.
Huang, X., Hou, X., and Zhao, J., Hematite facet confined ferrous ions as high efficient Fenton catalysts to degrade organic contaminants by lowering H2O2 decomposition energetic span, Appl. Catal. B: Environ., 2016, vol. 181, p. 127.
Alexandre, C., Luis, M., and Baginska, E., Degradation of 5-FU by means of advanced (photo) oxidation processes: UV/H2O2, UV/Fe2+/H2O2 and UV/TiO2-Comparison of transformation products, ready biodegradability and toxicity, Sci. Total Environ., 2015, vol. 528, p. 232.
Zhu, H., Shen, Z., and Tang Q., Degradation mechanism study of organic pollutants in ozonation process by QSAR analysis, Chem. Eng. J., 2014, vol. 255, p. 431.
Chelme-ayala, P., Smith, D.W., and Adams, C.D., Oxidation kinetics of two pesticides in natural waters by ozonation and ozone combined with hydrogen peroxide, Water Res., 2011, vol. 5, p. 2517.
Fontmorin, J. and Sillanpaa, M., Bioleaching and combined bioleaching/Fenton-like processes for the treatment of urban anaerobically digested sludge: Removal of heavy metals and improvement of the sludge dewaterability, Sep. Purif. Technol., 2015, vol. 156, p. 655.
Wu, D., Chen, Y., and Zhang, Z., Enhanced oxidation of chloramphenicol by GLDA-driven pyrite induced heterogeneous Fenton-like reactions at alkaline condition, Chem. Eng. J., 2016, vol. 294, p. 49.
Kuznetsova, E. V., Savinov, E.N., and Vostrikova, L., Heterogeneous catalysis in the Fenton-type system FeZSM-5/H2O2, Appl. Catal. B Environ., 2004, vol. 51, p. 165.
Gan, P.P. and Li, S.F.Y., Efficient removal of Rhodamine B using a rice hull-based silica supported iron catalyst by Fenton-like process, Chem. Eng. J., 2013, vol. 229, p. 351.
He, Y., Huang, W., and Chen, R., Anodic oxidation of aspirin on PbO2, BDD and porous Ti/BDD electrodes: Mechanism, kinetics and utilization rate, Sep. Purif. Technol., 2015, vol. 156, p. 124.
Zhang, C., Zhou, M., and Yu, X., Modified iron-carbon as heterogeneous electro-Fenton catalyst for organic pollutant degradation in near neutral pH condition: Characterization, degradation activity and stability, Electrochim. Acta., 2015, vol. 160, p. 254.
Trellu, C., Pechaud, Y., and Oturan, N., Comparative study on the removal of humic acids from drinking water by anodic oxidation and electro-Fenton processes: Mineralization efficiency and modelling, Appl. Catal. B: Environ., 2016, vol. 194, p. 32.
Barbusinski, K., Controversy Over Fenton Mechanism, Ecol. Chem. Eng. S., 2009, vol. 16, p. 347.
Zhou, M., Oturan, M.A., and Sires, I., Electro-Fenton Process: New Trends and Scale-Up, Springer Nature Singapure Pte Ltd., 2018, 430.
Kolyagin, G.A. and Kornienko, V.L., The effect of carbon black mixture composition on the structural and electrochemical characteristics of gas diffusion electrodes for electrosynthesis of hydrogen peroxide, Russ. J. Electrochem., 2016, vol. 52, p. 185. [Колягин, Г.А., Корниенко, В.Л. Влияние состава смеси саж на структурные и электрохимические характеристики газодиффузионного электрода для электросинтеза пероксида водорода. Электрохимия. 2016. Т. 52, С. 213.]
Kornienko, G.V., Kolyagin, G.A., Kornienko, V.L., and Parfenov, V.A., Graphitized carbon materials for electrosynthesis of Н2О2 from О2 in gas-diffusion electrodes, Russ. J. Electrochem., 2016, vol. 52, p. 983. [Корниенко, Г.В., Колягин, Г.А., Корниенко, В.Л., Парфенов, В.А. Исследование углеграфитовых материалов для электросинтеза Н2О2 из О2 в газодиффузионных электродах. Электрохимия. 2016. Т. 52. С. 1104.]
Kornienko, V.L., Kolyagin, G.A., Kornienko, G.V., Chaenko, N.V., Kosheleva, A.M., Kenova, T.A., and Vasileva, I.S., Use of aqueous hydrogen peroxide solutions prepared by cathodic reduction of oxygen for indirect oxidation of chemical substances in situ: Achievements and prospects, Russ. J. Appl. Chem., 2014, vol. 87, p. 1. [Корниенко, В.Л., Колягин, Г.А., Корниенко, Г.В., Чаенко, Н.В., Кошевая, А.М., Кенова, Т.А., Васильева, И.С. Использование водных растворов пероксида водорода, полученных катодным восстановлением кислорода, для непрямого окисления химических веществ в условиях in situ: достижения и перспективы. Журнал прикладной химии. 2014., Т. 87. С. 3.]
Kolyagin, G. A. and Kornienko, V. L., Electrosynthesis of hydrogen peroxide in solutions of salts that form molecular addition products (peroxo solvates) with it, Russ. J. Electrochem., 2014, vol. 50, p. 798. [Колягин, Г.А., Корниенко, В.Л. Электросинтез пероксида водорода в растворах солей, образующих с ним продукты молекулярного присоединения – пероксосольваты. Электрохимия. 2014., Т. 50. С. 884.]
Kolyagin, G. A., Kornienko, V. L., Kudenko, Y. A., Tikhomirov, A. A., and Trifonov, S. V., Electrosynthesis of hydrogen peroxide from oxygen in a gas-diffusion electrode in solutions of mineralized exometabolites, Russ. J. Electrochem., 2013, vol. 49, p. 1004. [Колягин, Г.А., Корниенко, В.Л., Куденко, Ю.А., Тихомиров, А.А., Трифонов, С.В. Электросинтез пероксида водорода из кислорода в газодиффузионном электроде в растворах минерализованных экзометаболитов. Электрохимия. 2013., Т. 49. С. 1120.]
Kornienko, G. V., Chaenko, N. V., Maksimov, N. G., Kornienko, V. L., and Varnin, V. P., Electrochemical oxidation of phenol on boron-doped diamond electrode, Russ. J. Electrochem., vol. 47, 2011, p. 225. [Корниенко, Г.В., Чаенко, Н.В., Максимов, Н.Г., Корниенко, В.Л., Варнин, В.П. Электрохимическое окисление фенола на допированном бором алмазном электроде. Электрохимия. 2011, Т. 47. С. 240.]
Zeng, K. and Zhang, D., Recent progress in alkaline water electrolysis for hydrogen production and applications, Prog. Energy Combust. Sci., 2010, vol. 36, p. 307.
Van Der Merwe, J., Uren, K., Van Schoor, G., and Bessarabov, D., Characterisation tools development for PEM electrolysers, Int. J. Hydrogen Energy, 2014, vol. 39, p. 14212.
Daneshpour, R. and Mehrpooya, M., Design and optimization of a combined solar thermophotovoltaic power generation and solid oxide electrolyser for hydrogen production, Energy Convers. Manag., 2018, vol. 176, p. 274.
Mohammadi, A. and Mehrpooya, M., A comprehensive review on coupling different types of electrolyzer to renewable energy sources, Energy, 2018, vol. 158, p. 632.
Lin, M. and Haussener, S., Techno-economic modeling and optimization of solar-driven high-temperature electrolysis systems, Sol. Energy, 2017, vol. 155, p. 1389.
Derbal-Mokrane, H., Benzaoui, A., Raoui, A., and Belhamel, M., Feasibility study for hydrogen production using hybrid solar power in Algeria, Int. J. Hydrogen Energy, 2011, vol. 36, p. 4198.
E. Bilgen, Domestic hydrogen production using renewable energy, Sol. Energy, 2004, vol. 77, p. 47.
Yilmaz, C. and Kanoglu, M., Thermodynamic evaluation of geothermal energy powered hydrogen production by PEM water electrolysis, Energy, 2014, vol. 69, p. 592.
Basha, C.A., Sendhil, J., Selvakumar, K.V., Muniswaran, P.K. A., and Lee, C.W., Electrochemical degradation of textile dyeing industry effluent in batch and flow reactor systems, Desalination, 2012, vol. 285, p. 188.
Gargouri, B., Gargouri, O.D., Gargouri, B., Trabelsi, S.K., Abdelhedi, R., and Bouaziz, M., Application of electrochemical technology for removing petroleum hydrocarbons from produced water using lead dioxide and boron-doped diamond electrodes, Chemosphere, 2014, vol. 117, p. 309.
Martinez-Huitle, C.A., Dos Santos, E.V., De Araujo, D.M., and Panizza, M., Applicability of diamond electrode/anode to the electrochemical treatment of a real textile effluent, J. Electroanal. Chem., 2012, vol. 674, p. 103.
Valero, D., Garcia-Garcia, V., Exposito, E., Aldaz, A., and Montiel, V., Electrochemical treatment of wastewater from almond industry using DSA-type anodes: Direct connection to a PV generator, Sep. Purif. Technol., 2014, vol. 123, p. 15.
Dominguez, J.R., Gonzalez, T., Palo, P., Sanchez-Martín, J., Rodrigo, M.A., and Saez, C., Electrochemical degradation of a real pharmaceutical effluent, Water. Air. Soil Pollut., 2012, vol. 223, p. 2685.
Isarain-Chavez, E., De La Rosa, C., Godinez, L.A., Brillas, E., and Peralta-Hernandez, J.M., Comparative study of electrochemical water treatment processes for a tannery wastewater effluent, J. Electroanal. Chem., 2014, vol. 713, p. 62.
Kim, D.G., Kim, W.Y., Yun, C.Y., Son, D.J., Chang, D., Bae, H.S., Lee, Y.H., Sunwoo, Y., and Hong, K., Agro-industrial wastewater treatment by electrolysis technology, Int. J. Electrochem. Sci., 2013, vol. 8, p. 9835.
Gajda, A. Stinchcombe, J. Greenman, C. Melhuish, and I. Ieropoulos, Microbial fuel cell–A novel self-powered wastewater electrolyser for electrocoagulation of heavy metals, Int. J. Hydrogen Energy, 2017, vol. 42, p. 1813.
Zhang, Y., Gao, M., and Wang, X., Enhancement of oxygen diffusion process on a rotating disk electrode for the electro-Fenton degradation of tetracycline, Electrochim. Acta, 2015, vol. 182, p. 73.
Barhoumi, N., Oturan, N., and Olvera-vargas, H., Pyrite as a sustainable catalyst in electro-Fenton process for improving oxidation of sulfamethazine-Kinetics, mechanism and toxicity assessment, Water Res., 2016, vol. 94, p. 52.
Davarnejad, R. and Azizi J., Alcoholic wastewater treatment using electro-Fenton technique modified by Fe2O3 nanoparticles, J. Environ. Chem. Eng., 2016, vol. 4, p. 2342.
Gong, Y., Li, J., and Zhang, Y., Partial degradation of levofloxacin for biodegradability improvement by electro-Fenton process using an activated carbon fiber felt cathode, J. Hazard. Mater., 2016, vol. 304, p. 320.
Ganzenko, O., Oturan, N., and Huguenot, D., Removal of psychoactive pharmaceutical caffeine from water by electro-Fenton process using BDD anode: Effects of operating parameters on removal efficiency, Sep. Purif. Technol., 2015, vol. 156, p. 987.
Petrucci, E., Pozzo, A.D., and Palma L.D., On the ability to electrogenerate hydrogen peroxide and to regenerate ferrous ions of three selected carbon-based cathodes for electro-Fenton processes, Chem. Eng. J., 2016, vol. 283, p. 750.
Ozcan, A. and Gencten, M., Investigation of acid red 88 oxidation in water by means of electro-Fenton method for water purification, Chemosphere, 2016, vol. 146, p. 245.
Sonmez, M., Oturan, N., and Zazou, H., Electrochemical oxidation of carbaryl on platinum and boron-doped diamond anodes using electro-Fenton technology, Sep. Purif. Technol., 2015, vol. 156, p. 996.
Hou, B., Han, H., and Jia, S., Three-dimensional heterogeneous electro-Fenton oxidation of biologically pretreated coal gasification wastewater using sludge derived carbon as catalytic particle electrodes and catalyst, J. Taiwan Inst. Chem. Eng., 2016, vol. 60, p. 352.
Muna, S.Y., Oturan, N., and Kacemi, K.E., Oxidative degradation study on antimicrobial agent ciprofloxacin by electro-fenton process: Kinetics and oxidation products, Chemosphere, 2014, vol. 117, p. 447.
Colades, J.I., Daniel, M., and Luna, G.D., Treatment of thin film transistor-liquid crystal display (TFT-LCD) wastewater by the electro-Fenton process, Sep. Purif. Technol., 2015, vol. 145, p. 104.
Ammar, S., Oturan, M.A., and Labiadh, L., Degradation of tyrosol by a novel electro-Fenton process using pyrite as heterogeneous source of iron catalyst, Water Res., 2015, vol. 74, p. 77.
Xuan, T., Le, H., and Charmette, C., Facile Preparation of porous carbon cathode to eliminate paracetamol in aqueous medium using electro-Fenton system, Electrochim. Acta, 2016, vol. 188, p. 378.
Hou, B., Han, H., and Jia, S., Heterogeneous electro-Fenton oxidation of catechol catalyzed by nano-Fe3O4: kinetics with the Fermi’s equation, J. Taiwan Inst. Chem. Eng., 2015, vol. 56, p. 138.
Xu, A., Han, W., and Li, J., Electrogeneration of hydrogen peroxide using Ti/IrO2-Ta2O5 anode in dual tubular membranes Electro-Fenton reactor for the degradation of tricyclazole without aeration, Chem. Eng. J., 2016, vol. 295, p. 152.
Ren, G., Zhou, M., and Liu, M., A novel vertical-flow electro-Fenton reactor for organic wastewater treatment, Chem. Eng. J., 2016, vol. 298, p. 55.
Tzedakis, T. and Assouan, Y., One-flow feed divided electrochemical reactor for indirect electrolytic production of hypochlorite from brine for swimming pool treatment-experimental and theoretical optimization, Chem. Eng. J., 2014, vol. 253, p. 427.
Lin, H., Zhang, H., and Wang, X., Electro-Fenton removal of Orange II in a divided cell: reaction mechanism, degradation pathway and toxicity evolution, Sep. Purif. Technol., 2014, vol. 122, p. 533.
El-ghenymy, A., Centellas, F., and Garrido, J.A., Decolorization and mineralization of Orange G azo dye solutions by anodic oxidation with a boron-doped diamond anode in divided and undivided tank reactors, Electrochim. Acta., 2014, vol. 130, p. 568.
Meijide, J. and Pazos, M., Degradation of thiamethoxam by the synergistic effect between anodic oxidation and Fenton reactions, J. Hazard. Mater., 2016, vol. 319, p. 43.
Moreira, F.C., Garcia-segura, S., and Brillas, E., Decolorization and mineralization of Sunset Yellow FCF azo dye by anodic oxidation, electro-Fenton, UVA photoelectro-Fenton and solar photoelectro-Fenton processes, Appl. Catal. B: Environ., 2013, vol. 143, p. 877.
Bedolla-guzman, A., Sires, I., and Thiam, A., Application of anodic oxidation, electro-Fenton and UVA photoelectro-Fenton to decolorize and mineralize acidic solutions of Reactive Yellow 160 azo dye, Electrochim. Acta., 2016, vol. 206, p. 307.
Maryam, A., Maziyar, M.P., and Hassan, F.J., Treatment of petrochemical wastewater by modified electro-fenton method with nano-porous aluminum electrode, J. Water. Environ. Nanotechnol., 2017, vol. 2, p. 186.
Baolin, H., Bozhi, R., and Renjian, D., Three-dimensional electro-Fenton oxidation of N-heterocyclic compounds with a novel catalytic particle electrode: high activity, wide pH range and catalytic mechanism, RSC Adv., 2017, vol. 7, p. 154.
Hicham, Z., Oturan, N., and Sonmez-Celebi, M., Mineralization of chlorobenzene in aqueous medium by anodic oxidation and electro-Fenton processes using Pt or BDD anode and carbon felt cathode, J. Electroanal. Chem., 2016, vol. 774, p. 22.
Florenza, X., Maria, A., and Solano, S., Degradation of the azo dye Acid Red-1 by anodic oxidation and indirect electrochemical processes based on Fenton’s reaction chemistry: Relationship between decolorization, mineralization and products, Electrochim. Acta, 2014, vol. 142, p. 276.
Zhang, Q., Hua, Y., and Wang, R., Anodic oxidation of chloride ions in 1-butyl-3-methyl-limidazolium tetrafluoroborate ionic liquid, Electrochim. Acta, 2013, vol. 105, p. 419.
Fernandes, A., Santos, D., and Pacheco, M.J., Nitrogen and organic load removal from sanitary landfill leachates by anodic oxidation at Ti/Pt/PbO2, Ti/Pt/SnO2-Sb2O4 and Si/BDD, Appl. Catal. B: Environ., 2014, vol. 149, p. 288.
De Rosa-ju, C., Peralta-hern, J.M., and Rodrigo-rodrigo, M.A., Synergism between anodic oxidation with diamond anodes and heterogeneous catalytic photolysis for the treatment of pharmaceutical pollutants, Sustain. Environ. Res., 2016, vol. 26, p. 70
Giraldo, A.L., Erazo-erazo, E.D., and Florez-acosta, O.A., Degradation of the antibiotic oxacillin in water by anodic oxidation with Ti/IrO2 anodes: Evaluation of degradation routes, organic by-products and effects of water matrix components, Chem. Eng. J., 2015, vol. 279, p. 103.
Vale-junior, E., Dosta, S., and Garcia, I., Acid blue 29 decolorization and mineralization by anodic oxidation with a cold gas spray synthesized Sn–Cu–Sb alloy anode, Chemosphere, 2016, vol. 148, p. 47.
Chen, H., Zhang, Z., and Yang, Z., Heterogeneous Fenton-like catalytic degradation of 2, 4-dichlorophenoxyacetic acid in water with FeS, Chem. Eng. J., 2015, vol. 273, p. 481.
Golub, T. and Becker, J.Y., The effect of ring-size on the anodic oxidation of cyclic amides in methanol, Electrochim. Acta., 2016, vol. 205, p. 207.
Florenza, X., Maria, A., and Solano, S., Degradation of the azo dye Acid Red-1 by anodic oxidation and indirect electrochemical processes based on Fenton’s reaction chemistry; Relationship between decolorization, mineralization and products, Electrochim. Acta., 2014, vol. 142, p. 276.
Akrout, H., Jellali, S., and Bousselmi, L., Enhancement of methylene blue removal by anodic oxidation using BDD electrode combined with adsorption onto sawdust, C. R. Chim., 2015, vol. 18, p. 110.
Rabaaoui, N., Moussaoui, Y., and Salah M., Anodic oxidation of nitrobenzene on BDD electrode: Variable effects and mechanisms of degradation, Sep. Purif. Technol., 2013, vol. 107, p. 318.
Xu, L., Guo, Z., and Du, L., Decolourization and degradation of C. I. Acid Red 73 by anodic oxidation and the synergy technology of anodic oxidation coupling nanofiltration, Electrochim. Acta, 2013, vol. 97, p. 150.
Chu, Y., Wang, W., and Wang, M., Anodic oxidation process for the degradation of 2,4-dichlorophenol in aqueous solution and the enhancement of biodegradability, J. Hazard. Mater., 2010, vol. 180, p. 247.
Lizhang, W., Shengxiang, Y., and Bo, W., The influence of anode materials on the kinetics toward electrochemical oxidation of phenol, Electrochim. Acta, 2016, vol. 206, p. 270.
Chen, Y., Li, H., and Liu, W., Electrochemical degradation of nitrobenzene by anodic oxidation on the constructed TiO2–NTs/SnO2–Sb/PbO2 electrode, Chemosphere, 2014, vol. 113, p. 48.
Pleskov, Y.V., Electrochemistry of diamond: A review, Russ. J. Electrochem., 2002, vol. 38, p. 1275. [Плесков, Ю.В., Электрохимия алмаза: обзор. Электрохимия. 2002. Т. 38. С. 1411.]
Pleskov, Yu.V., Evstefeeva, Yu.E., Krotova, M.D., Mishuk, V.Ya., Laptev, V.A., Palyanov, Yu.N., and Borzdov, Yu.M., Synthetic semiconductor diamond electrodes: Electrochemical characteristics of individual faces of high-temperature-high-pressure single crystals, Russ. J. Electrochem., 2002, vol. 38, p. 620. [Плесков, Ю.В., Евстефеева, Ю.Е., Кротова, М.Д., Мишук, В.Я., Лаптев, В.А., Пальянов, Ю.Н., Борздов, Ю.М. Электроды из синтетического полупроводникового алмаза: электрохимические характеристики индивидуальных граней моно-кристаллов, выращенных при высоких давлении и температуре. Электрохимия. 2002. Т. 38. С. 698.]
Pleskov, Y.V., Evstefeeva, Y.E., Varnin, V.P., and Teremetskaya, I.G., Synthetic semiconductor diamond electrodes: Electrochemical characteristics of homoepitaxial boron-doped films grown at the (111), (110) and (100) faces of diamond crystals, Russ. J. Electrochem., 2004, vol. 40, p. 886. [Плесков, Ю.В., Евстефеева, Ю.Е., Варнин, В.П., Теремецкая, И.Г. Электроды из синтетического полупроводникового алмаза: электрохимические характеристики гомоэпитаксиальных CVD-пленок на гранях (111), (110) и (100) кристаллов алмаза. Электрохимия. 2004. Т. 40. С. 1023.]
Pleskov, Yu.V., Evstefeeva, Yu.E., Krotova, M.D., Lim, P.Y., Chu, S.S., Ral’chenko, V.G., Vlasov, I.I., Kononenko, V.V., Varnin, V.P., Teremetskaya, I.G., and Shi, H.C., Electrodes of synthetic diamond: The effects of Ti substrate pretreatment on the electrode properties, Russ. J. Electrochem., 2005, vol. 41, p. 337. [Плесков, Ю.В., Евстефеева, Ю.Е., Кротова, М.Д., Лим, П.-И., Чу, С.С., Ральченко, В.Г., Власов, И.И., Кононенко, В.В., Варнин, В.П., Теремецкая, И.Г., Ши, Х. С. Электроды из синтетического алмаза: влияние предобра-ботки титановой подложки на электрохимические свойства алмазных пленок. Электрохимия. 2005. Т. 41. С. 387.]
Pleskov, Yu.V., Krotova, M.D., Ralchenko, V.G., Saveliev, A.V., and Bozhko, A.D., Electrochemical behavior of nitrogenated nanocrystalline diamond electrodes, Russ. J. Electrochem., 2007, vol. 43, p. 827. [Плесков, Ю.В., Кротова, М.Д., Ральченко, В.Г., Савельев, А.В., Божко А.Д. Электрохимическое поведение азотированных нанокристаллических алмазных электродов. Электрохимия. 2007. Т. 43. С. 868.]
Pleskov, Yu.V., Krotova, M.D., Elkin, V.V., and Ekimov, E.A., Electrochemical behavior of new electrode material: Compact of boron-doped synthetic diamond, Russ. J. Electrochem., 2016, vol. 52, p. 1. [Плесков, Ю.В., Кротова, М.Д., Ёлкин, В.В., Екимов Е.А. Электрохимическое поведение нового электродного материала-компакта из легированного бором синтетического алмаза. Электрохимия. 2016. Т. 52. С. 3.]
Dai, Y., Denis, A.P., and Swain, G.M., Effects of film morphology and surface chemistry on the direct electrochemistry of cytochrome c at Boron-Doped Diamond Electrodes, 2017, Electrochim. Acta, vol. 4, p. 129.
Zhao, H., Bian, X., Galligan, J.J., and Swain, G.M., Electrochemical measurements of serotonin (5-HT) release from the guinea pig mucosa using continuous amperometry with a boron-doped diamond microelectrode, 2010, Diam. Relat. Mater., vol. 19, p. 182.
Kapałka, A., Joss, L., Anglada, A., Comninellis, C., and Udert, K. M., Direct and mediated electrochemical oxidation of ammonia on boron-doped diamond electrode, 2010, Electrochem. commun., vol. 12, p. 1714.
He, S., Huang, Q., Zhang, Y., Wang, L., and Nie, Y., Investigation on Direct and Indirect Electrochemical Oxidation of Ammonia over Ru–Ir/TiO2 Anode, 2015, Ind. Eng. Chem. Res., vol. 54, p. 1447.
Bounab, L., Iglesias, O., and Pazos M., Effective monitoring of the electro-Fenton degradation of phenolic derivatives by differential pulse voltammetry on multi-walled-carbon nanotubes modified screen-printed carbon electrodes, Appl. Catal. B: Environ., 2016, vol. 180, p. 544.
Garcia-rodriguez, O., Banuelos, J. A., and El-ghenymy, A., Use of a carbon felt-iron oxide air-diffusion cathode for the mineralization of Malachite Green dye by heterogeneous electro-Fenton and UVA photoelectro-Fenton processes, J. Electroanal. Chem., 2016, vol. 767, p. 40.
Davarnejad, R., Mohammadi, M., and Fauzi, A., Petrochemical wastewater treatment by electro-Fenton process using aluminum and iron electrodes: Statistical comparison, J. Water Process. Eng., 2014, vol. 3, p. 18.
Marco, J.F. and Escalona, N., Preparation and characterization of bimetallic Fe-Cu allophane nanoclays and their activity in the phenol oxidation by heterogeneous electro-Fenton reaction. Microporous Mesoporous Mater., 2016, vol. 225, p. 303.
Song, S., Wu, M., and Liu, Y., Efficient and stable carbon-coated nickel foam cathodes for the electro-Fenton process, Electrochim. Acta., 2015, vol. 176, p. 811.
Wang, Y., Liu, Y., and Wang K., Preparation and characterization of a novel KOH activated graphite felt cathode for the electro-Fenton process, Appl. Catal. B: Environ., 2015, vol. 165, p. 360.
Yuan, S., Gou, N., and Alshawabkeh, A.N., Efficient degradation of contaminants of emerging concerns by a new electro-Fenton process with Ti/MMO cathode, Chemosphere, vol. 93, p. 2796.
Xia, G., Lu, Y., and Xu, H., An energy-saving production of hydrogen peroxide via oxygen reduction for electro-Fenton using electrochemically modified polyacrylonitrile-based carbon fiber brush cathode, Sep. Purif. Technol., 2015, vol. 156, p. 553.
Paramo-vargas, J., Estrada, A.M., and Gutierrez-granados, S., Applying electro-Fenton process as an alternative to a slaughterhouse effluent treatment, J. Electroanal. Chem., 2015, vol. 754, p. 80.
Nouha, B.T., Hanife, S.E., and Guleda, O.E., The investigation of shale gas wastewater treatment by electro-Fenton process: Statistical optimization of operational parameters, Process. Saf. Environ. Prot., 2017, vol. 109, p. 203.
Bedolla-guzman, A., Sires, I., and Thiam, A., Application of anodic oxidation, electro-Fenton and UVA photoelectro-Fenton to decolorize and mineralize acidic solutions of Reactive Yellow 160 azo dye, Electrochim. Acta., 2016, vol. 206, p. 307.
Meijide, J. and Pazos, M., Degradation of thiamethoxam by the synergistic effect between anodic oxidation and Fenton reactions, J. Hazard. Mater., 2016, vol. 319, p. 43.
De Rosa-ju, C., Peralta-hern, J.M., and Rodrigo-rodrigo, M.A., Synergism between anodic oxidation with diamond anodes and heterogeneous catalytic photolysis for the treatment of pharmaceutical pollutants, Sustain. Environ. Res., 2016, vol. 26, p. 70.
Hicham, Z., Oturan, N., and Sonmez-Celebi, M., Mineralization of chlorobenzene in aqueous medium by anodic oxidation and electro-Fenton processes using Pt or BDD anode and carbon felt cathode, J. Electroanal. Chem., 2016, vol. 774, p. 22.
Pillai, I.M.S. and Gupta, A.K., Anodic oxidation of coke oven wastewater: Multiparameter optimization for simultaneous removal of cyanide, COD and phenol, J. Environ. Manage., 2016, vol. 176. p. 45.
Zhao, Z., Zhang, Y., and Yu, Q., Enhanced decomposition of waste activated sludge via anodic oxidation for methane production and bioenergy recovery, Int. Biodeterior. Biodegradation., 2016, vol. 106, p. 161.
Giraldo, A.L., Erazo-erazo, E.D., and Florez-acosta, O.A., Degradation of the antibiotic oxacillin in water by anodic oxidation with Ti/IrO2 anodes: Evaluation of degradation routes, organic by-products and effects of water matrix components, Chem. Eng. J., 2015, vol. 279, p. 103.
Garcia-segura, S., Silva, A., and Bezerra, E., Anodic oxidation, electro-Fenton and photoelectro-Fenton degradations of pyridinium- and imidazolium-based ionic liquids in waters using a BDD/air-diffusion cell, Electrochim Acta., 2016, vol. 198, p. 268.
Chen, L., Campo, P., and Kupferle, M.J., Identification of chlorinated oligomers formed during anodic oxidation of phenol in the presence of chloride, J. Hazard. Mater., 2015, vol. 283, p. 574.
El-ghenymy, A., Centellas, F., and Garrido, J.A., Decolorization and mineralization of Orange G azo dye solutions by anodic oxidation with a boron-doped diamond anode in divided and undivided tank reactors, Electrochim. Acta., 2014, vol. 130, p. 568.
Moreira, F.C., Garcia-segura, S., and Brillas, E., Decolorization and mineralization of Sunset Yellow FCF azo dye by anodic oxidation, electro-Fenton, UVA photoelectro-Fenton and solar photoelectro-Fenton processes, Appl. Catal. B: Environ., 2013, vol. 143, p. 877.
Rabaaoui, N., Mohamed, M., and Saad, K., Anodic oxidation of o-nitrophenol on BDD electrode: Variable effects and mechanisms of degradation, J. Hazard. Mater., 2013, vol. 251, p. 447.
Garcia-Seguraa, S., Keller, J., Brillas, E., and Radjenovic, J., Removal of organic contaminants from secondary effluent by anodic oxidation with a boron-doped diamond anode as tertiary treatment, J. Hazard. Mater., 2015, vol. 283, p. 551.
Pillai, I.M.S., and Gupta, A.K., Batch and continuous flow anodic oxidation of 2,4-dinitrophenol: Modeling, degradation pathway and toxicity, J. Electroanal. Chem., 2015, vol. 756, p. 108.
Ammar, S., Oturan, M.A., and Labiadh, L., Degradation of tyrosol by a novel electro-Fenton process using pyrite as heterogeneous source of iron catalyst, Water Res., 2015, vol. 74, p. 77.
Xuan, T., Le, H., and Charmette, C., Facile Preparation of porous carbon cathode to eliminate paracetamol in aqueous medium using electro-Fenton system, Electrochim. Acta., 2016, vol. 188, p. 378.
Labiadh, L., Oturan, M.A., and Panizza, M., Complete removal of AHPS synthetic dye from water using new electro-Fenton oxidation catalyzed by natural pyrite as heterogeneous catalyst, J. Hazard. Mater., 2015, vol. 297, p. 34.
Hou, B., Han, H., and Jia, S., Heterogeneous electro-Fenton oxidation of catechol catalyzed by nano-Fe3O4: kinetics with the Fermi’s equation. J. Taiwan Inst. Chem. Eng., 2015, vol. 56, p. 138.
Iglesias, O., Tavares, T., and Sanroman, M.A., Heterogeneous electro-Fenton treatment: preparation, characterization and performance in groundwater pesticide removal, Ind. Eng. Chem. Res., 2015, vol. 27, p. 276.
Maria, A., Solano, S., and Cristina, I., Application of electro-Fenton process as alternative for degradation of Novacron Blue dye, J. Environ. Chem. Eng., 2014, vol. 2, p. 875.
Su, C., Chang, A., and Bellotindos, L.M., Degradation of acetaminophen by Fenton and electro-Fenton processes in aerator reactor, Sep. Purif. Technol., 2012, vol. 99, p. 8.
Wang, Y., Zhao H., and Chai, S., Electrosorption enhanced electro-Fenton process for efficient mineralization of imidacloprid based on mixed-valence iron oxide composite cathode at neutral pH, Chem. Eng. J., 2015, vol. 223, p. 524.
Rodriguez, M.L., Timokhin, V.I., and Contreras, S., Rate equation for the degradation of nitrobenzene by Fenton-like reagent, Adv. Environ. Res., 2003, vol. 7, p. 583.
Buxton, G.V., Greenstock, C.L., and Helman, W.P., Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (OH/O−) in aqueous solution, J. Phys. Chem. Ref. Data., 1986, vol. 17, p. 513.
Nidheesh, P.V. and Gandhimathi, R., Trends in electro-Fenton process for water and wastewater treatment: An overview, Desalination, 2012, vol. 299, p. 1.
David, C., Arivazhagan, M., and Tuvakara, F., Decolorization of distillery spent wash effluent by electro-oxidation (EC and EF) and Fenton processes: A comparative study, Ecotoxicol. Environ. Saf., 2015, vol. 121, p. 142.
Maria, A., Solano, S., and Garcia-segura, S., Degradation of acidic aqueous solutions of the diazo dye Congo Red by photo-assisted electro-chemical processes based on Fenton’s reaction chemistry, Appl. Catal. B Environ., 2015, vol. 168, p. 559.
Thirugnanasambandham, K. and Sivakumar, V., Optimization of treatment of grey wastewater using Electro-Fenton technique- Modeling and validation, Process Saf. Environ. Prot., 2015, vol. 95, p. 60.
Zhang, C., Zhou, M., and Ren, G., Heterogeneous electro-Fenton using modified iron- carbon as catalyst for 2,4-dichlorophenol degradation: Influence factors, mechanism and degradation pathway, Water Res., 2014, vol. 70, p. 414.
Seyyedali, M., Behnoush, A., and Ali, T., Optimizing electro-coagulation and electro-Fenton process for treating car wash wastewater, Environ. Health Eng. Manage. J., 2017, vol. 4, p. 37.
Ghosh P., Samanta A. N. and Ray S., Reduction of COD and removal of Zn2+ from rayon industry wastewater by combined electro-Fenton treatment and chemical precipitation, Desalination, 2011, vol. 266, p. 213.
Lai, B., Zhou, Y., and Wang, J., Application of excitation and emission matrix fluorescence (EEM) and UV-vis absorption to monitor the characteristics of Alizarin Red S (ARS) during electro-Fenton degradation process, Chemosphere, 2013, vol. 93, p. 2805.
Kourdali, S., Badis, A., and Boucherit, A., Degradation of direct yellow 9 by electro-Fenton: Process study and optimization and monitoring of treated water toxicity using catalase, Ecotoxicol. Environ. Saf., 2014, vol. 110, p. 110.
El-ghenymy, A., Centellas, F., and Rodriguez, R.M., Comparative use of anodic oxidation, electro-Fenton and photoelectro-Fenton with Pt or boron-doped diamond anode to decolorize and mineralize Malachite Green oxalate dye, Electrochim. Acta, 2015, vol. 182, p. 247.
Mohammad, M. and Alireza, M., Efficiency of electro-Fenton process in removing Acid Red 18 dye from aqueous solutions, Process Saf. Environ. Prot., 2017, vol. 111, p. 138.
Amanjit, S., Anoop, V., and Palak, B., Evaluation of the process parameters for Electro-Fenton and Electro-Chlorination treatment of reactive black 5 (RB5) dye, J. Electrochem. Soc., 2017, vol. 164, p. 203.
Mousavi, A., Mokhtari, M., and Khashij, M., Evaluating Fenton process efficiency in removal of reactive red 2 from aqueous solution, J. Environ. Health Sustain. Dev., 2017, vol. 2, p. 292.
Malak, M. and Nizar, B., Treatment of a Tunisian textile effluent containing Bromothymol Blue dye using anodic oxidation on Boron Doped Diamond electrode, J. Tunisian Chem. Soc., 2017, vol. 19, p. 32.
Ghosh P., Thakur L.K., Samanta A.N., and Ray S., Electro-Fenton treatment of synthetic organic dyes: Influence of operational parameters and kinetic study, Korean J. Chem. Eng., 2012, vol. 29, p. 1203.
Ghime D., Kumar V., and Ghosh P., Electrochemical Oxidation of Diazo Dye Trypan Blue in Aqueous Medium: Influence of Experimental Parameters and Kinetic Study, Presented at 1st International Conference on New Frontiers in Engineering, Science & Technology (NFEST-2018), Delhi Technological University, 8th–12th of January 2018.
Meijide, J., Rosales, E., and Pazos, M., p-Nitrophenol degradation by electro-Fenton process: Pathway, kinetic model and optimization using central composite design, Chemosphere, 2017, vol. 185, p. 726.
Bahadir, K.K. and Pelin, D., Electrochemical oxidation of resorcinol in aqueous medium using boron-doped diamond anode: reaction kinetics and process optimization with response surface methodology, Front. Chem., 2017, vol. 5, p. 75.
Hongna, L., Yujiao, L., and Xiuping, Z., Influencing factors and chlorinated byproducts in electrochemical oxidation of bisphenol A with boron-doped diamond anodes, Electrochim. Acta., 2017, vol. 246, p. 1121.
Sarah, B., Souad, B., and Malika, C., Study of oxytetracycline degradation by means of anodic oxidation process using platinized titanium (Ti/Pt) anode and modeling by artificial neural networks, Process Saf. Environ. Prot., 2017, vol. 111, p. 170.
Pape, A.D., Nihal, O., and Mame, D.G.S., Oxidative degradation and mineralization of the phenylurea herbicide fluometuron in aqueous media by the electro-Fenton process, Sep. Purif. Technol., 2017, vol. 186, p. 197.
Nejmeddine, R., Sabrine, B.K., and Mohamed El, K. S., Anodic oxidation of chlorinated pesticides on BDD and PBO2 electrodes: kinetics, influential factors and mechanism determination, Mod. Chem. Appl., 2017, vol. 5, p. 234.
Mukherjee, P., Bagchi, J., and Dutta, S., The nickel supported platinum catalyst for anodic oxidation of ethanol in alkaline medium, Appl. Catal. A Gen., 2015, vol. 506, p. 220.
Olvera-vargas, H., Oturan, N., and Oturan, M.A., Electro-Fenton and solar photoelectro-Fenton treatments of the pharmaceutical ranitidine in pre-pilot flow plant scale, Sep. Purif. Technol., 2015, vol. 146, p. 127.
Lei, Y., Liu, H., and Shen, Z., Development of a trickle bed reactor of electro-Fenton process for wastewater treatment, J. Hazard. Mater., 2013, vol. 261, p. 570.
Krengvirat, W., Sreekantan, S., and Noor, A.M., Carbon-incorporated TiO2 photoelectrodes prepared via rapid-anodic oxidation for efficient visible-light hydrogen generation, Int. J. Hydrog. Energy., 2012, vol. 37, p. 10046.
Rui, Z., Chen, C., and Lu, Y., Anodic alumina supported Pt catalyst for total oxidation of trace toluene, Chin. J. Chem. Eng. 2014, vol. 22, p. 882.
Teng, C.C., Ten-En, C., and Ming-Chun, L., Removal of COD from TFT-LCD Wastewater by Electro-Fenton Technology Using a Tubular Reactor, J. Environ. Eng., 2017, vol. 143, p. 4017.
Annabel, F., Lazhar, L., and Lurdes, C., Electro-Fenton oxidation of reverse osmosis concentrate from sanitary landfill leachate: Evaluation of operational parameters, Chemosphere, 2017, vol. 184, p. 1223.
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия