Электрохимия, 2019, T. 55, № 7, стр. 808-824
Оценка поведения адсорбирующихся из воды ионов Ca(II) и Mg(II) (жесткость воды) с помощью потенциометрического сенсора с электродом на основе модифицированной металлоорганической каркасной структуры меди
Т. А. Али a, *, Х. М. Абд Эль Салам a, Х. Р. Али a, Ю. М. Мустафа a
a Египетский научно-исследовательский институт нефти (EPRI)
11727 Каир, Египет
* E-mail: dr_tamerawad@yahoo.com
Поступила в редакцию 28.06.2017
После доработки 28.06.2017
Принята к публикации 10.04.2018
Аннотация
Исследована адсорбция ионов Ca(II) и Mg(II) из воды при различных их концентрациях. Обсуждаются такие проблемы, как коррозия и образование накипи. Адсорбентами ионов Ca2+ и Mg2+ из воды служили обычная и модифицированная металлоорганическая каркасная структура (МОКС) на основе меди: [МОКС-Cu, Cu3(1,3,5-бензотрикарбонат)2]. Морфология и структура этих адсорбентoв охарактеризованы методами рентгенофазового дифракционного анализа, ИК-спектроскопии с преобразованием Фурье, адсорбции–десорбции азота и сканирующей электронной микроскопии. Проведено испытание партии образцов при различных условиях. Описаны кинетика и изотермы адсорбции. Экспериментальные данные описаны на основе кинетики второго порядка и с помощью модели Лэнгмюра. Адсорбционная емкость адсорбента МОКС-Cu, модифицированного глутатионом [4.6 мг/г (90.2%) и 6.2 мг/г (87.2%)], выше, чем не модифицированного Cu3(1,3,5-бензотрикарбоната)2 [(9.2 мг/г (81.2%) и 11.3 мг/г (77.4%)] соответственно для ионов Ca(II) и Mg(II) (условия определения: за 6 ч при концентрации 50 ppm, pH 7, 50 мг и 30°C). Предложенные потенциометрические сенсоры демонстрируют широкие области линейности по концентрациям ионов Mg(II) и Ca(II): 1.0 × 10–2–1.0 × 10–7 и 1.0 × 10–2–1.3 × 10–7 М, с нернстовскими наклонами 30.04 ± 0.98 и 29.15 ± 0.44 мВ декада–1 соответственно для ионов Mg(II) и Ca(II), и наименьшими определяемыми концентрациями 1 × 10–7 и 1.3 × 10–7 М для Mg-угольно-пастового электрода (электрод IV) и Ca-угольно-пастового электрода (электрод X). Эти электроды не чувствительны к величине pH в интервалах 2.5–7.5 и 3.0–8.0, обладают быстрым откликом: время отклика – около 7 и 10 с соответственно для электродов (IV) и (X). Полученные результаты находятся в хорошем согласии с данными атомно-абсорбционной спектрометрии с индуктивно связанной плазмой.
ВВЕДЕНИЕ
Вода – наш спасательный трос, жизненно важная дорога, без которой жизнь не существует. Вода – важнейший элемент жизни животных и растений. В настоящее время для воды существует много рисков, таких как загрязнение и засаливание, которые вызывают необходимость внимательного и рационального ее потребления, а также развития и сохранения водных источников и ресурсов [1]. Одно из модальных качеств, атрибут воды – это присутствие в ней Ca и Mg, что обычно обозначают термином “жесткость воды” [2]. Жесткость воды мешает ее использованию в домашнем хозяйстве и промышленности, так как она создает проблемы для систем охлаждения и нагрева, в производстве пара, в изготовлении различных изделий. Высокая концентрация кальция и магния вызывает засорение трубопроводов и теплообменников в результате образования накипи – осадков карбонатов, сульфатов или фосфатов. Поэтому в густонаселенных районах возникает необходимость в получении воды с низким уровнем жесткости для таких производств, как, например, кожевенная промышленность [3, 4]. Здесь жесткость воды (203.6 ppm) выше, чем стандарт для питьевой воды (100.0 ppm, согласно заявлению Министерства здравоохранения Египта, 1991 г.). Поэтому воду для домашнего хозяйства необходимо очищать прежде чем использовать ее для питья и готовки. Существует много технологических способов обработки воды для ее очистки и снижения жесткости, таких как электродеионизация [5], электромембранные процессы [6], ионный обмен [7] и адсорбция [8]. Процесс адсорбции рассматривается как один из наиболее эффективных способов удаления ионов Ca и Mg из водных растворов. В последние годы многочисленные исследования были направлены на разработку высокоизбирательных адсорбентов на основе металлоорганических каркасных структур. Металлоорганические каркасные структуры (МОКС) – это целый класс неорганических–органических материалов. Это упорядоченные пористые структуры с большой площадью поверхности и пористостью. В общем и целом, гибкая и весьма пористая структура МОКС дает возможность “гостевым” частицам, таким как ионы металлов, диффундировать в глубину материала. Форма и размер пор обеспечивают избирательность по отношению к “гостям”, которые способны адсорбироваться. Эти особенности делают МОКС идеальным сорбентом для экстрагирования тяжелых металлов в твердой фазе [9].
Для определения Mg(II) и Ca(II) используют различные инструментальные методы, включая рентгеновскую флуоресценцию [10, 11], оптическую излучательную спектрометрию с индуктивно связанной плазмой [12], спектрофотометрию [13] и нейтронно-активационный анализ [14]. Однако эти инструментальные методы слишком дороги и недоступны большинству аналитических лабораторий, а также требуют больших затрат времени. Интересной областью аналитических исследований остается развитие и применение ион-селективных электродов, чувствительных к катионам металлов [15–19] и анионным частицам [20], поскольку они позволяют разрабатывать точные, быстрые, неразрушающие и дешевые методы анализа. Потенциометрические сенсоры с угольно-пастовыми электродами используются в фармацевтическом и биологическом анализе, в анализе воды [21–24]. Это объясняется их простым устройством, дешевизной, адекватной избирательностью, хорошей точностью, широким диапазоном измеряемых концентраций и способностью анализировать окрашенные и замутненные растворы. Сообщалось [25–31] о модифицированных угольно-пастовых электродах для определения ионов Mg(II) и Ca(II). В настоящей работе успешно исследована очистка воды от ионов Ca и Mg путем адсорбции на металлоорганической каркасной структуре (МОКС): МОКС-Cu, Cu3(1,3,5-бензотрикарбонат)2, и такой же структуре, функционализированной путем покрытия глутатионом (GSH), что увеличивает стабильность частиц по сравнению с не функционализированной МОКС-Cu. Глутатион был выбран для этого исследования адсорбции, потому что он содержит несколько типов связывающих активных мест, таких как группы –SH, –NH2 и –COOH, у которых высокое адсорбционное сродство по отношению к ионам металлов на поверхности адсорбентов [32, 33]. Изготовлены простые, чувствительные и недорогие сенсоры на основе модифицированных угольно-пастовых электродов для определения ионов Mg(II) и Ca(II) в различных образцах воды из разных источников. Наконец, эти электроды сравнивали с другими электродами, селективными по отношению к Mg(II) и Ca(II), и во многих аспектах, таких как наименьшая определяемая концентрация, диапазон определяемых концентраций и избирательность, разработанные нами электроды их превосходят.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Тригидрат нитрата меди(II) (Cu(NO3)2 ⋅ 3H2O), глутатион [2-амино-5-{[2-[(карбоксиметил)амино]-1-(меркаптометил)-2-оксоэтил]амино}-5-оксо-пентаноевая кислота, (H2NCH(CO2H)CH2CH2 CONHCH(CH2SH)CONHCH2CO2H)], 1,3,5-бензотрикарбоновая кислота, N,N-диметилформамид (ДМФ), этанол (C2H5OH), нитрат магния (Mg(NO3)2 · 6H2O) и нитрат кальция(Ca(NO3)2 · · 4H2O) использовались без дополнительной очистки. Для изготовления электродов использовались особо чистые порошок синтетического графита (зерно 1–2 мкм, Aldrich) и парафиновое масло (Merck). В качестве ионов-помех применялись соли – хлориды цинка, магния, кадмия, хрома, стронция, никеля, калия, марганца, свинца, бария, кобальта, натрия, железа (II) и алюминия.
Образцы
Образцы воды включали сточные воды (образец 1 из Египетского научно-исследовательского института нефти, Наср Сити, Каир), воду из градирни (Sidpec Petrochemical Company, образец 2, Амрия, Александрия, Египет), питьевую воду (образец 3 из Египетского научно-исследовательского института нефти, Наср Сити, Каир) и пластовую воду (образец 4, Qarun Petroleum Company, Карама, Аль-Ваххат-Аль-Баххриях, Египет).
Синтез МОКС-Cu
4.5 ммоль гексадигидрата нитрата меди растворяли в 15 мл деионизованной воды и смешивали с 2.5 ммоль бензол-1,3,5-трикарбоновой кислоты, растворенной в 15 мл этанола. Смесь перемешивали в течение 30 мин, затем перенесли в 50‑миллилитровый автоклав, обшитый изнутри тефлоном, запечатали и нагревали при 120°C в течение 12 ч. Продукт отделили фильтрованием и трижды промыли деионизованной водой и этанолом (по 10 мл), а затем в течение ночи сушили при 150°C на воздухе [32].
Синтез МОКС-Cu-GSH
Поверхность МОКС-Cu модифицировали водным раствором L-глутатиона (γ-L-глутамил-L-цистеинил-глицин) по методу внедрения. В 10 мл деионизованной воды растворяли под действием ультразвука нужное количество глутатиона в течение 15 мин, затем добавляли нужное количество МОКС-Cu и продолжали облучать ультразвуком в течение 2 ч, после чего полученный продукт сушили при 60°C.
Приготовление растворов кальция и магния
Исходные растворы Ca2+ и Mg2+ (1000 ppm) готовили, растворяя 1 г Ca(NO3)2 · 4H2O или Mg(NO3)2 · 6H2O в 1 л деионизованной воды. Этот раствор разбавляли до 50, 100, 150, 200, 300 и 400 ppm.
Приготовление модифицированных угольно-пастовых электродов
Обычный угольно-пастовый электрод готовили, смешивая 500 мг порошка графита, предварительно прогретого при 700°C в муфельной печи в течение 10 с, с 300 мкл парафинового масла в ступке с пестиком. Таким же способом готовили и модифицированный электрод (МОКС-Cu), с той лишь разницей, что к порошку графита примешивали нужное количество лиганда [Cu3(1,3,5-бензотрикарбонат)2)], меняя таким образом его состав. Эти пасты вмазывали в трубку из полиэтилена (диаметром 2.5 мм), кончик которой обрезали. Электрический контакт к пасте делали, вставляя сбоку медную проволочку. Поверхность свежеприготовленного угольно-пастового электрода предварительно обрабатывали, выдерживая его в 1.0 × 10–3 М растворе ионов Mg(II) или Ca(II) в течение 1 ч, после чего электрод ополаскивали деионизованной водой. Поверхность электрода освежали, выдавливая наружу больше пасты. Избыток пасты срезали стеклянной палочкой, а срезанную поверхность полировали до блеска на бумаге.
Снятие характеристик
Кристаллическую структуру фаз и размер кристаллитов исследовали методом порошкового рентгенофазового анализа на дифрактометре PAN Analytical X-PERT PRO с рентгеновским CuKα-излучением (λ = 1.540 Å). Удельную площадь поверхности определяли по изотерме адсорбции–десорбции N2 при температуре жидкого азота (‒196°C), используя автоматизированный прибор для газовой сорбции Quantachrome Nova 3200 S. Перед этими измерениями все образцы тщательно обезгаживали при 150◦C в течение ночи в вакууме при давлении 1.3 × 10–3 Па. ИК-спектры с преобразованием Фурье образцов записывали в интервале от 4000 до 500 cм–1 на спектрометре Perkin Elmer (модель spectrum one FT-IR, США). Образцы изготавливали, используя стандартные таблетки KBr. Исследования морфологии и размера кристаллитов адсорбентов проводили методом сканирующей электронной микроскопии (SEM) с помощью эмиссионного автоэлектронного микроскопа Quanta 250 FEG (с автоэмиссионной пушкой).
Лабораторные измерения потенциала вели с помощью pH-метра Jenway 3505. Использовали хлор-серебряный электрод сравнения с двумя жидкостными соединениями Metrohm 6.0726.100 в сочетании с различными ион-селективными электродами. Величину pH измеряли прибором Thermo-Orion, модель Orion 3 stars (США). Перед анализами всю стеклянную посуду тщательно мыли дистиллированной водой и сушили в печи.
Методика адсорбции
Для получения изотермы и термодинамической модели адсорбции мы проводили опыты с адсорбцией при различных концентрациях (50, 100, 150, 200, 300 и 400 ppm) и температурах (303, 313, 323, 333 и 343 K), взяв количество адсорбента (MOКС-Cu или MOКС-Cu-GSH) равным 50 мг, время перемешивания раствора 360 мин и объем рабочего раствора 5 мл. Эти растворы ионов Ca2+ и Mg2+ получали разбавлением их исходных растворов, а значение pH (3, 5, 7, 10 и 12) устанавливали, используя растворы 0.1 M NaOH или HCl. Для изучения кинетики процесса адсорбции и подбора оптимального времени встряхивания рабочего раствора мы варьировали количество МОКС-Cu и МОКС-Cu-GSH (10, 25, 50 и 100 мг) на 5 мл раствора адсорбата и время реакции (60, 120, 240 и 360 мин). Все эксперименты по адсорбции проводили в колбах при слабом перемешивании (200 об/мин); температуру регулировали с помощью водяной бани. По окончании каждого опыта суспензию отфильтровывали с помощью центрифуги. После этого определяли концентрацию не адсорбировавшихся ионов металлов с помощью метода хроматографии; эффективность удаления (RE) рассчитывали по следующей формуле:
где C0 и Ce – соответственно, исходная концентрация ионов Ca(II) и Mg(II) и концентрация по достижении равновесия (мг л–1).Калибровка сенсоров
Новый модифицированный угольно-пастовый электрод калибровали, перенося аликвоты по 10 мл 1.0 × 10–7–1 × 10–2 М растворов Ca(II) или Mg(II) в стакан на 25 мл (при 25°C), в который затем погружали ион-селективный электрод на ионы Ca(II) или Mg(II) и Ag/AgCl-электрод сравнения. На графике откладывали изменение потенциала против логарифма концентрации ионов Ca(II) или Mg(II), и таким образом получали калибровочную кривую.
Определение ионов Ca(II) и Mg(II), намеренно введенных в образцы воды
Различные концентрации ионов Ca(II) и Mg(II) добавляли к аликвоте (5 мл) реального образца воды и переносили в стакан на 10 мл. Ионы Ca(II) и Mg(II) определяли потенциометрически, используя различные изготовленные нами электроды. Полученные результаты сравнивали с результатами измерений методом атомно-абсорбционной спектрометрии с индуктивно связанной плазмой [34].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
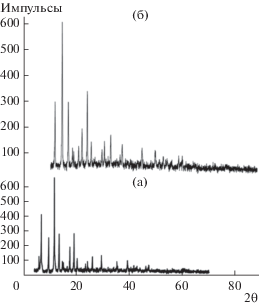
На рис. 1 приведены рентгеновские дифрактограммы приготовленных образцов МОКС-Cu и МОКС-Cu-GSH. При сравнении с теоретической дифрактограммой [35] они подтверждают успешный синтез образца с Cu3(1,3,5-бензотрикарбонатом)2 и внедрение глутатиона в поверхность МОКС-Cu без нарушения ее структурной целостности.
Особенности текстуры образцов исследовали с помощью адсорбции–десорбции N2 при температуре –196°C. Cu3(1,3,5-бензотрикарбонат)2 · 3H2O и МОКС-Cu-GSH демонстрируют изотерму адсорбции N2 типа I, характерную для в высшей степени микропористого материала. В табл. 1 показано, что площадь поверхности образца МОКС-Cu (1315 м2/г) больше, чем площадь поверхности образца МОКС-Cu-GSH (1017 м2/г). Это можно объяснить тем, что внедренный глутатион блокирует мелкие поры в МОКС-Cu, что приводит к уменьшению площади поверхности образца и общего объема пор с 0.8012 cм3/г (МОКС-Cu) до 0.7216 cм3/г (МОКС-Cu-GSH). На рис. 2 даны SEM-микрофотографии образцов МОКС-Cu и МОКС-Cu-GSH. Они показывают, что формы на поверхности обоих образцов приблизительно одинаковы; это говорит о том, что глутатион распределен равномерно по поверхности Cu3(1,3,5-бензотрикарбоната)2, а кроме того, не меняет его морфологию.
Таблица 1.
Структурообразующие свойства синтезированных образцов MOF-Cu и MOF-Cu-GSH
| Образцы | SBET, м2/г | Smicro, м2/г | VP, cм3/г |
|---|---|---|---|
| MOF-Cu | 1315 | 712 | 0.8012 |
| MOF-Cu-GSH | 1017 | 561 | 0.7216 |
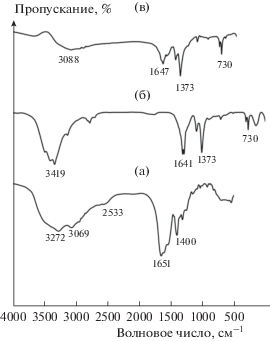
ИК-спектры с преобразованием Фурье образцов МОКС-Cu и МОКС-Cu-GSH показаны на рис. 3. На нем даны ИК-спектры свежеприготовленного МОКС-Cu. В низкочастотной области (менее 730 cм–1) появляется колебательная мода единиц димерной меди [36]. Полосы при 1641 и 1375 cм–1 относятся к присутствию в образце карбоксильных групп [37]. Широкая полоса приблизительно при 3100–3500 cм−1 относится к частоте валентных колебаний O–H в кластере воды [37]. В глутатионе полосу при 1651 cм–1 можно приписать группе –COOH глицинового остатка, в МОКС-Cu-GSH она слегка сдвинута к 1647 cм–1, что подтверждает наличие связывания. Глутатион демонстрирует два пика симметричных валентных колебаний группы –NH2 при 3272 и 3069 cм–1 [38]; но в МОКС-Cu-GSH эти два пика сливаются в один приблизительно при 3088 cм–1, что свидетельствует о неподеленности групп N–H. Полосу при 2533 cм–1 в глутатионе можно приписать валентным колебаниям; в спектре МОКС-Cu-GSH этот пик пропадает, указывая на депротонирование и координирование в тиольной группе [39].
Влияние рН
Рисунок 4 показывает, что при увеличении pH с 3 до 12 на МОКС-Cu адсорбционное удаление ионов Ca(II) возрастает с 43 до 89%, а ионов Mg(II) – с 42 до 87%, в то время как на МОКС-Cu-GSH адсорбционное удаление ионов Ca(II) возрастает с 54 до 94.5%, а ионов Mg(II) – с 49 до 91.4%. Значение pH оказывает различное влияние на адсорбционную емкость в зависимости от типа адсорбента и функциональных групп. Основные структурные единицы глутатиона, присутствующие в МОКС-Cu-GSH, содержат разнообразные функциональные группы (–COOH, –SH, –NH2). Эти группы могут прочно связываться с металлом, что приводит к высокой адсорбционной емкости в отношении металлов; при более высоких значениях рН поверхность приобретает чистый отрицательный заряд, создавая ситуацию, электростатически благоприятную для усиления адсорбции катионов металла. Это можно объяснить тем, что при низких значениях pH (в кислых растворах) карбоксильные группы (COOH) и аминогруппы (NH2) в глутатионе легко протонируются, что вызывает электростатическое отталкивание катионов металлов. Поэтому между протонами и ионами металлов существует конкуренция, результатом которой является уменьшение адсорбированного количества. С ростом pH это электростатическое отталкивание ослабляется, а вместе с ним и протонирование вышеупомянутых групп, что увеличивает поглощение металла. При более высоких pH эти депротонированные группы, т.е. отрицательно заряженные карбоксилат и свободная электронная пара на азоте, становятся более нуклеофильными и потому образуют комплексы с ионами металлов [40].
Влияние количества адсорбента
На рис. 5 приведен график процентного содержания адсорбированных ионов кальция и магния в зависимости от количества задействованного адсорбента. С ростом количества адсорбента с 10 до 100 мг адсорбционное удаление Ca(II) на МОКС-Cu возрастает с 31 до 89.9%, а Mg(II) – с 19 до 84.5%, в то время как на МОКС-Cu-GSH оно растет для Ca(II) с 45 до 93.4%, а для Mg(II) – с 39.5 до 90.5%. Аналогичная тенденция просматривалась и в работе [41]. Это означает, что с ростом массы адсорбента соответствующая эффективность удаления (RE) возрастает как в случае Ca(II), так и в случае Mg(II), благодаря большей площади поверхности для адсорбции и большему числу активных мест для связывания ионов. Адсорбционная активность МОКС-Cu-GSH по отношению к удалению ионов Ca(II) и Mg(II) из воды выше, чем активность МОКС-Cu, благодаря склонности Ca(II) и Mg(II) связываться с тиольными функциональными группами, присутствующими в МОКС-Cu-GSH и образующими прочные ковалентные связи с получением CaS и MgS.
Влияние исходной концентрации ионов металлов
Для того, чтобы выявить влияние исходной концентрации ионов металлов на адсорбцию, были поставлены опыты в широком диапазоне исходных концентраций ионов металлов (50–400 мг/л). Рисунок 6 показывает, что с ростом исходной концентрации ионов металлов с 50 до 400 мг/л адсорбционное удаление на МОКС-Cu снижается в случае Ca(II) с 81.2 до 19.7%, а в случае Mg(II) – с 77.4 до 17.2%, в то время как на МОКС-Cu-GSH оно уменьшается в случае Ca(II) с 90.2 до 30.6%, а в случае Mg(II) – с 87.2 до 22.9%. Для обоих адсорбентов наблюдается высокое адсорбционное сродство по отношению к ионам кальция и магния. Причина наблюдаемого эффекта в том, что при более низкой концентрации больше пространства пор и мест для адсорбции на поверхности МОКС становится доступным для Ca(II) и Mg(II); но с ростом их концентрации адсорбционная емкость обоих типов МОКС неуклонно падает из-за снижения наличия свободного пространства пор и числа мест для адсорбции.
Изотерма адсорбции
Изотермы адсорбции содержат несколько постоянных параметров, отражающих свойства поверхности и сродство адсорбента, и это делает возможным оценивать адсорбционную емкость адсорбента по отношению к иону металла. Данные, полученные для равновесных условий, мы анализировали с помощью модельных изотерм Ленгмюра и Фрейндлиха с тем, чтобы добиться наилучшего фитинга. Две вышеупомянутых изотермы – самые популярные при описании адсорбционных систем твердое тело–жидкость. Ниже приводятся два уравнения для фитинга экспериментальных данных [42]:
(1) изотерма Ленгмюра:
(2)
$\frac{{{{c}_{{\text{e}}}}}}{{{{q}_{{\text{e}}}}}} = \frac{1}{{b{{q}_{{\text{m}}}}}} + \frac{{{{c}_{{\text{e}}}}}}{{{{q}_{{\text{m}}}}}},$(2) изотерма Фрейндлиха:
где k и n – константы Фрейндлиха, относящиеся, соответственно, к адсорбционной емкости и интенсивности адсорбции. Эффективность адсорбции выражается через безразмерный постоянный коэффициент распределения, или равновесный параметр RL, определяемый следующим соотношением [43]: где c0 – исходная концентрация иона металла. Значения параметра RL связано с формой изотермы, которая может быть неблагоприятной (RL ≥ 1) или благоприятной (0 ≤ RL ≤ 1).Таблица 2 и рис. 7a, 7б иллюстрируют модельные изотермы Ленгмюра и Фрейндлиха в приложении к адсорбции ионов Ca(II) и Mg(II), соответственно, на МОКС и МОКС-GSH. Модель Ленгмюра указывает на то, что на поверхности адсорбента образуется монослой адсорбата. Также обнаружилось, что в случае МОКС-Cu значение Qmax для Ca(II) (8.9 мг) выше, чем для Mg(II) (8.23 мг), в то время как в случае МОКС-Cu-GSH для Ca(II) и Mg(II) получаются значения, соответственно, 11.56 и 10.74 мг. Для адсорбции Ca(II) и Mg(II) на адсорбентах МОКС-Cu и МОКС-Cu-GSH получается коэффициент корреляции R2 = = 0.99, что очень близко к 1.
Таблица 2.
Параметры изотерм адсорбции
| Модель на основе уравнения Ленгмюра | Модель на основе уравнения Фрейндлиха | |||||
|---|---|---|---|---|---|---|
| Адсорбент | Qm, мг/г | KL, мин–1 | R2 | KF | n | R2 |
| MOF-Cu(Ca2+) | 8.9 | 1.17 | 0.998 | 2.27 | 3.72 | 0.902 |
| MOF-Cu(Mg2+) | 8.23 | 1.13 | 0.996 | 2.38 | 3.59 | 0.876 |
| MOF-Cu-GSH(Ca2+) | 11.56 | 0.114 | 0.999 | 3.06 | 3.34 | 0.913 |
| MOF-Cu-GSH(Mg2+) | 10.74 | 0.088 | 0.991 | 2.65 | 3.45 | 0.966 |
Рис. 7.
Изотермы Ленгмюра и Фрейндлиха для адсорбции ионов Ca и Mg на МОКС-Cu (а). Изотермы Ленгмюра и Фрейндлиха для адсорбции ионов Ca и Mg на МОКС-Cu-GSH (б).
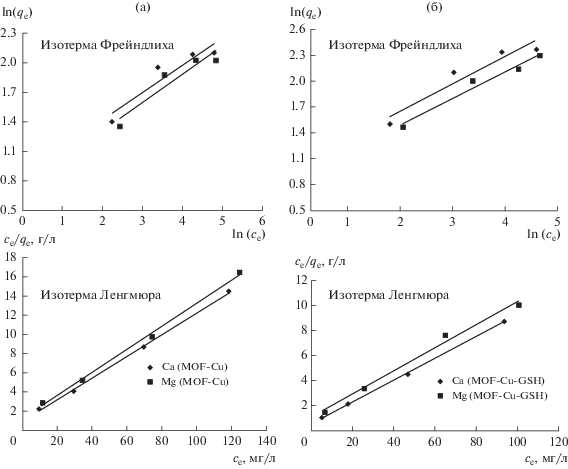
Модельная изотерма Фрейндлиха для МОКС-Cu и МОКС-Cu-GSH дала более низкое значение коэффициента корреляции; это означает, что данная модель хуже описывает адсорбцию ионов металлов Ca(II) и Mg(II). В дальнейшем применимость модели Ленгмюра была подтверждeна фитингом этих экспериментальных данных.
Влияние времени контактирования и кинетика адсорбции
Рисунок 8 иллюстрирует влияние времени контактирования на процент удаления Ca(II) и Mg(II) из воды с помощью адсорбентов МОКС-Cu и МОКС-Cu-GSH за различные интервалы времени (от 60 до 360 мин) при комнатной температуре. Исследование этих временных зависимостей показало, что процесс адсорбции Ca(II) и Mg(II) с быстрой кинетикой требует времени для достижения максимальной адсорбции. С ростом времени контактирования от 60 до 360 мин процент адсорбционного удаления Ca(II) с помощью МОКС-Cu вырос с 36 до 81.2%, а Mg(II) – с 22 до 80%, в то время как на адсорбенте МОКС-Cu-GSH процент удаления Ca(II) увеличился с 47 до 90.2%, а Mg(II) – с 41 до 87.2%. Причина этого, скорее всего, в том, что радиус гидратированного иона Ca меньше, чем радиус иона Mg, и потому ионы Ca адсорбируются быстрее ионов Mg. Этот результат коррелирует с данными работы [3], в которой был найден природный адсорбент – пемза, лучший материал для очистки воды от ионов Ca, чем от ионов Mg. Для того, чтобы проанализировать механизм адсорбции двухвалентных металлов на адсорбентах МОКС, для фитинга экспериментальных данных, полученных с различными концентрациями, были испробованы две кинетических модели – псевдопервого и псевдовторого порядка:
(5)
$\ln \left( {{{q}_{{\text{e}}}} - {{q}_{{\text{t}}}}} \right) = \ln \left( {{{q}_{{\text{e}}}}} \right) - \left( {\frac{{{{k}_{1}}}}{{2.303}}} \right)t,$(6)
$\frac{t}{{{{q}_{{\text{t}}}}}} = \frac{1}{{{{k}_{2}}q_{{\text{e}}}^{2}}} + \frac{t}{{{{q}_{{\text{e}}}}}}.$Выражение для скорости реакции псевдовторого порядка использовано для описания хемосорбции с участием валентных сил посредством разделения или обмена электронами между адсорбентом и адсорбатом с образованием ковалентных связей либо ионного обмена. В последнее время это выражение для реакции псевдовторого порядка широко используется при описании адсорбции загрязнителей из водных растворов.
Кинетика адсорбции ионов металлов определяется целым комплексом факторов, таких как механизм адсорбции, электростатические эффекты, ионные радиусы, электроотрицательность, “предпочтение” функциональных групп сорбента по отношению к конкретным ионам металлов и т.п. [44]. В табл. 3 представлены экспериментальные и вычисленные значения qe и R2. Из табл. 3 и рис. 9a, 9б видно, что модель кинетики псевдовторого порядка не дает хорошего фитинга экспериментальных данных. Напротив, кинетика псевдопервого порядка дает гораздо лучшие коэффициенты корреляции: R2 = 0.997 и 0.998 соответственно для адсорбции Ca(II) и Mg(II) на адсорбенте МОКС-Cu-GSH. Вычисленные равновесные значения сорбционной емкости для ионов Ca(II) и Mg(II) qe равняются соответственно 6.2 и 5.4 мг г–1, а константа скорости адсорбции псевдопервого порядка k1 – соответственно 0.1809 и 0.1774 г мг–1 мин–1 для ионов Ca и Mg на адсорбенте МОКС-Cu-GSH. Таким образом, можно заключить, что адсорбция Ca(II) и Mg(II) на МОКС-Cu-GSH описывается кинетикой псевдопервого порядка, и процесс зависит как от концентрации раствора, так и от числа имеющихся мест для адсорбции.
Таблица 3.
Параметры кинетики адсорбции
| Адсорбент | Кинетическая модель псевдопервого порядка | Кинетическая модель псевдовторого порядка | |||||
|---|---|---|---|---|---|---|---|
| qe, exp, мг/г | qe, мг/г | k1, мин–1 | R2 | qe, мг/г | k2, мг/(г мин) | R2 | |
| MOF-Cu(Ca2+) | 4.06 | 3.82 | 0.0123 | 0.834 | 5.89 | 0.0108 | 0.990 |
| MOF-Cu(Mg2+) | 4.00 | 3.53 | 0.0101 | 0.725 | 4.75 | 0.0089 | 0.888 |
| MOF-Cu-GSH(Ca2+) | 4.50 | 6.2 | 0.1809 | 0.997 | 5.1 | 0.0276 | 0.945 |
| MOF-Cu-GSH(Mg2+) | 4.30 | 5.4 | 0.1774 | 0.998 | 4.9 | 0.0165 | 0.971 |
Рис. 9.
Кинетика адсорбции ионов Ca и Mg на МОКС-Cu (а). Кинетика адсорбции ионов Ca и Mg на МОКС-Cu-GSH (б).

На адсорбенте МОКС-Cu подход на основе кинетики псевдопервого порядка для адсорбции Ca(II) и Mg(II) дает плохой фитинг с низким значением R2 [0.834 и 0.725 соответственно для Ca(II) и Mg(II)]. Полученные результаты показывают, что уравнение кинетики псевдопервого порядка не подходит для описания адсорбции катионов кальция и магния на МОКС-Cu. С другой стороны, согласно коэффициентам регрессии, хороший фитинг данных по адсорбционной кинетике на МОКС-Cu получается на основе модели псевдовторого, а не псевдопервого порядка, с R2 > 0.99 и 0.88, соответственно, для Ca(II) и Mg(II). Этот вывод настоящей работы находится в хорошем согласии с результатами работы 2016 г. [45], но он противоречит данным работы [46] (также 2016 г.), в которой для адсорбционного удаления катионов кальция и магния не наблюдалось аналогичного поведения; адсорбционная емкость, предсказанная кинетической моделью псевдовторого порядка для Ca (qe = 32.87 мг/г), оказалась относительно высокой по сравнению с таковой для Mg (qe = 30.45 мг/г).
Влияние температуры и термодинамические параметры
На рис. 10 показан график адсорбции Ca(II) и Mg(II) на МОКС-Cu и МОКС-Cu-GSH для температур 303, 313, 323, 333 и 343 K. Этот рисунок показывает, что процент удаления ионов Ca и Mg с помощью адсорбентов МОКС-Cu и МОКС-Cu-GSH падает с ростом температуры; это означает, что для сорбционного удаления Ca(II) и Mg(II) благоприятны более низкие температуры. Причиной такого поведения может быть стремление ионов Ca(II) и Mg(II) переходить из твердой фазы в объем раствора с ростом его температуры.
Изостерическое тепло адсорбции ∆Hx – одна из главных величин для характеристики и оптимизации процесса адсорбции; это критическая переменная для оценки процесса адсорбционного выделения веществ.
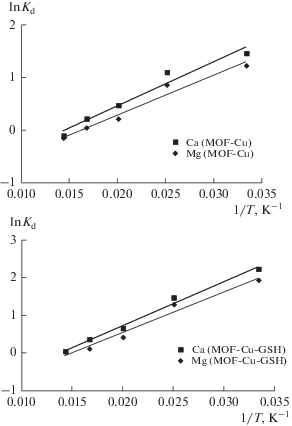
На рис. 11 показано влияние температуры Т на коэффициент распределения; из наклона графика зависимости ln Kd от 1/T и величины отрезка, отсекаемого на оси, были вычислены значения энтальпии (ΔH°) и энтропии (ΔS°) с использованием следующих уравнений:
Здесь Kd – коэффициент распределения, ΔS°, ΔH° и ΔG° – изменения энтропии, энтальпии и свободной энергии Гиббса, T – температура (K), R – универсальная газовая постоянная (8.3145 Дж моль−1 K−1).Вычисленные по уравнениям (7) и (8) термодинамические параметры представлены в табл. 4. Отрицательное значение ΔH° указывает на то, что адсорбция Ca(II) и Mg(II) на МОКС-Cu и МОКС-Cu-GSH – это экзотермический процесс. Отрицательное значение G° указывает на то, что адсорбция – это самопроизвольный процесс, не требующий энергии из внешнего источника. Отрицательное значение ΔS° указывает на уменьшение разупорядоченности на границе раздела твердое тело/жидкость в ходе адсорбции ионов Ca(II) и Mg(II). Для того, чтобы подтвердить преобладающий тип механизма адсорбции, мы вычислили из экспериментальных данных энергию активации (Ea) и вероятность прилипания (S). При этом энергия активации была определена по наклону графика зависимости ln(1 – θ) от 1/T, а заполнение поверхности (θ) вычисляли по уравнению
в котором θ – заполнение поверхности, c0 и c – это, соответственно, исходная и равновесная концентрации (мг л–1).Таблица 4.
Термодинамические параметры
| Адсорбент | ΔG° (кДж моль–1) при различных T, K | ΔS°, кДж моль–1 K–1 | ΔH°, кДж моль–1 | Ea, кДж моль–1 | S* | |||
|---|---|---|---|---|---|---|---|---|
| 203 | 313 | 323 | 333 | |||||
| MOF-Cu(Ca2+) | –364 | –245 | –198 | –100 | –11 | –697 | –0.06403 | 0.586 |
| MOF-Cu(Mg2+) | –336 | –281 | –83 | –19 | –10 | –688 | –0.05112 | 0.1009 |
| MOF-Cu-GSH(Ca2+) | –553 | –482 | –270 | –181 | –13.25 | –965 | –0.09809 | 0.0145 |
| MOF-Cu-GSH(Mg2+) | –478 | –320 | –251 | –172 | –13.22 | –888 | –0.08299 | 0.02734 |
Значения вероятности прилипания (S*) были вычислены из экспериментальных данных. Мы использовали уравнение Аррениуса в приложении к заполнению поверхности [47]:
Значения энергии активации (Ea) и вероятности прилипания (S*), вычисленные по уравнениям (9) и (10), приведены в табл. 4. Отрицательное значение энергии активации (Ea) указывает на отсутствие энергетического барьера для адсорбции на образцах адсорбентов МОКС-Cu и МОКС-Cu-GSH (на которых адсорбция – экзотермический процесс). Однако, значение энергии активации для МОКС-Cu-GSH несколько больше, чем для МОКС-Cu. Возможно, это связано с пористостью адсорбента. Вероятность прилипания S* – это мера способности адсорбата оставаться на адсорбенте. Ее часто интерпретируют следующим образом: S* > 1 (отсутствие сорбции), S* = 1 (сочетание физической сорбции и хемосорбции), S* = 0 (бесконечно сильное прилипание – хемосорбция), 0 < S* < 1 (благоприятное прилипание – физическая сорбция). Значения вероятности прилипания меньше 1 для обоих адсорбентов (МОКС-Cu и МОКС-Cu-GSH): это указывает на то, что вероятности прилипания ионов Ca(II) и Mg(II) к поверхностям этих адсорбентов велики. Эти значения подтверждают, что обсуждаемый процесс сорбции – это физическая сорбция [47].
Состав электродов и их характеристики
Чувствительность потенциометрического угольно-пастового электрода зависит от состава пасты. Было исследовано влияние количества ионофора (МОКС-Cu-GSH) в угольной пасте. Полученные результаты представлены в табл. 5. Для выполнения вышеуказанной задачи были изготовлены пять модифицированных угольно-пастовых электродов (I–XII), которые содержали 2.5, 5.0, 7.5, 10.0 и 12.5 мг ионофора МОКС-Cu-GSH, в то время как содержание других компонентов оставалось постоянным. Измеренные значения наклонов и коэффициентов корреляции таковы: 23.00 ± 2.22 (0.950), 25.40 ± 1.65 (0.969), 29.15 ± 0.11 (0.995), 30.04 ± 0.98 (0.999), 28.96 ± ± 1.21 (0.992) и 26.70 ± 1.79 (0.980), и 21.80 ± 2.02 (0.946), 24.95 ± 1.35 (0.958), 27.75 ± 1.55 (0.990), 29.15 ± 0.44 (0.998), 27.30 ± 1.90 (0.990) и 27.11 ± ± 1.11 (0.985) мВ декада–1, соответственно, для электродов IV (ион Ca(II)) и X (ион Mg(II)). Полученные результаты показывают, что модифицированные электроды (электроды IV и X), содержащие 10 мг ионофора, демонстрируют более высокий нернстовский наклон и более широкую область линейности.
Таблица 5.
Влияние содержания ионофора на эксплуатационные характеристики угольно-пастового сенсора
| Номер электрода | Содержание ионных пар, мг | Область концентраций, М |
Наклон, мВ декада–1 |
Процент обратного извлечения, % |
Полное изменение потенциала, мВ |
|---|---|---|---|---|---|
| Определение Ca(II) | |||||
| I | 2.5 | 1.0 × 10–5–1.0 × 10–2 | 23.00 ± 2.22 | 95.00 | 148 |
| II | 5.0 | 1.0 × 10–6–1.0 × 10–2 | 25.40 ± 1.65 | 96.95 | 160 |
| III | 7.5 | 1.0 × 10–7–1.0 × 10–2 | 29.15 ± 0.11 | 99.50 | 212 |
| IV | 10.0 | 1.0 × 10–7–1.0 × 10–2 | 30.04 ± 0.98 | 99.93 | 217 |
| V | 12.5 | 1.5 × 10–7–1.0 × 10–2 | 28.96 ± 1.21 | 99.20 | 202 |
| VI | 15.0 | 1.0 × 10–6–1.0 × 10–2 | 26.70 ± 1.79 | 98.00 | 197 |
| Определение Mg(II) | |||||
| VII | 2.5 | 5.0 × 10–5–1.0 × 10–2 | 21.80 ± 2.02 | 94.60 | 137 |
| VIII | 5.0 | 1.0 × 10–5–1.0 × 10–2 | 24.95 ± 1.35 | 95.80 | 155 |
| IX | 7.5 | 3.7 × 10–7–1.0 × 10–2 | 27.75 ± 1.55 | 99.00 | 188 |
| X | 10.0 | 1.3 × 10–7–1.0 × 10–2 | 29.15 ± 0.44 | 99.80 | 194 |
| XI | 12.5 | 5.8 × 10–7–1.0 × 10–2 | 27.30 ± 1.90 | 99.00 | 183 |
| XII | 15.0 | 3.7 × 10–6–1.0 × 10–2 | 27.11 ± 1.11 | 98.50 | 170 |
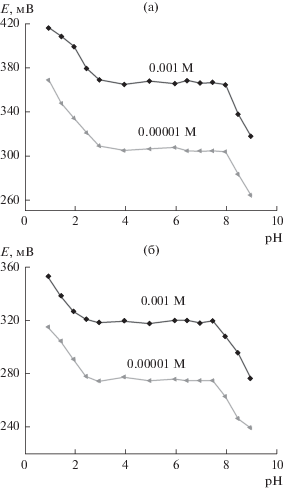
Влияние pH
Исследование кривых потенциал–pH мембранных сенсоров на Ca(II) и Mg(II) на основе ионофора (МОКС-Cu-GSH) показало, что в интервалах рН 3.0–8.0 и 2.5–7.5 для электродов, соответственно, IV и X (рис. 12) потенциал не изменяется больше, чем на ± 2 мВ. При pH > 8 э. д. с. сенсора резко падает из-за осаждения Ca(OH)2 и Mg(OH)2 или образования гидроксильных комплексов кальция и магния и конкуренции иона OH– с ионофором за ионы Ca(II) и Mg(II). При pH < 2.5 наблюдаются существенные помехи со стороны иона H+ с последующим ростом отклика потенциала. Все последующие потенциометрические измерения с ионами Ca(II) и Mg(II) были проведены на фоне 10–3 и 10–5 М ацетатного буфера (pH 5.5).
Влияние температуры исследуемых растворов
Были построены калибровочные графики (зависимости потенциала электрода (Eelec) от p[Ca(II)]) и p[Mg(II)]) для различных температур исследуемых растворов (15–60°C) с целью определить изотермический коэффициент электрода (dE0/dt). Стандартные электродные потенциалы (E0) при различных температурах, полученные из этих калибровочных графиков, как отрезок, отсекаемый на оси при p[Ca(II)] = 0 и p[Mg(II)] = 0, были отложены против величин (t − 25), где t – температура исследуемых растворов (°C) (рис. 13); получены прямолинейные графики в соответствии с уравнением Антропова [48–51]:
Время отклика
Динамическое время отклика – важный фактор для всех ион-селективных электродов. Мы измеряли среднее время, необходимое ион-селективным электродам на Ca(II) и Mg(II) для того, чтобы достичь потенциала в пределах ±1 мВ от окончательного, равновесного значения после погружения в набор растворов ионов кальция и магния, концентрация каждой пары которых различается в 10 раз. В настоящей работе измеряли практическое время отклика после изменения концентрации ионов Ca(II) или Mg(II) в растворе, в области концентраций от 1.0 × 10–2 до 1.0 × × 10–7 М. Кривые потенциал–время показаны на рис. 14. Эти графики потенциал–время для указанных концентраций ясно показывают, что потенциометрическое время отклика составляет 7 и 10 с, соответственно, для Ca(II) и Mg(II) с использованием электродов (IV) и (X). Эти результаты говорят о быстром достижении диффузионного равновесия между водным слоем и мембранным сенсором и о быстром образовании комплекса и ионном обмене в мембране [24, 29, 52–56]. Поведение и чувствительность мембранного электрода не меняются при измерении потенциала с переходом от низких концентраций к высоким или в обратном направлении.
Влияние ионов-помех
Наиболее важная характеристика мембранного сенсора – это его отклик на заданный ион в присутствии посторонних ионов. Ее мера – потенциометрические коэффициенты избирательности (KCa(II),M и KMg(II),M), которые измеряют по методу смешанного раствора [43]. В настоящей работе мы использовали постоянную концентрацию иона-помехи (1 × 10–3 М) и переменную концентрацию ионов Ca(II) и Mg(II): от 1 × 10–2 до 1 × 10–5 М. Найденные коэффициенты избирательности по отношению к различным катионам приведены в табл. 6. Эти данные показывают, что наши угольно-пастовые электроды избирательны по отношению к Ca(II) и Mg(II) на фоне ионов переходных металлов, щелочных и щелочно-земельных металлов и других многовалентных ионов. Эти коэффициенты избирательности были определены согласно следующему уравнению [57]:
(11)
$a_{{\text{M}}}^{{{2 \mathord{\left/ {\vphantom {2 n}} \right. \kern-0em} n}}}K_{{{\text{A,}}\,{\text{M}}}}^{{{\text{MSM}}}} = {{a}_{{\text{A}}}}\left\{ {{{\exp \left( {{{E}_{2}} - {{E}_{1}}} \right)2F} \mathord{\left/ {\vphantom {{\exp \left( {{{E}_{2}} - {{E}_{1}}} \right)2F} {RT}}} \right. \kern-0em} {RT}}} \right\} - {{a}_{{\text{A}}}},$Таблица 6.
Потенциометрические коэффициенты избирательности угольно-пастовых электродов [электрод (IV) на Ca(II) и электрод (X) на Mg(II)] для некоторых ионов-помех
| Ион-помеха | $ - \lg K_{{{\text{Ca(II), В }}}}^{{{\text{MSM}}}}$ | $ - \lg K_{{{\text{Mg(II),}}\,{\text{В }}}}^{{{\text{MSM}}}}$ | Ион-помеха | $ - \lg K_{{{\text{Ca(II),}}\,{\text{В }}}}^{{{\text{MSM}}}}$ | $ - \lg K_{{{\text{Mg(II),}}\,{\text{В }}}}^{{{\text{MSM}}}}$ |
|---|---|---|---|---|---|
| Fe2+ | 1.65 | 1.42 | Ag+ | 3.07 | 2.97 |
| Zn2+ | 2.71 | 2.54 | Li+ | 4.01 | 3.99 |
| Hg2+ | 1.38 | 1.17 | Na+ | 3.56 | 3.45 |
| Cd2+ | 3.01 | 2.92 | NH4+ | 3.59 | 3.49 |
| Pb2+ | 3.20 | 3.05 | Cl– | 4.07 | 4.02 |
| Mn2+ | 2.95 | 2.78 | I– | 4.12 | 4.00 |
| Ni2+ | 2.87 | 2.56 | ${\text{SO}}_{4}^{{2 - }}$ | 2.95 | 2.86 |
| Fe3+ | 1.98 | 1.88 | ${\text{NO}}_{3}^{ - }$ | 4.11 | 4.10 |
| Al3+ | 3.32 | 3.22 | Br– | 4.31 | 4.24 |
Как известно, коэффициент избирательности зависит от способности ионофора к связыванию иона и состава электродов (IV) и (X). Эти невысокие значения коэффициентов избирательности можно объяснить тем, что с ростом ионной силы снижается коэффициент активности иона, следовательно, и активность определяемого иона [ионов Ca(II) и Mg(II)]. Этот спад активности определяемого иона сам по себе вызывает уменьшение потенциала, который до некоторой степени противодействует росту потенциала, вызванному ионом-помехой.
Аналитические применения
Предложенные электроды (IV) и (X) с успехом применялись для непосредственного определения ионов Ca(II) и Mg(II) в различных реальных образцах воды, в которые они были намеренно добавлены. Эти образцы готовили, добавляя аликвоты растворов Ca(II) и Mg(II) в реальные образцы воды из градирни, речной воды и питьевой воды; непосредственно определяли количество добавленных Ca(II) и Mg(II) в этих образцах (см. табл. 7). Процент обратного извлечения (n = 5) ионов Ca(II) и Mg(II) при различных их концентрациях определяется вполне количественно [58–60].
Таблица 7.
Определение ионов Ca(II) и Mg(II) в образцах воды, в которые они были намеренно добавлены, с использованием электродов (IV) и (X)
| Образец | Добавлено | Электрод (IV) | Электрод (X) | ICP-AESб | |||
|---|---|---|---|---|---|---|---|
| найдено | RSDa, % | найдено | RSDa, % | найдено | RSDa, % | ||
| 1 | 1.50 | 1.49 | 0.62 | 1.48 | 0.94 | 1.46 | 1.02 |
| 2 | 1.00 | 0.98 | 0.71 | 0.96 | 1.04 | 0.95 | 1.13 |
| 3 | 1.55 | 1.54 | 0.49 | 1.53 | 0.88 | 1.51 | 1.01 |
| 4 | 2.00 | 1.99 | 0.59 | 1.98 | 0.79 | 1.96 | 1.10 |
ЗАКЛЮЧЕНИЕ
В настоящей работе приготовлены адсорбенты МОКС-Cu и МОКС-Cu-GSH и исследована их адсорбционная эффективность по отношению к удалению ионов Ca(II) и Mg(II) из водных растворов. Адсорбент МОКС-Cu-GSH демонстрирует более высокую адсорбционную активность по отношению к ионам Ca и Mg из воды, чем МОКС-Cu. Кинетика адсорбции протекает по модели псевдовторого порядка, а изучение изотерм показало, что для описания экспериментальных данных можно использовать изотерму Ленгмюра. Показано, что с ростом температуры в эксперименте адсорбционная емкость уменьшается. Это указывает на тот факт, что при комнатной температуре адсорбируется больше ионов Ca и Mg и что процесс адсорбции по своей природе экзотермичен.
Предложенные электроды очень просты в изготовлении, они демонстрируют высокую чувствительность и широкую область динамического отклика. Высокая избирательность угольно-пастовых электродов позволяет считать их потенциально полезными для мониторинга уровня концентраций кальция и магния в различных образцах воды без необходимости стадий предварительного концентрирования или предобработки и без сколько-нибудь существенных помех со стороны других катионов, присутствующих в образцах. Предложенные электроды показали хорошие эксплуатационные характеристики (чувствительность, стабильность, быстрота отклика, наименьшая определяемая концентрация, широкая область линейности). Эти электроды были успешно использованы для определения содержания кальция и магния в различных образцах воды.
Список литературы
Zhao, X., Cai, H., Chen, Z., Gong, H., and Feng, Q., Assessing urban lifeline systems immediately after seismic disaster based on emergency resilience, Structure Infrastructure Eng., 2016, vol. 12, p. 1634.
Tegel, M., Schöne, S., Kieback, B., and Röntzsch, L., An efficient hydrolysis of MgH2-based materials, Int. J. Hydrogen Energy, 2017, vol. 42, p. 2167.
Sepehr, M.N., Zarrabi, M., Kazemian, H., Amrane, A., Yaghmaian, K., and Ghaffari H.R., Removal of hardness agents, calcium and magnesium, by natural and alkaline modified pumice stones in single and binary systems, Appl. Surf. Sci., 2013, vol. 274, p. 295.
Sheikholeslami, R., Composite scale formation and assessment by the theoretical Scaling Potential Index (SPI) proposed previously for a single salt, Desalination, 2011, vol. 278, p. 259.
Fu, L., Wang, J., and Su, Y., Removal of low concentrations of hardness ions from aqueous solutions using electrodeionization process, Separation Purification Technol., 2009, vol. 68, p. 390.
Park, J.-S., Song, J.-H., Yeon, K.-H., and Moon, S.-H., Removal of hardness ions from tap water using electromembrane processes, Desalination, 2007, vol. 202, p. 1.
Apell, J.N. and Boyer, T.H., Combined ion exchange treatment for removal of dissolved organic matter and hardness, Water Res., 2010, vol. 44, p. 2419.
Seifi, L., Torabian, A., Kazemian, H., Bidhendi, G.N., Azimi, A.A., Nazmara, S., et al., Adsorption of BTEX on surfactant modified granulated natural zeolite nanoparticles: parameters optimizing by applying taguchi experimental design method, CLEAN–Soil, Air, Water, 2011, vol. 39, p. 939.
Furukawa, H., Gándara, F., Zhang, Y.-B., Jiang, J., Queen, W.L., Hudson, M.R., et al., Water adsorption in porous metal–organic frameworks and related materials, J. Amer. Chem. Soc., 2014, vol. 136, p. 4369.
Al-Sabagh, A.M., El-Awamri, A.A., Abdou, M.I., Hussien, H.A., Abd El Fatah, H.M., and Rasmy, W.E., Egyptian diatomite as high fluid loss squeeze slurry in sealing fractures and high permeable formation, Egyptian J. Petroleum, 2016, vol. 25, p. 409.
Mitri, E., Millucci, L., Merolle, L., Bernardini, G., Vaccari, L., Gianoncelli, A., et al., A new light on Alkaptonuria, p. A Fourier-transform infrared microscopy (FTIRM) and low energy X-ray fluorescence (LEXRF) microscopy correlative study on a rare disease, Biochim. Biophys. Acta – Gen. Subjects, 2017, vol. 1861, p. 1000.
Natasha, N.C. and Lalasari, L.H., Calcium extraction from brine water and seawater using oxalic acid, AIP Conf. Proc., 2017.
Salem, A., Noaman, E., Kandil, E., Badawi, A., and Mostafa, N., Crystal structure and chemotherapeutic efficacy of the novel compound, gallium tetrachloride betaine, against breast cancer using nanotechnology, Tumor Biology, 2016, vol. 37, p. 11025.
Asare, G.A., Ngala, R.A., Afriyie, D., Adjei, S., Nyarko, A., Anang-Quartey, Y., et al., Calcium Magnesium imbalance implicated in benign prostatic hyperplasia and restoration by a phytotherapeutic drug, Croton Membr. Müll. Arg. BMC Complement. Alternative Medicine, 2017, vol. 17.
Akl, Z.F. and Ali, T.A., Highly sensitive potentiometric sensors for thorium ions detection using morpholine derivative self-assembled on silver nanoparticles, RSC Advances, 2016, vol. 6, p. 77854.
Ali, T.A., Aglan, R.F., Mohamed, G.G., and Mourad, M.A., New Chemically modified screen-printed electrode for Co(II) determination in different water samples, Int. J. Electrochem. Sci., 2014, vol. 9, p. 1812.
Ali, T.A., Azzam, E.M.S., Hegazy, M.A., El-Farargy, A.F.M., and Abd-elaal, A.A., Zinc(II) modified carbon paste electrodes based on self-assembled mercapto compounds-gold-nanoparticles for its determination in water samples, J. Industr. Eng. Chem., 2014, vol. 20, p. 3320.
Ali, T.A., Eldidamony, A.M., Mohamed, G.G., and Elatfy, D.M., Construction of chemically modified electrode for the selective determination of copper(II) ions in polluted water samples based on new β-cyclodextrine and 1,4-bis(6-bromohexyloxy)benzene ionophores, Int. J. Electrochem. Sci., 2014, vol. 9, p. 2420.
Ali, T.A., Farag, A.A., and Mohamed, G.G., Potentiometric determination of iron in polluted water samples using new modified Fe(III)-screen printed ion selective electrode, J. Industr. Eng. Chem., 2014, vol. 20, p. 2394.
Ali, T.A. and Mohamed, G.G., Modified screen-printed ion selective electrodes for potentiometric determination of sodium dodecylsulfate in different samples, J. AOAC Int., 2015, vol. 98, p. 116.
Ali, T.A., Mohamed, G.G., Al-Sabagh, A.M., and Migahed, M.A., A new screen-printed ion selective electrode for determination of citalopram hydrobromide in pharmaceutical formulation, Fenxi Huaxue/Chinese J. Anal. Chem., 2014, vol. 42, p. 565.
Ali, T.A., Mohamed, G.G., Omar, M.M., and Abdrabou, V.N., Improved determination of mebeverine hydrochloride in urine, serum and pharmaceutical preparations utilizing a modified carbon paste electrode, Int. J. Electrochem. Sci., 2015, vol. 10, p. 2439.
Ali, T.A., Soliman, M.H., Mohamed, G.G., Farag, A.B., and Samah, M.K., Development of a new modified screen-printed and carbon paste electrodes for selective determination of cetyltrimethylammonium bromide in different water samples, Int. J. Electrochem. Sci., 2015, vol. 10, p. 3192.
Frag, E.Y.Z., Ali, T.A., Mohamed, G.G., and Awad, Y.H.H., Construction of different types of ion-selective electrodes. characteristic performances and validation for direct potentiometric determination of orphenadrine citrate, Int. J. Electrochem. Sci., 2012, vol. 7, p. 4443.
Abudu, N., Miller, J.J., and Elin, R.J., The effect of thiocyanate on the nova ion-selective electrode for magnesium, J. Clinical Ligand Assay, 2007, vol. 29, p. 182.
Gasser, S., Scherr, E., and Gasser, R., An ion-selective microelectrode study on the effect of acidification on free intracellular magnesium cardiac guinea pig papillary muscle, Trace Elements Electrolytes, 2008, vol. 25, p. 14.
Mosayebzadeh, Z., Ansari, R., and Arvand, M., Preparation of a solid-state ion-selective electrode based on polypyrrole conducting polymer for magnesium ion, J. Iranian Chem. Soc, 2014, vol. 11, p. 447.
Ali, T.A. and Mohamed, G.G., Determination of Mn(II) ion by a modified carbon paste electrode based on multi-walled carbon nanotubes (MWCNTs) in different water samples, Sensors Actuators B: Chem., 2014, vol. 202, p. 699.
Ali, T.A., Mohamed, G.G., Azzam, E.M.S., and Abd-Elaal, A.A., Thiol surfactant assembled on gold nanoparticles ion exchanger for screen-printed electrode fabrication. Potentiometric determination of Ce(III) in environmental polluted samples, Sensors Actuators, B: Chem., 2014, vol. 191, p. 192.
Qu, J., Wu, L., Liu, H., Li, J., Lv, H., Fu, X., et al., A novel Electrochem. biosensor based on DNA for rapid and selective detection of cadmium, Int. J. Electrochem. Sci., 2014, vol. 10, p. 4020.
Zamani, H.A., Nezhadali, A., and Saghravanian, M., Magnesium-PVC membrane sensor based on 4,5-Bis(benzoylthio)-1,3-dithiole-2-thione, Anal. Lett., 2008, vol. 41, p. 2727.
Abiman, P., Wildgoose, G.G., Crossley, A., and Compton R.G., Quantitative studies of metal ion adsorption on a chemically modified carbon surface: adsorption of Cd(II) and Hg(II) on glutathione modified carbon, Electroanalysis, 2009, vol. 21, p. 897.
Li, H., Cui, Z., and Han, C., Glutathione-stabilized silver nanoparticles as colorimetric sensor for Ni2+ ion, Sensors Actuators B: Chem., 2009, vol. 143, p. 87.
Yan, M., Wang, D., Ni, J., Qu, J., Yan, Y., and Chow, C.W., Effect of polyaluminum chloride on enhanced softening for the typical organic-polluted high hardness North-China surface waters, Separation Purification Technol., 2008, vol. 62, p. 401.
Ke, F., Qiu, L.-G., Yuan, Y.-P., Peng, F.-M., Jiang, X., Xie, A.-J., et al., Thiol-functionalization of metal-organic framework by a facile coordination-based postsynthetic strategy and enhanced removal of Hg 2+ from water, J. Hazardous Mater., 2011, vol. 196, p. 36.
Holland, P.L., Cramer, C.J., Wilkinson, E.C., Mahapatra, S., Rodgers, K.R., Itoh, S., et al., Resonance Raman Spectroscopy as a Probe of the Bis (μ-oxo) dicopper Core, J. Amer. Chem. Soc., 2000, vol. 122, p. 792.
Jun, W., Wei-Ping, W., Lu, L., and Bin, X., Self-assembly of water cluster in Cu(II) complexes and magnetic property, J. Molecular Struct., 2013, vol. 1036, p. 174.
Shindo, H. and Brown, T.L., Infrared Spectra of Complexes of L-Cysteine and Related Compounds with Zinc(II), Cadmium(II), Mercury(II), and Lead(II), J. Amer. Chem. Soc., 1965, vol. 87, p. 1904.
Silver, J., Hamed, M.Y., and Morrison, I.E., Studies of the reactions of ferric iron with glutathione and some related thiols. Part V. Solid complexes containing FeII and glutathione or FeIII with oxidized glutathione, Inorg. Chim. Acta, 1985, vol. 107, p. 169.
Fathy, M., Moghny, Th.A., Abdou, M.M., El-Bellihi, A.-H. A.-A., and Awadallah, A.E., Study the Adsorption of Ca(II) and Mg(II) on High Cross-Linked Polystyrene Divinyl Benzene Resin, Int. J. Modern Chem., 2015, vol. 7, p. 36.
Onundi, Y.B., Mamun, A., Al Khatib, M., and Ahmed, Y.M., Adsorption of copper, nickel and lead ions from synthetic semiconductor industrial wastewater by palm shell activated carbon, Int. J. Environ. Sci. Technol., 2010, vol. 7, p. 751.
Hartono, T., Wang, S., Ma, Q., and Zhu, Z., Layer structured graphite oxide as a novel adsorbent for humic acid removal from aqueous solution, J. Colloid Interface Sci., 2009, vol. 333, p. 114.
Bhatnagar, A. and Jain, A., A comparative adsorption study with different industrial wastes as adsorbents for the removal of cationic dyes from water, J. Colloid Interface Sci., 2005, vol. 281, p. 49.
Al-Asheh, S. and Duvnjak, Z., Sorption of heavy metals by canola meal, Water, Air, Soil Pollution, 1999, vol. 114, p. 251.
Mahatmanti, F.W., Nuryono, N., and Narsito, N., Adsorption of Ca(II), Mg(II), Zn(II), and Cd(II) on Chitosan Membrane Blended with Rice Hull Ash Silica and Polyethylene Glycol, Indonesian J. Chem., 2016, vol. 16, p. 45.
Fosso-Kankeu, E., Waanders, F., Maloy, E., and Steyn, B., Reduction of salinity and hardness of water using copolymerized biopolymers.
Horsfall Jnr, M. and Spiff, A.I., Effects of temperature on the sorption of Pb2+ and Cd2+ from aqueous solution by Caladium bicolor (Wild Cocoyam) biomass, Electronic J. Biotechnol., 2005, vol. 8, p. 43.
Антропов, Л.Л. Теоретическая электрохимия, Москва: Мир, 1977.
Ali, T.A., Mohamed, G.G., and Farag, A.H., Electroanalytical studies on Fe(III) ion-selective sensors based on 2-methyl-6-(4-methylenecyclohex-2-en-1-yl)hept-2-en-4-one ionophore, Int. J. Electrochem. Sci., 2015, vol. 10, p. 564.
Ali, T.A., Mohamed, G.G., Omar, M.M., and Hanafy, N.M., Construction and performance characteristics of chemically modified carbon paste electrodes for the selective determination of Co(II) ions in water samples, J. Industr. Eng. Chem., 2015.
Ali, T.A., Mohamed, G.G., and Othman, A.R., Design and construction of new potentiometric sensors for determination of copper(II) ion based on copper oxide nanoparticles, Int. J. Electrochem. Sci., 2015, vol. 10, p. 8041.
Ali, T.A., Mohamed, G.G., El-Dessouky, M.M.I., Abou El Ella, S.M., and Mohamed, R.T.F., Modified carbon paste ion selective electrodes for the determination of iron(III) in water, soil and fish tissue samples, Int. J. Electrochem. Sci., 2013, vol. 8, p. 1469.
Ali, T.A., Mohamed, G.G., El-Dessouky, M.M.I., Abou El-Ella, S.M., and Mohamed, R.T.F., Modified screen-printed electrode for potentiometric determination of copper(II) in water samples, J. Solution Chem., 2013, vol. 42, p. 1336.
Mohamed, G.G., Ali, T.A., El-Shahat, M.F., Al-Sabagh, A.M., and Migahed, M.A., New Screen-Printed Ion-Selective Electrodes for Potentiometric Titration of Cetyltrimethylammonium Bromide in Different Civilic Media, Electroanalysis, 2010, vol. 22, p. 2587.
Mohamed, G.G., Ali, T.A., El-Shahat, M.F., Migahed, M.A., and Al-Sabagh, A.M., Novel screen-printed electrode for the determination of dodecyltrimethylammonium bromide in water samples, Drug Testing Analysis, 2012, vol. 4, p. 1009.
Mohamed, G.G., El-Shahat, M.F., Al-Sabagh, A.M., Migahed, M.A., and Ali, T.A., Septonex-tetraphenylborate screen-printed ion selective electrode for the potentiometric determination of Septonex in pharmaceutical preparations, Analyst, 2011, vol. 136, p. 1488.
Ali, T.A., Aglan, R.F., Mohamed, G.G., and Mourad, M.A., New Chemically Modified Screen-Printed Electrode for Co(II) Determination in Different Water Samples, Int. J. Electrochem. Sci., 2014, vol. 9, p. 1812.
Ali, T.A. and Mohamed, G.G., Potentiometric determination of La(III) in polluted water samples using modified screen-printed electrode by self-assembled mercapto compound on silver nanoparticles, Sensors Actuators, B: Chem., 2015, vol. 216, p. 542.
Ali, T.A. and Mohamed, G.G., Multi-walled carbon nanotube and nanosilica chemically modified carbon paste electrodes for the determination of mercury(II) in polluted water samples, Anal. Methods, 2015, vol. 7, p. 6280.
Ali, T.A., Mohamed, G.G., El-Dessouky, M.M., and Ragheb, R.M., Highly selective potentiometric determination of 1-dodecyl-5-methyl-1H-benzo-1,2,3-triazol-1-ium bromide surfactant in polluted water samples using 1,4-bis-(8-Mercaptooctyloxy)-benzene ionophore, Int. J. Electrochem. Sci., 2015, vol. 10, p. 4820.
Дополнительные материалы отсутствуют.