Электрохимия, 2019, T. 55, № 7, стр. 885-896
Платиновые электрокатализаторы, нанесенные на композиционный оксидно-углеродный носитель
И. Н. Новомлинский a, *, В. Е. Гутерман a, М. В. Даниленко a, В. А. Волочаев a
a Южный федеральный университет, химический факультет
344090 Ростов-на-Дону, ул. Зорге, 7, Россия
* E-mail: novomlinskiy@sfedu.ru
Поступила в редакцию 23.01.2018
После доработки 19.12.2018
Принята к публикации 06.02.2019
Аннотация
Новый наноструктурный Pt/(SnO2/C)-электрокатализатор (20 мас. % Pt) был синтезирован посредством химического осаждения платины на поверхность микрочастиц композиционного SnO2/C-носителя (4 мас. % олова), предварительно полученного оригинальным методом электролитического осаждения олова на дисперсный углерод. Методами рентгеновской дифрактометрии и просвечивающей электронной микроскопиии установлено, что размер наночастиц платины и диоксида олова, распределенных по поверхности углерода равен, соответственно, 2.4 и 2.9 нм. Электрохимические измерения показали, что полученный катализатор близок к коммерческому образцу Pt/C HiSPEC 3000 (20 мас. % Pt) по масс-активности в реакции электровосстановления кислорода и превосходит его по величинам площади электрохимически активной поверхности, стабильности в стресс-тесте и активности в реакции электроокисления метанола. Специфика электрохимического поведения синтезированного Pt/(SnO2/C)-электрокатализатора может быть обусловлена влиянием наночастиц SnO2 на процессы нуклеации/роста наночастиц платины, а также присутствием на поверхности трехграничных наноструктур Pt–SnO2–C. Наличие контакта Pt/SnO2 упрочняет адгезию платины к носителю и обусловливает бифункциональный механизм катализа при электроокислении метанола. При этом наличие контакта Pt/C обеспечивает подвод/отвод электронов к/от этих же наночастиц платины.
ВВЕДЕНИЕ
Низкотемпературные топливные элементы (НТЭ) с полимерной мембраной являются перспективными энергопроизводящими устройствами благодаря высокой эффективности преобразования энергии химической реакции в электрическую, автономности, низкому загрязнению воздуха [1–3]. Наиболее распространенными электрокатализаторами, используемыми в НТЭ, являются платиносодержащие материалы. К сожалению, проблемы, связанные с высокой стоимостью и ограниченными запасами платины, существенно ограничивают их использование [4–7]. Это обусловливает проведение активных исследований в области создания новых и оптимизации характеристик уже известных каталитически активных материалов для НТЭ.
Особое значение имеет поиск катализаторов, сочетающих высокую активность в реакции электровосстановления кислорода (РВК) и стабильность [8, 9], поскольку кинетические затруднения в реакции электровосстановления кислорода существенно снижают напряжение НТЭ, а сам кислород и промежуточные продукты его восстановления обусловливают деградацию катализатора. К сегодняшнему дню предложены различные решения, позволяющие понизить содержание Pt в катализаторе, повысить его активность в РВК и стабильность [10]. Например, эффективные электрокатализаторы были получены путем легирования Pt переходными d-металлами [11, 12] и замены углеродного носителя оксидами металлов [13–17]. Оксидные материалы, выступающие в качестве более стабильной альтернативы по отношению к углеродным носителям, могут повышать каталитическую активность за счет электронного взаимодействия с нанесенными наночастицами платины [14, 18–23]. В качестве одного из перспективных неуглеродных носителей в последнее время широко исследуется диоксид олова (SnO2) [24–27]. К сожалению, низкая электронная проводимость этого материала препятствует его применению в качестве носителя. Кроме того, неясно, каким образом можно было бы получать в мембранно-электродном блоке высокопористый каталитический слой из Pt/SnO2-катализатора. В этой связи большой интерес вызывают композиционные системы на основе SnO2, содержащие пористую электронопроводящую фазу: углеродную сажу [28, 29], углеродные нанотрубки [30] и др. В [24–26, 31, 32] было показано, что частицы SnO2 в композиции с углеродом могут повышать электрокаталитическую активность Pt в РВК за счет электронного взаимодействия между Pt и SnO2, возникающего при образовании трехграничных структур: Pt–SnO2–С. Усиление адгезии наночастиц (НЧ) платины к носителю, обусловленное сильным взаимодействием с НЧ SnO2, существенно повышает стабильность Pt/(SnO2/C)-катализаторов в ускоренных стресс-тестах по сравнению с Pt/C-аналогом [32].
В основе большинства способов нанесения наноразмерных частиц оксида олова на поверхность углеродного носителя лежит реакция гидролиза его соединений [31, 33]. Весьма перспективными, с точки зрения управления морфологией поверхности и чистоты получаемого продукта, могут быть электрохимические методы получения SnO2/С материалов. Так, например, А.Б. Куриганова и соавторами получали оксид олова электрохимическим диспергированием металлического олова в условиях наложения переменного тока промышленной частоты [34, 35]. Частицы олова, образующиеся при разрушении электродов, в дальнейшем оседали на поверхность углерода и самопроизвольно окислялись до SnO2. В результате были получены композиты, содержащие НЧ диоксида олова диаметром 15–20 нм. Последующее нанесение платины на частицы такого композиционного носителя позволило получить Pt/(SnO2 + C)-катализаторы, наибольшая активность которых в реакции электроокисления СО наблюдалась при небольшом содержании SnO2 (2–5 мас. %) По-видимому, часть НЧ платины, закрепленных на поверхности крупных НЧ диоксида олова, являлась электрически изолированной, из-за чего повышение доли диоксида олова в материале более 5% негативно влияло на активность катализатора в реакциях электроокисления метанола и СО. Повышение активности платины в присутствии SnO2 авторы [34, 35] объяснили бифункциональным механизмом электрокатализа: гидроксильные группы, адсорбированные на поверхности SnO2, облегчают окисление молекул СО, адсорбированных на поверхности НЧ платины.
С учетом вышеизложенного можно сделать вывод о том, что двухкомпонентные SnO2/С-носители весьма перспективны для получения нанесенных платиновых электрокатализаторов при условии закрепления НЧ платины на границе раздела диоксид олова–углерод. Закрепление платины на поверхности SnO2 в отсутствие электрического контакта с углеродом, напротив, может приводить к их деактивации в электрокатализе.
В основе настоящего исследования лежит гипотеза о том, что применение композиционного SnO2/С-носителя, содержащего диоксид олова в виде НЧ малого размера, для последующего нанесения НЧ платины, позволит получить трехфазные Pt/(SnO2/C)-электрокатализаторы, в которых, с одной стороны, обеспечен подвод и отвод электронов к/от НЧ платины, а с другой – непосредственный контакт значительной части НЧ платины с НЧ диоксида олова. Целями работы было получение подобного материала оригинальным методом электролитического осаждения, изучение его структуры и электрохимического поведения платиносодержащего катализатора на его основе в РВК и реакции электроокисления метанола в сравнении с коммерческим Pt/C-катализатором.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез SnO2/C
Получение SnO2/C-материалов проводили по оригинальной методике. Электродное пространство двухэлектродной электрохимической ячейки заполняли суспензией дисперсного углеродного материала на основе раствора хлорида олова(II). Суспензию получали путем смешения углеродной сажи Vulсan XC72 (Cabot Corporation, США; удельная площадь поверхности 270 м2 г–1) и 1 М раствора хлорида олова(II) (“х. ч.”), приготовленного на основе 1 M H2SO4. Полученную смесь диспергировали в ультразвуковом гомогенизаторе Sonics в течение 2 мин, после чего непрерывно перемешивали на магнитной мешалке для сохранения однородности суспензии. В суспензию погружали электроды: в качестве катода использовали медную проволоку с площадью рабочей поверхности 0.5 см2, в качестве анода – графитовый стержень. Электролиз вели при интенсивном перемешивании суспензии, пропуская постоянный ток силой 9 А.
Микрочастицы углерода, соприкасаясь с катодом в процессе перемешивания, фактически становились частью катода. На таких микрочастицах происходил процесс электровосстановления ионов олова с формированием наноразмерных кристаллов этого металла. За время электролиза множество частиц углеродного носителя неоднократно соприкасались со стационарным катодом, в результате чего на их поверхности происходили процессы нуклеации/роста частиц олова. Постоянное обновление микрочастиц углерода в электронопроводящем прикатодном слое, обусловленное искусственной конвекцией, привело к более или менее равномерному распределению электроосажденного олова по поверхности микрочастиц углеродного носителя (см. “Результаты и обсуждение”). По-видимому, уже в процессе получения часть наночастиц олова окислялась растворенным кислородом и превращались в наночастицы оксида олова(IV).
После окончания электролиза суспензию фильтровали, затем многократно промывали бидистиллированной водой до нейтральной реакции среды. Осушку проводили в сушильном шкафу при 80°C в течение сут. В процессе фильтрования и высушивания нанесенные на углеродный носитель НЧ олова, оставшиеся неокисленными, окислялись с образованием НЧ диоксида олова.
Суспензию углеродного носителя Vulcan XC72 подвергли аналогичной обработке в растворе 1 M H2SO4 путем пропускания постоянного тока силой 9А. Pt/C-катализатор, полученный после нанесения платины на этот углерод, был использован в качестве образца сравнения.
Получение Pt/(SnO2/C) и Pt/C
Синтез Pt/(SnO2/C)- и Pt/C-катализаторов проводили посредством химического восстановления H2PtCl6 из жидкой фазы, как это описано в [36], в суспензии, содержащей частицы углерода или композиционного SnO2/C-носителя. Расчетная массовая доля Pt в Pt/(SnO2/C) – 20%. Для этого порошкообразный носитель, полученный после проведения электролиза, помещали в 20 мл этиленгликоля, после чего добавляли необходимое количество H2[PtCl6] · 6H2O. Полученную суспензию гомогенизировали ультразвуком, затем последовательно добавляли 0.5 мл 37% НСОН и 1М раствор NaOH в смеси вода–этиленгликоль (1 : 1) до достижения рН 11. После 2-часовой выдержки при 90°С и самопроизвольного охлаждения перемешиваемой суспензии добавляли к ней 20 мл седиментационного агента – 1 М раствора NaCl.
Через 30 мин проводили фильтрование смеси на воронке Бюхнера, 5–6 раз последовательно промывали продукт бидистиллированной водой и этиловым спиртом, затем сушили при 80°С.
Методы исследования
Для определения состава полученных SnO2/C-, Pt/C- и Pt/(SnO2/C)-материалов и наличия в них кристаллитов диоксида олова и платины использовали рентгенофазовый анализ и термогравиметрию. Порошковые дифрактограммы металл- и оксидуглеродных материалов регистрировали на автоматическом дифрактометре ARL X’TRA (Thermo Fisher Scientific, Швейцария) (геометрия по Бреггу–Брентано, радиус 260 мм, вертикальный тета-тета гониометр) с использованием медного Кα-излучения (λ = 1.5418 Å). Типичные установки: 40 кВ, 30 мА, шаг сканирования 0.02 град. Скорость регистрации варьировали от 2 град/мин для простого рентгенофазового анализа до 0.5 град/мин при съемках с целью уточнения деталей структуры. В качестве калибровочного стандарта использовали стандартную пластину поликристаллического альфа-кварца.
По полученным дифрактограммам определяли наличие оксида олова и платины в материалах, а также средний размер (диаметр) кристаллитов как для платины, используя отражение (111), так и для диоксида олова, пик (101). Расчет D проводили по формуле Шеррера, в которую подставляли значение ширины пика соответствующего пика на половине его высоты: D = Kλ/(FWHMcosθ), где λ − длина волны монохроматического излучения, Å, FWHM – ширина пика на полувысоте (в радианах), D – средний размер кристаллитов, нм, θ – угол отражения, радианы, K = 0.89 – постоянная Шеррера.
Массовую долю оксида олова (ω(SnO2)) и платины, соответственно, в SnO2/C и Pt/(SnO2/C) определяли методом термогравиметрии по массе остатка SnO2 или (Pt + SnO2) после сгорания углерода (800°С, 40 мин).
Соотношение платины и олова в исследуемых материалах определяли методом рентгеноспектрального флуоресцентного анализа на спектрометре ARL OPTIM’X (Thermo Fisher Scientific, Швейцария).
Для измерения электрохимической активной площади поверхности (ЭХАП) платины использовали метод циклической вольтамперометрии. Тонкий слой платиносодержащего материала наносили на торец вращающегося дискового электрода. Для этого 6 мкл суспензии, содержащей Pt/(SnO2/C) или Pt/C и добавку полимера Nafion, наносили на торец стеклографитового дискового электрода (ВДЭ). После сушки для закрепления пористого слоя порошка наносили еще 7 мкл 0.05% раствора Nafion в изопропаноле, после чего электрод высушивали 15 мин при комнатной температуре. С помощью потенциостата AFCBP1 (Pine Applied Instrumentation, США) задавали развертку потенциала и фиксировали значения тока.
Первоначально, для стандартизации поверхности Pt и полного удаления примесей проводили 100 циклов развертки потенциала со скоростью 200 мВ с–1 в диапазоне потенциалов от 0 до 1 В. Далее регистрировали 2 циклических вольтамперограммы (ЦВА) в диапазоне потенциалов 0.03–1.20 В при скорости развертки 20 мВ с–1. Затем по количеству электричества, затраченному на электрохимическую адсорбцию и десорбцию атомарного водорода, по 2-й ЦВА проводили расчет ЭХАП, как это описано в [37]. В качестве электрода сравнения использовали Ag/AgCl/KCl-электрод. Все значения потенциалов в работе приведены относительно обратимого водородного электрода (ОВЭ).
При определении площади активной поверхности платины по количеству электричества, затраченному на окисление монослоя хемосорбированного CO, при потенциале исследуемого электрода 0.45 В в течение 20 мин продували через раствор CO, а затем 30 мин – аргон. После этого регистрировали две ЦВА в диапазоне потенциалов 0.03–1.20 В при скорости развертки потенциала 20 мВ с–1.
Для оценки активности катализаторов в РВК проводили измерение серии вольтамперограмм с линейной разверткой потенциала в диапазоне от 0.02 до 1.2 В со скоростью развертки 20 мВ с–1 при скоростях вращения дискового электрода 400, 900, 1600 и 2500 об. мин–1. Значения потенциалов (E) были скорректированы с учетом омического падения напряжения в ячейке по формуле: E = = Eрег – iR, где Eрег – зарегистрированное значение потенциала, В, i – значение силы тока при данном потенциале, А, R – сопротивление электролита, Ом. Измеренная величина сопротивления электролита составила 25 Ом, что хорошо соответствует литературным данным [38]. Кроме того, вычитали фоновую кривую, измеренную в электролите, насыщенном Ar, как это описано в [39]. Расчет кинетического тока и количества электронов, участвующих в реакции, проводили с использованием уравнения Коутецкого–Левича [40]:
Для оценки стабильности электрокатализатора был выбран метод вольтамперометрического циклирования в трехэлектродной ячейке в диапазоне потенциалов 0.6–1.4 В со скоростью развертки 100 мВ/с. Циклирование проводили в 0.1 М растворе HClO4 в атмосфере Ar при 25°C в течение 2000 циклов, при этом после каждых 100 циклов регистрировали две циклические вольтамперограммы (при скорости развертки потенциала 20 мВ/с, диапазон потенциалов – от 0.03 до 1.20 В). По второй ЦВА проводили расчет площади поверхности (S) так, как это описано ранее. Стабильность оценивали по изменению соотношения Sj/S0, где j – число проведенных циклов стресс-теста, и по величине S2000/S0.
Активность катализаторов в реакции окисления метанола оценивали методом ЦВА и потенциостатической хроноамперометрии (Е = 0.8 В) в электролите, содержащем 0.5 М CH3OH на фоне 0.1 М HClO4.
Фотографии ПЭМ получали с помощью микроскопа JEM-2100 (JEOL, Japan) при напряжении 200 кВ и разрешении 0.2 нм. Для проведения измерений 0.5 мг Pt/C помещали в 1 мл изопропанола и диспергировали ультразвуком. Каплю полученной суспензии наносили на медную сетку, покрытую слоем аморфного углерода, которую затем высушивали на воздухе при комнатной температуре в течение 20 мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате электролитического нанесения олова на микрочастицы углеродной сажи были получены SnO2/C-материалы с массовой долей олова от 4 до 40 мас. %. Изучение материалов методом рентгенофазового анализа подтвердило наличие в них фазы оксида олова(IV) (рис. 1). Увеличение массовой доли SnO2 в материале приводит к увеличению интенсивности пиков, характерных для оксида олова(IV) (рис. 1). На дифрактограмме для образца с 40 мас. % загрузкой SnO2 присутствуют также узкие пики, свидетельствующие о наличии окристаллизованной фазы олова, которое, по всей видимости, осыпалось с поверхности катода.
Рис. 1.
Дифрактограммы углеродного носителя Vulcan XC72- и SnO2/C-материалов с разной массовой долей оксида олова (4–40 мас. %).

Для электронно-микроскопического изучения состояния оксида олова был выбран образец SnO2/C с наибольшим содержанием оксида олова – 40 мас. %.
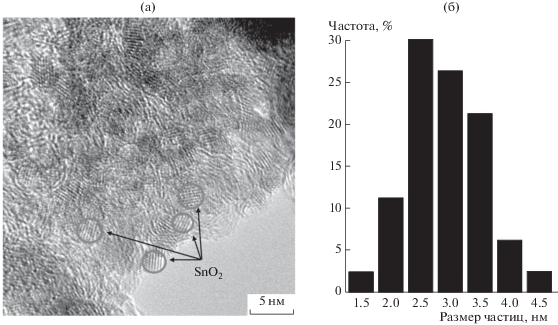
Анализ изображений (рис. 2) показал, что в результате электрокристаллизации олова и последующего окисления этих нанокристаллов на частицах углеродного носителя, действительно, образуются НЧ оксида олова, достаточно равномерно распределенные по поверхности микрочастиц углерода. Средний размер таких частиц составляет примерно 2.9 нм. Таким образом, метод электрокристаллизации олова на частицах углерода в суспензии, разработанный нами для получения SnO2/C-материалов, позволяет получать наночастицы диоксида олова меньшего размера, чем методы синтеза, использованные в работах [31, 32, 34, 35].
Рис. 2.
Просвечивающая электронная микроскопия. Микрофотография фрагмента поверхности SnO2/C-материала (а) и гистограмма размерного распределения наночастиц SnO2 (б). Массовая доля SnO2 – 40%.
При изучении циклических вольтамперограмм SnO2/C-материалов не было обнаружено каких-либо фарадеевских процессов, связанных с окислением остатка металлического олова или восстановления Sn(IV). Основные отличия в характере ЦВА, наблюдаемые при переходе от углеродного (рис. 3а) к оксидно-углеродному (рис. 3б) электроду состоят в увеличении абсолютных значений силы тока на оксидно-углеродном материале. По-видимому, присутствие наноразмерных частиц SnO2 на поверхности микрочастиц углерода приводит к увеличению общей площади поверхности материала, в результате чего на процессы заряда–разряда двойного электрического слоя затрачивается большее количество электричества.
Плоские максимумы в диапазоне потенциалов 0.5–0.8 В (рис. 3б) характерны для взаимопревращений в системе хинон-гидрохинон [41, 42] и обусловлены окислением поверхности углеродного носителя в процессе электролитического нанесения олова. При электролитическом получении композита олово осаждается на контактирующих с катодом частицах сажи с образованием НЧ. В растворе НЧ олова, обладающие низкой термодинамической стабильностью, окисляются до диоксида. При соприкосновении частиц Sn/C и SnO2/C с анодом происходит: а) анодное растворение олова, когда и если металлические НЧ еще не успели превратиться в НЧ оксида; окисление фрагментов поверхности углерода (формирование хинонных групп).
Учитывая низкую электронную проводимость SnO2, а также преимущественную локализацию НЧ SnO2 на поверхности, а не в порах микрочастиц углеродной сажи, для приготовления нанесенного платинового катализатора был использован образец композиционного носителя, содержащий 4 мас. % оксида олова. Выбор такого состава принимал во внимание и результаты [34, 35], кратко описанные во Введении. Рентгеновская дифрактометрия полученного Pt/(SnO2/C)-материала подтвердила наличие в нем фазы платины (рис. 4), средний размер кристаллитов которой составил 2.4 нм. Отметим, что в связи с низким содержанием диоксида олова в катализаторе соответствующие ему широкие отражения практически не различимы на рентгенограмме на фоне платины.
Тем не менее, сравнение микрофотографий фрагментов поверхности SnO2/C- (рис. 2) и Pt/(SnO2/C)-материалов (рис. 5а) позволяет установить наличие как НЧ платины, так и НЧ диоксида олова. Присутствие SnO2 на поверхности катализатора подтверждается также результатами энергодисперсионной рентгеновской спектроскопии (рис. 5в). Отражения меди на данном спектре обусловлены использованием медной сетки в процессе исследования катализатора (см. раздел Методы исследования). Данные, полученные в STEM-режиме (рис. 5б), свидетельствуют о равномерности распределения НЧ платины по поверхности катализатора. Средний размер НЧ составляет 2.3 нм (рис. 5г). Значительная часть НЧ платины контактирует как с углеродом, так и с НЧ оксида олова, т.е. участвует в формировании трехграничных зон.
Рис. 5.
Фотография фрагмента поверхности Pt/(SnO2/C), полученная методом просвечивающей электронной микроскопии (а); STEM-изображение поверхности Pt/(SnO2/C) (б); результат анализа методом энергодисперсионной просвечивающей микроскопии (в) и гистограмма распределения НЧ платины по поверхности носителя (г) в Pt/(SnO2/C)-материале.

Изучение методом рентгенофазового анализа Pt/C-катализатора, полученного на основе углеродного носителя, обработанного в аналогичных условиях, показало наличие характерных отражений платины. Средний размер кристаллитов платины, рассчитанный по полуширине отражения 111 с использованием уравнения Шеррера, составил 1.6 нм.
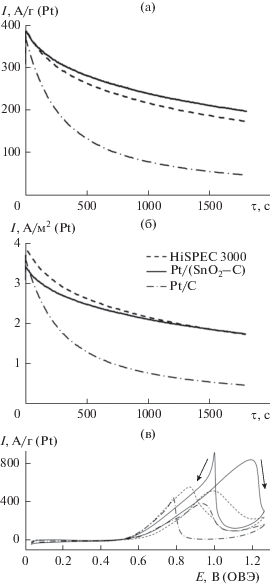
По циклическим вольтамперограммам, измеренным на Pt/(SnO2/C)-электроде после его предподготовки (смотрите раздел Экспериментальная часть), был проведен расчет ЭХАП, которая составила ~118 ± 12 м2 г–1, что превышает ЭХАП коммерческого Pt/C-катализатора HiSPEC 3000 и Pt/C-катализатора, полученного нами в аналогичных условиях (~93 ± 9 и 101 ± 10 м2 г–1 соответственно). Высокие значения ЭХАП в Pt/(SnO2/C)-катализаторе обусловлены, на наш взгляд, сочетанием малого размера НЧ в и низкой степени их агрегации (равномерности пространственного распределения). Также нельзя исключать наличие в трехграничной зоне некоторого количества малоразмерных (менее 1 нм) плохо окристаллизованных НЧ платины, не различимых методами рентгеновской дифрактометрии и ПЭМ. Расчет ЭХАП по количеству электричества, затраченного на окисление адсорбированного СО, подтвердил значения, рассчитанные по количеству электричества, затраченного на адсорбцию и десорбцию водорода (рис. 6а), что позволяет исключить версию о непосредственном участии SnO2 в каких-либо электрохимических реакциях, протекающих в диапазоне потенциалов 0–0.4 В относительно ОВЭ.
Рис. 6.
Циклические вольтамперограммы катализаторов в атмосфере аргона (а) и вольтамперограммы реакции электровосстановления кислорода (б).
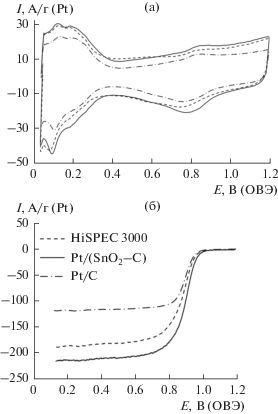
Активность Pt/(SnO2/C) в реакции электровосстановления кислорода очень близка к активности коммерческого аналога (рис. 6б): при одинаковом потенциале полуволны, равном 0.90 В, значения кинетического тока составили 153 и 187 А/г(Pt) для Pt/(SnO2/C) и HiSPEC 3000 соответственно. При этом значения кинетического тока, рассчитанные для “home made” Pt/C, оказались заметно ниже, чем у Pt/(SnO2/C) – (95 А/г(Pt)). С учетом литературных данных [43] можно предположить, что более высокая ЭХАП Pt/(SnO2/C)-материала по сравнению с коммерческим Pt/C не приводит к его более высокой масс-активности в РВК вследствие большей доли малоразмерных (2 нм и ниже) НЧ, поверхность которых обладает пониженной удельной активностью [44]. При этом для катализатора на композиционном носителе наблюдается значительное увеличение удельного кинетического тока (1.30 А/м2) по сравнению с Pt/C на основе предобработанного углерода (1.02 А/м2), что косвенно свидетельствует о позитивном влиянии диоксида олова на активность наночастиц платины.
По результатам стресс-тестов в диапазоне потенциалов 0.6–1.4 В, который соответствует так называемому “протоколу носителя”, Pt/(SnO2/C)-катализатор показал более высокие значения относительной стабильности по сравнению с Pt/C аналогами (рис. 7). Степень деградации Pt/(SnO2/C), Pt/C и HiSPEC3000 после 2000 циклов составила, соответственно, 80, 86 и 88%. Известно, что деградация платиноуглеродных электрокатализаторов при тестировании в диапазоне потенциалов 0.6–1.4 В в значительной степени связана с окислением углеродного носителя в местах контакта с НЧ платины, катализирующими это процесс [11, 44]. Позитивное влияние даже небольшого количества (~4%) диоксида олова на устойчивость катализатора к деградации может быть связано как с более прочной адгезией платины к поверхности носителя в местах трехфазного контакта Pt/(SnO2/C), так и с понижением скорости деградации углерода в местах такого контакта. Полученный результат хорошо коррелирует с данными Na Zhang с соавторами [32], которые наблюдали позитивное влиянии SnO2 на стабильность нанесенных платиновых электрокатализаторов в более “мягких” условиях стресс-тестирования (табл. 1).
Рис. 7.
Изменение площади электрохимически активной поверхности платины в ходе вольтамперометрического стресс-теста. Диапазон потенциалов 0.6–1.4 В, скорость развертки 20 мВ/с. Электролит – 0.1 М раствор HClO4, насыщенный Ar при атмосферном давлении.
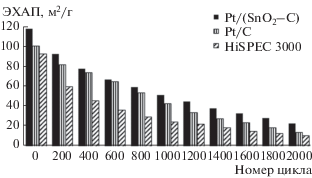
Таблица 1.
Сравнение ЭХАП катализаторов и значений потенциала полуволны в РВК до и после стресс-теста
| Название | ЭХАП, м2/г (Pt) | E1/2, В | ||
|---|---|---|---|---|
| до | после | до | после | |
| Pt/(SnO2 + C) | 118 | 23 | 0.90 | 0.75 |
| HiSPEC 3000 | 93 | 11 | 0.90 | 0.67 |
| Pt/C | 101 | 14 | 0.90 | 0.79 |
С учетом литературных данных о позитивном влиянии диоксида олова на скорость реакции электроокисления метанола (РЭОМ) на платине [35], при изучении этой реакции мы ожидали более высокой активности катализатора, содержащего SnO2. Действительно, значения максимальных токов в РЭОМ на вольтамперограммах прямого и обратного хода, а также площади под соответствующими максимумами оказались для Pt/(SnO2/C)-катализатора заметно выше, чем для Pt/C аналогов (рис. 8в). При проведении РЭОМ в хроноамперометрическом режиме при Е = 0.8 В, оксидсодержащий катализатор также демонстрирует более высокую скорость реакции в течение всего времени измерения (рис. 8а), что может быть связано с более высокой площадью поверхности платины в оксидсодержащем образце. Сопоставление удельных характеристик (рис. 8б) показывает, что активность Pt/(SnO2/C)-катализатора в РЭОМ при 0.80 В падает медленнее, чем активность коммерческого образца. Это может свидетельствовать как об особенности процесса окисления поверхности платины в Pt/(SnO2/C), так и о ее более высокой устойчивости к отравлению продуктами окисления метанола [45]. Для Pt/C-катализатора на основе предобработанного углерода спад тока происходит много быстрее. При сопоставимых значениях начального тока значения конечного тока хроноамперограммы в случае Pt/C приблизительно в 4 раза меньше таковых для Pt/(SnO2/C).
ЗАКЛЮЧЕНИЕ
Методом электроосаждения на поверхности частиц дисперсного углеродного носителя были сформированы НЧ олова, самопроизвольно окисляющиеся до SnO2 компонентами раствора и кислородом воздуха. В результате получены композиционные SnO2/C-материалы, содержащие от 4 до 40% диоксида олова в виде равномерно распределенных малоразмерных НЧ со средним диаметром около 2.9 нм. Посредством химического восстановления Pt(IV) в суспензии SnO2/C на основе материала, содержащего 4 мас. % SnO2, был приготовлен нанесенный Pt/(SnO2/C)-электрокатализатор.
Близость размеров НЧ платины и SnO2 затрудняет электрическую изоляцию сорбированных НЧ платины от углерода и способствует формированию трехграничных областей контакта Pt–SnO2–C в полученном Pt/(SnO2/C)-катализаторе, содержащем около 20 мас. % Pt. При среднем размере НЧ платины 2.3 нм площадь ее электрохимически активной поверхности составляет ~118 ± 12 м2/г (Pt)). Синтезированный Pt/(SnO2/C)-катализатор демонстрирует более высокие значения масс-активности в РВК и коррозионно-морфологической стабильности в условиях вольтамперометрического циклирования в диапазоне потенциалов 0.6–1.4 В по сравнению с Pt/C-материалом, полученным в аналогичных условиях, а также заметно превосходит Pt/C-аналоги по масс-активности в РЭОМ. Причиной установленных особенностей электрохимического поведения Pt/(SnO2/C)-катализатора может быть наличие на его поверхности значительного количества НЧ платины, контактирующих одновременно и с диоксидом олова, и с углеродом. Более прочная адгезия таких НЧ к поверхности композиционного носителя может затруднять деградацию платины в процессе стресс-теста, а наличие контакта Pt/SnO2 – обеспечивать бифункциональный механизм катализа в реакции электроокисления метанола. Другим важным фактором, обусловливающим особенности электрохимического поведения Pt/(SnO2/C)-катализатора, может быть влияние наночастиц диоксида олова на процессы нуклеации/роста наночастиц платины в процессе синтеза катализатора и, как следствие, их более равномерное пространственное распределение, а также наличие плохо идентифицируемых наночастиц очень малого (менее 1 нм) размера. Именно этими факторами может быть обусловлена высокая площадь электрохимически активной поверхности платины, определенная методами электрохимической десорбции атомарного водорода и СО.
Отметим, что влияние НЧ диоксида олова на характеристики платинового катализатора проявляется уже при его небольшом содержании в композите. Учитывая возможность благоприятного влияния контакта Pt/SnO2 на функциональные характеристики катализатора и негативную роль низкой электронной проводимости самого диоксида олова, систематическое изучение влияния содержания SnO2 на электрохимическое поведение Pt/(SnO2/C)-катализаторов может быть полезно для оптимизации их состава.
Список литературы
Debe, M.K., Electrocatalyst approaches and challenges for automotive fuel cells, Nature, 2012, vol. 486, no. 7401, p. 43. https://doi.org/10.1038/nature11115
Ярославцев, А.Б., Добровольский, Ю.А., Шаглаева, Н.С., Фролова, Л.А., Герасимова, Е.В., Сангинов, Е.А. Наноструктурированные материалы для низкотемпературных топливных элементов. Успехи химии. 2012. Т. 81. С. 191. [Yaroslavtsev, A.B., Dobrovolsky, Yu.A., Shaglaeva, N.S., Frolova, L.A., Gerasimova, E.V., and Sanginov, E.A., Nanostructured materials for low-temperature fuel cells, Russ. Chem. Rev., 2012, vol. 81, p. 191.]
Liao, H., Qiu, Z., Wan, Q., Wang, Z., Liu, Y., and Yang, N., Universal Electrode Interface for Electrocatalytic Oxidation of Liquid Fuels, ACS Appl. Mater. Interfaces, 2014, vol. 6, no. 20, p. 18055. https://doi.org/10.1021/am504926r
Gong, K., Du, F., Xia, Z., Durstock, M., and Dai, L., Nitrogen-Doped Carbon Nanotube Arrays with High Electrocatalytic Activity for Oxygen Reduction, Science, 2009, vol. 323, no. 5915, p. 760. https://doi.org/10.1126/science.1168049
Jin, S., Chen, M., Dong, H., He, B., Lu, H., Su, L., Dai, W., Zhang, Q., and Zhang, X., Stable silver nanoclusters electrochemically deposited on nitrogen-doped graphene as efficient electrocatalyst for oxygen reduction reaction, J. Power Sources, 2015, vol. 274, p. 1173. https://doi.org/10.1016/j.jpowsour.2014.10.098
Liu, S., Zhang, Q., Li, Y., Han, M., Gu, L., Nan, C., Bao, J., and Dai, Z., Five-Fold Twinned Pd2NiAg Nanocrystals with Increased Surface Ni Site Availability to Improve Oxygen Reduction Activity, J. Am. Chem. Soc., 2015, vol. 137, no. 8, p. 2820. https://doi.org/10.1021/ja5129154
Ma, T.Y., Ran, J., Dai, S., Jaroniec, M., and Qiao, S.Z., Phosphorus-Doped Graphitic Carbon Nitrides Grown In Situ on Carbon-Fiber Paper: Flexible and Reversible Oxygen Electrodes, Angew. Chem. Int. Ed. 2014, vol. 54, no. 15, p. 4646. https://doi.org/10.1002/anie.201411125
Гутерман, В.Е., Беленов, С.В., Алексеенко, А.А., Табачкова, Н.Ю., Волочаев, В.А. О связи активности и стабильности нанесенных платиноуглеродных электрокатализаторов. Электрохимия. 2017. Т. 53. С. 602. [Guterman, V.E., Belenov, S.V., Alekseenko, A.A., Tabachkova, N.Yu., and Volochaev, V.A., The relationship between activity and stability of deposited platinum-carbon electrocatalysts, Russ. J. Electrochem., 2017, vol. 53, p. 531.]
Lim, C.S., Wang, L., Chua, C.K., Sofer, Z., Jankovský, O., and Pumera, M., High temperature superconducting materials as bi-functional catalysts for hydrogen evolution and oxygen reduction, J. Mater. Chem. A, 2015, vol. 3, no. 16, p. 8346. https://doi.org/10.1039/c4ta06767c
Qiao, Y. and Li, C.M., Nanostructured catalysts in fuel cells, J. Mater. Chem., 2011, vol. 21, no. 12, p. 4027. https://doi.org/10.1039/c0jm02871a
Hasche, F., Oezaslan, M., and Strasser, P., Activity, stability, and degradation mechanisms of dealloyed PtCu3 and PtCo3 nanoparticle fuel cell catalysts, ChemCatChem., 2011, vol. 3, p. 1805.
Alekseenko, A.A., Belenov, S.V., Volochaev, V.A., Novomlinskiy, I.N., and Guterman, V.E., Cu@Pt/C catalysts: synthesis, structure, activity in oxygen reduction reaction, In Advanced Materials – Techniques, Physics, Mechanics and Applications, Springer Proceedings in Physics, vol. 193, Parinov, I.A. (Eds.). Heidelberg, New York, 2017, 540 p.
Gojković, S., Babić, B., Radmilović, V., and Krstajić, N., Nb-doped TiO2 as a support of Pt and Pt–Ru anode catalyst for PEMFCs, J. Electroanal. Chem., 2010, vol. 639, no. 1–2, p. 161. https://doi.org/10.1016/j.jelechem.2009.12.004
Ho, V.T.T., Pan, C.-J., Rick, J., Su, W.-N., and Hwang, B.-J., Nanostructured Ti0.7Mo0.3O2 Support Enhances Electron Transfer to Pt: High-Performance Catalyst for Oxygen Reduction Reaction, J. Am. Chem. Soc., 2011, vol. 133, no. 30, p. 11716. https://doi.org/10.1021/ja2039562
Ignaszak, A., Song, C., Zhu, W., Wang, Y.-J., Zhang, J., Bauer, A., Baker, R., Neburchilov, V., Campbell, S., and Ye, S., Carbon–Nb0.07Ti0.93O2 composite supported Pt–Pd electrocatalysts for PEM fuel cell oxygen reduction reaction, Electrochim. Acta, 2012, vol. 75, p. 220. https://doi.org/10.1016/j.electacta.2012.04.111
Jukk, K., Kongi, N., Tarre, A., Rosental, A., Treshcha-lov, A., Kozlova, J., Ritslaid, P., Matisen, L., Sammelselg, V., and Tammeveski, K., Electrochemical oxygen reduction behaviour of platinum nanoparticles supported on multi-walled carbon nanotube/titanium dioxide composites, J. Electroanal. Chem., 2014, vol. 735, p. 68. https://doi.org/10.1016/j.jelechem.2014.10.008
Tiido, K., Alexeyeva, N., Couillard, M., Bock, C., Macdougall, B.R., and Tammeveski, K., Graphene–TiO2 composite supported Pt electrocatalyst for oxygen reduction reaction, Electrochim. Acta, 2013, vol. 107, p. 509. https://doi.org/10.1016/j.electacta.2013.05.155
Cui, X., Shi, J., Chen, H., Zhang, L., Guo, L., Gao, J., and Li, J., Platinum/Mesoporous WO3 as a Carbon-Free Electrocatalyst with Enhanced Electrochemical Activity for Methanol Oxidation, J. Phys. Chem. B, 2008, vol. 112, no. 38, p. 12024. https://doi.org/10.1021/jp803565k
Ioroi, T., Siroma, Z., Fujiwara, N., Yamazaki, S.-I., and Yasuda, K., Sub-stoichiometric titanium oxide-supported platinum electrocatalyst for polymer electrolyte fuel cells, Electrochem. Comm., 2005, vol. 7, no. 2, p. 183. https://doi.org/10.1016/j.elecom.2004.12.007
Lei, B., Xue, J., Jin, D., Ni, S., and Sun, H., Fabrication, annealing, and electrocatalytic properties of platinum nanoparticles supported on self-organized TiO2 nanotubes, Rare Metals, 2008, vol. 27, no. 5, p. 445. https://doi.org/10.1016/s1001-0521(08)60160-6
Shim, J., Lee, C.-R., Lee, H.-K., Lee, J.-S., and Cairns, E.J., Electrochemical characteristics of Pt–WO3/C and Pt–TiO2/C electrocatalysts in a polymer electrolyte fuel cell, J. Power Sources, 2001, vol. 102, no. 1–2, p. 172. https://doi.org/10.1016/s0378-7753(01)00817-5
Vayssilov, G.N., Lykhach, Y., Migani, A., Staudt, T., Petrova, G.P., Tsud, N., Skála, T., Bruix, A., Illas, F., Prince, K.C., Matolı’n, V., Neyman, K.M., and Libuda, J., Support nanostructure boosts oxygen transfer to catalytically active platinum nanoparticles, Nature Materials, 2011, vol. 10, no. 4, p. 310. https://doi.org/10.1038/nmat2976
Wang, M., Guo, D.-J., and Li, H.-L., High activity of novel Pd/TiO2 nanotube catalysts for methanol electro-oxidation, J. Solid State Chemistry, 2005, vol. 178, no. 6, p. 1996. https://doi.org/10.1016/j.jssc.2005.04.006
Dou, M., Hou, M., Liang, D., Lu, W., Shao, Z., and Yi, B., SnO2 nanocluster supported Pt catalyst with high stability for proton exchange membrane fuel cells, Electrochim, Acta, 2013, vol. 92, p. 468. https://doi.org/10.1016/j.electacta.2013.01.070
Nakada, M., Ishihara, A., Mitsushima, S., Kamiya, N., and Ota, K.-I., Effect of Tin Oxides on Oxide Formation and Reduction of Platinum Particles, Electrochem. Solid State Lett., 2007, vol. 10, no. 1. https://doi.org/10.1149/1.2382263
Tripković, D., Stevanović, S., Gavrilović, A., Rogan, J., Lačnjevac, U., Kravić, T., and Jovanović, V.M., The Role of SnO2 on Electrocatalytic Activity of PtSn Catalysts, Electrocatalysis, 2017, vol. 9, no. 1, p. 76. https://doi.org/10.1007/s12678-017-0424-4
Фролова, Л.А., Добровольский, Ю.А., Букун, Н.Г. Электрокатализаторы на основе платинированных оксидов олова для водородных и спиртовых топливных элементов. Электрохимия. 2011. Т. 47. С. 745. [Frolova, L.A., Dobrovolsky, Y.A., and Bukun, N.G., Oxide supported platinum electrocatalysts for hydrogen and alcohol fuel cells, Rus. J. Electrochem., 2011, vol. 47, no. 6, p. 697. doi 10.1134/s1023193511060024.]
Antoniassi, R., Silva, J., Neto, A.O., and Spinacé, E., Synthesis of Pt SnO2/C electrocatalysts containing Pt nanoparticles with preferential (100) orientation for direct ethanol fuel cell, Appl. Catal. B Environ., 2017, vol. 218, p. 91. https://doi.org/10.1016/j.apcatb.2017.06.031
Jia, J., Wang, H., Ji, S., Yang, H., Li, X., and Wang, R., SnO2-embedded worm-like carbon nanofibers supported Pt nanoparticles for oxygen reduction reaction, Electrochim. Acta, 2014, vol. 141, p. 13. https://doi.org/10.1016/j.electacta.2014.07.020
Huang, M., Zhang, J., Wu, C., and Guan, L., Pt Nanoparticles Densely Coated on SnO2-Covered Multiwalled Carbon Nanotubes with Excellent Electrocatalytic Activity and Stability for Methanol Oxidation, ACS Appl. Mater. Interfaces, 2017, vol. 9, no. 32, p. 26921. https://doi.org/10.1021/acsami.7b07866
Zhang, K., Feng, C., He, B., Dong, H., Dai, W., Lu, H., and Zhang, X., An advanced electrocatalyst of Pt decorated SnO2/C nanofibers for oxygen reduction reaction, J. Electroanal. Chem., 2016, vol. 781, p. 198. https://doi.org/10.1016/j.jelechem.2016.11.002
Zhang, N., Zhang, S., Du, C., Wang, Z., Shao, Y., Kong, F., Lin, Y., and Yin, G., Pt/Tin Oxide/Carbon Nanocomposites as Promising Oxygen Reduction Electrocatalyst with Improved Stability and Activity, Electrochim. Acta, 2014, vol. 117, p. 413. https://doi.org/10.1016/j.electacta.2013.11.139
Parrondo, J., Mijangos, F., and Rambabu, B., Platinum/tin oxide/carbon cathode catalyst for high temperature PEM fuel cell, J. Power Sources, 2010, vol. 195, no. 13, p. 3977. https://doi.org/10.1016/j.jpowsour.2010.01.027
Kuriganova, A.B., Leontyeva, D.V., Ivanov, S., Bund, A., and Smirnova, N.V., Electrochemical dispersion technique for preparation of hybrid MOx–C supports and Pt/MOx–C electrocatalysts for low-temperature fuel cells, J. Appl. Electrochem., 2016, vol. 46, no. 12, p. 1245. https://doi.org/10.1007/s10800-016-1006-5
Kuriganova, A.B. and Smirnova, N.V., Pt/SnOx–C composite material for electrocatalysis, Mendeleev Commun., 2014, vol. 24, no. 6, p. 351. https://doi.org/10.1016/j.mencom.2014.11.013
Алексеенко, А.А., Гутерман, В.Е., Волочаев, В.А., Беленов, С.В. Влияние условий синтеза в жидкой фазе на микроструктуру и активную площадь поверхности Pt/C-катализаторов. Неорганические материалы. 2015. Т. 51. № 12. С. 1355–1360. . [Alekseenko, A.A., Guterman, V.E., Volochaev, V.A., and Belenov, S.V., Effect of wet synthesis conditions on the microstructure and active surface area of Pt/C catalysts, Inorganic Materials, 2015, vol. 51, no. 12, p. 1258. doi 0.1134/s0020168515120018.]https://doi.org/10.7868/s0002337x15120015
Guterman, V.E., Lastovina, T.A., Belenov, S.V., Tabachkova, N.Y., Vlasenko, V.G., Khodos, I.I., and Balakshina, E.N., PtM/C (M = Ni, Cu, or Ag) electrocatalysts: effects of alloying components on morphology and electrochemically active surface areas, J. of Solid State Electrochemistry, 2013, vol. 18, no. 5, p. 1307. https://doi.org/10.1007/s10008-013-2314-x
Vliet, D.V.D., Strmcnik, D.S., Wang, C., Stamenkovic, V.R., Markovic, N.M., and Koper, M.T., On the importance of correcting for the uncompensated Ohmic resistance in model experiments of the Oxygen Reduction Reaction, J. Electroanal. Chem., 2010, vol. 647, no. 1, p. 29. https://doi.org/10.1016/j.jelechem.2010.05.016
Shinozaki, K., Zack, J.W., Pylypenko, S., Pivovar, B.S., and Kocha, S.S., Oxygen Reduction Reaction Measurements on Platinum Electrocatalysts Utilizing Rotating Disk Electrode Technique, J. Electrochem. Soc., 2015, vol. 162, no. 12. https://doi.org/10.1149/2.0551512jes
Jeon, M.K., Zhang, Y., and Mcginn, P.J., A comparative study of PtCo, PtCr, and PtCoCr catalysts for oxygen electro-reduction reaction, Electrochim. Acta, 2010, vol. 55, no. 19, p. 5318. https://doi.org/10.1016/j.electacta.2010.04.056
Fabbri, E., Rabis, A., Kötz, R., and Schmidt, T.J., Pt nanoparticles supported on Sb-doped SnO2 porous structures: developments and issues, Phys. Chem. Chem. Phys., 2014, vol. 16, no. 27, p. 13672. https://doi.org/10.1039/c4cp00238e
Wang, J., Yin, G., Shao, Y., Zhang, S., Wang, Z., and Gao, Y., Effect of carbon black support corrosion on the durability of Pt/C catalyst, J. Power Sources, 2007, vol. 171, no. 2, p. 331. https://doi.org/10.1016/j.jpowsour.2007.06.084
Thompsett, D., Catalysts for the proton exchange membrane fuel cell, in: Vielstich, W., Lamm, A., and Gasteiger H.A., (Eds.), Handbook of Fuel Cells. Fundamentals, Technology and Applications, 3 Wiley & Sons Ltd, New York, 2003, p. 6.
Park, Yu-Ch., Kakinuma, K., Uchida, M., Uchida, H., and Watanabe, M., Deleterious effects of interim cyclic voltammetry on Pt/carbon black catalyst degradation during start-up/shutdown cycling evaluation, Electrochim. Acta, 2014, vol. 123, p. 84.
Eris, S., Daşdelen, Z., and Sen, F., Enhanced electrocatalytic activity and stability of monodisperse Pt nanocomposites for direct methanol fuel cells, J. Colloid Interface Sci., 2018, vol. 513, p. 767. https://doi.org/10.1016/j.jcis.2017.11.085
Дополнительные материалы отсутствуют.
Инструменты
Электрохимия