Электрохимия, 2019, T. 55, № 7, стр. 873-884
Оксид серебра(I) на сплавах серебра с цинком: анодное формирование и свойства
М. М. Муртазин a, М. Ю. Нестерова a, С. Н. Грушевская a, *, А. В. Введенский a
a Воронежский государственный университет
394018 Воронеж, Университетская пл., 1, Россия
* E-mail: sg@chem.vsu.ru
Поступила в редакцию 23.11.2018
После доработки 20.12.2018
Принята к публикации 29.01.2019
Аннотация
Анодное формирование и свойства оксида Ag(I) на сплавах системы Ag–Zn с атомной долей цинка от 5 до 30 ат. % в деаэрированном 0.1 М KOH исследованы методом циклической вольтамперометрии с привлечением фотоэлектрохимических измерений. Фазовый состав сплавов подтвержден результатами ренгтеновской дифрактометрии; морфология поверхности изучена при помощи сканирующего электронного микроскопа. Установлено, что оксид Ag(I), анодно сформированный на сплавах серебра с цинком, характеризуется n-типом проводимости и преобладанием донорных дефектов. По мере увеличения содержания цинка в сплаве концентрация донорных дефектов в оксиде Ag(I) растет, что приводит к снижению максимального фототока и ширины области пространственного заряда. Размер частиц оксида Ag(I) уменьшается, а плотность их распределения по поверхности увеличивается с ростом концентрации цинка в сплаве.
ВВЕДЕНИЕ
Электрохимическое поведение серебра и цинка в щелочных растворах интенсивно изучается в течение многих десятилетий, что обусловлено не только их использованием в первичных источниках тока, но и необходимостью решения фундаментальных проблем анодного растворения и коррозии. Действительно, появление на поверхности металлов и сплавов труднорастворимых продуктов окисления определяет возможность их практического применения. На чистых металлах такими продуктами являются прежде всего их оксидные или гидроксидные пленки [1–4]; на гомогенных сплавах состав и строение продуктов окисления усложняется [5–7]. Так, при окислении бинарного А,В-сплава обычно образуется оксидная пленка, состоящая из твердого раствора типа (AB)O [6]. Однако соотношение компонентов A и B в оксидной пленке, как правило, отличается от их исходного соотношения в сплаве и зависит от многих факторов: сродства металлов к кислороду, коррозионной устойчивости и взаимной растворимости их оксидов, скорости диффузии в системе металл-оксид, а также способности к сегрегации компонентов A и B на определенной глубине как в фазе самого сплава, так и в оксидной пленке.
Кинетические исследования в этой ситуации затруднены необходимостью расчета парциальных токов окисления компонентов сплава. Кроме того, учитывая возможность селективного растворения (СР) сплавов, можно ожидать существенных изменений в химическом составе и энергетическом состоянии их поверхностной зоны. Как правило, в ходе СР она обогащается электроположительным компонентом, а также точечными структурными дефектами, прежде всего, вакансиями, концентрация которых заметно превышает равновесную [7–10]. Данное обстоятельство не может не отразиться в кинетике последующего анодного фазообразования, по крайней мере, на его начальном этапе.
Предполагается, что выявление подобного рода зависимостей позволит сделать заключение о преобладающем маршруте анодного формирования оксида, а именно – прямое электрохимическое окисление или растворение/обратное осаждение. Единое мнение по этому принципиальному вопросу все еще не сформировано [11], поскольку с термодинамической точки зрения указанные маршруты неразличимы. Однако наличие зависимости кинетических особенностей анодного фазообразования, а также свойств оксидных слоев от структурно-химического состояния металлической подложки косвенно указывает на преобладание прямого электрохимического окисления.
Одной из модельных систем, удобных для установления таких закономерностей, являются гомогенные сплавы серебра с цинком, содержащие до 30 ат. % Zn (α-фаза), поскольку закономерности их СР неплохо изучены [7–10]. Достаточно много работ посвящено и вопросам анодного формирования оксидных слоев как на серебре [11–15], так и на цинке [16–21].
Свойства самих оксидов данных металлов интенсивно изучаются в связи с развитием технологий получения новых материалов с заданным набором функциональных свойств. Так, оксид Ag(I) используется при создании прозрачных электродов и антибликовых покрытий в инфракрасной и видимой области поглощения света в технологиях получения электрических, оптических и магнитооптических накопителей данных [22–24]. Оксиды Ag2O и AgO привлекают внимание и как материалы для изготовления солнечных элементов и фотовольтаических устройств благодаря их нетоксичности и оптимальным значениям ширины запрещенной зоны (~1.5 эВ) [25]. Кроме того, наночастицы оксида серебра Ag2O применяются в качестве катализаторов [26], а в [27] обнаружена высокая фотокаталитическая активность редокс-пары Ag2O/AgO в отношении реакции выделения кислорода. Таким образом, катализаторы на основе серебра и его оксидов могут рассматриваться как перспективные материалы для фотокаталитического разложения воды [28].
Направление исследований последних лет связано с синтезом композитов на основе графена, где равномерно распределены и стабилизированы наночастицы металла [29, 30]. Такие материалы находят широкое применение не только в электрокатализе, но и в других областях прикладной электрохимии, например, при создании проводящих нанопленок, суперконденсаторов и наносенсоров [31–33]. Зачастую наночастицы металла подвергаются окислению с образованием оксидов или гидроксидов, свойства которых определяют возможности дальнейшего использования композитов. В частности, показано [34], что эффективным неферментативным сенсором для обнаружения глюкозы может служить композит на основе углеродной матрицы, в которой распределены наночастицы серебра, покрытые тонкой пленкой оксида Ag(I).
Новый виток научных исследований, посвященных свойствам оксида цинка, вызван прогрессом в синтезе наноструктур и гетеросоединений на его основе [35]. Свойства оксида цинка могут быть существенно модифицированы путем добавления других металлов. Например, присутствие ионов серебра не только смещает пик области поглощения оксида цинка от 370 до 450 нм, но и значительно увеличивает его фотокаталитическую активность [36].
Широкое применение находят функциональные материалы, в которых совместно присутствуют именно серебро, цинк и/или их оксиды. Помимо индустрии токогенерирующих устройств, такие материалы используются в медицинской биохимии в качестве сенсоров [37] и антибактериальных материалов для имплантов [38–41]. В частности, наногетероструктуры ZnO–Ag рассматриваются как перспективные материалы для производства низкотемпературных газовых сенсоров благодаря синергическому эффекту цинка и серебра на границе раздела, а также по ряду других причин, среди которых: экологическая безопасность, высокая подвижность электронов проводимости, доступность оксида цинка и относительная дешевизна серебра в сочетании с его высокой каталитической активностью [42, 43]. Немаловажно, что при освещении регистрируется весьма высокая фотокаталитическая активность этих материалов [44–47], обусловленная эффективным разделением генерируемых светом электронно-дырочных пар вследствие возникновения барьера Шоттки [48].
Область применения полупроводниковых материалов прежде всего определяется их свойствами. Электрохимический способ относится к наиболее контролируемым способам получения материалов с заданными свойствами. В данной работе в качестве одного из возможных методов управления свойствами оксидной фазы предлагается анодное окисление в щелочной среде гомогенных сплавов Ag–Zn с различной объемной концентрацией цинка.
Мониторинг свойств получаемых покрытий обычно осуществляется ex situ методами, которые при своей достаточно высокой информативности, тем не менее, не вполне отвечают реальным условиям роста. В этом плане гораздо более ценны in situ методы, важное место среди которых занимают фотоэлектрохимические измерения, в частности спектроскопия фототока (iph) и фотопотенциала (Eph). Уже сам факт появления фототока или фотопотенциала свидетельствует о возникновении на металлической поверхности полупроводниковой фазы. Полярность iph и Eph указывает на тип проводимости, а их амплитуда позволяет рассчитать ряд важных структурно-зависимых параметров полученных оксидных пленок [49–51].
Цель работы – определить закономерности анодного окисления сплавов системы Ag–Zn (α‑фаза) в щелочном растворе и установить характер зависимости свойств анодно сформированных оксидов серебра от состава сплава.
МЕТОДИКА ЭКСПЕРИМЕНТА
Гомогенные поликристаллические сплавы для изготовления рабочих электродов получены термическим сплавлением серебра и цинка (чистота обоих металлов не менее 99.99 мас. %) в течение не менее двух часов при 1000°С с последующим охлаждением в печи. Расчетная концентрация цинка XZn в исследуемых сплавах составляла 5, 10, 15, 20 и 30 ат. %; соответствующие электроды обозначены как Ag5Zn, Ag10Zn, Ag15Zn, Ag20Zn и Ag30Zn. Фазовый состав сплавов определен при помощи рентгеновского дифрактометра Empyrean B.V. (PANalytica, Нидерланды) с медным анодом; длина волны Kα1-излучения 1.54060 Å. Сканирующий электронный микроскоп JSM-6380LV, совмещенный с системой микроанализа INCA Energy 250 (JEOL, Япония), применен для изучения морфологии поверхности образцов и подтверждения их химического состава (табл. 1).
Таблица 1.
Концентрация цинка XZn в сплавах Ag–Zn по результатам энергодисперсионного анализа, параметр решетки сплавов a и размеры кристаллитов d по данным рентгеновской дифрактометрии
| Сплав | XZn, ат. % | a, нм | d, Å |
|---|---|---|---|
| Ag5Zn | 5.07 ± 0.62 | 0.408 0.4076919* |
328 |
| Ag10Zn | 10.23 ± 0.66 | 0.407 | 276 |
| Ag15Zn | 14.97 ± 0.72 | 0.406 0.4058381* |
247 |
| Ag20Zn | 20.54 ± 0.75 | 0.405 | 222 |
| Ag30Zn | 29.40 ± 0.82 | 0.403 0.4029623* |
204 |
* Значения параметра решетки a (нм) сплавов Zn–Ag по данным [54].
Стационарные рабочие электроды цилиндрической формы, изготовленные из исследуемых сплавов, армированы в оправку из полимеризованной эпоксидной смолы. Геометрическая площадь (S) рабочей поверхности для различных электродов составляла 0.40–0.50 см2. Электрод сравнения – хлоридсеребряный с потенциалом 0.208 В11, вспомогательный – платина.
Электрохимические исследования выполнены на компьютеризированном потенциостатическом комплексе IPC-Сompact в стандартной трехэлектродной ячейке в растворе 0.1 М KОН (“х. ч.”), приготовленном на бидистиллированной воде и деаэрированном барботажем х. ч. аргона.
Подготовка рабочей поверхности к эксперименту включала зачистку на шлифовальной бумаге с размером зерна абразива менее 10 мкм, финишную полировку на замше и обезжиривание изопропиловым спиртом. Для стандартизации состояния поверхности рабочего электрода после механической подготовки осуществлялась его катодная поляризация в течение 300 с при потенциале Ec = –1.10 В. В потенциодинамических исследованиях потенциал менялся со скоростью 10 мВ/с от катодного Ec до анодного Ea с последующим изменением направления сканирования. Значение Ea составляло 0.80 и 1.00 В при определении закономерностей анодного роста оксидов Ag(I) и Ag(II) соответственно. Потенциостатическое формирование оксидов Ag(I) определенной толщины, контролируемой по пропущенному электрическому заряду, проводилось при потенциалах максимумов на вольтамперограммах сплавов.
Фотоэлектрохимические эксперименты выполнены в ячейке из оргстекла, оснащенной дополнительным платиновым электродом для измерения фотопотенциала. В дно ячейки вклеена кварцевая пластина толщиной 1 мм, проницаемая для УФ-облучения рабочего электрода. В качестве источника импульсного освещения применялся сверхяркий квазимонохроматический светодиод LIGITEK с длиной волны λ = 470 нм. Плотность светового потока Φ0 (в расчете на единицу геометрической площади электрода) составила 1.65 × 10–14 фотон с–1 см–2. Все электроды находились в одном отсеке, защищенном металлическим заземленным экраном от электромагнитных помех. Электродом сравнения служил оксидсеребряный электрод с потенциалом 0.430 В, приготовленный путем электрохимического окисления серебра в аэрированном 0.1 М KОН в течение 20 мин при I = 5 мА.
Измерения фототока и фотопотенциала выполнены при помощи потенциостата Compact Photo Edition, который характеризуется диапазоном 5–1200 нА по фототоку и 0.5–1500 мкВ по фотопотенциалу. Анодную поляризацию с синхронной регистрацией тока поляризации и фототока проводили в течение 30 мин. Измерения фотопотенциала начинали непосредственно после отключения потенциостатической поляризации и продолжали в течение 30 мин. Плотности тока и фототока рассчитаны на единицу геометрической поверхности электрода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рентгеноструктурные исследования
Результаты рентгеновской дифрактометрии сплавов Ag–Zn представлены на рис. 1. По количеству, положению и интенсивности пиков полученные дифрактограммы схожи с дифрактограммой серебра (Crystallography Open Database, No. 1100136). Данный факт позволяет заключить, что фазовый состав Zn,Ag-сплавов с концентрацией цинка до 30 ат. % представлен α-фазой в полном соответствии с фазовой диаграммой [52]. Пиков, соответствующих β- или γ-фазам, на дифрактограммах сплавов не обнаружено. Отметим, что и при механическом сплавлении серебра с цинком устойчиво существует и надежно идентифицируется именно α-фаза независимо от наличия последующего этапа их термической обработки [53].
По мере увеличения XZn максимумы на дифрактограммах (рис. 1) смещаются вправо, что обусловлено, как правило, изменением размера элементарной ячейки в соответствии с правилом Вегарда. C использованием условия Вульфа–Брэгга рассчитаны межплоскостные расстояния и постоянная решетки a. Последняя незначительно снижается с ростом содержания цинка в сплаве (табл. 1), что согласуется с данными рентгеновской дифрактометрии, полученными в [54]. Уменьшение рассчитанного из полуширины пиков диаметра кристаллитов d с увеличением XZn выражено более ярко (табл. 1).
Вольтамперометрия сплавов системы Ag–Zn
Согласно [11–14], основным устойчивым продуктом первой стадии окисления серебра в щелочной среде является Ag2O, образующийся по брутто-реакции:
(1)
${\text{2Ag}} + {\text{2O}}{{{\text{H}}}^{--}} = {\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}} + {{{\text{H}}}_{{\text{2}}}}{\text{O }} + 2{\text{e}},$равновесный потенциал которой при 298 К составляет [55]:
(2)
$E_{{{{{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}} {{\text{Ag,O}}{{{\text{H}}}^{ - }}}}} \right. \kern-0em} {{\text{Ag,O}}{{{\text{H}}}^{ - }}}}}}^{{{\text{eq}}}} = 0.{\text{342}}--0.0{\text{59lg}}({{a}_{{{\text{O}}{{{\text{H}}}^{--}}}}}{{a}_{{{\text{Ag}}}}}).$Если аAg = 1, то в водном растворе 0.1 М KOH $E_{{{{{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}} {{\text{Ag,O}}{{{\text{H}}}^{ - }}}}} \right. \kern-0em} {{\text{Ag,O}}{{{\text{H}}}^{ - }}}}}}^{{{\text{eq}}}}$ = 0.407 В. Однако при переходе к сплавам термодинамическая активность серебра уже меньше единицы, что ведет к повышению равновесного потенциала формирования оксида Ag(I). Результаты расчетов по (2) в предположении aAg ≈ XAg демонстрируют незначительное повышение $E_{{{{{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}} \mathord{\left/ {\vphantom {{{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}} {{\text{Ag,O}}{{{\text{H}}}^{ - }}}}} \right. \kern-0em} {{\text{Ag,O}}{{{\text{H}}}^{ - }}}}}}^{{{\text{eq}}}}$ с увеличением концентрации цинка в сплаве (табл. 2).
Таблица 2.
Равновесный электродный потенциал образования оксида Ag(I) Eeq на серебре и сплавах Ag–Zn, потенциал ЕА1 и плотность тока iA1 максимума А1
| Электрод | Eeq, В | ЕА1, В | iA1, мА/см2 |
|---|---|---|---|
| Ag | 0.407 | 0.56 | 0.83 |
| Ag5Zn | 0.409 | 0.55 | 1.44 |
| Ag10Zn | 0.410 | 0.53 | 1.25 |
| Ag15Zn | 0.412 | 0.51 | 1.42 |
| Ag20Zn | 0.413 | 0.49 | 1.30 |
| Ag30Zn | 0.417 | 0.47 | 1.48 |
Вторая стадия окисления серебра включает образование оксида Ag(II):
(3)
${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}} + {\text{2O}}{{{\text{H}}}^{--}} = {\text{2AgO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + 2{\text{e}}$(4)
$E_{{{{{\text{AgO}}} \mathord{\left/ {\vphantom {{{\text{AgO}}} {{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}}}} \right. \kern-0em} {{\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{O}}}}}}^{{{\text{eq}}}} = 0.{\text{6}}0{\text{4}}--0.0{\text{59lg}}{{a}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}.$Основные закономерности анодного поведения цинка в щелочах установлены в [16–20]. В широкой области потенциалов цинк находится в пассивном состоянии, обусловленном формированием гидроксида цинка по брутто-реакции:
равновесный потенциал которой определяется уравнением [55]:
(6)
$\begin{gathered} E_{{{{{\text{Zn(OH}}{{{\text{)}}}_{{\text{2}}}}} \mathord{\left/ {\vphantom {{{\text{Zn(OH}}{{{\text{)}}}_{{\text{2}}}}} {{\text{Zn,O}}{{{\text{H}}}^{ - }}}}} \right. \kern-0em} {{\text{Zn,O}}{{{\text{H}}}^{ - }}}}}}^{{{\text{eq}}}} = \\ = --{\text{1}}.{\text{246}}--0.0{\text{59lg}}{{a}_{{{\text{O}}{{{\text{H}}}^{--}}}}}--0.0{\text{3}}0{\text{lg}}{{a}_{{{\text{Zn}}}}}. \\ \end{gathered} $Поскольку в 0.1 М KОН равновесный потенциал образования гидроксида цинка на цинке составляет –1.179 В, то можно полагать, что при потенциалах анодного формирования оксида Ag(I) на поверхности сплавов Ag–Zn присутствует гидроксид цинка, либо продукт его дегидратации – оксид цинка ZnO. Однако как сам цинк, так и труднорастворимые продукты его окисления – Zn(OH)2 и ZnO – способны химически растворяться в щелочах с образованием гидроксокомплексов [16–21]. Толщина пленки зависит от потенциала, концентрации цинка в исходном сплаве и растворе.
Экспериментальные данные по составу пленок, анодно сформированных в щелочной среде на сплавах Ag–Zn, в литературе не обнаружены. Известно [56], что при термическом окислении таких сплавов с концентрацией цинка 36.35 ат. % на поверхности присутствует лишь оксид цинка.
Для определения потенциалов оксидообразования на сплавах Ag–Zn (α-фаза) проведена серия потенциодинамических исследований в деаэрированном 0.1 M KOH. Вольтамперограммы, полученные в широком диапазоне потенциалов, характеризуются наличием двух анодных максимумов A1 и A2 (рис. 2а); на катодной ветви им отвечают два катодных пика C1 и C2. Опираясь на данные [11–15] и учитывая равновесные потенциалы реакций (3) и (5), можно заключить, что анодные максимумы отвечают формированию оксидов Ag(I) и Ag(II), а катодные – их восстановлению. По мере роста содержания цинка в сплаве потенциал пика A1 смещается влево. Для пика A2 четкой зависимости от концентрации цинка не наблюдается, поскольку рост AgO реализуется на подслое из Ag2O. Положение катодных максимумов тока меняется несистематично.
Рис. 2.
Циклические вольтамперограммы сплавов Ag–Zn в 0.1 M KOH, полученные в широкой области потенциалов (а) и в области, ограниченной потенциалами формирования оксида Ag(I) (б).

Исследование процессов образования и восстановления оксида Ag(I) возможно при уменьшении потенциала реверса до такого значения, которое исключает формирование оксида Ag(II) (рис. 2б). Полученные вольтамперограммы демонстрируют смещение потенциалов анодного A1 и катодного C1 пиков в сторону более отрицательных значений по мере увеличения концентрации цинка в сплаве.
Следует отметить, что направление смещения потенциала анодного максимума не совпадает с направлением смещения равновесного потенциала формирования Ag(I), рассчитанного по уравнению (2) в предположении, что термодинамическая активность серебра в сплаве совпадает с его атомной долей (табл. 2). Экспериментально наблюдаемое уменьшение потенциала пика A1 может быть связано с наличием короткого начального этапа селективного растворения цинка из сплава. Данный процесс приводит к структурному разупорядочиванию поверхностного слоя сплава [7–9], как следствие, к увеличению термодинамической активности серебра в этом слое. Дополнительным, хотя и косвенным свидетельством в пользу данного предположения может служить рост плотности тока в пике A1, наблюдаемый при переходе от серебра к сплавам (табл. 2).
В ряде случаев анодному максимуму A1 предшествует плечо A0 при потенциалах 0.35–0.40 В, появление которого связано, по данным [11–15], с образованием подслоя AgOH, трансформирующегося в оксид Ag(I) по мере роста потенциала. Наиболее четко эта ситуация проявляется на вольтамперограмме сплава Ag30Zn: здесь удается наблюдать расщепление не только анодного, но и катодного пика.
Измерения фототока и фотопотенциала
Почти сразу после включения поляризации при потенциалах формирования оксида Ag(I) на сплавах регистрируется положительный фототок (рис. 3а). Отметим, что сам факт появления фототока свидетельствует о наличии полупроводниковой фазы на поверхности металлической подложки. Положительный знак фототока указывает на n-тип проводимости, обусловленный преобладанием донорных дефектов в структуре данной фазы.
По мере накопления заряда и утолщения анодной пленки оксида Ag(I) положительный фототок достаточно быстро возрастает, приближаясь к некоторому стационарному значению. Такая форма зависимости характерна для тонких полупроводниковых пленок, толщина которых не превышает ширины области пространственного заряда (ОПЗ) [57]. Согласно теории, разработанной применительно к таким пленкам в [58, 59], фототок iph зависит от толщины L линейно, тогда как фотопотенциал Eph – квадратично:
(7)
$\begin{gathered} {{i}_{{{\text{ph}}}}} = e\eta f{{\Phi }_{0}}\left( {{\text{1}} - {{R}_{{{\text{ref}}}}}} \right)\left( {{\text{1}} - {{{\text{e}}}^{{ - {\text{2}}\alpha L}}}} \right) = \\ = i_{{{\text{ph}}}}^{{{\text{max}}}}\left( {{\text{1}} - {{{\text{e}}}^{{ - {\text{2}}\alpha L}}}} \right) \approx {\text{2}}\alpha i_{{{\text{ph}}}}^{{{\text{max}}}}L, \\ \end{gathered} $(8)
${{E}_{{{\text{ph}}}}} \approx - \frac{{{\text{2}}kT}}{e}\frac{{\eta {{\Phi }_{0}}({\text{1}} - R)\alpha {{L}^{2}}}}{{{{N}_{{\text{D}}}}{{D}_{{\text{n}}}}}}{{{\text{e}}}^{{\frac{{e{\text{(}}E - {{E}_{{{\text{fb}}}}}{\text{)}}}}{{kT}}}}}.$Численная обработка зависимости фототока от толщины пленки оксида Ag(I) с применением (7) обеспечивает получение ряда ее оптических и структурных параметров. Прежде всего путем аппроксимации экспериментальных кривых с применением программы Table Curve найдены значения коэффициента поглощения света и максимального фототока. Далее, учитывая, что толщина пленки L, при которой достигается $i_{{{\text{ph}}}}^{{{\text{max}}}},$ отвечает ширине ОПЗ W, на аппроксимирующей iph,L-кривой зафиксированы соответствующие значения при условии iph(L)/$i_{{{\text{ph}}}}^{{{\text{max}}}}$ = 0.99. По уравнению для определения ширины ОПЗ можно рассчитать концентрацию донорных дефектов ND:
(9)
$W = \sqrt {\frac{{{\text{2}}\varepsilon {{\varepsilon }_{0}}\left| {E - {{E}_{{{\text{fb}}}}}} \right|}}{{e{{N}_{{\text{D}}}}}}} .$При известной концентрации донорных дефектов ND становится возможным расчет еще одного характеристичного параметра – расстояния, на котором потенциал электрического поля, созданного носителем электрического заряда в полупроводнике, снижается в e раз, т.е. дебаевской длины экранирования LD:
(10)
${{L}_{{\text{D}}}} = \sqrt {\frac{{\varepsilon {{\varepsilon }_{0}}kT}}{{{{e}^{2}}{{N}_{{\text{D}}}}}}} .$Комплекс параметров, полученных по (7), (9), (10) и характеризующих структурные свойства тонких оксидных пленок, анодно сформированных на сплавах при различных потенциалах оксидообразования, представлен в табл. 3.
Таблица 3.
Структурные и оптические параметры оксида Ag(I), сформированного при потенциалах максимума А1 на сплавах; λ = 470 нм; Φ0 = 1.65 × 10–14 фотон с–1 см–2
| Сплав | Е, В | $i_{{{\text{ph}}}}^{{{\text{max}}}},$ мкА/см2 | $\eta f\left( {{\text{1}} - {{R}_{{{\text{ref}}}}}} \right)$ | α × 10–5 см–1 | W, нм | ND × 10–15 см–3 | LD, нм |
|---|---|---|---|---|---|---|---|
| Ag5Zn | 0.55 | 2.29 | 0.081 | 0.72 | 321.82 | 2.07 | 77.78 |
| Ag10Zn | 0.53 | 2.14 | 0.083 | 1.23 | 186.68 | 5.59 | 47.32 |
| Ag15Zn | 0.51 | 1.67 | 0.063 | 1.69 | 135.53 | 9.54 | 36.21 |
| Ag20Zn | 0.49 | 0.98 | 0.036 | 1.78 | 129.07 | 9.35 | 36.58 |
| Ag30Zn | 0.47 | 0.45 | 0.019 | 2.48 | 92.70 | 15.87 | 28.09 |
Наблюдается уменьшение максимального фототока $i_{{{\text{ph}}}}^{{{\text{max}}}}$ с увеличением концентрации цинка в сплаве. Скорее всего, это уменьшение обусловлено снижением комплексного параметра $\eta f\left( {{\text{1}} - {{R}_{{{\text{ref}}}}}} \right),$ объединяющего квантовую эффективность, коэффициент отражения света от границы оксид/раствор и константу скорости реакции с участием дырок на этой же границе.
Показатель поглощения света α и концентрация донорных дефектов ND увеличиваются с ростом концентрации цинка в сплаве, тогда как ширина ОПЗ и дебаевская длина экранирования уменьшаются. Таким образом, можно полагать, что на сплавах Ag–Zn с более высоким содержанием цинка формируются более разупорядоченные оксидные пленки.
Сразу после окончания периода анодного формирования оксида Ag(I) на сплавах Ag–Zn и отключения поляризации рабочего электрода регистрируется отрицательный фотопотенциал, абсолютное значение которого снижается как во времени, так и с ростом XZn (рис. 3б). Отрицательный знак фотопотенциала свидетельствует об n‑типе проводимости оксидной фазы, что согласуется с результатами измерения фототока.
Если толщина оксидной пленки не превышает области пространственного заряда, то, согласно (8), фотопотенциал оказывается размерно-зависимой величиной, как и фототок. Таким образом, наблюдаемое уменьшение абсолютного значения фотопотенциала со временем, скорее всего связанное с уменьшением толщины оксидной пленки, косвенно указывает на возможность ее химического растворения в щелочном растворе.
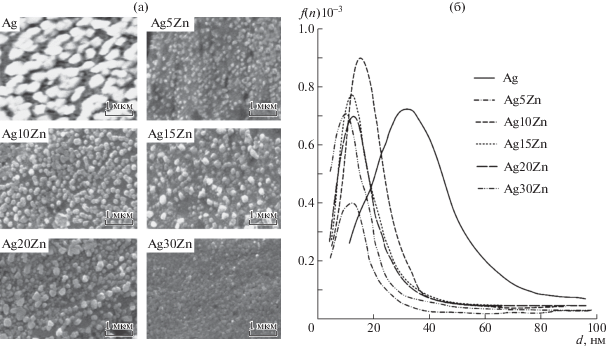
Морфология оксидных фаз
Информация о морфологических особенностях формирующихся анодных пленок получена по результатам сканирующей электронной микроскопии (рис. 4). Средний размер зерен в оксиде найден путем обработки СЭМ-изображений с помощью программы ImageJ 1.50 I. Распределение частиц по размерам одномодальное (рис. 4б). Диаметр отдельных частиц оксида, сформированных на чистом серебре, составляет около 35 нм. При переходе к сплавам диаметр частиц оксида уменьшается, составляя 10–25 нм. Уменьшение размера частиц оксида согласуется с тенденцией снижения постоянной решетки и размера кристаллитов сплавов по мере увеличения XZn, зарегистрированной по результатам рентгеновской дифрактометрии. Плотность распределения частиц P (табл. 4) заметно возрастает при переходе от серебра к сплавам Ag–Zn и с ростом XZn, что косвенно указывает на увеличение поверхностной концентрации активных центров.
ЗАКЛЮЧЕНИЕ
1. Анодное окисление гомогенных сплавов Ag–Zn c атомной долей цинка до 30 ат. % включительно (α-фаза) в деаэрированном водном щелочном растворе приводит к формированию на их поверхности адсорбционного слоя AgOH, оксидов Ag(I) и Ag(II).
2. Потенциалы формирования оксида Ag(I) уменьшаются с ростом концентрации цинка в сплаве. При этом плотность тока в максимуме A1 на вольтамперограмме увеличивается, косвенно указывая на наличие короткого начального этапа селективного растворения цинка, приводящего к повышению термодинамической активности серебра на поверхности. Для оксида Ag(II) зависимость потенциалов его формирования, а также плотности тока в максимуме А2 от состава сплава не характерна.
3. Оксид Ag(I), анодно сформированный на сплавах Ag–Zn в щелочной среде, обладает островковой структурой. Плотность распределения анодно сформированного оксида по поверхности электрода повышается с ростом концентрации цинка, а размеры отдельных частиц уменьшаются.
4. Оксид Ag(I), анодно сформированный на серебре и сплавах Ag–Zn, характеризуется n-типом проводимости, обусловленным преобладанием донорных дефектов. При переходе от серебра к сплавам и по мере увеличения XZn концентрация донорных дефектов и коэффициент оптического поглощения в анодно сформированном оксиде повышаются, тогда как значения максимального фототока и фотопотенциала, а также ширины области пространственного заряда и дебаевской длины экранирования снижаются.
5. Зависимость структурно-морфологических характеристик анодно сформированного оксида Ag(I) от концентрации цинка в сплавах системы Ag–Zn позволяет сделать вывод о преобладании прямого маршрута оксидообразования, по крайней мере, на его начальных стадиях, пока толщина оксидной пленки не велика.
Список литературы
Скорчеллетти, В.В. Теоретические основы коррозии металлов. Л.: Химия, 1973. 264 с. [Skorchelletti, V.V., Theoretical bases of corrosion of metals (in Russian), Leningrad: Khimiya, 1973. 264 p.]
Marcus, P., Corrosion mechanisms in theory and practice, New York: Marcel Dekker, 2002. 729 p.
McCafferty, E., Introduction to Corrosion Science, New York: Springer, 2010. 583 p.
Kaesche, H., Corrosion of metals, Berlin: Springer-Verlag, 2012. 594 p.
Тодт, Ф. Коррозия и защита от коррозии. Коррозия металлов и сплавов. Методы защиты от коррозии. М.-Л.: Химия, 1966. 847 с. [Tödt, F., Althof, F-C., Korrosion und Korrosionsschutz, Berlin: De Gruyter, 1961. 847 p.]
Бенар, Ж. Окисление металлов. Том 1. Теоретические основы. М.: Металлургия, 1968. 499 с. [Benar, Zh., The oxidation of metals. Volume 1. Theoretical bases (in Russian), Moscow: Metallurgiya, 1968. 499 p.]
Маршаков, И.К. Термодинамика и коррозия сплавов. Воронеж: Изд-во Воронеж. ун-та, 1983. 166 c. [Marshakov, I.K., Thermodynamics and corrosion of alloys (in Russian), Voronezh: Izd-vo Voronezh. un-ta, 1983. 166 p.]
Маршаков, И.К., Введенский, А.В., Кондрашин, В.Ю., Боков, Г.А. Анодное растворение и селективная коррозия сплавов. Воронеж: Изд-во Воронеж. ун-та, 1988. 402 с. [Marshakov, I.K., Vvedenskii, A.V., Kondrashin, V.Yu., and Bokov, G.A. Anodic dissolution and selective corrosion of alloys (in Russian), Voronezh: Izd-vo Voronezh. un-ta, 1988. 402 p.]
Козадеров, О.А., Введенский, А.В. Массоперенос и фазообразование при анодном селективном растворении гомогенных сплавов. Воронеж: Издательско-полиграфический центр “Научная книга”, 2004. 288 c. [Kozaderov, O.A. and Vvedenskii, A.V., Mass transfer and phase formation in anodic selective dissolution of homogeneous alloys (in Russian), Voronezh: Izdatel’sko-poligraficheskii tsentr “Nauchnaya kniga”, 2004. 288 с.]
Vvedenskii, A.V. and Kozaderov, O.A., Linear Voltammetry of Anodic Selective Dissolution of Homogeneous Metallic Alloys in Voltammetry: Theory, Types and Applications, Saito, Y. and Kikuchi, T., Eds, New York: Nova Science Publishers, Inc., 2014. p. 363.
Liu, H.T., Xia, X., and Guo, Z.P., A novel silver oxide electrode and its charge–discharge performance, J. Appl. Electrochem., 2012, vol. 32, no. 3, p. 275. https://doi.org/10.1023/A:1015541703258
Lopez, T.M., Vilche, J.R., and Arvia, A.J., The electroformation and electroreduction of anodic films formed on silver in 0.1 M sodium hydroxide in the potential range of the Ag/Ag2O couple, J. Electroanal. Chem., 1984, no. 12, p. 207. https://doi.org/10.1016/S0022-0728(84)80165-5
Ambrose, J. and Barradas, R.G., The electrochemical formation of Ag2O in KOH electrolyte, Electrochim. Acta, 1974, vol. 19, no. 11, p. 781. https://doi.org/10.1016/0013-4686(74)80023-X
Assaf, F.H., Abd El-Rehim, S.S., and Zaky, A., Cyclic voltammetric behavior of α brass in alkaline media, Brit. Corr. J., 2001, vol. 36, no. 2, p. 143. https://doi.org/10.1179/000705901101501587
Введенский, А.В., Грушевская, С.Н., Кудряшов, Д.А., Ганжа, С.В. Тонкие оксидные пленки на металлах и сплавах: кинетика анодного формирования и фотоэлектрохимические свойства. Воронеж: Издательско-полиграфический центр “Научная книга”, 2016. 296 с. [Vvedenskii, A.V., Grushevskaya, S.N., Kudryashov, D.A., and Ganzha, S.V., Thin oxide films on metals and alloys: anodic formation kinetics and photoelectrochemical properties (in Russian), Voronezh: Izdatel’sko-poligraficheskii tsentr “Nauchnaya kniga”, 2016. 296 p.]
Hull, M.N., Ellison, J.E., and Toni, J.E., The Anodic Behavior of Zinc Electrodes in Potassium Hydroxide Electrolytes, J. Electrochem. Soc., 1970, vol. 117, no. 2, p. 192. https://doi.org/10.1149/1.2407463
Armstrong, R.D., and Bell, M.F., The active dissolution of zinc in alkaline solution, J. Electronal. Chem. Interfac. Electrochem., 1974, vol. 55, no. 2, p. 201. https://doi.org/10.1016/S0022-0728(74)80120-8
Aurian-Blajeni, B. and Tomkiewicz, M., Passive Zinc Electrodes: Application of the Effective Medium Theory, J. Electrochem. Soc., 1985, vol. 132, no. 4, p. 869. https://doi.org/10.1149/1.2113975
Xiaoge, G.Z., Corrosion and Electrochemistry of Zinc, New York: Springer, 1996. 474 p.
Протасова, И.В., Недобежкина, Л.А. Особенности растворения цинка при анодной поляризации в растворах гидроксида натрия. Конденсированные среды и межфазные границы. 2016. № 1(18). С. 91. [Protasova, I.V. and Nedobezhkina, L.A., Features of zinc dissolution during anodic polarization in sodium hydroxide solutions, Kondensirovannye sredy i mezhfaznye granitsy (in Russian), 2016, no. 1(18), p. 91.]
Андрухив, А.И., Бачаев, А.А., Чиянов, А.А., Бандуркин, Д.В. Влияние промежуточных соединений цинка, образующихся при его анодном растворении, на показатели электродных процессов и свойства цинкатных растворов. Вестн. Нижегород. ун-та им. Н.И. Лобачевского. 2013. № 5(1). С. 97. [Andrukhiv, A.I., Bachaev, A.A., Chiyanov, A.A., and Bandurkin, D.V., Influence of zinc intermediate compounds formed during its anodic dissolution on the parameters of electrode processes and properties of zinc solutions, Vestn. Nizhegorod. univer. im. N.I. Lobachevskogo (in Russian), 2013, no. 5(1), p. 97.]
Mehdi, H.E., Hantehzadeh, M.R., and Valedbagi, Sh., Physical Properties of Silver Oxide Thin Film Prepared by DC Magnetron Sputtering: Effect of Oxygen Partial Pressure During Growth, J. Fusion Energy, 2013, vol. 32, no. 1, p. 28. https://doi.org/10.1007/s10894-012-9509-5
Gao, X.-Y., Wang, S.-Y., Li J., Zheng, Y.-X., Zhang R.-J., Zhou, P., Yang Y.-M., and Chen, L.-Y., Study of structure and optical properties of silver oxide films by ellipsometry, XRD and XPS methods, Thin Solid Films, 2004, vol. 455–456, p. 438. https://doi.org/10.1016/j.tsf.2003.11.242
Barik, U.K., Srinivasan, S., Nagendra, C.L., and Subrahmanyam, A., Electrical and optical properties of reactive DC magnetron sputtered silver oxide thin films: role of oxygen, Thin Solid Films, 2003, vol. 429, p. 129. https://doi.org/10.1016/S0040-6090(03)00064-6
Ida, Y., Watase, S., Shinagawa, T., Watanabe, M., Chigane, M., Inaba, M., Nasaka, A., and Izaki, M., Direct electrodeposition of 1.46 eV band gap silver (I) oxide semiconductor films by electrogenerated acid, Chemistry of Materials, 2008, vol. 20, p. 1254. https://doi.org/10.1021/cm702865r
Ferretti, A.M., Ponti, A., and Molteni, G., Silver(I) oxide nanoparticles as a catalyst in the azide–alkyne cycloaddition, Tetrahedron Letters, 2015, vol. 56, no. 42, p. 5727. https://doi.org/10.1016/j.tetlet.2015.08.083
Wei, J., Lei, Y., Jia, H., Cheng, J., Hou, H., and Zheng, Z., Controlled in situ fabrication of Ag2O/AgO thin films by a dry chemical route at room temperature for hybrid solar cells, Dalton Trans., 2014, vol.43, no. 29, p. 11333. https://doi.org/10.1039/C4DT00827H
Wei, W., Zhao, Q., Dong, J., and Li, J., A novel silver oxides oxygen evolving catalyst for water splitting, Internat. J. Hydrogen Energy, 2011, vol. 36, no. 13, p. 7374. https://doi.org/10.1016/j.ijhydene.2011.03.096
Owen, C.C. and SonBinh, T.N., Graphene oxide, highly reduced graphene oxide, and graphene: versatile building blocks for carbonbased materials, Small, 2010, vol. 6, no. 6, p. 711. https://doi.org/10.1002/smll.200901934
Kazemi, M.S., Fakharian, M., Dabiri, M., and Bazgir, A., Gold nanoparticles decorated reduced graphene oxide sheets with significantly high catalytic activity for ullmann homocoupling, RSC Adv., 2014, vol. 4, no. 10, p. 5243. https://doi.org/10.1039/C3RA45518A
Liu, S., Yan, J., He, G., Zhong, D., Chen, J., Shi, L., Zhou, X., and Jiang, H., Layer-by-layer assembled multilayer films of reduced graphene oxide/gold nanoparticles for the electrochemical detection of dopamine, Electroanal. Chem., 2012, vol. 672, p. 40. https://doi.org/10.1016/j.jelechem.2012.03.007
Deng, K-Q., Zhou, J-H., and Li, X-F., Direct electrochemical reduction of graphene oxide and its application to determination of L-tryptophan and L-tyrosine, Colloids and Surfaces B: Biointerfaces, 2013, vol. 101, p. 183. https://doi.org/10.1016/j.colsurfb.2012.06.007
Dey, R.S. and Raj, C.R., Development of an amperometric cholesterol biosensor based on graphene-Pt nanoparticle hybrid material, J. Phys. Chem. C, 2010, vol. 114, no. 49, p. 21427. https://doi.org/10.1021/jp105895a
Shahriary, L. and Athawale, A.A., Electrochemical deposition of silver/silver oxide on reduced graphene oxide for glucose sensing, J. Solid State Electrochem., 2015, vol. 19, p. 2255. https://doi.org/10.1007/s10008-015-2865-0
Klingshirn, C.F., Meyer, B.K., Waag, A., Hoffmann, A., and Geurts, J., Zinc Oxide. From Fundamental Properties Towards Novel Applications, Berlin: Springer, 2010. 374 p.
Istomina, O.V., Evstropiev, S.K., Kolobkova, E.V., and Trofimov, A.O., Photolysis of Diazo Dye in Solutions and Films Containing Zinc and Silver Oxides, Optics and Spectroscopy, 2018, vol. 124, no. 6, p. 774. https://doi.org/10.1134/S0030400X18060097
Narang, J., Singhal, C., Mathur, A., Sharma, S., and Pundir, C.S., Portable bioactive paper based genosensor incorporated with Zn–Ag nanoblooms for herpes detection at the point-of-care, Intern. J. Biolog. Macromolecules, 2018, vol. 107, p. 2559. https://doi.org/10.1016/j.ijbiomac.2017.10.146
Ding, X, Zhang, Y., Ling, J., and Lin, C., Rapid mussel-inspired synthesis of PDA-Zn-Ag nanofilms on TiO2 nanotubes for optimizing the antibacterial activity and biocompatibility by doping polydopamine with zinc at a higher temperature, Colloids and Surfaces B: Biointerfaces, 2018, In Press, Accepted Manuscript https://doi.org/10.1016/j.colsurfb.2018.07.014
Sikora-Jasinska, M., Mostaed, E., Mostaed, A., Beanland, R., Mantovani, D., and Vedani, M., Fabrication, mechanical properties and in vitro degradation behavior of newly developed Zn–Ag alloys for degradable implant applications, Materials Science and Engineering: C, 2017, vol. 77, p. 1170. https://doi.org/10.1016/j.msec.2017.04.023
Jin, G., Qin, H., Cao, H., Qian, S., Zhao, Y., Peng, X., Zhang, X., Liu, X., and Chu, P.K., Synergistic effects of dual Zn/Ag ion implantation in osteogenic activity and antibacterial ability of titanium, Biomaterials, 2014, vol. 35, no. 27, p. 7699. https://doi.org/10.1016/j.biomaterials.2014.05.074
Bunoiu, I., Mindroiu, M., Manole, C.C., Andrei, M., Nicoara, A., Vasilescu, E., Popa M., and Didilescu A.C., Electrochemical testing of a novel alloy in natural and artificial body fluids, Annals of Anatomy – Anatomischer Anzeiger, 2018, vol. 217, p. 54. https://doi.org/10.1016/j.aanat.2017.12.011
Xiang, Q., Meng, G., Zhang, Y., Xu, J., Xu, P., Pan, Q., and Yu, W., Ag nanoparticle embedded-ZnO nanorods synthesized via a photochemical method and its gas-sensing properties, Sens. Actuators B, 2010, vol. 143, p. 635. https://doi.org/10.1016/j.snb.2009.10.007
Meng, F., Hou, N., Jin, Z., Sun, B., Guo, Z., Kong, L., Xiao, X., Wu, H., Li, M., and Liu, J., Ag-decorated ultra-thin porous single-crystalline ZnO nanosheets prepared by sunlight induced solvent reduction and their highly sensitive detection of ethanol, Sens. Actuators B, 2015, vol. 209, p. 975. https://doi.org/10.1016/j.snb.2014.12.078
Ansari, S.A., Khan, M.M., Ansari, M.O., Lee, J., and Cho, M.H., Biogenic synthesis photocatalytic, and photoelectrochemical performance of Ag-ZnO nanocomposite, J. Phys. Chem. C, 2013, vol. 117, p. 27023. https://doi.org/10.1021/jp410063p
Chen, X., Li, Y., Pan, X., Cortie, D., Huang, X., and Yi, Z., Photocatalytic oxidation of methane over silver decorated zinc oxide nanocatalysts, Nat. Commun., 2016, vol. 7, p. 12273. https://doi.org/10.1038/ncomms12273
Lu, Y.H., Xu, M., and Xu, L.X., Enhanced ultraviolet photocatalytic activity of Ag/ZnO nanoparticles synthesized by modified polymer-network gel method, J. Nanopart. Res, 2015, vol. 17, p. 1. https://doi.org/10.1007/s11051-015-3150-y
Shuaishuai, M., Jinjuan, X.,Yuming, Z., and Zewu, Z., Photochemical synthesis of ZnO/Ag2O heterostructures with enhanced ultraviolet and visible photocatalytic activity, J. Mater. Chem. A, 2014, vol. 2, no. 20, p. 7272. https://doi.org/10.1039/C4TA00464G
Zhang, Q., Xie, G., Xu, M., Su, Y., Tai, H., Du, H., and Jiang, Y., Visible light-assisted room temperature gas sensing with ZnO–Ag heterostructure nanoparticles, Sensors and Actuators B: Chemical, 2018, vol. 259, p. 269.
Гуревич, Ю.Я., Плесков, Ю.В. Фотоэлектрохимия полупроводников. М.: Наука, 1983. 312 с. [Gurevich, Yu.Ya. and Pleskov, Yu.V., Photoelectrochemistry of semiconductors (in Russian), Moscow: Nauka, 1983. 312 p.]
Bard, A.J., Stratmann, M., and Licht, S., Encyclopedia of electrochemistry. V.6: Semiconductor Electrodes and Photoelectrochemistry, Weinheim: Wiley-VCH, 2002. 608 p.
Giménez, S., and Bisquert, J., Photoelectrochemical Solar Fuel Production: From Basic Principles to Advanced Devices, Switzerland: Springer International Publishing, 2016. 574 p.
Massalski, T.B., Binary alloy phase diagrams. V. 1, Ohio: American Society for Metals, Metals Park, 1986. 1100 p.
Guzmán, D., Rivera, O., Aguilar, C., Ordoñez, S., Martínez, C., Serafini, D., and Rojas, P., Mechanical alloying and subsequent heat treatment of Ag–Zn powders, Transactions of Nonferrous Metals Society of China, vol. 23, no. 7, 2013, p. 2071. https://doi.org/10.1016/S1003-6326(13)62698-9
Pearson, W.B., A Handbook of Lattice Spacings and Structures of Metals & Alloys, London: Pergamon Press, 1958. 1044 p.
Новый справочник химика и технолога: Электродные процессы. Химическая кинетика и диффузия. Коллоидная химия / С.А. Симанова (ред.), С.-Пб.: АНО НПО “Профессионал”, 2004. 838 с. [New handbook of chemist and technologist: Electrode processes. Chemical kinetics and diffusion. Colloid chemistry / S.A. Simanova, Ed. (in Russian), Saint Petersburg: ANO NPO “Professional”, 2004. 838 p.]
Chandra-ambhorn, S. and Chumpanya, P., High temperature oxidation behaviour of Ag–36.35 wt % Zn and Ag–38.50 wt % Zn-0.60 wt. % Al, Corr. Sci., 2018 vol. 131, p. 38. https://doi.org/10.1016/j.corsci.2017.11.007
Gerischer, H., Models for the discussion of the photo-electrochemical response of oxide layers on metals, Corr. Sci., 1989, vol. 29, no. 2-3, p. 257. https://doi.org/10.1016/0010-938X(89)90034-6
Кудряшов, Д.А., Грушевская, С.Н., Ганжа, С.В., Введенский, А.В. Влияние ориентации кристаллической грани серебра и его легирования золотом на свойства тонких анодных пленок оксида Ag(I). Часть I. Фототок. Физикохимия поверхности и защита материалов. 2009. Т. 45. № 5. С. 451. [Kudryashov, D.A., Grushevskaya, S.N., Ganzha, S.V., and Vvedenskii, A.V., Effect of the crystal face orientation and alloying with gold on the properties of thin anodic films of Ag(I) oxide: I. Photocurrent, Protection of Metals and Physical Chemistry of Surfaces, 2009, vol. 45, p. 501. doi 10.1134/S2070205109050013.]
Кудряшов, Д.А., Грушевская, С.Н., Олалекан, О., Кухарева, Н.В., Введенский, А.В. Влияние ориентации кристаллической грани серебра и его легирования золотом на свойства тонких анодных пленок оксида Ag(I). Часть II. Фотопотенциал. Физикохимия поверхности и защита материалов. 2010. Т. 46. № 1. С. 28. [Kudryashov, D.A., Grushevskaya S.N., Olalekan, O., Kukhareva, N.V., and Vvedenskii, A.V., Effect of orientation of crystal face of silver and its alloying with gold on properties of thin anodic Ag(I) oxide films: II. Photopotential, Protection of Metals and Physical Chemistry of Surfaces, 2009, vol. 46, p. 32. doi 10.1134/S2070205110010041.]
Chatterjee, K., Banerjee, S., and Chakravorty, D., Plasmon resonance shifts in oxide-coated silver nanoparticles, Phys. Rev. B, 2002, vol. 66, no. 8, P. 085421. https://doi.org/10.1103/PhysRevB.66.085421
Jiang, Z.Y., Huang, S.Y., and Qian, B. Semiconductor properties of Ag2O film formed on the silver electrode in 1 M NaOH solution, Electrochim. Acta, 1994, vol. 39, no. 16, p. 2465. https://doi.org/10.1016/0013-4686(94)E0149-I
Дополнительные материалы отсутствуют.